Нейропатология при гипоксически-ишемической энцефалопатии у новорожденного (ГИЭ, неонатальной энцефалопатии)
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Последствия перинатального поражения центральной нервной системы с атонически- астатическим синдромом – поражение головного мозга в определенный период его развития с последующим формированием патологического мышечного тонуса по гипотоническому типу с выраженными нарушениями моторной координации.
Наиболее частозаболевание является исходом перинатального поражения центральной нервной системы гипоксически-ишемического генеза (Церебральная ишемия P91.0, Внутричерепное нетравматическое кровоизлияние у плода и новорожденного II, III степени P52, Перивентрикулярные кисты (приобретенные) у новорожденного P91.1, Церебральная лейкомаляция у новорожденного P91.2, др.) вследствие нейронального некроза и апоптоза, отсроченной запрограммированной гибели нейронов.
У недоношенных детей, родившихся с экстремально низкой массой тела (ЭНМТ), очень низкая масса тела (ОНМТ), на протяжении первых 6 месяцев жизни часто отмечается период «мнимого благополучия».
Для детей, родившихся доношенными, недоношенными с низкой массой тела характерным является постепенное развитие стойких двигательных нарушений. Симптомы неврологического дефицита проявляются по мере созревания нервной системы ребенка.
Дети первого года жизни с диагнозом: последствия перинатального поражения центральной нервной системы с атонически-астатическим синдромом состоят в группе риска по формированию детского церебрального паралича 1 , 2 , 3 .
1.2 Этиология и патогенез
Наиболее частыми причинами последствий перинатального поражения ЦНС с атонически- астатическим синдромом являются перинатальные поражения центральной нервной системы гипоксически-ишемического генеза: церебральная ишемия II, III степени, внутричерепное кровоизлияние II, III степени. Поражение лобных долей, мозжечка, лобномосто-мозжечкового пути.
Гипоксия плода – неспецифическое проявление различных осложнений беременности и родов, прежде всего токсикозов беременных. Степень и выраженность токсикоза, его связь с экстрагенитальной патологией женщины (особенно с болезнями сердечно-сосудистой системы) определяют длительность и выраженность гипоксии плода, центральная нервная система которого наиболее чувствительна к кислородной недостаточности. Антенатальная гипоксия приводит к замедлению роста капилляров головного мозга, увеличивает их проницаемость. Возрастают проницаемость клеточных мембран и метаболический ацидоз, развивается ишемия мозга с внутриклеточным ацидозом. Антенатальная гипоксия часто сочетается с интранатальной асфиксией. Частота первичной асфиксии составляет 5%. Гипоксия и асфиксия сопровождаются комплексом компенсаторно-приспособительных реакций, важнейшей из которых является усиление анаэробного гликолиза.
Наиболее часто геморрагический инфаркт и ишемия развиваются у плодов и новорожденных в области перивентрикулярных сплетений – субэпендимально в сочетании с поражением вещества мозга. Кровоизлияние может происходить также в боковые желудочки мозга и в субарахноидальное пространство. Помимо описанных изменений, морфологическим субстратом гипоксии, как правило, является полнокровие мозга, его общий или локальный отек.
В патогенезе гипоксически-травматических и гипоксически-ишемических энцефалопатий причины и следствия меняются местами, переплетаются в сложных «порочных кругах». Нарушение гемодинамики (макро- и микроциркуляции) приводят к многовариантным метаболическим сдвигам (нарушение кислотно-основного состояния и электролитного баланса, дестабилизация клеточных мембран, гипоксемия и тканевая гипоксия), а эти сдвиги в свою очередь усугубляют расстройства микроциркуляции.
У недоношенных детей повреждающее действие внутриутробной гипоксии потенцируется незрелостью сосудов головного мозга, дезадаптацией в интранатальном периоде.
В последние годы расшифрованы тонкие механизмы патогенеза гипоксическиишемических поражений мозга. Установлена роль выброса свободно-радикальных веществ и нарушений перекисного окисления липидов в повреждении мембран нервных клеток, роль блокады кальциевых каналов, страдания энергетических субклеточных структур – в первую очередь митохондрий.
Установлено, что повреждающее воздействие различных факторов может реализоваться как в форме быстрой гибели клетки (нейрональный некроз), так и в форме отсроченной, замедленной гибели – апоптоз.
Последний механизм может быть обратимым, т.е. у врача появляется время для предотвращения гибели клетки – так называемое «терапевтическое окно». Установлено, что пострадавшие нейроны через межнейронные связи могут обусловить каскады патологических реакций, которые так же необходимо купировать, что обусловливает необходимость своевременного лечения и реабилитации детей с перинатальной патологией 4 , 16 , 19 , 20 , 22 .
1.3 Эпидемиология
По данным эпидемиологических исследований распространенность перинатального поражения центральной нервной системы по гипотоническому типу занимает 20% среди всей перинатальной патологии нервной системы. Частота последствий перинатального поражения центральной нервной системы протекающих с атонически- астатическим синдромом в раннем возрасте составляет составляет 10-12%. Частота формирования детского церебрального паралича составляет 2-4 на 1000 живых новорожденных детей.
Среди недоношенных детей частота формирования детского церебрального паралича возрастает до 1%. По данным различных авторов, у детей, родившихся с ОНМТ, распространённость детского церебрального паралича (ДЦП) увеличивается до 5-15%, с ЭНМТ ― до 25-30%
1.4 Кодирование по МКБ 10
P91.0 - Церебральная ишемия (до 42 недели постконцептуального возраста)
P91.1 - Перивентрикулярные кисты (приобретенные) у новорожденного (до 42 недели постконцептуального возраста)
P91.2 - Церебральная лейкомаляция у новорожденного (до 42 недели постконцептуального возраста)
P91.5 - Неонатальная кома
P91.8 - Другие уточненные нарушения со стороны мозга у новорожденного
P52 - Внутричерепное нетравматическое кровоизлияние у плода и новорожденного II,
III степени (до 42 недели постконцептуального возраста)
G80.4 - Атаксический церебральный паралич
G80.8 - Другой вид детского церебрального паралича
G80.9 - Детский церебральный паралич неуточненный
1.5 Примеры диагнозов
Атаксический церебральный паралич. G80.4 Грубая задержка психомоторного развития. Недоношеннность 28 недель в анамнезе.
Последствия перинатального поражения центральной нервной системы. Атонически- астатический синдром. Задержка психомоторного и речевого развития. Недоношеннность 27 недель в анамнезе. Риск формирования детского церебрального паралича.
1.6 Классификация
Классификация последствий перинатальных поражений нервной системы у детей первого года жизни (Российская ассоциация специалистов перинатальной медицины, 2005 г.) представлена в табл. 1 8 .
Таблица 1 - Классификация последствий перинатальных поражений нервной системы у детей первого года жизни (Российская ассоциация специалистов перинатальной медицины, 2005 г.)
2. Диагностика
2.1 Жалобы и анамнез
При сборе анамнеза и жалоб следует обратить внимание на наличие:
Тяжелых соматических болезней матери; Инфекционно-воспалительных болезней матери; Гестоза в акушерском анамнезе; Хронической гипоксии плода;
Асфиксии при рождении; Недоношенности;
Перинатального поражения центральной нервной системы гипоксическиишемического генеза;
Наличие судорог в анамнезе;
Жалоб на задержку психомоторного развития
Наличие неврологической симптоматики в медицинской документации Снижение устойчивости к активности Гипермобильность и повышенная гибкость суставов
Низкий тонус мышц, нарушение координации движений и равновесия, а также избыточный объемом движений в суставах конечностей
Деформация грудной клетки, искривление позвоночника, вывихи тазобедренных суставов, грыжи
2.2 Физикальное обследование
Комментарии : проводится объективный клинический осмотр: определение общего состояния, физического развития, объективный осмотр по всем органам и системам. Проводится оценка неврологического статуса ребенка первого года жизни с учетом возрастной периодизации: положения тела, позы, состояния родничков, выраженности рефлексов новорожденных, спонтанной и стимулированной двигательной активности, изменений мышечного тонуса, сухожильных рефлексов, наличия патологических рефлексов, тремора, клонусов, очаговой симптоматики. Оценивается психомоторное развитие, когнитивное развитие ребенка с учетом фактического и корригированного возраста (график нервно-психического обследования младенца ГНОМ, шкалы развития младенца Bayley).
2.3 Лабораторная диагностика
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: у пациентов с перинатальной патологией (гестозы беременных, гипоксия плода, недоношенность в анамнезе) выявляют анемию, изменения лейкоцитарной формулы. Анализ необходим для принятия решения о возможности проведения восстановительного лечения.
Комментарии: у пациентов с перинатальной патологией (гестозы беременных, гипоксия плода, недоношенность в анамнезе) могут выявлять протеинурию, лейкоцитурию, бактериурию. Анализ необходим для принятия решения о возможности проведения восстановительного лечения.
Комментарии: определение уровня ЩФ необходимо для исключения рахита, при котором одним из симптомов является гипотонус мышц. КФК содержится преимущественно в скелетной мускулатуре, миокарде, а также в гладких мышцах и головном мозге. Определение креатинкиназы и её изоферментов используется в диагностике и мониторинге миодистрофий и митохондриальных энцефаломиопатий. Лактат - продукт анаэробного метаболизма глюкозы (гликолиза), который образуется при кислородном дефиците. Его повышение может быть при гипоксически-ишемическом поражении ЦНС, острой гипоксии. Определение концентрации аммиака в крови необходимо для проведения дифференциального диагноза с болезнями обмена веществ, при которых одним из симптомов является диффузная мышечная гипотония.
Комментарии: для проведения дифференциального диагноза с болезнями обмена веществ
2.4 Инструментальная диагностика
Комментарии: у пациентов с перинатальной патологией (гестозы беременных, гипоксия плода, недоношенность в анамнезе), перинатальным поражением центральной нервной системы в анамнезе, с последствиями перинатального поражения центральной нервной системы выявляются отклонения: асимметрия структуры, расширение ликворных пространств, участки гиперэхогенности, др. Метод является скринирующим для выявления структурной патологии головного мозга. Необходимо использование метода по показаниям в динамике на протяжении первого года жизни.
Комментарии: у пациентов с перинатальной патологией (гестозы беременных, гипоксия плода, недоношенность в анамнезе), перинатальным поражением центральной нервной системы в анамнезе, с последствиями перинатального поражения центральной нервной системы с атонически- астатическим синдромом выявляются изменения скорости кровотока по передней мозговой артерии, вене Галена. Полученные данные позволяют обоснованно назначить лечение.
Комментарии: у пациентов с перинатальным поражением центральной нервной системы в анамнезе, с последствиями перинатального поражения центральной нервной системы с атонически- астатическим синдромом выявляются пароксизмальные изменения биоэлектрической активности головного мозга на фоне задержки созревания корковой ритмики.
Комментарии: у пациентов с последствиями перинатального поражения центральной нервной системы с атонически- астатическим синдромом проводится – при наличии в клинической картине тяжелых неврологических симптомокомплексов, при подозрении на порок развития мозга.
Комментарии: у пациентов с последствиями перинатального поражения центральной нервной системы с атонически- астатическим синдромом возможно выявление признаков врожденной атрофии зрительного нерва, для проведения дифференциальной диагностики наследственных болезней обмена веществ.
Комментарии: проводится у пациентов с последствиями перинатального поражения центральной нервной системы с атонически- астатическим синдромом при подозрении на тугоухость 6 .
Комментарии : у пациентов с последствиями перинатального поражения центральной нервной системы с атонически-астатическим синдромом проводится для оценки функционального состояния нервов, нервно-мышечной передачи и мышечного ответа путем регистрации биопотенциала мышц в покое и состоянии напряжения.
2.5 Медико-генетическое консультирование
(Сила рекомендаций – 1; достоверность доказательств – С)
Комментарии: проводится кариотипирование, молекулярно-генетическое исследование, ТМС для проведения дифференциальной диагностики синдромальной патологии, наследственных болезней обмена веществ.
2.6 Дифференциальная диагностика
Дифференцировать перинатальное поражение центральной нервной системы с атонически-астатическим синдромом следует от спиномозжечковых атаксий, к которым относят прогрессирующие наследственные дегенеративные заболевания, при которых в основном страдают структуры мозжечка, ствола головного мозга и проводящие пути спинного мозга, относящиеся главным образом к экстрапирамидной системе, например, наследственная атаксия Фридрейха.
Также дифференциальный диагноз проводят с врожденной мозжечковой атаксией, которая проявляется задержкой развития двигательных функций ребенка, а также задержкой речи, длительным сохранением дизартрии, иногда отставанием психического развития, нередки проявления микрокрании. На КТ уменьшены полушария мозжечка. Примерно к 10 годам обычно наступает компенсация мозговых функций, которая, однако, может нарушаться под влиянием вредных экзогенных воздействий. Возможны и прогредиентные формы заболевания.
Дифференциальный диагноз проводится с наследственными болезнями обмена веществ, причинами которых являются мутации структурных генов и под их контролем осуществляется синтез белков, выполняющих различные функции в организме. Основным клиническим проявлением НБО у детей первых месяцев жизни является выраженная диффузная мышечная гипотония, дыхательные нарушения, рвота, синдром мальабсорбции, гепатоспленомегалия и др.
Гипоксически-ишемическая энцефалопатия новорожденных
Настоящее руководство отражает многолетние многосторонние исследования авторов в области неонатальной неврологии, а также представляет обобщение научных достижений различных неонатологических и неврологических школ в этой области. Рассмотрены вопросы эпидемиологии, причины и механизмы развития гипоксических поражений головного мозга, представлены данные о морфологических изменениях в нервной системе новорожденного при гипоксии. Значительное место
уделено клинической картине и современным методам диагностики гипоксически-ишемической энцефалопатии, приведены результаты оригинальных исследований авторов. Лечение рассматриваемых состояний представлено с учетом современных требований к назначению и контролю медикаментозной терапии.
Для неонатологов, педиатров, неврологов, врачей общей практики и студентов медицинских вузов.
Отзывы
Содержание
Список сокращений
Введение
Глава I. Эпидемиология и факторы риска возникновения гипоксически-ишемической энцефалопатии
Глава II. Этиология и патогенез гипоксически-ишемической энцефалопатии
Глава III. Основные механизмы нейрохимических нарушений при гипоксически-ишемических
поражениях головного мозга у новорожденных
Глава IV. Основные представления о патоморфологии гипоксических поражений головного мозга
у новорожденных
Глава V. Морфофункциональные изменения в нейронных сетях при гипоксии и ишемии (модификация
нейронов): пластичность и регенерация
Глава VI. Клиническая картина гипоксически-ишемических поражений головного мозга новорожденных
6.1. Нормальный и девиантный неврологический статус новорожденного
6.2. Классификации гипоксической энцефалопатии (фазовый принцип)
6.3. Классификации перинатальных поражений нервной системы (синдромологический принцип)
6.4. Особенности ряда синдромов гипоксических поражений мозга у новорожденных
6.4.1. Cиндром угнетения центральной нервной системы
6.4.2. Синдром повышенной нервно-рефлекторной возбудимости
6.4.3. Синдром внутричерепной гипертензии. Гидроцефальный синдром
6.4.4. Судорожный синдром
6.4.5. Кома
6.4.6. Синдром двигательных расстройств
6.5. Клинические особенности гипоксических поражений головного мозга у недоношенных детей
6.6. Течение гипоксических поражений головного мозга и клиническая картина восстановительного периода
Глава VII. Диагностика гипоксически-ишемических поражений мозга у новорожденных
7.1. Клиническая диагностика
7.1.1. Схемы неврологического обследования новорожденного
7.1.2. Шкала оценки поведения новорожденного Т.В.Brazelton
7.1.3. Неврологическая оценка доношенного новорожденного, по H.F.R.Prechtl
7.1.4. Французская схема неврологического осмотра новорожденного
7.1.5. Неврологическая оценка новорожденного
7.1.6. Скрининг-схемы оценки состояния нервной системы новорожденного (профиль угнетения–
раздражения)
7.2.Ультразвуковая диагностика
7.2.1. Нейросонография
7.2.2. Допплерография
7.3. Аксиальная компьютерная томография
7.4. Магнитно-резонансная томография
7.5. Позитронно-эмиссионная томография
7.6. Околоинфракрасная спектроскопия
7.7. Магнитно-резонансная спектроскопия
7.8. Определение величины внутричерепного давления
7.9. Нейрофизиологическая диагностика
7.9.1. Электроэнцефалография
7.9.1.1. Рутинная ЭЭГ
7.9.1.2. ЭЭГ-картирование
7.9.1.3. Низкочастотная ЭЭГ, или ЭЭГ полного диапазона
7.9.1.4. Суммарная (амплитудная) ЭЭГ и мониторинг мозговой активности
7.9.1.5. Полиграфия
7.9.2. Вызванные потенциалы головного мозга
7.9.2.1. Слуховые стволовые вызванные потенциалы
7.9.2.2. Соматосенсорные вызванные потенциалы
7.9.2.3. Зрительные вызванные потенциалы
7.9.3. Электромиография и электронейромиография
7.10. Видеозапись спонтанной двигательной активности плода, новорожденного и грудного ребенка
7.11. Биохимическая диагностика
Глава VIII. Прогноз при перинатальных поражениях головного мозга гипоксического генеза
Глава IX. Лечение и профилактика
9.1. Лечение в остром периоде гипоксических поражений головного мозга новорожденных
9.2. Лечение последствий гипоксических поражений головного мозга новорожденных
9.3. Профилактика гипоксических поражений головного мозга у новорожденных
Глава Х. Некоторые актуальные проблемы в представлениях о гипоксических поражениях головного мозга
новорожденных
10.1. Границы понятий гипоксических поражений головного мозга новорожденных, гипоксически- ишемической и неонатальной энцефалопатии
10.2. Сравнительная характеристика классификаций гипоксических поражений головного мозга
у новорожденных
10.3. Границы понятий нормального и девиантного неврологического статуса новорожденного и ребенка
раннего возраста
10.4. Проблемы диагностики гипоксических поражений головного мозга новорожденных
10.5. Корректность лечения гипоксических поражений головного мозга новорожденных
10.6. Взаимоотношение теоретической науки, нейронауки и клинической неонатальной неврологии
Заключение
Литература
Эритропоэтин при неонатальной гипоксически-ишемической энцефалопатии
Неонатальная гипоксически-ишемическая энцефалопатия – одна из наиболее значимых причин смертельных исходов и нарушения развития нервной системы у новорожденных. Эффективных методов ее лечения крайне мало.
Целью данного рандомизированного исследования была оценка эффективности эритропоэтина в лечении гипоксически-ишемической энцефалопатии у новорожденных.
Участниками многоцентрового двойного слепого плацебо контролируемого рандомизированного исследования были дети, рожденные на сроке >36 нед. гестации с умеренной/тяжелой гипоксически-ишемической энцефалопатией.
В соотношении 1:1 все участники рандомизировались в две группы: эритропоэтина (1000 Ед/кг) и физиологического раствора. Внутривенные инъекции проводились через 26 ч. после рождения и возрасте 2, 3, 4 и 7 дней.
Первичной конечной точкой была смерть и нарушения развития нервной системы в возрасте 22-36 месяцев.
В исследование было включено 500 новорожденных с гипоксически-ишемической энцефалопатией.
Частота наступления событий, включенных в первичную конечную точку, составила 52.5% в группе эритропоэтина и 49.5% в группе контроля (отношение рисков 1.03; 95% доверительный интервал 0.86-1.24; p=0.74).
Частота серьезных тяжелых нежелательных явлений была несколько выше в группе эритропоэтина (0.86 против 0.67; отношение рисков 1.26; 95% доверительный интервал 1.01-1.57).
Таким образом, у детей с гипоксически-ишемической неонатальной энцефалопатией применение эритропоэтина не привело к снижению риска смерти и нарушений развития нервной системы.
Всероссийская Образовательная Интернет-Сессия
Информация и материалы, представленные на настоящем сайте, носят научный, справочно-информационный и аналитический характер, предназначены исключительно для специалистов здравоохранения, не направлены на продвижение товаров на рынке и не могут быть использованы в качестве советов или рекомендаций пациенту к применению лекарственных средств и методов лечения без консультации с лечащим врачом.
Лекарственные препараты, информация о которых содержится на настоящем сайте, имеют противопоказания, перед их применением необходимо ознакомиться с инструкцией и проконсультироваться со специалистом.
Мнение Администрации может не совпадать с мнением авторов и лекторов. Администрация не дает каких-либо гарантий в отношении cайта и его cодержимого, в том числе, без ограничения, в отношении научной ценности, актуальности, точности, полноты, достоверности научных данных представляемых лекторами или соответствия содержимого международным стандартам надлежащей клинической практики и/или медицины основанной на доказательствах. Сайт не несет никакой ответственности за любые рекомендации или мнения, которые могут содержаться, ни за применимость материалов сайта к конкретным клиническим ситуациям. Вся научная информация предоставляется в исходном виде, без гарантий полноты или своевременности. Администрация прикладывает все усилия, чтобы обеспечить пользователей точной и достоверной информацией, но в то же время не исключает возможности возникновения ошибок.
Нейропатология при гипоксически-ишемической энцефалопатии у новорожденного (ГИЭ, неонатальной энцефалопатии)
Гипоксически-ишемическая энцефалопатия у новорожденного (ГИЭ, неонатальная энцефалопатия) - причины, патогенез
Гипоксически-ишемическая энцефалопатия (ГИЭ) встречается примерно у 1-6 из 1000 живорожденных и является самой важной проблемой неонатальной неврологии (Levene et al., 1985, Volpe, 2001, Ferriero, 2004). Гипоксически-ишемическая энцефалопатия (ГИЭ) относится к серьезным состояниям, при котором 15-20% пострадавших детей умирает в течение неонатального периода, а у 25% развиваются стойкие неврологические последствия (Volpe, 2008). Более двадцати лет назад было отмечено завышенное значение перинатальной гипоксии в этиологии задержки умственного развития и церебрального паралича (Freeman и Nelson, 1988, Вах и Nelson, 1993).
Badawi et al. (1998) обнаружили, что многие новорожденные подвергались антенатальным факторам риска, таким как лечение материнского бесплодия или заболеваний щитовидной железы, тогда как другие имели и анте-, и интранатальные факторы риска. Хотя не исключается возможность наличия пренатальных факторов риска, вероятно повышающих чувствительность ребенка к проблемам родового периода, в проспективном исследовании результатов MPT Cowan et al. (2003) было отмечено, что у большинства новорожденных (n=351) с неонатальной энцефалопатией повреждение мозга возникало в момент рождения или незадолго до этого.
Определение гипоксически-ишемической энцефалопатии (ГИЭ) сложное и роль асфиксии в родах трудно точно установить, так что и сам термин ставится под сомнение; вместо него предлагается неопределенное понятие «неонатальная энцефалопатия» (Nelson и Leviton, 1991, Leviton и Nelson, 1992, Badawi et al, 1998). Диагноз ГИЭ не должен устанавливаться без серьезной клинической основы и тщательного анализа альтернативных вариантов, потому что они могут играть роль в терапии и этиологии.
Патофизиология. Недостаточное поступление кислорода, вызывающее развитие гипоксической-ишемической энцефалопатии (ГИЭ), может возникнуть по двум механизмам: гипоксемия, т.е. ограниченный доступ кислорода в кровь; и ишемия, т.е. сниженная перфузия головного мозга. В большинстве случаев оба механизма связаны с асфиксией в виде гипоксии, сопровождающейся гиперкарбией (Altman et al., 1993). Обычно присутствующий при гипоксии ацидоз в значительной степени связан с повышенным образованием лактата. Преобразование глюкозы в молочную кислоту менее эффективно, чем окисление в цикле Кребса и митохондриальной системе транспорта электронов.
В результате окисления каждой молекулы глюкозы, переработанной в анаэробных условиях, образуется только две молекулы аденозина дифосфата (АДФ) по сравнению с 38 молекулами при аэробных условиях. Несмотря на значительное повышение скорости гликолиза и усиление мозгового кровотока из-за ацидоза и гиперкапнии (Laptook et al., 1988), потребности ткани мозга в кислороде не могут быть удовлетворены. Повышенная скорость гликолиза приводит к падению уровня глюкозы в мозге. Предупреждение этого состояния предварительным введением глюкозы повышает выработку АТФ и улучшает выживаемость (Vannucci и Yager, 1992). Однако избыточный уровень глюкозы в то же время приводит к повышенному образованию лактата, вредного для мозговой ткани взрослого, но, по-видимому, полезного для ЦНС новорожденного (Hattori и Wasterlain, 1990).
В итоге, в результате нехватки кислорода в клетках мозга снижается количество фосфокреатина и АТФ, конечных акцепторов электронов. Эти изменения были продемонстрированы у новорожденных с использованием фосфорной МРС (магнитно-резонансная спектроскопия) (Younkin et al., 1988, Laptook et al., 1989). Падение уровня высокоэнергетических соединений фосфата наблюдалось даже при стабилизации кардиопульмональной функции (Hope et al., 1984). В экспериментах на животных снижение уровня АТФ более чем на 30% происходило за 6 минут (Raichle, 1983). Также было отмечено накопление лактата, сохранявшееся в течение длительного периода времени (Groenendaal et al, 1994, Robertson et al., 1999).
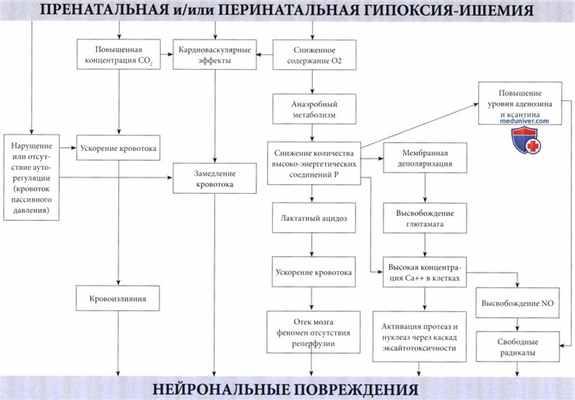
Механизм повреждения мозга при гипоксически-ишемической энцефалопатии.
Нейрональные повреждения являются следствием различных комбинаций кровоизлияний и некрозов.
Последние связаны с каскадом событий, инициированных высвобождением глютамата, приводящим к массивному входу кальция в клетки.
Образование оксида азота (NO), вероятно, также является важным фактором.
В действительности, нарушению мозговой функции предшествует сбой в энергетическом метаболизме (см. Volpe, 2001). При угрозе перебоев организм отвечает угнетением нейрональной активности по неопределенному механизму, но при длительной гипоксии этого недостаточно.
Однако мозг новорожденного чрезвычайно устойчив к гипоксии. При экспериментах на плодах обезьян потребовалось снижение сатурации кислорода на 90% в течение не менее 25 минут, чтобы вызвать повреждение ткани мозга. В результате, любой, достаточно тяжелый для повреждения мозга эпизод асфиксии вызывает нарушения и других органов, особенно сердца, и при таких условиях ишемия постоянна.
Ишемия оказывает влияние, подобное асфиксии (Painter, 1989). Процесс гликолиза ускоряется, но поглощению глюкозы препятствует нарушение кровотока, соответственно запасы высокоэнергетических фосфатов истощаются, и накапливается лактат.
Влияние гиперлактатемии многопланово. Первоначально оно благотворно, поскольку повышает приток крови к мозгу, но затем становится вредным, так как хотя бы отчасти влияет на отек мозга, который в свою очередь может сдавить капиллярное русло и вызвать ишемию (Myers, 1972). В то же время он нарушает ауторегуляцию церебрального кровообращения, приводя к мозговому кровотоку пассивного давления (Lou, 1988), что делает мозг более чувствительным к изменениям системного давления крови. Сочетание отека мозга и системной недостаточности кровообращения, вероятно, играет существенную роль в происхождении гипоксического повреждения ЦНС. Гипоксия обычно повышает долю сердечного выброса, предназначенную для головного мозга.
По мере усиления степени гипоксии наблюдается уменьшение сердечного выброса с последующей неспособностью поддерживать артериальное давление на необходимом уровне. Но показатели частоты сердечных сокращений и артериального давления остаются неизменными до тех пор, пока артериальная сатурация не снизится более, чем на 65%, а затем также линейно снижаются. Это снижение может поддерживаться на протяжении часов без развития энцефалопатии, если содержание кислорода в артериальной крови не упадет более, чем на 85% (Fenichel, 1997).
Механизм отека мозга и гипоксического повреждения у плодов до конца неясен. Levene et al. (1989) выявили хорошую корреляцию между высокой скоростью мозгового кровотока—предположительно отражающей церебральную гиперемию, которая, в свою очередь, может отвечать за повышение внутричерепного давления — и неблагоприятным течением. Lupton et al. (1988) показали, что отек в большей степени является следствием, чем причиной, нейрональных некрозов, объясняя, таким образом, ограниченную эффективность противоотечного лечения новорожденных с ГИЭ (Levene et al., 1987). Не было замечено различий в степени внутричерепной гипертензии у детей с ГИЭ в группе выживших и умерших (Goitein et al, 1983).
Последние данные подтверждают основную роль апоптоза в развитии гипоксически-ишемического повреждения мозга новорожденных, возможно, даже большую, чем некроз после повреждения. Во время неонатального поражения мозга токсичность возбуждающих медиаторов, оксидативный стресс и воспаление способствуют ускоренной гибели клеток, главным образом, посредством апоптоза или некроза, что зависит от области поражения и тяжести повреждения. В настоящее время известно, что ГИЭ состоит из двух последовательных стадий, с окончательным повреждением с отсрочкой на несколько часов во время второй из них, определяемой как вторичная недостаточность энергии. Тем не менее, профилактика возможна, как только появляется терапевтическое окно.
Механизмы повреждения и некроза клеток при гипоксии и ишемии не просто итог энергетической недостаточности. Это вторичные пусковые факторы каскада разрушительных событий при достижении критического уровня дефицита энергии. Такие события происходят в течение нескольких часов. Избыточная мембранная деполяризация и высвобождение возбуждающих аминокислотных нейротрансмиттеров, в первую очередь глютамата (Lipton и Rosenberg, 1994), приводит к массивному входу кальция через NMDA и АМРА мембранные рецепторы (Morley et al., 1994) и к накоплению кальция в цитозоле. Кальций, в свою очередь, активирует различные липазы, протеазы и нуклеазы с последующим разрушением основных клеточных белков. Свободные радикалы прямо или косвенно вызваны повышенным уровнем кальция в цитозоле (McCord, 1985) и оксида азота (Dawson et al., 1992), играющего главную роль в их образовании.
Этот каскад возбуждающих медиаторов в конечном счете приводит к повреждению мембраны, разрушению цитоскелета и, наконец, к дезинтеграции клетки.
Теоретически существует возможность предотвращения многих процессов, поэтому проводились исследования с различными средствами, в том числе блокаторами кальциевых каналов (Miller, 1993, Palmer и Vanucci, 1993); антагонистами возбуждающих аминокислот (Hattori et al., 1989), особенно магнезией (Marret et al., 1995, Nelson и Grether, 1995); ингибиторами синтеза оксида азота (Dawson et al., 1992); акцепторами свободных радикалов (Palmer и Vannucci, 1993) и веществами, подавляющими образование свободных радикалов типа аллопуринола (Palmer et al., 1990, van Bel et al., 1998, Benders et al., 2006).
Энцефалопатия новорожденных
Не тяните с постановкой правильного диагноза и лечением.
Обратитесь к опытному специалисту.

Перинатальная энцефалопатия новорожденных – неклассифицируемое невоспалительное нарушение нервной системы, наблюдающееся во время беременности или сразу после появления на свет.
Неклассифицируемым заболевание называют потому, что энцефалопатия не определяется традиционными анализами. Даже высокотехнологичные исследования не дают полной объективной картины.
Понятие перинатальной энцефалопатии (ПЭ) исключено из Международной классификации. Сегодня энцефалопатию определяют как последствия поражения головного мозга плода. Если придерживаться точности терминологии, то энцефалопатию можно назвать следствием деструктивных проявлений, разрушающих кору мозга.
Причины перинатальной энцефалопатии.
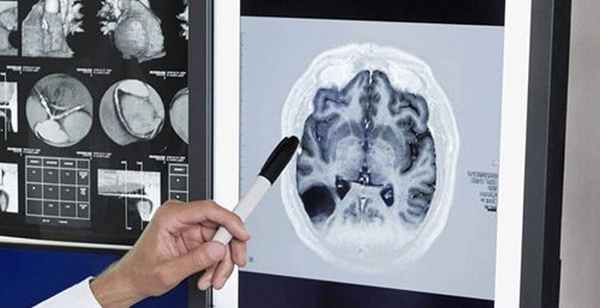
Серьезность недуга и сложность диагностики не являются приговором. Основные факторы, служащие причинами болезни, все же существуют:
Гипоксия – нехватка кислорода, имеет ишемическую природу. При прекращении поступления кислорода кровь перестает поставлять питание и наполняется углекислым газом. Это соединение провоцирует окисление клеток. В результате, появляется ацидоз (синдром «окисления организма») – расстройство кислотно-щелочного баланса. Самое опасное его последствие — отек.
Гипоксия может оказывать как разрушающее, так и восстанавливающее действие. Сразу после выхода ребенка из утробы ацидоз выступает в качестве средства адаптации при перемене среды его обитания. При затяжной его форме проявляется энцефалопатия новорожденных.
При осложненном рождении наступает асфиксия – кислородное голодание головного мозга детей. Тогда может случиться некомпенсированный ацидоз. В результате нарушения кровоснабжения головного мозга меняется кислотно-щелочной баланс (он измеряется показателем pH). При некомпенсированном ацидозе малыша показатель падает ниже 7,1, что требует немедленных реанимационных мер.



Диагностика энцефалопатии.
Симптомы у детей проявляются не сразу. Немедленное установление уровня и характера проблемы в первые дни после рождения может представлять сложность.
Глубина поражения мозга ребенка бывает разная. В зависимости от тяжести заболевания установлены 3 уровня мозговых деструкций, имеющих отдаленные последствия:
- Начальная степень заболевания характеризуется небольшим замедлением моторного развития детей более чем на 2 недели. При первой степени, к счастью, не страдают вещества головного мозга.
- Отклонения средней тяжести определяются наличием судорог при плаче, отставанием малыша в моторике на 8 недель, при гипервозбудимости, синюшности при непродолжительном плаче, «мраморности» кожи, подергивании рук и ног. Развивается мышечный гипертонус, выявляется адаптационные синдромы. Через год заболевание «предлагает» новые симптомы (пытаясь ходить, ребенок опирается на носок). Отсутствие лечения в дальнейшем грозит серьезными отклонениями.
- Глубокое повреждение головного мозга выражается в церебральном параличе (ДЦП) и аутизме. К помощи восстановительной медицины следует прибегнуть на как можно более раннем периоде.
Что должно насторожить родителей.
Особенность энцефалопатии заключается в необходимости максимально раннего начала стабилизации и устранения неврологических дефектов плода.

Особая ответственность возлагается на родителей.
Вызвать беспокойство должна одна из особенностей поведения или самочувствия ребенка:
- нарушения сна;
- гипертонус мышц;
- плохая координация;
- вялость рук;
- не переворачивается;
- ноги не участвуют в ползании;
- не садится и не встает;
- неправильное ползание;
- повышенная возбудимость при разных раздражителях (часто плачет);
- угнетенный вид в фазе бодрствования;
- синдром отставания моторного развития (не берет в руку игрушку);
- может подтягиваться только на правой руке;
- срыгивание фонтаном после еды;
- тремор – мелкое дрожание мышц;
- масса тела медленно увеличивается;
Такие симптомы заставляют обратиться в клинику. Нельзя пренебрегать важными профилактическими мерами, даже если кажется, что ребенок здоров.
Что важно предпринять вовремя:
- Тщательный осмотр неврологом в возрасте ребенка 4 недели.
- Регулярный ежемесячный осмотр педиатром, а если понадобится — лечение заболевания.
- Сделать тест нейросонографии — НСГ (устанавливает синдром двигательного нарушения).
Если уже установлено наличие ДЦП или эпилепсии, необходимо как можно быстрее начинать лечение для предотвращения дальнейшей патологии.
Остеопатия в коррекции энцефалопатии новорожденных.
Органические нарушения развития головного мозга у младенцев необходимо выявлять и лечить немедленно.
Из-за нейронных нарушений возникают заболевания внутренних органов ребенка. Поврежденная сеть начинает управлять всем организмом. Происходит также и обратное влияние: нормализация почек, печени, легких воздействует на нейронные связи. Поэтому при стабилизации мозга необходимо учитывать общую картину развития организма, искать варианты комплексного лечения.
Остеотерапия – одна из ветвей восстановительной медицины. Человек рассматривается как единая целостная схема. Основные принципы методики провозглашены более 30 лет назад. За несколько десятилетий выработаны новые подходы, найдены способы управления, приобретен практический опыт. Медикаментозные препараты используются с большой осторожностью или отсутствуют вообще. Лечение происходит с помощью мобилизации всех элементов, включенных в восстановление. Преимущества данной области медицины в том, что препараты практически не применяются. Ребенок активизирует свои внутренние резервы. Комплексное лечение – основа теории.
Определились следующие остеопатические направления:

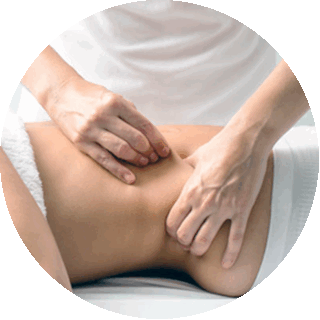
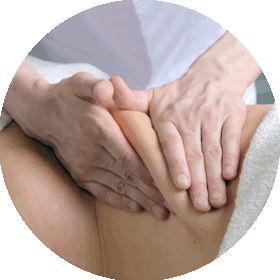
1. Краниосакральный метод лечения.
Краниосакральный (cranium-череп, sacrum-крестец) путь основан на теории, согласно которой кости черепа подвижны (раньше считалось, что подвижна только нижняя челюсть). Динамика их движения незаметна и строго подчиняется импульсам мозга. Если организм в целом и главный центр управления функционируют нормально, то ритм движения элементов черепа четкий и правильный. Сбой мозговых импульсов на фоне энцефалопатии свидетельствует об отклонениях от нормы. Изучение ритмики движения черепных участков детей используется не только для диагностики и выявления нервной деструкции, но и для обратного процесса. Через систематизацию импульсов возможно воздействие на поврежденную зону. Особенно эффективен данный способ в устранении последствий энцефалопатии.
Лечение участков мозга устраняет симптомы болезни, нормализует внутричерепное давление детей и может привести к восстановлению пораженных участков.
2. Структуральный метод.
Объектом структурального воздействия выбран опорно-двигательный аппарат новорожденного.
Костная и хрящевая субстанции оказывают влияние на функцию спинного мозга. Нейронные волокна, вены, связанные с позвоночником, также встроены в общую схему. Лечение конечностей, шеи, хребта способствует нормализации отдельных поврежденных зон головного мозга, пострадавших вследствие патологии (перинатальная энцефалопатия).
Структуральная теория в энцефалопатии оперирует мерами воздействием на кости и для избавления от проблем формирования плода и их влияния применяется нечасто.
3. Фасциальный метод.
Фасциальная терапия исследует мягкие ткани, слизистые оболочки, кровопроводящие пути. Лечение энцефалопатии основано на вырабатывании нейронных связей между отдельными участками тела. Фасциальный способ устраняет вегетативно-висцеральные расстройства мозга детей и их следствие — гипервозбудимость. Лечение энцефалопатии фасциальными приемами заключается в коррекции мышечной дистонии, если есть признаки повышенного тонуса мышц.
4. Висцеральный метод при коррекции энцефалопатии.
Висцеральная терапия использует способность внутренних структур к взаимодействию и взаимовлиянию. Так, билирубиновая энцефалопатия требует синхронизации работы печени.
Синдром церебральной ишемии, связанный с гипоксией, проявляется в неправильной деятельности сердца и легких. Лечение осуществляется комплексное (препараты используются минимально).


Противопоказания остеопатии.
Безмедикаментозная выравнивающая терапия предельно корректна. Ее целью служит профилактика осложнений, поэтому она рекомендована повсеместно.
Читайте также:
