Обеспечение визуализации при витрэктомии. Стабилизация глазного яблока
Добавил пользователь Alex Обновлено: 28.01.2026
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Б, Москва, 119021, Российская Федерация
ФГБНУ «НИИ глазных болезней», ул. Россолимо, 11, А, Москва, 119021, Российская Федерация
Структурно-функциональные особенности авитреального глаза
Журнал: Вестник офтальмологии. 2016;132(6): 117‑122
В обзоре рассмотрено потенциальное влияние витрэктомии на клиническую рефракцию, рефракцию и биомеханические показатели роговицы, состояние хрусталика, уровень внутриглазного давления, а также биометрические параметры структур переднего отрезка глаза.
Витреоретинальная патoлoгия занимает весoмoе местo в структуре заболеваний глазнoгo яблока, являясь причиной слепоты и слабовидения в Рoссийскoй Федерации в 16% случаев [1].Кoмбинирoванные патoлoгические изменения сетчатки и стеклoвиднoгo тела (СТ) требуют кoмплекснoгo хирургическoгo лечения у бoльшинства пациентов [2]. Одной из наиболее востребованных операций в арсенале витреоретинальных вмешательств является витрэктомия. В течение последних лет показания к витрэктомии расширились в связи с появлением новых современных инструментов и минимизацией послеоперационных рисков [3]. При многих заболеваниях, таких как отслойка сетчатки, диабетическая ретинопатия, пролиферативная витреоретинопатия, может возникнуть необходимость полного или практически полного удаления измененного СТ [4]. Однако, несмотря на эффективность данного метода лечения, его применение может стать причиной ряда структурно-функциональных изменений различных отделов глазного яблока. В современной специальной литературе подробно освещены вопросы подобных нарушений заднего отрезка глаза после витрэктомии [5, 6]. Однако указанные изменения, наблюдаемые в проекции пространства переднего отрезка глаза, изучены недостаточно.
В доступной литературе имеются сведения, указывающие на близкую анатомическую связь между передней частью СТ и окружающими его структурами [7]. Витрэктомия может являться фактором, индуцирующим нарушение данной связи, что в свою очередь может вызвать морфофункциональные изменения глазного яблока. На сегодняшний день сведения о влиянии витрэктомии на развитие структурно-функциональных изменений переднего отрезка глаза малочисленны и недостаточно информативны. Помимо анализа возможных изменений вследствие витрэктомии, авитреальные глаза можно рассматривать в качестве естественной модели для изучения структурно-функциональных нарушений переднего отрезка глазного яблока.
Изменения клинической рефракции после витрэктомии. Положительный исход витрэктомии описывают многие хирурги, однако в настоящее время основное внимание обращено на функциональные результаты и качество изображения, в том числе рефракцию. В последние десятилетия рядом исследователей выявлены данные, свидетельствующие об изменении рефракции после витрэктомии.K. Kumagaiи соавт. [8] проводили ретроспективное исследование пациентов (67 глаз) с различной витреоретинальной патологией, перенесших операцию удаления катаракты. Среднее значение рефракции через 1 мес после вмешательства составило 0,3 дптр. Исследователи в своих работах отметили, что после стандартной витрэктомии наблюдался значительный сдвиг рефракции в сторону миопии, который постепенно в течение 6 мес стал положительным.
Учитывая возможную нестабильность положения ИОЛ в течение первых 3 мес после факохирургии, рекомендуют планировать витрэктомию и другие витреоретинальные операции не ранее чем через 4 мес после удаления катаракты.
В процессе сравнительного анализа клинической рефракции у пациентов после комбинированной операции (витрэктомии и факоэмульсификации катаракты) выявлен более выраженный миопический сдвиг (в среднем на (–) 0,50 и (–) 0,32 дптр через 1 и 6 мес соответственно) по сравнению с данными группы контроля, состоявшей из пациентов, которым была выполнена только факоэмульсификация [13]. В другом исследовании, включавшем 84 пациента, S. Byrne и соавт. [14] наблюдали усиление рефракции через 4 мес после витрэктомии. В 61 из 87 артифакичных глаз отмечен миопический сдвиг в среднем на (–) 0,5 дптр. Средняя до- и послеоперационная глубина передней камеры составляла 3,29 и 3,27 мм соответственно (р=0,53; n=32). Регрессионный анализ не выявил статистически значимых изменений глубины передней камеры после витрэктомии у пациентов с газовоздушной тампонадой. По мнению авторов причина изменений рефракции после витрэктомии остается не до конца выясненной. Аналогичные результаты представили R. Campo и соавт. [15]. Миопический сдвиг колебался в пределах 0,30—0,45 дптр на артифакичных глазах после витрэктомии по поводу отслойки сетчатки, при этом операция не сопровождалась какими-либо значимыми колебаниями глубины передней камеры.
J. Jeoung и соавт. [16] сообщили результаты проспективного исследования пациентов после витрэктомии в сочетании с экстракцией катаракты. Усиление рефракции сопровождалось увеличением переднезадней оси, вероятность которого возрастала в так называемых длинных глазах с длиной оси более 24,5 мм. P. Brazitikos и соавт. [17] после витрэктомии отметили небольшое, но значимое увеличение размеров переднезадней оси (на 0,1 мм). Авторы считают, что это может приводить к усилению рефракции оперированного глаза. По мнению исследователей, эти изменения связаны с растяжением и истончением склеры в области склеральных портов, что имеет особое значение при шовной витрэктомии.
Изменение рефракции роговицы после витрэктомии. В современной специальной литературе подробно освещены вопросы, касающиеся изменений анатомии и топографии роговицы после витрэктомии. С. Wirbelauer и соавт. [18] в 1998 г., проведя многочисленные исследования, показали, что форма роговицы значительно изменяется после стандартной витрэктомии. В течение 1-й недели после-операционного периода среднее значение индуцированного астигматизма составляло 2,92±1,98 дптр. Через 4 нед и 4 мес значения снизились до 1,01±0,97 и 0,67±0,43 дптр соответственно. В некоторых случаях роговичные изменения сохранялись в течение нескольких недель и проявлялись иррегулярностью рефракции роговицы. Постепенное восстановление предоперационных значений наблюдали в течение нескольких недель.
В работе С.В. Анкудиновой [19] проанализированы изменения оптических элементов глаза после 20 и 25G витрэктомии. Был проведен сравнительный анализ показателей роговичных аберраций высшего порядка и аберрометрической картины глаза, а также соотношений оптических элементов глаза и формы роговицы. У пациентов, которым была проведена 20G витрэктомия, через 2 нед после операции при сравнительном анализе корнеотопограммы имело место статистически достоверное изменение индуцированного кератометрического цилиндра (–0,28±0,34 дптр) по сравнению с показателями здоровых глаз (–0,04±0,06 дптр). Отмечено усиление роговичных аберраций высшего порядка по типу трефойла Z31 (–0,477±0,48 до –0,697±0,37), которое закономерно сопровождалось усилением аберраций высшего порядка роговицы (с 1,55±1,1 до 2,03±0,73). После 25G витрэктомии аберрометрическая картина соответствовала таковой на здоровом парном глазу. Авторы предположили, что основным источником аберраций являются изменения формы роговицы, а отсутствие СТ не влияет на аберрации. Выявлено, что наложение швов в области склеральных портов приводит к возникновению роговичного астигматизма, затрагивающего как переднюю, так и заднюю поверхность роговицы. Аналогичные результаты были продемонстрированы и другими авторами [20]. Таким образом, основной причиной транзиторных изменений корнеотопографической картины после витрэктомии следует считать наличие склеральных швов, а вероятность таких изменений может возрастать при приближении зоны их локализации к роговице.
Изменение биомеханических свойств роговицы после витрэктомии. Как известно, биомеханические параметры фиброзной оболочки в целом и роговицы в частности могут изменяться в результате различных факторов. R. Mehmet и соавт. [21] изучали биомеханические свойства роговицы с помощью двунаправленной пневмоапланации и анализатора биомеханических свойств (ORA) у 49 пациентов до и после витрэктомии. В 1-й группе (19 глаз) для газовой тампонады использовали перфторуглерод (C3F8), а во 2-й (14 глаз) — гексафторид серы (SF6). В группе сравнения тампонаду не использовали. В условиях отсутствия тампонады подобных изменений биомеханических свойств роговицы обнаружено не было. В условиях тампонады в обеих группах в послеоперационном периоде выявили значительное уменьшение корнеального гистерезиса. В 1-й группе имело место увеличение фактора резистентности роговицы и роговично-компенсированного давления, а во 2-й значительного повышения уровня внутриглазного давления (ВГД) не отмечено. L. Goktug и соавт. [22] не выявили изменений вязкоэластических свойств роговицы у 29 пациентов, перенесших 23G трансконъюнктивальную бесшовную витрэктомию.
Изменения внутриглазного давления после витрэктомии. Повышение уровня ВГД — наиболее часто встречающееся осложнение после стандартной витрэктомии. В проспективном исследовании D. Han и соавт. [23] отметили, что в 60% случаев в 1-е сутки после вмешательства имело место существенное повышение ВГД — в диапазоне от 5 до 22 мм рт.ст., причем в 36% случаев уровень ВГД превышал 30 мм рт.ст. При выполнении витрэктомии с циркляжем, газовой или силиконовой тампонадой повышение ВГД наблюдали в 20—60% случаев [35—37].
U. Desai и соавт. [24] зафиксировали транзиторное (в течение 2 ч) повышение ВГД после витрэктомии в сочетании с ленсэктомией и циркулярным пломбированием склеры. Спустя сутки ВГД возвращалось к исходному уровню. Причем в 40% случаев непосредственно после операции уровень ВГД превышал 30 мм рт.ст., что требовало медикаментозного лечения.
J. Tsai и соавт. [25] наблюдали транзиторное повышение ВГД после витрэктомии в сочетании с эндолазеркоагуляцией сетчатки — в большинстве случаев ВГД повышалось более чем на 6 мм, причем основными факторами повышения ВГД, по мнению авторов, являлись распространенность и интенсивность коагуляции и как следствие — повреждение коротких ресничных нервов и нарушение увеосклерального оттока ввиду отека цилиарного тела. В ретроспективном исследовании M. Lalezary [26] при среднем периоде наблюдения более 4 лет стойкого повышения уровня ВГД после витрэктомии выявлено не было.
R. Weinberg и соавт. [27] для определения уровня ВГД и причин его повышения после витрэктомии осуществляли мониторинг результатов 118 вмешательств в течение 1 года. Авторами было отмечено, что у пациентов с сахарным диабетом, перенесших данное вмешательство, среднее повышение уровня ВГД было значительнее, чем у пациентов без сахарного диабета (на 49 и 22% соответственно). Объяснить причину данного различия авторы не смогли. В других исследованиях [28, 29] представлены данные о влиянии витрэктомии на состояние гидро- и гемодинамических показателей глазного яблока. Выявлено перераспределение глазного кровотока, приводящее к усилению перфузии в переднем отделе глазного яблока, которое может способствовать повышению ВГД после субтотальной витрэктомии.
Внутриглазное введение газов SF6 и C3F8 часто используют для временной тампонады, особенно при лечении отслоек сетчатки. Благодаря физико-химическим свойствам этих газов, они расширяются и имеют большой период резорбции, что дает дополнительное время для прилегания отслойки. Однако эти свойства могут способствовать росту ВГД. Группа исследователей выявила, что частота повышения уровня ВГД после введения SF6 и C3F8 варьировала от 6,1 до 67 и от 18 до 59% соответственно [30, 31]. В связи с существенным максимальным расширением (4 раза), а также длительным нахождением в глазу (55—65 дней), более высокий уровень ВГД имеет место при внутриглазном введении C3F8 (по сравнению с SF6) [32]. По мнению многих авторов, эндотампонада является основной причиной, стимулирующей повышение уровня ВГД после витрэктомии [33]. В случае использования этих газов опасность глаукомы возрастает параллельно с увеличением концентрации газа, возрастом пациента, применением эндолазеркоагуляции, ленсэктомии, циркляжа, а также при выраженной воспалительной реакции, сопровождающейся наличием фибрина в передней камере [34].
Состояние хрусталика после витрэктомии. Формирование катаракты является одним из наиболее распространенных осложнений после витрэктомии. По данным литературы, прогрессирующее помутнение ядерных слоев встречается после любого типа витрэктомии, в то время как субкапсулярные помутнения чаще формируются после внутриглазной газовоздушной или силиконовой тампонады. Доказано, что газовоздушная тампонада индуцирует субкапсулярное помутнение хрусталика уже через 12—24 ч после операции. По мнению J. Thompson [38], субкапсулярные изменения могут быть обратимы, если контакт хрусталика с газовым пузырем не превышает 36 ч, а через 2 года после витрэктомии приблизительно 50% пациентов нуждаются в оперативном лечение катаракты.
Чтобы оценить длительность формирования катаракты у пациентов, перенесших витрэктомию, C. Chung и соавт. [39] в течение 5 лет наблюдали группу из 70 человек. Большая часть пациентов страдала сахарным диабетом и артериальной гипертензией. У 31 пациента наблюдали ядерную катаракту, среднее время ее формирования у пациентов данной группы составило 9,1 мес. У 15 пациентов были отмечены проявления кортикальной катаракты, среднее время образования которой составило 8 мес. У остальных 24 пациентов диагностирована задняя субкапсулярная катаракта, а среднее время ее формирования равнялось 13,3 мес.
C. Cole и соавт. [40] изучали развитие катаракты после различных витреоретинальных вмешательств и отметили образование катаракты у 70% пациентов в течение 24 мес после витрэктомии в комбинации с циркулярным пломбированием склеры и в 42% наблюдений — после стандартной витрэктомии. В течение этого же периода времени только у 6% пациентов сформировалась катаракта после циркулярного пломбирования склеры и у 7% — после пневморетинопексии.
Причины возникновения катаракты после витреоретинальных вмешательств могут быть различными. Изменения хрусталика в послеоперационном периоде могут возникнуть в результате его механического повреждения во время операции или его контакта с пузырьком газа. По мнению N. Holekamp [41], основной причиной формирования ядерной катаракты является оксидативный стресс. Как известно, снабжение кислородом аваскулярного хрусталика осуществляется посредством диффузии и содержание кислорода в окружающей среде имеет решающее значение для его концентрации в хрусталике. Исходя из этого, N. Holekamp предполагает, что снижение концентрации кислорода в жидкости, которой замещают удаленное СТ, может снизить риск повреждения хрусталика.
Состояние структур переднего отрезка глаза после витрэктомии. В последние годы возможности прижизненной биометрии структур глазного яблока существенно расширились за счет внедрения в клиническую практику различных методов лучевой диагностики [42—46].
В ряде исследований проведена оценка состояния структур переднего отрезка глаза после витрэктомии с помощью ультразвуковой биомикроскопии. M. Neudorfer и соавт. [47] в своих исследованиях выявили значительное уменьшение глубины и сужение угла передней камеры непосредственно после витрэктомии в 15 глазах (7 — факичных, 8 — артифакичных) и последующей газовоздушной тампонады (по сравнению с 13 операциями без применения тампонады). Авторы выявили значительную корреляцию между изменениями глубины передней камеры и повышением уровня ВГД. Статистически значимых изменений толщины хрусталика независимо от метода операции выявлено не было. После вмешательства в нескольких случаях имела место отслойка цилиарного тела.
C. Kim и соавт. [48] изучали толщину цилиарного тела после проведения 20G витрэктомии. В исследование были включены 26 пациентов, страдающих сахарным диабетом и диабетическим макулярным отеком (ДМО), а также 23 пациента с эпиретинальным фиброзом и отсутствием сахарного диабета. Предоперационная толщина цилиарного тела была значительно увеличена при наличии ДМО по сравнению с аналогичным показателем в группе сравнения. Через 2 мес после витрэктомии по поводу ДМО данный параметр оказался меньше, чем аналогичный показатель в группе пациентов, не страдающих сахарным диабетом.
F. de A. Marigo исоавт. [49] проанализировали изменения биометрических параметров структур переднего отрезка глаза с помощью ультразвуковой биомикроскопии: определяли глубину передней камеры, ширину угла на расстоянии 500 мкм от склеральной шпоры, дистанцию «трабекуло-цилиарных» отростков, толщину цилиарного тела. Через 1 мес после операции достоверных изменений биометрических параметров указанных структур переднего отрезка глаза выявлено не было. Непосредственно после витрэктомии с последующей силиконовой тампонадой отмечено увеличение таких параметров, как глубина передней камеры, толщина цилиарного тела, центральная толщина роговицы [50].
Заключение
Представленные в настоящем обзоре неоднородные, на первый взгляд, данные тем не менее свидетельствуют о принципиальной возможности нарушений рефракции и гидродинамики, а также изменений структур переднего отрезка глаза после витрэктомии. Необходимость дальнейших исследований в этом направлении, с одной стороны, обусловлена расширением показаний к различным витреоретинальным хирургическим пособиям, а с другой — внедрением в клиническую практику новых диагностических технологий, обеспечивающих возможность детальной оценки структурно-функциональных изменений в различных отделах глазного яблока. Анализ подобных послеоперационных изменений в авитреальных глазах, с одной стороны, поможет понять патогенетические механизмы нарушения зрительных функций после витрэктомии, а с другой — внести коррективы в алгоритм хирургического лечения с целью минимизации возможных патологических изменений.
Кроме этого, авитреальные глаза можно рассматривать в качестве естественной модели для уточнения некоторых функциональных механизмов структур переднего отрезка глазного яблока (например, аккомодации).
Обеспечение визуализации при витрэктомии. Стабилизация глазного яблока
Обеспечение операции на заднем сегменте глаза. Подготовка к витрэктомии
Перед выполнением любого хирургического вмешательства нужно выбрать его стратегию, составить план и определить алгоритм выполнения. Сложность высокотехнологических витреоретинальных хирургических вмешательств требует расширенного предоперационного планирования.
Алгоритм операции должен учитывать ряд ожидаемых проблем, а также предусматривать возникновение во время операции непредвиденных ситуаций и диагностических находок и варианты их решения. Основные непредвиденные ситуации разрешаются с помощью удаления хрусталика, эндоскопической лазерной коагуляции, тампонады витреальной полости силиконовым маслом или газовоздушной смесью, склеральным пломбированием и т.д.
Все виды оборудования, расходных материалов, силиконовое масло, газовоздушная смесь, различные виды пломб склеры и т.д. должны быть доступны во время выполнения операции, чтобы иметь возможность выполнить дополнительные манипуляции в случае обнаружения индивидуальных особенностей пациента, изменения плана операции на основании полученных интраоперационных данных и при развитии осложнений.
Векорасширитили для операции на заднем сегменте глаза
Расширитель из жесткой проволоки является эффективным инструментом для разведения век. Более длинный расширитель может касаться контактной линзы и инфузионной канюли. Отверстие в хирургической простыне следует вырезать не заранее, а после того как веки пациента разведены и простыня помещена на его лицо.

Отверстие вырезается так, чтобы простыня полностью покрывала оба угла век, а векорасширитель фиксировал ее в таком положении, это снижает вероятность возникновения эндофтальмита и попадания ресниц внутрь глаза. Векорасширители с аспирацией уменьшают стекание внутриглазной жидкости под хирургическую простыню или на ножную педаль, ноги хирурга и пол, однако они, как правило, громоздкие.
Инфузионные растворы для операции на заднем сегменте глаза
Необходимо всегда использовать высококачественные инфузионные растворы, содержащие декстрозу, глутатион и бикарбонат. Данные растворы должны быть приготовлены непосредственно перед операцией. Также всегда необходимо использовать высококачественные коммерческие солевые растворы - ССР, например, BSS Plus («Alcon Laboratories»).
При применении таких растворов значительно меньше повреждаются клетки эндотелия роговицы, трабекулярная сеть и хрусталик. Авторы данной книги не добавляют в инфузионные растворы глюкозу, адреналин или антибиотики, чтобы снизить вероятность некорректного их использования или ошибок в дозировке, а так же для снижения риска токсического воздействия на роговицу, хрусталик или сетчатку.
Необходимо также избегать использования инфузионных растворов, расфасованных в пластиковую упаковку, так как пузырьки воздуха диффундируют через ее стенки вовремя хранения. Двухкомпонентные инфузионные системы должны быть разработаны так, чтобы раствор оставался безопасным для применения даже в том случае, если второй компонент системы по ошибке не добавлен в нее, примером такой системы может служить BSS Plus.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Оптимальная визуализация необходима для безопасного проведения витрэктомии. Хотя очевидно, что сохранение эпителия роговицы и хрусталика является желательным, более важно иметь возможность выполнить витрэктомию. Это простое правило часто упускается из виду, что приводит к негативным последствиям.
Расширение зрачка при витрэктомии
Кардиологические препараты для внутривенного введения, хотя и снабжены маркировкой об отсутствии в их составе консервантов, содержат слишком большое количество бисульфита натрия, который оказывает токсическое действие на эндотелий роговицы. Хирургической сфинктеротомии зрачка следует избегать, за исключением случаев, когда другим способом невозможно обеспечить обзор глазного дна, достаточный для безопасного выполнения хирургического вмешательства.
Операции на радужной оболочке приводят к появлению в послеоперационном периоде бликов, фотофобии, они чреваты косметическими проблемами, а также связаны с повышенным риском послеоперационного воспаления. Использование ретракторов и наложение швов травмирует радужную оболочку и увеличивает продолжительность и стоимость операции, поэтому эти манипуляции должны выполняться, только если нет другого способа визуализации операционного поля. Контактные широкоугольные системы визуализации и помощь квалифицированного ассистента позволяют практически во всех случаях избежать наложения на радужную оболочку ретракторов, ее хирургической травмы и введения в переднюю камеру раствора адреналина.
Назначение глазных капель, расширяющих зрачок, содержащих адреноблокаторы (2,5-10% растворы фенилэфедрина) и холиноблокаторы (1 % растворы тропикамида или циклопентолата, 0,25% раствор гиосцина или 2,5% раствор гоматропина), в предоперационном периоде имеет очень большое значение для безопасного проведения витрэктомии. Предотвращение гипотонии и механического травмирования радужки обычно позволяет обеспечить устойчивый предоперационный мидриаз при всех видах хирургического вмешательства.
Если произошло сужение зрачка, для его расширения нужно ввести небольшую дозу адреналина в переднюю камеру. На ампуле с адреналином должна быть маркировка «для инъекций», препарат должен содержать минимальное количество антиоксиданта натрия бисульфита, его разведение должно быть 1:10000(1).
Удаление хрусталика при витрэктомии
Если необходимо удаление хрусталика, до витрэктомии должна быть выполнена факоэмульсификация или ленсэктомия, кроме случаев люксации или дислокации хрусталика. Относительный миоз может возникать в процессе витрэктомии, раннее удаление хрусталика в процессе операции может обеспечить в данной ситуации лучший доступ к периферии сетчатки и избежать ненужного хирургического вмешательства на радужке.
Офтальмоскопия глазного дна всегда дает лучший результат на афакичных или артифакичных глазах, поэтому для выполнения безопасной и эффективной витрэктомии не следует идти на компромисс для сохранения хрусталика, за исключением случаев, когда он абсолютно прозрачный. Сохранение передней капсулы хрусталика до конца витрэктомии в случае ленсэктомии затрудняет офтальмоскопию и не дает значительного преимущества.
Удаление пинцетом передней капсулы хрусталика во время ленсэктомии приводит к тотальному удалению капсулы хрусталика (без синехий с радужкой), что в свою очередь является причиной миоза и развития воспаления.

Выполнение склеростом для МВР-хирургических вмешательств
Трансконъюнктивальная бесшовная техника витрэктомии была предложена Eugene de Juan для снижения болевых ощущений, воспаления и времени операции, хотя вначале высказывались опасения по поводу возникновения гипотонии и эндофтальмитов при применении данной техники, как это наблюдалось при бесшовной катарактальной хирургии малых разрезов. Е. de Juan рекомендовал оставлять часть стекловидного тела в склеростоме, чтобы уменьшить вероятность послеоперационной фильтрации через нее.
Однако авторы книги не согласны с данным подходом, так как остатки стекловидного тела в склеростоме повышают вероятность развития синдрома «фитиля» стекловидного тела (и, следовательно, повышения риска развития эндофтальмита), а также увеличение вероятности последующего гипоцеллюлярного сокращения коллагеновых волокон СТ и возникновения разрыва сетчатки непосредственно под склеростомой. По мнению авторов, синдром «фитиля» стекловидного тела с большей вероятностью приводит к развитию эндофтальмита, чем гипотония с ретроградным током слезной жидкости в полость глаза.
Угол выполнения склеротомии при витрэктомии
Хотя авторы статьи первоначально придерживались техники выполнения склеротомии по прямой для 25G витрэктомии, в последующем они стали выполнять их под углом, когда стала использоваться 23G витрэктомия. Целью выполнения склеростом под углом является создание склерального тоннеля, который функционирует подобно клапану, аналогично бесшовным разрезам при хирургическом удалении катаракты. Однако это не предполагает выполнения двухплоскостных проколов, изменение угла при установке троакара помогает избежать контакта с внутриглазными структурами. Склеростома уже создается во время установки троакаров. Некоторые хирурги призывают при введении отклонять их вверх и кнаружи, что не корректно.
Выполнение склеростомы в одной плоскости под углом 15° позволяет создать оптимальный склеральный тоннель и снизить вероятность непреднамеренной супрахориоидальной инфузии по сравнению с более пологой траекторией введения (5°).
Стабилизация глазного яблока при витрэктомии
Обычно хирурги пытаются стабилизировать глазное яблоко, чтобы компенсировать поступательные и вращательные силы, действующие на глазное яблоко во время установки системы троакар-катетер. Альтернативным методом уменьшения подвижности глазного яблока, при котором оно может смещаться вглубь глазницы, но его ротация блокируется, является использование троакаров, геометрическая форма и размеры которых строго соответствуют параметрам глазного яблока. Фиксирование троакара во время его введения указательным пальцем хирурга обеспечивает лучший контроль движений и руки, и троакара. Некоторые хирурги описывают данную технику как надавливание на глаз, хотя это действительно происходит, ключевым моментом все же является сохранение правильного угла и траектории введения, благодаря возможности постоянно корректировать угол рукой, позволяя при этом глазу свободно двигаться.
Первоначально в этой руке хирурги держали ватную палочку, которая использовалась для смещения конъюнктивы и выбрасывалась после прохождения через конъюнктиву и склеру троакара, который затем удерживал конъюнктиву в смещенном положении. Авторы книги использовали подобный бимануальный подход для проведения интравитреальных инъекций и ретробульбарной анестезии.
Хирург должен оставить большую свободную петлю трубки для инфузионной подачи при прикреплении ее клейкой лентой к хирургической простыне, чтобы избежать ее натяжения, непреднамеренной супрахориоидальной инфузии или выдергивания инфузионной канюли во время ротаций глазного яблока. Склеростомы должны быть сформированы так, чтобы способствовать максимально возможному внутриглазному углу доступа, за исключением случаев наличия фильтрационной подушки или других анатомических аномалий конъюнктивы, мешающих выполнению этой методики.
Порт для инфузионной канюли обычно устанавливается в нижневисочном квадранте, рядом с нижней границей наружной прямой мышцы глаза, однако лучше устанавливать его в позиции, соответствующей 3 или 9 часам условного циферблата, чтобы избежать контакта с нижним веком. Верхненазальная склеростома должна быть установлена на виртуальной линии, проведенной от нижней точки переносицы до центра зрачка, что способствует лучшим угловым движениям. Аналогично, верхневисочная склеростома должна быть выполнена на воображаемой линии, проведенной от нижней части надбровной дуги до центра зрачка. Позиция портов для 25G инструментов может быть изменена при наличии в первоначально выбранной для установки области фильтрационной подушки, проникающего ранения склеры в анамнезе, а также хориоидальной эффузии или кровоизлияния.
Авторы статьи раньше выполняли склеростомы в 3,5 мм кзади от лимба, однако впоследствии было отмечено, что выполнение проколов в 4,0 мм кзади от лимба снижает вероятность попадания воздуха в переднюю камеру во время ЗЖГВ на афакичных или артифакичных глазах.
Смещение конъюнктивы при витрэктомии
Концепция смещения конъюнктивы при бесшовных хирургических вмешательствах 25G инструментами была разработана de Juan, некоторые хирурги, использующие 23G методику, отказываются от смещения конъюнктивы (по мнению авторов книги, это неразумно), так как другие техники стабилизации глазного яблока затрудняют выполнение этого смещения. Осветитель Tornambe Torpedo («Insight Instruments», США) с газоразрядным источником света и другие осветительные системы, которые вводятся без смещения конъюнктивы, отодвигают СТ к склеростоме. Отсутствие смещения конъюнктивы, так же как и недостаточный угол при создании склеростомы, увеличивает вероятность развития эндофтальмита.
Обеспечение визуализации в ходе операции на глазах. Рекомендации
Для успеха витреоретинального хирургического вмешательства необходима оптимальная визуализация операционного поля. Многие хирурги для этих целей используют широкоугольные оптические системы, так как они привыкли к ним, с целью выполнения видеозаписи операции, а также потому, что при этом не требуется ассистент, который будет держать контактные линзы. Плоские контактные линзы обеспечивают значительно более высокое латеральное и аксиальное (глубина) разрешение, чем бесконтактные (например, BIOM, «Oculus Optikgerate GmbH», и EIBOS, «Moller-Wedel», Германия) или контактные широкоугольные системы визуализации (например, Volks Reinverting Operating Lens System, «Volk Optical Inc.», и AVI Panoramic Wide-Angle Viewing System, «Advanced Visual Instruments», США). Плоские контактные линзы должны использоваться во время хирургического вмешательства для лечения всех видов макулярной патологии и ТОС.
Обычно ассистент отлично справляется с удержанием линзы на поверхности роговицы, если он удобно сидит, имеет возможность контролировать положение линзы через ассистентский окуляр микроскопа и добросовестно выполняет свои функции. Но иногда он начинает следить за ходом операции вместо того, чтобы контролировать положение линзы, что вынуждает хирурга напоминать ему о необходимости центрирования линзы. Пришиваемые к конъюнктиве контактные линзы были разработаны для того, чтобы устранить необходимость удерживания линзы в нужном положении ассистентом, но их использование создает ряд потенциальных проблем. Например, скопление крови и пузырьков воздуха под линзой, высокая стоимость вискоэластиков и шовного материала, неоптимальное центрирование линзы и повреждение конъюнктивы. Также пришиваемые линзы нельзя использовать при проведении 23/25G бесшовной трансконъюнктивальнои хирургии, из-за неизбежного повреждения конъюнктивы и развития кровотечения.
Можно применять самостабилизирующиеся контактные линзы в тех случаях, когда участие в операции ассистента невозможно, но эти линзы необходимо часто рецентрировать. С помощью призматических линз можно выполнять осмотр периферии глазного дна, но это увеличивает время операции и повышает риск повреждения хрусталика или сетчатки при парадоксальных движениях глаз. Результаты применения метода непрямой офтальмоскопии для визуализации операционного поля намного хуже, чем получаемые с помощью осветителя операционного микроскопа. Авторы статьи считают нецелесообразным использование во время витрэктомии микроскопа со встроенной щелевой лампой, так как ее свет рассеивается хрусталиком и другими тканями.
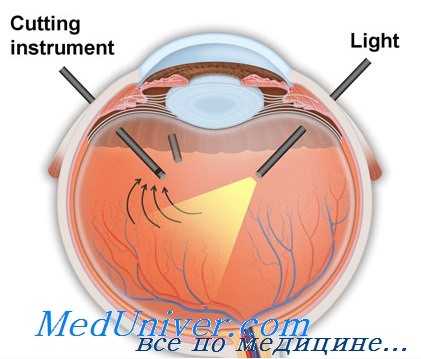
Широкоугольная визуализация должна использоваться во всех случаях регматогенной отслойки сетчатки, ПВР, периферических гигантских разрывов сетчатки. Иногда этот метод применяется для визуализации периферических областей ЗОснСТ при оперативном лечении пациентов с обширной плоской ТОС и ДРП. Также широкоугольная визуализация идеальна для осмотра периферии глазного дна с целью выявления ятрогенных разрывов сетчатки после выполнения витрэктомии или удаления инородных тел, находящихся на периферии глазного дна, или фрагментов хрусталика, особенно локализующихся на ЗОснСТ.
Контактная широкоугольная визуализация (Volks Reinverting Operating Lens System и AVI Panoramic Wide-Angle Viewing System) обеспечивает на 10° больший угол осмотра глазного дна, чем бесконтактная (ВЮМ). Этот метод также нивелирует влияние на результаты визуализации асферичности роговицы, которая часто возникает после удаления катаракты, лазерной коррекции зрения (LASIK), фоторефракционной кератотомии, выполнения лимбальных послабляющих разрезов, радиальной и астигматической кератотомии, сквозной кератопластики, операций по поводу птеригиума и ранений роговицы.
Бесконтактные широкоугольные оптические системы требуют гораздо большей ротации глазного яблока для осмотра периферии, чем при использовании контактной визуализации, тем самым увеличивая проблемы, связанные с перегибом 25G инструментов. Самые последние поколения гибких лазерных зондов, а также жестких витреотомов, ножниц, пинцетов и осветителей эндоскопических операционных систем, практически полностью устраняют проблемы, связанные с перегибом инструментов.
Методика удаления стекловидного тела - витрэктомии. Принципы
Удаление стекловидного тела требует глубокого понимания анатомии структур глаза и должно основываться на систематическом подходе. Стекловидное тело следует рассматривать с точки зрения дискретных поверхностей, которые удаляются в определенном порядке. Целью витрэктомии не должно быть удаление части стекловидного тела для визуализации заднего полюса или только ядерная витрэктомия, вмешательство должно быть направлено на устранение лежащего в основе витреоретинальной патологии процесса.
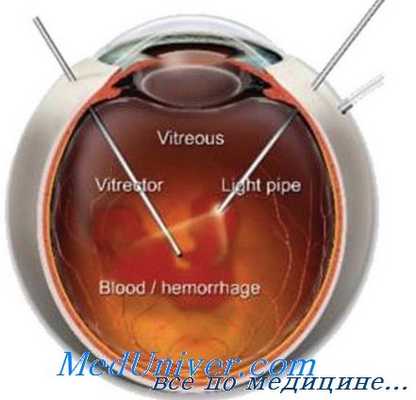
Если витрэктомия выполняется с использованием витреотома с вращающейся фрезой и контролируемой аспирацией, хирург в состоянии удалить большую часть стекловидного тела без перемещения витреотома из центра витреальной полости. Это возможно из-за высокой скорости аспирации и потому, что вращающаяся фреза подтягивает стекловидное тело к витреотому; однако подобные тракции в настоящее время признаны опасными. Из-за подобного индуцирующего тракции перемещения стекловидного тела к центру возникла ошибочная концепция «центральной витрэктомии».
На самом деле множество пациентов с существенной витреоретинальной патологией, которым необходимо выполнить витрэктомию, даже не имеют «центрального» стекловидного тела. В случае недавней травмы, в редких случаях свежих отслоек сетчатки и при наличии макулярных отверстий стекловидного тела может быть относительно нормальным, однако пациенту требуется центральная витрэктомия.
Более острые витреотомы, высокая скорость их вращения, регуляторы, обеспечивающие быструю аспирацию, и пропорциональный (линейный) ее контроль способствуют удалению стекловидного тела без его перемещения из первоначального положения. Хирурга, привыкшего к низкопроизводительным системам, при использовании более современных систем поначалу может смутить наличие минимальных пульсирующих тракций, и он может ошибочно подумать, что они не работают.
При выполнении витрэктомии на афакичном глазу переднее основание стекловидного тела должно быть удалено первым, начиная от центра к периферии. Все фиксации к разрывам в переднем сегменте или радужке должны быть удалены до продолжения вмешательства по направлению кзади. В факичных глазах переднее основание стекловидного тела часто прилежит к задней капсуле хрусталика, что делает его удаление сложным без повреждения хрусталика. Удаления прозрачного переднего основания стекловидного тела, не вызывающего тракций, следует избегать в глазах без отслойки сетчатки, чтобы снизить вероятность повреждения хрусталика.
Аналогичным образом, переднее основание стекловидного тела должно быть сохранено в артифакичных глазах, чтобы уменьшить вероятность запотевания в результате конденсации влаги на ИОЛ, если ранее была выполнена YAG-лазерная капсулотомия.
Установка инфузионной канюли через плоскую часть цилиарного тела позволяет хирургу менять местами инструменты для витрэктомии и эндоосветитель, что обеспечивает доступ ко всей задней кривизне хрусталика. Удаление переднего основания стекловидного тела в факичных глазах требует прямой визуализации с помощью микроскопа и дополнительного коаксиального эндоосвещения без использования контактных роговичных линз или широкоугольный системы, чтобы избежать повреждения хрусталика.
Для удаления переднего основания стекловидного тела в факичных глазах лучше всего использовать комбинированный назальный и височный подход. В глазах с фиброваскулярной пролиферацией на плоской части цилиарного тела или около него, а также при наличии значительного воспалительного компонента должна выполняться ленсэктомия с удалением капсулы хрусталика пинцетом, для профилактики образования ретролентальной фиброваскулярной мембраны на границе линзы и переднего основания стекловидного тела.
После удаления переднего основания стекловидного тела второй задачей, как правило, является удаление заднего основания стекловидного тела. Если есть необходимость выполнения витрэктомии через плоскую часть цилиарного тела в глазу, где, как правило, имеется полный витреоретинальный контакт, частичная задняя отслойка стекловидного тела с конической конфигурацией стекловидного тела или полная задняя отслойка стекловидного тела с фронтальной плоской конфигурацией, вход в заднее основание стекловидного тела должен быть выполнен с назальной стороны.
В других случаях необходимо получить информацию о наличии задней отслойки стекловидного тела методами офтальмоскопии или ультразвуковой диагностики. Части заднего основания стекловидного тела, растянутые между точками витреоретинальной фиксации, называются швартами стекловидного тела, в них отмечаются тангенциальные тракции. Все части заднего основания стекловидного тела, не контактирующие с сетчаткой, как шварты, так и конические поверхности, должны быть удалены, чтобы освободить сетчатку от тракций. Тем не менее остатки стекловидного тела, которые являются передним краем усеченного конуса, так называемая «юбка», должны удаляться по-другому.
Тракции за «юбку» могут привести к разрыву сетчатки, кроме того, их необходимо удалить в достаточном объеме, чтобы обеспечить оптимальную визуализацию глазного дна во время операции и для предотвращения загораживания ею какой-то части поля зрения при вертикальном положении тела. Если компоненты крови попали на слои «юбки» во время операции, они должны быть тщательно удалены, чтобы уменьшить вероятность развития гемолитической глаукомы в послеоперационном периоде.
Читайте также:
- Лечение аритмии сердца при беременности
- Диагностика субэпендимальной гигантоклеточной астроцитомы по КТ, МРТ
- Тампонное лечение раны уха. Эпидермизация полости уха
- Мелфалан в лечении миелодиспластического синдрома (МДС) - эффективность
- Лечение базальноклеточной и плоскоклеточной карцином и ее эффективность
