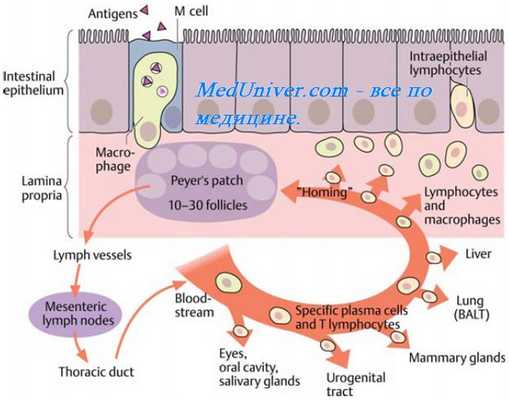
Отторжение трансплантанта. Реакция отторжения трансплантата. Клеточные реакции отторжения трансплантата. Аллоантитела. Типирование антигенов ( Аг ).
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Распространенность операций по трансплантации тканей (органов) заметно увеличилась в клинической практике за последние два десятилетия. В настоящее время успешно проводятся операции по трансплантации роговицы, кожи и костей. Трансплантация почек выполняется с большим успехом во многих крупных медицинских центрах. Пересадка сердца, легких, печени и костного мозга — все еще экспериментальные процедуры, но успех этих операций увеличивается с каждым днем.
Факторами, ограничивающими трансплантацию тканей, являются иммунологические реакции против пересаженных клеток и наличие соответствующих донорских органов. Не вызывает иммунологических реакций отторжения аутотрасплантация — трансплантация собственных тканей хозяина из одной части организма в другую (например, кожи, костей, вен), а также обмен тканями между генетически идентичными (монозиготными) близнецами (изотрансплантат), так как ткань воспринимается как “своя”.
При пересадке бессосудистых трансплантатов (например, роговицы) реакция иммунологического отторжения не появляется, так как отсутствие кровообращения в трансплантате предотвращает контакт иммунных клеток с антигенами, а для развития иммунного ответа необходимо соприкосновение антигена с клетками иммунной системы.
Трансплантация ткани между генетически разнородными людьми вызывает иммунологический ответ, который может вести к отторжению. Выраженность реакции отторжения увеличивается по мере роста генетических различий между донором и реципиентом. В настоящее время почти все органы пересаживаются от людей. Пересадка органов между генетически различными членами одного и того же вида названа аллотрасплантантацией. Ксенотрансплантация (гетерологическая трансплантация) — это пересадка органов между особями разных видов (например, известен случай пересадки сердца бабуина ребенку); такой вид трансплантации сопровождается тяжелой иммунологической реакцией и практически не используется.
Трансплантационные антигены (антигены гистосовместимости). Иммунологическая реактивность против пересаженных клеток может быть направлена против большого количества антигенов на поверхностной мембране клеток.
Антигены на эритроцитах: хотя антигены ABO, Rh, MNS и других систем групп крови не являются собственно антигенами гистосовместимости, совместимость между эритроцитами донора и сывороткой реципиента очень важна и при переливаниях крови, и при трансплантации тканей. Достигнуть такой совместимости легко, потому что имеются относительно небольшое количество различных клинически существенных групп антигенов.
Антигены на поверхности клеток тканей:
1. HLA-комплекс — антигены HLA-комплекса (HLA — human leukocyte antigen — человеческий антиген лейкоцитов) — антигены гистосовместимости (то есть, генетически детерминированные изоантигены, которые вызывают иммунный ответ при трансплантации в организм другого человека). У человека главный комплекс гистосовместимости (MHC) — это участок хромосомы, содержащий гены, которые определяют синтез антигенов гистосовместимости — находится на коротком плече 6 хромосомы.
А. Молекулярные классы MHC-региона — молекулы, кодируемые MHC-областью разделены на три класса: I, II и III.
Молекулы I класса — HLA-A, HLA-B и HLA-C — кодируются тремя отдельными парами генных локусов. Антигены I класса, впервые найденные на лейкоцитах (отсюда термин HLA), экспрессируются (синтезируются и выводятся на клеточную поверхность) почти во всех тканях (продукт четвертого локуса I класса, HLA-G, экспрессируется только в трофобласте.) Молекулы I класса играют важную роль при распознавании антигена цитотоксическими T-клетками (CD8).
Молекулы II класса кодируются тремя или более генными локусами (DR, DP и DQ). HLA-DR антигены известны также как Ia антигены по аналогии с антигенами иммунного ответа у мышей. Антигены II класса имеют ограниченное распространение в тканях, преимущественно на B-клетках, макрофагах, обрабатывающих антиген, и активированных T-клетках; они участвуют в распознавании антигена T-клетками (хелперами; CD4).
В 6 хромосоме между генами I и II классов находятся гены, кодирующие молекулы III класса (которые включают факторы комплемента 2, 4a и 4b) и цитокины TNFa и TNFb.
Б. Генетика — в клетках человека для каждого HLA-локуса имеются два аллеля (альтернативных формы гена), которые кодируют, соответственно, два HLA-антигена в клетке. Оба антигена экспрессируются, поэтому все ядросодержащие клетки в организме имеют четыре пары антигенов (A, B, C и D), т.е. в общей сложности как минимум восемь HLA-антигенов (для простоты считается, что HLA-D не имеет разновидностей). Таким образом человек наследует одну аллель в каждом локусе от каждого родителя (то есть, восемь HLA антигенов на клетке, четыре унаследованы от одного родителя и четыре от другого).
Сложность системы HLA антигенов объясняется существованием большого количества различных возможных аллелей для каждого локуса (по крайней мере 20 для HLA-A, 40 для HLA-B, 10 для HLA-C и 40 HLA-D). Они кодируют соответствующее число HLA антигенов в клетках: то есть, в общей популяции любые два из 20 различных антигенов могут быть закодированы в локусе А, любые два из 40 в локусе B и т.д. Огромное число возможных комбинаций HLA антигенов приводит к низкой вероятности того, что два индивидуума будут иметь идентичный тип HLA.
Так как HLA локусы близко расположены в 6 хромосоме они обычно наследуются как гаплотипы (без рекомбинации; плод получает материнские группы A, B, C и D и отцовские группы A, B, C и D). Поэтому среди потомства двух родителей имеется приблизительно 1:4 случаев полного совпадения (двух-гаплотипные) HLA антигенов, 1:2 случаев одно-гаплотипного сходства HLA антигенов и 1:4 случаев полного несоответствия HLA антигенов. Высокая степень совместимости редко наблюдается у двух неродственных людей, поэтому трансплантация органов родственников чаще имеет положительные результат, чем при трансплантации генетически несвязанных органов.
При определении HLA совместимости используются периферические лимфоциты крови. Определение совместимости по HLA-A, HLA-B, HLA-C и HLA-DR антигенам производится путем использования набора антисывороток с антителами известной HLA специфичности; то есть, HLA тип определяется серологически. Так как другие HLA-D антигены не могут быть определены серологически (т.к. невозможно получить соответствующие антисыворотки), совместимость по ним определяется методами смешанной культуры лимфоцитов. Выживание почечного аллотрасплантата самое высокое, когда донор и реципиент близко согласованы по HLA-A, HLA-B и HLA-DR антигенам.
2. Другие антигены гистосовместимости — факт наличия иммунологических реакций при пересаживании полностью HLA совместимых тканей позволяет сделать вывод, что присутствуют другие активные антигены гистосовместимости в клетках, но они еще недостаточно изучены.
Механизмы отторжения трансплантата. При отторжении трансплантата играют a роль и гуморальные, и клеточные механизмы. Хотя отторжение трансплантата иногда рассматривают как проявление феномена гиперчувствительности, потому что происходит повреждение клеток, это — фактически нормальный иммунный ответ на чужеродные антигены.
Гуморальные механизмы: гуморальные механизмы опосредованы антителами, которые могут присутствовать в сыворотке реципиента перед трансплантацией или развиваться после пересадки чужеродной ткани. Предоперационное определение уже присутствующих антител против пересаженных клеток выполняется путем прямого определения совместимости тканей, которая выполняется in vitro постановкой реакции между клетками донора (лимфоцитами крови) и сывороткой реципиента. Гуморальные факторы повреждают пересаженную ткань путем реакций, которые эквивалентны реакциям гиперчувствительности II и III типов. Взаимодействие антител с антигеном на поверхности пересаженных клеток приводит к некрозу клеток, а накопление иммунных комплексов в кровеносных сосудах активирует комплемент, что приводит к развитию острого некротизирующего васкулита или хронического фиброза интимы с сужением сосудов. Иммуноглобулины и комплемент в таких препаратах можно обнаружить иммунологическими методами.
Клеточные механизмы: клеточные механизмы отторжения вызывают T-лимфоциты, которые становятся сенсибилизированными к пересаженным антигенам. Эти лимфоциты вызывают повреждение клеток путем прямой цитотоксичности и путем секреции лимфокинов. Повреждение Т-клетками характеризуется некрозом паренхиматозных клеток, лимфоцитарной инфильтацией и фиброзом. Клеточные механизмы в процессе отторжения более важны, чем гуморальные.
Клинические типы отторжения трансплантата
Отторжения трансплантата имеет несколько форм: от быстротечной реакции, протекающей в течении нескольких минут после трансплантации, до медленных реакций, проявляющихся нарушением функций пересаженных тканей через несколько лет после трансплантации. Механизмы, вовлеченные в эти различные типы отторжения, также различны.
Острейшее отторжение: острейшее отторжение — молниеносная реакция, протекающая в пределах нескольких минут после трансплантации и характеризующееся тяжелым некротическим васкулитом с ишемическим повреждением пересаженного органа. Накопление иммунных комплексов и активация комплемента в стенке вовлеченных сосудов могут определяться иммунологическими методами.
Острейшее отторжение вызывается присутствием в сыворотке реципиента высоких уровней предсуществующих антител против антигенов на пересаженных клетках. Реакция антител с антигенами вызывает иммунокомплексное (типа феномена Артюса) повреждение в сосудах трансплантата. После начала применения техники прямого определения совместимости тканей острейшее отторжение стало редкостью.
Острое отторжение: острое отторжение наблюдается довольно часто и может протекать от нескольких дней до месяцев после трансплантации. Оно является острым потому, что даже если признаки отторжения появляются через несколько месяцев после трансплантации и быстро прогрессирует с момента его начала. Острое отторжение характеризуется некрозом клеток и нарушением функций органа (например, острый некроз миокарда и сердечная недостаточность при пересадке сердца).
При остром отторжении участвуют и гуморальные, и клеточные механизмы. Иммунные комплексы депонируются в мелких сосудах трансплантата и вызывают острый васкулит, ведущий к ишемическим изменениям. Клеточное иммунное отторжение характеризуется некрозом паренхиматозных клеток и лимфоцитарной инфильтацией тканей. При пересадке почек острое отторжение проявляется в виде острой почечной недостаточности в результате некроза почечных канальцев с лимфоцитарной инфильтрацией интерстициальной ткани. Для предупреждения и лечения острого отторжения применяют иммуносупрессивные лекарствами, например, кортикостероиды (преднизолон) и циклоспорины, или антилимфоцитарную сыворотку, которая разрушает Т-клетки пациента.
Хроническое отторжение: хроническое отторжение наблюдается в наибольшем количестве пересаженных тканей и вызывает прогрессирующее ухудшение функции органа в течении месяцев или лет. У пациентов часто имеются эпизоды острого отторжения, приостановленные иммуносупрессивной терапией.
При хроническом отторжении активируется клеточный иммунитет (IV тип гиперчувствительности), что приводит к прогрессивному уничтожению паренхиматозных клеток. В пораженной ткани развивается фиброз с лимфоцитарной инфильтрацией. В некоторых случаях присутствие хронического васкулита указывает на параллельное воздействие антител.
При лечение хронического отторжения пытаются достичь баланса между повреждением трансплантата и выраженностью токсического влияния иммуносупрессивных лекарств, которые обычно используются для предотвращения отторжения.
Реакция отторжения трансплантата
Реакция отторжения трансплантата (РОТ) – иммунологический процесс, направленный против чужеродных для организма тканей, пересаженных в ходе операции трансплантации. Сопровождается комплексом местных (отек, воспаление) и общих (явления интоксикации, повышение температуры, слабость) проявлений, выраженность и скорость развития которых зависят от варианта реакции. Диагностика производится посредством изучения клинической картины, гистологического исследования пересаженных тканей, ряда лабораторных и инструментальных методов в зависимости от типа трансплантата. Лечение сводится к проведению иммуносупрессивной терапии, использованию цитотоксических средств, некоторые препараты назначают пожизненно.
Общие сведения
Иммунологические реакции отторжения трансплантата возникают при использовании аллогенных (пересаженных от человека человеку) или ксеногенных (от животных человеку) тканей и органов. Аутотрансплантаты, например кожа, пересаженная с бедра на лицо, имеют такую же антигенную структуру, как и другие ткани организма, поэтому реакции не вызывают. Отторжение крайне редко возникает при пересадке бессосудистых структур – роговицы, некоторых хрящей – поскольку в этом случае отсутствует контакт чужеродных тканей с иммунокомпетентными клетками. Состояние было самым распространенным осложнением на заре трансплантологии, но в последние годы встречается все реже, несмотря на увеличение количества хирургических операций такого типа. Это связано с успехами в определении гистосовместимости тканей донора и реципиента, разработкой более действенных методов иммуносупрессивной терапии.
Причины реакции отторжения трансплантата
Антигенная совместимость тканей обусловлена сочетанием ряда антигенов – в первую очередь, главного комплекса гистосовместимости (шесть главных антигенов и ряд второстепенных или минорных). Кроме того, влияние могут оказывать и другие белковые антигенные комплексы (АВ0, белки соединительных тканей). Во многом реакции отторжения аналогичны обычному иммунному ответу при попадании в организм чужеродных антигенов или (в некоторых случаях) реакциям гиперчувствительности 2-го и 3-го типов. В их развитии принимают участие гуморальные и клеточные механизмы иммунитета. Скорость возникновения патологических изменений трансплантата зависит от вида реакции, активности иммунитета реципиента, величины антигенного различия тканей.
Причиной молниеносных разновидностей отторжения трансплантата служит сенсибилизация организма реципиента, в результате которой при пересадке возникают процессы, аналогичные реакциям непереносимости с образованием иммунных комплексов и активацией системы комплемента. Более распространенные острые виды иммунологической реакции на пересаженные ткани обычно развиваются из-за несовместимости по антигенам ГКГС, в патогенезе участвует преимущественно клеточный иммунный ответ. Хронические формы РОТ обусловлены как клеточными, так и гуморальными реакциями, их причиной часто становится некорректная иммуносупрессивная терапия, назначенная после операции.
Патогенез
Процессы патогенеза реакции отторжения трансплантата отличаются при разных формах этого состояния. Сверхострые или молниеносные реакции обусловлены сенсибилизацией организма к антигенам пересаженного органа, поэтому протекают по типу непереносимости или аллергии. При контакте тканей аллотрансплантата с кровью реципиента стимулируется образование иммунокомплексов, оседающих на внутренней поверхности сосудов. Они провоцируют активацию системы комплемента, сильно повреждая эндометрий сосудистой сети трансплантата, из-за чего происходит образование множественных микротромбов и эмболизация сосудов. Это ведет к ишемии пересаженных тканей, их отеку, а при отсутствии терапевтических мер – к некрозу. Скорость развития патологических процессов составляет всего несколько часов или суток.
В основе острых и хронических видов РОТ лежат процессы клеточного иммунного ответа, поэтому такие реакции развиваются несколько медленнее – на протяжении нескольких недель. При антигенной несовместимости тканей трансплантата и реципиента на фоне адекватной или повышенной активности иммунитета происходит распознавание чужеродных клеток макрофагами и Т-лимфоцитами (хелперами или индукторами). Последние активируют Т-киллеры, которые выделяют протеолитические ферменты, разрушающие клеточные мембраны структур аллотрансплантата. Итогом является развитие воспалительной реакции в пересаженном органе, выраженность которой зависит от уровня активности иммунной системы. При длительно протекающем процессе возможно подключение гуморальных факторов иммунитета с синтезом специфических антител, направленных против антигенов трансплантата.
Классификация
Выделяют несколько форм реакции отторжения, различающихся между собой по скорости развития и ряду клинических проявлений. Причиной такой разницы являются разные виды РОТ, обладающие неодинаковой скоростью возникновения, а также преимущественным поражением тех или иных структур трансплантата. Зная примерные сроки формирования того или иного типа иммунного ответа, специалист может определить его характер и назначить оптимальное лечение. Всего существует три основных клинических формы реакций непереносимости тканей трансплантата:
- Молниеносная или сверхострая. Возникает в первые минуты или часы после «подключения» пересаженного органа к системному кровотоку реципиента, обусловлена сенсибилизацией организма последнего к антигенам трансплантата. Характеризуется массивными микроциркуляторными нарушениями с ишемическими явлениями в аллотрансплантате и развитием некроза, воспаление при этом имеет вторичный характер.
- Острая. Регистрируется в течение первых трех недель после пересадки, патогенез основан на клеточном иммунном ответе при несовместимости донора и реципиента. Основным проявлением становится развитие воспалительных процессов в пересаженных тканях, их выраженность зависит от активности иммунитета.
- Хроническая. Возникает через несколько месяцев после трансплантации, может иметь рецидивирующий характер, сильно зависит от режима иммуносупрессивной терапии. Развивается посредством как клеточных, так и гуморальных механизмов иммунного ответа.
Симптомы реакции отторжения трансплантата
Все проявления отторжения аллотрансплантата разделяют на системные, зависящие только от патогенеза процесса и реактивности иммунитета, и локальные, связанные непосредственно с трансплантированным органом или тканью. Среди общих симптомов всегда наблюдается повышение температуры, озноб, лихорадка большей или меньшей степени выраженности. Регистрируются проявления общей интоксикации – головная боль, тошнота, рвота, снижение артериального давления. Симптомы интоксикации организма резко усиливаются при развитии процессов некроза в трансплантате, в тяжелых случаях на этом фоне возможно возникновение токсигенного шока.
Локальные проявления РОТ связаны с пересаженным органом, поэтому могут различаться у разных больных. При трансплантации целого органа на первый план выступают симптомы, обусловленные нарушением его функции – например, кардиалгии, нарушения ритма, сердечная недостаточность при пересадке сердца. Острая почечная недостаточность может быть связана с реакцией отторжения трансплантированной почки, печеночная – печени. При аллотрансплантации кожного лоскута возникает его отек, покраснение вплоть до багрового оттенка, возможно присоединение вторичной бактериальной инфекции. Сроки появления местных и общих симптомов отторжения зависят от его формы – молниеносный тип характеризуется тяжелой реакцией уже через 2-3 часа после трансплантации, тогда как острые и хронические виды могут проявляться через несколько недель или даже месяцев.
Осложнения
Наиболее ранним и тяжелым осложнением реакции отторжения пересаженных тканей является развитие шока, связанного с иммунологическими процессами или обусловленного интоксикацией организма. Некроз и поражение тканей трансплантированного органа, работа которого является жизненно важной для организма (например, сердца), часто приводит к летальному исходу. К осложнениям РОТ некоторые специалисты относят и инфекционные болезни, вызванные усиленной иммуносупрессивной терапией. В отдаленной перспективе на фоне искусственного понижения активности клеточного иммунитета возможно развитие онкологических заболеваний.
Диагностика
Особенностью диагностики реакции отторжения трансплантата является необходимость ее максимально быстрого проведения, позволяющего не только улучшить состояние больного, но и сохранить пересаженный орган. Некоторые исследователи относят к диагностике РОТ ряд иммунологических исследований, выполняемых перед операцией на этапе подбора донора – типирование спектра трансплантационных антигенов, определение биологической совместимости тканей. Качественное выполнение данных анализов позволяет избежать развития сверхострой реакции и значительно снизить вероятность возникновения других форм отторжения. Среди диагностических процедур, выполняемых после трансплантации, наиболее информативными являются следующие:
- Лабораторные исследования. При процессе отторжения в общем анализе крови будут выявляться признаки неспецифического воспаления – лимфоцитоз, увеличение СОЭ. Исследование иммунного статуса позволяет обнаружить иммунные комплексы, увеличение уровня компонентов комплемента (при молниеносных формах), иммуноглобулинов. Под действием иммуносупрессивной терапии результаты анализов могут искажаться, что необходимо учитывать при их интерпретации.
- Инструментальные исследования. Инструментальные методы диагностики (рентгенография, УЗИ, УЗДГ, КТ, МРТ) используют для оценки функциональной активности и структуры трансплантата – почки, печени, сердца, легкого. В общем плане РОТ проявляется отеком органа, нарушением его работы, наличием циркуляторных нарушений (ишемии, инфарктов, некроза). При хронических и рецидивирующих типах реакции в структуре трансплантата могут определяться участки склероза.
- Гистологические исследования. Биопсия тканей аллотрансплантата, их последующее гистологическое и гистохимическое изучение является золотым стандартом в определении РОТ. При молниеносном типе реакции в биоптате выявляются поврежденны е капилляры, периваскулярный отек, признаки ишемии и некроза тканей, биохимические исследования определяют иммунные комплексы на поверхности эндометрия. При хронических или острых типах отторжения обнаруживается лимфоцитарная инфильтрация тканей трансплантата, наличие участков ишемии и склероза.
Подходы к диагностике реакций отторжения могут меняться с учетом конкретного пересаженного органа. Например, при трансплантации почки показаны общий и биохимический анализ мочи, УЗДГ и другие ультразвуковые исследования органа, с осторожностью – экскреторная урография. В случае пересадки сердца необходимо проведение электрокардиографии, ЭхоКГ, коронарной ангиографии.
Лечение реакции отторжения трансплантата
Лечение РОТ заключается в уменьшении активности иммунного ответа, до сих пор продолжается разработка наиболее эффективных методов. Составлением схемы терапии занимается врач-иммунолог в кооперации с трансплантологом. Перспективной техникой считается выработка иммунологической толерантности к антигенам аллотрансплантата, однако ее механизмы довольно сложны и пока недостаточно изучены. Поэтому практически единственным методом лечения и профилактики отторжения является неспецифическая иммуносупрессивная терапия, проводимая несколькими группами лекарственных средств:
- Стероидные препараты. К этой группе относят преднизолон и его производные, дексаметазон и другие средства. Они снижают скорость пролиферации лимфоцитов, являются антагонистами многих факторов воспаления, эффективно уменьшают выраженность иммунного ответа. В ряде случаев курсовое применение этих препаратов после проведения трансплантации назначают пожизненно.
- Аналоги азотистых оснований. Данные препараты способны встраиваться в процесс синтеза нуклеиновых кислот и тормозить его на определенном этапе, снижая скорость образования иммунокомпетентных клеток и выраженность процессов отторжения. В целях профилактики их используют вскоре после пересадки органа.
- Алкилирующие средства. Группа препаратов, способных присоединяться к ДНК клеток и блокировать их деление. Медикаменты применяют при острых формах данного состояния по причине быстрого и надежного цитотоксического эффекта.
- Антагонисты фолиевой кислоты. Витамин В9 участвует в синтезе некоторых азотистых оснований и пролиферации лимфоцитов, его антагонисты замедляют процесс развития иммунного ответа при РОТ. Средства используют при хронических формах реакции в составе комплексной терапии.
- Антибиотики. Отдельные препараты данной группы (циклоспорин, хлорамфеникол) блокируют синтез РНК, тормозя как клеточные, так и гуморальные иммунные реакции. Иногда применяются пожизненно после трансплантации для профилактики отторжения.
По показаниям могут быть назначены и другие медикаменты для улучшения состояния больного – детоксикационные препараты, диуретики, стимуляторы сердечной деятельности, противовоспалительные и жаропонижающие средства. При тяжелых осложнениях (шок, острая сердечная или почечная недостаточность) необходимы реанимационные мероприятия, гемодиализ. При присоединении инфекции на фоне иммуносупрессии требуется своевременное назначение антибиотиков, противогрибковых или противовирусных (с учетом характера возбудителя) средств.
Прогноз и профилактика
Прогноз при молниеносных видах реакции отторжения трансплантата практически в 100% случаев неблагоприятный – требуется операция по удалению пересаженного органа, подбор нового донора и повторная трансплантация. В то же время, риск развития РОТ при вторичной пересадке повышается в несколько раз. Своевременно начатая иммуносупрессия при острых или хронических вариантах состояния нередко позволяет сохранить аллотрансплантат, но повышает риск инфекционных осложнений и вероятность возникновения рака в будущем. Эффективной профилактикой отторжения является тщательный подбор донора для пересадки, проверка совместимости по всем возможным антигенным системам – особенно по ГКГС, совместимы должны быть не менее 4-х из 6-ти главных аллелей. Резко снижает вероятность развития патологии наличие прямой кровной родственной связи между донором и реципиентом.
Отторжение почечного трансплантата ( Отторжение пересаженной почки )
Отторжение почечного трансплантата — это иммунная реакция организма реципиента на чужеродные антигены донорской почки. При остром течении проявляется гриппоподобным синдромом, олигоанурией, уплотнением и болезненностью пересаженного органа, артериальной гипертензией. Хроническое отторжение до появления ХПН обычно определяется только лабораторно. Патология диагностируется при помощи лабораторных анализов, УЗИ, УЗДГ, пункционной биопсии трансплантата. В ходе лечения применяют пульс-курсы кортикостероидов, противотимоцитарные глобулины, плазмаферез, плазмообмен. В тяжелых случаях требуется нефротрансплантатэктомия, ЗПТ, повторная трансплантация почки.
МКБ-10
Пересадка почки — самая распространенная трансплантологическая операция, в проведении которой нуждается не менее 40 пациентов с ХПН на 1 млн. населения, однако дефицит донорских органов не позволяет удовлетворить эту потребность. Ситуация усугубляется риском потери пересаженного органа из-за различия антигенных структур реципиента и донора.
Причины
В основе патологического процесса лежит иммунный ответ организма на антигены донорского органа. Поскольку абсолютная антигенная совместимость тканей существует только у однояйцевых близнецов, во всех остальных случаях аллотрансплантации наблюдается повреждение элементов пересаженной почки факторами иммунитета. В современной урологии, нефрологии, трансплантологии определены следующие причины отторжения нефротрансплантата:
- Несовместимость тканей донора и реципиента. Еще до проведения трансплантации в организме реципиента могут присутствовать антитела к тканям донора. Индикаторами риска отторжения являются AB0-несовместимость, тканевая несовместимость, определяемая методом HLA-типирования, пресенсибилизация реципиента: титр предсуществующих антител (PRA) выше 30, наличие донор-специфических антител (DSA), повторная трансплантация.
- Повышенная иммуногенность трансплантата. Вероятность отторжения увеличивается при наличии изменений из-за неправильной консервации или длительной транспортировки донорской почки, полученной от трупа. Фактором риска считается период холодовой ишемии дольше 24 часов. Повышение иммуногенности связано с деструкцией тканей и высвобождением антигенов. Зачастую в таких случаях отмечается отсроченная реакция пересаженного органа.
- Некорректная иммуносупрессорная терапия. Важным условием приживления трансплантированной почки является превентивная иммуносупрессия при выявлении несовместимости тканей и прием иммунодепрессивных препаратов после операции. Кризы отторжения чаще возникают при ведении пациента без назначения индукционного агента, использовании циклоспорин-азатиопринового протокола (вместо такролимус-мофетилового) или протокола без стероидов.
Факторами риска считаются пожилой возраст донора почки, молодой возраст реципиента и его принадлежность к этническим афроамериканцам, отсроченное функционирование почечного трансплантата. Возникновение первого эпизода отторжения повышает вероятность повторных кризисов. Предпосылками к гиперергическому иммунному эффекту являются наличие аутоиммунной и атопической патологии, склонность к аллергическим реакциям.
Механизм отторжения почечного трансплантата основан на развитии реакций гуморального и клеточного иммунитета. При сверхострых и ускоренных кризах чужеродные антигенные структуры подвергаются атаке уже существующих антител, которые путем комплимент-зависимого лизиса повреждают капиллярный эндотелий нефронов пересаженной почки. Возможно быстрое развитие иммунокомплексного воспаления с осаждением в тканях почечного трансплантата комплексов антиген-антитело и активацией системы комплимента. Результатом ответа становятся гемокоагуляционные нарушения с тромбированием сосудов почечного аллотрансплантата, прекращением кровотока и отмиранием тканей вследствие ишемии.
Ключевую роль в развитии острой трансплантационной иммунной реакции играет Т-клеточный ответ. После распознавания донорских HLA-антигенов лимфоцитами реципиента возникает прямой быстрый эффект в виде созревания специфических Т-киллеров, разрушающих чужеродные клетки, и более поздняя дифференциация B-лимфоцитов в плазматические клетки, секретирующие иммуноглобулины. Вначале происходит очаговая клеточная инфильтрация почечного трансплантата лимфоцитами и плазмоцитами, в последующем пересаженный орган тотально инфильтрируется зрелыми лимфоцитарными клетками, на завершающем этапе отторжения в воспалительном процессе участвуют сегментоядерные клетки и макрофаги.
Патогенез хронического отторжения представлен гуморальной иммунной реакцией, при которой циркулирующие антитела реципиента связываются с HLA-антигенами донорских тканей. В воспалительный процесс вовлекаются преимущественно артерии, артериолы, капилляры клубочков и канальцев трансплантата, эндотелий которых подвергается альтерации с последующей постепенной облитерацией просвета. Возникающая ишемия приводит к отмиранию функциональной ткани почки, ее замещению соединительнотканными фиброзными волокнами, прогрессированию почечной недостаточности.
Критериями для систематизации вариантов отторжения почки-трансплантата служат сроки возникновения и патогенетические особенности иммунного ответа. По скорости развития отторжение бывает сверхострым (происходящим на операционном столе или в первые часы после пересадки), ускоренным (спустя 12-72 часа после начала кровотока в пересаженном органе), острым (от 3 дней до 3 месяцев после операции), хроническим (развившимся по окончании острого периода). В международной морфологической классификации Banff-2007 нормальное приживление трансплантата определяется как реакция I типа, выделяются следующие сомнительные и патологические состояния:
- ТипII — антитело-опосредованные изменения. При отсутствии признаков активного отторжения сопровождается отложением Т-хелперов, наличием в сыворотке DSA. Иммунный ответ может проявляться острым канальцевым некрозом, поражением гломерулярных и перитубулярных капилляров, артериитом и фибриноидным некрозом.
- ТипIII— пограничные изменения. Служат маркером возможной Т-клеточной реакции отторжения. В биоптате почки отсутствуют признаки сосудистого поражения. У 7% пациентов выявляется тубулит без воспалительных изменений в интерстиции либо интерстициальное воспаление без значительного повреждения канальцев.
- ТипIV— Т-клеточно-опосредованное отторжение. Умеренное (1А) или тяжелое (1Б) тубулоинтерстициальное воспаление определяется у 51-52% реципиентов с отторжением трансплантата. В 10-11% случаев обнаруживается слабый, умеренный (2А) или тяжелый (2Б) артериит, в 1-2% — трансмуральный артериит, фибриноидный некроз.
II-IV типы реакций соответствуют сверхострым и острым расстройствам. Хроническое отторжение с атрофией канальцев и интерстициальным фиброзом отнесено к типу V. Тип VI включает другие изменения, возникающие при кризах отторжения почечного аллотрансплантата. Использование классификации Banff позволяет подобрать эффективную патогенетическую терапию иммунной реакции.
Симптомы
Клиника зависит от времени возникновения криза. При ускоренных и острых формах отторжения общее состояние ухудшается резко: нарастает слабость, общее недомогание, нарушается сон, возникают мышечные и суставные боли, при тяжелом течении обнаруживается кашель, тошнота, рвота, кожный зуд. Температура повышается до 38° С и более, отмечаются ознобы. Существенно, вплоть до полного прекращения мочевыделения, сокращается диурез.
В области почечного трансплантата определяется болезненное припухание или уплотнение. Повышается артериальное давление. Реакция позднего отторжения длительное время протекает бессимптомно и устанавливается преимущественно лабораторно. При значительном склерозировании паренхимы трансплантата могут наблюдаться быстрая утомляемость, снижение работоспособности, появление утренних отеков на лице, артериальная гипертензия, уменьшение объема суточной мочи.
Острая воспалительная деструкция или постепенное склерозирование паренхимы завершаются развитием почечной недостаточности и нарастанием признаков уремии. Интоксикация организма продуктами разрушения тканей трансплантата в сочетании с нарушением ренин-ангиотензиновой регуляции давления и коагулопатическими расстройствами может спровоцировать возникновение интоксикационного шока, ДВС-синдрома, тромбозов крупных сосудов (тромбоэмболии легочной артерии и др.), сердечной недостаточности с отеком легких, асцитом.
На фоне проводимой иммуносупрессорной терапии возможно усугубление иммунной реакции инфекционно-воспалительным процессом. Основными последствиями позднего синдрома отторжения являются стойкая артериальная гипертензия, анемия, остеопороз.
Диагностический поиск у пациентов с подозрением на отторжение почечного трансплантата направлен на верификацию иммуновоспалительного процесса. Проще диагностируются острые варианты трансплантологического кризиса, возникающие сразу либо в первые месяцы после операции. При хроническом синдроме отторжения в связи с отсутствием выраженной симптоматики требуется высокая диагностическая настороженность при оценке динамики лабораторных показателей. Рекомендованными методами обследования являются:
- Биохимический анализ крови. Признаками синдрома отторжения служат нарастание уровня креатинина, высокие концентрации мочевины, калия. Обычно увеличивается содержание лактатдегидрогеназы, С-реактивного белка. В пробе Реберга выявляется снижение скорости клубочковой фильтрации. Результаты исследования крови дополняют данными нефрологического комплекса.
- УЗИ трансплантата. При остром процессе пересаженная почка увеличена в размерах, чашечно-лоханочная система и мочеточник расширены. В паранефрии определяется выпот. Паренхима гипоэхогенна, характерен симптом «выделяющихся пирамид». Хроническое отторжение проявляется уменьшением размера почечного аллотрансплантата, гиперэхогенностью вследствие склероза.
- УЗДГ почечных сосудов. У пациента с острой реакцией снижается линейная скорость кровотока или обнаруживается его полное отсутствие. Индекс сопротивления превышает 0,7, выявляются аваскулярные зоны размерами более 0,3 см. Артериальный диастолический кровоток существенно уменьшен или отсутствует. При тяжелом отторжении возможен реверсивный кровоток в диастоле.
- Расширенное комплексное иммунологическое исследование. Позволяет определить отдельные субпопуляции лимфоцитов, их активность, содержание циркулирующих иммунных комплексов, иммуноглобулинов. Дополняется исследованием уровня комплемента и общим анализом крови, в котором отмечается лейкоцитоз (реже — лейкопения), эозинофилия, тромбоцитопения, ускорение СОЭ.
- Пункционная биопсия почечного трансплантата. Наиболее достоверный метод диагностики кризиса отторжения - биопсия почки. В полученном материале при остром воспалении обнаруживается инфильтрация лимфоцитами, плазматическими клетками, признаки поражения интимы сосудов. При позднем процессе выявляется тубулоинтерстициальный нефрит, фибропролиферативный эндартериит, гломерулосклероз.
Дополнительное проведение нефросцинтиграфии почечного трансплантата позволяет оценить функциональный резерв органа. Начавшийся эпизод ускоренного или острого отторжения дифференцируют с сохраняющейся отстроченной функцией нефротрансплантата, тромботической микроангиопатией, мочевым затеком, острым тубулонекрозом, другими хирургическими, сосудистыми, урологическими причинами дисфункции пересаженной почки. После исключения других видов почечной патологии проводят дифференциацию между острыми гуморальным и клеточным отторжениями.
При хроническом течении исключают возвратный гломерулонефрит, волчаночную нефропатию, пиелонефрит, полиомавирусное поражение почек, нефротоксичное действие ингибиторов кальциневрина. По назначению трансплантолога, врача-нефролога или уролога пациента консультирует анестезиолог-реаниматолог, гематолог, инфекционист, иммунолог, ревматолог.
Лечение отторжения почечного трансплантата
Врачебная тактика определяется клинико-морфологической формой трансплантационного криза. Диагноз сверхострого отторжения является основанием для проведения нефротрансплантатэктомии. При подозрении на ускоренную либо острую реакцию обеспечивается динамический мониторинг жизненных показателей, кислотно-щелочного состояния, водно-электролитного баланса, функциональной состоятельности почек. С учетом патогенеза патологического процесса назначают:
- При ускоренном отторжении. Требуется экстренная многокомпонентная антикризовая терапия. Для подавления иммунной реакции применяются кортикостероиды, антитимоцитарный глобулин, осуществляется плазмаферез. При отсутствии эффекта пораженный почечный трансплантат удаляется.
- При остром клеточном отторжении. Рекомендовано усиление или конверсия базовых иммуносупрессорных препаратов, пульс-терапия кортикостероидами, проведение 1-3 процедур плазмафереза или плазмообмена. При стероидной резистентности вводятся антитимоцитарные глобулины.
- При остром гуморальном отторжении. Назначается до 3-5 процедур плазмообмена или плазмафереза. После укороченной стероидной пульс-терапии и при гормональной резистентности показаны повторные курсы истощающих моноклональных и поликлональных антилимфоцитарных антител.
- При хроническом отторжении. Корректируется дозировка иммунодепрессивных средств, применяется пульс-терапия глюкокортикостероидами коротким курсом. Для снижения повышенного АД используются гипотензивные препараты. При нарастании ХПН возобновляется ЗПТ, возможна повторная трансплантация.
Исход зависит от своевременности и адекватности терапии. Прогноз всегда считается серьезным. С помощью высокодозной пульс-терапии ГКС удается купировать до 75-80% эпизодов отторжения. Эффективное применение противотимоцитарных антител возможно при 5 и более первых трансплантационных кризах. Проведение повторных курсов истощающих антител обеспечивает сохранение почечного трансплантата у 40-50% реципиентов с острым гуморальным отторжением.
Для профилактики необходимо тщательное обследование реципиента на гистосовместимость с донором, выполнение предоперационной десенсибилизации при выявлении AB0-несовместимости, соблюдение правил забора органа, выбор подходящего режима индукционной и поддерживающей иммуносупрессорной терапии с периодическим биопсийным контролем состояния почечного трансплантата.
1. Причины дисфункции почечного трансплантата по данным нефробиопсии/ Дмитриев М.М.// 70-я Международная научно-практическая конференция студентов и молодых ученых «Актуальные проблемы современной медицины и фармации – 2016».
2. Подходы к лечению позднего острого и активного хронического отторжения почечного трансплантата: Диссертация/ Артюхина Л.Ю. – 2016.
4. Диагностика острой реакции отторжения почечного трансплантата на фоне отсутствия начальной функции: Автореферат диссертации/ Арзуманов С.В. – 2005.
Отторжение трансплантата
Читайте также:
- Облучение населения радиацией и ее последствия
- Рентгенограмма, КТ, МРТ при лимфоме кости
- Патогенез актиномикозов. Патогенез поражений актиномицетами. Клиника актиномикоза. Клинические проявления актиномикоза. Признаки актиномикоза.
- Лучевая анатомия (КТ, МРТ анатомия) перикарда
- Рентгенограмма, КТ при зубной кисте
