Обзор метаболизма липидов
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Липиды - жиры, которые поступают в организм с пищей и могут синтезироваться в печени. Несмотря на то, что все липиды являются физиологически важными веществами, наибольший вклад в развитие заболеваний вносят триглицериды (ТГ) и холестерин.
Холестерин является непременным компонентом клеточных мембран, стероидных гормонов, желчных кислот и сигнальных молекул.
Триглицериды прежде всего обеспечивают энергией адипоциты и мышечные клетки.
Липопротеины являются гидрофильными сферическими частицами, которые удерживают поверхностные белки (апопротеины, или аполипопротеины), являющиеся кофакторами или лигандами ферментов метаболизма липидов (см. таблицу Основные апопротеины и ферменты, важные для липидного метаболизма Основные апопротеины и ферменты, важные для липидного метаболизма ). Все липиды являются гидрофобными и в основном нерастворимы в крови, поэтому они транспортируются в составе липопротеинов. Липопротеины классифицируют по их размерам и плотности (зависящей от соотношения липидов и протеинов); исследование их уровней является важным, поскольку высокие уровни липопротеинов низкой плотности (ЛПНП) и низкие уровни липопротеинов высокой плотности (ЛПВП) являются основными факторами риска атеросклеротического поражения сердца Атеросклероз Атеросклероз характеризуется образованием неоднородных бляшек (атером) в интиме средних и крупных артерий. Бляшки содержат липиды, воспалительные клетки, гладкомышечные клетки и соединительную. Прочитайте дополнительные сведения
Дислипидемией Дислипидемия Дислипидемией называют либо повышение уровней холестерина, триглицеридов (ТГ) или того и другого, либо низкий уровень холестерина липопротеинов высокой плотности в плазме, что способствует. Прочитайте дополнительные сведения называют либо повышение уровней холестерина и/или триглицеридов, либо снижение уровня холестерина ЛПВП в плазме, что способствует развитию атеросклероза Атеросклероз Атеросклероз характеризуется образованием неоднородных бляшек (атером) в интиме средних и крупных артерий. Бляшки содержат липиды, воспалительные клетки, гладкомышечные клетки и соединительную. Прочитайте дополнительные сведения
Физиология липидного обмена
Нарушение процессов синтеза, процессинга и клиренса липопротеинов может приводить к накоплению атерогенных липидов в плазме и эндотелии сосудов.
Метаболизм экзогенных (пищевых) липидов
Более 95% диетических липидов составляют:
Оставшиеся около 5% диетические липиды
Холестерин (присутствует в пищевых продуктах в виде эстерифицированного холестерина)
Витамины, растворимые в жирах
Свободные жирные кислоты (FFAs)
ТГ пищи под действием желудочной липазы расщепляются в желудке и двенадцатиперстной кишке на моноглицериды (МГ) и СЖК и эмульгируются под действием активной перистальтики желудка и панкреатической липазы. Те же механизмы обеспечивают высвобождение холестерина из его эфиров, содержащихся в пище.
Моноглицериды, СЖК и свободный холестерин затем солюбилизируются под действием мицелл желчных кислот, которые смещают их к микроворсинкам кишечника, где происходит их всасывание.
Попадая в энтероциты, МГ и СЖК объединяются в ТГ и вместе с холестерином упаковываются в хиломикроны – самые крупные липопротеины.
Хиломикроны переносят ТГ и холестерин из энтероцитов по лимфатическим сосудам в кровь. В капиллярах жировой и мышечной ткани апопротеин С-II (Апо С-II), находящийся на поверхности хиломикронов, активирует эндотелиальную липопротеинлипазу (ЛПЛ), превращающую 90% содержащихся в хиломикронах триглицеридов в жирные кислоты и глицерин, которые поглощаются адипоцитами и мышечными клетками и либо используются для получения энергии, либо запасаются.
Остатки хиломикронов, содержащие холестерин, затем поглощаются печенью, где гидролизуются в процессе, опосредованном апопротеином E (Апo E).
Метаболизм эндогенных липидов
Липопротеины синтезируются в печени из поступающих в нее эндогенных триглицеридов и холестерина. Они циркулируют в крови, пока содержащиеся в них ТГ не поглотятся периферическими тканями или они сами не поглотятся печенью. Факторы, стимулирующие печеночный синтез липопротеинов, обусловливают повышение уровней холестерина и ТГ в плазме.
Липопротеины очень низкой плотности (ЛПОНП), содержащие апопротеин В-100 (Апо В-100), синтезируются в печени и переносят ТГ и холестерин в периферические ткани. Продукция ЛПОНП – способ освобождения печени от избытка ТГ, образующихся в ней из свободных жирных кислот плазмы и остатков хиломикронов. С увеличением уровня СЖК в печени синтез ЛПОНП возрастает, как это происходит при потреблении жирной пищи или в тех случаях, когда жировая ткань высвобождает СЖК напрямую в кровь (например, при ожирении Ожирение Ожирение представляет собой избыток массы тела, который определяется при индексе массы тела (ИМТ) ≥ 30 кг/м 2 . Осложнения, связанные с ожирением, включают сердечно-сосудистые заболевания. Прочитайте дополнительные сведения и декомпенсированном сахарном диабете Сахарный диабет (СД) Сахарный диабет характеризуется нарушением секреции инсулина и той или иной степенью инсулинорезистентности, обусловливающими гипергликемию. Ранние симптомы связаны с гипергликемией и включают. Прочитайте дополнительные сведения ). Апо С-II, находящийся на поверхности ЛПОНП, активирует эндотелиальную ЛПЛ, расщепляющую ТГ на СЖК и глицерин, которые поглощаются клетками.
Липопротеины промежуточной плотности (ЛППП) образуются под действием ЛПЛ, расщепляющей ЛПОНП. ЛППП – это обогащенные холестерином ЛПОНП; в печени эти частицы либо разрушаются, либо под действием печеночной липазы превращаются в ЛПНП, содержащие Аполипопротеин В-100.
Липопротеины низкой плотности (ЛПНП), являющиеся продуктом метаболизма ЛПОНП и ЛППП, – самые богатые холестерином липопротеины. Примерно 40-60% всех ЛПНП поглощаются печенью через печеночные рецепторы ЛПНП с участием Апо В. Остальные ЛПНП поглощаются либо печенью или внепеченочными клетками через скавенджер-рецепторы. И наоборот, при снижении жира и холестерина в диете число этих рецепторов увеличивается («повышающая регуляция»). При поступлении в печень холестерина хиломикронов и повышенном содержании насыщенных жиров в диете число и связывающая способность печеночных рецепторов ЛПНП уменьшаются («снижающая регуляция»). Через внепеченочные скавенджер-рецепторы (в основном на макрофагах) происходит поглощение из крови ЛПНП, не поглощенных через рецепторы ЛПНП печени. Моноциты мигрируют в субэндотелиальное пространство и превращаются в макрофаги. Последние поглощают больше окисленных ЛПНП, превращаясь в пенистые клетки внутри атеросклеротических бляшек Патофизиология Атеросклероз характеризуется образованием неоднородных бляшек (атером) в интиме средних и крупных артерий. Бляшки содержат липиды, воспалительные клетки, гладкомышечные клетки и соединительную. Прочитайте дополнительные сведенияРазмеры частиц ЛПНП варьируют от крупных и рыхлых до мелких и плотных. Мелкие, плотные частицы ЛПНП особенно богаты эфирами холестерина и играют роль в патогенезе таких состояний, как гипертриглицеридемия и инсулино резистентность.
Липопротеины высокой плотности (ЛПВП) синтезируются в эритроцитах и печени и вначале не содержат холестерина. Метаболизм ЛПВП достаточно сложен, но основной их функцией является извлечение холестерина из периферических тканей и других липопротеинов и его транспорт туда, где он более всего необходим: в другие клетки, другие липопротеины [с помощью белка-транспортера эфиров холестерина (СЕТР)] и печень (для клиренса). В целом ЛПВП обладают антиатерогенным эффектом.
Выход свободного холестерина из клеток происходит с участием АТФ-связывающего кассетного транспортера А1 (АСКТА1), который, соединяясь с апопротеином А-I (Апо А-I), приводит к образованию незрелых ЛПВП. Затем свободный холестерин таких ЛПВП под действием фермента лецитин-холестерин ацилтрансферазы (ЛХАТ) эстерифицируется и образуются зрелые ЛПВП. Уровни ЛПВП в плазме могут не полностью отражать обратный транспорт холестерина, а защитные эффекты более высоких уровней ЛПВП также могут быть обусловлены антиоксидантными и противовоспалительными свойствами.
Липопротеины (а) [ЛП(а)] – это ЛПНП-подобные частицы, которые содержат апопротеин (а); особенностью Апо(а) является присутствие в нем пяти богатых цистеином доменов, называемых кринглами. Один из этих доменов гомологичен плазминогену и, как полагают, конкурентно ингибирует фибринолиз, способствуя тем самым образованию тромбов. ЛП(а) могут и прямо ускорять атеросклероз Атеросклероз Атеросклероз характеризуется образованием неоднородных бляшек (атером) в интиме средних и крупных артерий. Бляшки содержат липиды, воспалительные клетки, гладкомышечные клетки и соединительную. Прочитайте дополнительные сведения , особенно у пациентов на диализе, их уровень повышается.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Нарушения метаболизма. Биохимия специализированных тканей. (Для клин.ордов КЛД)
Метаболизм липидов в норме и при патологии. Дисфункция жировой ткани. Ожирение
В 1680 году Juan Carreno de Miranda была изображена девочка-"монстр", страдающая синдромом Prader–Willi (1954)
1. Метаболизм липидов
Термин «липиды» объединяет вещества, обладающие общим физическим свойством — гидрофобностью, то есть нерастворимостью в воде. Однако такое определение в настоящее время является не совсем корректным ввиду, того, что некоторые группы (триацилглицерины, фосфолипиды, сфинголипиды и др.) проявляют себя как амфифильные или дифильные соединения, т.е. способные растворяться как в полярных веществах (гидрофильность), так и в неполярных (гидрофобность). По структуре липиды настолько разнообразны, что у них отсутствует общий признак химического строения. Липиды разделяют на классы, в которые объединяют молекулы, имеющие сходное химическое строение и общие биологические свойства.
Основную массу липидов в организме составляют жиры — триацилглицеролы, служащие формой депонирования энергии. Жиры располагаются преимущественно в подкожной жировой ткани и выполняют также функции теплоизоляционной и механической защиты. Триацилглицеролы практически не растворимы в воде, поэтому их депонирование не сопровождается появлением осмотических проблем.
Фосфолипиды — большой класс липидов, получивший своё название из-за остатка фосфорной кислоты, придающего им свойства амфифильности. Благодаря этому свойству фосфолипиды формируют бислойную структуру мембран, в которую погружены белки. Клетки или отделы клеток, окружённые мембранами, отличаются по составу и набору молекул от окружающей среды, поэтому химические процессы в клетке разделены и ориентированы в пространстве, что необходимо для регуляции метаболизма.
Стероиды, представленные в животном мире холестеролом и его производными, выполняют разнообразные функции. Холестерол — важный компонент мембран и регулятор свойств гидрофобного слоя. Производные холестерола (жёлчные кислоты) необходимы для переваривания жиров. Стероидные гормоны, синтезируемые из холестерола, участвуют в регуляции энергетического, водно-солевого обменов, половых функций. Кроме стероидных гормонов, многие производные липидов выполняют регуляторные функции и действуют, как и гормоны, в очень низких концентрациях. Например, тромбоцитактивирующий фактор — фосфолипид особой структуры — оказывает сильное влияние на агрегацию тромбоцитов в концентрации 10 -12 М; эйкозаноиды, производные полиеновых жирных кислот, вырабатываемые почти всеми типами клеток, вызывают разнообразные биологические эффекты в концентрациях не более 10 -9 М. Из приведённых примеров следует, что липиды обладают широким спектром биологических функций.
В тканях человека количество разных классов липидов существенно различается. В жировой ткани жиры составляют до 75 % сухого веса. В нервной ткани липидов содержится до 50 % сухого веса, основные из них фосфолипиды и сфингомиелины (30 %), холестерол (10 %), ганглиозиды и цереброзиды (7 %). В печени общее количество липидов в норме не превышает 10-13 %.
Нарушения обмена липидов приводят к развитию многих заболеваний, но среди людей наиболее распространены два из них — ожирение и атеросклероз.
Липидный обмен включает в себя следующие процессы:
- Расщепление, переваривание и всасывание липидов в пищеварительном тракте, поступающих вместе с пищей.
- Транспорт жиров из кишечника с помощью хиломикронов.
- Обмен триацилглицеролов.
- Обмен фосфолипидов.
- Обмен холестерола.
- Взаимопревращения жирных кислот и кетоновых тел.
- Липогенез.
- Катаболизм липидов — липолиз.
- Катаболизм жирных кислот.
Печень является главным местом синтеза жирных кислот, жиров, кетоновых тел и холестерина. Жиры могут также синтезироваться в жировой ткани, однако её основной функцией остаётся депонирование липидов.
Обзор метаболизма липидов (Overview of Lipid Metabolism)
Из липидов — в дирижеры клеточных реакций, или Как общаются клетки
Обзор
Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h)
Авторы
Редакторы
Статья на конкурс «Био/Мол/Текст»: Задумывались ли вы когда-нибудь о том, что клетки общаются между собой? Ведь клеточный мир настолько многообразен и велик, что в нем без языка не обойтись! Всем известные гормоны — только один из диалектов такого «языка»! В этой статье мы расскажем о том, как липиды помогают клеткам «общаться». Почему такой, казалось бы, простой химический процесс, как окисление липидов, может приводить к гибели клетки? Как клетки понимают, когда пора заканчивать фазу воспаления и переходить к восстановлению? Что такое ферроптоз. Вы все еще читаете аннотацию? Давайте скорее окунемся в удивительный мир редокс-липидомики и взглянем на липиды по-новому!
Конкурс «Био/Мол/Текст»-2020/2021
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2020/2021.
Генеральный партнер конкурса — ежегодная биотехнологическая конференция BiotechClub, организованная международной инновационной биотехнологической компанией BIOCAD.

Спонсор конкурса — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Давно известно, что без липидов человеческий организм не может существовать. Эта обширная группа природных органических соединений, включающая жиры и жироподобные вещества, необходима для построения клеточных мембран и регуляции обмена веществ. Изучением липидов занимается липидомика, а появление раздела «редокс-липидомика» (окислительно-восстановительная липидомика, часть липидомики, занимающаяся характеристикой окисленных липидов) позволило по-новому взглянуть на роль продуктов окисления липидов и оценить их влияние на ключевые процессы, происходящие в клетках.
О липидах в составе клеточных мембран читайте в статье «Липидный фундамент жизни» [1]. — Ред.
В дополнение к природному липидому (совокупности всех липидов организма), существуют виды липидов, полученные в результате ферментативных и неферментативных модификаций (эпилипидом), что делает общую картину еще более сложной, поскольку их функции все еще в значительной степени неизвестны. Окисленные липиды представляют собой фракцию эпилипидома, которая привлекла большое внимание ученых из-за их роли в возникновении и развитии многих заболеваний человека. Однако основной проблемой редокс-липидомики остается отсутствие оптимальных вычислительных инструментов для надежной, точной и специфической идентификации уже открытых и еще неизвестных модифицированных липидов. В настоящее время жидкостная хроматография и масс-спектрометрия являются основными методами, позволяющими определить количество липидов в клетке, оценить их участие в ряде физиологических механизмов и даже изучить структуру продуктов окисления этих веществ [2].
Знакомство с липидами
Молекулы липидов чрезвычайно разнообразны, их насчитывают более миллиона вариантов [3]! Впечатляющее количество, по сравнению с 70 000 выявленных белков и 30 000 генов! Для удобства химики разделили все липиды на две большие группы:
- омыляемые, которые легко гидролизуются в воде под действием щелочей;
- неомыляемые, которые не гидролизуются в щелочной среде.
К первой группе относятся простые липиды, состоящие исключительно из спирта и жирных кислот (воски, триацилглицеролы, эфиры холестерола), и сложные липиды, в состав которых входят и другие компоненты (фосфолипиды, гликолипиды, сфинголипиды). К неомыляемым липидам относится большая группа стероидов, включающая холестерин и его производные: стероидные гормоны, витамины, желчные кислоты.
Большая роль маленьких молекул
Липиды, содержащие полиненасыщенные жирные кислоты (ПНЖК — кислоты, содержащие две и более двойных связей), являются важными сигнальными молекулами, регулирующими многие метаболические процессы и клеточные реакции, включая воспаление. Для выполнения этих функций они подвергаются реакциям окисления, то есть присоединяют кислородсодержащие группы.
Окисление липидов происходит с помощью двух основных механизмов. Первый способ — неферментативное перекисное окисление. При этом липиды взаимодействуют с активными формами кислорода (АФК), в результате чего происходит накопление гидроперекисей липидов (LOOH) (рис. 1). В норме процессы перекисного окисления необходимы для поддержания структуры клеточных мембран, функционирования ионных каналов, рецепторов и ферментных систем. Их роль велика и в синтезе липидных медиаторов — биорегуляторов (простагландинов, тромбоксанов, лейкотриенов и др.). Однако неконтролируемое свободнорадикальное окисление липидов может приводить к изменению проницаемости мембраны, нарушению ее целостности, а это прямая угроза гибели клетки [3]!
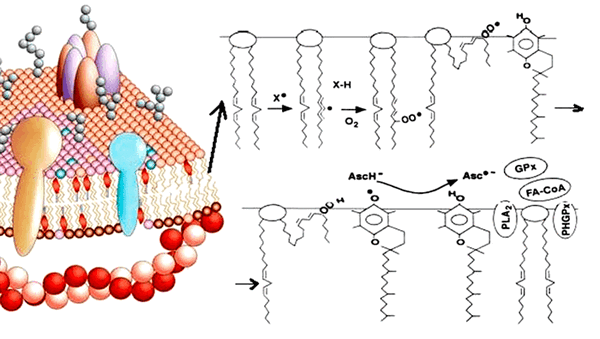
Рисунок 1. Зарождение цепной реакции перекисного окисления липидов. Фосфолипиды клеточных мембран, взаимодействуя со свободными радикалами, превращаются в гидроперекиси липидов, что может влиять на функции мембраны клетки.
Второй путь окисления — ферментативные изменения, отличающиеся высокой селективностью и специфичностью. Ферментативное окисление происходит под действием металлопротеинов: липоксигеназы, циклооксигеназы, цитохрома Р450, пероксидазы. Продукты реакций окисления ПНЖК, выступая в качестве сигнальных молекул, координируют метаболизм и другие физиологические процессы, иными словами, управляют судьбой клетки [4]! Такие вещества носят название эйкозаноидов. Они принимают участие во многих важнейших процессах: росте мышечной ткани, реакциях иммунитета на токсины и патогены, выступают в роли нейромедиаторов и даже гормонов!
К сожалению, человеческий организм не научился синтезировать все необходимые ПНЖК. Возникает вопрос: можно ли их получить извне? Разумеется! Пищевыми источниками полиненасыщенных жирных кислот являются растительные масла, рыбий жир и препараты омега-3-жирных кислот. Таким образом, казалось бы невкусный рыбий жир — просто лакомство для наших клеток!
Из липидов — в дирижеры клеточных реакций
Исследования редокс-липидомики, проведенные при помощи масс-спектрометрии в сочетании с обращенно-фазовой хроматографией, выявили удивительный факт: липиды контролируют активность иммунной системы [4]! При попадании в организм чужеродных агентов, желающих нанести вред и повредить ткани, развивается воспаление, цель которого — устранить патоген. Иммунные клетки, встав на защиту организма, в зоне повреждения вырабатывают «провоспалительные» производные ПНЖК (лейкотриены, липоксины, гипоксины и т.д.), которые усиливают воспаление и таким образом избавляют организм от патогена (рис. 2).
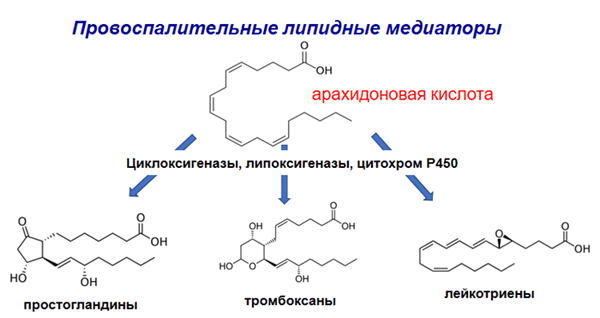
Рисунок 2. Провоспалительные производные арахидоновой кислоты: простагландины, тромбоксаны и лейкотриены
рисунок авторов статьи
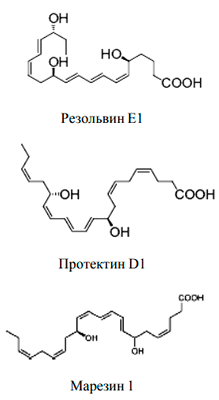
Рисунок 3. Противовоспалительные медиаторы: резолвины, протектины, марезины
Но воспаление — патологический процесс, и при удалении повреждающего фактора важно вовремя остановиться и прекратить воспалительный ответ. Здесь на помощь приходят противовоспалительные липидные медиаторы — резолвины, протектины, марезины (рис.3). Они останавливают образование «провоспалительных» медиаторов и обеспечивают защиту клеток от повреждающих факторов.
Кроме того, собственные поврежденные клетки, не способные восстановиться, для перехода воспаления в завершающую фазу и сохранения постоянства внутренней среды должны подвергнуться уничтожению, чему также способствуют липидные медиаторы. Как это возможно? Оказалось, что липидные молекулы фосфатидилсерина (фосфолипида клеточной мембраны) выставляются на мембрану поврежденных клеток и «помечают» их. Фосфатидилсерин на поверхности клеток является сигналом для их поглощения макрофагами и клетками микроглии [5]. В исследованиях также была продемонстрирована значимость этого медиатора: наличие даже одной молекулы фосфатидилсерина уже достаточно для активации фагоцитоза!
Две стороны одной медали
Оказалось, что роль липидов велика не только в уничтожении старых или поврежденных клеток, но и их компонентов, или органелл. Например, для удаления митохондрий, безвозвратно утративших свои функции, на поверхности ее внешней мембраны появляется кардиолипин — фосфолипид, который в норме присутствует только на внутренней мембране органелл. Именно он и служит сигналом митофагии, или уничтожения митохондрий [5]. Удаление исключительно ненужных организму структур без повреждения нормальных клеток требует точной передачи сигналов и имеет решающее значение для поддержания постоянства внутренней среды.
Однако данный процесс может стать опасным для организма. Чрезмерная митофагия описана при многих острых и хронических заболеваниях центральной нервной системы. Так, при болезни Паркинсона она может привести к гибели нейронов [6]. Контроль качества митохондрий с целью избежания излишнего уничтожения имеет центральное значение для функционирования и благополучия нейронов. Это открывает новые возможности для исследований в области лечения нейродегенеративных заболеваний!
Как липиды «помогают» клетке погибнуть?
Что же делать со старыми клетками, честно отслужившими свой срок? Безусловно, оставлять их на своем месте нельзя, иначе новым здоровым клеткам будет некуда деться. Остается один вариант — аккуратно разобрать и удалить из организма те из них, которые не способны более функционировать. Данный процесс носит названия апоптоза. Валериан Каган и его соавторы доказали, что для осуществления этого процесса необходимо окислить ПНЖК кардиолипина [7]. При необратимых изменениях в клетке знакомый нам кардиолипин образует комплекс с белком дыхательной цепи — цитохромом c — и превращает его в фермент пероксидазу. Пероксидаза тотчас окисляет ПНЖК кардиолипина, и он перемещается на внешнюю мембрану митохондрий, увеличивая ее проницаемость (рис.4). Это приводит к высвобождению других проапоптотических факторов клетки, действие которых приводит к клеточной гибели.
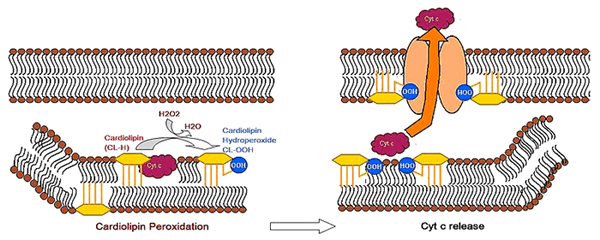
Рисунок 4. Окисление кардиолипина как фактор апоптоза. На рисунке представлена клеточная мембрана, состоящая из бислоя липидов, один из которых — кардиолипин (показан желтым цветом). При взаимодействии с белком цитохромом c (cyt c) кардиолипин превращает его в пероксидазу, которая, в свою очередь, окисляет ПНЖК кардиолипина (на рисунке — cardiolipin hydroperoxide, CL-OOH). Гидроперекись кардиолипина выходит на внешнюю мембрану митохондрии, изменяя ее проницаемость, что приводит к апоптозу.
Новый взгляд на клеточную смерть
Одним из важнейших достижений редокс-липидомики является открытие уникального варианта неапоптотической программируемой гибели клетки — ферроптоза [8]. По сравнению с другими формами этот путь клеточной гибели неповторим. В чем же его особенность? Оказалось, что, в отличие от апоптоза, при котором происходит аккуратная разборка клетки, ферроптоз приводит к клеточному коллапсу, в котором железо и АФК принимают активное участие. Давайте разберемся, как это происходит!
Ферроптоз назван так неспроста. Железо (Fe от лат. ferrum) — основной элемент, необходимый для осуществления ключевого звена данного пути гибели клетки: перекисного окисления липидов (рис. 5) [9], [10]. Перекисное окисление может происходить под действием свободного двухвалентного железа (через реакцию Фентона), а также посредством фермента липоксигеназы, содержащей железо.
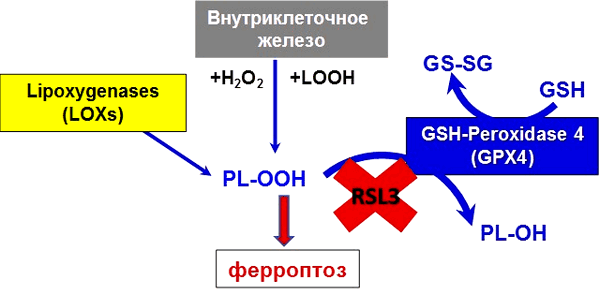
Рисунок 5. Ионы железа в организме находятся под строгим метаболическим контролем. Нарушение баланса ионов железа в клетке и возникновение окислительного стресса приводит к цепной реакции окисления липидов и формированию избытка гидроперекисей. Накопление гидроперекисей липидов приводит к развитию ферроптоза. Гидроперекиси фосфолипидов (PL-OOH) образуются внутри клетки с участием различных форм низкомолекулярного внутриклеточного железа и железосодержащих ферментов. Активная GPX4 восстанавливает гидроперекиси липидов до спиртов. В случае ингибирования фермента, например, специфическим ингибитором RSL3, PL-OOH накапливаются в клетках, усиливая развитие окислительного стресса.
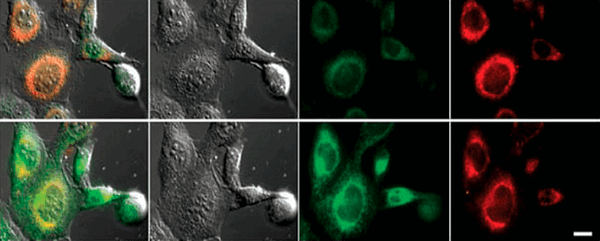
Конкретные механизмы редокс-модификации липидов, задействованные в выполнении программы ферроптоза, на сегодняшний день остаются тайной. Но, окрасив клетку различными флуоресцентными красителями, можно увидеть, насколько удивительные очертания они приобретают при ферроптозе (рис. 6) [11]!
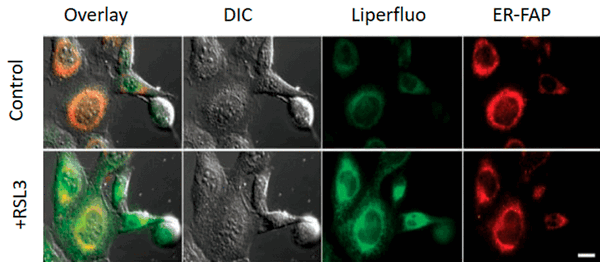
Рисунок 6. Снимок конфокальной микроскопии эмбриональных фибробластов мыши, обработанных индуктором ферроптоза RSL3 (100 nM, 6h). Control — необработанные клетки. Liperfluo — флуоресцентный зонд, который после взаимодействия с гидроперекисями липидов способен флуоресцировать, если он встроен в плазматическую мембрану клеток. ER-FAP (ER-targeted fluorogen-activating protein) — флуоресцентный белок, чья флуоресценция активируется при связывании метки с эндоплазматическим ретикулумом.
В клетках организма существуют механизмы, препятствующие неконтролируемому перекисному окислению. Одним из ключевых ферментов здесь является глутатионпероксидаза 4 (GPX4), которая восстанавливает гидроперекиси липидов до спиртов за счет окисления глутатиона (GSH). Далее окисленная молекула глутатиона (GS-SG) восстанавливается с помощью фермента глутатион-редуктазы. В случае инактивации клеточного глутатиона и GSH-зависимой антиоксидантной защиты происходит накопление токсичных липидных АФК и запуск ферроптоза [12].
Две крайности одной и той же сущности. Как ферроптоз реализуется в целом организме и можно ли обернуть его в свою пользу?
Проведенные исследования показывают, что ферроптоз осуществляется во многих типах тканей человека. Так, при отравлении парацетамолом в организме накапливается N-ацетил-p-бензохинонимин, при этом наблюдается истощение глутатиона, в результате чего происходит массивная гибель клетки по механизму ферроптоза [13].
Имеющиеся данные указывают на то, что ферроптоз может выступать одним из ключевых механизмов развития некоторых нейродегенеративных заболеваний, а также является одной из возможных причин гибели клеток в условиях глутаматной эксайтотоксичности [14].
Ионы железа могут играть ключевую роль в гибели эпителиальных клеток почечных канальцев в условиях острой почечной недостаточности [13]. Данный механизм обусловлен нарушением гломерулярной фильтрации и накоплением ионов железа как внутриклеточно, так и в полости канальца, что приводит к реализации клеточной смерти.
Ферроптоз, как механизм регулируемой клеточной смерти, имеет и терапевтическую ценность. Существует ряд потенциальных молекул, ингибирующих Xc – — транспортную систему (эрастин, RSL3), которые, воздействуя на культуру опухолевых клеток, вызывают их гибель по механизму ферроптоза [12], [13]. Как доказать, что это происходит благодаря ферроптозу, а не случайному совпадению? При добавлении к клеткам веществ, связывающих железо, оно становится «неподвижным» и не может участвовать в химических процессах. В этом случае процессы ферроптоза значительно замедляются. Однако не все так просто и радужно! Эти молекулы не обладают высокой специфичностью, и при более высоких дозах клеточная гибель может происходить по механизму апоптоза!
Вывод
Благодаря редокс-липидомике стало известно, что кислородсодержащие липиды играют огромную роль в сохранении постоянства внутренней среды, запуская апоптоз, ферроптоз и контролируя воспаление. Однако стоит принять во внимание, что, несмотря на очевидное значение в регуляции множества биологических функций, содержание окисленных липидов в организме крайне мало (0,03–3,0 моль% от всего липидома организма) [4]. Кроме того, трудности анализа окисленных липидов заключаются в их химической нестабильности, термолабильности и неоднородности окисленных продуктов. Не зря их сравнивают с иголкой в стоге сена!
Хороший, плохой, злой холестерин

Нарушение жирового обмена является основным фактором развития атеросклероза и связанных с ним осложнений (ишемическая болезнь сердца, инфаркт, инсульт, облитерация сосудов нижних конечностей и пр.). При этом наиболее важным фактором повышенного риска атеросклероза является повышение содержания в крови атерогенных липопротеинов.
Автор
Статья на конкурс «био/мол/текст»: Вряд ли сейчас найдется человек, который не слышал, что высокий холестерин — это плохо. Однако столь же мала вероятность встретить человека, который знает, ПОЧЕМУ высокий холестерин — это плохо. И чем определяется высокий холестерин. И что такое высокий холестерин. И что такое холестерин вообще, зачем он нужен и откуда берется.
Конкурс «био/мол/текст»-2012
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2012 в номинации «Лучший обзор».
Спонсор конкурса — дальновидная компания Thermo Fisher Scientific.
Итак, история вопроса такова. Давным-давно, в одна тысяча девятьсот тринадцатом году, петербуржский физиолог Аничков Николай Александрович показал: не что иное, как холестерин, вызывает атеросклероз у экспериментальных кроликов, содержащихся на пище животного происхождения [1]. Вообще же, холестерин необходим для нормального функционирования животных клеток и является основной составляющей клеточных мембран , а также служит субстратом для синтеза стероидных гормонов и желчных кислот.
Довольно подробно о роли холестерина в работе биомембран рассказывается в статье «Липидный фундамент жизни» [12]. — Ред.
Главный липидный компонент пищевого жира и жировых отложений — это триглицериды, которые представляют собой эфиры глицерина и жирных кислот. Холестерин и триглицериды, будучи неполярными липидными веществами, транспортируются в плазме крови в составе липопротеиновых частиц. Частицы эти подразделяют по размеру, плотности, относительному содержанию холестерина, триглицеридов и белков на пять больших классов: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП) [2]. Традиционно ЛПНП считается «плохим» холестерином, а ЛПВП — «хорошим» (рис. 1).
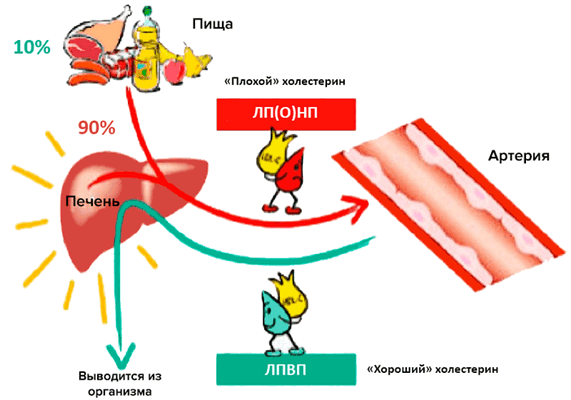
Рисунок 1. «Плохой» и «хороший» холестерины. Участие различных липопротеиновых частиц в транспорте липидов и холестерина.
Схематично структура липопротеина включает неполярное ядро, состоящее по большей части из холестерина и триглицеридов, и оболочку из фосфолипидов и апопротеинов (рис. 2). Ядро — функциональный груз, который доставляется до места назначения. Оболочка же участвует в распознавании клеточными рецепторами липопротеиновых частиц, а также в обмене липидными частями между различными липопротеинами [3].
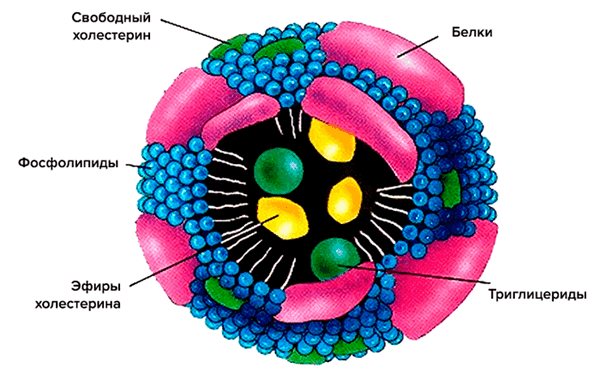
Рисунок 2. Схематическое строение липопротеиновой частицы
Баланс уровня холестерина в организме достигается следующими процессами: внутриклеточный синтез, захват из плазмы (главным образом из ЛПНП), выход из клетки в плазму (главным образом в составе ЛПВП). Предшественник синтеза стероидов — ацетил коэнзим А (CoA). Процесс синтеза включает, по крайней мере, 21 шаг, начиная с последовательного преобразования ацетоацетил CoA. Лимитирующая стадия синтеза холестерина в большой степени определяется количеством холестерина, абсорбируемого в кишечнике и транспортируемого в печень [4]. При недостатке холестерина происходит компенсаторное усиление его захвата и синтеза.
Транспорт холестерина
Систему транспорта липидов можно разделить на две большие части: внешнюю и внутреннюю.
Внешний путь начинается с всасывания в кишечнике холестерина и триглицеридов. Его конечный результат — доставка триглицеридов в жировую ткань и мышцы, а холестерина — в печень. В кишечнике пищевой холестерин и триглицериды связываются с апопротеинами и фосфолипидами, формируя хиломикроны, которые через лимфоток попадают в плазму, мышечную и жировую ткани. Здесь хиломикроны взаимодействуют с липопротеинлипазой — ферментом, который освобождает жирные кислоты. Эти жирные кислоты поступают в жировую и мышечную ткани для накопления и окисления соответственно. После изъятия триглицеридного ядра остаточные хиломикроны содержат большое количество холестерина и апопротеина Е. Апопротеин Е специфически связывается со своим рецептором в клетках печени, после чего остаточный хиломикрон захватывается и катаболизируется в лизосомах. В результате этого процесса освобождается холестерин, который затем преобразуется в желчные кислоты и выводится или участвует в формировании новых липопротеинов, образующихся в печени (ЛПОНП). При нормальных условиях хиломикроны находятся в плазме в течение 1–5 ч. после приема пищи [2], [3].
Внутренний путь. Печень постоянно синтезирует триглицериды, утилизируя свободные жирные кислоты и углеводы. В составе липидного ядра ЛПОНП они выходят в кровь. Внутриклеточный процесс формирования этих частиц схож с таковым для хиломикронов, за исключением различия в апопротеинах. Последующее взаимодействие ЛПОНП с липопротеинлипазой в тканевых капиллярах приводит к формированию остаточных ЛПОНП, богатых холестерином (ЛППП). Примерно половина этих частиц выводится из кровотока клетками печени в течение 2–6 ч. Остальные претерпевают модификацию с замещением оставшихся триглицеридов эфирами холестерина и освобождением от всех апопротеинов, за исключением апопротеина В. В результате формируются ЛПНП, которые содержат ¾ всего плазменного холестерина. Их главная функция — доставка холестерина в клетки надпочечников, скелетных мышц, лимфоцитов, гонад и почек [3]. Модифицированные ЛПНП (окисленные продукты, количество которых возрастает при повышенном содержании в организме активных форм кислорода, так называемом окислительном стрессе) могут распознаваться иммунной системой как нежелательные элементы. Тогда макрофаги их захватывают и выводят из организма в виде ЛПВП. При чрезмерно высоком уровне ЛПНП макрофаги становятся перегруженными липидными частицами и оседают в стенках артерий, образуя атеросклеротические бляшки.
Основные транспортные функции липопротеинов приведены в таблице.
| Класс | Размеры | Функция |
|---|---|---|
| ЛПВП | 4–14 нм | Транспорт холестерина от периферийных тканей к печени |
| ЛПНП | 20–22,5 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛППП | 25–35 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| ЛПОНП | 30–80 нм | Транспорт холестерина, триглицеридов и фосфолипидов от печени к периферийным тканям |
| Хиломикроны | 75–1200 нм | Транспорт холестерина и жирных кислот, поступающих с пищей, из кишечника в периферические ткани и печень |
Регуляция уровня холестерина
Уровень холестерина в крови в большой степени определяется диетой. Пищевые волокна снижают уровень холестерина, а пища животного происхождения повышает его содержание в крови.
Один из основных регуляторов метаболизма холестерина — рецептор LXR (рис. 3). LXR α и β принадлежат к семейству ядерных рецепторов, которые образуют гетеродимеры с ретиноидным Х рецептором и активируют гены-мишени. Их естественные лиганды — оксистерины (окисленные производные холестерина). Обе изоформы идентичны на 80% по аминокислотной последовательности. LXR-α обнаружен в печени, кишечнике, почках, селезенке, жировой ткани; LXR-β в небольшом количестве обнаруживается повсеместно [6]. Метаболический путь оксистеринов быстрее, чем у холестерина, и поэтому их концентрация лучше отражает краткосрочный баланс холестерина в организме. Существует всего три источника оксистеринов: ферментативные реакции, неферментативное окисление холестерина и поступление с пищей. Неферментативные источники оксистеринов как правило минорные, но в патологических состояниях их вклад возрастает (окислительный стресс, атеросклероз), и оксистерины могут действовать наряду с другими продуктами перекисного окисления липидов [6]. Основное влияние LXR на метаболизм холестерина: обратный захват и транспорт в печень, вывод с желчью, снижение кишечного всасывания. Уровень продукции LXR различается на протяжении аорты; в дуге, зоне турбулентности, LXR в 5 раз меньше, чем в участках со стабильным течением. В здоровых артериях повышение экспрессии LXR в зоне сильного потока оказывает антиатерогенное действие [7].
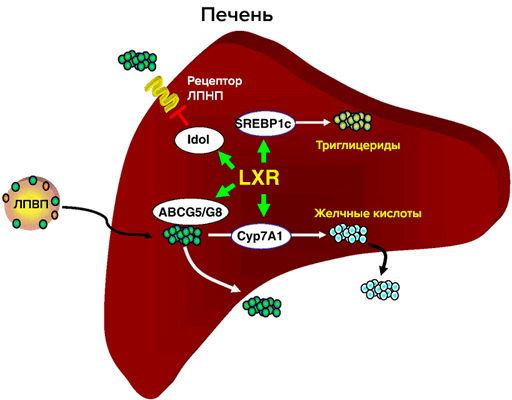
Рисунок 3. Участие рецептора LXR в метаболизме холестерина в печени
Важную роль в метаболизме холестерина и стероидов играет рецептор-«мусорщик» SR-BI (рис. 4). Он был обнаружен в 1996 году как рецептор для ЛПВП [8]. В печени SR-BI отвечает за избирательный захват холестерина из ЛПВП. В надпочечниках SR-BI опосредует избирательный захват этерифицированного холестерина из ЛПВП, который необходим для синтеза глюкокортикоидов. В макрофагах SR-BI связывает холестерин, что является первым этапом в обратном транспорте холестерина. SR-BI также захватывает холестерин из плазмы и опосредует его прямой выход в кишечник [9].
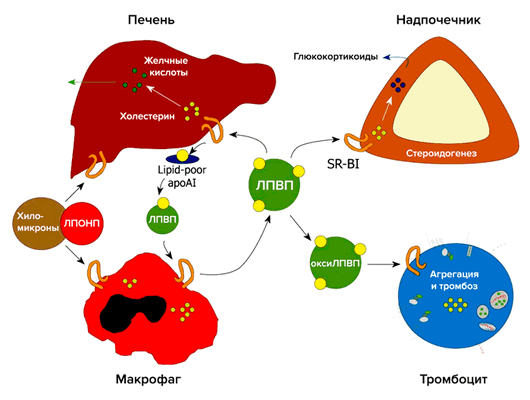
Рисунок 4. Участие рецептора SR-BI в метаболизме холестерина
Выведение холестерина из организма
Классический путь выведения холестерина: транспорт холестерина с периферии в печень (ЛПВП), захват клетками печени (SR-BI), экскреция в желчь и выведение через кишечник, где большая часть холестерина возвращается в кровь [10].
Основная функция ЛПВП — обратный транспорт холестерина в печень. Плазменные ЛПВП являются результатом комплекса различных метаболических событий. Состав ЛПВП очень различается по плотности, физико-химическим свойствам и биологической активности. Это сферические или дисковидные образования. Дисковидные ЛПВП в основном состоят из апопротеина A-I с вложенным слоем фосфолипидов и свободного холестерина. Сферические ЛПВП больше и дополнительно содержат гидрофобное ядро из эфиров холестерина и небольшого количества триглицеридов.
При метаболическом синдроме активируется обмен триглицеридов и эфиров холестерина между ЛПВП и триглицерид-богатыми липопротеинами. В результате содержание триглицеридов в ЛПВП повышается, а холестерина снижается (т.е. холестерин не выводится из организма) [11]. Отсутствие ЛПВП у людей встречается при болезни Tangier, главные клинические проявления которой — увеличенные оранжевые миндалины, роговичная дуга, инфильтрация костного мозга и мукозного слоя кишечника [3].
Если коротко обобщить, то страшен не сам холестерин, который является необходимым компонентом, обеспечивающим нормальную структуру клеточных мембран и транспорт липидов в крови, а кроме того он является сырьем для производства стероидных гормонов. Метаболические расстройства же проявляются при нарушении баланса ЛПНП и ЛПВП , что отражает нарушение системы транспорта липопротеинов, включающей работу печени, образование желчи и участие макрофагов. Поэтому любые заболевания печени, а также аутоиммунные процессы могут вызвать развитие атеросклероза даже при вегетарианской диете. Если мы вернемся к изначальным опытам Н.А. Аничкова по кормлению кроликов пищей, богатой холестерином, то увидим, что холестерин не встречается в естественном рационе кроликов и поэтому, как яд, нарушает работу печени, вызывает сильное воспаление сосудов и, как следствие, образование бляшек.
Восстановление этого баланса искусственным путем (например, на молекулярном уровне с использованием наночастиц) когда-нибудь станет основным способом лечения атеросклероза (см. «Наночастицами — по „плохому“ холестерину!» [13]). — Ред.
Читайте также:
- Плюсы и минусы катетерных стом (цекостома, гастростома, еюностома)
- Потовые железы. Строение и функции потовых желез.
- Влияние температуры на теплообмен. Влияние ветра на теплообмен
- Отягощенный акушерский анамнез и хромосомные перестройки у родителей.
- Результаты алкоголизации межреберных нервов. Результаты межреберной блокады

