Онкогенные РНК-геномные вирусы. Онкогенные ретровирусы. Свойства онкогенных рнк-вирусов.
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Их онкогенный потенциал обусловлен наличием обратной транскриптазы (РНК-зависимая ДНК-полимераза).
Выделяют 3(4) группы – А,В,С,Д. К типу А относят ефектные вирусные частицы или незрелые формы других онковирусов.
Вирионы разнообразной формы, размер 90-130 нм, сложноорганизованные.
Онковирусы типа С вызывают лейкозы и саркомы у животных. Н-р: вирус Рауса вызывают саркомы у птиц, млекопитающих.
Онковирусы типа В – рак молочных желез мышей, лейкоз морских свинок.
Онковирусы типа Д - рак молочных желез обезьян, рак гортани человека.
Высокоактивные вирусы индуцируют новообразования с коротким инкубационным периодом.
Вирусы с умеренной активностью вызывают неоплазмы после длительного инкубационного периода.
По характеру распространения выделяют:
1. Экзогенные ретровирусы – распространяются горизонтально. К ним относят: вирус саркомы Рауса, Т - лимфотропные вирусы человека I и II типа.
2. Эндогенные ретровирусы – распространяются вертикально.
Практические задания для студентов
– Разбор демонстрационной РТГА, применяемой для диагностики клещевого энцефалита.
1. Парные сыворотки больного:
а) в острый период заболевания (№ 1);
б) Через 3 – 4 недели (№ 2);
2. Диагностикум (антиген) клещевого энцефалита;
3. Гусиные эритроциты;
| Исследуемые сыворотки | Разведения сыворотки | ||||||
| 1:10 | 1:20 | 1:40 | 1:80 | 1:160 | КЭ | КС | КА |
| № 1 | |||||||
| № 2 |
ЛИТЕРАТУРА.
5.1. Основная:
1. Борисов Л.Б., Козмин-Соколов Б.Н., Фрейндлин И.С., Федорова З.Ф. Руководство к лабораторным занятиям по микробиологии / Под ред. Л.Б. Борисова, -2-е изд. перераб. и доп.-М.: Медицина.- 1984.-256с.
2. Борисов Л.Б., Козмин-Соколов Б.Н., Фрейндлин И.С. Руководство к лабораторным занятиям по медицинской микробиологии, вирусологии и иммунологии. Учебное пособие.-М.: Медицина.-1993.-240с.
3. Борисов Л.Б., с соавт. Медицинская микробиология, вирусология, иммунология: Учебник М.: Медицина.- 1994.- 528 с.
4. Борисов Л.Б. Медицинская микробиология, вирусология и иммунология: учебник. М.: ООО «Мед. Информ. Агентство».-2002-736 с.
5. Букринская А.Г. Вирусология. М.: Медицина.- 1986.-336с.
6. Поздеев О.К. Медицинская микробиология/Под редак. Акад. РАМН В.И.Покровского.- М.: ГЕОТАР – МЕД. – 2001.-786С.
5.2. Дополнительная:
1. Медицинская микробиология/Гл. ред. В.И.Покровский, О.К.Поздеев.- М.: ГЕОТАР - Медицина.- 1998.- 1200 с.
2. Коротяев А.И., Бабичев С.А. Мед. микробиология, иммунология и вирусология: Учебник для мед. вузов.- 3 – е изд., испр. и доп.- Спб. «Спец. литература». – 2002.- 591 с.
3. Руководство к практическим занятиям по мед. микробиологии, иммунологии и вирусологии / Под. Ред. В.В.Теца.- изд. 2- е., перереб. и доп.- М.: Медицина.- 2002.- 352 с.
Методические рекомендации рассмотрены и утверждены на кафедральном совещании
Онкогенные РНК-геномные вирусы. Онкогенные ретровирусы. Свойства онкогенных рнк-вирусов.
Механизм трансформации клеток onс плюс вирусами во многом напоминает специфическую трансдукцию у бактерий. Онкоген, внесённый в хромосому, придаёт клетке способность бесконтрольно размножаться.
Гены onс плюс вирусов, обладающие трансформирующей активностью в отношении клеток человека, имеют следующие свойства.
• Вирусные гены присутствуют в трансформированных клетках и отсутствуют в нормальных; они могут быть интегрированы в клеточный геном или находиться в плазмидах.
• Клонированные вирусные гены из опухолевых клеток вызывают злокачественную трансформацию клеток человека.
• Из трансформированных клеток можно получить клеточные линии, онкогенные для других видов животных, что связано с присутствием в трансформированных клетках вирусных генов и межклеточным обменом генетической информацией.
• Репродукция онкогенных вирусов в трансформированных клетках может и не происходить; опухолевый статус клетки поддерживает функционирование отдельных вирусных генов.
При заражении onс+-вирусами чувствительных клеток развивается продуктивная инфекция. В результате образуются дочерние популяции вирусов, но трансформации клеточного генома не происходит, так как клетки погибают после завершения репродуктивного цикла вируса.
При заражении onс плюс вирусами нечувствительных или слабочувствительных клеток развивается трансформирующая инфекция.
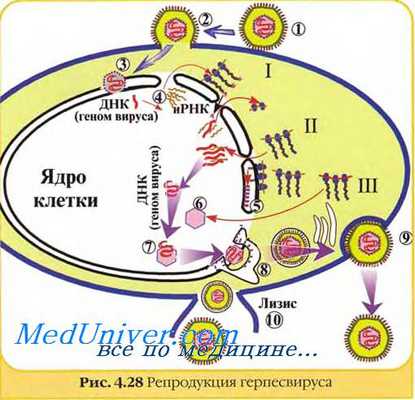
Начальные этапы инфицирования нечувствительных или слабочувствительных клеток принципиально не отличаются от таковых при заражении чувствительных клеток. Вирусная ДНК интегрирует в клеточный геном, где экспрессируются вирусные гены, кодируемые трансформированной областью. Интеграцию вирусной ДНК или её части в состав клеточной хромосомы облегчают частичные нарушения синтеза клеточной ДНК. Однако активность «ранних» вирусспецифических процессов не вызывает полного нарушения синтеза ДНК в клетке и её гибели. Более того, заражение щетки опс+-вирусом активирует некоторые клеточные ферменты (ДНК-полимеразы, тимидинкиназы, протеинки-назы), в результате чего усиливается синтез ДНК и белков, связанных с хромосомами. При этом возникают частичные нарушения синтеза хромосомных белков, что приводит к появлению протеинов с изменённой структурой и свойствами. В результате этого трансформирующая инфекция и вызывает бесконтрольную пролиферацию клеток. Поскольку в нечувствительных клетках блокируются поздние стадии репродукции и образование дочерних популяций, то гибель заражённых клеток не происходит. В устойчиво трансформированных клетках:
• устанавливается равновесие между клеточными и вирусснецифическими синтетическими процессами,
• вирус не убивает клетку,
• клетка сохраняет вирусные гены при размножении (передаёт из поколения в поколение); обычно это осуществляется путём интеграции этих генов в одну или более клеточных хромосом.
В нечувствительных и малочувствительных клетках условия перехода вируса в позднюю фазу репликативного цикла практически отсутствуют. Все трансформированные клетки содержат генетический материал онкогенного вируса в виде вирусспецифических иРНК, белков и ДНК. Геном онкогенного вируса не только всегда присутствует в трансформированных клетках, но и функционирует, то есть осуществляет транскрипцию вирусспецифических иРНК и трансляцию с образованием вирусспецифических белков.
Интегрированный геном также обеспечивает синтез вирусспецифической мРНК. В ней закодированы один или два белка, подавляющие механизмы контроля роста и деления нормальной клетки, а также вызывающие изменения структуры и функции ЦПМ заражённой клетки. Для папова- или герпесвирусов характерно образование особых вирусспецифических белков, обозначаемых как опухолевые Аг (Т-Аг) и опухолеспецифические трансплантационные Аг.
Т-Аг [лат. tumor, опухоль] — растворимые высокомолекулярные белки из группы ранних неструктурных белков. Сразу же после образования Т-Аг транспортируются из цитоплазмы в ядра заражённых или трансформированных клеток, где связываются с вирусным генетическим материалом. Т-Аг обладают АТФазной и протеинкиназной активностью, регулируют транскрипцию «ранних» и «поздних» вирусных генов, активируют репликацию клеточной и вирусной ДНК. Независимо от регуляторных клеточных механизмов, Т-Аг способствуют интеграции вирусной ДНК в геном клетки.
Они связываются с клеточной протеинкиназой и клеточным фосфорилированным белком р53. Он появляется в клетках, трансформированных ДНК- и РНК-геномными онкогенными вирусами, в периоды высокой пролиферативной активности возбудителей. Белок р53 известен как опухолеассоциированный клеточный белок, регулирующий репликацию вирусной ДНК.
Опухолеспецифические трансплантационные Аг представлены двумя группами поверхностных невирусных белков плазматических мембран клеток — TSTA [от англ. tumor spesific transplantat antigen, опухолеспецифичные трансплантационные Аг] и TSSA [от англ. tumor spesific surface antigen, опухолеспецифичные поверхностные Аг].
Синтез TSTA определяет не только тип вируса, но и видовая принадлежность клеток. Опухолеспецифические трансплантационные Аг распознают иммунокомпетентные клетки
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Онкогенные РНК-геномные вирусы представлены ретровирусами, включёнными в подсемейство онковирусов. Онкогенные ретровирусы широко распространены в природе: они найдены как у различных позвоночных (птиц, человека), так и у беспозвоночных и способны вызвать развитие опухолей у своего хозяина.
Их онкогенный потенциал обусловлен наличием обратной транскриптазы (РНК-зависимой ДНК-полимеразы), обеспечивающей образование из вирусной РНК ДНК-геномного провируса.
Первоначально под контролем обратной транскриптазы в цитоплазме клетки происходит превращение вирусного РНК-генома в неинтегрированную линейную ДНК. В ходе этого процесса происходит дупликация последовательностей РНК, после чего ДНК принимает кольцевую, замкнутую форму.
Затем вирусная ДНК интегрируется в клеточный геном. Встраивание определяет повторяющиеся LTR- [от англ. [ong terminal repeat, длинные концевые повторы] последовательности, имеющиеся на концах провируса.
За счёт инвертированных комплементарных повторов на концах LTR-последовательности проявляют свойства транспозонов и вставочных элементов. После интеграции в хромосомы клетки вирусная ДНК становится матрицей для синтеза вирусного РНК-генома и вирусной иРНК.
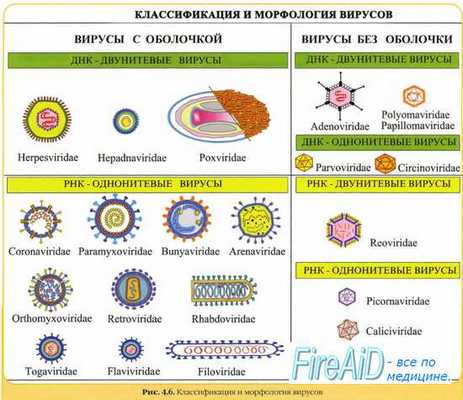
В редких случаях может происходить случайный «захват» ретровирусом регуляторного клеточного протоонкогена. Сам ген не используется в жизненном цикле вируса, но может кардинально влиять на судьбу клетки.
Вирус, захвативший клеточный протоонкоген, становится опс+-вирусом, и его легко обнаружить по трансформирующему эффекту на инфицированные клетки, которые начинают бурно размножаться.
Онкогенные ретровирусы вызывают развитие опухолей трёх групп: солидных опухолей (сарком и раков), острых лейкозов (лимфом, миелобластом) и хронического лимфоидного лейкоза.
На основании морфологических и антигенных различий онкогенные ретровирусы разделены на пять типов: А, В, С, D и Т-лимфотропные вирусы.
Наибольшее количество онкогенных вирусов относят к типу С (вызывают лимфоретикулярные новообразования). По своему онкогенному потенциалу все известные онкогенные ретровирусы разделяют на две разграниченные группы:
Высокоактивные опухолеродные вирусы, индуцирующие неопластические заболевания с коротким инкубационным периодом (например, вирус саркомы Рауса).
Вирусы с умеренной активностью, вызывающие развитие неоплазий после длительного латентного периода (например, HTLV).
За редким исключением все вирусы первой группы — двухкомпонентны и состоят из вируса-помощника и дефектного вируса, ответственного за патогенность (см. также главу 5h\B отличие от ДНК-содержащих вирусов, большинство ретровирусов относительно безвредно для клетки-хозяина. Для большинства ретровирусов характерна высокая специфичность по отношению к чувствительным клеткам, и лишь некоторые из них могут инфицировать клетки разных видов животных.
По характеру распространения среди хозяев выделяют экзогенные и эндогенные ретровирусы.
РНК-вирусы как причина развития рака - вирусный канцерогенез
Открытие вирусов, вызывающих злокачественные опухоли у животных, произошло еще на рубеже XIX и XX веков. В 1910 г. Пейтон Рауш обнаружил, что бесклеточный фильтрат из тканей птичьей саркомы может вызывать развитие аналогичной саркомы у цыплят. Примерно в это же время была доказана вирусная природа птичьего миелобластоза. Позднее было обнаружено, что часто проходит весьма значительный латентный период между инфицированием вирусом и развитием рака.
Тем не менее вплоть до 1960-х годов не существовало четких доказательств того, что инкорпорация вирусной ДНК в геном клетки является необходимым условием развития злокачественной трансформации, как не было и случаев выделения вирусной ДНК из раковых клеток.
В настоящее время выделяют два типа вирусных онкогенов. Оба этих типа онкогенов встраиваются в клеточную ДНК. Вирусы первого типа несут онкогены, которые вызывают быструю злокачественную «трансформацию» клеток в культурах in vitro, а в организме вызывают развитие опухолей. При втором типе вирус действует медленнее и для развития опухоли требуется значительное время. Вирусы второго типа не вызывают злокачественной трансформации клеток в культурах in vitro.
РНК-содержащие вирусы вызывают развитие целого ряда различных опухолей у животных, при этом наиболее распространена индукция этими вирусами лимфом, лейкемий и сарком. Типичная структура таких вирусов - это две идентичные цепочки молекул РНК в сочетании с ферментом обратная транскриптаза, одетых в гликопротеиновую оболочку. При инфицировании вирусом его обратная транскриптаза заставляет клетки синтезировать ДНК, комплементарную вирусной РНК.
Эта ДНК затем встраивается в клеточные хромосомы, и на ее основе клетка уже сама начинает синтез новых вирусных белков, вирусных обратных транскриптаз и элементов гликопротеиновой оболочки. Из-за механизма их действия этот тип вирусов получил название ретровирусы. Все они имеют весьма схожий внешний вид на электронных микрофотографиях и являются самыми маленькими из известных вирусов.
Некоторые из ретровирусов (например, вирусы птичьего лейкоза, кошачьей и мышиной лейкемии) содержат в себе только три гена и обладают очень длительным инкубационным периодом с момента заражения до возникновения опухоли. Другие вирусы (например, вирус саркомы Рауса (ВСР)) вызывают очень быструю злокачественную трансформацию и могут быть выделены из культуры опухолевых клеток.
Показано, что вирус ВСР содержит особый ген (v-src), способный вызывать трансформацию фибробластов in vitro. Этот ген кодирует наработку протеинкиназы, которая фосфорилирует тирозин. К сожалению, действие этой протеинкиназы запускает целый каскад различных метаболических процессов, и очень сложно оценить, какой именно из них ведет к злокачественной трансформации.
В настоящее время известно, что и нормальные, и злокачественные клетки содержат в своем генотипе участки ДНК, сходные или идентичные ряду последовательностей онкогенных РНК-содержащих вирусов. Такие участки получили название клеточных прото-онкогенов (чтобы отличать их от вирусных онкогенов). Постулируется, что активация этих участков, возникающая в результате канцерогенного воздействия, запускает целую цепочку событий, ведущую в итоге к злокачественной трансформации клетки. Считается также, что ретровирусы инкорпорировали эти клеточные участки в свой геном в процессе эволюции.
В настоящее время мы лучше понимаем механизмы действия продуктов вирусной активации. Примером такого продукта является протеинкиназа, активируемая геном sre, а также целый ряд других вирус-индуцированных канцерогенов. Это и рецепторы к эпидермальному фактору роста, продуцируемые геном v-erb, и тромбоцитарный фактор роста (ТФР), кодируемый фрагментами гена v-sis, и целый ряд связывающихся с ядром клетки белков, продукцию которых вызывает вирус птичьей лейкемии.
Вирусные онкогенные молекулы в большинстве случаев структурно отличаются от своих аналогов клеточного происхождения; кроме того, в них отсутствуют интроны. Например, белок, кодируемый геном v-erb, гомологичен клеточному рецептору к эпидермальному фактору роста (ЭФР), но в нем отсутствует часть экстраклеточного домена, включая ЭФК-специфичный сайт. Так как в продуцируемой вирусом молекуле отсутствует плазматический участок, ответственный за автофосфорилирование, такой вирусный рецептор все время находится во «включенном» состоянии.
Как нормальные, так и раковые клетки содержат в себе участки последовательностей ДНК, гомологичные РНК онкогенных вирусов. Если происходит экспрессия или активация под действием канцерогенов этих клеточных онкогенов, это ведет к злокачественной трансформации клеток.
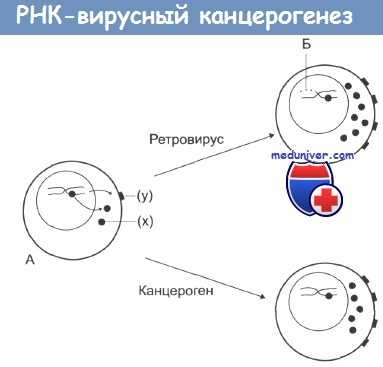
Онкогенная и злокачественная трансформация.
На стадии А нормальная клетка, которая характеризуется низкой протоонкогенной активностью, продуцирует фактор роста (х) или белки дифференцировки или рецепторы (у).
Канцерогены повышают активность протоонкогенов, что дает начало неопластической трансформации.
По другому механизму: при заражении ретровирусом происходит внедрение в ДНК клетки вирусных промоторов или онкогенов (Б), что также ведет к увеличению онкогенной активности и последующей злокачественной трансформации.
Вирус может активировать процессинг в клетках путем внедрения в их ДНК специальных регуляторных последовательностей — промоторов считывания белка, нарушая таким образом нормальные процессы транскрипции. Запускаемый таким образом механизм внедренного мутагенеза может вовлекать в себя целый комплекс различных процессов. Примером может служить внедрение в ДНК клетки вирусной после довательности «многочисленных терминальных повторений» (МТП). При внедрении в клеточную ДНК данная последовательность инициирует транскрипцию в обоих направлениях цепочки ДНК, позволяя транскрибировать одновременно как клеточные, так и вирусные гены. Такой механизм действия характерен для вируса клеточного лейкоза, когда вирусная ДНК интегрируется в клеточную сразу вслед за участком с-тус, вызывая его активацию.
Первым ретровирусом, для которого была однозначно доказана связь со злокачественными новообразованиями, был вирус Т-клеточной лейкемии человека (ВТКЛ-1), выделенный из клеток хронической кожной Т-лимфомы. Этот вирус довольно широко распространен, может передаваться половым путем, через кровь, особенно в среде наркоманов, и от беременной женщины к плоду. Первоначально эндемический ареал циркуляции данного вируса был в основном представлен тропическими странами, однако в настоящее время в США серопозитивная реакция на вирус обнаруживается у каждого из 4000 человек населения. Кроме Т-клеточной лейкемии вирус вызывает тропический спастический паралич.
После 20 лет наблюдения за серопозитивными пациентами оценено, что риск развития последнего заболевания составляет около 5%. Один из вирусных генов, а именно tax-ген, вызывает увеличение продукции клеточного интерлейкина-2 (ИЛ-2) и его рецепторов, что является основным фактором, стимулирующим деление Т-клеток.
Ретровирусы могут вызывать опухолевые заболевания не напрямую, а опосредованно, как это было показано для вируса иммунодефицита человека (ВИЧ-1), вызывающего развитие СПИДа. Случаи развития рака у ВИЧ-инфицированных рассмотрены в одном из обзоров. Отмечается, что у ВИЧ-инфицированных наиболее часто развиваются три типа опухолей: мгновенная или высокозлокачественная В-клеточная лимфома; саркома Капоши (СК, которую вызывает другой вирус — герпесвирус ГСК, или герпесвирус 8); карцинома шейки матки.
До разработки эффективных методов терапии ВИЧ-инфицированных более 40% из них заболевали тем или иным видом рака. Тем не менее связь этого вируса с развитием онкологических заболеваний скорее всего косвенная и опосредована развитием общей хронической иммунодепрессии организма, которая и позволяет другим канцерогенным вирусам вызывать рак. В-клеточные лимфомы также характеризуются довольно сложным патогенезом. Хотя В-клетки не поражаются вирусом ВИЧ-1, они могут быть мишенью для других типов вирусов, например для вируса Эпштейна-Барра (ВЭБ). Рак шейки матки у женщин также развивается на основе вторичной вирусной инфекции — вируса папилломы человека (ВПЧ), на фоне общей иммунодепрессии, вызванной ВИЧ-1. По причине общего снижения иммунных реакций организма все эти опухоли развиваются особенно быстро и агрессивно.
Показано, что РНК-содержащий вирус гепатита С значительно увеличивает риск заболевания гепатоклеточной карциномой. У больных, инфицированных этим вирусом, риск развития раковой опухоли возрастает в 100 раз, но механизмы его канцерогенного действия в настоящее время почти не изучены. Если больной заражен еще и вирусом гепатита В, риск развития рака печени возрастает многократно. На земном шаре одним или обоими из этих вирусов заражено около миллиарда человек.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Онкогенные вирусы

Инфекция, вызванная онкогенными вирусами, является причиной 15,4% заболеваний раком по всей земле. Первый онкогенный вирус, который был идентифицирован — это куриный вирус саркомы Рауса в 1911 году. Десятилетиями позже были обнаружены серии других онкогенных вирусов, в том числе вирус папилломы Шопа (вирус папилломы кроличьего хвоста), вирус опухоли молочной железы мыши, аденовирус, вирус SV40 (обезьяний вирус sv40). Теория опосредованного вирусом онкогенеза в итоге была экспериментально продемонстрирована в 1976 году Гарольдом Вармусом и Майклом Бишопом путем превращения инфицированных клеток в опухолевые вирусом саркомы (ген v-src вызывает образование опухоли после захвата протоонкогена человеческой клетки в результате трансдукции).
Несмотря на то, что онкогенные вирусы нашли в исследованиях онкогенной активности животных клеток, они были не в состоянии преобразовать человеческие клетки. Теория вирусного онкогенеза в человеческой клетке оставалась спорной до 1965 года, когда вирус Эпштейн-Барр (EBV) был обнаружен в клетках лимфомы Беркитта. В ходе последующих исследований, в том числе выделении Т-лимфотропного вируса человека (HTLV) из клеток Т-клеточной лимфомы и выявлении роли папилломовирусов человека с высокой онкогенной активностью в развитии рака шейки матки, был определен путь для понятия человеческих онкогенных вирусов. Обнаружение связи между герпес-вирусом и саркомой Капоши (KSHV) и лимфомой и между полиомавирусом клеток Меркеля (MCV) и карциномой клеток Меркеля (MCC) подчеркнуло возможность открытия еще большего количества онкогенных вирусов с помощью современных технологий. Далее каждый вирус будет рассмотрен отдельно.
Вирус Эпштейн-Барр
Вирус Эпштейн-Барр (ВЭБ, EBV) — ДНК-содержащий вирус, который преимущественно поражает B-лимфоциты, также является митогеном для них; вызывает лимфопролиферативные болезни (лимфома Беркитта, носоглоточная карцинома, NK-клеточная лейкемия, лимфома Ходжкина и т.д.), а также инфекционный мононуклеоз. Вирионы вируса были обнаружены при электронной микроскопии биоптата лимфомы Беркитта в начале 1964 года Энтони Эпштейном и Ивонной Барр.
Строение. ВЭБ имеет вирусный капсидный антиген (VCA), ядерные антигены-EBNAs 1, 2, 3, 3a, 3b, 3c; латентные мембранные протеины (LMPs) 1, 2 и две маленькие Эпштейна-Барр-кодируемые РНК (EBER) молекулы — EBER1 и EBER2. EBNAs и LMPs являются ДНК-связывающими белками, считающимися необходимыми для развития инфекции и фиксации.
Промотор репликации плазмидного вектора показан оранжевым. Короткие толстые зеленые стрелки представляют экзоны, кодирующие латентные белки: (EBNAs 1, 2, 3A, 3B and 3C, and EBNA‑LP, LMPs 1, 2A and 2B, BHRF1,BARF1). Короткие голубые стрелки сверху представляют наиболее транскрибириуемые полиаденилированные ВЭБ-кодируемые РНК (EBER1, EBER2). Средняя длинная зеленая линия представляет транскрипцию ВЭБ при 3-ем типе латентности, в которой белки EBNA транскрибированы с промотора Ср или Wp. Различные EBNA кодированы индивидуальными мРНК, которые сгенерированы различным сплайсингом одного и того же длинного первичного транскрипта. Внутренняя красная линия представляет транскрипт EBNA1, который берет начало от промотора Qp при 1 и 2 типе латентности.
- необходим для трансформации В-лимфоцитов;
- функционирует как конститутивный активатор рецептора ФНО и имеет сходство с CD-40 рецептором;
- активирует сигнальные пути, которые делают вклад в онкогенный эффект.
В зависимости от набора экспрессируемых вирусных генов в пораженных клетках выделяют три типа латентности (I, II и III тип), характерные для различных видов лимфом: I тип подразумевает избирательную экспрессию EBNA-1 при ВЭБ-положительной лимфоме Беркитта; II тип заключается в экспрессии EBNA-1, LMP-1 и LMP-2 и является отличительным признаком ВЭБ-положительной ходжкинской лимфомы, периферических T/NK-клеточных лимфом; латентность III типа, характеризуемая экспрессией всего набора из девяти латентных белков ВЭБ, наблюдается при лимфопролиферативных поражениях, возникающих у пациентов с тяжелым иммунодефицитом (после трансплантации паренхиматозных органов или стволовых клеток, ВИЧ-инфекции). Тип латентности определяет восприимчивость инфицированных клеток к различным иммунотерапевтическим тактикам. Индуцированные ВЭБ злокачественные новообразования связаны с экспрессией латентных генов. У большинства иммунокомпетентных носителей ВЭБ вирус не индуцирует опухолевый процесс. Новообразования развиваются при комплексном взаимодействии ВЭБ, иммуногенетических факторов, факторов внешней среды (паразитарных инфекций — чаще, малярии, недоедании, потреблении пищи, содержащей канцерогены) и иммунодефицита (ВИЧ-инфекция, трансплантация).
Папилломавирусы человека
Описано около 200 папилломавирусов. Вирусы передаются при контактах через микротравмы кожи и слизистых оболочек, а также половым путем. Папилломавирусы человека вызывают доброкачественные кожные, генитальные, оральные и конъюнктивальные папилломы; индуцируют пролиферацию эпителия, обладают онкогенным потенциалом. С папилломавирусом, особенно ПВЧ-5 и ПВЧ-8, тесно связано развитие немеланомных разновидностей рака кожи. Различают низкоонкогенные папилломавирусы, вызывающие бородавки, которые не малигнизируются, и высокоонкогенные, способные вызвать рак шейки матки, — ПВЧ-16, 18, 31, 33, 35, 45, 51, 52, 58.
Строение. Капсид икосаэдрический, состоит из двух капсидных белков (L1-L2), формирующих 72 пентамера. Геном — двунитевая циркулярная ДНК; имеет в зависимости от вируса восемь ранних генов (E1-E8) и два поздних гена (L1-L2). Гены E6-E7 обладают онкогенной активностью.
Патогенез. В целом, для развития продуктивного поражения ВПЧ (высокого или низкого риска) требуется, чтобы вирус имел доступ к эпителию базального слоя как только эпителиальный барьер был подвержен риску. Папилломавирусы должны инфицировать делящуюся клетку, чтобы стать признанными как малое количество копий ядерной эписомы, и для развития стойкого поражения первичная инфицированная клетка, вероятно, должна быть похожа на долгоживующую эпителиальную стволовую клетку или похожую на нее. Кроме того, связанные с заживлением ран изменения в местном микроокружении, включая увеличение количества факторов роста, могут играть ключевую роль в создании резервуара инфекции в базальном слое. Способность ВПЧ инфицировать, и реплицироваться, и управлять прогрессированием рака зависит от функции вирусного белка, положении в эпителии, где эти белки экспрессируются. Как только инфицированные базальные клетки поделились и в конечном итоге вошли в парабазальный слой, они начинают проходить программу экспрессии генов, которая связана с дифференциацией. Амплификация вирусного генома обычно происходит в срединно-эпителиальных слоях, тогда как сбор и выход вируса происходит вблизи наружной поверхности эпителия.
Несмотря на то, что эффективная амплификация генома требует комбинированного действия множественных продуктов вирусного гена, включая E6, E7, E2 и кодированную вирусом геликазы E1, поддержание репликации в базальном слое эпителия может зависеть от факторов репликации клетки хозяина. Программа, зависящая от дифференциации, которая происходит в надбазальных слоях эпителиальной клетки, включает как временные изменения в активности промотора, так и изменения в шаблонах сплайсинга мРНК, которые облегчают производство различных продуктов вирусных генов на разных стадиях во время программы дифференциации. Функция вирусного белка далее регулируется посттрансляционной модификацией, включая фосфорилирование и протеолитическое деление клетки.
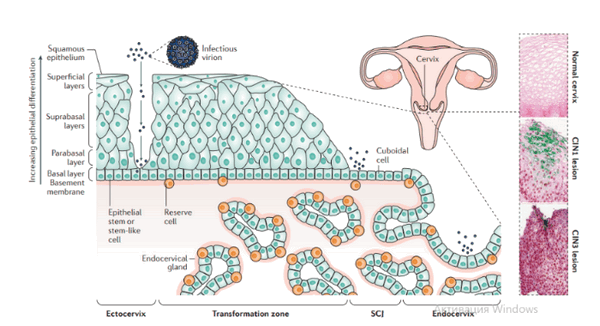
Cчитается, что прекращение регулирования гена экспрессии ВПЧ высокого риска зависит от конкретных характеристик базальной клетки, которую заражает вирус, а также от восприимчивости этой зараженной клетки к внешним стимулам, таким как гормоны и факторы роста. Большинство видов рака шейки матки возникает в зоне трансформации и слизистой оболочки шейки матки; область шейки матки, состоящая первоначально из столбчатого эпителия, затем подвергается метаплазии. Предполагается, что стратифицированные (разделенные) слои внешней шейки матки поддерживаются «обычными» эпителиальными стволовыми клетками, которые расположены в базальном слое. Природа этих клеток не установлена. Напротив, стратифицированные слои зоны трансформации и один слой столбчатых ячеек — это линия слизистой оболочки шейки матки, как полагают, поддерживается резервными клетками шейки матки. Хотя резервные клетки достаточно обильны в местах метаплазии, недавние исследования дополнительно предположили, что стволоподобные клетки второго типа кубического вида, которые расположены более точно в стыке переходной зоны (squamocolumnar junction), тоже проявляют резервную функцию.
Герпесвирус, ассоциированный с саркомой Капоши
KSHV, или человеческий герпесвирус 8, был обнаружен в 1994 году как член семейства гамма-герпеса человека, присоединившись к ВЭБ. Инфекция иммунокомпрометированных индивидуумов с KSHV была связана с развитием саркомы Капоши, полученной из эндотелиальных клеток, и по меньшей мере двумя B-лимфоцит лимфопролиферативными заболеваниями: первичная выпотная лимфома и многоцентричная болезнь Кастлмана. Однако изучение патогенеза и онкогенеза KSHV затруднено отсутствием значимой модели животных и восприимчивой клеточной культуры.
Онкогенное действие. Две иммортализованные клеточные линии, KS Y-1 и SLK, когда-то использовались для исследований KS и KSHV, но в KS Y-1 были также обнаружены клетки линии рака мочевого пузыря T 24, что затруднило дальнейшую работу. Первичные эмбриональные метанефрические мезенхимальные клетки-предшественники почек крысы восприимчивы к инфекции и трансформации KSHV, но из них распространяются ограниченное количество инфекционных вирионов. Линии B-клеток, полученные из первичной выпотной лимфомы, обычно заражаются KSHV на латентной стадии и могут быть индуцированы для получения малого количества вирионов KSHV, но первичные B-лимфоциты из периферической крови или тонзиллярной ткани являются устойчивыми к инфекции KSHV, и для их инфицирования может потребоваться совместный рост с KSHV-позитивными клетками.
KSHV кодирует несколько важных белков, которые обладают некоторой онкогенной активностью для индуцирования пролиферации клеток, иммортализации, трансформации и передачи сигналов; производства цитокинов; иммунного контроля; антиапоптозной активности; и ангиогенеза. К ним относятся вирусные латентные белки, латентный ассоциированный ядерный антиген (LANA), vFLIP (FADD (Fas-ассоциированный белок с доменом смерти), подобный ферменту, ингибирующему синтез интерферона или ингибирующему белок каспазы 8 (FLICE)), vCyclin и вирусные литические белки G-белкового рецептора (vGPCR), интерферон-регуляторный фактор 1 (vIRF-1) и K1. Хотя истинную онкогенную природу каждого белка еще предстоит определить, накопление доказательств указывает на то, что каждый из них вносит свой вклад в онкогенез KSHV. Таким образом, полный спектр вызванной KSHV злокачественности может потребовать, чтобы несколько онкогенных продуктов работали вместе в присутствии клеток хозяев и экологических факторов. Например, как LANA, так и vIRF-1 нацелены на клеточный опухолевый супрессор p53. LANA также ингибирует pRB и PP2A.vCyclin, активатор CDK4 6,198, подавляет p27kip1, ингибитор CDK199 и вызывает реакцию на задержку старения G1, результаты от гиперактивации NF-κB. vFLIP и K1 активируют путь сигнала NF-κB для предотвращения апоптоза B-клеток. vGPCR и K1 влияют на сигнальные пути AKT и NF-κB и способствуют ангиопролиферативному и воспалительному поражению саркомой Капоши.
Т-лимфотропный вирус человека (HTLV)
T-лимфотропный вирус человека (HTLV) относится к семейству ретровирусов, является возбудителем T-клеточного лимфолейкоза взрослых. Вирус впервые был изолирован в 1980 году от больного Т-лимфомой.
Геном. Gag, Pol и Env являются вирусными структурными белками, другие — вирусными регуляторными/вспомогательными белками. За исключением гена hbz, который кодируется минус-цепью провирусного генома HTLV из 3'-LTR, все остальные гены кодируются плюсовой нитью по направлению 5'-LTR. Следует отметить, что 5'-LTR часто удаляется или метилируется по мере прогрессирования заболевания. Кроме того, на поздних стадиях лейкемиогенеза в гене tax часто возникают нонсенс- или миссенс-мутации. Хотя белок tax и ген HBZ индуцируют опухоли у трансгенных мышей, а p12 проявляет слабую онкогенную активность, ни один из вирусных белков/генов, кроме tax, не требуется для опосредованного HTLV-1 опухолеобразования. Продукт tax гена действует на терминальные повторы LTR, стимулируя синтез вирусной иРНК, а также образование рецепторов IL-2 на поверхности зараженной клетки.
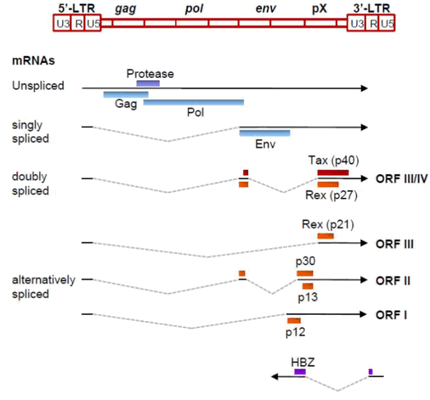
Рисунок 3. Gag, Pol и Env вирусные регуляторные/вспомогательные белки HTLV
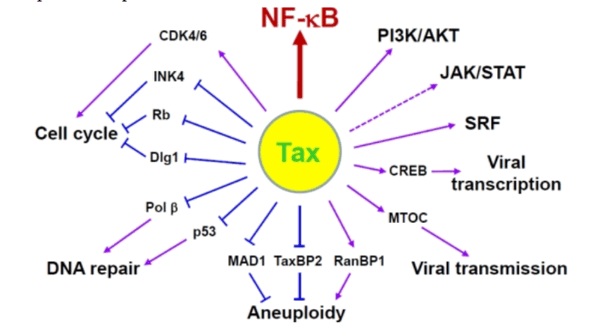
Рисунок 4. К леточные пути вирусного онкобелка tax
Патогенез. Проникновение HTLV-1 в клетку человека охарактеризовывает начало выживания и репликации вируса. HTLV-1 связывается с рецептором клеток, имеющих необходимый антиген, что инициирует процесс инвазии. Рецепторный комплекс состоит из транспортера глюкозы (GLUT1), гепаринсульфат протеогликана (HSPG) и рецептора VEGF-165 нейропилина-1 (NRP-1). HTLV-1 взаимодействует с HSPG. Процесс слияния происходит через комбинацию GLUT1 с HSPG/NRP-1, после чего ядро, содержащее вирусную РНК, доставляется в цитоплазму клеток-мишеней. После обратной транскрипции HTLV-1 встраивает свой геном в генома хозяина, чтобы сформировать провирус, окруженный двумя LTR на 5' и 3' концах. Затем провирус транскрибируется и кодирует структурные, регуляторные и вспомогательные белки. Впоследствии вирусные геномные РНК и Gag, Env и Gag-Pol белки переносятся в плазматическую мембрану, чтобы начать собираться в зрелую вирусную частицу.
Вирусы гепатита
Вирус гепатита В (HBV) и вирус гепатита С (HCV) представляют собой несвязанные вирусы, имеющие тропность к гепатоцитам и реплицирующиеся в них. Около 2 миллиардов человек инфицированы HBV, и более 350 миллионов человек становятся хроническими носителями. Только 5-10% взрослых, которые приобретают инфекцию, становятся хроническими носителями, у 30% развиваются прогрессирующие хронические заболевания печени: гепатит, фиброз, цирроз и, наконец, гепатоцеллюлярная карцинома (HCC).
Геном. Геном вируса гепатита B представляет собой одну двухцепочечную кольцевую ДНК длиной около 3200 нуклеотидов (длина генома различна у разных изолятов). Одна из цепей («плюс-цепь») ДНК короче другой (ее длина составляет 1700-2800 нуклеотидов). Вторая цепь тоже не является замкнутой и к ее 5’-концу ковалентно присоединена молекула полимеразы (P). В геноме вируса найдено 4 гена: S, С, Р, X, кодирующих соответственно HBsAg, HBcAg, полимеразу и белок-регулятор экспрессии генов. Кроме того, там есть регуляторные последовательности ДНК, ответственные за синтез белков и репликацию вируса. Гены частично перекрываются, что обусловливает малый размер генома.
Патогенез. HCC, индуцированная посредством HBV и HCV, развивается в области воспаления и регенерации, что является результатом хронического повреждения печени, а это в свою очередь указывает на то, что патогенез HCC иммунно-опосредован. Эти вирусы постоянно реплицируются в культуре клеток без явных повреждений и смерти клеток, подразумевая, что они являются не цитопатическими. Постоянная репликация вируса является фактором риска для образования HCC, потому что воспаление часто приводит к длительным хроническим заболеваниям печени CLD без выведения вируса. В этом контексте HBV и HCV генерируют белки, подавляющие иммунитет, который должен контролировать хронические инфекции. HBV- и HCV-кодированные белки изменяют экспрессию гена хозяина и клеточный фенотип, что является признаком рака. Эти изменения способствуют независимой от фактора роста пролиферации, сопротивлению к ингибированию роста, инвазии тканей и метастазированию, ангиогенезу, перепрограммированию энергетического метаболизма и устойчивости к апоптозу. Хроническое воспаление также способствует генетической нестабильности в клетках опухоли. Вклад HBV в развитие HCC включает в себя экспрессию гена гепатита Bx (HBx) и, возможно, усеченные пре-S или S-полипептиды карбоксимицина; основной белок и неструктурные (NS) белки NS3 и NS5A HCV способствуют онкогенной трансформации. Изменения в экспрессии гена хозяина, которые способствуют возникновению опухолевого генеза, также, похоже, поддерживают репликацию вируса и/или защиты вирусных гепатоцитов от иммунного опосредованного повреждения и разрушения.
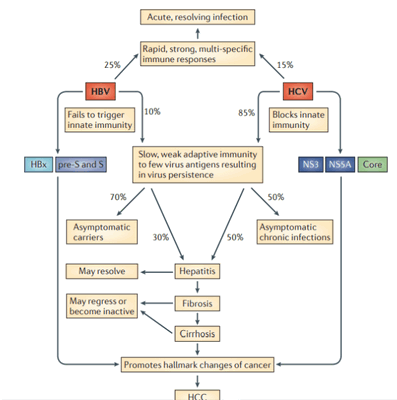
Иммунитет играет важную роль в исходе острых инфекций. Быстрый, сильный и мультиспецифичный ответ против многих белков вирусов гепатита В (HBV) и гепатита C (HCV) приводит к острой инфекции, устраняемой клеткой-хозяином.
Источники
Oncogenes and RNA splicing of human tumor viruses. Masahiko Ajiro & Zhi-Ming Zheng.(September 2014)
Carcinogenic human papillomavirus infection. Mark Schiffman, John Doorbar, Nicolas Wentzensen, Silvia de Sanjosé, Carole Fakhry, Bradley J. Monk, Margaret A. Stanley & Silvia Franceschi.( December 2016)
Human T-cell lymphotropic virus type 1 and its oncogenesis Lan-lan ZHANG, Jing-yun WEI, Long WANG, Shi-le HUANG, Ji-Long CHEN.(2017)
Immunoblastic Lymphoma in Persons with AIDS-Associated Kaposi's Sarcoma: a Role for Kaposi's Sarcoma–Associated Herpesvirus. Eric A Engels M.D., Stefania Pittaluga M.D., Denise Whitby Ph.D., Charles Rabkin M.D., Yoshiyasu Aoki M.D., Elaine S Jaffe M.D. & James J Goedert M.D.(may 2003)
Kaposi’s sarcoma-associated herpesvirus ORF34 is essential for late gene expression and virus production. Mayu Nishimura, Tadashi Watanabe, Syota Yagi, Takahiro Yamanaka & Masahiro Fujimuro( march 2017)
Саркома Капоши: патогенез и основы терапии Н.С. Потекаев, Г.А. Паньшин, Н.П. Теплюк, Н.С. Арсентьев, Е.Ю.,Вертиева,Г.И. Махов, Е.С. Сизова, В.С. Пауков, М.Г. Карташова. (март 2013)
Human T-Cell Lymphotropic Virus: A Model of NF-κB-Associated Tumorigenesis. Zhaoxia Qu and Gutian Xiao(June 2011)
Immune responses and immunopathology in acute and chronic viral hepatitis. Eui-Cheol Shin, Pil Soo Sung & Su-Hyung Park(July 2016)
Pathogenic mechanisms in HBV and HCV-associated hepatocellular carcinoma. Alla Arzumanyan, Helena M. G. P. V. Reis and Mark A. Feitelson(February 2013) Epstein–Barr virus: more than 50 years old and still providing surprises. Lawrence S. Young, Lee Fah Yap & Paul G. Murray( September 2016)
Медицинская микробиология, вирусология и иммунология. В.В. Зверев, А. С. Быков.
Читайте также:
