Примеры хеморедукции ретинобластомы
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Ретинобластома (РБ) – наиболее распространенная внутриглазная злокачественная опухоль оптической части сетчатки нейроэктодермального происхождения. Опухоль развивается внутриутробно или в раннем возрасте и характеризуется высокой степенью злокачественности, инвазивностью, способностью быстро метастазировать в соседние органы и ткани. В последние годы наблюдается рост частоты РБ в популяции: в настоящее время она составляет 1:10000-20000 живых новорожденных [2,7,16], хотя еще 20 лет назад частота опухоли оценивалась как 1:30000 [1,3]. Участие генетических факторов в процессе канцерогенеза в настоящее время не подвергается сомнению. Многочисленными исследованиями подтверждено, что злокачественная опухоль развивается в результате как структурных, так и функциональных (эпигенетичеких) мутаций генов.
Ретинобластома – наследственное заболевание, и предрасположенность к ней обусловлена герминальной мутацией в одном из аллелей гена RB1, который относится к классу генов-супрессоров опухолевого роста и расположен в проксимальном районе длинного плеча хромосомы 13 (q14.1). Передается потомству по аутосомно-доминантному типу с варьированием экспрессивности и достаточно высокой пенетрантностью (90%) [5,6]. РБ – первое онкологическое заболевание, на примере которого была сформулирована двухударная теория канцерогенеза, предполагающая, что для перехода нормальной клетки в опухолевую необходимы два последовательных мутационных события [5,10]. При наследственной форме РБ вторая мутация может появиться в любой соматической клетке организма, поэтому у больных с герминальной мутацией в гене RB1 существует большой риск развития различных злокачественных опухолей, таких как остеосаркома, рак молочной железы и другие. Существует спорадическая и наследственная форма заболевания. Спорадическая форма встречается в 60% случаев и проявляется как монолатеральная, монофокальная опухоль у детей после года. Наследственная форма встречается в 40% случаев, выявляется преимущественно на первом году жизни и сопровождается двусторонним поражением с мультицентричным характером роста.
РБ развивается в возрасте от 0 до 9 лет. У подавляющего большинства детей РБ развивается в возрасте до 3 лет. Однако в последние 10 лет наблюдается увеличение заболеваемости у детей старше 5 лет. Выявление опухоли в юношеском возрасте считается раритетом [6,10]. Оба глаза поражаются одинаково часто. Различий по половому признаку, расовой принадлежности не установлено. В начале 20 века дети, страдающие от ретинобластомы, имели мало шансов на выживание. Прогресс в лечении этого заболевания позволил повысить выживаемость с 30% в 1930 году, до 80% в 1960 г. В настоящее время, благодаря внедрению в практику различных комбинированных методов лечения, эта цифра достигает 95% в развитых странах [10,16]. Ключевую роль в революционном снижении смертности сыграли усовершенствование лучевых технологий и внедрение новых лекарственных препаратов, которые были включены в протоколы лечения детей [3].
Целью настоящего исследования является анализ эффективности проводимого комбинированного лечения больных с различными формами ретинобластомы.
Материал и методы
Проведен ретроспективный анализ эффективности лечения детей с различными формами РБ, поступившими в стационар отдела офтальмоонкологии и радиологии МНИИ ГБ им. Гельмгольца с января 2002 г. по декабрь 2006 г. Под наблюдением находились 164 ребенка (79 девочек и 85 мальчиков) с первичной ретинобластомой. Монокулярная форма выявлена у 110 больных (67.0%), бинокулярная – у 54 детей (32.9%), у 1 ребенка выявлена трилатеральная ретинобластома. Наследственная РБ отмечена в 9 случаях (5.5%). Средний возраст больных с монокулярной формой заболевания при обращении составил 28±2.4 мес., при бинокулярном поражении – 14.5±1.5 мес. До госпитализации дети проходили полноценное общеклиническое обследование на предмет исключения регионарных и отдаленных метастазов. Всем детям после года проводили КТ орбит и головного мозга, дети до года подвергались этому обследованию в случае подозрения на экстрабульбарный рост или наличие метастазов в головной мозг. В стационаре все больные были обследованы в условиях медикаментозного сна с максимальным мидриазом, во время которого проводилось полное офтальмологическое обследование, включающее в себя, помимо рутинных методов, осмотр глазного дна ретинальной педиатрической камерой (RetCam), УЗИ, УЗДГ и ОСТ. Согласно классификации ВОЗ, III стадия заболевания была выявлена у 80% детей, IV стадия – в 11% случаев, а I-II стадия присутствовала только у 9% больных. Согласно принятой в западных странах классификации Reese-Ellsworth, построенной по прогностическому принципу, 75% больных отнесены к 4-5 группе (плохой прогноз), а 25% – к 1-3 группе.
В клинической картине монокулярных РБ преобладали больные со смешанным (рис.1) и эндофитным характером роста (74%), а при бинокулярном поражении – в лучших глазах наблюдался экзофитный (рис.2) или эндофитный (рис.3) характер роста (93%). У 36 из 54 больных (66.7%) с бинокулярной РБ имело место мультифокальное поражение сетчатки (рис.4). Количество опухолевых очагов колебалось от 2 до 5. У большинства больных с монокулярным поражением (82%) параметры опухоли определить было невозможно, так как опухоль выполняла практически весь глаз, помимо этого, отслойка сетчатки, кровоизлияния препятствовали детальному осмотру опухоли. Кальцификаты выявлялись в 76% случаев. При бинокулярном поражении толщина опухоли в «лучших» глазах варьировала от 1.2 до 8.5 мм (в среднем 5.3±0.7мм), а диаметр основания – от 3.5 до 14.5 мм (в среднем 7.5±1.2 мм).
Всем больным проведено комбинированное лечение с обязательной полихимиотерапией. Ликвидационные операции при монокулярном поражении сопровождались адъювантной полихимиотерапией по дробно-протяженной схеме, которая проводилась 1 раз в 3 недели в течение года под контролем гематологов и педиатров. Протокол включал внутривенное введение винкристина в дозе 0.05 мг/кг веса и циклофосфана из расчета 30 мг/кг веса. При проведении органосохраняющих операций лечение начинали с неадъювантной полихимиотерапии, предложенной нами, включающей цитостатик платинового ряда – карбоплатин (доза 18.7 мг/кг веса) и винкристин (0.05 мг/кг веса) в/в 1 раз в 3 недели с соблюдением всех норм введения. Количество курсов колебалось от 3 до 11 (стандартный блок – 6 курсов), зависело от параметров опухоли и ее чувствительности. После уменьшения параметров опухоли переходили к одному из видов локального разрушения опухоли (лазеркоагуляция, криодеструкция, брахитерапия Ru 106 +Rh 106 или Sr 90 +Y 90 ). Сроки наблюдения за больными составили от 12 до 60 мес., в среднем 42.5 мес. При оценке эффективности проведенной терапии из исследования были исключены 8 детей с бинокулярной РБ, наблюдение за которыми по не зависящим от нас причинам было прервано на разных этапах лечения.
Результаты и обсуждение
Анализ полученных результатов показал, что единственным методом лечения, который можно было предложить 91% больных (100 детей) с монокулярной ретинобластомой, являлась энуклеация. Во всех случаях опухоль или выполняла практически всю полость глаза, или имелись вторичные осложнения в виде тотально отслоенной сетчатки, вторичной глаукомы, гемофтальма, диссеминации опухолевых клеток в стекловидное тело или инвазия в ДЗН (рис.5), распространение опухоли в переднюю камеру (рис.6). Объясняется это, во-первых, поздним обращением больных к врачу, а во-вторых, отсутствием системы активного выявления врожденной патологии у детей младшего возраста. Известно, что самой распространенной жалобой является свечение зрачка (симптом «кошачьего глаза», лейкокория – 68%) однако этот признак свидетельствует о поздней стадии заболевания, при которой сохранение глаза практически невозможно. Анализ предъявляемых родителями жалоб свидетельствует о том, что второй основной жалобой у детей младшего возраста является косоглазие (32%). Но, к сожалению, врачи, как правило, не обращают на него внимания, в то время как косоглазие может возникать на ранней стадии развития центрально расположенной опухоли. Об отсутствии настороженности у офтальмопедиатров в плане выявления РБ говорит тот факт, что даже в семьях с высоким риском появления больного ребенка к врачу с просьбой об обследовании обращались родители [6].
В некоторых работах дискутируется вопрос о необходимости проведения адъювантной ПХТ после ликвидационных операций [7]. Основанием для исключения ПХТ из протокола лечения является отсутствие прорастания опухоли в хориоидею. Однако согласно полученным в нашем исследовании патоморфологическим результатам у 89% больных с рТ3с стадией развития опухоли наблюдались признаки инвазии опухоли в подлежащую хориоидею, что, как известно, резко повышает риск метастазирования опухоли и считается плохим прогностическим признаком [9]. Следовательно, включение в протокол лечения адъювантной полихимиотерапи, направленной на эрадикацию микрометастазов и профилактику рецидивов заболевания, является вполне обоснованным и необходимым принципом. В 10 случаях (9.09%), несмотря на большие размеры опухоли (более 8 мм), была предпринята попытка органосохраняющего лечения, которое начинали с неоадъювантной ПХТ. Глаза удалось сохранить у 8 больных, что составило 7.2% от общего числа больных с монокулярной формой опухоли.
Основной группой больных, среди которых развернулась борьба за сохранение глаза и зрения, были дети с бинокулярным поражением. После исключения 8 детей анализ эффективности лечения был проведен среди 46 детей с двухсторонней ретинобластомой. Необходимо отметить, что после тщательного обследования у 3 детей было выявлено полное поражение обоих глаз с развитием вторичной глаукомы, в связи с чем произведена одномоментная бинокулярная энуклеация. Еще у четырех детей была предпринята попытка сохранения второго глаза, однако, несмотря на временный эффект после неоадъювантной ПХТ, брахитерапии и лазеркоагуляции, возникли рецидивы опухоли и новые очаги, которые вынудили нас провести энуклеацию и второго глаза. Таким образом, на фоне лечения было удалены оба глаза в 8.7% случаев. У двух детей, благодаря предпринятым мерам, удалось сохранить оба глаза (4.3%). У 39 больных после обследования худшие глаза были удалены (Т3сm). Парный «лучший» глаз был подвергнут комбинированному лечению, на первом этапе которого применялась НХТ, разрушающая первичную опухоль до размеров, позволяющих проводить один из методов локального разрушения. Во всех случаях вторым этапом проводилась брахитерапия. При этом у 8 детей (20.5%) на фоне лечения возникли рецидивы или новые очаги, по поводу которых производилась повторная брахитерапия или разрушающая лазеркоагуляция. Помимо локального облучения, в случаях с мультицентричным поражением, при небольших размерах (толщиной до 1.5 мм), очаги, расположенные постэкваториально, разрушались с помощью диодного лазера (18 детей – 46.2%), а преэкваториальные – с помощью криодеструкции (3 больных). Таким образом, благодаря многофакторному воздействию на мультицентричные опухолевые очаги удалось сохранить 39 из 46 глаз (84.8%), а предметное зрение – у 35 детей (рис.7).
Анализ результатов комбинированного лечения больных с РБ еще раз доказал, что разрушение опухоли с помощью локального облучения офтальмоаппликаторами является наиболее эффективным методом. Известно, что брахитерапия для лечения ретинобластомы впервые была использована Stallard and Moore в 1920 г. в виде капсул с радоном. Затем радиоактивные источники неоднократно пересматривались. Сейчас в мире используются в основном офтальмоаппликаторы с радиоактивным йодом ( 125 I) и рутением 106 Ru. Локальное облучение рутениевыми аппликаторами впервые было применено в 1960 г. немецкими офтальмологами Lommatzsch and Vollmar. У нас в стране брахитерапия при РБ впервые использована Г.Д. Зарубеем в 1978 г. в отделении патологии глаз у детей МНИИ ГБ им. Гельмгольца (руководитель – проф. А.В. Хватова). Несмотря на то, что радиоактивный йод обладает большей проникающей способностью, чем рутений, применение его ограничено быстрым распадом частиц (одноразовое применение), большим количеством осложнений и дороговизной. Рутениевые офтальмоаппликаторы зарекомендовали себя как надежные, хорошо переносимые при правильном расчете дозы источники. В нашем исследовании не было ни одного случая склеромаляции, несмотря на то, что в 8 случаях аппликатор был использован повторно.
Хорошие результаты, полученные при лечении детей с тяжелой формой поражения, объясняются включением в комплекс лечения обязательной полихимиотерапии. Протокол адъювантной полихимиотерапии, применяемой в отделе офтальмоонкологии и радиологии МНИИ ГБ им. Гельмгольца, разработан в 1989 г. Международным комитетом по изучению ретинобластомы во главе с J. Shields. Почти 20-летний опыт использования подтвердил его высокую эффективность и хорошую переносимость. Внедрение в практику в 1995 г. неоадъювантной терапии произвело революцию в лечении больших и мультицентричных опухолей, так как основной компонент ПХТ – карбоплатин – обладает способностью разрушать первичную опухоль внутри глаза. Необходимо отметить, что приведенный нами протокол можно и нужно использовать только при локальных формах опухоли. При наличии признаков экстрабульбарного роста или генерализации процесса дети направляются в общеонкологические клиники для проведения высокодозной химиотерапии [3,7,13].
Благодаря карбоплатину стало возможным сохранять глаза, которые ранее однозначно подлежали удалению или подвергались наружному облучению в виде дистанционной гамматерапии. Безусловно, рентгенотерапия позволила в середине прошлого века резко повысить непосредственные результаты лечения детей с ретинобластомой и уменьшить смертность от заболевания. Однако уже в 1969 г. Sagerman [14] показал высокую зависимость развития вторичных опухолей от облучения. В последующие годы многие авторы подтверждали эту взаимосвязь. Так, Abramson [8] описал многочисленные случаи развития вторых, третьих и четвертых опухолей у выживших после РБ больных, причем количество вторых опухолей увеличивалось с каждым прожитым десятилетием, а смертность возрастала. Основываясь на этих данных, мы резко сократили показания к облучению детей. К сожалению, полностью исключить дистанционную гамма-терапию из протокола лечения невозможно, так как вероятность рецидива опухоли в орбиту или продолженного роста в полость мозга при экстрабульбарном росте очень велика. В связи с этим при наличии клеток в ретробульбарном пространстве или на срезе зрительного нерва больные направлялись на наружное облучение. В нашей серии мы не наблюдали развития вторых или вторичных опухолей, но косметические дефекты развились у всех 7 детей, направленных на облучение.
За исследуемый период (январь 2002 – декабрь 2006 гг., 5 лет) в общей группе погибло 4 ребенка, что составило 2.6%. Во всех случаях дети погибли от прорастания опухоли в головной мозг. Смертность в группе с монокулярным поражением составила 1.8%, а смертность в группе с бинокулярным поражением – 4.3%.
Таким образом, благодаря проведению адекватного индивидуального комбинированного и многофакторного лечения различных форм ретинобластомы выживаемость детей с бинокулярной ретинобластомой составила 95.7%, а вторые глаза и зрение сохранены в 84.7% случаев.
Все выжившие дети, несмотря на то, что являются инвалидами с детства, благодаря даже частично сохраненному зрению полностью адаптированы в окружающую общественно-социальную среду. Они посещают детские и средние образовательные учреждения, что свидетельствует о большой медико-социальной значимости разработанного комплекса комбинированного лечения больных с разными формами РБ и повышения качества жизни не только самих детей, но и их родителей.
Выявляемость ретинобластомы на ранних стадиях развития остается чрезвычайно низкой (4%). Своевременная диагностика ретинобластомы позволяет сохранить не только глаз, но и зрение. С целью выявления опухоли на ранних стадиях следует проводить офтальмоскопию с широким зрачком всем детям при рождении, в 3, 6 и 12 мес. Далее не реже, чем раз в год. Дети из группы риска должны находиться под постоянным динамическим наблюдением и обследоваться каждые 3 мес. Внедрение в клинику протокола неоадъювантной полихимиотерапии и многофакторного воздействия на опухоль позволило расширить показания к органосохранному лечению больших и мультицентричных ретинобластом, повысило выживаемость и качество жизни детей и их семей.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Примеры хеморедукции ретинобластомы
Ретинобластома: признаки, гистология, лечение, прогноз
Ретинобластома - наиболее часто встречающаяся внутриглазная злокачественная опухоль детского возраста (1-45), развивающаяся приблизительно у 1 из 15000 живых новорожденных. Эта злокачественная опухоль развивается скрыто, проявляется лишь безболезненной лейкокорией и приводит к гибели пациента (1,2). При отсутствии лечения летальный исход наступает в течение 1-2 лет. Массивные опухоли, прорастающие окружающие ткани, характеризуются наибольшим риском метастазирования. Во всем мире выживаемость при ретинобластоме коррелирует с уровнем экономического развития: в Африке она составляет приблизительно 30%, 60% - в Азии, 80% - Латинской Америке, и от 95% до 97% в Европе и Северной Америке (1).
а) Генетика. Причиной ретинобластомы является соматическая или зародышевая мутация 13 хромосомы (3-8). При всех двусторонних и семейных формах ретинобластомы имеются зародышевые мутации. При односторонней ретинобластоме зародышевая мутация выявляется в 15% случаев и соматическая мутация - в 85% случаев. У пациентов с зародышевой мутацией может присутствовать видимые клинические проявления синдрома 13q хромосомы; также у них отмечается высокий риск развития пинеа-лобластомы и других злокачественных опухолей.
Пинеалобластома и другие параселлярные опухоли с точки зрения анатомии, эмбриологии и иммунологии идентичны ретинобластоме (9-16). У пациентов с зародышевой мутацией отмечена тенденция к развитию этих злокачественных опухолей, обычно они возникают в течение года после диагностики ретинобластомы и почти всегда в возрасте моложе пяти лет (14). Сочетание двусторонней ретинобластомы и пинеалобластомы получило название трилатеральной ретинобластомы. Но этот термин не совсем точен, поскольку у некоторых пациентов с пинеалобластомой ретинобластома развивается только с одной стороны или не развивается вовсе.
С другой стороны, другие злокачественные опухоли у таких больных могут развиваться в течение всей жизни (17-21), наиболее часто это остеосаркома длинных костей, саркома мягких тканей и меланома кожи. Если пациенты с зародышевой мутацией выживают после второй злокачественной опухоли, у них также сохраняется риск развития третьей, четвертой и пятой опухолей. У детей, получавших системную химиотерапию по поводу ретинобластомы, отмечается снижение риска развития других злокачественных опухолей в отдаленном периоде (21).
б) Клиническая картина. Клинические признаки ретинобластомы варьируют в зависимости от распространенности опухоли (22-45). В большинстве случаев опухоль выявляется у детей в возрасте младше трех лет. Однако эта опухоль может диагностироваться и в более старшем возрасте, у подростков или даже у взрослых (29, 30). В Соединенных Штатах первыми симптомами опухоли чаще всего являются лейкокория (56%), косоглазие (24%) и низкие зрительные функции (8%) (22). В более позднем исследовании другой группы пациентов, проведенном в США и включавшем в себя около 1200 глаз, средний возраст на момент манифестации заболевания составил 15 месяцев, 51% составили пациенты мужского пола, 49% - женского, одностороннее поражение наблюдалось в 53% случаев, в 47% диагностирована двусторонняя опухоль (23). Другие крайние цифры были получены в некоторых областях Африки, где опухоль чаще всего манифестирует буфтальмом (56%) и лейкокорией (32%), при этом отмечается высокий риск двусторонней энуклеации и летального исхода (24).
Клинически ретинобластома возникает в виде мелкого прозрачного новообразования сенсорной сетчатки, которое можно легко не заметить при офтальмоскопии. По мере увеличения опухоли она становится матово-белой, появляются расширенные ретинальные питающая артерия и дренирующая вена, может развиваться вторичная отслойка сетчатки. Среди первых симптомов наиболее известен белый зрачковый рефлекс, получивший название лейкокория. По мере роста опухоли она перестает быть исключительно интраретинальным новообразованием и демонстрирует экзофитный рост, эндофитный рост, или комбинацию этих двух типов роста. Экзофитный рост характеризуется увеличением опухоли кнаружи, в субретинальное пространство, что вызывает отслойку вышележащей сетчатки. Эндофитный рост характеризуется появлением в стекловидном теле отсевов опухолевых клеток, иногда препятствующих визуализации сетчатки. Изредка в ткани ретинобластомы может формироваться внутренняя полость, что указывает на высокую дифференцировку опухоли (36).
Реже наблюдается диффузный инфильтративный рост, характеризуемый развитием плоской или минимально проминирующей опухоли (31); хотя диффузная ретинобластома обычно локализуется в задних отделах сетчатки, изредка она развивается вблизи ora serrata и над цилиарным телом и не прорастает расположенные сзади структуры (32). Ретинобластома становится причиной вторичной глаукомы приблизительно в 17% случаев, обычно вследствие неоваскуляризации радужки и вторичного закрытия угла передней камеры (33). Неоваскуляризация радужки может сопровождаться спонтанными гифемами, которые изредка являются первым симптомом опухоли. Воспаление, вызванное некротической внутриглазной ре-тинобластомой, может симулировать или провоцировать целлюлит глазницы (34). Хотя обычно сохраняются прозрачность и правильное положение хрусталика, в редких случаях развиваются катаракта и подвывих хрусталика. В далекозашедших случаях наблюдается экстрасклераль-ное распространение опухоли, которая выглядит как объемная эрозивная масса.
РЕТИНОБЛАСТОМА: КЛИНИЧЕСКАЯ КАРТИНА
На ранних стадиях ретинобластома представляет собой мелкое прозрачное новообразование сетчатки. Несколько увеличившись, она становится матовой и более заметной, со временем появляются расширенные сосуды - питающая ретинальная артерия и дренирующая вена. Иногда при офтальмоскопии в ткани опухоли визуализируются очаги кальциноза «мелового» белого цвета. Опухоли фовеолярной области вызывают нарушение фиксации взора и развитие косоглазия, как эзотропии, так и экзотропии. Со временем развивается характерный белый зрачковый рефлекс (лейкокория). В большинстве случаев опухоль диагностируется уже после развития лейкокории.
Мелкая ретинобластома снизу от центральной ямки правого глаза. Несколько более крупная ретинобластома сверху от диска зрительного нерва. Обратите внимание на расширенные сосуды - питающую артерию и дренирующую вену. Более крупная ретинобластома в верхней части макулярной зоны. Обратите внимание на расширение сосудов верхней аркады, идущих от диска зрительного нерва, при этом сосуды нижней аркады не расширены. Две ретинобластомы, прилегающие к диску зрительного нерва. Верхняя опухоль диссеминирует в вышележащее стекловидное тело (эндофитный рост), нижняя опухоль все еще лежит в плоскости сетчатки. Массивная ретинобластома эндофитного типа. Массивная ретинобластома экзофитного типа.
в) Спонтанный регресс. Приблизительно в 3% случаев отмечается тенденция к спонтанному регрессу ретинобластомы (37-40). Первоначально была описана спонтанно регрессировавшая ретинобластома, имевшая достаточно типичные клинические признаки. Впоследствии был описан доброкачественный вариант ретинобластомы, названный рети-ноцитомой или ретиномой. Для обозначения сначала увеличивавшейся до определенного размера, а затем самостоятельно регрессировавшей опухоли мы предпочитаем пользоваться термином спонтанно регрессировавшая ретинобластома. Доброкачественный вариант опухоли, увеличивавшейся до определенного размера, а затем стабилизировавшейся, мы называем спонтанно стабилизировавшаяся ретинобластома (1).
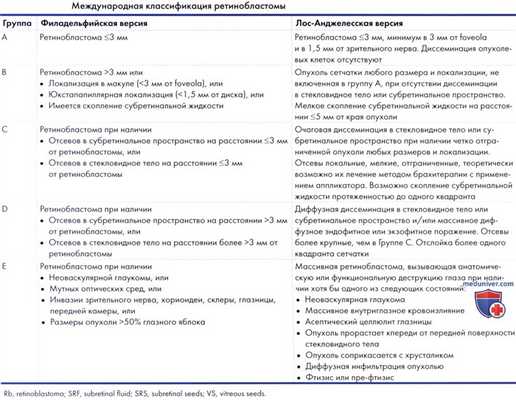
г) Международная классификация ретинобластомы. В настоящее время в крупных лечебных центрах, занимающихся лечением таких пациентов используется Международная классификация ретинобластомы (41-43) (табл. 15.1). Нюансы этой классификации и их использование для прогнозирования и оценки перспектив сохранения глаза после проведения хеморедукции и интраартериальной химиотерапии обсуждаются в соответствующих публикациях (44, 45). Классификация сведена в таблицу, которую мы приводим ниже.
Ниже описаны и проиллюстрированы клинические варианты, диагностика, лечение и дифференциальная диагностика ретинобластомы.
Клинические примеры ретинобластомы:
Редактор: Искандер Милевски. Дата публикации: 17.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ретинобластома
Ретинобластома – злокачественное внутриглазное новообразование, развивающееся из нейроэктодермы сетчатки и встречающееся преимущественно у детей раннего возраста. Для клиники ретинобластомы характерна потеря центрального и бинокулярного зрения, боль, лейкокория, развитие косоглазия, экзофтальма, вторичного воспаления и глаукомы. Обследование при подозрении на ретинобластому включает исследование зрения, измерение внутриглазного давления, осмотр глазного дна, проведение УЗИ глаза, рентгенографии орбиты и придаточных пазух носа, КТ головного мозга, люмбальной пункции. Пациентам с ретинобластомой выполняется фотокоагуляция, криотерапия опухоли; при невозможности сохранения органа зрения - энуклеация пораженного глаза с последующим глазопротезированием.
Общие сведения
Ретинобластома – злокачественное новообразование детского возраста, поражающее сетчатку, сосудистую оболочку глаза, орбиту и часто дающее отдаленные метастазы. На долю ретинобластомы приходится 2,5-4,5% случаев всех злокачественных новообразований у детей до 15 лет. В большинстве случаев ретинобластома развивается в возрасте до 5 лет, пик заболеваемости приходится на 2-3 года. В офтальмологии опухоль с одинаковой частотой встречается у девочек и мальчиков.
Причины ретинобластомы
В 50-60% случаев ретинобластомы имеют генетическое (врожденное) происхождение. Более половины детей с ретинобластомой рождается от родителей, имевших в детстве аналогичное заболевание. Врожденная ретинобластома обычно выявляется у детей в возрасте до 30 месяцев. В этом случае ретинобластома, как правило, сочетается с другими врожденными аномалиями – пороками сердца, расщелинами неба («волчьей пастью»), кортикальным детским гиперостозом и др. У больных с генетической формой ретинобластомы имеется повышенный риск развития злокачественных новообразований другой локализации.
Спорадические случаи ретинобластомы встречаются реже и возникают по неизвестным причинам. К числу факторов риска негенетической формы ретинобластомы принято относить высокий возраст родителей, их занятость на металлургических производствах, неблагоприятные экологические и алиментарные факторы, вызывающие аберрации в хромосомах ретинальных и половых клеток. Данная форма опухоли проявляется у детей более старшего возраста и крайне редко - у взрослых.
Современные воззрения на гистогенез ретинобластомы позволяют ее отнести к опухолям нейроэктодермального происхождения. Ретинобластома может исходить из клеток любого ядерного (зернистого) слоя сетчатки. При микроскопическом исследовании определяются отсутствие стромы, очаги некроза и кальцификаты, разная степень дифференцировки опухолевых клеток.
Для ретинобластомы характерен быстрый рост, метастазирование по зрительному нерву в головной мозг, а также гематогенное распространение в костный мозг и трубчатые кости.
Классификация ретинобластомы
По происхождению ретинобластомы делятся на наследственные и спорадические. Наследственные ретинобластомы обычно поражают одновременно оба глаза. Спорадические ретинобластомы, как правило, поражают один глаз и развиваются локально, с образованием единичного (унилатерального) опухолевого узла.
По степени дифференцировки опухолевых клеток различают дифференцированную форму опухоли – ретиноцитому и недифференцированную форму – ретинобластому, которая встречается чаще и является более злокачественной.
Ретинобластома может иметь эндофитный тип роста в направлении центра глазного яблока: при этом происходит разрушение слоев сетчатки и стекловидного тела. При другом варианте роста – экзофитном, ретинобластома инфильтрирует сетчатку, распространяясь в субретинальное пространство. Экзофитные опухоли могут вызывать отслойку сетчатки и скопление транссудата в субретинальном пространстве. В редких случаях (1-2%) встречается инфильтративная форма ретинобластомы, которая ведет к диффузному истончению сетчатки, накоплению экссудата в передних отделах глаза, развитию передних спаек и псевдогипопиона.
Согласно клинической классификации ретинобластомы по системе TNM, выделяют степени развития первичной опухоли:
- Т1 – ретинобластома занимает до 25% глазного дна
- Т2 – ретинобластома распространяется на площадь более 25%, но менее 50% поверхности сетчатки
- ТЗ – ретинобластома распространяется более чем на половину сетчатки или выходит за ее пределы, но сохраняет интраокулярное расположение
- Т4 – ретинобластома выходит за пределы орбиты.
- N1 – имеются метастазы в регионарных (околоушных, подчелюстных, шейных) лимфоузлах.
- Ml - определяются отдаленные метастазы ретинобластомы в головном мозге, костном мозге, костях, печени и др. органах.
Симптомы ретинобластомы
В клиническом течении ретинобластомы различают четыре последовательные стадии.
I – стадия покоя. В этом периоде субъективные симптомы отсутствуют. При осмотре пораженного глаза выявляется лейкокория (симптом «кошачьего глаза») – белый зрачковый рефлекс, обусловленный просвечиванием опухолевой массы через зрачок. К ранним признакам ретинобластомы относят потерю центрального и бинокулярного зрения, вследствие чего может развиваться косоглазие.
II – стадия глаукомы. Сопровождается воспалительными явлениями в глазу – гиперемией, светобоязнью, слезотечением, развитием иридоциклита и увеита. На фоне опухолевой инвазии отмечается локальный болевой синдром. Разрушение ретинобластомой трабекулярного аппарата приводит к затруднению оттока ВГЖ, увеличению внутриглазного давления и возникновению вторичной глаукомы.
III - стадия прорастания. Характеризуется развитием экзофтальма различной степени выраженности, инвазией мягких тканей орбиты и разрушением ее стенок, прорастанием ретинобластомы в придаточные пазухи и субарахноидальное пространство.
IV – стадия метастазирования. Протекает с выявлением отдаленных диссеминированных очагов в костном мозге, печени, трубчатых костях, головном мозге, костях черепа. Распространение ретинобластомы происходит по мягкой мозговой оболочке, зрительному нерву, лимфогенным и гематогенным путем. На этой стадии страдает общее состояние пациента: развивается интоксикация, слабость, мозговые симптомы (тошнота, рвота, головная боль).
Диагностика ретинобластомы
Дети с семейным анамнезом ретинобластомы должны находиться под постоянным наблюдением офтальмолога. На развитие ретинобластомы обычно указывает триада симптомов: лейкокория, косоглазие, расширение зрачка с ослаблением его реакции на свет. При появлении данных признаков проводится тщательное офтальмологическое обследование ребенка, включающее биомикроскопию, прямую и обратную офтальмоскопию, визометрию, тонометрию, гониоскопию, исследование бинокулярного зрения, экзофтальмометрию, измерение угла косоглазия. При помутнении оптических сред важная роль в выявлении ретинобластомы принадлежит УЗИ глаза.
Интраокулярная биопсия может привести к диссеминации злокачественных клеток внутри глаза, поэтому к ее проведению прибегают только при наличии абсолютных показаний. Для оценки распространенности ретинобластомы используются рентгенография орбиты, рентгенография околоносовых пазух, КТ и МРТ головного мозга, сцинтиграфия печени, остеосцинтиграфия. Для оценки возможного отдаленного метастазирования прибегают к выполнению люмбальной пункции с исследованием цереброспинальной жидкости; пункции костного мозга и исследованию миелограммы.
В процессе диагностики ретинобластому следует дифференцировать от рубцовой ретинопатии, дисплазии сетчатки, гамартом, мягкотканных сарком, метастазов нейробластомы, поражений орбиты при лимфоме и лейкемии.
Дети с ретинобластомой должны быть проконсультированы неврологом и отоларингологом.
Лечение ретинобластомы
Лечение ретинобластомы проводится с учетом стадии опухолевого поражения. При этом может использоваться хирургическое вмешательство, лучевая и лекарственная химиотерапия, лазеркоагуляция, криотерапия, термотерапия. Правильное сочетание этих методов во многих случаях позволяет сохранить глаз и зрение. В случает двусторонней ретинобластомы, в отношении каждого глаза определяется дифференцированная тактика в зависимости от степени его поражения опухолью.
В настоящее время офтальмохирурги и офтальмоонкологи стремятся придерживаться максимально консервативного ведения ретинобластомы. При поражениях переднего участка сетчатки и диаметре опухоли до 7 мм прибегают к криодеструкции ретинобластомы; при поражении задних отделов и размерах опухоли до 4 мм показана фотокоагуляция. Возможно проведение термотерапии – комплексного воздействия на опухоль с помощью микроволновой терапии, ультразвукового и инфракрасного излучения.
При массивном внутриглазном поражении, развитии глаукомы, утрате и невозможности восстановления зрения прибегают к энуклеации глаза с последующим глазопротезированием. При экстраокулярном распространении ретинобластомы показана экзентерация глазницы.
Ретинобластома чрезвычайно чувствительна к лучевому лечению. Лучевая терапия при ретинобластоме позволяет добиться хороших результатов в сочетании с органосохраняющими и хирургическими методами лечения. При этом возможно как наружное дистанционное, так и контактное облучение с помощью аппликаций радиоактивных веществ. Осложнением лучевой терапии может являться развитие постлучевой катаракты, лучевого кератита, ксероза.
Химиотерапия в лечении ретинобластомы используется при массивном внутриглазном поражении, опухолевой инвазии зрительного нерва, региональных метастазах. Наиболее эффективным признано сочетание нескольких цитостатиков (винкристина, этопозида, карбоплатина).
Прогноз и профилактика ретинобластомы
При своевременной диагностике и выявлении ретинобластомы на ранней стадии возможно стойкое излечение пациента с помощью органосохраняющих методов – фотокоагуляции, криотерапии, лучевой терапии. При энуклеации глаза также наблюдается высокая выживаемость, однако данная операция сопровождается потерей глаза как органа зрения и образованием косметического дефекта. Факторами неблагоприятного прогноза ретинобластомы служат прорастание опухоли в зрительный нерв, инвазия хориоидальной оболочки, экстрасклеральное распространение опухоли, двустороннее поражение.
Для профилактики ретинобластомы необходимо медико-генетическое консультирование семей с наследственными случаями рака сетчатки, обследование детей раннего возраста из групп риска.
ОФТАЛЬМОЛОГИЯ
П оражение глаз при болезни Лайма считается достаточно редким явлением. Болезнь Лайма - мультисистемное инфекционное заболевание, вызываемое спирохетой Borrelia burgdorfery. Известно три группы боррелий: собственно B. burgdorfery, B. garinii, B. afzelii. В Европе боррелиоз может быть вызван любой из указанных спирохет. Спектр клинических проявлений болезни, называемой также боррелиозом Лайма, варьирует от явлений эритемы мигранс до артритов, неврологических и кардиологических расстройств. Первый случай внутриглазного боррелиоза был описан в 1985 г.
В 11% случаев на стадии ранней диссеминации инфекции у больных обнаруживаются явления конъюнктивита, однако на этой стадии больные редко попадают к окулисту. К ранним проявлениям относят также такие нейроофтальмологические расстройства, как парез окуломоторных нервов и неврит зрительного нерва, что связано с проникновением спирохет через гематоэнцефалический барьер уже через неделю после инфицирования. На поздних стадиях (через месяцы и годы после начала заболевания) развиваются кератиты и внутриглазные воспалительные поражения. При биомикроскопическом исследовании выявляются весьма необычные признаки, например, рубцовые инфильтраты роговицы, атипические парспланиты, витрииты по типу паутины, выраженные отеки диска зрительного нерва, изменения, подобные пигментному ретиниту. Многие изменения напоминают таковые при сифилитических поражениях глаза.
Глазной боррелиоз распознается крайне редко вследствие позднего появления симптомов и частых случаев серонегативной реакции ELISA.
Можно заподозрить боррелиоз в случае необычной клинической картины внутриглазного воспалительного процесса, но точный диагноз ставится с помощью иммуноблоттинга или путем обнаружения ДНК боррелии. Скрининг всех больных увеитом на предмет выявления боррелиозной этиологии процесса нецелесообразен. При кератитах возможно успешное применение антибиотиков per os, но при наличии пареза окуломоторных нервов и внутриглазных воспалительных изменений требуется назначение антибиотиков внутривенно. Обычно используют цефтриаксон (2 г/сут) или цефотаксим (6 г/сут). Передозировка цефтриаксона может привести к развитию осложнений со стороны желчевыделительной системы.
Karma A, Mikkila H. Ocular manifestations and treatment of Lyme disease. Current Opinion in Ophthalmology 1996;7(111):7-12.
НОВЫЕ ВОЗМОЖНОСТИ В ЛЕЧЕНИИ РЕТИНОБЛАСТОМЫ
И. Лоскутов
I. Loskutov
П рогноз для зрения и жизни больных с ретинобластомой значительно улучшился в последние десятилетия вследствие раннего выявления заболевания и совершенствования методов лечения. Сто лет назад ретинобластома почти всегда приводила к гибели больного. Ведение больного с ретинобластомой должно быть комплексным. Первой и главной целью лечения было и остается сохранение жизни больного, в известной степени вторичным оказывается вопрос сохранения глаза и зрения. Основными методами лечения данной опухоли являются: энуклеация глазного яблока, облучение, лазерное воздействие, криоаппликации, термотерапия, химиотерапия, хеморедукция, хемотермотерапия и экзентерация орбиты.
Проведение энуклеации показано при развитой стадии заболевания, а также при инвазии опухоли в зрительный нерв, хориоидею или орбиту. При вторичной глаукоме, вовлечении плоской части цилиарного тела или передней камеры также производится удаление глазного яблока.
Ретинобластома относится к опухолям, чувствительным к воздействию ионизирующего излучения. Результаты такого лечения во многом зависят от размеров и локализации опухоли, а также возникновения осложнений вследствие облучения (например, ретинопатии). Аргоновая или ксеноновая лазерная фотокоагуляция может быть успешно применена при лечении опухолей маленького размера, расположенных в заднем полюсе. Криотерапия используется для лечения маленьких опухолей, расположенных периферично к экватору.Термотерапия - метод воздействия на опухолевую ткань ультразвуком, микроволновым или инфракрасным излучением. Целью термотерапии является достижение температурного воздействия от 42 до 47 ° С, что ниже порога коагуляции. Комбинация термотерапии и химиотерапии определяется как хемотермотерапия, которая наиболее эффективна при опухолях, расположенных в заднем полюсе глазного яблока.
Хеморедукция - метод уменьшения объема опухолевой ткани для лучшей фокусировки последующего терапевтического воздействия, что делает его менее опасным.
Если заболевание распознано лишь в развитой стадии, на что указывает вовлечение тканей орбиты, то для спасения жизни больного необходимо проведение экзентерации орбиты с последующим курсом химиотерапии и облучения.
Shields C, Shields J, Potter P. New treatment modalities for retinoblastoma. Current Opinion in Ophthalmology 1996;7(111):20-6.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Особенности диагностики нейроэндокринных опухолей

Нейроэндокринные опухоли (НЭО) — это гетерогенная группа новообразований, развивающихся из нейроэндокринных клеток. Такие клетки расположены в различных органах и секретируют биологически активные вещества, эффекты которых обуславливают многообразие клинической картины и трудности диагностики. Прежде чем попасть на прием к онкологу, пациентам зачастую бывают проведены консультации различных специалистов, обращение к которым вызвано симптоматикой новообразования. Ранняя диагностика НЭО в значительной мере зависит от онконастороженности непрофильных клиницистов и, конечно же, от морфологической верификации диагноза — «золотого правила» в онкологии, своеобразной точки отсчета онкологической истории.
Локализация НЭО крайне разнообразна, но чаще всего они обнаруживаются в органах пищеварительной системы (более 50 %): прямая (17,2 %) и тонкая кишка (13,4 %), желудок (6,0 %), поджелудочная железа (6–7 %). НЭО занимают второе место в общей структуре онкологической патологии ЖКТ, уступая лидерские позиции лишь колоректальному раку. Около 27 % случаев НЭО возникают в легких (согласно базе данных Surveillance, Epidemiology, and End Results (SEER) 1975-2016) [1].
Еще недавно обсуждались вопросы включения НЭО в список орфанных заболеваний. Но в настоящее время отмечается увеличение частоты встречаемости этой патологии, в том числе из-за улучшения диагностических возможностей (в частности, распространение гастроскопии, колоноскопии, капсульной эндоскопии).
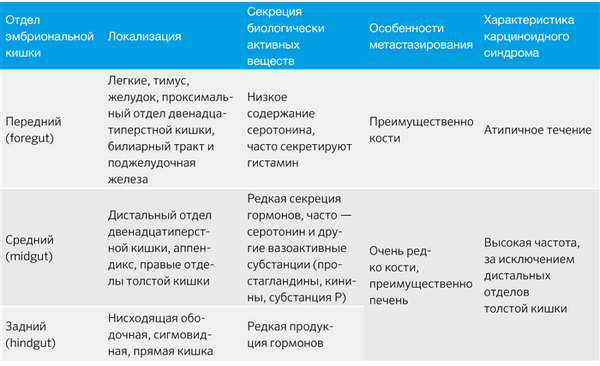
НЭО классифицируют в зависимости от отдела эмбриональной кишечной трубки: из передней, средней и задней кишки (табл. 1) [2].
Табл.1 | Классификация НЭО по эмбриогенезу [2].
Карциноидный синдром — важный клинический признак. В основном, он обусловлен эффектами серотонина, а также брадикинина, гистамина, дофамина и в меньшей степени других биологически активных веществ (БАВ).
Клинические проявления карциноидного синдрома разнообразны. Наиболее часто у пациентов отмечается гиперемия кожи лица, приливы, диарея, боль в животе. У 60 % пациентов отмечают формирование карциноидной болезни сердца, с нарушением работы преимущественно клапанного аппарата правых отделов (стеноз и/или недостаточность легочного и трехстворчатого клапанов). Серьезным осложнением является декомпенсация нарастающей сердечной недостаточности. Морфологическим субстратом служит выраженный диффузный фиброэластоз эндокарда. Возможны появления телеангиоэктазий, одышки, пеллагры, бронхоспазма. Усиливается продукция соединительнотканных компонентов, в частности, коллагена. Это ведет к фиброзированию и стенозу брыжеечных артерий, фиброзирующему стенозу уретры. Ввиду склонности к развитию спаечного процесса в брюшной полости нарастает риск формирования кишечной непроходимости.
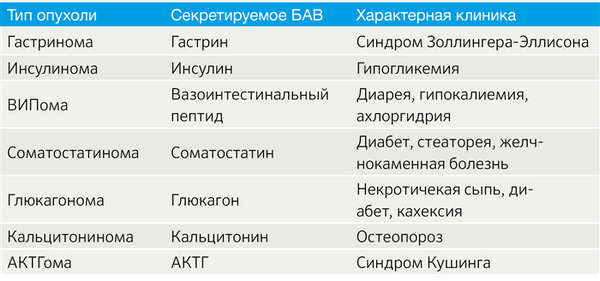
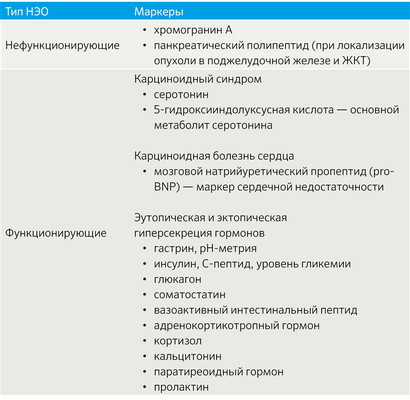
Важным аспектом является функциональный статус опухоли. В зависимости от наличия продукции БАВ выделяют функционирующие (табл. 2) и нефункционирующие новообразования [3].
Табл.2 | Функционирующие НЭО [3].
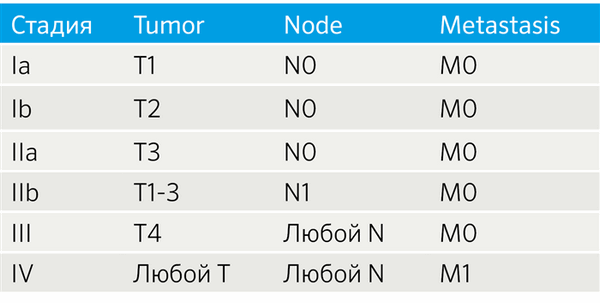
Особенности TNM-классификации определяются локализацией НЭО. НЭО легких стадируются как немелкоклеточный рак легких, для НЭО ЖКТ и поджелудочной железы разработаны рекомендации Европейского общества по изучению НЭО (ENETS) [4]. Также установление стадии TNM для всех анатомических локализаций регламентируется руководством, созданным Американским объединенным комитетом по раковым заболеваниям (the American Joint Committee on Cancer, AJCC) [5, 6]. Так как эти системы не идентичны, возникают вопросы унификации подходов к стадированию. Например, была создана модифицированная система ENETS (mENETS), для диагностики НЭО поджелудочной железы (pNET) (табл. 3) [7].
Табл.3 | Стадирование НЭО поджелудочной железы согласно модифицированной системе ENETS (mENETS) [7].
И вот мы подходим к той черепахе, на которой стоят киты онкологической диагностики. Это, несомненно, гистологическая верификация диагноза. Как и многие опухолевые заболевания, морфологические градации НЭО подвергались различным модификациям, уточнениям, дополнениям. Дискуссии в этой области в итоге привели к созданию 4-ой редакции классификации ВОЗ (2017 год) [8]. Именно она является актуальной на настоящий момент и заключение при проведении патологоанатомическом исследовании должно отвечать введенным в ней понятиям и требованиям.
Параметрами морфологической оценки нейроэндокринных новообразований являются: гистологическое строение опухоли, определение сосудистой и периневральной инвазии, митотический индекс. Несмотря на многообразия источников НЭО, морфологическая картина является сходной (рис. 1) [9].
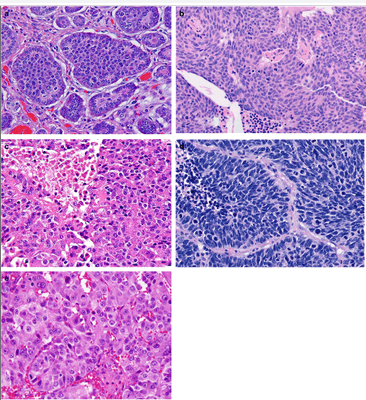
а — НЭО G1 (Grade) подвздошной кишки, б — НЭО G2 легкого (атипичный карциноид), с — НЭО G3 поджелудочной железы, d — мелкоклеточный НЭР легких, е — крупноклеточный НЭР поджелудочной железы. Окраска гематоксилин-эозин [9].
Нейроэндокринное происхождение атипичных клеток доказывает положительная экспрессия так называемых общих нейроэндокринных маркеров. Основные из них это хромогранин А, окрашивающий компоненты нейросекреторных гранул, и пептид синаптофизин, накапливающийся в мелких синаптических везикулах. Также применяется дополнительно установление экспрессии рецепторов соматостатина 2 и 5 типов (SSTR2 и SSTR5). В этом случае возможно определить чувствительность опухолевых клеток к аналогам соматостатина.
Степень злокачественности НЭО определяют на основании двух основных критериев: уровня дифференцированности опухолевых клеток и их пролиферативной активности. Традиционно выделяют три степени злокачественности (grade): G1, G2, G3. Для НЭО ЖКТ и поджелудочной железы введены понятия высокодифференцированных и низкодифференцированных новообразований (или нейроэндокринного рака (карциномы), НЭР). Высокодифференцированные НЭО объединяют G1 (менее 2 митозов на 10 репрезентативных полей зрения (РПЗ) при большом увеличении микроскопа (х400) и индекс Ki-67 ≤ 2%), G2 (2–20 митозов на 10 РПЗ и индекс Ki-67 3–20 %), G3 (> 20 митозов на 10 РПЗ и индекс Ki-67 > 20 %). Grade 3 опухоли разделяют на мелко- и крупноклеточный рак. Опухоли мелкоклеточного типа построены из однотипных клеток округлой, овальной или вытянутой формы, мелкого размера, со скудной цитоплазмой и нечеткими границами. Ядра имеют характерный вид за счет нежного хроматина и невизуализирующихся ядрышек. Определяются массивные некрозы. Крупноклеточные НЭР образованы, соответственно, клетками крупного или среднего размера, с низким ядерно-цитоплазматическим соотношением, выраженной атипией ядер, содержащих гранулярный хроматин и четкие ядрышки. В опухолевой ткани выявляются мультифокальные некрозы, значительное число митозов [8, 9].
Индекс Ki-67 определяют как средний процент окрашенных ядер при учете 500–2000 злокачественно трансформированных клеток (рис. 2) [9].
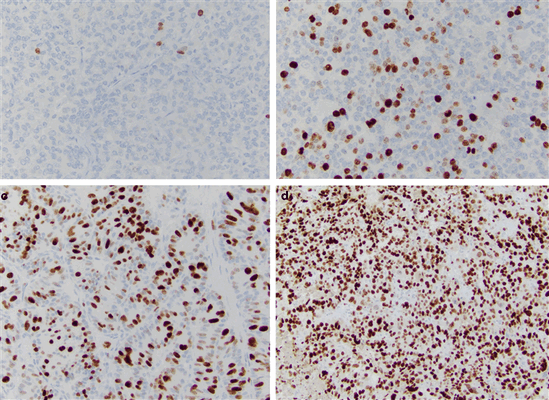
а — НЭО G1 (Grade) подвздошной кишки, б — НЭО G2 легкого (атипичный карциноид), с — НЭО G3 поджелудочной железы, d — мелкоклеточный НЭР легких [9].
Рассмотрим различия понятий НЭО G3 и НЭР при локализации в поджелудочной железе. Несмотря на высокую степень злокачественности НЭО G3 гистологически имеют органоидную модель строения (рис. 3), отсутствие некрозов [10]. При иммуногистохимическом исследовании опухолевая ткань сохраняет экспрессию общих маркеров нейроэндокринной дифференцировки (диффузно и интенсивно определяется экспрессия синаптофизина, зачастую хромогранина А), а также панкреатические экзокринные или эктопические гормоны. Кроме того, в них отсутствует выраженная экспрессия p53 и утрата экспрессии RB (также определяются иммуногистохимически).
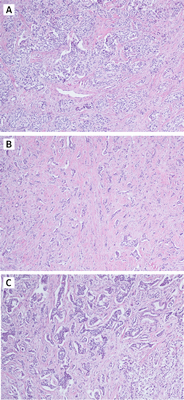
Отмечается наличие хорошо организованной гистоархитектуры: А — органоидный тип; В — псевдотрабекулярный тип; С — крибриформный тип. Окраска гематоксилин-эозин [10].
НЭР поджелудочной железы — это опухоли низкой степени дифференцировки и соответственно высокой степени злокачественности. Экспрессия общих маркеров нейроэндокринной дифференцировки атипичными клетками снижается: синаптофизин определяется слабо или диффузно, хромогранин А также слабо или фокально. Экзокринные гормоны отрицательны в таких опухолях [9]. Часто определяется экспрессия р53, белков ремоделирования хроматина DAXX (death-associated protein 6) и ATRX (АТФ-зависимая хеликаза), потеря экспрессии RB (белок ретинобластомы) и ISL1 (энхансер гена инсулина 1) [11].
Ввиду многообразия секретирующего профиля НЭО биохимическая диагностика включает различные маркеры, комбинируемые с учетом клинической картины (табл. 4).
Табл. 4 | Спектр биохимических маркеров НЭО [2].
Методы лучевой диагностики включают «классические» КТ и МРТ с контрастированием. Для оценки метастатического поражения печени возможно проведение УЗИ органов брюшной полости.
Радионуклидная диагностика играет важную роль в топической характеристике НЭО. Она включает методы специфической метаболической визуализации ( 123 I-MIBG), рецепторной визуализации ( 111 In-октреотид, 68 Ga-DOTA-TOС/DOTA-NOC/DOTA-TATE) и неспецифической метаболической визуализации ( 18 F-FDG, 18 F-DOPA).
123 I-метайодбензилгуанидин (MIBG) является аналогом норадреналина (норэпинефрина). Он накапливается в адренергических тканях и опухолях, происходящих из них. Сцинтиграфия с 123 I-MIBG используется для диагностики нейробластомы, феохромоцитомы, параганглиомы, карциноидов бронха и тонкой кишки [12].
Для рецепторной визуализации применяют 111 In (индий)-октеотид. Он выявляет высокодифференцированные нейроэндокринные опухоли, опухоли из клеток островкового аппарата поджелудочной железы (гастринома, глюкагонома, инсулинома). Также для верификации НЭО ЖКТ применяется соматостатин-рецепторная сцинтиграфия, так как большинство из них имеют рецепторы к соматостатину (SSTR) на поверхности опухолевых клеток (чаще 2 и 5 типа).
Выбор радионуклидного метода связан со степенью дифференцировки опухолевых клеток. Первичная диагностика НЭО Grade 1 и 2 проводится путем ПЭТ/КТ с радиофармпрепаратами (РФП), мечеными галлием 68 (является ПЭТ-радионуклидом). Сродство (аффинитет) РФП к конкретному подтипу трансмембранных рецепторов соматостатина определяет выбор диагностического индикатора (ПЭТ-лиганда, представленного различными модификациями DOTA). Например, для визуализации НЭО, экспрессирующих рецепторы подтипов SSTR2a и SSTR2b, применяют 68 Ga-DOTA-TATE (DOTA-Tyr3-октреотад). 68 Ga-DOTA-NOC (DOTA-1-Nal3-октреотид) выявляет подтипы SSTR3 и SSTR5, 68 Ga-DOTA-ТOC (DOTA-Tyr3-октреотид) — рецепторы SSTR5 [13].
При отсутствии возможности проведения данного исследования следует выполнить однофотонную эмиссионную компьютерную томографию (ОФЭКТ)/КТ (гибридный метод визуализации) с соматостатин-рецепторным радиофармпрепаратом.
Для недифференцированных НЭО Grade 3 и НЭР при отрицательных результатах соматостатин-рецепторной сцинтиграфии рекомендуется ПЭТ неспецифическая метаболическая визуализация с использованием других РФП. В частности, ПЭТ/КТ c 18F-фтордезоксиглюкозой (18F-ФДГ), которая неэффективна при высокодифференцированных НЭО [14]. Также рассматривают применение 18F-L–DOPA (дигидроксифенил-аланин) — меченого предшественника допамина, который эффективен для обнаружения медуллярного рака щитовидной железы, НЭО, параганглиомы и феохромоцитомы [15].
Современные классификации НЭО в значительной мере основаны на общей морфологии, которую эти новообразования демонстрируют в различных анатомических участках. Закономерно предположить, что такая структурная схожесть является результатом общей «нейроэндокринной» мультигенной программы, стимулирующей дифференцировку нейроэндокринных клеток. Но схожесть не означает идентичность, и несомненно существующая тканеспецифичность нейроэндокринных клеток диктует характерною индивидуальную гормональную продукцию. Профиль экспрессии БАВ атипичными клетками определяет клиническую картину и прогноз заболевания. Поэтому важно иметь возможность точно определяет источник опухоли. С использованием все расширяющихся диагностических возможностей такой подход становится реальным, формируя персонализацию терапевтических стратегий в нейроэндокринной онкологии.
Читайте также:
