Операции при травме вен грудной полости. Хирургическая тактика
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Сегодня проблема травмы грудной клетки остается одной из самых актуальных в современной хирургии и травматологии. Интенсивность современной жизни, насыщенность ее техникой и высокими скоростями, сложная криминогенная обстановка обусловливают особенности травматизма в наши дни.
Принципиальным для определения хирургической тактики является деление ранений на проникающие и непроникающие. Критерием служит повреждение париетальной плевры. Проникающие раны делят на две группы: с повреждением и без повреждения внутренних органов. Особо выделяют торакоабдоминальные ранения, при которых повреждается диафрагма и раневой канал проникает в плевральную или брюшную полость. К торакоабдоминальным необходимо относить также внеплевральные ранения, проникающие в брюшную полость. Отдельной группой, по рекомендации М.Абакумова, выделяют абдоминоторакальные ранения, при которых раневой канал может проходить либо через обе серозные полости, либо заканчиваться внеплеврально.
Частные вопросы общей классификации закрытой травмы конкретизируют в отдельных классификациях переломов ребер, пневмоторакса и гемоторакса, огнестрельных ранений.
Переломы ребер подразделяют на единичные, множественные и флотирующие; на односторонние и двусторонние. Кроме того, различают неосложненные и осложненные (подкожной эмфиземой, гемотораксом, пневмотораксом).
Классификация пневмоторакса и гемоторакса по объему воздуха или жидкости в плевральной полости имеет большое значение для определения хирургической тактики. Различают ограниченный (легкое сдавлено на 1/3 объема), средний (на половину объема), большой (более чем на половину объема) и тотальный (коллапс всего легкого) пневмоторакс. Аналогичные принципы положены в основу классификации гемоторакса П.Куприянова. Малый гемоторакс - скопление крови в плевральном синусе (200-500 мл), средний - скопление крови до угла лопатки (500-1000 мл), большой - скопление крови выше угла лопатки (более 1 л). Кроме того, различают гемоторакс при состоявшемся кровотечении и с продолжающимся кровотечением. Критерием различия служит проба Рувиллуа - Грегуара: при продолжающемся кровотечении кровь, взятая из плевральной полости, сворачивается.
Повреждения, непосредственно угрожающие жизни, могут привести к летальному исходу за несколько минут вследствие расстройства внешнего дыхания (обструкция дыхательных путей, пневмоторакс, массивный гемоторакс, патологическая подвижность грудной стенки) или расстройства кровообращения (кровотечение из магистральных сосудов, тампонада сердца, сдавление магистральных сосудов), шок.
Повреждения, потенциально опасные для жизни, без своевременного лечения обычно приводят к летальному исходу, однако при этих состояниях имеется несколько часов для постановки точного диагноза и разработки оптимальной тактики лечения. К ним относят разрывы пищевода, ранения и разрывы диафрагмы, легкого, ушиб сердца, ушиб легкого, эмфизему мягких тканей и клетчатки средостения.
Важным дополнением к любой классификации повреждений грудной клетки являются шкалы оценки тяжести травмы. Наиболее распространенными являются шкалы Revised Trauma Score, Injury Severity Score, Abbreviated Injury Scale и система TRISS.
Переработанный индекс травмы (Revised Trauma Score, RTS) - физиологическая оценка тяжести травмы, ведущаяся на основании комплекса объективных критериев: шкалы комы Глазго, систолическому артериальному давлению и частоте дыхания. Показатель является достоверным и точным в прогнозе исхода травмы. Значения RTS варьируют от 0 до 7,8408. RTS хорошо коррелирует с прогнозом вероятности выживания, при этом определяется порог RTS=4 (вероятность выживания - 60,5%), ниже которого пациент считается тяжелым.
Индекс тяжести травмы (Injury Severity Score, ISS) - анатомический показатель - оценивается при установленном характере и объеме повреждений. В основе его лежит сокращенная шкала травмы пересмотра 1990 г. (Abbreviated Injury Scale, AIS-90). AIS может принимать значения от 1 до 6 для каждого поврежденного органа, при этом 1 - самое легкое повреждение, 5 - самое тяжелое, при котором пациент может выжить, 6 - несовместимое с жизнью. AIS определяется для травмы соответствующего органа по таблицам. ISS представляет собой сумму квадратов трех наивысших показателей AIS для каждого из шести отделов тела - голова, лицо, грудь, живот, конечности (включая таз) и наружные повреждения. В случае если один из AIS равен 6, ISS автоматически равняется 75 (максимальное значение). ISS в диапазоне 0-14 соответствует малой травме, 16-66 - большой травме и 75 - несовместимой с жизнью.
Система TRISS признана международным "золотым стандартом" оценки тяжести травмированного пациента. Она представляет собой комбинацию анатомического показателя тяжести травмы (ISS), физиологического показателя тяжести травмы (RTS), возраста пострадавшего и механизма травмы. Чувствительность, специфичность и процент правильно прогнозируемых исходов для системы TRISS составляют 50,8%, 97,1% и 90,9% соответственно.
Описанные классификации и способы оценки тяжести состояния позволяют сформулировать основные принципы оказания хирургической помощи пострадавшим с травмой грудной клетки. Вне зависимости от вида травмы и варианта хирургической тактики при лечении пострадавших следует соблюдать лечебно-диагностический алгоритм, включающий: 1) устранение боли; 2) раннее и адекватное дренирование плевральной полости; 3) мероприятия, направленные на скорейшее расправление легкого; 4) восстановление и поддержание проходимости дыхательных путей; 5) герметизацию и стабилизацию грудной стенки; 6) окончательную остановку кровотечения и восполнение кровопотери; 7) инфузионную, антимикробную и поддерживающую терапию.
Операции при травме вен грудной полости. Хирургическая тактика
Тактика при травме сосудов грудной полости. Сортировка пациентов
Торакотомия в отделении неотложной помощи при травме крупных сосудов грудной полости. Торакотомия в отделении неотложной помощи у больных, имеющих признаки жизни и гемодинамический коллапс, может выявить повреждения крупных грудных сосудов. Эти повреждения требуют вмешательств, позволяющих выиграть время, дающих быструю остановку кровотечения, позволяющих провести реанимацию с переводом в операционную для окончательного вмешательства.
Например, кровотечение из повреждения подключичных сосудов можно остановить путем тампонирования или пережатия у вершины грудной клетки, или путем введения больших катетеров с раздуваемым баллоном на конце. Профузное кровотечение из ворот легкого может быть временно остановлено проксимальным пережатием ворот или перекрутом легкого на 180° после пересечения нижней легочной связки.
Торакотомия трубкой. Если при рентгенографии органов грудной клетки выявляется значительный гемоторакс, плевральная дренажная трубка подключается к резервуару для аутогемотрансфузии. Начальный «прорыв» большого объема крови (> 1500 мл) или значительное продолжающееся кровотечение (> 200-250 мл в час) может указывать на повреждение крупного сосуда и считается показанием к срочной торакотомии.
Внутривенный доступ и назначение жидкости при травме крупных сосудов грудной полости. В настоящее время, если пациент не находится в крайнем состоянии, внутривенные катетеры большого диаметра до операции не применяют. Если подключичный венозный катетер требуется пациенту с подозрением на повреждение подключичного сосуда, то его устанавливают на противоположной стороне. Лечение тяжелого шока должно включать переливание крови.
Однако быстрые вливания чрезмерных объемов крови или кристаллоидных растворов до операции могут увеличить кровяное давление до такого уровня, что защитный мягкий периваскулярный сгусток будет размыт и разовьется профузное фатальное кровотечение. Принципы допущения умеренной гипотензии (систолическое кровяное давление 60-90 мм рт. ст.) и ограничения назначения жидкости до достижения хирургической остановки кровотечения являются принципами лечения при разрывах аневризм брюшной аорты и должны также применяться при остром повреждении крупного сосуда грудного полости.
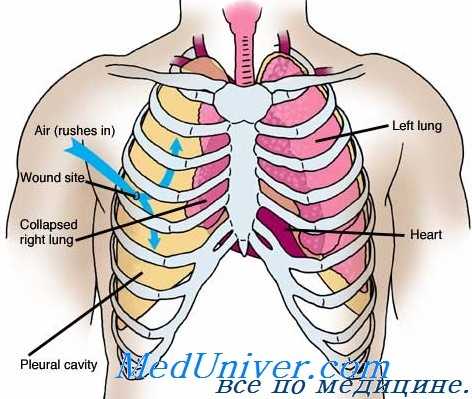
Агрессивное дооперационное восстановление объема жидкости усугубляет послеоперационные дыхательные осложнения и может способствовать увеличению смертности по сравнению с ограничением жидкости. При проникающей и закрытой травме грудной клетки часто бывают сочетанные ушибы легких, что дает дополнительное обоснование вливания кристаллоидных растворов до операции.
Бета-блокада при травме крупных сосудов грудной полости. Фармакологическое уменьшение dP/dT остается основной целью лечения при расслоении аорты, с тех пор, как впервые было описано Wheat et al. в 1965 г. Основываясь на гистопатологическом подобии между расслоением и закрытой травмой аорты, этот принцип был впервые применен к уменьшению dP/dT у пациентов с травмой в 1970 г.
«Скрининговая» КТ по поводу повреждения сосудов груди. Спиральная КТ груди рекомендуется многими диагностами как скрининговый метод для выявления гематомы средостения, обычно связанной с повреждением аорты. Кроме того, при спиральной КТ различные другие изменения стенки и просвета аорты указывают на ее повреждение. Очень часто первичная рентгенография уже дает основания для подозрения на гематому средостения.
Некоторые клиницисты настаивают на дополнительном скрининге с помощью КТ для обоснования проведения диагностической артериографии. Хотя некоторые хирурги и диагносты разработали «действия» и уровень выполнения операций только по данным КТ скрининга, большинство хирургов настаивают на артериографической навигации для определения специфического повреждения и любых неожиданных сосудистых аномалий. Даже когда КТ используется как диагностический тест, это исследование ограничивается повреждениями проксимальной нисходящей грудной аорты.
Если гематома средостения визуализируется на КТ, формальная аортография все еще показана, чтобы точно определить место (места) повреждения (повреждений) и выявить любые сосудистые аномалии, которые потребуют изменения хирургического подхода. Поскольку хирурги очень осторожны в определении показании к операциям на магистральных сосудах на основе данных только обычной КТ, в большинстве случаев это исследование является просто дорогим дублированием первичной рентгенографии органов грудной клетки и задерживает аортографию.
Чтобы помочь хирургу поставить диагноз и лечить пациента с повреждением аорты можно построить алгоритм. Трехмерная реконструкция изображений с высоким разрешением добавляет к базе знаний очень немного. Чреспищеводная эхокардиография и внутрисосудистое УЗИ также малоинформативны при диагностике повреждения грудной аорты. Магнитно-резонансная ангиография может дать сходную детализацию, но для таких потенциально нестабильных пострадавших в настоящее время этот метод исследования не практикуется.
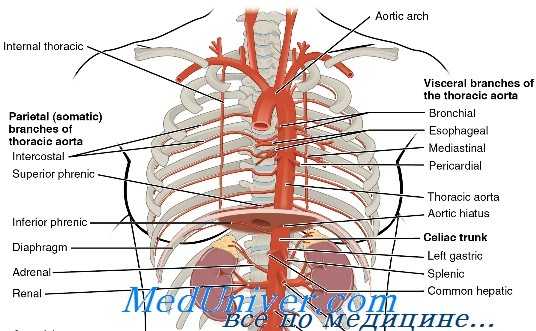
Катетерная артериография при травме сосудов грудной полости
При проникающей травме груди катетерная ангиография показана в случаях подозрения на повреждения аорты, безымянных, сонных или подключичных артерий. Для проксимальной и дистальной остановки кровотечения из этих сосудов требуются различные грудные разрезы.
Поэтому артериография показана для локализации повреждения и планирования адекватного разреза. Близость траектории ранящего снаряда к плечеголовным сосудам, даже без каких-либо физикальных признаков сосудистого повреждения, является показанием для артериографии. Хотя аортография может также быть полезной у гемодинамически устойчивых пациентов с подозрением на проникающее повреждение аорты, нужно признать ее ограничения в этом случае. «Отрицательная» аортограмма может дать ложное чувство безопасности, если разрывы временно «заклеились» или если столб контраста в аорте перекрывает небольшую область экстравазации.
Поэтому должны быть предприняты усилия, чтобы получить снимки предполагаемой зоны повреждения в проекции по касательной.
После закрытой травмы возможность повреждения крупного сосуда грудной полости, а исходя из этого и необходимость аортографии, определяется на основании:
1) механизма повреждения,
2) физикального исследования,
3) стандартной рентгенографии грудной клетки или
4) скрининговой КТ.
С учетом присущих каждому фактору ограничений целесообразнее рассматривать их в комплексе. Были описаны травматические разрывы аорты при достаточно невинных механизмах, включая автоаварии на низкой скорости (< 15 км/ч) с раскрытием подушки безопасности и удары между лопаток для смещения инородного тела в пищеводе.
К тому же, средостение выглядит нормально на рентгенограмме грудной клетки при поступлении у 50% пациентов с повреждениями сосудов груди вследствие закрытой травмы без каких-либо внешних физикальных признаков повреждения и у 7% пациентов с закрытыми травмами аорты и плечеголовных артерий.
Торакоскопия при травме крупных сосудов грудной клетки
Торакоскопия в прошлом использовалась выборочно у больных с проникающей травмой груди, чтобы осмотреть средостение, перикардиальный мешок, грудную стенку, диафрагму и легкое. КТ заменила торакоскопию в оценке траектории с подозреваемым пересечением средостения.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Хирургическое лечение травм сосудов грудной полости. Тактика
Показания к срочному направлению в операционную для торакотомии включают гемодинамическую неустойчивость, значительное кровотечение из плевральных дренажных трубок и рентгенографическое подтверждение быстро расширяющейся гематомы средостения.
Подготовка к операции при травме крупных сосудов грудной полости. Пациенты и их семьи должны быть поставлены в известность относительно возможности неврологических осложнений — параплегии, инсульта и повреждений плечевого сплетения — после хирургической реконструкции крупных сосудов грудной полости. Важна тщательная документация дооперационного неврологического статуса.
При любым подозрении на повреждение сосудов перед операцией назначается профилактическая антибиотикотерапия. У гемодинамически устойчивых пациентов введение жидкости ограничивается до остановки кровотечения в операционной. Должно быть подготовлено устройство для аутогемотрансфузии. При индукции анестезии избегают значительных колебаний кровяного давления; при всей нежелательности глубокой гипотензии, эпизоды гипертензии могут привести к сходным катастрофическим последствиям.
Оперативный подход к повреждению крупного сосуда зависит как от общей оценки пациента, так и от специфического повреждения. Начальные шаги расположения пациента и выбора разреза особенно важны при операции по поводу повреждений крупных сосудов, поскольку соответствующая экспозиция обязательна для проксимального и дистального контроля сосуда. Обработка и ограничение операционного поля должны обеспечить доступ от шеи до коленей для действий при непредвиденных обстоятельствах. У гипотензивного пациента с невыявленным повреждением основа операции по поводу травмы груди — левая переднебоковая торакотомия в положении пациента на спине. У стабильных пациентов дооперационная артериография может диктовать оперативный доступ другим разрезом.
Необходимы адекватные протезирующие материалы. Наряду с тем, что проявление инфицирования синтетического трансплантата — псевдоаневризма, трансплантат из большой подкожной вены нижней конечности — это омертвевшая трубка из коллагена, восприимчивая к бактериальной коллагеназе, которая может вызвать растворение трансплантата с острым разрывом и бесконтрольным кровотечением. Поэтому для сосудов более 5 мм предпочтителен синтетический трансплантат, особенно в потенциально инфицированных ранах. Однако из-за соображений проходимости трансплантат из большой подкожной вены, возможно, применим при необходимости меньшего калибра. Для хрупких сосудов, таких как подключичная артерия и аорта у молодых людей, хорош мягкий трикотажный дакроновый трансплантат. Промывание материала трансплантата антибиотиком помогает предотвратить последующую инфекцию.
Ограничение последствий повреждения. Пациентам с сильно сниженными физиологическими резервами для выживания часто необходимо ведение для ограничения последствий. Существует два варианта подхода в грудной полости:
1) радикальная коррекция повреждений с использованием быстрой и простой техники, которая восстанавливает физиологию для выживания в ходе единственной операции и
2) сокращенная торакотомия с восстановлением физиологии для выживания с плановой повторной операцией для окончательной коррекции. Кровотечения вследствие тяжелых сосудистых повреждений в области ворот можно быстро остановить, выполнив пульмонэктомию с помощью сшивающих устройств.
Временная перевязка сосуда или установка внутрисосудистых шунтов может остановить кровотечение, пока последующая коррекция ацидоза, гипотермии и коагулопатии не позволит возвратить пациента в операционную.
Закрытие торакотомии через все слои более гемостатично, чем использование зажимов для операционного белья. Для временного закрытия срединной стернотомии в случаях с сопутствующей дисфункцией сердца может использоваться «мешок Боготы».
Об изолированном повреждении надпеченочной или верхней полой вены сообщают нечасто. Повреждение любой локализации связано со значительной частотой сопутствующих травм органов, вызывая смертность более 60%. Повреждение внутригрудной нижней полой вены создает гемоперикард и тампонаду сердца.
Выделение грудной части нижней полой вены очень сложно, пока пациент не переводится на полное искусственное кровообращение с нижней канюлей, введенной через пах в брюшной отдел нижней полой вены. Восстановительные манипуляции облегчаются правой атриотомией и внутрикавальной баллонной окклюзией, чтобы предотвратить проникновение воздуха в канюлю и массивный возврат крови к сердцу, кроме как через печеночные вены.
Восстановление производится изнутри полой вены через правое предсердие. Повреждения верхней полой вены устраняются путем боковой венорафии. Иногда необходим внутрикавальный шунт." При сложных повреждениях можно безопасно использовать заплатку из ПТФЭ или вставку из дакронового трубчатого трансплантата, что более целесообразно, чем отнимающее много времени создание составного трансплантата из подкожной вены ноги.
Тактика при повреждении легочных вен
Повреждение легочных вен трудно лечить через передний разрез. При профузном кровотечении может потребоваться временная окклюзия ворот целиком. Если нужна перевязка легочной вены, то должна быть резецирована адекватная часть легкого. Повреждения легочных вен часто связаны с сопутствующими повреждениями сердца, легочной артерии, аорты и пищевода.
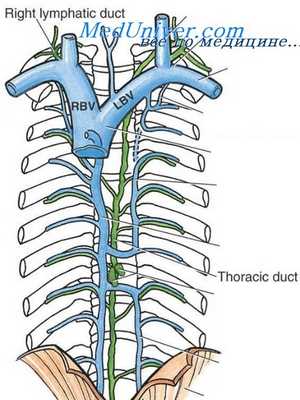
Тактика при повреждении подключичных вен
Оперативное выделение подключичных вен аналогично описанному для повреждений подключичной артерии: срединная стернотомия с продолжением на шею при правосторонних повреждениях и левосторонняя переднебоковая торакотомия с отдельным надключичным разрезом при левосторонних повреждениях. В большинстве случаев требуется или боковая венорафия, или перевязка.
Тактика при травме непарной вены
Непарная вена обычно не рассматривается, как крупный сосуд грудной полости, но из-за размера и силы потока повреждения считается потенциально опасно.45 Проникающие раны в области апертуры грудной клетки могут создать комбинацию повреждений, вовлекающих непарную вену, безымянную артерию, трахею или бронх и верхнюю полую вену. При этих сложных повреждениях очень высокая смертность и особые сложности для контроля при доступе через срединную стернотомию.
Для успешного восстановления часто необходимы комбинированные разрезы и доступы. Травмированную непарную вену лучше всего перевязать с прошиванием с обеих сторон повреждения. Следует определить и исключить сопутствующие повреждения пищевода и бронха.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Хилоторакс ( Хилезный плеврит )
Хилоторакс – это патологическое скопление лимфатической (хилезной) жидкости в полости плевры, возникающее вследствие лимфореи из грудного протока. Развитие хилоторакса сопровождается одышкой, прогрессирующим ухудшением самочувствия, коллаптоидным состоянием, истощением, дыхательной недостаточностью. Хилоторакс диагностируется по клинико-анамнестическим данным, результатам рентгенографии, торакоцентеза, цитологической оценки хилезной жидкости, торакоскопии. Лечение хилоторакса включает повторные пункции или дренирование плевральной полости для удаления хилуса, при упорной лимфорее - перевязку грудного лимфатического протока, плевроперитонеальное шунтирование, плевродез, наложение лимфовенозного анастомоза и др.
МКБ-10
Общие сведения
Хилоторакс - достаточно редкая патология, которая развивается в результате нарушения целостности грудного лимфатического протока и поступления в полость плевры циркулирующей по нему лимфатической (хилезной) жидкости. Хилоторакс может сопровождаться значительной лимфореей (истечением лимфы) - до 4-5 л в сутки и приводить к глубоким респираторным, обменным и иммунологическим нарушениям в организме, представляющим угрозу для жизни пациента в связи с потерей жиров, белков, витаминов, электролитов, лимфоцитов.
Хилоторакс отмечается во всех возрастных группах, в т ч. и у новорожденных. В клинической практике с хилотораксом приходится сталкиваться специалистам в области торакальной хирургии, травматологии, кардиохирургии, гастроэнтерологии, онкологии, фтизиатрии, флебологии и лимфологии.
Причины
Хилоторакс является вторичным заболеванием или осложнением, связанным с патологией лимфатических сосудов. В зависимости от этиологических факторов различают следующие виды хилоторакса: врожденный, травматический и нетравматический. Также выделяют идиопатический хилоторакс, развивающийся у курильщиков с многолетним стажем. Возможные причины:
- Врожденные патологии. Хилоторакс, проявляющийся в период новорожденности и в детском возрасте, может быть обусловлен наследственной атрезией грудного лимфатического протока, наличием свища между его нижним отрезком и плевральной полостью. При первичном персистирующем хилотораксе плода не всегда возможно установить явную причину заболевания (в редких случаях это могут быть наследственные лимфангиэктазии).
- Ятрогенные повреждения. Ятрогенный хилоторакс развивается при механическом повреждении грудного лимфатического протока или его главных ветвей во время оперативных вмешательств (торакальных, кардиохирургических, абдоминальных, спинальных), диагностических процедур (транслюмбальной артериографии, катетеризации подключичной вены или левых отделов сердца, эзофагоскопии)
- Травмы. Травматический хилоторакс - результат тупой травмы или проникающего ранения грудной клетки и области шеи. При повреждении грудного лимфатического протока выше уровня V-VI грудных позвонков формируется левосторонний хилоторакс, ниже – правосторонний. В основе идиопатического хилоторакса лежит спонтанный разрыв стенки лимфатического сосуда при кашле и повышении давления в наддиафрагмальной области.
- Опухоли. Хилоторакс нетравматического генеза часто возникает при наличии различных доброкачественных и злокачественных новообразований, затрагивающих лимфатическую систему области средостения и шеи (медиастинальной злокачественной неходжкинской лимфомы, доброкачественной лифангиомы протока, лимфангиоматоза средостения, рака плевры).
- Заболевания органов грудной и брюшной полости. К развитию хилоторакса может приводить внутригрудной туберкулез и саркоидоз, медиастинит, восходящий лимфангит, амилоидоз, диафрагмальная грыжа и др. Скопление хилезной жидкости в плевральной полости может отмечаться при синдроме верхней полой вены, сопровождающемся повышением венозного давления и гипертензией в системе грудного лимфатического протока. Иногда хилоторакс может быть результатом распространившегося хилезного асцита при сочетанном лимфангиолейомиоматозе легких, средостения, органов брюшной полости и забрюшинной клетчатки.
Псевдохилоторакс развивается вследствие хронизации плеврального выпота (при туберкулезе, ревматоидном артрите). Псевдохилезный экссудат имеет мутный молочно-белый цвет со своеобразным опалесцирующим блеском и высоким содержанием холестерина.
Патогенез
Хилезная жидкость имеет беловатую окраску, содержит большое количество хиломикронов, являющихся основной транспортной формой триглицеридов, холестерина и экзогенных жирных кислот. Хиломикроны образуются в эпителиальных клетках слизистой кишечника; после всасывания по лимфатическим путям поступают в грудной лимфатический проток и далее в систему кровообращения. При хилотораксе, кроме высокого содержания липидов (более 1,1 ммоль/л), в плевральном хилезном экссудате наблюдается превышение общего количества клеточных элементов (более 1000 в мкл) и лимфоцитов (более 90 %).
Симптомы хилоторакса
Для послеоперационного хилезного плеврита характерно постепенное развитие: это связано со щадящим режимом питания в реабилитационный период, незначительным количеством лимфы, небыстрым ее проникновением в плевральную полость. Поэтому послеоперационный хилоторакс, как правило, распознается лишь на 2-10 сутки после оперативного вмешательства. Клинические проявления возникают тогда, когда объем хилезного выпота достигает 200 и более мл.
Первым признаком служит одышка, которая по мере нарастания хилоторакса может прогрессировать до дыхательной недостаточности. Отмечается тяжесть в соответствующей половине грудной клетки, тахикардия, гипотония, развитие коллаптоидного состояния. В отличие от экссудативного плеврита, для хилоторакса нетипичны боли в грудной клетке и гипертермия, поскольку лимфа не вызывает раздражения плевры и благодаря своим бактериостатическим свойствам способна длительно не инфицироваться.
Критической является лимфорея до 1,5-2 л в день, т. к. вместе с лимфой теряется значительное количество белка, жиров, электролитов, лимфоцитов. Длительное или массивное истечение лимфы вызывает развитие метаболических нарушений и иммунодефицита, истощение пациента, поэтому может привести к его гибели.
Диагностика
Физикальные данные при хилотораксе напоминают признаки плеврита. Определяется притупление перкуторного звука и ослабление дыхания на стороне, соответствующей поражению. Данные физикального обследования уточняются с помощью инструментальной диагностики:
- Лучевые методы.Рентгенография легких определяется наличие выпота в плевральной полости, поджатие легкого и смещение средостения. Для выяснения причин хилоторакса необходимо проведение УЗДГ лимфатических сосудов, лимфангиографии, лимфосцинтиграфии и КТ грудной клетки.
- Диагностическая плевральная пункция. Проводится на основании рентгенологической картины и данных УЗИ плевральной полости. При хилотораксе получают хилезную жидкость молочно-белого цвета. Анализ плеврального выпота обнаруживает маслянистый характер экссудата, типичное для лимфы высокое содержание лимфоцитов, триглицеридов, общего количества клеточных элементов.
- Анализы крови. При хилотораксе в крови нарастает лимфопения и гипопротеинемия.
- Инвазивная диагностика. Для выяснения точной причины нетравматического хилоторакса может потребоваться проведение биопсии лимфоузла, плевры, ткани легкого, диагностической торакоскопии или медиастиноскопии с морфологическим исследованием биопсийного материала.
Лечение хилоторакса
Консервативная тактика
Лечение начинают с консервативных методов: с их помощью удается достичь спонтанного прекращения лимфореи почти у 50% пациентов с малосимптомным или бессимптомным хилотораксом. При консервативном ведении хилоторакса производят дренирование плевральной полости с установкой постоянного дренажа или серию плевральных пункций с эвакуацией хилезной жидкости. Тем самым достигается декомпрессия легкого и органов средостения, уменьшение дыхательных расстройств.
Для уменьшения выработки хилуса больного полностью переводят на парентеральное питание или назначают высококалорийную диету с ограничением жиров. С целью коррекции гипопротеинемии и электролитных расстройств при хилотораксе проводится инфузионная терапия белковыми и солевыми препаратами. Для рассасывания выпота успешно используется внутривенное введение соматостатина.
Хирургическое лечение
При безуспешности консервативных мероприятий и продолжающейся лимфорее целесообразен переход к хирургической тактике. Основными видами операций, выполняемыми при хилотораксе, являются:
- плевроперитонеальное шунтирование;
- перевязка грудного лимфатического протока выше и ниже фистулы;
- облитерация плевральной полости тальком (плевродез);
- наложение лимфовенозного анастомоза.
Описаны успешные случаи эмболизации лимфатического протока у взрослых пациентов. При хилотораксе, обусловленном туберкулезным процессом, показано специфическое лечение; при опухолевой этиологии – химиолучевая терапия.
Прогноз и профилактика
Летальность при хилотораксе составляет от 15 до 50%. Прогностически неблагоприятно течение хилоторакса при злокачественных новообразованиях грудной полости. При своевременной диагностике и комплексном лечении травматического хилоторакса в большинстве случаев удается достичь положительных результатов.
Предупреждение ятрогенного хилоторакса заключается в осторожном и оправданном проведении диагностических манипуляций, инвазивных лечебных процедур, оперативных вмешательств. При травмах грудной клетки всегда необходимо помнить о возможности повреждения грудного лимфатического протока и развития хилоторакса. Профилактика идиопатического хилоторакса диктует необходимость отказа от курения.
Читайте также:
- Диэнцефально-гипофизарная кахексия (болезнь Симмондса): этиология, клиника, лечение
- Клиника и диагностика отравления диметилформамидом (ДМФ)
- Лабиринтиты гематогенные. Диагностика и лечение гематогенных лабиринтитов
- Злокачественная фиброзная гистиоцитома кости - лучевая диагностика
- Причины туберкулезного менингита. Спинномозговая жидкость при туберкулезном менингите
