Операция при повреждении почечной артерии, вены. Тактика
Добавил пользователь Евгений Кузнецов Обновлено: 08.01.2026
Аневризмы висцеральных артерий (АВА) встречаются довольно редко и в большинстве наблюдений являются диагностической находкой при обследовании больного. По данным мировой литературы, частота АВА при аутопсиях составляет от 0,01 до 0,2% [8]. АВА классифицируются по происхождению: врожденные и приобретенные; по морфологии: истинные и ложные; по форме: мешотчатые и веретенообразные [1, 2]. Наиболее часто из АВА встречаются аневризмы селезеночной артерии (60-80%), затем следуют аневризмы печеночной артерии (20%), аневризмы гастродуоденальной, панкреатодуоденальной артерий, артерии поджелудочной железы (6%); реже наблюдаются аневризмы верхней брыжеечной артерии (5,5%), чревного ствола (4%); аневризмы артерий других локализаций встречаются менее чем в 4% наблюдений [2, 9]. Особняком стоит проблема диагностики и лечения аневризм почечных артерий, встречающихся гораздо чаще и занимающих второе место после аневризм селезеночной артерии [6].
Этиология АВА довольно широка. Причинами появления истинных АВА являются атеросклероз, фибромышечная дисплазия, нарушение в строении коллагеновых волокон и часто встречающееся разрушение медии сосудистой стенки, выражающееся в потере или фрагментации эластиновых нитей и уменьшении мышечных волокон. Однако, по данным литературы, атеросклеротические изменения сосудистой стенки рассматриваются как вторичные проявления. Псевдоаневризмы появляются вследствие травматического повреждения сосудистой стенки, вызванного в том числе ятрогенией, инфицированием, воспалением или васкулитами. Изменение структуры окружающих тканей также способствует развитию АВА. Наглядным примером является неблагоприятное воздействие ферментативной системы поджелудочной железы на окружающие ткани при развитии панкреатита [10].
Аневризмы селезеночной артерии (АСА)
АСА встречаются чаще всего. Для АСА характерна четкая связь с половой принадлежностью пациента, у женщин они встречаются в 4 раза чаще, чем у мужчин [11]. Данное соотношение объясняется агрессивным воздействием на сосудистую стенку селезеночной артерии повышенного уровня эстрогенов [9]. Среди женщин с АСА 40% являются повторнородящими [11] и у 10% выявляются деструктивные изменения печени с исходом в цирроз и развитием портальной гипертензии, приводящей к повышению давления в бассейне селезеночной артерии [11]. Фибродисплазия как основной фактор появления АСА отмечается в 2% наблюдений [11] в сочетании с изменениями в структуре почечных артерий. Псевдоаневризмы селезеночной артерии, как правило, возникают в результате развития панкреатита и панкреатических псевдокист. Как правило, АСА достигают 4 см в диаметре, мешковидные, протекают асимптомно и располагаются в средней или дистальной трети селезеночной артерии [10]. Гораздо реже встречаются веретенообразные АСА. Частота разрывов АСА зависит от размера аневризм и достигает 12% с летальностью 36% [5]. Разрывы АСА во время беременности, часто происходящие в III триместре, являются катастрофой и приводят к смерти плода и матери в 70-90% наблюдений [10].
Развернутая клиническая картина при АСА проявляется, как правило, при разрыве. Пациенты в момент разрыва АСА ощущают острую боль в области левого подреберья с иррадиацией в подлопаточную область, что сопровождается выраженной гипотонией. Начинающийся разрыв АСА происходит изнутри в толщу аневризматического мешка с последующим разрывом внешней оболочки и кровоизлиянием в брюшную полость; описанный процесс известен под названием «феномен двойного разрыва» [10].
В большинстве наблюдений АСА можно визуализировать при плановой рентгенографии органов грудной клетки как сосудистый кальцинат, имеющий вид круга [11]. Диагностика АСА дополняется применением мультиспиральной компьютерной томографии, а также селективной ангиографии.
Хирургическое лечение АСА сводится к резекции аневризматического мешка, перевязке селезеночной артерии и спленэктомии при больших размерах аневризматического мешка и расположении в воротах селезенки. После спленэктомии образовавшееся пространство заполняют большим сальником [11]. Дистальная панкреатотомия может быть выполнена при расположении аневризмы в паренхиме поджелудочной железы. Сохранение селезенки без реконструкции артериального сегмента может привести к инфаркту этого органа с развитием абсцесса. В случае возможности реконструкции производят резекцию аневризматического мешка с восстановлением структуры селезеночной артерии с помощью наложения анастомоза конец в конец или протезированием артерии аутовенозным трансплантатом.
Известны наблюдения эндоваскулярных вмешательств при АСА. Однако несмотря на малую травматичность применяемых методик, существуют ограничения в использовании эндоваскулярной хирургии. Для оптимального результата необходимо наличие широкой шейки АСА и расположения последней в проксимальной трети селезеночной артерии, что приведет к «выключению» аневризмы из кровотока и улучшению перфузии селезенки и снижению риска разрыва. Кроме того, применение стент-графта позволяет облегчить доступ к селезеночной артерии во время эмболизации селезенки при гиперспленизме. Однако естественный извитой ход селезеночной артерии, дистальное расположение аневризм существенно ограничивают проведение стента, поэтому открытое хирургическое вмешательство выходит на первый план [11].
Аневризмы печеночной артерии (АПА)
АПА занимают второе место по частоте среди аневризм непарных висцеральных ветвей брюшного отдела аорты, составляя 20%, половина из которых представлена ложными аневризмами. Расположение аневризм помогает в выявлении причины и определении дальнейшей тактики ведения больного. Внутрипеченочные аневризмы ветвей печеночной артерии часто образуются в результате травмы, ятрогенных повреждений после биопсии или оперативных вмешательств на печени, воздействия инфекционных агентов или вследствие васкулита. Внепеченочные аневризмы, как правило, наблюдаются после трансплантации печени, общехирургических манипуляций, чрескожных вмешательств на желчевыводящих путях, закрытой травмы живота, а также сопровождают гепатоцеллюлярный рак [10].
Как правило, АПА одиночные, веретенообразные или мешотчатые и в 80% наблюдений располагаются внепеченочно. Очень малая доля АПА протекает с определенной симптоматикой (дискомфорт в эпигастральной области вследствие расширения аневризматического мешка, болевой синдром, характерный для панкреатита) [11]. Иногда АПА могут вызывать желтуху или гемобилию. Описанные симптомы составляют триаду Квинке и отмечаются у 1 / 3 больных [10]. Чаще всего АПА диагностируют с помощью применения селективной ангиографии, компьютерной томографии, ультразвуковой диагностики или МРТ. Рентгенография малоинформативна ввиду низкой частоты атеросклеротического поражения артериальной стенки.
От 20 до 40% АПА осложняются разрывом, что приводит к летальному исходу в 35-40% наблюдений [10]. Велик риск разрыва неатеросклеротических АПА. Разрыв АПА чаще происходит в гепатобилиарное пространство, приводя к гемобилии, в желудочно-кишечный тракт, полость желчного пузыря, воротную вену, а также в брюшную полость [5].
Хирургическое лечение АПА заключается в перевязке печеночной артерии без реконструкции в случае проксимального внепеченочного расположения аневризмы. Однако при выраженном атеросклерозе и имеющихся в анамнезе хирургических вмешательствах в гепатобилиарной зоне необходимо шунтирование дистального внепеченочного сегмента печеночной артерии с выключением аневризмы из кровотока [10]. В лечении внутрипеченочных аневризм в настоящее время применяют эндоваскулярные методы - имплантацию покрытого стента и выключение аневризмы из кровотока, что благоприятствует улучшению кровотока и снижению риска ишемии органа. Осложнениями эндоваскулярного лечения являются ишемизация печени, развитие абсцессов печени и холецистит [5, 10].
Аневризмы гастродуоденальной, панкреатодуоденальной артерий и артерии поджелудочной железы
В большинстве наблюдений развитию аневризм указанных артерий способствуют панкреатит, язвенная болезнь желудка и двенадцатиперстной кишки, повышение артериального давления в соответствующих бассейнах при окклюзии чревного ствола, перенесенные оперативные вмешательства на поджелудочной железе. Большинство больных предъявляют жалобы на боль в эпигастральной области с иррадиацией в спину. Разрывы аневризм сопровождаются кровотечением в полость желудка, двенадцатиперстной кишки, реже через желчевыводящие пути и панкреатические протоки. F. Boudghene и соавт. сообщали об успешном лечении 32 аневризм панкреатодуоденальных артерий с применением транскатетерной эмболизации. Следует подчеркнуть, при использовании эндоваскулярного лечения очень важно произвести поиск «питающей» артерии, так как в перигастральной области имеется очень развитая сосудистая сеть. С целью контроля за эффективностью проведенного лечения необходим ангиографический контроль в динамике [4, 5, 10].
Аневризмы чревного ствола (АЧС)
АЧС встречаются в 4% всех аневризм висцеральных ветвей аорты и часто являются асимптомными. В 13% наблюдений отмечаются разрывы с летальностью более 50%. Клиническая картина при разрыве АЧС представлена кровотечением в брюшную полость или в желудочно-кишечный тракт. Часто АЧС бывает дегенеративными, сочетаются в 20% наблюдений с аневризмами аорты и в 40% наблюдений с аневризмами других висцеральных артерий. В большинстве наблюдений АЧС являются диагностическими находками. При лечении АЧС применяют традиционное хирургическое вмешательство в объеме резекции аневризмы с восстановлением проходимости чревного ствола путем анастомозирования конец в конец. Если это невозможно, то производят целиакоаортальное протезирование синтетическими протезами или аутовеной. Частое расположение аневризм в проксимальном отделе чревного ствола и отсутствие шейки ограничивают применение эндоваскулярного вмешательства [5, 10].
Аневризмы верхней брыжеечной артерии (АВБА)
АВБА составляют 5,5% всех аневризм висцеральных артерий, часто сопровождаются дискомфортом и болью в животе, варьирующей от тупой до нестерпимой и ассоциирующейся с «кишечной жабой». Они бывают мешотчатыми и веретенообразными, обычно располагаются в проксимальной части ВБА рядом с устьем панкреатодуоденальной артерии и средней толстокишечной артерии. Причинами развития АВБА являются грибковые поражения с вторичным присоединением бактериальной микрофлоры, связанные с бактериальным эндокардитом, наркоманией. Также имеются сведения о влиянии дегенерации медии, травмы и болезни Бекета. От 38 до 50% аневризм осложняются разрывами.
Выбор метода лечения зависит от состояния гемодинамики больного и операционного риска. Наиболее часто применяется традиционное хирургическое лечение. Варианты оперативных вмешательств включают резекцию, ушивание или перевязку аневризмы с выполнением артериальной реконструкции или без нее. Допускается перевязка ВБА и ЧС в связи с выраженным развитием коллатерального кровообращения. Однако реконструктивная хирургия с применением аутовенозного или синтетического трансплантата незаменима при высокой угрозе разрыва аневризмы или наличии признаков ишемии кишечника. Ввиду наиболее частого захвата аневризмой проксимального отдела ВБА, отсутствия зоны имплантации стента ограничивают применение эндоваскулярного лечения [3, 5, 10].
Аневризмы почечных артерий (АпА)
АпА часто рассматривают отдельно от остальных аневризм висцеральных ветвей ввиду отличной этиологии и значительно меньшего риска разрыва и низкой летальности. АпА тесно связаны с артериальной гипертензией. Частота истинных АпА составляет примерно 0,015-1%. Появлению АпА способствует дегенерация медии и фибродисплазия, а также фрагментация внутренней эластической пластинки, обнаруженная при гистологических исследованиях. В определенной степени развитию АпА способствуют артериальная гипертензия и атеросклероз. Редкими причинами являются нейрофиброматоз и неспецифический артериит. Большинство АпА мешотчатые и в 75% наблюдений они расположены в ветвях первого или второго порядка, менее чем в 10% наблюдений отмечается интрапаренхимальное расположение аневризм. Большинство АпА протекает асимптомно и лишь в 30% наблюдений имеют место злокачественная гипертензия, болевой синдром, гематурия, инфаркт почки и разрыв. Наиболее серьезным осложнением, встречающимся в 30% наблюдений, является разрыв АпА. Летальность достигает 10%. Однако имеются сведения о сочетании АпА с АСА у беременных, при разрыве во время беременности летальность достигает 80-90% [11].
АпА выявляются с помощью ультразвуковой диагностики, брюшной аортографии и мультиспиральной компьютерной томографии.
Лечение АпА заключается в применении как консервативных методов, так и хирургического лечения. Консервативный метод лечения используют при асимптомных АпА. Аневризмы диаметром до 2 см требуют динамического наблюдения. В случае злокачественной гипертензии, проявления урологических симптомов рекомендуют проведение диссекции, эмболизации, локальной компрессии путем эндоваскулярного вмешательства у женщин репродуктивного возраста или в периоде беременности. При хирургическом лечении производят резекцию аневризмы с последующей реконструкцией почечной артерии. При эндоваскулярном лечении в основном применяют стент-графты с учетом адекватного почечного кровотока. Однако при больших размерах аневризмы, распространении ее на паренхиму почки и при подозрении на разрыв производят резекцию почки или нефрэктомию с резекцией аневризмы и перевязкой пораженной почечной артерии. Оптимальным вариантом при хирургическом вмешательстве является забрюшинный доступ, обеспечивающий хорошую экспозицию почечной артерии и почки [6, 11]. В эпоху развития эндоваскулярной хирургии последнюю рассматривают как оптимальный вариант ввиду малой травматичности и хорошего отдаленного результата [7].
Таким образом, аневризмы висцеральных артерий являются редким сосудистым заболеванием и часто осложняются разрывом. Наиболее распространены аневризмы селезеночной, печеночной и почечных артерий. Клиническая картина крайне скудна и в основном проявляется в момент разрыва. Диагностический спектр включает ультразвуковое исследование, мультиспиральную компьютерную томографию с применением контрастных веществ; для оценки возможности применения эндоваскулярных методик используют селективную ангиографию. Выбор метода лечения зависит от тяжести состояния больного, клинических проявлений, а также локализации аневризмы и ее морфологии. Предпочтение отдают эндоваскулярным методикам, являющимся малотравматичными и обеспечивающими хороший долгосрочный результат. Однако в каждом конкретном наблюдении тактика ведения больного индивидуальна, выбор оптимального способа лечения аневризм висцеральных артерий основывается на данных всего спектра возможных диагностических манипуляций.
Операция при повреждении почечной артерии, вены. Тактика
Если в боковом отделе забрюшинного пространства имеется гематома, то можно заподозрить повреждение почечной артерии, почечной вены или всей сосудистой ножки, а также самой почки. Большинству пациентов с проникающей травмой живота выполняется лапаротомия до детального обследования; однако у отдельных пациентов, которые остались гемодинамически стабильными после проникающего ранения в бок, можно выполнить КТ для обнаружения изолированных небольших повреждений почки и тем самым избежать операции.
Напротив, при обнаружении околопочечной гематомы во время лапаротомии следует вскрыть гематому и ревизовать раневой канал. Если не происходит быстрого расширения гематомы, и нет свободной крови в брюшной полости, некоторые хирурги берут ипсилатеральную почечную артерию на держалку, выделив ее по средней линии, у основания брыжейки ободочной кишки. Левую почечную вену можно взять на держалку в том же месте; однако проксимальное выделение правой почечной вены потребует мобилизации подковы двенадцатиперстной кишки и обнаружения устья почечной вены на нижней полой вене. Следует отметить, что создание такого проксимального сосудистого контроля перед ревизией околопочечной гематомы неоднозначно. В одном исследовании предварительное выделение сосудов действительно не влияло на частоту нефрэктомий, потребность в трансфузии и кровопотерю.
Напротив, при активном кровотечении из почки через фасцию Герота или из забрюшинных тканей, покрывающих почечные сосуды, не следует получать доступ к проксимальным отделам почечных сосудов. Хирург должен просто открыть забрюшинное пространство латеральнее поврежденной почки и рукой вывихнуть почку непосредственно в рану. Проксимальнее ворот можно наложить большой сосудистый зажим, посередине слева или тотчас латеральнее нижней полой вены справа, чтобы остановить любое дальнейшее кровотечение.
У пациентов, госпитализированных после закрытой травмы, может также быть повреждение сосудов или паренхимы почки. Однако в первом случае обычно имеются признаки окклюзии сосудов почки, что будет обсуждаться ниже. У пациентов с закрытой травмой живота, которым была выполнена предоперационная ВВП, почечная ангиография или КТ почек, продемонстрировавшая сохраненное кровоснабжение почек, и/или у которых повреждение имеет низкую степень по шкале повреждения органов, нет оснований для ревизии околопочечной гематомы в случае, если им по другому поводу показана экстренная лапаротомия.
Повреждения сосудов почек трудно лечить, особенно когда затронута почечная артерия. Это сосуд среднего диаметра, расположенный глубоко в забрюшинном пространстве. Иногда небольшие отверстия в артерии, вызванные проникающими ранениями, можно закрыть путем боковой артериорафии или резекции с анастомозом «конец в конец». Вставочный трансплантат из большой подкожной вены или ПТФЭ показан только, когда есть обоснованная надежда на спасение почки.
Заимствования артерий, такие как замена левой почечной артерии селезеночной или замена правой почечной артерии печеночной, используются редко, будучи нечасто показанными у гипотензивных пациентов с тяжелыми проникающими реноваскулярными ранениями. У этих пациентов и при множественных повреждениях органов живота или длительном периоде ишемии до операции, лучшим выбором может быть нефрэктомия, если интраоперационная пальпация подтверждает наличие нормальной контралатеральной почки. Выживаемость пациентов с повреждениями почечных артерий вследствие проникающих ранений в двух старых исследованиях была приблизительно 87%, при спасении почки только в 30-40% случаев. В трех более свежих сериях выживаемость достигала 65,1% (28/43).
Диагностика при закрытых травмах почечных артерий более трудна. Разрывы интимы в почечных артериях могут произойти из-за торможения при автокатастрофах, наездах на пешеходов и падениях с высоты. Это обычно приводит к вторичному тромбозу сосуда и к жалобам на боли в боку и верхних отделах живота, как отмечалось ранее. В одном старом обзоре литературы было указано, что всего 30% пациентов с разрывами интимы почечных артерий имели макрогематурию, 43% имели микрогематурию и у 27% не было крови в моче.
В силу этого диагноз может быть не поставлен, потому что КТ у стабильных пациентов со спокойным животом может не выполняться.
Если ВВП или КТ фиксирует окклюзию почечной артерии, то хирург должен определиться с необходимостью операции. Время, начиная с момента травмы является наиболее критическом фактором спасения поврежденной почки. В одном исследовании была отмечена 80% вероятность восстановления некоторой функции почки через 12 часов, но этот показатель падал до 57% через 18 часов после возникновения окклюзии. В недавней серии, всего две из пяти почек были спасены после попытки реваскуляризации, при этом одно раннее спасение потребовало нефрэктомии через шесть месяцев по поводу тяжелой гипертензии, что привело к тому, что впоследствии оказалась спасенной одна почка (20%). Интересно, что у троих из семерых пациентов, у которых почка не подвергалась реваскуляризации, потребовалась поздняя нефрэктомия.
Если выполняется операция, то широкая мобилизация поврежденной почечной артерии обычно позволяет выполнить ограниченную резекцию зоны разрыва интимы в 2-3 см от брюшной аорты с реконструкцией в виде анастомоза «конец в конец». Альтернативным подходом является нефрэктомия, перфузия почки раствором Евро-Коллинз и аутотрансплантация. Последний подход, очевидно, применим только у стабильных пациентов, в идеале с изолированным повреждением. Констатация успешного результата обычно невозможна, пока через несколько недель не разрешится острый канальцевый некроз.
Еще одним закрытым повреждением почечной артерии, обнаруживаемым при селективной почечной ангиографии, является дефект или отслойка интимы с сохранением притока к ипсилатеральной почке. Некоторые их этих повреждений заживают, тогда как другие могут привести к раннему тромбозу. Единственным современным подходом является введение эндоваскулярного стента через такое повреждение, особенно когда степень других повреждений не позволяет применять антикоагуляцию.
В качестве вывода можно констатировать, что вследствие обсуждавшейся выше низкой частоты спасения почки после окклюзии почечной артерии в результате закрытой травмы, интерес к реваскуляризации почки падает, особенно при отсрочке диагноза или у пациентов с односторонним повреждением. Поэтому пациенты с повреждением одной почечной артерии должны рассматриваться с точки зрения реваскуляризации только если они стабильны и имеют короткий период теплой ишемии, в идеале, менее пяти часов.
Других пациентов с предположительно нормально работающей контралатеральной почкой следует наблюдать. Очевидно, что пациентам с двухсторонним повреждением почечных артерий или тем, у кого травмирована единственная почка, обязательно требуется реваскуляризация. Помимо этого, во всех случаях показано длительное наблюдение, так как у некоторых из них разовьется гипертензия.
Тактика при повреждении почечной вены
Хотя закрытые отрывные повреждения почечной вены могут привести к профузному кровотечению, пациенты с проникающими ранениями могут быть достаточно стабильными в результате ранее описанной забрюшинной тампонады. Для остановки кровотечения из раны почечной вены может использоваться прижатие пальцем или прямое наложение сосудистых зажимов. Боковая венорафия остается прекрасной техникой восстановления. Если для остановки кровотечения необходима перевязка правой почечной вены, то следует выполнить нефрэктомию, либо сразу же, либо при повторной операции, если потребовалась техника ограничения последствий повреждений.
Медиальный отдел левой почечной вены можно перевязать, так как остаются интактными вена левого надпочечника и гонадная вена. При возможности желательно восстановить вену, так как в старых сериях, где применялась перевязка, была отмечена большая частота послеоперационных осложнений со стороны почки. Выживаемость пациентов с проникающими ранениями почечных вен колеблется от 42 до 88% в старой литературе, с различиями преимущественно из-за степени и числа сочетанных сосудистых и висцеральных повреждений. В трех недавних обзорах выживаемость была от 44,2 до 70% со средним значением 60,4% (58/96).
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Операция при повреждении почечных артерий, верхней брыжеечной вены. Тактика
Повреждения проксимальных отделов почечных артерий также могут проявляться в зоне 1, гематомой над брыжейкой поперечной ободочной кишки или кровотечением в этой области. Описанный ранее маневр медиального поворота левосторонних внутренностей позволяет увидеть большую часть левой почечной артерии, от аорты до почки. Однако при этом не удается увидеть проксимальный отдел правой почечной артерии.
К проксимальной части сосуда легче всего подойти через корень брыжейки поперечной ободочной кишки, ниже левой почечной вены и между брюшной аортой и нижней полой веной.
Тактика при повреждении верхней брыжеечной вены
Еще один крупный сосуд брюшной полости, проксимальная верхняя брыжеечная вена, лежащая справа от верхней брыжеечной артерии, может быть поврежден у основания брыжейки поперечной ободочной кишки. Повреждение самого проксимального отдела этого сосуда около места его слияния с селезеночной веной, лечить трудно.
Находящаяся спереди поджелудочная железа, близость крючковидного отростка и тесная связь с верхней брыжеечной артерией часто мешают доступу для проксимального и дистального перекрытия сосуда. Поэтому для доступа к месту травмы, как и при повреждениях проксимальной верхней брыжеечной артерии, может потребоваться пересечение шейки поджелудочной железы между нераздавливающими сосудистыми или кишечными зажимами.
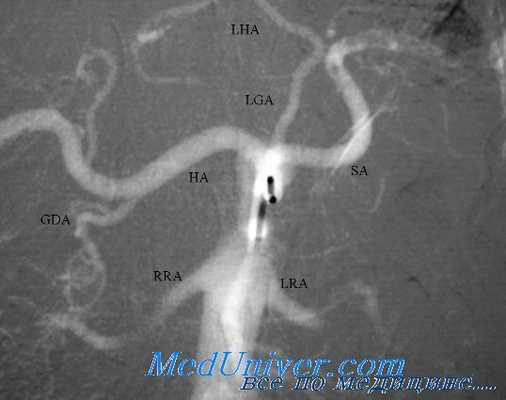
Нередко обнаруживается перфорация под нижним краем поджелудочной железы. Часто вену можно пережать рукой или пальцами, а ассистент наложит на края перфорации непрерывный шов из полипропилена 5-0. Если отверстие находится сзади, то для выворачивания его вперед потребуется перевязать впадающие здесь в вену множественные коллатерали. Иногда вена оказывается почти полностью пересеченной, и для остановки кровотечения требуется пережать оба конца сосудистыми зажимами.
Хирург может сопоставить концы вены без натяжения, если ассистент отведет тонкую кишку и ее брыжейку назад, в направлении поджелудочной железы.
Если в верхнем этаже брюшной полости имеется множество сосудистых и висцеральных повреждений, а верхняя брыжеечная вена сильно повреждена, то у молодых пациентов ее можно перевязать. В трех старых обзорах повреждений воротной венозной системы, перевязка верхней брыжеечной вены была выполнена у 27 пациентов и 22 из них выжили.
В одном обзоре повреждений верхней брыжеечной вены выживаемость была 85% среди 33 пациентов с перевязанной веной против 64% у 77 пациентов, которым был выполнен шов.93 Stone et al. подчеркивали потребность в энергичном восполнении объема циркулирующей жидкости у этих пациентов, так как внутренностная гиповолемия приводит к периферической гиповолемии в течение не менее трех дней после перевязки верхней брыжеечной вены.
Выживаемость пациентов с повреждениями верхней брыжеечной вены в четырех сериях, опубликованных с 1978 по 1983 гг., была 72,1% (75/104). В трех более свежих сериях средняя выживаемость была 58,3% (42/72).
Принципы операции при травме аорты над почечными артериями. Тактика
При небольших проникающих ранах аорты на этом уровне предпочтителен боковой шов аорты полипропиленовыми нитями 3-0 или 4-0. Соседние маленькие перфорации соединяют и ушивают поперечным полипропиленовым швом.
Если ушивание перфораций приводит к значительному сужению или если имеется дефект стенки аорты, то показана аортопластика заплаткой из политетрафторэтилена (ПТФЭ). Другим вариантом является резекция короткого поврежденного сегмента аорты и наложение анастомоза «конец в конец». К сожалению, это почти невозможно из-за ограниченной подвижности обоих концов аорты на этом уровне.
В редких случаях пациентам с обширными повреждениями диафрагмальной или надчревной части аорты требуется установка синтетической сосудистой вставки или спирального трансплантата после резекции поврежденной зоны. Многие из этих пациентов имеют сочетанные повреждения желудка, тонкой или толстой кишки, поэтому возникали сомнения относительно использования синтетических вставок, таких как 12-мм, 14-мм или 16-мм плетеные протезы из дакрона, покрытого альбумином дакрона или из ПТФЭ при операциях на брюшной аорте.
Выше уже говорилось, что восстановление аорты и кишечника не должно проводиться одновременно. После отграничения перфорированной кишки тампонами и смены перчаток, хирург фиксирует аортальный протез швами из полипропилена 3-0 или 4-0. После соответствующего промывания обоих концов аорты и снятия дистального аортального зажима проксимальный аортальный зажим нужно открывать очень медленно, одновременно с быстрой инфузией жидкости анестезиологом.
Если требуется длительное время пережатия аорты, показано профилактическое внутривенное введение бикарбоната, чтобы скомпенсировать «вымывной» ацидоз из ишемизированных нижних конечностей. Забрюшинное пространство обильно промывается и герметично закрывается.
Выживаемость пациентов с проникающими ранениями аорты выше почечных артерий в восьми сериях, опубликованных с 1974 по 1992 гг. составила 34,8% (54/155). Четыре более свежих обзора подтвердили значительное ухудшение выживаемости после повреждений брюшной аорты (выше и ниже почечных сосудов), которая колеблется от 21,1% до 50% (средняя 30,2%, 62/205 пациентов) даже когда исключались пациенты с большой потерей крови или те, которых лечили только перевязкой.
В одной серии с разделением повреждений аорты на над- и подпочечную выживаемость в супраренальной группе была всего 8,3% (3/36). Причины этого снижения выживаемости в описываемых обзорах не определены. Однако вероятной причиной является сокращение времени транспортировки пациентов с профузным кровотечением, что стало возможным с улучшением экстренной медицинской помощи.
Тупая травма надпопечного сегмента аорты чрезвычайно редка. В то время как закрытая травма нисходящей грудной аорты хорошо описана в травматологической литературе, Roth и et al. в литературном обзоре 1997 г. нашли всего 62 случая закрытой травмы брюшной аорты. Из них только один случай относился к аорте выше почечных артерий.
Наиболее частое место — между устьем нижней брыжеечной артерии и бифуркацией аорты. Эти повреждения обычно проявляются признаками и симптомами тромбоза аорты, а не кровотечения, и самыми частыми проявлениями являются отсутствие пульса на бедренных сосудах (81%), болезненность живота (55%), слабость или паралич нижних конечностей (47%) и парестезии (20%). Лечение этих повреждений более подробно обсуждается в разделе, посвященном повреждениями аорты ниже почечных артерий.
Операции при травме почки. Техника
Прежде чем приступить к хирургическому обследованию почек, необходимо оценить приоритетный порядок имеющихся повреждений и определить, насколько целесообразно выполнять ревизию почек в ходе предпринятой по экстренным показаниям операции. В тех случаях, когда предоперационная оценка с помощью методов медицинской визуализации не проведена, а хирургическое обследование поврежденной почки планируется, необходимо получить хотя бы минимальное представление о состоянии другой почки или, по крайней мере, выяснить, существует ли она вообще. Пальпация в области контралатерального почечного ложа с целью обнаружения макроскопически нормальной почки является приемлемым способом диагностики, к тому же порой единственно возможным в силу различных обстоятельств.
Тем не менее, выполненная в ходе операции ЭУ позволяет получить более точную информацию, поэтому в ряде случаев она может быть назначена. Процедура заключается во внутривенном введении йодсодержащего контраста в дозе 1-2 мл/кг с последующим 10-минутным рентгенологическим контролем его экскреции. Чтобы не терять время, ЭУ лучше выполнить на завершающем этапе выполнения хирургических вмешательств первой очередности. Несмотря на то, что данные интраоперационной ЭУ прибавляют уверенности в наличии функционирующей контралатеральной почки, в нашей клинике мы часто приступаем к хирургической оценке поврежденной почки, руководствуясь только данными пальпации другой почки.
Если уролог и хирург совместно приняли решение о необходимости хирургической ревизии, то последняя выполняется через передний вертикальный разрез фасции Герота. Сохраняются некоторые разногласия по вопросу о целесообразности первоочередного, до начала ревизии, достижения контроля над сосудами почечной ножки, о чем говорилось выше. По мнению сторонников метода, первичная диссекция почечных сосудов и их турникетный контроль заметно снижают частоту нефрэктомии. Оппоненты не усматривают такой необходимости для успешного оперативного обследования и лечения почек. Это расхождение во мнениях, возможно, носит преувеличенный характер, так как даже сомневающиеся в необходимости раздельного выделения сосудов почечной ножки до мобилизации почки, как правило, в ходе диагностических и лечебных манипуляций на почке используют другие способы контроля сосудистой ножки или уменьшения интенсивности почечного кровотечения.
В большей части публикаций поддерживает мнение о возможности снижения частоты необязательной нефрэктомии за счет обнажения и контроля почечной ножки до проведения хирургического обследования почки. Обеспечить сосудистый контроль можно традиционным способом, который включает вскрытие заднего пристеночного листка брюшины латеральнее аорты, раздельное выделение почечных сосудов на стороне повреждения и взятие их на турникеты. Другой возможный способ заключается в том, что сначала мобилизуют толстую кишку и отводят ее в медиальном направлении, в дальнейшем на ножку накладывают сосудистые зажимы в тех случаях, когда после вскрытия фасции Герота обнаруживают выраженное кровотечение. Альтернативным вариантом является пальцевое прижатие сосудистой ножки или почечной паренхимы (что больше подходит для повреждений, локализующихся в области полюсов почки) без дополнительного контроля почечных сосудов.
Не вызывает разногласий необходимость первичного контроля магистральных сосудов при травме почечной ножки, которую предполагают на основании большой или увеличивающейся в медиальном направлении гематомы вблизи этих сосудов.
После обеспечения контроля почечной ножки или доступа к ней, на стороне повреждения выполняют мобилизацию ободочной кишки и мезоколона путем рассечения и отведения париетальной брюшины в медиальном направлении. Когда передняя поверхность фасции Герота хорошо обнажена, ее вскрывают длинным вертикальным разрезом и полностью выделяют почку из окружающих тканей. Как говорилось ранее в разделе о хирургической анатомии, важно выделить почку только до фиброзной капсулы, не допуская неосторожного отслоения последней от подлежащего кортекса. Диссекцию лучше начинать не от места разрыва, а в зоне неповрежденной паренхимы, что упрощает выполнение процедуры.
Полноценная мобилизации полезна тем, что она позволяет вывести почку в рану для ее всесторонней ревизии. Обильное кровотечение при диссекци купируют наложением атравматичных сосудистых зажимов на почечную артерию, почечную вену или на всю почечную ножку. Следует дать предварительную оценку потенциалу сохранения почки и объему реконструктивных вмешательств, необходимых для ликвидации последствий травмы. В первую очередь учитывают степень повреждения центральной сосудистой сети и основных образований собирательной системы, а также объем нежизнеспособной паренхимы и состояние пострадавшего. При возможности восстановления почти у пациента с нестабильной гемодинамикой любое существенное интраренальное повреждение сосудов можно незамедлительно устранить путем наложения швов, после чего изолировать почку хирургическими салфетками до окончания оперативного лечения других повреждений. Закончив с последними, возвращаются к детальной ревизии и реконструкции почки, или предпринимают для этого самостоятельное хирургическое вмешательство.
Если же, исходя из характера травмы, почку определяют как не подлежащую восстановлению, то ее удаляют. Предпочтительнее раздельно лигировать почечную артерию и вену, так как это позволяет предотвратить возможное образование артериовенозной фистулы. Необходимо быстро найти добавочные или полюсные артерии и тоже наложить на них лигатуры. Урологи часто прошивают или просто лигируют почечную артерию и длинную культю вены, тогда как сосудистые хирурги и некоторые урологи отдают предпочтение наложению непрерывного обвивного шва нитью Prolene 3/0 на короткую правую почечную вену. При нефрэктомии по поводу травмы мочеточник и прилегающие сосуды перевязывают близко к почке, а при необходимости лигируют и пересекают гонадную вену, не опасаясь негативной реакции со стороны половых желез.
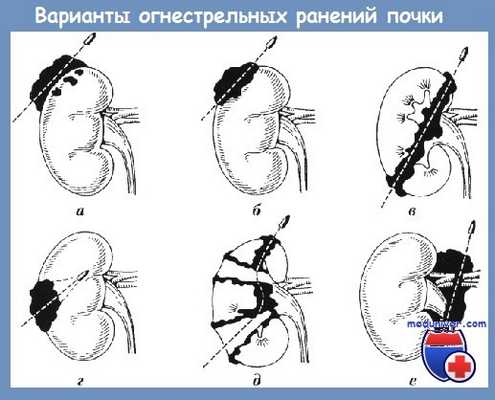
Виды огнестрельных ранений почки (по Л. К. Ревскому и соавт.):
а — ушиб почки;
б — касательное ранение;
в — сквозное ранение;
г — слепое ранение;
д — размозжение паренхимы почки;
е — ранение почечной ножки
В тех случаях, когда планируется органосохраняющая операция, обычно придерживаются следующей тактики. После эвакуации гематомы почку внимательно осматривают с целью выявления поврежденных сосудов, дефектов в чашечно-лоханочной системе и погибшей паренхимы. Большие участки разрушенной нежизнеспособной ткани иссекают, при этом кровоточащие мелкие сосуды контролируют рассасывающимися 3/0 или 4/0 швами. В целом почечные ткани сшивают рассасывающимися нитями, поскольку нерассасывающиеся лигатуры при контакте с собирательной системой могут стать причиной образования конкрементов. Надежное восстановление чашечно-лоха-ночной системы позволяет не проводить стентирования или нефростомии. Если остаются сомнения в надежности реконструкции или она удалась не в полном объеме, то установка внутреннего стента (дополненная катетеризацией мочевого пузыря) или нефростомической трубки позволит снизить послеоперационный риск возникновения мочевых затеков и формирования уриномы.
Резекцию разрушенного полюса почки выполняют «гильотинным» способом, с прошиванием пересеченных сосудов и образований коллекторной системы согласно вышеизложенным рекомендациям. Для остановки капиллярного кровотечения на раневую поверхность можно наложить гемостатические средства с последующим сшиванием почечной капсулы над дефектом паренхимы и гемостатическим материалом. Если после иссечения нежизнеспособной ткани или резекции почки удается сблизить края капсулы матрацными швами или за счет подшивания к капсуле абсорбируемой тканевой пластины, то это в значительной мере способствует остановке диффузного кровотечения. Если же из-за особенностей формы и локализации дефекта его закрытие за счет капсулы не представляется возможным или капсула повреждена в результате травмы или диссекции, то при проблематичном гемостазе можно использовать в качестве «заплатки» рассасывающиеся покрытия или биологические ткани. В хирургии почки также с успехом проводят коагуляцию потоком аргоновой плазмы в тех случаях, когда после прошивания крупных сосудов и открытых образований коллекторной системы продолжается паренхиматозное кровотечение.
При реконструктивных вмешательствах на почках (включая ее чашечно-лоханочную систему), мочеточниках и других мочевыводящих органах можно местно использовать гемостатические средства и тканевой клей в качестве вспомогательных средств остановки кровотечения и минимизации риска послеоперационных мочевых затеков. На основании отдельных работ можно сделать вывод о том, что аппликация фибринового клея или сиаланта по линии шва может уменьшить вероятность послеоперационной мочевой инфильтрации. Иногда при продолжающемся венозном кровотечении с целью легкой временной компрессии поврежденной паренхимы проводят обертывание декапсулированной почки рассасывающейся сетчатой тканью.
Меньший риск послеоперационного инфицирования связан с закрытыми аспирационными дренажами, а не открытыми дренажами Пенроуза, тем не менее, урологи обычно используют дренажи обоих типов. В условиях травмы соседнего органа показано раздельное дренирование окружающих поврежденные органы пространств.
В педиатрической практике распространены определенные типы повреждений, заслуживающие особого упоминания. Отрыв сводов чашечек, разрыв лоханочно-мочеточникового соустья и почечной ножки у детей встречаются чаще, чем у взрослых. При полных отрывных повреждениях чашечек проводят нефрэктомию, так как реконструкция практически невыполнима. Разрывы лоханочно-мочеточникового соединения лечат путем формирования прямого анастомоза. Разрывы лоханки, к тому же, предупреждают хирурга об уже имеющейся обструкции лоханочно-мочеточникового соединения. В таких случаях одновременно с зашиванием разрыва может потребоваться хирургическое устранение стриктуры, а если почечная ткань в основном атрофирована вследствие продолжительной обструкции, то более предпочтительной может оказаться нефрэктомия. Не вызывает сомнений, что повреждения сосудов почки, связанные с тупой или проникающей травмой, должны быть отнесены к сложным клиническим случаям.
Возможность проведения восстановительной операции зависит от уровня отрыва. Травматические разрывы многочисленных сосудистых ветвей, расположенных в почечной пазухе, фактически не подлежат хирургическому лечению, и обычно тоже являются показанием к нефрэктомии. Как следует из текущих публикаций, благоприятные исходы при реваскуляризации почки, выполненной по поводу травмы, маловероятны, и все же многое зависит от отбора пациентов. В подходящих клинических ситуациях (непродолжительная теплая ишемия и приемлемое для проведения операции состояние пострадавшего) затраченные усилия могут оказаться оправданными у тщательно отобранных пациентов. Стратегия сотрудничества, предусматривающая совместную работу сосудистого хирурга и уролога, весьма актуальна в случаях планируемой вазоренальной реконструкции. В выборочных наблюдениях, касающихся ангиографически подтвержденного разрыва интимы почечной артерии, при сохраненной перфузии возможна рентгенконтролируемая имплантация сосудистого стента. Многие ограниченные проникающие ранения почечной вены могут быть устранены за счет хирургического вмешательства, тогда как артериальные повреждения сопряжены с высокой частотой нефрэктомии. Поврежденные вследствие разрыва паренхимы ветви почечной артерии лигируют.
В то же время, пациенты, у которых разрывы артериальных ветвей выявлены при лучевой диагностике, могут быть проведены консервативно при условии стабильной гемодинамики и интактной паренхимы.
Травма обеих почек встречается редко и представляет собой особую проблему. При условии, что выраженное кровотечение отсутствует как из одной, так и из другой почки, первой оценивают менее пострадавшую (что определяют по размерам и локализации гематомы, направлению раневого канала, локализации входного и выходного раневого отверстия и т.п..), чтобы убедиться в возможности ее сохранения. Пока обследуют менее пострадавшую почку, другая, после контроля основных источников кровотечения, может быть временно изолирована влажным операционным материалом. Обследование в подобных случаях преследует целью найти любую возможность, позволяющую избежать нефрэктомии.
В редких случаях может быть выполнена экстракорпоральная реконструкция поврежденной почки. В качестве такого случая могла бы рассматриваться травма единственной (в функциональном или анатомическом отношении) почки, для сохранения которой требуется сложное реконструктивно-пластическое вмешательство.
Читайте также:
