Операция у беременной при раке
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Авторы: Паяниди Ю.Г. 1 , Боровкова Е.И. 2 , Доброхотова Ю.Э. 2 , Арутюнян А.М. 2
1 ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
2 РНИМУ им. Н.И. Пирогова Минздрава России, Москва, Россия
Рак шейки матки (РШМ) является одним из наиболее распространенных злокачественных новообразований, диагностируемых во время беременности. Частота его достигает 1,5 случая на 10 000 родов. Во время гестации стадирование и лечение заболевания должны соответствовать современным стандартам и быть идентичными тактике ведения больной вне беременности. Основными методами терапии инвазивного РШМ являются оперативный и медикаментозный (химиотерапия). Выбор лечебной тактики определяется сроком гестации на момент постановки диагноза, стадией заболевания, размером опухоли, а также вовлеченностью в процесс регионарных лимфатических узлов. При постановке диагноза до 20 нед. на выбор метода терапии влияет желание женщины сохранить беременность. При IА2 и IB1 стадиях и опухоли до 2 см проводится атипичная конизация шейки матки с лимфаденэктомией. В случае поражения лимфатических узлов в сроке до 22 нед. рекомендовано прерывание беременности. При желании пациентки сохранить беременность проводится неоадъювантная химиотерапия. После 22 нед. выполнение лимфаденэктомии технически сложно, стадирование проводится по результатам гистологического исследования. Химиотерапия проводится по стандартной методике с применением цисплатина в монорежиме или в комбинации с паклитакселом.
Ключевые слова: беременность, рак шейки матки, клинические рекомендации, конизация, неоадъювантная химиотерапия.
Managing invasive cervical cancer in pregnancy
Yu.G.Payanidi 1 , E.I. Borovkova 2 , Yu.E. Dobrohotova 2 , A.M. Arutunyan 2
1 Blokhin Cancer Research Center, Moscow, Russian Federation
2 Pirogov Russian National Research Medical University, Moscow, Russian Federation
Cervical cancer is one of the most common cancers diagnosed during the pregnancy. Its incidence is 1.5 cases per 10 000 births. During gestation, cancer staging and treatment should meet current standards and be similar to the treatment strategy in non-pregnant women. Key treatment approaches to the invasive cervical cancer are surgery and pharmacotherapy (chemotherapy). Treatment strategy is determined by the gestational period when the condition was diagnosed, cancer stage, tumor size, and regional lymph nodes involvement. When diagnosed up to 20 weeks, treatment approach choice depends on the decision of whether to proceed a pregnancy or not. In cervix cancer stage ІА2 and stage IB1 and in tumor size less than 2 cm, conization and lymph node dissection are recommended. In case of lymph node involvement in a women who is pregnant less than 22 weeks, abortion is recommended. If a woman decides to proceed her pregnancy, neoadjuvant chemotherapy is recommended. At 22 weeks pregnancy, lymphadenectomy is challenging; cancer staging is performed by histological examination. Standard chemotherapeutic strategy involves cisplatin monotherapy or cisplatin plus paclitaxel.
Keywords: pregnancy, cervical cancer, clinical guidelines, conization, neoadjuvant chemotherapy.
For citation: Payanidi Yu.G., Borovkova E.I., Dobrohotova Yu.E., Arutunyan A.M. Managing invasive cervical cancer in pregnancy. Russian Journal of Woman and Child Health. 2019;2(2):135–138.
В статье представлена тактика ведения беременных с инвазивным раком шейки матки.
Введение
Рак шейки матки (РШМ) является одним из наиболее распространенных злокачественных новообразований у беременных и встречается с частотой от 0,8 до 1,5 случая на 10 000 родов. Во время беременности и в течение первого года после родов верифицируется до 3% случаев болезни [1, 2].
Крупных рандомизированных исследований, на материалах которых можно основывать рекомендации по ведению беременных с РШМ, не проводилось. И при лечении этой категории больных применяются рекомендации, основанные на материалах исследований с участием небеременных пациенток. При этом дополнительно тактика ведения беременных с РШМ определяется сроком гестации, стадией опухолевого процесса и желанием пациентки сохранить беременность. Лечение должно быть индивидуальным, своевременным, с минимальным риском для женщины и плода [2].
Во время беременности РШМ в большинстве случаев диагностируется на ранних стадиях, а средний гестационный срок составляет 19,5 нед. [3, 4]. Клинические проявления РШМ во время беременности зачастую отсутствуют или могут быть приняты за акушерские осложнения (влагалищное кровотечение, тазовые боли, боли по ходу седалищного нерва, анемия).
Тактика лечения пациенток с РШМ
Тактика лечения пациенток с РШМ определяется стадией заболевания, сроком гестации, а также вовлеченностью в процесс регионарных лимфатических узлов. Основными методами лечения являются хирургический и медикаментозный (химиотерапия) [5–7] (табл. 1).
Согласно приказу Минздрава России № 572н от 1 ноября 2012 г. все беременные подлежат обязательному цитологическому скринингу, что позволяет своевременно поставить диагноз. При выявлении признаков, подозрительных в отношении микроинвазивного процесса, проводится атипичная конизация шейки матки с высотой конуса не более 1,5 см. Во время беременности не производится выскабливание цервикального канала в связи с высоким риском прерывания беременности после данной манипуляции. Конизация шейки матки может быть выполнена в любом сроке гестации, но не менее, чем за 4 нед. до предполагаемых родов. При IA1 стадии (инвазия до 3 мм и протяженность по горизонтали до 7 мм без сосудистой инвазии) конизация является оптимальным и безопасным методом лечения. Риск метастазирования составляет 0,8% при плоскоклеточном раке и 1,5% при аденокарциноме. При подозрении на поражение тазовых лимфатических узлов показано проведение тазовой лимфаденэктомии (ТЛАЭ) или биопсии сторожевого лимфатического узла [8].
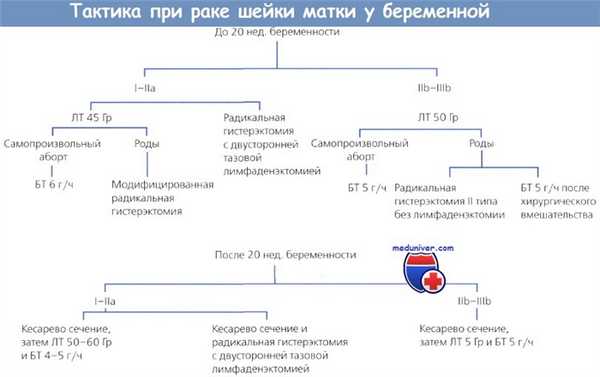
Ведение пациенток до 22 нед. гестации с IА2 и IB1 стадией и опухолью до 2 см.
На первом этапе проводится атипичная конизация шейки матки с лимфаденэктомией. Если подтверждается метастатическое поражение лимфатических узлов, должен быть рассмотрен вопрос прерывания беременности. При отсутствии поражения лимфатических узлов возможно пролонгирование беременности с проведением стандартной терапии после родов (при IА2 стадии) или неоадъювантной химиотерапии (НАХТ) (при IB1 стадии) с отсроченным стандартным лечением после родов [9] (рис. 1).
Ведение пациенток в сроке более 22 нед. с IА2 и IB1 стадией при опухоли до 2 см. В данном сроке гестации для стадирования процесса проводится атипичная конизация шейки матки. Тазовая лимфаденэктомия не выполняется в связи с техническими ограничениями, связанными с размером матки. При подтверждении IА2 стадии после родов проводится стандартное лечение, при IB1 стадии начинают неоадъювантную полихимиотерапию [9].
Ведение беременных до 22 нед. с IB1 стадией и опухолью до 2–4 см. Для уточнения распространенности процесса проводится ТЛАЭ. При подтверждении вовлечения лимфатических узлов рекомендовано прерывание беременности с последующим стандартным лечением. В случае интактности лимфатических узлов после 12 нед. начинают НАХТ [9].
Беременным в сроке гестации до 22 нед. с подтвержденным РШМ IB2 и IIA стадии рекомендовано прерывание беременности вне зависимости от вовлеченности лимфатических узлов [9]. После 22 нед. проводят несколько курсов НАХТ. Последний курс должен быть завершен не позднее 3 нед. до родов [9].
Хирургическое лечение
Диагностика РШМ основывается на гистологическом исследовании, однако прогноз заболевания определяется размером опухоли и вовлеченностью в патологический процесс лимфатических узлов. В первой половине беременности (до 22 нед.) проведение лапароскопической ТЛАЭ является безопасной и весьма информативной операцией [10]. При выявлении метастазов показано прерывание беременности и проведение химиолучевой терапии [11]. Пролонгирование беременности допустимо при интактности лимфатических узлов и начале НАХТ [11]. Проведение трахелэктомии во время беременности не рекомендовано в связи с малой эффективностью и высоким риском прерывания беременности (до 34%) [12].
Неоадъювантная химиотерапия
В случае пролонгирования беременности у пациенток с местнораспространенным РШМ проведение НАХТ позволяет стабилизировать опухолевый процесс [6]. Расчет лечебной дозы и выбор препарата идентичен таковым вне беременности. Однако необходимо учитывать, что физиологические изменения, связанные с беременностью (гемодилюция, гипопротеинемия, ускорение скорости клубочковой фильтрации, появление третьего пространства — амниотической полости), оказывают влияние на фармакокинетические свойства химиопрепаратов.
Согласно международным протоколам химиотерапия не проводится в I триместре беременности в связи с высоким риском эмбриотоксического и тератогенного действия. Во время беременности у пациенток с РШМ химиотерапию можно проводить начиная со II триместра: при IB1 стадии, отсутствии метастазов в лимфатических узлах и размерах опухоли В подавляющем большинстве случаев проведение НАХТ позволяет стабилизировать опухолевый процесс и пролонгировать беременность до периода достижения плодом жизнеспособности и зрелости. Наиболее часто схема терапии включает цисплатин (50–100 мг/м 2 ) в монорежиме или в комбинации с паклитакселом (175 мг/м 2 ). Курсы проводятся с интервалом каждые 3 нед. [13]. Реже применяется комбинация цисплатина (75 мг/м 2 ) с ифосфамидом 2 г/м 2 циклами каждые 2 нед. [12, 14].
Тактика родоразрешения беременных с РШМ
Последний курс полихимиотерапии должен быть завершен за 3 нед. до предполагаемой даты родов. Это связано с риском рождения ребенка с подавленным костным мозгом и высокой вероятностью развития у него инфекционных осложнений [14, 15]. В настоящее время рекомендовано пролонгировать беременность как минимум до доношенного срока (37 нед.), при отсутствии такой возможности — хотя бы до 34 нед. [14–17].
После конизации шейки матки, выполненной при IA1–IA2 стадиях, теоретически возможны влагалищные роды [9]. В случае распространенного РШМ методом родоразрешения является операция корпорального кесарева сечения с последующей операцией Вертгейма. Выбор метода родоразрешения зависит от стадии заболевания с учетом желания пациентки сохранить фертильность [1, 2, 12, 18–20].
Заключение
«Золотой стандарт» лечения РШМ у беременных еще не разработан. Следует признать, что приведенные выше клинические рекомендации ESGO, к сожалению, не могут ответить на все вопросы. Так, например, с нашей точки зрения, важным прогностическим фактором являются биологические особенности новообразования, которые в рекомендациях не учитываются. Также не ясно, какова тактика лечения при запущенных стадиях процесса и не являются ли рискованными рекомендуемые роды через естественные родовые пути при IA2 стадии заболевания и т. д. Тем не менее целесообразно следовать предложенному варианту тактических подходов, учитывая рекомендации Международного консенсусного совещания по «гинекологическим ракам», основанные на базе мирового опыта. Необходимо подчеркнуть особую роль мультидисциплинарного подхода с участием онкогинеколога, акушера-гинеколога, неонатолога, химио- и лучевого терапевтов, психолога, юриста в решении ряда важных вопросов.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Операция у беременной при раке
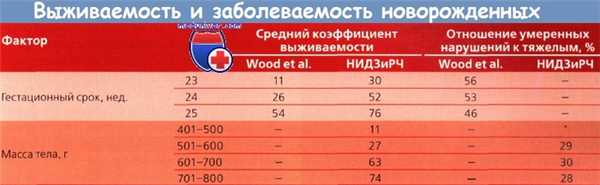
Благодаря достижениям в области неонатальной реанимации более 90 % новорожденных старше 28 нед. гестации выживают. В таблице ниже представлена статистика по результатам реанимации новорожденных, основанная на гестационном возрасте и массе тела при рождении. Как правило, во
II триместре беременности хирургическое вмешательство откладывают до созревания плода. В I и III триместрах при подозрении или диагностировании злокачественного новообразования рекомендуется безотлагательное проведение операции.
При выполнении вмешательства на 23—24-й неделе беременности необходимо до и после операции определять сердцебиение плода с помощью допплерографии. Мониторинг сердцебиения плода продолжают и на более поздних сроках беременности.
Определив объем амниотической жидкости с помощью УЗИ для минимизации маточных сокращений во время операции, беременным до и после вмешательства назначают индометацин 25—50 мг в суппозиториях. Применение индометацина до 30-й недели беременности может привести к преждевременному закрытию артериального протока.
Хотя профилактические токолитические препараты могут влиять на чувствительность матки, они не снижают риск преждевременных родов у прооперированных женщин. Во время и после операции советуют применять более широкий спектр методов по уменьшению частоты последовательных сокращений матки. После операции для мониторинга возбудимости матки и преждевременных маточных сокращений используют наружный токодинамометр.
Лапаротомия у беременной
Ранее лапаротомия во время беременности приводила к гибели плода. В 1967 г. Brant отмечал, что после аппендэктомии у беременных 17 % женщин теряли ребенка. В 1973 г. Saunders и Milton показали, что после лапаротомии 23 % женщин имели такой же исход беременности. Однако в современных условиях гибель плода после лапаротомии — явление редкое.
Например, Kort и соавт. в 1993 г. сообщали о 78 женщинах, подвергшихся неакушерским операциям. Перинатальная смертность не увеличилась. Чаще всего хирургическое вмешательство применяют при аппендиците, опухолях придатков и холецистите. Неродовспомогательные операции связаны с повышением риска преждевременных родов, поэтому необходимо применять токолитические средства.
Риск преждевременных родов после операции составил 21,8 %, что в 2 раза выше, чем в контрольной группе.
За редким исключением, при лапаротомии у беременных в связи с подозрением на злокачественную опухоль мы используем срединный вертикальный доступ. Это позволяет прекрасно визуализировать и обследовать всю полость таза и верхний отдел брюшной полости с минимальным воздействием на матку.
Лапароскопия у беременной
Лапароскопия используется для оценки новообразований придатков во время беременности и хорошо переносится как матерью, так и плодом. К концу II триместра увеличивающаяся матка препятствует лапароскопическому обзору, поэтому необходима лапаротомия.
В Швеции Reedy и соавт. проанализировали 2 млн данных по родам с 1973 по 1993 г., в 2233 случаях была проведена лапароскопия, в 2491 — лапаротомия. Параметры сравнения включали гестационный срок на время родов, массу тела при рождении, отставание во внутриутробном развитии, врожденные пороки развития, мертворождение и гибель новорожденных. Хотя в обеих группах был повышен риск преждевременных родов и рождение новорожденных массой менее 2500 г, не существовало никаких статистически значимых различий между ними.
Рекомендации Society of American Gastrointestinal Endoscopic Surgeon по проведению лапароскопии у беременных представлены в таблице ниже.
При опухолях более 10 см выполняют вертикальный разрез для максимального обзора операционного поля и удаления опухоли без манипуляций с маткой.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Лечение рака шейки матки у беременных - тактика
При раке шейки матки (РШМ) у беременных наиболее часто наблюдаются следующие симптомы: патологические вагинальные кровотечения (63 %), влагалищные выделения (13 %), посткоитальные кровотечения (4 %), боль в области таза (2 %). В исследовании, проведенном Hacker и соавт., бессимптомное течение заболевания наблюдалось у 18 % больных, в исследовании Creasman и соавт. — у 30 %.
При кровотечениях необходимо тщательное обследование. В случае обследования в I триместре риск прерывания беременности не повышается. При кровотечениях в III триместре обследование проводят в условиях операционной, т. к. возможно частичное предлежание плаценты. В большинстве случаев визуального контроля для диагностики инвазивного рака шейки матки (РШМ) бывает достаточно. У беременных при постановке диагноза пользуются классификацией FIGO.
Во избежание облучения плода для определения гидронефроза выполняют УЗИ почек, а при подозрении на прорастание опухолью параметрия — МРТ таза. Рентгенологическое исследование грудной клетки для исключения метастазов в легких может быть выполнено только при условии экранирования живота. На рис. 4.5 представлен возможный алгоритм действий при инвазивном раке шейки матки (РШМ).
Тактика при микроинвазивном раке шейки матки у беременной
Микроинвазивный рак у беременных, как правило, обнаруживают при кольпоскопической прицельной биопсии. Если при исследовании биоптата нельзя исключить микроинвазивный рак, проводят поверхностную или более широкую конизацию шейки матки. Беременным конизацию выполняют только при полной уверенности в поставленном диагнозе. При этом у больных с неглубокой стромальной инвазией нет необходимости прерывать беременность в отличие от больных с глубокой инвазией.
Мы считаем, что у пациенток с начальной стромальной инвазией (стадия Ia1 по FIGO) можно сохранять беременность до срока родов без хирургического вмешательства. Роды у этих женщин могут проходить через естественные родовые пути. Беременным с Iа2 или Ib1 стадией по FIGO сразу после созревания легких плода проводят кесарево сечение, а затем радикальную абдоминальную гистерэктомию с двусторонней тазовой лимфаденэктомией.
Предпочтительнее выполнять вертикальный разрез матки, чтобы не нарушить ее нижний сегмент, который тщательно обследуется. Физиологические изменения при беременности фактически улучшают результаты радикальной хирургии, т. к. дифференцировка тканей более четкая.
Проведение кесарева сечения с гистерэктомией и тазовой лимфаденэктомией при раке шейки матки у беременной
Выбор терапии при инвазивном раке шейк матки (РШМ) должен основываться на стадии заболевания и сроке беременности. Решение часто зависит от религиозных убеждений больной и ее семьи, от желания иметь ребенка. При I и IIa стадиях заболевания по FIGO радикальную гистерэктомию с двусторонней лимфаденэктомией проводят в любом триместре беременности. Мы предпочитаем хирургическое лечение из-за совокупного результата, включающего сохранение яичников, улучшение сексуальной функции и отказ от ненужной отсрочки лечения.
Частота осложнений после радикального хирургического вмешательства при раке шейки матки (РШМ) у беременных не превышает таковую у небеременных, если тщательно соблюдаются принципы операции. Monk и Montz изучили результаты радикальной гистерэктомии при инвазивном раке шейки матки (РШМ) у беременных. Они обследовали 8 больных, которым выполнили кесарево сечение, а затем радикальную гистерэктомию и двустороннюю тазовую лимфаденэктомию; другим 13 больным провели те же хирургические вмешательства, за исключением кесарева сечения.
Среднее время радикального удаления матки с плодом и лимфаденэктомии составило 281 мин, средняя кровопотеря — 777 мл; при кесаревом сечении с последующей радикальной гистерэктомией и лимфаденэктомией кровопотеря была 1750 мл. Риск летального исхода во время операции был минимальным, 7 младенцев родились здоровыми. 20 (95 %) больных выжили и находятся в ремиссии. Среднее время наблюдения за больными составило 40 мес.
Авторы заключили, что радикальная операция необходима на ранних стадиях рака шейки матки (РШМ) у беременных, причем такой метод характеризуется низкой смертностью, удовлетворительной выживаемостью и сохранением функции яичников.


Дистанционное облучение таза с внутриполостной брахитерапией при раке шейки матки у беременной
Лучевая терапия эффективна на ранней стадии рака шейки матки (РШМ) (стадия Ibl по FIGO). На поздних стадиях (стадии Ib2—IVa по FIGO) ЛТ сочетают с приемом радиосенсибилизирующих химиопрепаратов. В I и II триместрах беременности облучают таз, что вызывает самопроизвольный аборт. После самопроизвольного аборта проводят внутриполостное введение радия или цезия. Как правило, самопроизвольный аборт происходит на 35-й день после начала терапии при проведении облучения в I триместре беременности и на 45-й день при ЛТ во II триместре (редко на 60—70-й день).
Если самопроизвольный аборт не произошел, через 1—2 нед. после стандартного внутриполостного облучения выполняют гистерэктомию.
Если после завершения ДЛТ беременность не прервалась, что чаще бывает после 16-й недели, проводят радикальную гистерэктомию без лимфаденэктомии, чтобы удалить остаточную опухоль. Этот метод позволяет подвести достаточную дозу радиации к микрометастазам в лимфоузлах таза, т. к. ввести радий или цезий в полость беременной матки невозможно. Хотя некоторые практикующие врачи на ранних стадиях заболевания предпочитают выполнять экстрафасциальную экстирпацию матки после облучения таза дозой 50 Гр, мы считаем, что надо проводить более радикальное вмешательство. Этот способ обеспечивает адекватную эксцизию шейки матки, медиального параметрия и верхнего отдела влагалища, в которых доза радиации была эффективно распределена.
Те, кто придерживается экстрафасциальной гистерэктомии, часто советуют после операции проводить ЛТ свода влагалища, чтобы воздействовать на верхний отдел влагалища и медиальный параметрий.
Sood и соавт. изучили влияние беременности на развитие опухолевого процесса, продолжительность жизни и смертность при ЛТ. Они обследовали 26 беременных, которым проводили ЛТ. В контрольную группу вошло 26 небеременных пациенток того же возраста, у которых были те же результаты гистологического исследования, та же стадия опухоли, те же способы и время лечения. Всем пациенткам провели ДЛТ (средняя доза 46,7 Гр) и внутриполостное облучение (средняя доза 56,5 Гр в точке А). В I триместре ЛТ подверглись 3 беременных. Через 20—24 дня после начала облучения у всех произошел самопроизвольный аборт (средняя доза 34 Гр).
Во всех этих случаях облучение прерывали максимум на 3 дня. Между группой беременных и контрольной группой не было статистически значимых различий в риске рецидивов и выживаемости.
Неоадъювантная химиотерапия рака шейки матки во время беременности
Больным на поздних стадиях заболевания (стадия Ib2 по FIGO или выше) необходимо немедленно проводить терапию. В 1998 г. сообщалось о 2 женщинах с раком Ib2 и Па стадий, которые отказались прерывать беременность. Им была проведена неоадъювантная XT (винкристин 1 мг/м2 и цисплатин 50 мг/м2) в начале II и в III триместрах. У обеих отмечалась значительная регрессия опухоли.
Ребенок родился здоровым, а у матери наблюдалась регрессия опухоли. К сожалению, через 13 мес. после родов у женщины развился рецидив и она умерла. Неоадъювантная терапия рака шейки матки (РШМ) до сих пор остается экспериментальным подходом и применяется у женщин на поздних стадиях заболевания, отказывающихся прерывать беременность.
Операция при раке молочной железы у беременной - рекомендации
Беременным с раком молочной железы (РМЖ), как правило, проводят хирургическое вмешательство. Объем возможной операции обсуждается во всем мире.
Чаще всего при небольших поражениях проводят удаление опухоли молочной железы или частичную мастэктомию. На I, II и, в некоторых случаях, III стадиях предпочитают выполнять расширенную мастэктомию, чтобы избежать адъювантной ЛТ.
Поскольку у беременных с РМЖ часто обнаруживают метастазирование в лимфоузлы, рекомендуется в плановом порядке проводить лимфодиссекцию подмышечных лимфоузлов, если была выполнена биопсия сторожевого лимфоузла.
Недавно Keleher и соавт. оценили риск для эмбриона/плода, связанный с биопсией сторожевого лимфоузла и лимфосцинтиграфией молочной железы. После инъекции вблизи опухоли 92,5 МБк (2,5 мКи) коллоидной серы, меченной 99mТс, за день до операции у 2 беременных с РМЖ была высчитана доза абсорбции у эмбриона/плода при трех теоретически возможных локализациях вещества в организме.
Максимальная абсорбционная доза у плода составила 0,0043 Гр. Авторы сделали вывод, что лимфосцинтиграфия молочной железы имеет низкий риск для плода. Необходимы дальнейшие исследования, чтобы подтвердить эти данные.

Спорный момент — выбор времени проведения операции на поздних сроках беременности. Некоторые авторы полагают, что больные имеют большую продолжительность жизни, если лечение проводить после родов.
Но они не учитывают тот факт, что больные, получавшие лечение после родов, могли иметь небольшую опухоль, при которой течение заболевания более благоприятное. Следовательно, в случае большой опухоли и при агрессивном течении заболевания чем раньше проводится лечение, тем больше продолжительность жизни.
Хотя реконструкция молочной железы с помощью поперечного кожно-мышечного лоскута прямой мышцы живота считается эстетической операцией, а женщина не нуждается в протезировании, беременным с РМЖ, которым проведена мастэктомия, не рекомендуют эту процедуру.
Решение проблемы функциональности абдоминальной стенки после заимствования части или всей прямой мышцы живота также играет важную роль для планирования будущей беременности. Ранее полагали, что после реконструкции молочной железы беременность противопоказана, т. к. после ротации одной или обеих прямых мышц живота абдоминальная стенка ослабляется и не способна выдерживать нагрузку при беременности.
Избежать развития грыжи абдоминальной стенки в донорском участке при аутотрансплантации можно, если интервал между реконструкцией молочной железы и беременностью составил как минимум 12 мес.
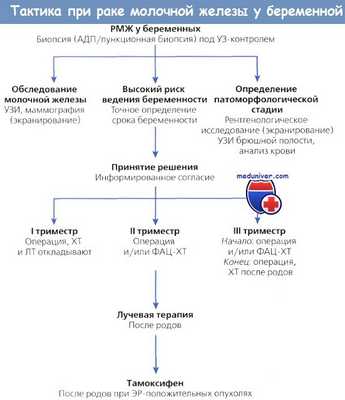
P.S. • Исследование сторожевого лимфоузла с помощью радионуклидов беременным противопоказано.
• ФАЦ-терапию рекомендуется проводить во II и III триместрах беременности.
• При локально распространенном РМЖ хирургическое вмешательство (радикальная мастэктомия) проводят после неоадъювантной XT.
• ЭР - эстрогеновые рецепторы;
• ФАЦ - 5-фторурацил, доксорубицин (Адриамицин) и циклофосфамид;
• АДП - аспирационная диагностическая пункция.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Беременность и онкология

Беременность не может быть провокатором онкологических заболеваний. У женщин в положении рак встречается с частотой, не выходящей за рамки общей статистики. На стадии беременности чаще всего обнаруживают рак шейки матки и молочной железы, а уже во вторую очередь все иные виды. Но очаги онкологических заболеваний могут возникнуть задолго до обнаружения. Беременность становится лишь поводом для обследования, в ходе которого обнаружен рак.
Диагностика во время беременности

К безопасной для плода диагностике относится метод ультразвукового исследования (УЗИ) и магнитно-резонансная томография (МРТ). Насчет МРТ у гинекологов есть разногласия, поэтому в ряде клиник этот метод может быть исключен либо применяться с большой осторожностью. Но доказанных противопоказаний для эмбриона магнитный резонанс не имеет. Рентген беременным можно делать выше диафрагмы с использованием свинцового фартука. До того же уровня можно применять компьютерную томографию (КТ), например, для исследования легких, головного мозга, щитовидной железы. Естественно не наносит никакого вреда беременным и плоду анализ крови на онкомаркеры. Биопсия с последующим цитологическим и гистологическим исследованием также активно используется при обследовании беременных с подозрениями на раковые опухоли.
К неразрешенным методам диагностики относится позитронно-эмиссионная томография (ПЭ КТ), поскольку ее влияние на зародыш до конца не изучено.
У беременных частота выявления онкозаболеваний не выходит за рамки статистической для популяции. Многое зависит от возраста беременной женщины. К сожалению, с возрастом рак встречаются чаще у людей в целом. Соответственно и беременные не являются исключением.
Лечение рака во время беременности
Будущим матерям очень важно знать, что большинство видов онкологии напрямую не угрожают плоду. Только меланома и лейкоз могут вызывать метастазы у плода, но и это случается крайне редко (в мире известно не более сотни случаев метастазирование этих видов рака в плаценту и эмбрион). Но определенную опасность может представлять лечение онкологии в период вынашивания.
Химиотерапия относится к жестким видам лечения, оказывающем влияние на весь организм в целом. Разумеется, используемые химические препараты, подавляющие рост раковых клеток, могут вызывать пороки у эмбриона, несмотря на природный защитный барьер. Вероятность развития пороков у плода тем выше, чем дольше и интенсивнее проводится химиотерапия. Больше всего рисков возникает, если такое лечение назначают уже в первом триместре. Но есть схемы, которые имеют показания при беременности, например, при таком виде рака, как синдром Ходжкина.
Во втором и третьем триместре эмбрион менее уязвим при химиотерапии. Но препараты могут вызывать задержку развития эмбриона. В медицинской литературе описаны случаи внутриутробной гибели плода. Несмотря на то, что это редкие в практике случаи, они дают основания с большой осторожностью подходить к использованию препаратов химиотерапии.
После 14-й недели беременности процессы формирующие органы у эмбриона завершаются. С этого момента введение схем ПХТ (паллиативной химиотерапии) становится значительно безопаснее для плода. До начала органогенеза, в частности в имплантационный период, химиотерапия воздействует соответственно закону «все или ничего». На сроке 2-8 недель уровень врожденных аномалий при химиотерапии доходит до 20%. Препараты в первую очередь оказывают негативное влияние на нервную систему и органы чувств (глаза, уши).
Лучевая терапия, как и воздействие химическими препаратами, несет в себе определенный риск для эмбриона. Поэтому при составлении схем и определении методики лечения рака у беременных решение принимают, взвешивая степень пользы и вреда. Лучевая терапия – важный этап в борьбе с многими видами рака. На ранних сроках беременности, когда зародыш еще мал и защищен от облучения толщей материнских тканей, этот метод не наносит ему вреда при дозах, не превышающих 100 мГр. Эти данные были получены в результате масштабных исследований применения лучевой терапии на животных, а также на основании практики влияния метода на людей в т.ч. и внутриутробного периода. Радиоактивные методики могут привести к гибели зародыша на самых ранних стадиях – до имплантации и в ее процессе.
Один из главных факторов риска операций для женщин в положении – тромбоэмболические осложнения. Перенесшим хирургическое вмешательство рекомендовано профилактическое лечение таких осложнений. При операциях на матке распространена практика применения токолитиков.
Влияние онкологических заболеваний на плод
Медицина пока не может объяснить всех механизмов воздействия основных методик лечения рака у матери на развивающийся в ее утробе эмбрион. Само заболевание не проникает метастазами в плод (за редким исключением). Опасность для ребенка представляют агрессивные методы, которые применяются для лечения рака. Медицинская наука не дает однозначного ответа на то, как влияет препарат или облучение на плод. Известны случаи, когда у близнецов, растущих в утробе матери, проходящей курс химиотерапии, наблюдались абсолютно разные последствия.
Дети, рожденные от матерей, проходивших курсы химиотерапии даже начиная с первого триместра, в большинстве рождаются здоровыми. Отклонения у них встречаются в порядке статистических. В зарубежной литературе приводятся результаты 20-летних исследований, в ходе которых изучалось 58 беременностей женщин с гемоблистозными видами рака. Дозы химических препаратов они получали уже в первом триместре. Из общего числа исследуемых произошло два выкидыша и два случая мертворождения. У остальных не наблюдалось врожденных аномалий, пороков умственного, физического или полового развития. За время наблюдения некоторые дети успели стать родителями, и их потомство тоже не имело врожденных патологических признаков.
Ранняя диагностика онкологии у беременных способствует улучшению прогноза. В таком случае чаще удается побороть основное заболевание (рак) у женщины и не дать ему развиться до стадии, угрожающей жизни ее и ребенка, которого она вынашивает. Избавление от беременности в большинстве случаев не улучшает прогноз для матери, у которой после лечения резко снижается фертильность вплоть до бесплодия.
Говоря о влиянии рака на эмбрион, нельзя не затронуть психологический аспект состояния беременной женщины, которой поставили диагноз злокачественного заболевания. На фоне эмоционального потрясения могут происходить выкидыши, преждевременны роды, поэтому к таким пациенткам нужен особый подход.
Читайте также:
