Оперативное лечение при сочетанной травме.
Добавил пользователь Валентин П. Обновлено: 10.01.2026
Политравма – это сложный патологический процесс, обусловленный повреждением нескольких анатомических областей или сегментов конечностей с выраженным проявлением синдрома взаимного отягощения, который включает в себя одновременное начало и развитие нескольких патологических состояний и характеризуется глубокими нарушениями всех видов обмена веществ, изменениями со стороны центральной нервной системы (ЦНС), сердечно-сосудистой, дыхательной и гипофизарно-надпочечниковой систем [1].
Множественная травма – повреждение двух и более органов одной полости, двух и более анатомических образований опорно-двигательного аппарата, повреждение магистральных сосудов и нервов в различных анатомических сегментах.
Сочетанная травма – повреждение внутренних органов различных полостей, совместные травмы внутренних органов и опорно-двигательной системы, совместная травма опорно-двигательного аппарата и магистральных сосудов и нервов.
В настоящее время политравму необходимо рассматривать в неразрывной связи с клинико-патофизиологическими особенностями течения травматической болезни.
Концепция травматической болезни предполагает изучение и оценку всего комплекса явлений, возникающих при тяжелых механических повреждениях организма в неотрывной связи с реакциями приспособительного, адаптивного характера в их сложных взаимосвязях на всех этапах болезни – с момента травмы до ее исхода: выздоровления (полного или неполного) или гибели [2].
- при завале сыпучими материалами.
Т 03 - Вывихи, растяжения и перенапряжение капсульно-связочного аппарата суставов, захватывающие несколько областей тела
Т 03.2 - Вывихи, растяжения и перенапряжение капсульно-связочного аппарата суставов нескольких областей верхней(их) конечности(ей)
Т 03.3 - Вывихи, растяжения и перенапряжение капсульно-связочного аппарата суставов нескольких областей нижней(их) конечности(ей)
Т 03.4 - Вывихи, растяжения и перенапряжение капсульно-связочного аппарата суставов нескольких областей верхней(их) и нижней(их) конечности(ей)
Т 03.8 - Другие сочетания вывихов, растяжений капсульно-связочного аппарата суставов и перенапряжений нескольких областей тела
Т 03.9 - Множественные вывихи, растяжения и перенапряжение капсульно-связочного аппарата суставов неуточненные
S26 - Травма сердца
S26.0 - Травма сердца с кровоизлиянием в сердечную сумку
S26.8 - Другие травмы сердца S26.9 - Травма сердца неуточненная
S27 - Травма других и неуточненных органов грудной клетки
S22.2 - Перелом грудины
S22.3 - Перелом ребер
S22.4 - Множественные переломы ребер
S22.5 - Западающая грудная клетка
S22.8 - Перелом других отделов костной грудиной клетки
S30.7 - Множественные поверхностные травмы живота, нижней части спины и таза
S31.7 - Множественные открытые раны живота, нижней части спины и таза
Дата разработки протокола: 2013 год
Категория пациентов: пациенты с политравмой, возникшей в результате воздействия различных повреждающих агентов.
Пользователи протокола: врачи-травматологи, анестезиологи-реаниматологи, врачи скорой помощи, хирурги, нейрохирурги, челюстно-лицевые хирурги, оториноларингологи, урологи, ангиохирурги.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
1. Период острой реакции на травму: соответствует периоду травматического шока и раннему постшоковому периоду; его следует рассматривать как период индукционной фазы СПОН.
2. Период ранних проявлений травматической болезни: начальная фаза СПОН – характеризуется нарушением или неустойчивостью функций отдельных органов и систем.
3. Период поздних проявлений травматической болезни: развернутая фаза СПОН – если больной выжил в I периоде течения травматической болезни, то протеканием именно этого периода определяется прогноз и исход болезни.
4. Период реабилитации: при благоприятном исходе, характеризуется полным или неполным выздоровлением.
Вышеизложенная концепция призывает рассматривать травматический шок, кровопотерю, посттравматический токсикоз, тромбогеморрагические нарушения, посттравматическую жировую эмболию, СПОН, сепсис не как осложнения политравмы, а как патогенетические связанные звенья единого процесса – травматической болезни [3].
Схема 1. Классификация травм [4]
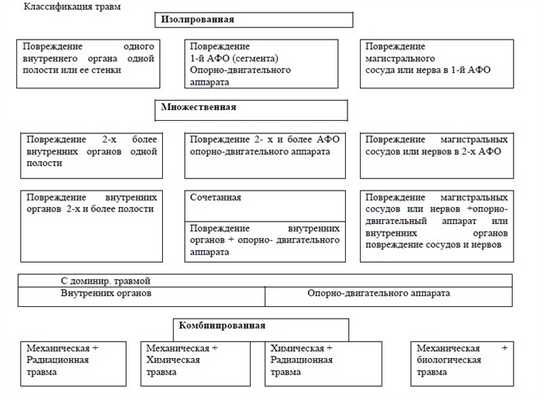
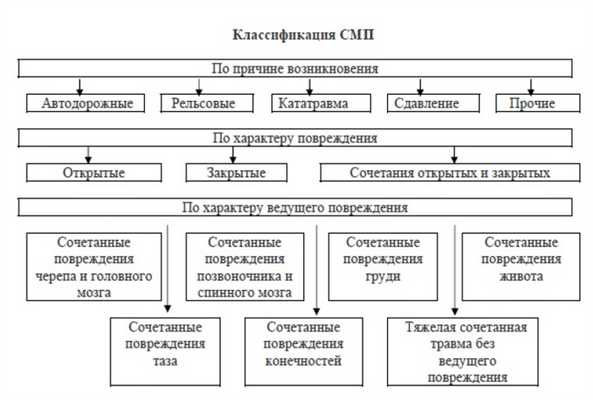
Схема 2. Классификация сочетанных механических повреждений [4].
Диагностика
II. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
3. Общий анализ крови: уровень эритроцитов, лейкоцитов, гемоглобина, гематокрит, СОЭ, агрегация эритроцитов
4. Биохимический анализ крови: общий белок, его фракции, мочевина, креатинин, билирубин и его фракции, ферментативная активность крови, липидный состав крови, электролиты
15. Рентгенография различных сегментов опорно-двигательного аппрата в зависмости от локализации повреждений
16. Компьютерная томография черепа, грудного, абдоминального сегментов позвоночника, таза – по показаниям в зависимости от локализации повреждений, механизма травмы
Транспортировка больного в отделение лучевой диагностики для проведения КТ возможна только после исключения внутрибрюшного кровотечения и патологии органов грудной клетки, требующих оперативного вмешательства.
Оценка состояния больного должна проводится на основании результатов проведенных обследований по интегральным прогностическим шкалам [7.]
Для оценки тяжести травмы используется шкала TRISS, базирующаяся на шкале RTS с поправкой на возраст.
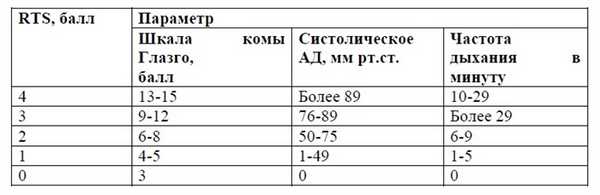
Таблица 3. Шкала Revised Trauma Score (RTS)[7]
b0 , b1 , b2 ,b3 - коэффициенты, полученные методом регрессивного анализа (разные для закрытой и открытой травмы).
Таблица 4. Шкала оценки острого и хронического состояния здоровья II – The Acute Physiology and Chronic Health Evaluation II (APACHE II) [Knaus W.A. et al., 1985]
А. Физиологическое состояние здоровья
- Тяжелая хроническая обструктивная болезнь легких (гиперкапния, необходимость проведения кислородотерапии в условиях дома)
C. Коррекция хроническими заболеваниями
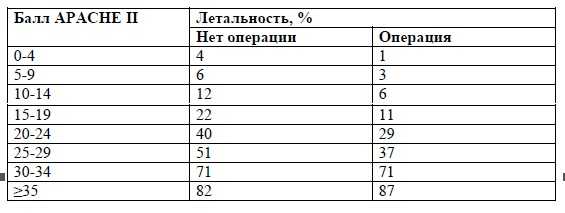
Таблица 5. Общая сумма баллов APACHE II
Анамнез: полезна первичная информация, которую могут сообщить родственники пострадавшего, очевидцы случившегося или сотрудники бригады, доставившие пострадавшего с места травмы.
Своевременная и краткая информация о механизме травмы , времени от момента травмы, величине ориентировочной кровопотери на месте травмы может значительно облеглить работу врачей и улучшить ее результаты.
В первую очередь проводится оценка нарушений сознания. С этой целью более удобно пользоваться шкалой ком Глазго – Glasgow Come Scale (GCS) (см.таб.1)
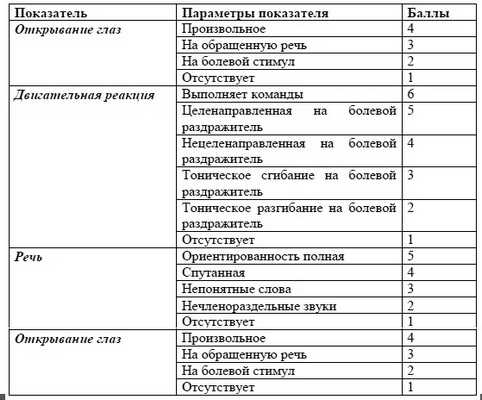
Таблица 1. Шкала ком Глазго
Градации расстройств сознания
Необходимо тщательно осмотреть глазные яблоки, оценить ширину зрачков и выявить наличие глазодвигательных нарушений как признака внутричерепного объемного процесса. Следует осмотреть волосистую часть головы, ротоглотку и все кожные покровы с целью выявления проникающих повреждений и инородных тел (в том числе протезов глазных яблок и вставных челюстей).
Целесообразно считать, что все пациенты с политравмой «условно» имеют повреждение шейного отдела позвоночника. Эта концепция требует обязательного применения коаксальной стабилизации при помощи жесткого съемного воротника начиная с догоспитального этапа оказания медицинской помощи. Подозрение на повреждение шейного отдела позвоночника снимается только после рентгенологического контроля, даже несмотря на высокий уровень сознания пострадавшего и отсутствие выраженной очаговой симптоматики!
При осмотре грудной клетки следует обратить внимание на видимую деформацию и асимметричное участие грудной клетки в акте дыхания. Необходимо внимательно осмотреть состояние ключиц, ребер и осторожно после поворота пострадавшего на бок – грудной и поясничный отделы позвоночника. Деформация грудной клетки свидетельствует о травме грудной клетки с нарушением ее каркасной функции и развитием гемо- или пневмотораксов. Наличие набухания яремных вен на фоне низких показателей системного АД в сочетании с деформацией грудной клетки или наличием проникающего ранения в «опасной» зоне позволяет заподозрить ранение сердца с развитием его тампонады.
Слева – среднеподмышечная линия
Выявленная у пострадавшего деформация позвоночника, болезненность при пальпации может свидетельствовать о его повреждении. Отсутствие у пострадавшего активных движений в нижних конечностях, выраженный брюшной тип дыхания при слабой экскурсии грудной клетки может быть признаком повреждения спинного мозга.
Первичный осмотр передней брюшной стенки при политравме недостаточно информативен. Однако необходимо осмотреть кожные покровы с целью выявления кровоизлияний в проекции паренхиматозных органов. Если пострадавший в сознании, то пальпация живота может выявить симптомы раздражения брюшины. В обязательном порядке должна быть визуально осмотрена промежность с проведением ректального и вагинального исследований. Катетеризация мочевого пузыря проводится осторожно с учетом возможного повреждения уретры. Макрогематурия является показанием для проведения рентгенологических исследований с использованием контраста с целью исключения повреждения мочевого пузыря и почек.
В случае отсутствия сознания или при его значительном угнетении клинические методы (перкуторное определение уровня жидкости, аускультация, определение увеличения окружности живота в динамике) не могут исключить патологию органов брюшной полости. Тогда исключение патологии органов брюшной полости (в первую очередь паренхиматозных) становится приоритетным для следующего диагностического этапа – «инструментального».
Осмотр верхних и нижних конечностей направлен на выявление деформации, переломов трубчатых костей и повреждение суставов. Особое внимание следует уделить выявлению возможных переломов костей таза. Иммобилизация переломов должна проводится на догоспитальном этапе, в противном случае это следует сделать сразу при поступлении в стационар.
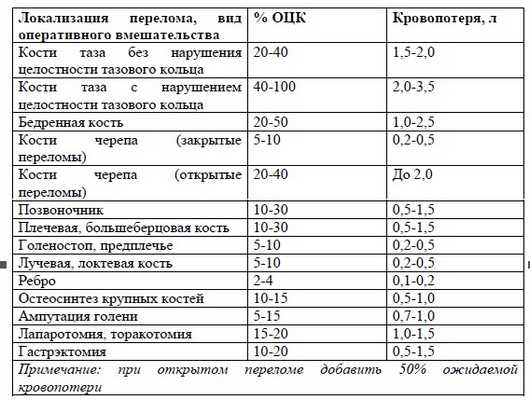
Все пациенты с политравмой в обязательном порядке должны совместно осматриваться травматологом, реаниматологом, хирургом, нейрохирургом.
Консультации других специалистов – в зависимости от локализации повреждений (оториноларинголог, челюстно-лицевой хирург, уролог) и наличия комбинированной травмы (комбустиолог).
Лечение
Цель лечения: стабилизация состояния больного и профилактика септических осложнений, синдрома осрого повреждения легкого, полиорганной недостаточности.
Режим в зависимости от тяжести состояния – 1, 2, 3. Диета – 15; другие виды диет назначаются в зависимости от сопутствующей патологии
2. Обеспечение адекватной перфузии тканей, что достигается коррекцией острой кровопотери, гиповолемических и метаболических расстройств.
5. Оперативное лечение повреждений.
Абсолютные показания для эндотрахеальной интубации(интубация трахеи и перевод на ИВЛ осуществляется при наличии хотя бы одного признака):
3. Угнетение сознания по шкале ком Глазго менее 8 баллов; нарушение механики дыхания (множественные переломы ребер с флотацией грудной клетки).
Дополнительные признаки для эндотрахеальной интубации (интубация трахеи и перевод на ИВЛ производится при наличии хотя бы двух признаков):
Оперативное лечение при сочетанной травме.
Принципы лечебной тактики при сочетанной травме.
В лечении пострадавших с сочетанной травмой принимают участие врачи многих специальности В их задачу входит не только проведение специфических лечебных мероприятий но и определение их последовательности. В зависимости от превалирующего повреждении та или иная специальность выходит на первый план, становится ведущей в лечении конкретною больного на определенном промежутке времени.
Лечение пострадавшего с сочетанной травмой включает проблемы реаниматологии, анестезиологии, хирургии, травматологии, нейрохирургии, трансфузиологии, иммунологии и т.д. Естественно, мы не претендуем на исчерпывающее раскрытие всех этих проблем, которые, несомненно, имеют свои особенности у пострадавших с данной патологией. Вместе с тем хирург, определяя показания к операции, выбирая ее объем и характер, не может не учитывать нарушений гемодинамики и метаболизма, острой дыхательной недостаточности, сопутствующей патологии.
В абсолютном большинстве работ показаниями к проведению оперативного вмешательства являются гемоперитонеум независимо от его величины, а также любое повреждение органов брюшной полости с нарушением их целости [Шапошников Ю.Г. и др., 1986; Пушков А.А., 1998 : Картавенко В.И. и др., 2001; Шмидт И.З. и др., 2003; Condon R.E. et al., 1998, и др.]. Однако в 50—80 % случаев при лапаротомии, выполненной в связи с гемоперитонеумом травматического генеза. признаков продолжающегося кровотечения не выявляется, а повреждения органов брюшной полости не считаются опасными для жизни [Mischinger H.L. et al., 1999]. Проведение подобных лапаротомии является дополнительной травмой для пострадавшего [Ермолов А.С. и др., 2002].
Эндоскопическое устранение гемоперитонеума, осмотр органов брюшной полости и дренирование брюшной полости в этих случаях приводят к излечению больных [Штарко В.И. и др., 1995; Ситников В.Н. и др., 1995; Рыбачков В.В. и др., 2001; Тимербулатов В.М. и др., 2001; Борисов А.Е. и др., 2003], хотя, как было показано выше, применение лапароскопии у пострадавших, находящихся в крайне тяжелом состоянии, способно усугубить гемодинамические нарушения. Кроме того, лапароскопия не позволяет диагностировать внутриорганные повреждения. По мнению ряда авторов, выбор между наблюдением и хирургическим вмешательством зависит не от объема гемоперитонеума, а от гемодинамической стабильности пациента [Hamour O.A. et aL 1996; Cuff R.F. et al., 1999]. Данная тактика не может быть использована у пострадавших с сочетанными повреждениями в связи с возникающими при ЧМТ гипертонией и брадикардией
Классификация оперативных вмешательств, выполняемых при повреждениях живота, основана на показаниях и сроках выполнения операций. Взяв за основу классификацию, используемую в России |Гуманенко Е.К., 1997], и несколько видоизменив ее, мы распределили оперативные вмешательства на следующие группы.

Неотложные операции проводили пострадавшим одновременно с реанимационными пособиями независимо от тяжести состояния больных. Вмешательство было направлено на устранение нарушений жизненно важных функции организма (как правило, при массивном внутрибрюшном кровотечении и повреждении органов желудочно-кишечного тракта).
Тяжесть состояния пострадавших, продолжающееся кровотечение, нарастающая дыхательная недостаточность и явления дислокации головного мозга предъявляют жесткие требования к определению хирургической тактики. При этом решающая роль принадлежит правильному выбору оперативных доступов, очередности и объему операций.
При наличии одновременно показаний к торакотомии и лапаротомии в первую очередь выполняют торакотомию. В остальных случаях сочетанных повреждений груди и живота производят дренирование плевральной полости, а затем лапаротомию. Если одновременно есть показания к торакотомии и декомпрессивной трепанации черепа, первой выполняют торакотомию.
У пострадавших с тяжелой травмой черепа, требующей экстренной декомпрессивной трепанации, и с повреждением органов брюшной полости, требующим экстренной лапаротомии, операции выполняют одновременно две бригады.
При повреждении сосудов конечностей и органов брюшной полости операции производят либо одновременно (при наличии профузного внутрибрюшного кровотечения), либо вначале выполняют операцию на сосудах, а затем — лапаротомию. Пострадавших с открытыми переломами конечностей и ранами мягких тканей оперируют после лапаротомии.
При наличии абсолютных показаний к операции, которая является жизнеспасаюшей, дооперационное выяснение степени риска хирургического вмешательства играет второстепенную роль [Bartels H. et al., 1997]. В то же время у пострадавших с сочетанной травмой достаточно часто возникает ситуация, когда диагностированная пагология может быть излечена как хирургическим, так и консервативным путем, однако при этом существуют объективные критерии, руководствуясь которыми хирург и реаниматолог должны стремиться уменьшить риск развития осложнении и неблагоприятного исхода. В группе несложных вмешательств особо следует выделять диагностические операции, которые выполняли при невозможности исключить повреждения органов брюшной полости. Несмотря на их относительно малое число (17 наблюдении из 267, что с ставляет 6,4 %), уровень летальности при этом достиг их 47 % (умерли 8 из 17 пострадавших).
Срочные операции производили пострадавшим при повреждении органов брюшной полости (печень, селезенка поджелудочная железа, сосуды брыжейки) при увеличивающемся в процессе наблюдения гемоперитонеуме свыше 500 мл а также при разрывах мочевого пузыря, разрывах почек, проникающих в чашечно-лоханочную систему, разрывах диафрагмы. Эти операции выполняли после стабилизации основных гемодинамических показателей.
Отсроченные операции выполняли, как правило, в сроки от нескольких дней до 3—4 нед после поступления в стационар пострадавшим с внутриорганными гематомами печени или селезенки. Лица с гематомами паренхиматозных органов находились под динамическим наблюдением с использованием УЗИ и КТ Увеличение объема гематомы, изменение конфигурации и размеров органа являются прогностическими признаками высокой вероятности ее разрыва, поэтому такие пострадавшие подлежали хирургическому лечению, несмотря на отсутствие в данный момент внутрибрюшного кровотечения.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
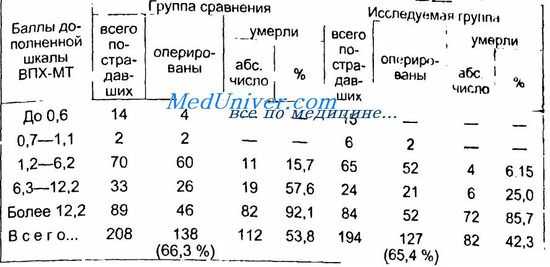
Оперативные вмешательства по поводу повреждения органов брюшной полости произведены 265 пострадавшим обеих групп. При сравнении результатов хирургического лечения в зависимости от применяемой лечебно-диагностической тактики видно, что уровень летальности при всех видах операций был существенно ниже при использовании предлагаемой методики. Летальность среди пострадавших, оперированных по поводу повреждении органов брюшной полости, снизилась с 42,8 % (59 случаев летального исхода среди 138 пострадавших) до 35,4 % (45 летальных исходов среди 127 пострадавших). При этом удалось полностью избежать проведения диагностических лапаротомий.
Результаты лечения в зависимости от тяжести состояния пострадавших при поступлении и выбранной лечебно-диагностической тактики представлены в табл. 3.5.
Как следует из таблице, предлагаемый лечебно-диагностический алгоритм позволяет не только ускорить дооперационное обследование пострадавшего, но и выбрать оптимальную тактику лечения, что способствует снижению летальности у данной группы больных с 53,8 до 42,3 %.
Уменьшение времени дооперационного обследования и использование инвазивных методов исследования (лапароскопия и лапароцентез) без задержки, но только при неясной клинической и сонографической картине позволяют добиться снижения летальности при всех степенях тяжести механических повреждений и исключить проведение диагностических лапаротомий. Особенно ярко это прослеживаете я при тяжелых и крайне тяжелых сочетанных повреждениях — свыше 1,2 балла по дополненной шкале ВПХ-МТ.
Использование предложенного алгоритма позволило снизить легальность при различной степени тяжести повреждения живота. Стопроцентная летальность при тяжести повреждения органов брюшной полости 15 баллов (повреждения живота с разрывом трех органов, причем два разрыва тяжелые), 19 баллов (разрыв аорты, нижней полой, воротной или печеночных вен) была связана с характером повреждения, а не с эффективностью диагностики.
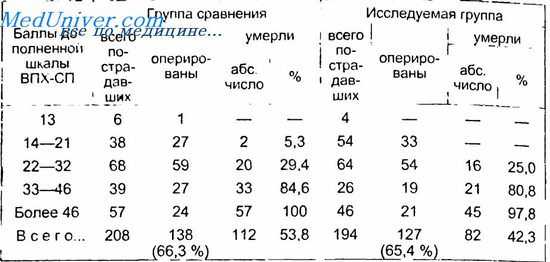
Результаты лечения пострадавших с повреждениями живота при сочетаннои травме в зависимости от их тяжести состояния и использованного лечебно-диагностического алгоритма
Иллюстрацией эффективности предлагаемого лечебно-диагностического алгоритма в диагностике повреждений живота у пострадавших с сочетаннои травмой являются следующие примеры.
Больная Б., 24 лет, поступила в ГКБ № 64 16 ноября. Избита за сутки до поступления При поступлении состояние средней тяжести (16 баллов по дополненной шкале ВПХ-СП; прогнозируемая летальность до 3 %, частота развития осложнений до 25 %). Сознание сохранено, бледна. Жалобы на боль в пр «вой половине живота. Живот при пальпации мягкий, болезненный в правой половине. Симптом Щеткина—Блюмберга отрицательный. АД 150/90 мм рт. ст., ЧСС 76 в 1 мин, ЧД 18 в 1 мин. Выявлен перелом X ребра слева. При УЗИ, выполненном через 20 мин после поступления, обнаружено незначительное количество свободной жидкости в малом тазу. Селезенка не увеличена, контуры ее ровные, в паренхиме верхнего полюса определяется жидкостное образование неправильной формы размером 21 х 16 мм. Для уточнения характера патологии и решения вопроса об оперативном лечении выполнена видеолапароскопия. В брюшной полости выявлено до 250 мл крови. Селезенка в поле зрения не выводится. В области селезенки — фиксированные сгустки размером 3 х 4 и 4 х 5 см. В связи с инструментальной картиной повреждения селезенки больная была оперирована. На операции в брюшной полости выявлен гемоперитонеум 250 мл, в области ворот селезенки — фиксированный сгусток крови, после удаления которого началось кровотечение из разрыва селезенки. Произведена спленэктомия. Послеоперационный период протекал без осложнений. Выписана в удовлетворительном состоянии.
В данном случае быстрое использование УЗИ и видеолапароскопии, результаты которых взаимно дополняли друг друга, позволило своевременно установить показания к оперативному лечению и провести его до возникновения массивного внутрибрюшного кровотечения.
Больной Ш., 43 лет, посипит в НИИСП им. Н.В. Склифосовского через 2 сут после автотравмы (находился за рулем). Состояние при поступлении средней тяжести (17 баллов по дополненной шкале ВПХ-СП; прогнозируемая летальность до 3 % частота развития осложнений до 25 %). Сознание сохранено. Жалобы на интенсивную боль в левом подреберье. АД 120/80 мм рт. ст., ЧСС 98 в 1 мин, ЧД 20 в 1 мин. Выявлены множественные (с III по X) переломы ребер справа гемопневмоторакс. Живот не вздут, ограниченно участвует в акте дыхания, резко бо!езненныи при пальпации в левом подреберье, где определяется симптом Шеткина— Блюмберга При УЗИ выявлена свободная жидкость в нижних отделах живота и между петлями тонкой кишки (разобщение листков брюшины 1,0—1,5 см). В связи с неоднозначностью клинической и сонографической картин произведена видеолапароскопия, при которой во всех отделах брюшной полости обнаружены небольшие скопления темной крови. Серозная оболочка петли тонкой кишки, находящейся в малом тазу, на протяжении 3 см пропитана кровью. Повреждений печени и селезенки нет. Заключение: ушиб участка тонкой кишки.
Учитывая данные лапароскопии, от оперативного лечения у данного больного отказались. Произведено дренирование плевральной полости. Для динамического контроля в последующие дни трижды выполняли УЗИ с интервалами 2—3 дня. При УЗИ свободной жидкости в брюшной полости не выявлено. Выписан в удовлетворительном состоянии на 39-е сутки после поступления.
Это наблюдение доказывает эффективность предлагаемой лечебно-диагностической схемы у пострадавших, не нуждающихся в оперативном лечении.
Больной Ф., 23 лет, поступил в НИИСП им. Н.В. Склифосовского в 07.00 24 июля, через 2 ч после получения травмы (избит). Состояние при поступлении средней тяжести (17 баллов по дополненной шкале ВПХ-СП; прогнозируемая летальность до 3 %, частота развития осложнений до 25 %), в сознании. Жалобы на головную боль, незначительные боли в животе. АД 120/80 мм рт. ст., ЧСС 100 в 1 мин, ЧД 18 в 1 мин. Живот участвует в акте дыхания, при пальпации мягким, болезненный в правом подреберье. Перитонеальная симптоматика отсутствует. Диагностировано сотрясение головного мозга. При УЗИ, выполненном через 30 мин после поступления, свободной жидкости в брюшной полости не обнаружено. Выявляется ушиб левой почки. Через 3 ч с момента поступления больной начал отмечать усиление боли в правом подреберье. При пальпации живота в этой области определялась болезненность. Перитонеальная симптоматика отсутствовала. В отлогих местах живота укорочение перкуторного звука не определялось. При повторном УЗИ свободной жидкости в брюшной полости не выявлено. Определялась утолщенная до 7 мм стенка желчного пузыря с признаками удвоения контура. Заключение: травма желчного пузыря?, острый холецистит?
В связи с неясностью клинической картины и ее несоответствием данным УЗИ выполнена видеолапароскопия. В брюшной полости обнаружены небольшое количество фибринозного выпота с примесью желчи, гематома стенки желчного пузыря 3 х 1 см, имбибиция желчью гепатодуоденальнои связки и забрюшинной клетчатки в области двенадцатиперстнои кишки. Заключение: разрыв двенадцатиперстной кишки. Данные видеолапароскопии послужили основанием для проведения оперативною лечения. При лапаротомии после мобилизации двенадцатиперстной кишки по Кохеру на переднеправой стенке нисходящей её части выявлен разрыв 2 х 1 см с поступлением из него желчи Разрыв ушит двухрядным викриловым швом на атравматической игле В связи с гематомой стенки желчного пузыря наложена холецистостома ппоиз ведено дренирование брюшной полости. Пocлeoпepaционный, период протекал гладко. Холецистостомическая трубка удалена на 15-е сутки после операции. Выписан на 22-е сутки после поступления.
В данном наблюдении применение лапароскопии, при несоответствии клинической и сонографической картин, позволило выявить разрыв двенадцатиперстной кишки до развития забрюшинной флегмоны и распространенного перитонита.
Особенно важно, что у всех 24 пострадавших с гемоперитонеумом менее 500 мл крови без признаков продолжающегося кровотечения (что было установлено инструментальными методами диагностики) применение предлагаемого диагностического алгоритма позволило избежать неоправданной лапаротомии.
Больной К., 26 лет. поступил в реанимационное отделение НИИСП им. Н.В. Склифосовского в 21.00 14 января, через 50 мин после автотравмы. Состояние при поступлении тяжелое (32 балла по дополненной шкале ВПХ-СП; прогнозируемая летальность до 30 %, вероятность развития осложнений до 50 %), уровень сознания — кома. АД 140/80 мм рт. ст., ЧСС 100 в 1 мин, ЧД 22 в 1 мин. Начаты реанимационные мероприятия, ИВЛ. Выявлены перелом свода черепа, ушиб мозга правой лобной доли, субарахноидальное кровоизлияние, перелом VIII—XI ребер справа. Живот не вздут, в отлогих его местах укорочение перкуторного звука отсутствует. При обзорной рентгенографии обнаружены свободная жидкость в брюшной полости, забрюшинная гематома. При УЗИ, выполненном через 10 мин после поступления, гидроперитонеума не выявлено. Обнаружены ушиб правой почки, забрюшинная гематома. Через 2,5 ч при контрольном УЗИ найдено минимальное количество жидкости в брюшной полости, подтвержден ушиб правой почки, забрюшинная гематома. За время лечения гемодинамика больного оставалась стабильной При очередном УЗИ выявлен ушиб правой доли печени без признаков гематомы. При последующих УЗИ определялся регресс ушиба печени. Свободная жидкость в брюшной полости перестала определяться к концу 2-х суток после поступления пострадавшего в институт. На 30-е сутки больной выписан в удовлетворительном состоянии.
Таким образом, УЗИ позволило выявить гемоперитонеум небольшого объема, исключив при этом его нарастание, что дало возможность избежать диагностической лапаротомии.
Характер и виды операций при сочетанной травме.
Оценивая степень риска, присущего хирургическому или консервативному методам лечения, врач выбирает более безопасную и надежную тактику. Оценка степени риска включает определение не только тяжести состояния пострадавшего в данный момент (что является динамичной, изменчивой величиной), но и общей тяжести повреждений, возраста, характера сопутствующих заболеваний (сахарный диабет, ишемическая болезнь сердца и т.д.).
В отдельную группу нами выделены операции, осуществляемые вследствие возникших осложнений, непосредственно не связанных с травмой. Показанием к их выполнению служили осложнения в результате травматической болезни либо осложнения, возникшие как следствие лечебных манипуляции.
Указанное распределение операций на группы стало возможным с внедрением в хирургическую практику современных инструментальных методов исследования, результаты которых в отдельности или комплексно позволяют, как правило, выявить и объективно оценить объем гемоперитонеума или повреждения полых органов брюшной полости и избирательно подходить к решению вопроса об оперативном лечении.
Распределение пострадавших с повреждениями живота при сочетанной травме в зависимости от характера абдоминальных операций
Из 402 пострадавших с повреждениями живота при сочетанной травме оперативные вмешательства по поводу повреждения органов брюшной полости произведены у 265 (65,9 %). По поводу осложнений, непосредственно не связанных с травмой, оперированы 2 больных.
Распределение пострадавших по четырем группам операций представлено в таблице. Неотложные операции произведены 190 пострадавшим. Типичным доступом (в 189 случаях) была срединная лапаротомия, которая у 4 больных была продолжена разрезом в правое или левое подреберье. В одном наблюдении ушивание разрыва левого купола диафрагмы с ревизией и низведением селезенки и части поперечной ободочной кишки в брюшную полость проводили через торакотомный доступ.
139 (73,2 %) операций начаты в первые 3 ч с момента поступления пострадавших в стационар. Выполнение оперативного лечения в сроки свыше 3 ч было связано с отсутствием убедительных данных о повреждении органов брюшной полости при первичном УЗИ, необходимостью выполнения лапароцентеза или лапароскопии (у 22 пострадавших), задержкой, связанной с использованием инструментальных методов исследования (у 27 пострадавших).
Наиболее часто показанием к оперативному вмешательству была травма селезенки (72 наблюдения) и печени (67 наблюдений). У 51 (26,8 %) пациента имелись множественные повреждения живота. Повреждения органов брюшной полости доминировали у 137 (72,1 %) оперированных.
У 101 пострадавшего для восполнения кровопотери использовали аутокровь (у 76 — реинфузию цельной крови и у 25 — реинфузию отмытых аутоэритроцитов с гематокритом не менее 65 %).
Причины отсутствия хирургической операции у пострадав ших с гемоперитонеумом более 500 мл
После операций, выполненных по неотложным показаниям, умерли 80 больных (42,1 %), из них 46 - в первые сутки после поступления в стационар. Основными причинами смерти были острая массивная кровопотеря в сочетании с травматическим шоком (49 наблюдении), пневмонии (9) и последствия ЧМТ (7 наблюдений).
Гемоперитонеум 500 мл и более у неоперированных больных с тяжелыми повреждениями органов брюшной полости наблюдали в 21 случае. Причины невыполнения хирургической операции у этих пострадавших представлены в табл. 4.2 Все пострадавшие погибли в течение первых суток с момента поступления. Во всех случаях причиной смерти был травматический шок в сочетании с кровопотерей; у 20 больных состояние при поступлении оценивалось как критическое (более 46 баллов по дополненной шкале ВПХ-СП, прогноз летальности — 99— 100 %, частота развития осложнений — 100 %), один пациент находился в крайне тяжелом состоянии (38 баллов по дополненной шкале ВПХ-СП, прогноз летальности — 85 %. частота развития осложнений — 90 %). У всех пострадавших характер механических повреждений оценивался как крайне тяжелый (более 12,2 балла по дополненной шкапе ВПХ-МТ). У 5 пострадавших показания к оперативному вмешательству выявлены в первые 30—40 мин с момента поступления, однако смерть больных наступила в момент подготовки к операции.
У 6 пострадавших смерть наступила в течение первого часа с момента поступления, до осмотра хирургом и использования инструментальных методов исследования.
Однократное УЗ-исследование проведено 5 больным, при этом данных о гемоперитонеуме получено не было. Повторные исследования не производили. В одном случае смерть наступила во время наложения пневмоперитонеума для проведения лапароскопии. Эти примеры показывают важность скорости выполнения и информационной точности инструментальных методов исследования, а также выбора правильной лечебной тактики у пострадавших с сочетанными повреждениями.
Патофизиологическая роль и тактика хирургического лечения скелетных повреждений при сочетанной черепно-мозговой травме
В обзоре представлены результаты экспериментальных и клинических исследований патофизиологических взаимовлияний скелетной травмы и черепно-мозговой травмы (ЧМТ) при политравме. Рассмотрены проблемы выбора сроков и метода остеосинтеза переломов костей конечностей и таза, сочетанных с травмой головы. Факторами отягощения сочетанной ЧМТ со стороны переломов длинных трубчатых костей и костей таза являются их шокогенность, кровопотеря, усиление системной воспалительной реакции и коагулопатии, что повышает вероятность вторичного поражения головного мозга и легких, развития эмболических, легочных осложнений и полиорганной недостаточности. Ранний остеосинтез при переломах бедренной кости, нестабильных переломах костей таза может уменьшить частоту системных осложнений, снизить летальность и улучшить анатомо-функциональные результаты лечения при политравме. Но необоснованно ранний остеосинтез, являясь операционной травмой, может провоцировать эффект «второго удара» и увеличить тяжесть повреждения головного мозга. Безопасность выполнения окончательного остеосинтеза у пациентов с сочетанной ЧМТ определяется уровнем сознания, показателями гемодинамики, церебрального перфузионного давления, внутричерепного давления, гипоксемии, тяжестью первичного повреждения мозга. Тактика этапного лечения (Damage Control Orthopedics) позволяет минимизировать риск вторичного повреждения мозга у пациентов с тяжелой и среднетяжелой ЧМТ. Изучение патофизиологических взаимодействий скелетной и черепно-мозговой травм, механизмов поражения головного мозга при феномене «второго удара» может стать основой для разработки и оптимизации клинических концепций лечения переломов костей при политравме.
Ключевые слова: политравма, сочетание повреждений, черепно-мозговая травма, переломы костей, «второй удар», вторичное повреждение мозга, воспалительный ответ, полиорганная недостаточность, контроль скелетных повреждений, интрамедуллярный остеосинтез.
Для цитирования: Шапкин Ю.Г., Селиверстов П.А. Патофизиологическая роль и тактика хирургического лечения скелетных повреждений при сочетанной черепно-мозговой травме. РМЖ. 2017;8:523-528.
Pathophysiological role and tactics of surgical treatment of skeletal lesions in the concomitant brain injury
Shapkin Y.G., Seliverstov P.A.
Saratov State Medical University named after V.I. Razumovsky
The review presents the results of experimental and clinical studies of the pathophysiological interactions of skeletal and concomitant brain injury in polytrauma. The article considers the problems of timing and the method of osteosynthesis of bones fractures of the extremities and pelvis combined with the head trauma. Factors of complication of the concomitant brain injury from the fractures of long tubular bones and pelvic bones are the shock-producing effect, blood loss, increased systemic inflammatory reaction and coagulopathy, which increases the probability of secondary damage to the brain and lungs, development of embolic, pulmonary complications and multiple organ failure. Early osteosynthesis in fractures of the femur, unstable fractures of the pelvic bones can reduce the frequency of systemic complications, reduce lethality and improve the anatomical and functional results of treating the polytrauma. But early unjustified osteosynthesis, being an operational trauma, can provoke the effect of a "second stroke" and increase the severity of brain damage. The safety of the final osteosynthesis in patients with concomitant brain injury is determined by the level of consciousness, hemodynamic parameters, cerebral perfusion pressure, intracranial pressure, hypoxemia, the severity of primary brain damage. The tactics of the step-wise treatment of Damage Control Orthopedics allow to minimize the risk of secondary brain damage in patients with severe and moderate traumatic brain injury. The study of pathophysiological interactions of skeletal and traumatic brain injury, mechanisms of brain damage in the phenomenon of "second hit" can become the basis for the development and optimization of clinical concepts for the treatment of bones fractures in polytrauma.
Key words: polytrauma, associated injury, traumatic brain injury, fractures, secondary brain injury, «second stroke», inflammatory response, multiple organ failure, control of skeletal injuries, intramedullary osteosynthesis.
For citation: Shapkin Y.G., Seliverstov P.A. Pathophysiological role and tactics of surgical treatment of skeletal lesions in the concomitant brain injury // RMJ. 2017. № 8. P. 523–528.
Статья посвящена хирургическому лечению скелетных повреждений при сочетанной черепно-мозговой травме
Сочетание черепно-мозговой травмы (ЧМТ) с переломами костей конечностей и таза наиболее распространено в клинической практике и встречается в 40–70% случаев политравмы [1, 2], определяемой как множественная травма с тяжестью повреждений по шкале ISS (Injury Severity Scale) ≥16 баллов [3]. В большинстве случаев скелетные повреждения при политравме требуют оперативного лечения, которое является дополнительной агрессией и оказывает существенное влияние на развитие и тяжесть системного воспалительного ответа, коагулопатии, гипоксии, ацидоза, а также связанного с ними вторичного повреждения внутренних органов. Согласно концепции «двойного удара» патофизиологические процессы, развивающиеся вследствие хирургического лечения повреждений, сходны с реакцией на исходную травму («первым ударом») и получили название «второй удар» (second hit) [3, 4]. Травмированный головной мозг наиболее подвержен вторичному поражению при проявлении феномена «второго удара» после операций остеосинтеза [5]. Если в отношении повреждений внутренних органов при политравме тактика лечения достаточно четко определена, то в выборе сроков и методов оперативной фиксации переломов костей, сочетанных с ЧМТ, существуют серьезные противоречия. Решение данного вопроса затруднено ввиду недостаточной изученности патофизиологических взаимовлияний скелетной травмы и ЧМТ, механизмов вторичного повреждения головного мозга при хирургическом лечении переломов костей.
Роль скелетных повреждений в отягощении сочетанной ЧМТ
Переломы длинных трубчатых костей и костей таза с тяжестью повреждений по AIS (Abbreviated Injury Scale) ≥2 баллов формируют при политравме феномен взаимного отягощения повреждений. При этом патологические факторы не просто суммируются, а образуют усугубляющий эффект, проявляющийся в более тяжелом течении каждого повреждения в отдельности, с большим риском развития осложнений и летального исхода, чем при изолированной травме [6].
Сложные переломы костей таза, позвоночника и крупных сегментов конечностей при сочетанной травме существенно увеличивают кровопотерю и становятся одним из основных шокогенных факторов. Шок и кровопотеря, связанные со скелетными повреждениями, у пострадавших с сочетанной ЧМТ могут вызывать вторичный ишемический инсульт головного мозга вследствие гипотонии и гипоксемии, а при поражении ствола мозга – усугублять нарушения кровообращения и дыхания. В эксперименте воспроизведение геморрагического шока у мышей с моделью «контролируемого коркового повреждения» головного мозга и перелома бедренной кости увеличивало выраженность дегенеративных изменений корковых клеток и реактивного астроглиоза [7]. Геморрагический шок приводил к увеличению отека и объема повреждения мозга на 33,3%, а также вызывал поведенческие расстройства у животных к 14-му дню после травмы [8].
Клинические исследования показали, что факторами риска летального исхода сочетанной ЧМТ становятся экстракраниальные скелетные повреждения с тяжестью по шкале AIS ≥3 баллов [9], тяжесть травмы по шкале ISS ≥40 баллов, позвоночно-спинальная травма, эпизоды гипоксемии и артериальной гипотензии ниже 90 мм рт. ст., развитие послеоперационных осложнений [10]. При сочетанной ЧМТ переломы костей таза, бедренной кости и позвоночника в большей степени снижают мобильность больного и увеличивают частоту жировой эмболии, тромбоэмболических осложнений [11, 12], острого респираторного дистресс-синдрома (ОРДС), пневмонии, сепсиса [2, 13].
Жировая эмболия при скелетной травме развивается чаще, чем клинически выявляется, приводит к нарушениям мозгового кровообращения и усугубляет состояние пострадавших с ЧМТ. При транскраниальной допплерографии у всех больных с переломами длинных костей в течение 4-х дней после травмы выявлялись признаки церебральной жировой микроэмболии сосудов мозга [14]. Жировая эмболия обнаружена у 57% умерших от политравмы с тяжелыми скелетными повреждениями и в большинстве случаев сочеталась с пневмонией, отеком головного мозга и легких [15].
ЧМТ, наряду с переломами костей, также относят к факторам риска тромбоза глубоких вен [16]. По данным В.А. Соколова (2005), при сочетании скелетной травмы и ЧМТ частота флеботромбозов повышалась до 10,5%, что становилось причиной тромбоэмболии легочной артерии в 5,2% случаев [6]. Выявленная у больных с тяжелой сочетанной ЧМТ корреляция показателей метаболического ацидоза и гиперкоагуляции отражает возможные механизмы развития синдрома диссеминированного внутрисосудистого свертывания [17]. Одной из причин формирования коагулопатии при ЧМТ служит генерация тромбина тканевым фактором, поступающим в церебральный и системный кровоток из поврежденной мозговой ткани вследствие нарушения гематоэнцефалического барьера [18].
Системное воспаление становится одной из наиболее важных причин вторичного повреждения головного мозга при сочетанной ЧМТ [19]. Роль скелетных повреждений в воспалительных реакциях при политравме до конца не выяснена. Клинические и экспериментальные исследования показывают, что переломы костей и повреждения мягких тканей при политравме приобретают роль значимых очагов местной воспалительной реакции. Нейтрофилы и макрофаги представляют собой наиболее многочисленную популяцию клеток иммунной системы в гематоме в области перелома кости [20]. Стимуляция эффекторных иммунных клеток в очаге повреждения приводит к продукции ими провоспалительных цитокинов (IL-6, IL-8, амфотерина HMGB1) и усилению локального и системного воспалительного эффекта [21–23]. Одним из механизмов активации иммунных клеток является высвобождение в системный кровоток из поврежденной кости и мягких тканей митохондриальных молекулярных структур, ассоциированных с повреждениями (mtDAMPs). Циркулирующая (внеклеточная) ДНК и пептиды, поступающие в кровоток из поврежденных костей, активируют клеточный иммунный ответ через Toll-like рецепторы, расположенные на макрофагах и нейтрофилах. В итоге развивается системный воспалительный ответ с апоптозом клеток паренхимы внутренних органов [24].
В эксперименте установлено, что вследствие дисфункции гематоэнцефалического барьера каждый из активированных переломом кости факторов воспалительного ответа может модулировать воспалительную реакцию в травмированном головном мозге и увеличивать тяжесть его поражения. У мышей с ЧМТ и закрытым переломом большеберцовой кости, в отличие от мышей с изолированной ЧМТ, отмечено нарушение поведенческих реакций через 30 дней после травмы, а при МРТ выявлены диффузные изменения в головном мозге. Эти эффекты произошли на фоне усугубления местной воспалительной реакции в мозговой ткани в виде значительного увеличения концентрации IL-1, маркера астроглиоза GFAP, нейтрофилов, повышения проницаемости гематоэнцефалического барьера и отека головного мозга [25]. Кроме того, у мышей с подобной моделью сочетанной травмы отмечен больший объем повреждения коры головного мозга, более высокие уровни в крови цитокинов TNF-α, IL-1β, IL-6 и HMGB1 через 2–4 сут после травмы, чем у мышей с изолированной ЧМТ. Выраженность изменений в коре мозга была меньше при блокировании антителами HMGB1, что свидетельствует о его важной роли в формировании очагов вторичного повреждения головного мозга [26].
При сочетании ЧМТ с переломами костей конечностей и шоком развивается более выраженная системная воспалительная реакция и поражение внутренних органов. Так, моделирование перелома бедренной кости и геморрагического шока у мышей с «контролируемым корковым повреждением» головного мозга приводило к повышению уровня цитокинов (TNF-α, CCL2, IL-6) в сыворотке крови и более тяжелым гистопатологическим изменениям головного мозга, легких, почек, селезенки и печени, что значимо увеличивало летальность от полиорганной недостаточности [7, 27].
Повреждения тканей, шок и острая кровопотеря активируют иммунные клетки, продуцирующие провоспалительные и противовоспалительные цитокины, которые определяют параллельное развитие и дисбаланс двух иммунных реакций: системного воспалительного ответа и компенсаторного противовоспалительного ответа [28]. Роль ЧМТ и шока в формировании противовоспалительной реакции при политравме малоизучена. Установлено, что у пациентов с политравмой, включающей тяжелую ЧМТ, по сравнению с пациентами с изолированной ЧМТ в первые сутки после травмы имеется значимо более высокий сывороточный уровень провоспалительного цитокина IL-6, который коррелирует с частотой развития полиорганной недостаточности, сепсиса и неврологическим исходом. Но наиболее высокий уровень IL-6 выявлен у пациентов с политравмой без тяжелой ЧМТ [29]. Воспроизведение геморрагического шока у мышей с «контролируемым корковым повреждением» головного мозга приводило к сдвигу профиля цитокинов в сыворотке от провоспалительных к противовоспалительным, в частности к значимому увеличению уровня IL-10. При этом на уровень цитокинов в ткани травмированного мозга геморрагический шок не оказал существенного влияния [30].
С системной воспалительной реакцией связано развитие окислительного стресса, индуцирующего необратимые нарушения метаболизма и гибель клеток внутренних органов у пострадавших с сочетанной ЧМТ [31]. В эксперименте обнаружено цитотоксическое действие на головной мозг окислительного стресса, вызванного множественными переломами костей конечностей. Дисбаланс в прооксидантной и антиоксидантной системах приводил к повреждению и дегенерации нервных клеток ядер ствола мозга и увеличивал риск летального исхода [32].
При политравме легкие представляют собой уязвимую мишень для вторичного поражения при системном воспалительном ответе, вызванном шоком и множественными переломами костей, что подтверждено в эксперименте [33]. Но при сочетании скелетных повреждений с ЧМТ отмечена значимо более выраженная вторичная местная воспалительная реакция в легких. Так, у крыс с моделью ЧМТ и переломом бедренной кости обнаружены ранние и более серьезные ультраструктурные повреждения в органеллах альвеолоцитов II типа [34] и более высокий уровень цитокинов TNF-α и IL-6 в легочной ткани, чем у крыс с изолированными аналогичными травмами [35]. В клинических исследованиях установлено, что при ЧМТ, сочетанной со скелетными повреждениями, частота пневмонии повышается до 32,2% [6], что объясняют гиповентиляцией легких и гиподинамией [36]. Кроме того, подавление антимикробной функции легких связывают с высвобождением из поврежденной кости формильных пептидов митохондриальных молекулярных структур, ассоциированных с повреждениями (mtDAMPs) [37].
Таким образом, при политравме с ЧМТ факторами отягощения со стороны тяжелых скелетных повреждений являются их шокогенность, увеличение кровопотери и вероятности развития эмболических и легочных осложнений, полиорганной недостаточности. Скелетные повреждения при сочетанной ЧМТ повышают риск вторичного поражения головного мозга за счет артериальной гипотензии и гипоксемии, церебральной жировой эмболии, усиления системной воспалительной реакции и коагулопатии.
Выбор сроков и метода остеосинтеза при скелетных повреждениях, сочетанных с ЧМТ
Заключение
Факторами отягощения сочетанной ЧМТ со стороны переломов длинных трубчатых костей и костей таза являются их шокогенность, кровопотеря, усиление системной воспалительной реакции и коагулопатии, что приводит к вторичному повреждению головного мозга и легких, повышает частоту эмболических, легочных осложнений и полиорганной недостаточности. Переломы костей и повреждения мягких тканей при политравме становятся значимыми источниками факторов системного воспалительного ответа и окислительного стресса, которые проникают через гематоэнцефалический барьер, модулируют иммунные реакции и оказывают цитотоксическое действие в головном мозге, усугубляя тяжесть ЧМТ.
При политравме с ЧМТ ранний остеосинтез при переломах бедренной кости, нестабильных переломах костей таза может уменьшить частоту осложнений (ОРДС, пневмонии, тромбоэмболии легочной артерии, синдрома жировой эмболии, сепсиса и полиорганной недостаточности), снизить летальность и улучшить анатомо-функциональные результаты лечения. Но, являясь операционной травмой, остеосинтез может, наоборот, провоцировать развитие опасных системных осложнений, т. е. вызвать «второй удар». Травматичные, длительные операции остеосинтеза, вызывающие усиление воспалительной реакции, артериальную гипотензию, гипоксию, жировую эмболию, а также чрезмерная интраоперационная инфузионная терапия могут индуцировать у пострадавших с сочетанной ЧМТ апоптоз нейронов, ишемический инсульт и отек головного мозга, усугублять кардиореспираторные нарушения и ухудшать неврологический исход.
Опубликованные данные не указывают однозначно на оптимальный срок окончательного остеосинтеза при переломах длинных костей, сочетанных с тяжелой ЧМТ. Стабильность состояния пострадавшего и безопасность выполнения окончательного остеосинтеза костей конечностей и таза у пациентов с ЧМТ определяются уровнем сознания, показателями гемодинамики, церебрального перфузионного давления, внутричерепного давления, гипоксемии, тяжестью повреждения мозга по данным КТ. Тактика этапного лечения DCO позволяет минимизировать риск вторичного повреждения мозга у пациентов с тяжелой и среднетяжелой ЧМТ.
Изучение патофизиологических взаимодействий скелетной травмы и ЧМТ, механизмов поражения головного мозга при феномене «второго удара» может стать основой для разработки и оптимизации клинических концепций лечения переломов костей при политравме, прогнозирования и профилактики послеоперационных осложнений.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Плевральные сращения. Значение плевральных сращений при искусственном пневмотораксе
- Возбудитель чумы. Механизм развития чумы
- Показания для артроскопической стабилизации при разнонаправленной нестабильности плечевого сустава
- Гипопротромбинемия - причины, клиника
- Криминальные травмы. Насилие в обществе
