Определения генотипа, фенотипа, моногенного заболевания
Добавил пользователь Владимир З. Обновлено: 18.01.2026
Генетические патологии часто диагностируются уже после рождения ребенка.
Эти заболевания отмечаются как при естественном зачатии, так и после использования репродуктивных технологий. Различные генетические нарушения встречаются у 5-6 детей из 100. Генные болезни, спровоцированные мутацией только одного гена, классифицируют как моногенные заболевания.
Что такое моногенные болезни?
Вследствие действия различных факторов с определенной частотой встречаются поломки или изменения только в одном гене.
В зависимости от типа наследования выделяют следующие виды патологий:
В случаях доминантного наследования даже одной пары модифицированного гена достаточно для проявления клинической картины болезни. Такие пациенты, как правило, осведомлены о наличии у себя определенного вида мутации. В таком случае при планировании ребенка удается предупредить передачу генного заболевания, исключив измененные мутацией гены.
При рецессивных изменениях генов полностью отсутствуют клинические проявления болезни. Поэтому в большинстве случаев пациенты не знают о наличии генетической аномалии и передают ее потомству. В тех случаях, когда оба родителя имеют одинаковые пары модифицированных генов, риск развития болезни стремительно возрастает.
Причины возникновения моногенных заболеваний
Моногенные заболевания обладают менделевским типом наследования. Без использования репродуктивных технологий поломанный ген передается по наследству. А риск развития клиники напрямую связан с механизмом такого наследования и наличия сопутствующих факторов.
Точковые мутации – обязательное условия для развития этой группы болезней.
В зависимости от этиологических причин развития моногенных заболеваний их подразделяют на две группы:
- с установленным первичным биохимическим дефектом;
- с неопределенным первичным молекулярным дефектом.
Вторая группа более многочисленна и насчитывает около 90% всех моногенных заболеваний.
Статистика
Распространенность каждого моногенного заболевания различна. Так самые частотные патологии диагностируются у одного ребенка из 500, а более редкие болезни могут встречаться с вероятностью 1:10000.
Если оба родителя имеют одинаковый мутированные ген, то у такого плода риск развития генных болезней существенно увеличивается. Кроме того, если носителем поврежденного гена является только один из родителей, но в семье уже есть дети с моногенной болезнью, риск диагностики патологии у младших детей увеличивается в несколько раз.
Точная диагностика генных мутаций в период планирования беременности позволяет генетику определить индивидуальные риски наследования моногенных болезней. Тем парам, у которых по результатам диагностики риск развития болезней выше среднего рекомендуется воспользоваться репродуктивными технологиями, чтобы не допустить наследования мутированной пары.
Диагностика
- предполагает своевременную диагностику моногенных болезней и определение изолированных генных аллей.
Данное обследование не проводится рутинно и рекомендуется парам, у которых были выявлены случаи врожденных патологий. Исследование на риски развития моногенных болезней минимизирует риск контаминации ДНК матери и плода.
Для этого эмбриолог проводит ряд обязательных тестов для определения оптимальных яйцеклеток для процедуры ЭКО. Использование этого метода диагностики позволяет имплантировать только эмбрионы с правильным генным набором.
- Вторым достоверным методом выявления моногенных заболеваний является неинвазивный пренатальный скрининг.
Это исследование крови, которое проводится после 10 недели гестации позволяет с высокой точностью определить генные мутации и вероятность рождения ребенка с тяжелыми заболеваниями, спровоцированные генными мутациями. Для проведения этого исследования ДНК плода выделяется из периферической крови беременной.
Метод абсолютно безопасный и высокоинформативный. Это позволяет вовремя оценить возможные риски и принять обоснованное решение о сохранении или прерывании беременности.
Лаборатория Медикал Геномикс рекомендует расширенный неинвазивный пренатальный тест VERAGENE
Муковисцидоз
Это генное заболевание спровоцировано модифицированным геном транмембранного регулятора муковисцидоза. Болезнь поражает железы внутренней секреции. Болезнь поражает органы дыхания, пищеварения, встречаются смешанные и изолированные формы. Продолжительность жизни зависит от степени патологических изменений и в среднем составляет около 30 лет. Использование специальных протоколов лечения позволяет минимизировать проявление болезни и улучшить качество жизни пациента.
Бета-талассемия
Данная патология - врожденная гемолитическая анемия, спровоцированная дефектом синтеза гемоглобина. Тяжесть патологии зависит от ее типа. Симптоматика болезни обусловлена изменениями в картине крови и приводит к поражению различных органов и систем. Для коррекции состояния пациента используют регулярные гемотрансфузии, медикаментозную поддержку.
Синдром Барде-Бидля
Это генетическое заболевания отражается на всех органах и системах. Самому негативному влиянию подвержена сетчатка глаз. Что приводит к развитию полной слепоты. Для таких больных свойственно нарушения анатомии тела, для них характерно укорочение ног, патологии развития половых органов. Кроме этого, болезнь способствует психическим и эмоциональным нарушениям, развитию патологий почек.
Артрогриппоз
Заболевание характеризуется нарушением анатомии и функции различных суставов. Встречаются формы, когда изменения наблюдаются только в 1-2 суставах, но не редки случаи, когда весь опорно -двигательный аппарат участвует в патологическом процессе. Деформация суставов приводит к существенному ухудшению качества жизни больного, приковывает его к инвалидной коляске.
Умственная отсталость и судороги (AMRS)
Заболевание характеризуется как экзогенная умственная отсталость. Для больных свойственна судорожная активность. Степень изменения психики зависит от клинического проявления заболевания. Отмечаются формы с сохранением интеллекта и полным нарушением умственной деятельности. Болезнь плохо поддается коррекции и ее течение непрогнозируемо.
Синдром Альстрема
Это цилиапатия, которая проявляется изменением пигментации сетчатки, ожирением, нейросенсорной глухотой. Такие пациенты подвержены проявлению сахарного диабета, кардиомиопатий и тяжелым нарушениям функции почек.
Синдром Андерманна
Это редко диагностируемый симптокомплекс наследственных патологий, который проявляется агенезией мозолистого тела и периферической нейропатией. Болезнь проявляется в первые часы после рождения, после чего стремительно прогрессирует. Выживаемость в среднем не составляет более 5х лет.
Аутосомно-рецессивная поликистозная болезнь почек
Эта болезнь проявляется кистозными изменениями в структуре почек. Болезнь в большинстве случаев имеет двустороннее проявление. Стремительное прогрессирование патологии приводит к увеличению почек.
Это состояния проявляется нарастанием почечной недостаточности. Для коррекции изменений больным проводятся процедуры гемодиализа, медикаментозная поддержка, пересадка трупного органа.
Своевременная диагностика моногенных заболеваний и использование репродуктивных технологий позволяет выносить и родить здорового ребенка! Будьте здоровы!
Определения генотипа, фенотипа, моногенного заболевания
Моногенные или менделирующие болезни: частота, причины
Моногенные признаки, вызываемые мутациями генов в ядерном геноме, часто называют менделирующими, поскольку они встречаются у потомства конкретных пар в фиксированных (в среднем) пропорциях, как у садового гороха, изученного Грегором Менделем.
Известные на сегодня моногенные болезни перечислены в классическом труде Виктора Мак-Кьюсика (Victor A. McKusick) «Менделирующие признаки у человека», остававшемся настольной книгой для медицинских генетиков в течение десятилетий. Интернет-версия (OMIM), доступная благодаря Национальной медицинской библиотеке Конгресса США, к настоящему времени включает более чем 3917 болезней с менделирующими типами наследования.
Из них 3310, или около 84%, вызываются известными мутациями в 1990 генах. Количество болезней с известными генетическими причинами и количество генов, в которых мутации могут вызывать болезнь, не совпадают, поскольку разные мутации в одном и том же гене могут вызывать различные болезни, а мутации в разных генах могут вызывать аналогичные или неразличимые болезни. Оставшиеся 16% болезней в OMIM — болезни с отчетливо менделирующим типом наследования, мутантные гены которых все еще неизвестны.
Таким образом, из приблизительно 25 000 генов человека около 8% уже непосредственно увязаны с развитием генетических болезней. Вероятно, это большая недооценка. Темп, с которым генетики распознают гены с аллелями, вызывающими болезни, очень высок, и он постоянно ускоряется из-за мощных новых инструментальных средств, ставших доступными благодаря проекту «Геном человека».
В целом моногенные болезни считают прерогативой (преимущественно, но никоим образом не исключительно) педиатрического возрастного диапазона; менее 10% из них обнаруживают после полового созревания и только 1% выявляют по завершении репродуктивного периода. Индивидуально редкие, моногенные болезни, как группа, ответственны за значимую часть болезней и смертей детства.
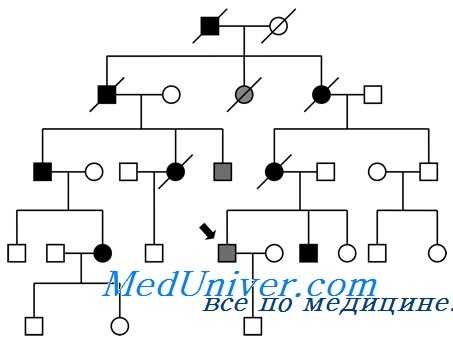
В популяционном исследовании более чем 1 млн живых новорожденных встречаемость серьезных моногенных заболеваний оценена в 0,36%; считают, что среди госпитализированных детей моногенные заболевания есть у 6-8%. Менделирующие болезни важны также в медицине взрослых. Оценка менделирующих форм 17 наиболее частых болезней у взрослых, таких как заболевания сердца, инсульты, опухоли и сахарный диабет, по базе OMIM обнаруживает почти 200 менделирующих нарушений, фенотипы которых включают эти распространенные болезни взрослого населения.
Хотя никоим образом нельзя исключать основные способствующие факторы в этиологии данных болезней в популяции в целом, учет менделирующих форм важен для конкретного пациента из-за их значения для здоровья других членов семьи, доступности генетического тестирования и подробно разработанного лечения для многих из них.
Хотя принципы медицинской генетики легки для понимания, незнакомая терминология может вначале вызвать впечатление недоступности.
Унаследованное изменение в геноме — краеугольный камень в генетике человека и медицинской генетике. Сегмент ДНК, занимающей конкретную позицию или положение в хромосоме, называют локусом. Если сегмент ДНК содержит ген, такой сегмент является локусом этого гена. Альтернативные варианты гена называют аллелями. Для многих генов существует один преобладающий аллель, представленный у большинства индивидуумов, называемый генетиками диким типом или нормальным аллелем.
Другие версии гена — вариантные или мутантные аллели, отличающиеся от аллеля дикого типа присутствием мутаций, стабильных изменений в последовательности нуклеотидов или перестроек ДНК. Конкретный набор аллелей в локусе или группе локусов в хромосоме называется гаплотипом.
Различные аллели возникают благодаря мутациям в недавнем или отдаленном прошлом. Если в популяции присутствует, по крайней мере, два сравнительно частых аллеля в локусе, говорят, что локус демонстрирует полиморфизм (буквально «многоформность»), что подробно обсуждается в последующих главах. Дополнительно к нормальному аллелю или к частым полиморфным аллелям локусы могут также иметь один или несколько редких аллелей. Некоторые из таких редких аллелей идентифицированы изначально, поскольку они вызывают генетические болезни; другие могут увеличивать восприимчивость к болезням, третьи не оказывают известного влияния на здоровье.
Термин мутация используют в медицинской генетике в двух смыслах: чтобы указать на новое генетическое изменение, ранее неизвестное в семье, и чтобы просто указать на мутантный аллель, как причину болезни. Термины «мутация» и «мутант» никогда не используют для обозначения людей, несущих мутацию.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
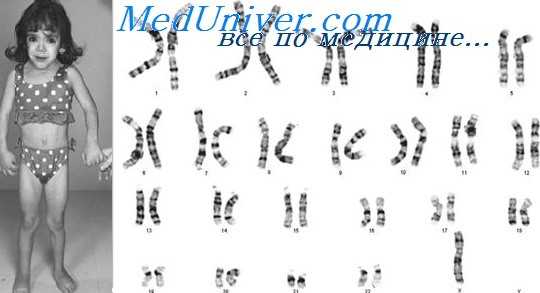
Синдром Тернера (45,X и другие кариотипы): признаки, фенотип
В отличие от пациентов с другими половыми хромосомными анеуплоидиями, девочек с синдромом Тернера часто идентифицируют при рождении или до половой зрелости из-за отчетливых фенотипических признаков. Синдром Тернера значительно более редкий, чем другие анеуплоидии по половым хромосомам. Встречаемость фенотипа синдрома Тернера — приблизительно 1 на 4000 новорожденных девочек, хотя в некоторых исследованиях приведены значительно более высокие цифры.
Наиболее частая хромосомная конституция при синдроме Тернера — 45,Х (иногда неправильно записываемая 45,Х0), без второй половой хромосомы. Тем не менее до 50% случаев имеет другие кариотипы. Около четверти случаев синдрома Тернера — мозаичные кариотипы, в которых только часть клеток содержит 45,Х. Наиболее частые кариотипы и их приближенные относительные частоты следующие:
1) 45,Х: 50%
2) 46,X,i(Xq): 15%
3) Мозаики 45,Х/46, XX: 15%
4) Мозаики 45,X/46,X,i (Xq): около 5%
5) 45,Х, другая аномалия X: около 5%
6) Другие мозаики 45,Х/?: около 5%
Состав хромосом клинически значим. Например, пациентки с i(Xq) подобны женщинам с классическим 45,Х, пациентки с делецией Хр имеют низкий рост и врожденные пороки развития, а с делецией Xq часто имеют только дисфункцию гонад.
Типичные аномалии при синдроме Тернера включают низкий рост, дизгенезию гонад (в результате нарушения их формирования яичники обычно представлены соединительнотканными полосками), характерное необычное лицо, складчатую шею, низкий рост волос на затылке, широкую грудную клетку с широко расположенными сосками и высокую частоту почечных и сердечно-сосудистых аномалий.
При рождении младенцы с этим синдромом часто имеют важный диагностический признак — отек тыльной стороны стоп и кистей.
У многих пациентов обнаруживают коарктацию аорты, женщины с синдромом Тернера имеют повышенный риск сердечно-сосудистых аномалий. Лимфоотек может проявляться во внутриутробном периоде, вызывая кистозную гигрому плода (обнаруживаемую при ультразвуковом исследовании — УЗИ), вызывающую видимые после родов шейные складки.
Синдром Тернера следует заподозрить у любой новорожденной девочки с отеком кистей и стоп или с гипоплазией левых отделов сердца или коарктацией аорты. Возможность этого диагноза нужно также учитывать в подростковом периоде у девушек с первичной или вторичной аменореей, особенно если они низкого роста. Терапия гормоном роста показана для всех девушек с синдромом Тернера и позволяет прибавить от 6 до 12 см роста.
Обычно считают, что интеллект у женщин с синдромом Тернера будет нормальным, хотя приблизительно 10% пациенток имеют значимую задержку развития, требующую специального образования. Даже среди тех, кто имеют нормальный интеллект, тем не менее, часто выявляют недостаточность в пространственном восприятии, двигательной и тонкой моторике.
Как следствие, невербальная оценка IQ значительно ниже вербальной, и большинство пациенток нуждается в педагогической поддержке, особенно по математике. Женщины с синдромом Тернера имеют высокий риск низкой социальной адаптации. Сравнение девушек 45,Х с материнским и отцовским происхождением Х-хромосомы показало значительно худшие социальные навыки при материнской Х-хромосоме. Поскольку эффект родительского происхождения может объясняться импринтингом, такую возможность исследуют для генов Х-хромосомы, которые влияют на фенотип.
Высокая встречаемость кариотипа 45,Х при спонтанных абортах уже упоминалась. Аномалия присутствует предположительно в 1-2% всех зачатий; выживание до срока родов — редкое явление, и более чем 99% таких беременностей спонтанно прерывается. Единственная Х-хромосома примерно в 70% случаев имеет материнское происхождение; другими словами, хромосомная ошибка, ведущая к потере половой хромосомы, обычно происходит у отца.
Основа для необыкновенно высокой частоты утраты Х- или Y-хромосомы неизвестна. Кроме того, неясно, почему кариотип 45,Х, столь часто летальный внутриутробно, очевидно полностью совместим с жизнью после родов. Утраченные гены, ответственные за фенотип синдрома Тернера, должны находиться как в Х-, так и Y-хромосоме. Предполагают, что эти гены входят в число генов, избегающих Х-инактивации, в частности, находящихся на коротком плече, включая псевдоаутосомную область.
Иногда у пациентов с низким ростом, дизгенезией гонад и умственной отсталостью выявляют небольшие кольцевые Х-хромосомы. Поскольку задержка умственного развития нетипична для синдрома Тернера, наличие такой задержки с другими аномалиями у больных с кариотипом 46,Х,r(Х) связывают с тем, что небольшие кольцевые Х-хромосомы утрачивают центр Х-инактивации.
Невозможность инактивировать кольцевую Х-хромосому приводит к избыточной экспрессии генов, в норме подлежащих инактивации. Обнаружение кольцевой Х-хромосомы при пренатальной диагностике может вести к большой неопределенности, в таком случае показано исследование экспрессии гена XIST. Большие кольца, содержащие центр Х-инактивации и экспрессирующие ген XIST, приводят к развитию фенотипа синдрома Тернера; при небольших кольцевых хромосомах без экспрессии гена XIST можно предполагать более серьезный фенотип.
Генетические факторы
Генетическая информация может быть поделена на три категории: семейный анамнез, фенотип и генотип. Все три типа информации важны для выявления пациентов, находящихся в группе высокого риска ИБС, которым могут быть показаны соответствующие вмешательства.
16.1. Семейный анамнез
Огромное значение семейного анамнеза как ФР ИБС установлено в большом числе исследований [223–225]. Он рассматривается как ФР в алгоритме PROCAM [226]. Риск развития ИБС повышается в 1,5–1,7 раза в случае ранней манифестации ИБС или ССЗ у родственников первой степени родства (у мужчин
Таким образом, детальный сбор семейного анамнеза является обязательным у всех пациентов, страдающих ИБС или другими болезнями атеросклеротического генеза, а также у лиц высокого риска развития этих заболеваний.
Риск ИБС тем выше, чем ближе степень родства. Он максимален при наличии отягощенного анамнеза у родственников первой степени родства (родители, дети, родные братья и сестры), и понижается у родственников второй степени родства (бабушки и дедушки, тети и дяди) и третьей степени родства (двоюродные братья и сестры). Риск ИБС повышается по мере увеличения количества больных ИБС в семье и при более раннем возрасте манифестации ИБС у родственников.
16.2. Фенотипы
Фенотип (от греческого слова phainotip – являю, обнаруживаю) – совокупность характеристик, присущих индивиду на определённой стадии развития. Фенотип формируется на основе генотипа, опосредованного рядом внешнесредовых факторов. Вклад генетических факторов достаточно сильный, степень их влияния оценивается с помощью “наследуемости”. Так, уровень апопротеинов и липидов на 40–60 % зависит от генетических характеристик [230], а уровень липопротеина (а) (Лп (а)) – на 90 % (т. е. ОЖ практически не влияет на уровень его уровень) [231]. В соответствии с последним консенсусным документом [232], у пациентов с умеренным и высоким риском ССЗ рекомендуется скрининговое определение Лп (а). Эксперты проанализировали целый ряд публикаций, основанных как на эпидемиологических, так и на генетических данных, что позволило сделать вывод о независимой роли Лп (а) как ФР ССЗ (его влияние по силе сопоставимо с эффектом от курения), а полиморфизм его гена является мощным генетическим ФР [233]. В настоящее время также получены данные, свидетельствующие о умеренной и высокой значимости “наследуемости” таких маркеров как интерлейкин-6, фосфолипаза А2, внутриклеточная молекула адгезии [234, 235]
16.3. Генотипы
В настоящее время наиболее широко распространена система взглядов на развитие ИБС как мультифакториального заболевания, обусловленного сложным взаимодействием различных генетических факторов и факторов окружающей среды. Длительный латентный период, сроки клинической манифестации, течение и прогноз такого заболевания во многом зависит как от средовых, так и от генетических факторов. Сложный механизм формирования клинического фенотипа заболевания обусловлен большим количеством генов, вовлеченных в патогенез. Из 40000 генов, представленных в геноме человека, более половины уникальных генов (>25000) экспрессируется в сердечно-сосудистой системе [236]. Исходя из современных представлений о патофизиологических механизмах ИБС, выделена группа генов, нарушения структуры и функционирования которых может вносить вклад в патогенез ИБС. Гены, детерминирующие физиологический признак и вследствие полиморфизма которых может возрасти риск заболевания, называют генами-кандидатами. Это гены ренин-ангиотензин-альдостероновой системы (РААС), ионных каналов, эндотелинов, каллекреинкининового пути, аполипопротеинов и ферментов метаболизма липидов и углеводов, молекул адгезии, факторов роста и гормонов, тромбоксанов, простагландинов и др.
В настоящее время широкое распространение получил ассоциативный метод исследования, основанный на формировании достаточно больших групп “случай” и “контроль” и сравнении распределения частоты аллельных вариантов полиморфных локусов у лиц с разными фенотипами.
Одним из наиболее изученных генов-кандидатов ИБС является ген ангиотензинпревращающего фермента (АПФ). В настоящее время описано более 10 полиморфных вариантов гена АПФ [237]. I/D полиморфизм стал использоваться как маркерный для изучения роли гена АПФ в детерминации риска мультифакториальных заболеваний. Отличительной чертой АПФ является то, что он играет ключевую роль в огромном количестве физиологических и патологических реакций, происходящих в организме человека. Установлены ассоциации полиморфизма гена АПФ с развитием гипертрофии миокарда при физических тренировках [237], рестенозированием после стентирования [238], с ремоделированием миокарда после ИМ [239], выживаемостью больных с застойной СН [240], с развитием диабетической нефропатии и ретинопатии [241] и с риском развития ИБС у курильщиков [242].
Списки потенциальных генов заболевания могут включать десятки и сотни наименований. Сложность проблемы состоит в отборе наиболее значимых, “главных” генов заболевания, но в настоящее время эта область очень интенсивно исследуется.
16.4. Наследственные синдромы
Существует ряд редко встречающихся тяжелых наследственных дислипидемий, ассоциированных с повышенным риском ИБС. Для выработки оптимальной диагностической и терапевтической стратегии необходима комплексная оценка фенотипических и генетических факторов.
Семейная гиперхолестеринемия – заболевание с аутосомно-доминантным типом наследования, обусловленное дефектом гена рецептора ХС-ЛНП [243]. Всего в мире описано более 700 мутаций этого гена, однако в пределах одной страны встречается значительно меньшее их количество [244, 245]. Заболевание диагностируется у 5–10 % лиц с ранней ИБС (до 55 лет) [246]. Поскольку диагностические уровни ХС у пациентов с семейной и несемейной гиперхолестеринемиями перекрещиваются, предполагается, что генетическое тестирование может играть важную диагностическую роль. В виду высокого риска ранней ИБС при выявлении семейной гиперхолестеринемии пациентам, начиная с молодого возраста, должна быть назначена агрессивная терапия статинами и рекомендованы меры по изменению ОЖ. Целесообразно выполнение каскадных генетических тестов у родственников.
Семейная комбинированная гиперлипидемия – это заболевание, имеющее полигенной характер наследования и встречающееся чаще, чем семейная гиперхолестеринемия [247]. В настоящее время нет убедительных данных в пользу каскадного генетического тестирования для выявления членов семьи с данной патологией. Пациентам с семейной комбинированной гиперлипидемией показаны ХС-снижающая терапия и коррекция ОЖ.
16.5. Фармакогенетика
В настоящее время получено недостаточно данных о перспективах использования знаний о генетических особенностях индивидуумов и применении лекарственных препаратов или профилактики их серьезных побочных эффектов. Наиболее значимые результаты были получены при изучении пациентов с низким ответом при приеме правастатина [250]. У лиц, несущих определенный гаплотип гена HMG CoA редуктазы (7 % населения), при приеме правастатина отмечается меньшее снижение уровня ХС (на 14 % против 19 %). Однако, эффект достигался простым повышением дозы статина, что, в целом, и не имело выраженного клинического значения. В настоящее время, самым ярким примером, позволяющим избегать тяжелых побочных эффектов лекарственных препаратов, является определение генотипа цитохрома CYP2C9 при назначении варфарина. Гетерозиготам по данному локусу (>20 % населения) для поддержания оптимального антикоагуляционного эффекта требуется меньшая доза варфарина, а у гомозигот (встречаются довольно редко) обычная доза варфарина может вызвать серьезное кровотечение [251]. В настоящее время активно изучаются генетические особенности пациентов при приеме клопидогреля.
Моногенные заболевания
Предстоящее родительство — это не только весьма ответственный шаг для будущих родителей, но и необходимость в знаниях о возможных рисках рождения ребенка с отклонениями в состоянии здоровья.
Среди разнообразия генетической патологии выделяют отдельную обширную группу наследственных болезней, в большинстве случаев с тяжелым течением, незначительной продолжительностью жизни, иногда с летальными последствиями уже внутриутробно или в первые дни и месяцы новорожденности.
Это – моногенные заболевания.
Моногенные заболевания – это недуги, в основе которых лежат мутации в одном гене, точковые мутации. Приведем лишь несколько самых частых из них: муковисцидоз, нейрофиброматоз 1-го типа, несиндромальная нейросенсорная тугоухость, мышечная дистрофия Дюшенна, фенилкетонурия, синдром Мартина-Белл, адреногенитальный синдром, иммунодефициты и т.д.
Генные мутации — это всегда изменение структуры гена. Структура гена – это программа воспроизводства и функций наших белков. Белки и их нормальный баланс – это наша жизнь, фундамент, развитие и функционирование всех органов и систем, наше здоровье. В геноме человека десятки тысяч генов и каждый из них может мутировать. Мутации в генах в процессе эволюции привели к разнообразию рас и этнических групп человечества, диктуют индивидуальные особенности каждого человека, но, к сожалению, они же и привели к накоплению в общем генофонде человечества наследственных болезней. На сегодняшний день их известно и описано около 7000.
Как часто встречаются моногенные болезни?
- Их частота колеблется от 1 на каждые 500-600 новорожденных (пример - семейная гиперхолестеринемия, серповидноклеточная анемия), 1:2000 -1:5000 (муковисцидоз, хорея Гентингтона, болезнь Тея-Сакса) и до 1 на 10000 новорожденных и выше.
- Преимущественное большинство этих заболеваний тяжелые, трудно поддающиеся лечению. Поражаются внутренние органы и системы органов, развивается умственная отсталость.
- Моногенные заболевания приводят к значительному сокращению продолжительности жизни. Например, люди с муковисцидозом живут не более 36 лет, при болезни Тея-Сакса – 3-5 лет. Дети со спинальной мышечной атрофией редко доживают до 2 лет. Лишь 10% таких болезней развиваются в возрасте старше 20 лет.
Каковы риски?
В контексте моногенных заболеваний мы часто слышим: «редкое генетическое заболевание». Уповать на то, что оно редкое и вас не коснется, не стоит. Достаточно только знать, что каждый из нас носит в себе генетические маркеры (мутации) от 5 до 10 наследственных заболеваний, передающихся по наследству.
У пары с необследованным собственным генотипом риск на 100% исключить невозможно. Исходя из законов наследования для этой группы заболеваний (законы Менделя), при скрытом носительстве будущими родителями мутаций в генах, ассоциированных с наследственным заболеванием, с каждой беременностью вероятность рождения больного ребенка будет составлять 25%. А в некоторых случаях с определенным типом наследования риск окажется еще выше.
Как наследуются моногенные заболевания?
Мы получаем от родителей 2 копии одного и того же гена — одна копия от отца, вторая – от матери. Всё зависит от того, в каком состоянии носит будущий родитель (или оба родителя) этот дефектный ген и в каком состоянии его унаследовал потомок.
Возможных вариантов при рождении ребенка три:
- родится больной ребенок;
- родившийся ребенок будет носителем моногенного заболевания и может передать его уже своим детям;
- родится здоровый ребенок.
Существуют такие понятия, как аутосомно-доминантный и аутосомно-рецессивный тип наследования, гомозиготное и гетерозиготное носительство мутации.
Всё это имеет прямое отношение к рискам, но самостоятельно разобраться в этом трудно. О наследовании моногенных заболеваний и персональных рисках в вашей семье вы сможете узнать, только пройдя консультирование у вашего врача-генетика или обратившись в наш центр за консультацией и тестированием на моногенные болезни.
Дефектный ген может долгие годы передаваться из поколения в поколение, никак не проявляя себя, до тех пор, пока не появится ряд условий, способствующих проявлению генетического заболевания. Для большинства наследственных заболеваний таким условием является зачатие ребенка от двух носителей мутации в одном и тоже гене.
Что означает носительство моногенного заболевания?
Каждый год для миллионов здоровых родителей в мире известие о рождении ребенка с неизлечимым генетическим заболеванием становится страшным поражением. Ведь они практически здоровы. Такие родители попросту не знали, что являются носителями мутантной версии гена. Носитель — это тот, у кого есть изменения (или мутации) в одной копии гена из двух в паре. Носитель, как правило, здоров, потому что другая копия гена работает нормально.
Как избежать рождения ребенка с моногенным заболеванием?
Наследственные болезни долгое время не поддавались лечению, а единственным методом профилактики в теперь уже далеком прошлом была рекомендация воздержаться от деторождения. К счастью, эти времена прошли.
Достаточно сделать всего один шаг — провести паре будущих родителей тест на носительство моногенных заболеваний и по его результатам узнать степень риска рождения больного ребенка, спланировать зачатие.
Как определить индивидуальное носительство мутаций, ассоциированных с моногенным заболеванием?
Для профилактики моногенных болезней и скрининга на носительство возможных мутаций, требуется исследование нескольких сотен, а подчас нескольких тысяч мутаций. В одном гене их может содержаться огромное количество. К примеру, только в гене муковисцидоза известно свыше 200 таких мутаций, в гене фенилкетонурии 30.
Для выявления носительства моногенных заболеваний применяются скрининговые генетические тесты, позволяющие одномоментно охватить: до 10, 30, 100, 250 и более моногенных заболеваний.
Не рискуйте, пройдите у нас тест на носительство моногенных заболеваний. Мы предложим вам универсальные тесты на 27 наиболее часто встречающихся наследственных болезней, либо предложим еще более расширенную панель — на 274 заболевания.
Читайте также:
- Круговорот серы. Сульфатное дыхание бактерий. Диссимиляционная сульфатредукция.
- Методы фундопликации при ГЭРБ: по Ниссену, Toupet, Dor, Черноусову
- Паравульварная денервация. Операции на девственной плеве. Удаление влагалищной перегородки.
- Влияние антиметаболитов на плод беременной
- Гигиена труда при дуговой сварке. Оздоровление труда сварщиков
