Опухоли из клеток Сертоли и Лейдига - клиника, лечение
Добавил пользователь Morpheus Обновлено: 28.01.2026
Опухоли из клеток Сертоли–Лейдига представляют собой довольно редкий вид новообразований яичников, относящихся к группе опухолей полового тяжа. Для данного вида новообразований характерны повышенная продукция андрогенов, приводящая к формированию так называемого вирильного синдрома, а также возможное сочетание с различными метаболическими нарушениями, такими как верхний тип ожирения, нарушения углеводного и белкового обмена, артериальная гипертензия.
Важным этапом дифференциально-диагностического поиска является установление источника избыточной продукции андрогенов. Андрогенпродуцирующую опухоль яичника следует дифференцировать с андрогенпродуцирующей опухолью надпочечника, стромальным текоматозом (гипертекозом) яичников, эндогенным гиперкортицизмом (синдромом Кушинга). В большинстве случаев опухоль из клеток Сертоли–Лейдига ассоциирована с носительством мутации гена DICER1, при выявлении которой необходимо проводить генетическое обследование родственников, так как пациенты с мутациями в этом гене имеют повышенный риск развития широкого спектра доброкачественных и злокачественных опухолей, большинство которых относительно редки в общей популяции.
Осведомленность специалистов (акушеров-гинекологов, эндокринологов, онкологов) об этом редко встречающемся новообразовании яичника должна обеспечить своевременную диагностику и адекватное лечение заболевания.
Ключевые слова
Для цитирования:
Калашникова М.Ф., Лиходей Н.В., Тюльпаков А.Н., Федорова Е.В., Брюнин Д.В., Бахвалова А.А., Глушакова М.А., Смирнова С.А., Фадеев В.В. Вирилизирующая опухоль яичника: проблемы дифференциальной диагностики. Проблемы Эндокринологии. 2019;65(4):273-277.
For citation:
Kalashnikova M.F., Likhodey N.V., Tiulpakov A.N., Fedorova E.V., Bryunin D.V., Bakhvalova A.A., Glushakova M.A., Smirnova S.A., Fadeyev V.V. Virilizing ovarian tumor: the challenges of differential diagnosis. Problems of Endocrinology. 2019;65(4):273-277.
Актуальность
Согласно американской базе данных, частота новых случаев опухолей яичников составляет 11,7:100 000 женщин в год. Андробластома, известная еще как опухоль из клеток Сертоли–Лейдига, относится к группе опухолей полового тяжа и является довольно редким заболеванием – 0,5% всех опухолей яичников [1]. Это новообразование за счет избыточной продукции тестостерона приводит к формированию синдрома гиперандрогении (вирильного синдрома), который включает такие симптомы, как избыточный рост волос по мужскому типу (гирсутизм), снижение тембра голоса (барифония), андрогенную алопецию, нарушение менструального цикла по типу олигоменореи/вторичной аменореи, увеличение размеров клитора. При сочетании гиперандрогении с различными проявлениями метаболического синдрома (верхний тип ожирения, артериальная гипертензия, нарушение толерантности к глюкозе, дислипидемия) необходимо исключать такие заболевания, как эндогенный гиперкортицизм (синдром Кушинга), гипертекоз (стромальный текоматоз) яичников, андрогенпродуцирующую опухоль надпочечника. Опухоли яичника из клеток Сертоли–Лейдига в большинстве случаев ассоциированы с носительством мутации гена DICER1, что требует проведения генетического исследования у данных пациенток.
Описание случая
Пациентка Ш., 43 лет, впервые обратилась в клинику эндокринологии №1 Первого МГМУ им. И.М. Сеченова в августе 2017 г. с жалобами на отсутствие менструации, избыточный рост волос на лице и теле, выпадение волос на голове по мужскому типу, избыточный вес тела, повышение АД до 180/100 мм рт.ст. Из анамнеза известно, что у пациентки менструации регулярные до 37 лет. С 38 лет – вторичная аменорея, появился избыточный рост волос в андрогензависимых зонах, угревые высыпания на лице, груди, спине. В 40 лет самостоятельно начала прием комбинированного орального контрацептива (ципротерона ацетат 2 мг + этинилэстрадиол 2 мг), который принимала до 42 лет. Имела место менструальноподобная реакция. С 30 лет пациентка отмечала постепенную прибавку массы тела; вес при госпитализации – 100 кг. В возрасте 40 лет выявлено повышение уровня тестостерона до 19,5 нмоль/л (норма 0,5–4,3); Уровни ТТГ, ЛГ, ФСГ, пролактина оставались в пределах референсных диапазонов. С 40 лет отмечает повышение АД максимально до 180/100 мм рт.ст.
При осмотре отмечены избыточный рост волос на лице и на теле (26 баллов по шкале Ферримана–Голлвея), гиперемия лица, акне на лице, груди, спины; выпадение волос на голове, преимущественно в лобно-теменной области, чрезмерное развитие подкожно-жировой клетчатки с распределением по центрипетальному типу, стрии розового цвета на животе. ИМТ = 37,2 кг/м 2 (рис. 1, 2, см. на цв. вклейке).
Рис. 1. Внешний вид пациентки Ш. до операции – избыточный рост волос на лице и на теле.
Рис. 2. Внешний вид пациентки Ш. до операции – гиперемия и угревая сыпь на спине, выпадение волос на голове, чрезмерное развитие подкожно-жировой клетчатки на животе.
При обследовании выявлено значительное повышение уровня общего тестостерона до 35,3 нмоль/л), андростендиона до 20,9 нмоль/л (норма 1,0–11,5), эстрадиола до 347 пмоль/л (норма 0–118/л); снижение уровня ЛГ до 0,08 мЕД/мл (норма 5–20) и ФСГ до 0,5 мЕД/мл (норма 5–20). Содержание 17-гидроксипрогестерона и ДГЭA-C – в пределах референсных значений. При гинекологическом осмотре: гипертрофия клитора, увеличение размера матки. Левый яичник также увеличен в размере. Учитывая наличие клинической картины выраженного вирильного синдрома, значительно повышенный уровень общего тестостерона на фоне нормального содержания дегидроэпиандрон-сульфат (ДГЭA-C), пациентке было проведено УЗИ органов малого таза. Выявлены увеличенные размеры матки до 61×52×75 мм за счет множественных миомных узлов, структурные изменения и увеличение левого яичника (43×27×42 мм). Диагностированы опухолевые образования левого яичника, миомы матки (рис. 3).
Рис. 3. УЗИ органов малого таза. Увеличение размеров и структурные изменения левого яичника (43×27×42 мм). Увеличение матки (61×52×75 мм), миомы матки разных размеров.
Несмотря на ряд клинических проявлений гиперкортицизма (матронизм, ожирение с перераспределением подкожно-жировой клетчатки по центрипетальному типу, стрии в области живота, нарушение менструального цикла, нарушение гликемии натощак, артериальная гипертензия), а также отрицательный результат подавляющего теста с 1 мг дексаметазона, состояние было расценено как андрогенпродуцирующая опухоль левого яичника. Нормальный уровень ДГЭА-С и отсутствие патологических изменений надпочечников по данным КТ позволяли исключить андрогенпродуцирующую опухоль надпочечника(-ов).
Лечение
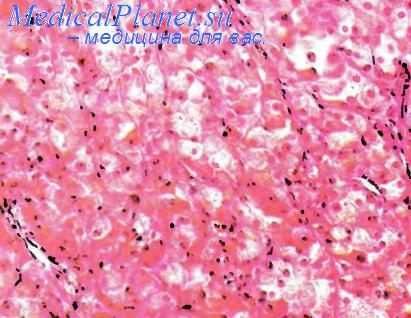
Выполнена лапароскопическая экстирпация матки с придатками. По данным гистологического исследования: опухоль левого яичника, состоящая из однородных солидных или полых трубчатых структур, выстланных клетками Сертоли; в соединительнотканной строме между этими структурами имеется различное число клеток Лейдига, которые содержат липофусцин; митозы встречаются редко (рис. 4, см. на цв. вклейке).
Через 2 мес после операции было выявлено значительное снижение уровня тестостерона до 0,8 нмоль/л, андростендиона до 1,6 нмоль/л по сравнению с дооперационным периодом. Отмечалась положительная динамика: снижение роста волос в андрогензависимых зонах, побледнение стрий, исчезновение акне, повышение тембра голоса, нормализация артериального давления. Повторно проведен ночной подавляющий тест с 1 мг дексаметазона: уровень кортизола составил 29 нмоль/л. При ПГТТ нарушений углеводного обмена не выявлено.
Рис. 4. Высокодифференцированная опухоль яичника из клеток Сертоли–Лейдига. Окраска гематоксилином и эозином, ×50.
Через 2 года после операции отмечено снижение веса пациентки на 17 кг, исчезновение угревых высыпаний на лице и теле (рис. 5, см. на цв. вклейке); избыточный рост волос по мужскому типу на лице сохранялся, тогда как на груди и спине стержневые волосы отсутствуют (рис. 6, 7, см. на цв. вклейке).
Рис. 5. Внешний вид пациентки Ш. спустя 2 года после операции – отсутствие угревых высыпаний на лице.
Рис. 6. Внешний вид пациентки Ш. спустя 2 года после операции – отсутствие угревых высыпаний, оволосения на спине.
Рис. 7. Внешний вид пациентки Ш. спустя 2 года после операции – отсутствие угревых высыпаний, оволосения на груди, на животе.
Для уточнения этиологии заболевания проведен молекулярно-генетический анализ методом секвенирования следующего поколения (NGS). Использовалась разработанная в отделении наследственных эндокринопатий ФГБУ ЭНЦ панель праймеров Ion Ampliseq Custom DNA Panel («LifeTechnologies», США), охватывающая кодирующие области следующих генов: SDHB, SDHC, CDKN2C, MEN1, AIP, SDHD, CDKN1B, DICER1, PRKAR1A, PRKCA, GNAS, POU1F1, PTTG2, SDHA, CDKN2A. В качестве референсной последовательности кодирующей области гена DICER1 использовался транскрипт NM_177438.2. Заключение: мутаций в гене DICER1 не выявлено.
Дифференциальный диагноз
Синдром гиперандрогении у женщин, страдающих верхним типом ожирения, артериальной гипертензией, нарушениями углеводного обмена, может быть обусловлен наличием андрогенпродуцирующей опухоли яичника или надпочечника, стромальным текоматозом яичников, а также эндогенным гиперкортицизмом.
На фоне значительного повышения уровня общего тестостерона интерпретация результатов подавляющего теста с 1 мг дексаметазона может приводить к ложноположительным результатам.
Проведенное первичное дифференциально-диагностическое обследование заставило проанализировать факторы, влияющие на чувствительность и специфичность подавляющего теста с 1 мг дексаметазона. Несмотря на то что в практике чаще используется именно данный тест, у него есть ряд ограничений [2]. Ложноположительный результат могут давать псевдокушингоидные состояния, прием ряда лекарственных препаратов (усиливающих/подавляющих активность цитохрома Р450 3А4), беременность, нарушения порядка проведения пробы, перекрестная реактивность при использовании глюкокортикоидов. Ложноотрицательный результат могут давать тяжелые соматические заболевания, патология печени и почек, выраженное ожирение. На основании результатов обследования можно предположить, что на специфичность ночного подавляющего теста с 1 мг дексаметазона также влияет высокий уровень тестостерона, синтезируемый андробластомой яичника.
Стромальный текоматоз яичников (в иностранной литературе чаще используется термин «гипертекоз яичников») является одной из форм овариальной гиперандрогении неопухолевого генеза, развивающейся преимущественно у женщин репродуктивного возраста и приводящей к развитию вирильного синдрома [3]. От синдрома поликистозных яичников стромальный текоматоз отличается гиперплазией межуточной (стромальной) ткани яичников и появлением в ней вне связи с фолликулами групп эпителиоидных клеток, формирующих очаги текоматоза различной формы и величины [4]. Клиническими особенностями стромального текоматоза яичников являются выраженный вирильный синдром, первичная или вторичная аменорея, а также частое сочетание с различными метаболическими нарушениями («верхним» типом ожирения, нарушениями углеводного обмена, артериальной гипертензией и черным акантозом – дерматологическим маркером инсулинорезистентности). Клинические проявления заболевания развиваются постепенно; при УЗИ органов малого таза выявляются двусторонние изменения яичников, а при гормональном исследовании – нормальные уровни ДГЭА-С и 17-гидроксипрогестерона.
Симптоматика вирилизирующей опухоли надпочечников сходна с таковой вирилизирующей опухоли яичников. Критериями диагноза являются высокий уровень ДГЭА-С и наличие опухолевого образования в надпочечнике.
Андробластома яичника была впервые описана в 1905 г. L. Pick [5]. С тех пор были описаны различные варианты развития, клиники и лечения опухолей из клеток Сертоли–Лейдига, которые чаще диагностируются в молодом возрасте (до 40 лет) [6, 7].
В 2014 г. H. Zhang и соавт. [8] описали 16 случаев опухолей яичников из клеток Сертоли–Лейдига; пациентки наблюдались в течение 10 лет. Наиболее распространенной жалобой было отсутствие менструаций или нерегулярный менструальный цикл, избыточная масса тела, наблюдались признаки вирилизации. У всех женщин опухоли были оперативно удалены, у 11 пациенток обнаружили низкодифференцированную опухоль, в связи с чем после оперативного вмешательства была проведена химиотерапия. У всех пациенток через 10 лет наблюдались стойкая ремиссия и обратное развитие первичных симптомов.
В 2008 г. A. Warenik-Szymankiewicz и соавт. [9] описали случай двусторонней андробластомы яичников у девочки 17 лет. У пациентки наблюдались вторичная аменорея, гирсутизм и акне. При лапаротомии выявили опухоли размером 40×30×20 мм в правом яичнике и 10 мм в диаметре в левом яичнике.
В 2009 г. D. Hill и др. [10] показали, что мутации в гене DICER1 приводят к развитию плевропульмональной бластомы. Это дало толчок к активному изучению роли гена DICER1 в канцерогенезе. Было доказано, что этот ген подавляет опухолевый рост.
Ген DICER1 расположен на 14-й хромосоме в положении q32,13 и кодирует белок DICER эндорибонуклеазы семейства рибонуклеаз III. Эндорибонуклеаза DICER была открыта E. Bernstein и соавт. в 2001 г. [11]; она расщепляет предшественник микроРНК с образованием активной микроРНК. МикроРНК играют большую роль в регуляции клеточной пролиферации и апоптоза. В ходе апоптоза ген DICER1 инициирует расщепление хромосомной ДНК, что является ключевым моментом в контролируемой гибели клеток.
Мутации в гене DICER1 приводят к его инактивации и нарушению процессинга определенных видов микроРНК, что может сопровождаться возникновением различных опухолей. Люди с мутациями DICER1 в зародышевой линии клеток подвергаются повышенному риску развития доброкачественных и злокачественных опухолей, таких как кистозная нефрома, почечная саркома, опухоль Вильмса, узловая гиперплазия и рак щитовидной железы, плевропульмональная бластома, андрогенпродуцирующие опухоли яичников. При выявлении мутации в гене DICER1 необходимо проводить генетическое обследование родственников больного, так как герминальные мутации в этом гене повышают риск развития широкого спектра опухолей, большинство которых в общей популяции относительно редки [12–14].
В настоящее время используется термин DICER1-синдром – редкое генетическое заболевание, ассоциированное с повышенным риском развития целого ряда злокачественных и доброкачественных новообразований в результате герминальных мутаций в гене DICER1.
В 2016 г. описан случай маскулинизации девочки 11 лет, у которой была обнаружена опухоль клеток Сертоли–Лейдига яичников, при УЗИ щитовидной железы визуализировались узлы, в аспирате которых была обнаружена цитологическая атипия [15]. При молекулярно-генетическом анализе были найдены мутации в гене DICER1.
В 2017 г. K. Schultz и др. [6] описали 49 случаев опухолей из клеток Сертоли–Лейдига. У 36 из 37 обследуемых была обнаружена мутация в гене DICER1. У трех человек были обнаружены герминальные мутации в этом гене. У таких пациентов существует высокий риск развития метахронных опухолей. У остальных 33 человек DICER1-ассоциированная мутация находилась в точке доступа к домену РНКазы IIIb.
Таким образом, почти все опухоли полового тяжа связаны с мутацией в гене DICER1. Скрининг таких мутаций может способствовать раннему выявлению соответствующих опухолей.
В описываемом нами случае у пациентки не было выявлено мутации гена DICER1. Однако это не исключает диагноза DICER1-синдрома, так как изменение нуклеотидной последовательности могло затрагивать некодирующие участки гена (интроны, регуляторные области), которые не были проанализированы при использованном методе ДНК-анализа. С другой стороны, возможно, что развитие опухоли у пациентки связано с другими молекулярными механизмами, отличными от первичного дефекта гена DICER1.
Заключение
Описанный клинический случай демонстрирует этапы диагностического поиска при вирильном синдроме и способствует большей осведомленности специалистов (акушеров-гинекологов, эндокринологов, онкологов) в данной области.
В большинстве случаев опухоль из клеток Сертоли–Лейдига ассоциирована с носительством мутации гена DICER1, которая может приводить к развитию целого ряда злокачественных и доброкачественных новообразований. Необходим дальнейший мониторинг возможных проявлений DICER1-синдрома у данной пациентки, что позволит оценить долгосрочный прогноз заболевания.
Дополнительная информация
Согласие пациента. Пациентка добровольно подписала информированное согласие на публикацию персональной медицинской информации в обезличенной форме в этом журнале.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов. Все авторы внесли значимый вклад в наблюдение пациентки и подготовку статьи, прочли и одобрили финальную версию до публикации.
Опухоли из клеток Сертоли и Лейдига - клиника, лечение
Опухоли из клеток Сертоли—Лейдига - диагностика, лечение
Опухоли из клеток Сертоли—Лейдига содержат в разной пропорции одноименные клетки в состоянии различной степени дифференцировки. Считают, что они возникают из стромы полового тяжа. Клетки могли дифференцироваться в любую структуру, возникающую из эмбриональной мезенхимы гонад.
Поскольку менее дифференцированные новообразования этой группы могут повторять развитие яичек, в качестве синонимов опухолей из клеток Сертоли—Лейдига использовали названия андробластома и арренобластома. Однако такое указание на маскулинизацию может ввести в заблуждение, поскольку некоторые из этих опухолей вообще не имеют эндокринных проявлений, а другие — сопровождаются эстрогенным влиянием.
Тем не менее эксперты ВОЗ в качестве альтернативного названия опухолей из клеток Сертоли—Лейдига выбрали термин «андробластома». Эти новообразования составляют менее 0,5 % всех опухолей яичников, но весьма интересны с клинической и патофизиологической точек зрения. В 97 % случаев это односторонние опухоли, ограниченные яичником, возникающие в любом возрасте, но чаще у молодых женщин в возрасте 20—30 лет, обычно с симптомами вирилизации.
При иммуногистохимических исследованиях обнаружили, что тестостерон находится в основном в клетках Лейдига, во многих этих клетках также выявили эстроген и андростендион. Этим и обусловлена разнообразная клиническая картина данных необычных опухолей. Как правило, это прогрессирующая маскулинизация, предвестником которой бывает гирсутизм, височное облысение, снижение тембра голоса и увеличение клитора. У других пациенток может быть вторичная аменорея, атрофия молочных желез и повышение либидо.
Опухоль из клеток Лейдига
Опухоли из клеток Сертоли—Лейдига можно описать с позиций дифференцировки и наличия или отсутствия клинически значимых гетерологичных элементов. Эти новообразования с гетерологичными элементами могут содержать различные виды необычных клеток. Но для прогноза большее значение имеет степень дифференцировки, чем содержание необычной ткани.
По данным Young и Scully, только 29 из 220 таких опухолей имели клинически признаки злокачественности. Ни одна из 27 высокодифференцированных опухолей не была злокачественной, и только 4 из 100 умереннодифференцированных опухолей оказались таковыми. Злокачественный характер имели 59 % низкодифференцированных и 19 % гетерологичных опухолей. Zaloudek и Norris сообщили о 64 умеренно- и низкодифференцированных опухолях: из 50 пациенток с I стадией рецидив развился только у 3 из них. 5-летняя выживаемость всех больных составила 92 %.
Согласно публикациям, 5-летняя выживаемость больных с опухолями из клеток Сертоли—Лейдига колеблется в пределах 70—90 %. Учитывая, что эти новообразования встречаются в основном у молодых женщин, а двусторонность поражения наблюдается менее чем в 5 % случаев, то при необходимости сохранения фертильности показано только удаление опухоли и маточной трубы на стороне поражения. Удаление опухоли останавливает, но не полностью прекращает процесс маскулинизации.

Увеличение клитора у пациентки с опухолью из клеток Сертоли-Лейдига (арренобластома)
Как и гранулезоклеточные опухоли, новообразования из клеток Сертоли—Лейдига обладают низкой степенью злокачественности. Убедительных данных об эффективности адъювантной терапии для предотвращения рецидивов у пациенток с I стадией нет. Показаниями к адъювантной химиотерапией (XT) служат низкодифференцированная опухоль, поздняя стадия заболевания, рецидив,наличие в опухоли гетерологичных элементов. Часто рекомендуют схему VAC. В редких случаях распространенной или рецидивирующей опухоли из клеток Сертоли—Лейдига эффективна химиотерапия (XT), но опыт ее применения ограничен.

Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
а) Терминология:
1. Синонимы:
• Опухоль из клеток Сертоли и Лейдига: андробластома, арренобластома
2. Определения:
• Опухоль стромы полового тяжа
• Включает опухоль из клеток Сертоли и Лейдига, опухоль из клеток Сертоли (сертолиома) и интерстициально-клеточную опухоль, или стромальную опухоль из клеток Лейдига (лейдигома)
б) Лучевая диагностика:
1. Общие сведения:
• Наиболее надежные диагностические признаки:
о Четко очерченное солидное образование яичника, характеризующееся усилением сигнала при введении контрастного вещества
о С помощью лучевых методов исследования отличить друг от друга различные подтипы данной опухоли невозможно
• Локализация:
о В большинстве случаев односторонняя
о Двусторонние опухоли встречаются очень редко
• Размер:
о Варьирует и может достигать 15 см:
- Интерстициально-клеточные опухоли (лейдигомы) обычно маленькие (1-3 см)
- Опухоли из клеток Сертоли (сертолиомы) имеют несколько большие размеры (4-7 см)
- Опухоли из клеток Сертоли и Лейдига отличаются вариабельностью размеров
о Опухоли, обладающие гормональной активностью, при обращении обычно имеют небольшой размер
• Морфология:
о В большинстве случаев это нодулярные солидные опухоли
о В опухоли могут присутствовать кистозный, некротический и геморрагический компоненты
о Описаны опухоли из клеток Сертоли и Лейдига, имеющие многокамерное кистозное строение
(Слева) При ТВУЗИ в сагиттальной плоскости у пациентки 75 лет с жалобами на рост волос на лице по мужскому типу в правом яичнике выявляется небольшое (1,8 см) объемное образование.
(Справа) При ТВУЗИ в сагиттальной плоскости с использованием ЭДК у той же пациентки отмечается повышенный кровоток в объемном образовании яичника. При патологоанатомическом исследовании диагностирована стромальная опухоль из клеток Лейдига. (Слева) При ТВУЗИ в аксиальной плоскости у пациентки 19 лет с аменореей и угревой сыпью в правом яичнике выявляется слаборазличимое объемное образование, имеющее слегка повышенную эхогенность относительно неизмененной ткани яичника (курсоры).
(Справа) При ТВУЗИ в сагиттальной плоскости с использованием ЦДК у той же пациентки в объемном образовании правого яичника выявляется усиленный кровоток. (Слева) При КТ с контрастным усилением в аксиальной плоскости у той же пациентки в правом яичнике визуализируется солидное образование, интенсивно накапливающее контрастное вещество в артериальной фазе.
(Справа) При КТ с контрастным усилением в аксиальной плоскости у той же пациентки отмечено равномерное накопление контрастного вещества в правом яичнике в венозной фазе. Объемное образование, выявленное в артериальной фазе, на изображении, полученном в венозной фазе контрастного усиления, не различимо. При патологоанатомическом исследовании диагностирована опухоль из клеток Сертоли и Лейдига.
2. КТ при стромальной опухоли из клеток Сертоли:
• Нативная КТ:
о Объемное образование мягкотканной плотности
о Обызвествление наблюдается редко
• КТ с контрастным усилением:
о Солидная часть опухоли характеризуется интенсивным усилением сигнала
о Усиление сигнала может быть гомогенным или гетерогенным
о Могут присутствовать также кистозный и некротический компоненты
3. МРТ при стромальной опухоли из клеток Сертоли:
• Т1-ВИ:
о Сигнал от опухоли варьирует в зависимости от количества фиброзного и жирового компонентов в ней
о Мелкие опухоли бывает трудно отличить от стромы яичника
• Т2-ВИ:
о Сигнал от опухоли варьирует в зависимости от количества фиброзного и жирового компонентов в ней
о Солидный компонент опухоли дает сигнал промежуточной интенсивности
о Сигнал от фиброзной стромы яичника имеет низкую интенсивность
о В опухоли могут быть кистозно-измененные и некротические участки, дающие сигнал высокой интенсивности
• Т1-ВИ с контрастированием:
о Солидная часть опухоли характеризуется интенсивным усилением сигнала
о Усиление сигнала может быть гомогенным или гетерогенным
о В опухоли могут присутствовать также кистозный и некротический компоненты
4. УЗИ при стромальной опухоли из клеток Сертоли:
• Исследование в режиме серой шкалы:
о Опухоль имеет неоднородную эхоструктуру, подобную эхоструктуре мягких тканей
о Могут присутствовать также анэхогенные или гипоэхоген-ные кистозно-измененные участки
о Опухоли, содержащие клетки Лейдига, могут иметь повышенную эхогенность
• ЦДК:
о Позволяет выявить в опухоли сосуды
о Выявление сосудов в опухоли позволяет исключить сложную кисту
• ЭДК:
о Улучшает визуализацию сосудов опухоли
6. Рекомендации по проведению лучевых исследований:
• Наиболее информативные методы визуализации:
о Для выявления этих опухолей можно прибегнуть к УЗИ или МРТ
о Для выявления опухоли небольших размеров лучше выполнить МРТ с контрастным усилением
(Слева) При МРТ на Т2-ВИ в аксиальной плоскости у пациентки 17 лет с аменореей и ростом волос на лице по мужскому типу в правом яичнике выявляется объемное образование, дающее сигнал преимущественно высокой интенсивности относительно скелетных мышц таза и имеющее очаги сигнала еще большей интенсивности. Левый яичник не изменен и содержит многочисленные мелкие фолликулы.
(Справа) При МРТ на Т2-ВИ в корональной плоскости у той же пациентки в правом яичнике видно объемное образование, дающее сигнал высокой интенсивности. (Слева) При МРТнаТ1-ВИ ваксиальной плоскости у той же пациентки выявлено слаборазличимое объемное образование правого яичника, дающее сигнал несколько большей интенсивности по сравнению с мышцами таза.
(Справа) При МРТ на Т1-ВИ FS у той же пациентки визуализируется объемное образование правого яичника, которое дает сигнал несколько большей интенсивности по сравнению с мышцами таза. (Слева) При МРТ с контрастным усилением на Т1-ВИ FS в аксиальной плоскости у той же пациентки отмечается интенсивное усиление сигнала от опухоли правого яичника.
(Справа) При МРТ с контрастным усилением на Т1 -ВИ FS в корональной плоскости у той же пациентки визуализируется объемное образование правого яичника, демонстрирующее интенсивное усиление сигнала. Патологоанатомическое исследование операционного материала выявило опухоль из клеток Сертоли и Лейдига.
в) Дифференциальная диагностика стромальной опухоли из клеток Сертоли:
1. Гранулезоклеточная опухоль:
• Наиболее часто проявляется симптомами гиперэстрогении
• По строению может быть солидной, смешанной солидно-кистозной или полностью кистозной
2. Фиброма, фибротекома и текома:
• В типичных случаях на Т2-ВИ дают сигнал низкой интенсивности, что связано с присутствием в этих опухолях значительного объема волокнистой соединительной ткани и коллагеновых волокон
• Отек ткани опухоли и клеточные компоненты могут характеризоваться сигналом промежуточной интенсивности
• Фиброма не обладает эстрогенной активностью
• Богатая липидами текома может проявлять эстрогенную активность
3. Склерозирующая стромальная опухоль яичника:
• Объемное образование с кистозным и солидным компонентом неоднородной структуры:
о В ранней фазе контрастирования проявляет признаки усиления сигнала, распространяющегося от периферии к центру
г) Патологоанатомические особенности:
1. Общие сведения:
• Генетика:
о Опухоли стромы полового тяжа относительно чаще встречаются у больных с плевропульмональной бластомой:
- Плевропульмональная бластома - наиболее частая форма первичного рака легкого у детей:
Легочный аналог других эмбриональных опухолей в этой возрастной категории, таких как опухоль Вильмса, нейробластома, ретинобластома
- У пациенток с опухолью стромы полового тяжа, ассоциированной с плевропульмональной бластомой, выявляют мутацию в гене DICER1:
В большинстве случаев это опухоли из клеток Сертоли и Лейдига
Согласно накопленным данным, опухоль из клеток Сертоли и Лейдига, ассоциированная с плевропульмональной бластомой, наблюдается в более раннем возрасте, чем спорадическая опухоль из клеток Сертоли и Лейдига
- Мутацию гена DICER1 выявляют и у больных другими опухолями стромы полового тяжа
- Мутация гена DICER1 ассоциирована не только с опухолью из клеток Сертоли и Лейдига, но и с семейным многоузловым зобом
2. Стадирование, градация и классификация стромальной опухоли из клеток Сертоли:
• Стромальные опухоли из клеток Сертоли:
о Опухоли из клеток Сертоли и Лейдига
о Опухоль из клеток Сертоли
о Стромальная опухоль из клеток Лейдига (интерстициально-клеточная опухоль)
3. Макроскопические изменения и исследование операционного материала:
• Узловатая солидная опухоль желто-коричневого цвета, в редких случаях содержащая кисты
• В низкодифференцированных опухолях могут быть участки некроза и кровоизлияний
4. Микроскопические изменения:
• Стромальные опухоли из клеток Сертоли содержат (в «чистом» виде или в различных сочетаниях):
о Клетки Сертоли
о Клетки, напоминающие эпителиальные клетки сети яичника
о Клетки, напоминающие фибробласты о Клетки Лейдига
• Опухоль из клеток Сертоли и Лейдига:
о Состоит из различного соотношения клеток Сертоли, клеток Лейдига, а в случае умеренно дифференцированной или недифференцированной опухоли также примитивных половых клеток, эпителиальных клеток сети яичника и/или гетерологических элементов:
- Гетерологические элементы бывают разные, например карциноид, мезенхимальная ткань и муцинозные эпителиальные клетки, наиболее часто относящиеся к гастроинтестинальному типу
о Опухоли могут быть разделены на четыре подтипа:
- Высокодифференцированная
- Умеренно дифференцированная
- Низкодифференцированная
- Сетевидная
о При иммуногистохимическом исследовании характеризуются положительной реакцией на α-ингибин (маркер стромы полового тяжа) и цитокератин СК7, содержащийся в муцинозных раковых опухолях
• Опухоль из клеток Сертоли:
о Положительная реакция на ингибин в 82% случаев
о Отрицательная реакция на эпителиальный мембранный антиген и хромогранин
• Стромальная опухоль из клеток Лейдига:
о Аналогично лютеинизированной текоме (частично лютеинизированная тека-клеточная опухоль), но, в отличие от нее, содержит кристаллы Рейнке
о Состоит из узелков, образованных клетками Лейдига, заключенных в пролиферирующие стромальные элементы
д) Клинические особенности:
1. Клиническая картина:
• Наиболее частые субъективные и объективные симптомы:
о Опухоль из клеток Сертоли и Лейдига:
- Самое частое клиническое проявление - вирилизация
- Утрачиваются женские вторичные половые признаки:
Олигоменорея
Аменорея
Атрофия молочных желез
Исчезает характерная для женщин форма тела
- Прогрессирующие симптомы маскулинизации:
Угревая сыпь
Появление растительности на лице
Височное облысение
Огрубение голоса
Увеличение клитора
о Опухоль из клеток Сертоли:
- Чаще обладает эстрогенной активностью, реже - андрогенной
- У больных может появиться артериальная гипертензия, обусловленная секрецией ренина
- В 11% случаев ассоциируется с синдромом Пейтца-Егерса
о Стромальная опухоль из клеток Лейдига:
- Чаще проявляет андрогенную активность, реже эстрогенную
• Другие симптомы:
о Повышение уровня тестостерона и андростендиона
о Вздутие живота и боли в нем
о Увеличение количества эритроцитов в крови
2. Демографические особенности:
• Возраст:
о Опухоль из клеток Сертоли и Лейдига:
- Обычно встречается у молодых женщин:
Средний возраст больных - 25 лет
75% случаев опухоли приходится на возраст моложе 30 лет
о Опухоль из клеток Сертоли:
- В типичных случаях болеют женщины молодого возраста
- Средний возраст больных - 30 лет
о Стромальная опухоль из клеток Лейдига:
- В типичных случаях диагностируют у женщин в постменопаузе
- Средний возраст больных - 60 лет
• Эпидемиология:
о Стромальные опухоли из клеток Сертоли встречаются редко:
- Составляют о Опухоль из клеток Сертоли и Лейдига является наиболее частой вирилизирующей опухолью яичников
3. Естественное течение и прогноз:
• Большинство из этих опухолей имеют доброкачественное течение:
о Тем не менее опухоль из клеток Сертоли и Лейдига примерно в 20% случаев бывает злокачественной
• Факторы, имеющие прогностическое значение:
о Стадия опухолевого процесса
о Степень дифференцировки опухоли
о Наличие в опухоли гетерологических элементов
4. Лечение стромальной опухоли из клеток Сертоли:
• Основывается на индивидуальном подходе с учетом:
о Возраста и предпочтений пациентки
о Степени злокачественности (категория) и стадии опухоли
• У женщин молодого возраста, у которых опухоль не выходит за пределы яичника, важно сохранить фертильную функцию:
о У молодых пациенток с I стадией опухолевого процесса можно ограничиться односторонней сальпинговариэктомией
• При II и более далеко зашедшей стадии опухолевого процесса необходима абдоминальная гистерэктомия в сочетании с двусторонней сальпинговариэктомией
• При необходимости проводят адъювантную лучевую терапию или комбинированную химиотерапию:
о Показана в тех случаях, когда опухоль содержит низкодифференцированные или гетерологические элементы
е) Особенности диагностики:
1. Важно знать:
• Причиной вирилизации у женщин могут быть:
о Синдром Кушинга
о Опухоли надпочечника
о Опухоли яичника
о Другие заболевания яичников:
- СПКЯ
- Стромальная гиперплазия яичников
- Стромальный гипертекоз яичников
• Для установления диагноза большинство больных подвергаются большому объему клинического, лабораторного и лучевого обследования
• Показания к проведению лучевых исследований зависят от клинических особенностей заболевания
• Во многих случаях правильно выполненные лучевые исследования позволяют решить диагностическую задачу
• Опухоли из клеток Сертоли и Лейдига у некоторых пациенток с вирильным синдромом имеют небольшой размер, и поэтому их трудно выявить методами визуализации:
о Выполнение в таких случаях диагностической лапаротомии с селективным исследованием венозной крови, оттекающей от яичников и надпочечников, на гормоны позволяет уточнить локализацию этих опухолей
2. Признаки, учитываемые при интерпретации результатов:
• Односторонняя солидная опухоль яичника у пациентки с вирильным синдромом
Андробластома яичника
Андробластома яичника – редкая гормонпродуцирующая опухоль яичника. Диагностируется преимущественно в молодом возрасте. Проявляется возникновением акне, исчезновением менструаций, изменением фигуры по мужскому типу, гирсутизмом, огрублением голоса и увеличением клитора. Реже наблюдается преждевременное изосексуальное развитие (у подростков) или появление кровянистых выделений из влагалища (у женщин климактерического возраста). Андробластома яичника чаще бывает высокодифференцированной и протекает доброкачественно. В отдельных случаях возможно злокачественное течение. Диагноз выставляют на основании жалоб, данных общего и гинекологического осмотра и результатов дополнительных исследований. Лечение оперативное.
МКБ-10
Общие сведения
Андробластома яичника – опухоль яичника, выделяющая мужские половые гормоны. По различным данным, составляет 0,2-0,4% от общего количества опухолей овариальной ткани. Обычно встречается у девушек-подростков и молодых женщин. Может быть высокодифференцированной, промежуточной или низкодифференцированной.
Чаще выявляются высокодифференцированные андробластомы яичника с относительно доброкачественным течением. Реже, обычно в старшем возрасте или при низком уровне дифференцировки клеток, наблюдается злокачественное течение. После удаления андробластомы яичника избыточный рост волос на теле прекращается, овуляторный цикл восстанавливается, фигура снова приобретает женские очертания. При высокодифференцированных опухолях прогноз благоприятный. Диагностику и лечение осуществляют специалисты в области онкогинекологии.
Причины
Причины развития андробластомы яичника неизвестны. Считается, что такие опухоли образуются из эмбриональных остатков мужской части гонады под влиянием определенных изменений гипоталамо-гипофизарной системы или в связи с особенностями взаимодействия лютеинезирующего гормона с соответствующими рецепторами в яичниках, однако, какие именно изменения вызывают рост подобных новообразований – пока установить не удалось. Наследственной предрасположенности не выявлено.
Классификация
Андробластома яичника относится к группе вирилизирующих опухолей, развивающихся из ткани мезенхимы. Обычно бывает одиночной и односторонней, двухсторонние опухоли встречаются менее чем в 1% случаев. С учетом уровня дифференцировки клеток выделяют три варианта андробластом яичника:
- Высокодифференцированные.
- Промежуточные.
- Низкодифференцированные.
Существует четыре вида высокодифференцированных андробластом:
- тубулярная аденома;
- андробластома с накоплением липидов;
- лейдигома;
- опухоль из клеток Лейдига и Сертоли.
Тубулярная аденома и андробластома яичника с накоплением липидов состоят из клеток Сертоли. Эффект вирилизации в большей степени обеспечивается клетками Лейдига, эффект феминизации (при преждевременном изосексуальном развитии) – клетками Сертоли.
Симптомы андробластомы яичника
Болезнь обычно диагностируется в возрасте до 40 лет, пик заболеваемости приходится на третье десятилетие жизни. В отдельных случаях страдают дети. Развитие андробластомы яичника сопровождается появлением признаков мускулинизации. В 2/3 случаев возникает гирсутизм, в 1/3 случаев – аменорея. Примерно в течение полугода у пациентки становятся скудными, а затем прекращаются менструации, меняется фигура, возникают акне и избыточное оволосение.
Обычно заболевание протекает в две стадии. На первой стадии андробластомы яичника (стадии дефеминизации) развивается олигоменорея, а затем аменорея. Атрофируются молочные железы, исчезают жировые отложения, придающие фигуре женщины характерную округлость и мягкость. На второй стадии андробластомы яичника (стадии маскулинизации) увеличивается клитор, возникает избыточное оволосение. Голос становится более грубым. У некоторых больных появляются залысины в теменной и лобных областях.
Описаны случаи андробластомы яичника в сочетании гиперэстрогенемией. У девочек начинается преждевременное половое созревание в соответствии с полом. У женщин репродуктивного возраста отмечаются нарушения менструального цикла, у пациенток в постменопаузе появляются кровянистые выделения из половых путей. Данный вариант развития болезни не является типичным для андробластомы и встречается достаточно редко.
Диагностика
Диагноз андробластома яичника устанавливается на основании жалоб, анамнеза, данных внешнего и гинекологического осмотра и результатов инструментальных исследований. Обычно больные обращаются к гинекологу или эндокринологу с жалобами на отсутствие менструаций, избыточное оволосение и изменение внешности. При общем осмотре пациенток с андробластомой яичника обнаруживается атрофия молочных желез, гирсутизм и изменение фигуры по мужскому типу.
- Осмотр на кресле. При гинекологическом осмотре выявляется гипертрофия клитора и безболезненное, подвижное, гладкое опухолевидное образование плотной консистенции, расположенное справа или слева от матки.
- УЗИ половых органов. Сонография свидетельствует о наличии опухолевидного образования кистозного, солидного или кистозно-солидного типа с четко выраженной капсулой и неоднородным внутренним строением, характеризующегося чередованием гипер- и гипоэхогенных участков.
- Гормональные исследования. При проведении анализов крови на гормоны у больных с андробластомой яичника выявляется повышение уровня тестостерона, снижение уровня лютеинезирующего и фолликулстимулирующего гормона. Уровень дегидроэпиандростерона в норме или незначительно повышен.
Лечение андробластомы яичника
Лечение хирургическое. Объем оперативного вмешательства определяется с учетом возраста больной. Пациенткам репродуктивного возраста, страдающим андробластомой яичника, обычно выполняют одностороннюю аднексэктомию. В процессе операции обязательно проводят ревизию второго яичника. При увеличении размера яичника рассекают орган, выполняют интраоперационное гистологическое исследование для исключения второй опухоли. В постклимактерическом возрасте обычно проводят пангистерэктомию - гистерэктомию с удалением придатков.
При злокачественном течении, низком уровне дифференцировки и разрыве капсулы андробластомы яичника средней степени дифференцировки радикальное хирургическое вмешательство с удалением матки показано вне зависимости от возраста больной. В послеоперационном периоде назначают химиотерапию и лучевую терапию, однако эффективность комбинированной терапии при злокачественных андробластомах яичника пока трудно оценить из-за небольшого количества наблюдений.
Прогноз
Прогноз обычно благоприятный. 90-95% пациенток с высокодифференцированной андробластомой яичника преодолевают десятилетний порог выживаемости. При злокачественной опухоли, диагностированной на I стадии, и использовании лучевой терапии в послеоперационном периоде пятилетняя выживаемость по некоторым данным составляет 75%. При начале лечения на II и III стадиях отмечается снижение пятилетней выживаемости до 50%. Характерной особенностью андробластомы яичника является раннее рецидивирование. 60% рецидивов выявляются в течение первого года после хирургического вмешательства. Признаки вирилизации исчезают в течение 1-1,5 года после операции. Гипертрофия клитора сохраняется в течение всей жизни.
2. Опухоли женской репродуктивной системы/ под ред. Давыдова М.И., Летягина В.П., Кузнецова В.В. - 2007.
Гигантоклеточная опухоль кости ( Остеобластокластома , Остеокластома )
Гигантоклеточная опухоль кости – это доброкачественное, реже злокачественное новообразование, состоящее из мононуклеарных и гигантских многоядерных клеток, напоминающих остеокласты. Чаще локализуется в метафизах длинных трубчатых костей. Протекает бессимптомно или проявляется болями, припухлостью, локальной гипертермией, ограничением движений. Диагностика базируется на данных опроса, объективного осмотра, рентгенографии, компьютерной томографии, других аппаратных методик, цитологического и гистологического исследования. Лечение – хирургическое вмешательство, лучевая терапия.
Гигантоклеточная опухоль кости (ГКО, остеобластокластома, остеокластома) – неоплазия с двумя клиническими вариантами течения. Данные о распространенности существенно разнятся – от 4 до 25% от общего количества опухолевых поражений скелета. Доля злокачественного варианта составляет 5-10%. 80% пациентов находятся в возрастной категории 20-50 лет, пик заболеваемости приходится на третье десятилетие жизни. Женщины страдают несколько чаще мужчин. В 50-65% случаев поражается область коленного сустава (дистальная часть бедра или проксимальная часть голени).
Этиология гигантоклеточных опухолей окончательно не выяснена. Специалисты придерживаются общей для всех новообразований концепции Петерсона, согласно которой неоплазии являются полиэтиологическим заболеванием, возникают при сочетании внешних и внутренних неблагоприятных влияний. К экзогенным факторам риска относят вредные биологические (вирусные), химические, лучевые воздействия. Эндогенными факторами считаются обменные расстройства, нарушения гормонального баланса, снижение реактивности организма.
Патанатомия
В 89% ГКО формируется в длинных трубчатых костях. Нижние конечности поражаются двое чаще верхних. Первое место по распространенности занимает дистальный метафиз бедра, второе – проксимальная часть большеберцовой либо малоберцовой кости, третье – периферические отделы луча, четвертое – дистальная часть большеберцовой кости. Позвонки, мелкие и плоские кости страдают редко.
Характерны одиночные очаги, в литературе также описываются отдельные двойные локализации, чаще расположенные близко друг к другу в сочленяющихся костях. Гигантоклеточная опухоль находится в метафизе, иногда растет в сторону диафиза. Первично диафизарное расположение выявляется крайне редко. Одноядерные клетки новообразования имеют сходство с остеобластами, гигантские многоядерные – с остеокластами. В ткани неоплазии выявляются костные балочки, включения остеоида.
Доброкачественные опухоли имеют типичное строение. При озлокачествлении возможны три варианта. Первый – остеокластома метастазирует, сохраняя стандартную структуру (которая, выявляется, в том числе, в отдаленных очагах). Второй – первично злокачественная ГКО, которая отличается от доброкачественной наличием атипии и митозов преимущественно в одноядерных клетках. Третий – трансформация первично доброкачественной остеобластокластомы в различные виды сарком: остеогенную, веретеноклеточную, фибросаркому.
Симптомы
У большинства пациентов на начальной стадии единственным проявлением доброкачественной (типичной) гигантоклеточной опухоли является боль в зоне поражения. Иногда прослеживается связь между болевым синдромом и предшествующим травматическим повреждением. Симптом выражен умеренно, эпизодически беспокоит при движениях, имеет ноющий либо тянущий характер. Реже болезненности сопутствует появление опухолевидного образования, еще реже припухлость возникает без болевых ощущений.
У взрослых ГКО крайне редко манифестирует патологическим переломом. В то же время, у детей доля этого признака составляет более 50%. Все проявления, кроме патологического перелома, не доставляют особого беспокойства, поэтому больные впервые обращаются к врачу через 8 и более месяцев после дебюта заболевания, на стадии формирования развернутой клинической картины. На этом этапе боли выявляются у всех пациентов, нарастают при физической нагрузке, сохраняются в покое, зачастую беспокоят постоянно, усиливаются по ночам.
Пальпируемая неоплазия обнаруживается в 70-75% случаев. У остальных больных отмечается локальный отек мягких тканей. Частым симптомом в этом периоде становится ограничение подвижности в близлежащем суставе. Проявление, как правило, связано с усилением боли во время движений. Иногда отмечаются постепенно формирующиеся контрактуры, напрямую не связанные с болевым синдромом. У некоторых пациентов определяется выпот.
Злокачественная гигантоклеточная опухоль проявляется аналогичными признаками. Основными отличиями считаются незначительная продолжительность периода первичной симптоматики, быстрое прогрессирование, более высокая интенсивность болезненных ощущений. Новообразование, в среднем, начинает прощупываться через 4 месяца, развернутая клиническая картина выявляется спустя полгода с момента появления первых симптомов остеобластокластомы. Метастазы в легкие, другие кости, мягкие ткани обнаруживаются редко.
Первичные диагностические мероприятия осуществляются травматологами-ортопедами, в дальнейшем пациентов направляют к специалистам в области остеоонкологии. Характер патологии определяют на основании жалоб, данных физикального обследования, дополнительных исследований. В ходе внешнего осмотра выявляют опухолевидное образование костной плотности, отек и гиперемию, оценивают объем движений. Для уточнения вида новообразования применяют следующие методы:
- Рентгенография кости. На снимках визуализируется кистообразные изменения или неоплазия в виде «мыльных пузырей» в метафизарной зоне. Признаки общего остеопороза отсутствуют, вокруг измененного участка может просматриваться остеосклероз. Границы доброкачественной ГКО более четкие, но из-за местно-агрессивного роста при значительном размере возможно появление «костного козырька». Выраженная периостальная реакция нехарактерна. Злокачественная остеокластома имеет нечеткую структуру. На снимках рано обнаруживается разрушение кортикального слоя.
- КТ и МРТ кости. Компьютерная томография дает более четкое представление о форме, размерах, границах гигантоклеточной опухоли, в сомнительных случаях позволяет подтвердить или опровергнуть разрыв коркового слоя. В ходе магнитно-резонансной томографии исследуют интрамедуллярный и кистозный компоненты, оценивают состояние окружающих мягких тканей, расположение сосудов и нервов. Методики помогают выбрать оптимальный вариант хирургического вмешательства, спланировать операцию.
- Другие аппаратные исследования. При злокачественном процессе назначают сцинтиграфию костей скелета или ПЭТ-КТ. Благодаря накоплению остеотропных фармпрепаратов, методы хорошо визуализируют новообразование, выявляют вторичные костные очаги. Ангиография при злокачественном течении свидетельствует о формировании беспорядочной сосудистой сети с артериями неравномерного диаметра. Рентгенография легких показана при подозрении на метастазирование.
- Морфологические исследования. Верификацию гигантоклеточной опухоли осуществляют путем цитологического или гистологического анализа. Материал получают методом аспирационной биопсии или трепанобиопсии. Вероятность точного определения вида и степени дифференцировки неоплазии составляет 80-90%, сложности чаще возникают при рецидивах. При недостаточной информативности выполняют повторный забор ткани методом открытой биопсии.
- Другие лабораторные анализы. Результаты тестов неспецифичны, но способствуют дифференцировке доброкачественных и злокачественных ГКО. В первом случае изменения отсутствуют, во втором в крови выявляются ускорение СОЭ, лейкоцитоз, снижение железа и белка, увеличение уровня щелочной фосфатазы, фосфора, кальция. В моче обнаруживаются гексокиназа, оксипролин.
Различение проводят с аневризмальной костной кистой (чаще – солидным вариантом), центральной гигантоклеточной гранулемой, хондробластомой. Также требуется дифференциальная диагностика с неоссифицирующей фибромой и остеосаркомой.
Лечение гигантоклеточной опухоли кости
Основной метод лечения ГКО – хирургическое вмешательство. Объем операции выбирают с учетом размеров и распространенности неоплазии. В случаях «неудобного» расположения (в позвонках, плоских костях) или незначительного поражения трубчатых костей осуществляют экскохлеацию. Новообразования среднего размера удаляют методом краевой резекции. При вовлечении половины и более диаметра либо центральном расположении прибегают к сегментарной резекции. По показаниям применяют костно-пластические методики для замещения образовавшегося дефекта. Ампутации требуются редко.
При ограниченных легочных метастазах производят парциальную резекцию легких. Лучевая терапия показана при труднодоступных неоплазиях, прежде всего – расположенных в верхних отделах крестца. Метод также используется при отказе от операции, наличии тяжелой соматической патологии. В рамках комбинированного лечения рекомендован в пред- и послеоперационном периоде. Чаще всего проводится дистанционная гамма-терапия.
Прогноз доброкачественной гигантоклеточной опухоли кости достаточно благоприятный – после радикального иссечения с соблюдением принципов абластичности в большинстве случаев наступает выздоровление. Частота рецидивирования напрямую зависит от выбранного оперативного метода, составляет 46% после экскохлеации, 30% после краевой резекции и 6,6% после радикальной резекции. При злокачественном характере патологического процесса пятилетняя выживаемость составляет 35%, через 10 лет в живых остается 18% больных.
1. Первичные опухоли костей и костные метастазы. Диагностика и принципы лечения. Учебное пособие/ Маланин Д.А., Черезов Л.Л. – 2007.
2. Дифференциальная диагностика гигантоклеточных опухолей у детей. Автореферат диссертации/ Рогожин Д.В. – 2018.
Читайте также:
- Профилактика атеросклероза. Первичная и вторичная профилактика атеросклероза.
- Лимфатические узлы при раке. Морфология лимфатических узлов при опухоли.
- Влияние бета-адреноблокаторов (атенолола, бисопролола) на плод беременной
- Резекция пищевода с интерпозицией ободочной кишки. Техника резекции пищевода.
- Оборотная сторона тромболизиса. Влияние тромболизиса на смертность
