Осложнения болезни Вильсона-Коновалова. Клиника гемолитического осложнения Вильсона-Коновалова
Добавил пользователь Евгений Кузнецов Обновлено: 09.01.2026
Болезнь Вильсона-Коновалова (синонимы гепатолентикулярная дегенерация, гепатоцеребральная дистрофия) – тяжелое прогрессирующее наследственное заболевание, передающееся по аутосомно-рецессивному типу, в основе которого лежит нарушение экскреции меди из организма, приводящее к избыточному накоплению этого микроэлемента в тканях и сочетанному поражению паренхиматозных органов (прежде всего печени) и головного мозга (преимущественно подкорковых ядер).
NB! Причиной возникновения БВК являются мутации гена ATP7B, который локализован на 13 хромосоме в локусе 13q14.3 и кодирует медь транспортирующую АТФ-азу Р-типа – ATP7B.
Код(ы) МКБ-10:
| МКБ-10 | |
| Код | Название |
| E83.0 | Нарушение обмена меди (Болезнь Вильсона-Коновалова) |
Дата разработки/пересмотра протокола: 2017 год.
Сокращения, используемые в протоколе:
| анти-LC | антитела к цитозольному антигену печени |
| анти-LKM | антитела к микросомам печени и почек |
| анти-LP | антитела к белкам печени и поджелудочной железы |
| анти-SLA | антитела к растворимым печеночным антигенам |
| БВК | болезнь Вильсона-Коновалова |
| БХАК | биохимический анализ крови |
| ГГТП | Гамма-глютамилтранспептидаза |
| ГЛД | гепатолентикулярная дегенерация |
| КТ | компьютерная томография |
| МРТ | магниторезонансная томография |
| ОАК | общий анализ крови |
| ОАМ | общий анализ мочи |
| СОЭ | скорость оседания эритроцитов |
| СРБ | С-реактивный протеин |
| УЗИ | ультразвуковое исследование |
| ЩФ | Щелочная фосфотаза |
| ЭКГ | электрокардиограмма |
| ЭНМГ | электронейромиография |
| ЭРХПГ | Эндоскопическая ретроградная холангиопанкреатография |
| ЭЭГ | электроэнцефалография |
| ANA | антинуклеарные антитела |
| IgG | иммуноглобулин G |
| АNCА | антитела к цитоплазме нейтрофилов |
| АМА | антимитохондриальные антитела |
Пользователи протокола: врачи общей практики, педиатры, детские гастроэнтерологи, детские неврологи.
Категория пациентов: дети.
Шкала уровня доказательности:
| A | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| B | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| C | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+), результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая клиническая практика. |

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Классификация
Клиническая картина гепатолентикулярной дегенерации характеризуется большим полиморфизмом в отношении как неврологических, так и соматических проявлений. Этот полиморфизм отражен в различных классификациях заболевания.
Формы болезни Вильсона [3]:
· Бессимптомная форма;
· Печеночная форма;
· Церебральная форма;
· Смешанная форма.
В зависимости от вовлечения в патологический процесс печени и центральной нервной системы и характера экстрапирамидной симптоматики, распознают 5 форм гепато-церебральной дистрофии [11]:
· Брюшная (абдоминальная) форма – манифестирует в возрасте от 5 до 17 лет и характеризуется различными вариантами поражения печени, нередко принимающими злокачественное «галопирующее» течение, приводящее к смерти раньше появления симптомов со стороны нервной системы. Её продолжительность от нескольких месяцев до 3-5 лет.
· Ригидно-аритмогиперкинетическая, или ранняя форма отличается быстрым течением; начинается также в детском возрасте. В клинической картине преобладают мышечная ригидность, приводящая к контрактурам, бедность и замедленность движений, хореоатетоидные или торсионные насильственные движения. Характерны дизартрия и дисфагия, судорожный смех и плач, аффективные расстройства и умеренное снижение интеллекта. Заболевание длится 2-3 года, заканчивается летально.
· Дрожательно-ригидная форма встречается чаще других; начинается в юношеском возраста, протекает медленнее, порой с ремиссиями и внезапными ухудшениями, сопровождающимися субфебрильной температурой; характеризуется одновременным развитием тяжѐлой ригидности и дрожания, дрожание очень ритмичное (2-8 дрожаний в секунду), резко усиливается при статическом напряжении мышц, движениях и волнении, в покое и во сне исчезает. Иногда обнаруживаются атетоидные хореоформные насильственные движения; наблюдаются также дисфагия и дизартрия. Средняя продолжительность жизни около шести лет.
· Дрожательная форма начинается в возрасте 20-30 лет, протекает довольно медленно (10-15 лет и больше); дрожание резко преобладает, ригидность появляется лишь в конце болезни, а порой наблюдается гипотония мышц; отмечается амимия, медленная монотонная речь, тяжѐлые изменения психики, часты аффективные вспышки. Наблюдаются эпилептиформные припадки.
· Экстрапирамидно-корковая форма встречается реже других форм. Типичные для гепатоцеребральной дистрофии нарушения в дальнейшем осложняются апоплектиформно развивающимися пирамидными парезами, эпилептиформными припадками и тяжѐлым слабоумием (обнаруживаются обширные размягчения в коре больших полушарий). Длится 6-8 лет, заканчивается летально.
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [1-6,10,19,20]: на БВ должны обследоваться дети в возрасте от 2 до 18 лет, имеющих необъяснимое повышение сывороточных аминотрансфераз, проявления фульминантной печеночной недостаточности, хронического гепатита, цирроза печени, неврологические нарушения неустановленной этиологии, Кумбс-негативную гемолитическую анемию, отягощенный семейный анамнез по БВ. Диагностика БВ базируется на комбинации клинических симптомов, данных лабораторного обследования и молекулярно-генетического тестирования.
Диагностические критерии 2
Жалобы:
· боли в животе различной локализации;
· изменение цвета кожи;
· носовые кровотечения;
· тремор и непроизвольные движения;
· слюнотечение, дизартрия, нарушение глотания;
· мигренеподобные головные боли;
· бессонница;
· депрессия;
· невротическое поведение;
· изменения личности;
· психоз.
Клинические признаки болезни отражены в таблице 1.
Таблица 1 - Клинические признаки болезни Вильсона.
| Проявления болезни Вильсона-Коновалова | Симптомы |
| Поражение печени | Бессимптомная гепатомегалия |
| Изолированная спленомегалия | |
| Стеатогепатит | |
| Острый (фульминантный) гепатит | |
| Аутоиммуноподобный гепатит | |
| Цирроз печени | |
| Поражение ЦНС | Двигательные нарушения (тремор, непроизвольные движения) |
| Слюнотечение, дизартрия | |
| Ригидная дистония | |
| Псевдобульбарный синдром | |
| Вегетососудистая дистония | |
| Мигренеподобные головные боли | |
| Бессоница | |
| Дистонические атаки | |
| Психиатрические симптомы | Депрессия |
| Невротическое поведение | |
| Изменения личности | |
| Психоз | |
| Другие системы | Офтальмология: кольца Кайзера-Флейшера, «медная» катаракта |
| Гемолитическая анемия | |
| Патология почек: аминоацидурия, нефролитиаз | |
| Патология скелета: ранний остеопороз, артрит | |
| Поражение сердца: кардиомиопатия, нарушения ритма | |
| Панкреатит, желчекаменная болезнь | |
| Гипопаратиреодизм, гигантизм |
Физикальное обследование 3:
необходимо оценить наличие:
· смуглого («медный») цвета кожи;
· желтушности склер;
· незначительной или умеренной гепатомегалии;
· спленомегалии;
· неврологических нарушений и психических расстройств в виде непроизвольных движений в мышцах торса и конечностей;
· мигренеподобной головной боли;
· скованности в мышцах;
· эмоциональной лабильности;
· агрессивности.
Лабораторные исследования 2:
· общий анализ крови: лейкопения, нормохромная анемия, тромбоцитопения, ретикулоцитоз, ускоренная СОЭ.
· общий анализ мочи: при поражении почек можно обнаружить микрогематурию, незначительную протеинурию, гиперкальциурию.
· суточная экскреция мочи: гиперкупренилурия, признаки развившейся тубулопатии с признаками: глюкозурией, аминоацидурией, фосфатурией, уратурией, протеинурией.
· биохимический анализ крови: снижение церулоплазмина и общей меди, увеличение уровней свободной меди (таблица 1), аминотрасфераз (в 1,5-50 раз); билирубин повышен более чем в 2 раза, преимущественно за счет прямой фракции; уровень щелочной фосфатазы обычно повышен; может быть повышена активность гаммаглютамилтранспептидазы (ГГТП); гипоальбуминемия.
· коагулограмма: снижение протромбинового индекса, гипофибриногенемия, снижение тромбинового времени.
· пеницилламиновый тест: необходимо исследовать мочу, собранную сразу после приема 500 мг пеницилламина и через 12 часов. У пациентов с болезнью Вильсона-Коновалова суточная экскреция меди будет повышаться до более 1500 мкг/дл/сут (норма
Показатели лабораторных исследований представлены в таблице 2.
Таблица 2 - Лабораторные показатели при гепатолентикулярной дегенерации [6].
| Показатель | Норма | ГЛД |
| Церулоплазмин, мг/дл | 17–40 | < 17 |
| Общая медь в сыворотке крови, мкмоль/л | 12–32 | < 12 |
| Свободная медь в сыворотке крови, мкг/дл | 5–12 | > 50 |
| Суточная экскреция меди с мочой, мкг/сут | < 50 | > 100–1000 |
| Суточная экскреция меди с мочой в пробе с Д-пеницилламином, мкг/сут | 600–800 | 1000–3000 |
| Количественное содержание меди в печени, мкг/г | 15–55 | > 250 |
Инструментальные исследования 6:
· УЗИ печени и селезенки: позволяют выявить увеличение печени и реже селезенки, признаки портальной гипертензии и цирроза печени [5].
· ЭКГ – при поражении сердца можно выявить признаки гипертрофии левого или обоих желудочков, депрессию сегмента ST, инверсию зубца Т, различные виды нарушений ритма.
· ЭхоКГ – в ходе этого исследования можно выявить кардиомиопатию, гидроперикард.
· Электроэнцефалография – проводится пациентам с тяжелыми нарушениями со стороны ЦНС с эпилептическими приступами, регистрируется эпилептическая активность.
· Эзофагогастродуоденоскопия: на наличие варикозно расширенных вен пищевода и желудка.
· МРТ головного мозга: более информативно в диагностике, чем КТ головного мозга. Характерны билатеральные очаги пониженной плотности 3-15 мм в диаметре в области базальных ганглиев (хвостатое ядро, скорлупа и бледный шар), в таламусе, в области зубчатых ядер и коры мозжечка - симптом «морды гигантской панды» [19]. По мере прогрессирования процесса выявляются признаки диффузного атрофического процесса головного мозга с равномерным расширением субарахноидальных пространств и желудочковой системы [20]. Изменения МР-сигнала от структур головного мозга могут отсутствовать у 7-17% детей со смешанной формой болезни Вильсона при наличии неврологической симптоматики в виде тремора, дизартрии и изменения мышечного тонуса по экстрапирамидному типу 1.
· Пункционная биопсия печени: 1. для морфологического исследования биоптата печени, где выявляются дистрофические изменения клеток, некрозы, слабую воспалительную инфильтрацию и фиброз различной степени выраженности; 2. Определения концентрации меди в препарате печени - при ГЛД медь находится на уровне 1 000 мкг на 1 г сухого вещества печени. На доклинической стадии уровень печеночной меди не всегда превышает 250 мкг/г, у гетерозиготных носителей может быть в пределах 150–200 мкг/г. Нормальный уровень печеночной меди исключает ГЛД, тогда как повышенный подтверждает диагноз при наличии соответствующих клинических данных 5.
· Гистологическое исследование биоптата печени: морфологические изменения печени при болезни Вильсона не являются патогномоничными и включают в себя на ранних стадиях заболевания признаки жировой инфильтрации гепатоцитов (крупнокапельной и мелкокапельной), гликогеновой дегенерации ядер и фокальный гепатоцеллюлярный некроз, а также преобладание минимальной и низкой степени активности воспалительного процесса, нередко в сочетании с выраженными фибротическими изменениями. Могут быть изменения по типу аутоиммунного гепатита, вирусного, алкогольного и лекарственного поражения печени. По мере прогрессирования повреждений паренхимы, формируется фиброз и, впоследствии, цирроз печени. Обычно встречается гистологическая картина крупноузлового цирроза печени в исходе болезни Вильсона, однако, встречаются случаи и мелкоузлового цирроза.
Показания для консультации специалистов 2:
· консультация офтальмолога – для выявления колец Кайзера-Флейшера, также на наличие катаракты у детей, с целью исключения других болезней накопления;
· консультация невропатолога – оценка неврологического статуса, нервно-психического статуса;
· консультация психиатра – диагностика психиатрических состояний;
· консультация психотерапевта – коррекция психологических проблем;
· консультация гастроэнтеролога – коррекция нарушений желудочно-кишечного тракта;
· консультация гематолога – при наличии симптомов гемолитической анемии, коагулопатии;
· консультация нефролога – при наличии патологии в анализах мочи;
· консультация сурдолога – определение остроты слуха;
· консультация физиотерапевта – определение методов физиотерапевтического лечения;
· консультация хирурга – при риске пищеводно-желудочных кровотечений, для выявления показаний к проведению трансплантации печени у детей с признаками цирроза печени (ЦП), печеночно-клеточной декомпенсацией;
· консультация инфекциониста – при наличии сопутствующего вирусного гепатита;
· консультация отоларинголога – при инфекциях верхних дыхательных путей.
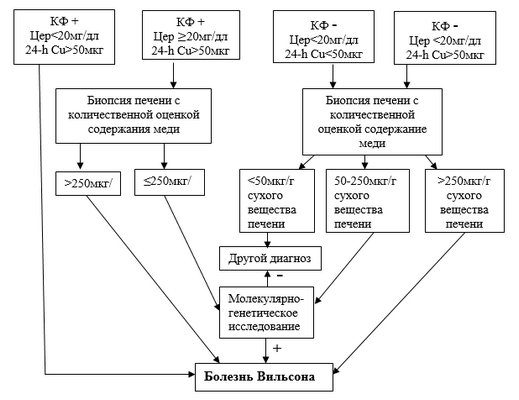
Диагностический алгоритм:
Рисунок 1- Алгоритм диагностики болезни Вильсона [3]. КФ – кольца Кайзера-Флейшера; Цер – церулоплазмин; 24-h Cu – суточная экскреция меди с мочой.
Ни один лабораторный тест (за исключением полного секвенирования патологического гена АТР7В) не обладает 100% чувствительностью и не обеспечивает 100% специфичность, таблица 3.
Таблица 3 - Тесты для диагностики болезни Вильсона.
| Тест | Характерные находки | Ложноотрицательный результат | Ложноположительный результат |
| Сывороточный церулоплазмин | Уменьшение на 50% относительно нормы | Нормальный уровень у пациентов с выраженным воспалением в печени. Завышение результата при иммунологических методах исследования. Беременность, прием эстрогенов. | Низкий уровень при: -мальабсорбции; -ацерулоплазминемии; -гетерозиготы |
| Суточная экскреция меди с мочой | >0,64мкмоль/24часа | Норма: -неправильный сбор мочи; -дети без вовлечения печени | Повышение: -гепатоцеллюлярный некроз; -холестаз; -контаминация |
| Свободная медь сыворотки | >1,6мкмоль/л | Норма при завышении уровня церулоплазмина иммунологическими методами | |
| Печеночная медь | >4мкмоль/г сухого вещества | В зависимости от места взятия материала: -активная болезнь печени; -узелки регенерации | Синдромы холестаза |
| Кольцо Кайзера-Флейшнера (при использовании щелевой лампы) | Наличие кольца | Отсутствует: -у 50% пациентов с печеночной формой; -у большинства асимптоматических сибсов | Первичный биллиарный цирроз |
Диагноз болезни Вильсона ставится на основании совокупности клинических данных, результатов лабораторного исследования и молекулярно-генетического анализа (таблица 4).
Таблица 4 - Лейпцигские балльные критерии диагностики болезни Вильсона [11]
Родственники по прямой линии вновь выявленного больного с болезнью Вильсона должны проходить скрининг на наличие у них болезни Вильсона-Коновалова.
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований 18
Таблица 5– Дифференциальный диагноз болезни Вильсона-Коновалова.
Осложнения болезни Вильсона-Коновалова. Клиника гемолитического осложнения Вильсона-Коновалова
Клиника гемолитического осложнения характеризуется развитием тяжелого шока, респираторного дистресс-синдрома, диссеминированного внутрисосудистого свертывания, крайне тяжелых признаков токсикоза с последующим развитием полиорганной недостаточности. Уже через 10—12 ч от начала осложнения, а в тяжелых случаях и раньше, наблюдается развитие признаков острой почечной недостаточности в виде выделительного нефроза. Развитие выделительного нефроза связано с механической закупоркой мочевыводящих путей продуктами распада крови и образовавшимся солянокислым гематином, а также с нарушениями почечного кровотока вследствие децентрализации кровообращения и развития ДВС-синдрома.
Степень гемолиза и, соответственно, тяжесть гемолитического осложнения определяются тем, какие эритроциты пострадали — собственные или донорские, то есть количеством гемолизированных клеток, а также длительностью воздействия повреждающего фактора, если речь идет об аппаратном гемолизе. Наиболее выражен, как правило, гемолиз аппаратного происхождения. При гемолизе химической природы содержание свободного гемоглобина в сыворотке крови может превышать 2000 мг%. Крайне неблагоприятен прогноз при гемолизе, связанном с нарушениями в аппарате искусственного кровообращения — в этих случаях полиорганная недостаточность развивается особенно быстро.
Первым клиническим проявлением гемолитического осложнения является шок. Степень выраженности его различна. В тяжелых случаях наблюдается внезапное резкое падение артериального давления, иногда систолическое давление падает до нуля, снижается объем циркулирующей крови за счет депонирования ее во внутренних органах: легких, печени, почках, головном мозге и т. д. Шок длится от нескольких минут до нескольких часов, и его следует рассматривать как начальный период полиорганной недостаточности.
Диагностировать причину шока и характер осложнения обычно удается только после нормализации гемодинамики и появления первых порций мочи характерного темно-бурого или красного лакового цвета.

Еще более сложна диагностика гемолитического осложнения у пациентов с ренопривным состоянием, терминальной стадией хронической почечной недостаточности, находящихся на программном гемодиализе, у которых типичная клиническая картина гемолитического осложнения не выявляется. В случае внезапных гемодинамических осложнений у таких больных следует обязательно исследовать кровь на содержание свободного гемоглобина.
Гемотрансфузионные и подобные им гемолитические осложнения требуют экстренных реанимационных мероприятий. Основные задачи проводимой медикаментозной и трансфузионной терапии состоят в:
— восстановлении объема циркулирующей крови;
— улучшении реологических свойств крови и микроциркуляции;
— дезагрегации форменных элементов;
— выведении токсических продуктов из организма;
— поддержании диуреза;
— предупреждении внугрисосудистого свертывания крови;
— нейтрализации протеолитических ферментов и вазо-активных веществ.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Внутрисосудистый гемолиз. Плазмаферез при остром внутрисосудистом гемолизе
Перечень основных причин острого внутрисосудистого гемолиза в хирургической клинике:
• гемолитические гемотрансфузионные осложнения;
• несовместимость крови донора и реципиента по системе АВО или по другим эритроцитарным антигенам;
• переливание недоброкачественной крови;
• осложнения экстракорпоральной гемоперфузии;
• болезнь Вильсона—Коновалова;
• аутоиммунные гемолитические анемии.
О проблеме внутрисосудистого гемолиза у пациентов с аутоиммунными гемолитическими анемиями речь в данном разделе идти не будет.
Гемотрансфузионные гемолитические осложнения могут быть иммунной или неиммунной природы. Иммунные осложнения связаны с несовместимостью крови донора и реципиента по антигенам эритроцитов. Наиболее тяжелыми бывают осложнения, вызванные переливанием крови, несовместимой по групповым факторам системы АВО. Клиника осложнений, вызванных переливанием крови, несовместимой с кровью реципиента по резус-фактору и другим эритроцитарным антигенам, характеризуется более поздним началом и менее бурным течением. Сравнительная активность изоантигенов представляется следующим образом:
Д>С>с>Е> Келл > Даффи > Кидд.
Еще меньшей иммуногенностью обладают антигены систем М, N, S, s, Левис, Р, Челлано и другие. Согласно данным зарубежной литературы, иммунные осложнения составляют от 50 до 94 % всех гемолитических гемотрансфузионных осложнений.
Неиммунные гемотрансфузионные гемолитические осложнения связаны с недоброкачественностью перелитой крови: ее бактериальным загрязнением, перегревом, гемолизом в процессе хранения или подготовки к трансфузии, денатурацией белков, длительным хранением, несоблюдением температурного режима хранения — перегревом или переохлаждением.
Случаи внутрисосудистого и внутриаппаратного гемолиза нередки при лечении больных с использованием методов экстракорпоральной гемоперфузии. Он может быть связан с бактериальным загрязнением ЭК контура, перегреванием крови, находящейся в ЭК контуре, попаданием в контур дезинфицирующих средств и других веществ, вызывающих разрушение форменных элементов крови и денатурацию белков. Возможна механическая или баротравма эритроцитов в ЭК контуре.
При гемодиализе причиной гемолиза могут стать отклонения в составе диализирующей жидкости. Нередки гемолитические осложнения вследствие технических погрешностей при проведении искусственного или вспомогательного кровообращения.
Описано развитие острого гемолиза во время плазмафереза, выполняемого фильтрационным методом на аппарате фирмы «Гамбро», что было связано с нарушением трансмембранного давления.
В доступной литературе данные о гемолизе вообще и об аппаратном, в частности, встречаются крайне редко. В основе аппаратного гемолиза лежат ятрогенные причины, точно так же как и в основе гемолиза гемотрансфузионного. Поэтому следует отметить, что на самом деле аппаратный гемолиз встречается отнюдь не реже гемотрансфузионного, а может быть, и чаще. Нередко он связан с низкой резистентностью мембраны эритроцитов.
В этой статье следует также остановиться на проблемах, связанных с заболеванием Вильсона—Коновалова. Для этого состояния характерны спонтанные гемолитические кризы. В основе патогенеза болезни лежит генетически обусловленный дефект (отсутствие фермента церрулоплазмина) метаболизма меди, что приводит к эндогенной интоксикации этим элементом. Первым органом, подвергающимся токсическому воздействию избытка меди, является печень, непосредственно участвующая в депонировании и элиминации этого металла. При прорыве печеночного барьера происходит существенное повышение концентрации меди в кровотоке, последствием чего становится массивный гемолиз эритроцитов.
Единственным способом, позволяющим обеспечить полную нормализацию метаболизма меди, является трансплантация донорской печени. Беспеченочный период этой сложной продолжительной операции особенно опасен развитием массивного внутрисосудистого гемолица эритроцитов. Вероятность гемолиза в беспеченочный период операции трансплантации печени усугубляется необходимостью использования вспомогательного кровообращения, а именно вено-венозного шунтирования, в процессе которого может наблюдаться травматизация эритроцитов и последующий внутрисосудистый гемолиз.
В основе патогенеза любого гемолитического осложнения лежит массивное внутрисосудистое или внутриаппаратное разрушение донорских или собственных эритроцитов пациента. При этом развивается биохимическая травма практически всех органов продуктами распада эритроцитов, других форменных элементов, белков. Наблюдается накопление биологически активных веществ и тканевого тромбопластина. Развивается недостаточность собственных детоксикационных систем организма.
Тактика при внутрисосудистом гемолизе. Опыт применения плазмафереза при гемолизе
Для стабилизации кислородтранспортной функции крови и профилактики тканевой гипоксии крайне важно своевременно устранить фактор, вызвавший гемолитическое осложнение, обеспечить больному адекватную вентиляцию легких, при необходимости используя ИВЛ, выполнить трансфузию отмытых индивидуально подобранных эритроцитов. При развитии явлений полиорганной дисфункции в комплексе реанимационных мероприятий целесообразно использовать различные методы экстракорпоральной детоксикации: гемофильтрацию, гемодиафильтрацию, гемодиализ, что позволяет повысить эффективность терапии, снизить летальность. На ранних стадиях гемолитического осложнения наиболее эффективен плазмаферез.
Этот универсальный метод ЭКД оказывает положительное влияние практически на все звенья патологического процесса, развивающегося при гемолизе. ПФ в достаточно короткие сроки выводит из кровяного русла свободный гемоглобин, строму разрушенных эритроцитов, другие продукты клеточного распада, биологически активные вещества, тканевый тромбопластин и т. д. Кроме того, ПФ усиливает поступление свежей плазмы из собственных тканей организма, улучшает микроциркуляцию в периферическом сосудистом русле, в сосудах печени, почек, малом круге кровообращения, оказывает влияние на реологию, гемокоагуляционную систему, иммунитет. Все эти воздействия в целом позволяют предотвратить развитие полиорганной недостаточности. Успех плазмафереза в профилактике ПОН определяется целым рядом факторов: временем начала эфферентных мероприятий относительно момента возникновения осложнения, объемом удаленной плазмы, наличием признаков гемолиза после окончания процедуры ПФ.
Имеющийся опыт доказывает, что признаки острого гемолиза удается ликвидировать в течение 3—10 ч, если плазмаферез начать сразу после купирования явлений шока. В тяжелых случаях процедуры плазмафереза следует повторять, а у пациентов с отсутствующей функцией почек чередовать с методами заместительной почечной терапии. ПФ следует продолжать до полной ликвидации признаков гемолиза в плазме и моче. Методы ЗПТ позволяют также снизить содержание в крови некоторых метаболитов, задействованных в развитии гемолитического осложнения.
Объем удаляемой плазмы однозначно определяется исходным уровнем свободного гемоглобина в плазме. Если исходный уровень свободного гемоглобина не превышает 1000 мг%, то для достижения клинико-лабораторного результата достаточно удалить один объем циркулирующей плазмы. Если исходный уровень свободного гемоглобина до 2000 мг%, следует замещать 2 ОЦП, при более высоких цифрах — до 3 ОЦП. Замещение выполняется свежезамороженной плазмой, изотоническими растворами глюкозы, кристаллоидами. У пациентов с сохраненной функцией почек замещение проводится в режиме гиперволемии. При отсутствии самостоятельного диуреза — в соотношении 1:1с объемом удаленной плазмы.
Для коррекции явлений энцефалопатии и гемокоагуляционных расстройств было достаточно эксфузировать 1 ОЦП с адекватным плазмозамещением.
Подобная тактика эфферентной терапии, внедренная в отделениях реанимации и трансфузиологии РНЦХ РАМН 12 лет назад, позволяет избежать развития симптомов полиорганной дисфункции в 90 % случаев. Ни в одном случае не потребовалось перевода больного, находящегося на самостоятельном дыхании, на ИВЛ.
Через 8—12 ч после окончания ПФ отмечалось не более чем двукратное повышение уровня билирубина и трансаминаз, которое корригировалось консервативными мероприятиями в течение ближайших суток и не требовало повторения эфферентных мероприятий. Лабораторных и клинических проявлений острой почечной недостаточности также не наблюдалось.
Позднее начало экстракорпоральных мероприятий, недостаточный объем плазмозамещения может стать причиной развития гемоглобинурийного нефроза и дальнейшего прогрессирования ПОН.
Таким образом, включение обменного плазмафереза в комплекс реанимационных мероприятий при остром внутрисосудистом гемолизе является эффективным способом профилактики полиорганной недостаточности при своевременном начале ЭК мероприятий и достаточном объеме плазмозамещения.
Болезнь Вильсона ( Болезнь Вестфаля-Вильсона-Коновалова , Болезнь Вильсона-Коновалова , Гепатолентикулярная дистрофия , Гепатоцеребральная дистрофия , Лентикулярная прогрессирующая дегенерация )
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФазы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Болезнь Вильсона может протекать в брюшной, ригидно-аритмогиперкинетической, дрожательной или экстрапирамидно-корковой форме. Диагностика болезни Вильсона включает офтальмологическое обследование, биохимические анализы мочи и крови, МРТ или КТ головного мозга. Основу патогенетической терапии составляют тиоловые препараты, которые могут приниматься в течении нескольких лет и даже пожизненно.
МКБ-10
Общие сведения
Болезнь Вильсона — наследственное заболевание, передающееся по аутосомно-рецессивному типу. Возникает в условиях мутаций в гене АТР7В, кодирующем белок медьтраснпортирующей АТФ-азы печени. Характерный признак болезни Вильсона — накопление меди в различных органах и тканях, в большей степени в печени и базальных ганглиях. Первооткрыватель заболевания — А.К. Вильсон, описавший заболевание в 1912 году, в отечественной медицине — Н.А. Коновалов. Патогенез болезни Вильсона был выявлен в 1993 году. Понятию «болезнь Вильсона» соответствуют также: болезнь Вильсона-Коновалова, болезнь Вестфаля-Вильсона-Коновалова, дистрофия гепатоцеребральная, дистрофия гепатолентикулярная, дегенерация лентикулярная прогрессирующая.
Причины
Ген АТР7В картирован на длинном плече хромосомы 13 (13q14.3-q21.1). Организм человека содержит около 50-100 мг меди. Суточная потребность меди для человека — 1-2 мг. 95% абсорбированной в кишечнике меди, транспортируется в форме комплекса с церулоплазмином (один из глобулинов сыворотки, синтезируемых печенью) и только 5% в форме комплекса с альбумином. Кроме того, ион меди входит в состав важнейших метаболических ферментов (лизилоксидаза, супероксиддисмутаза, цитохром-С-оксидаза и др.). При болезни Вильсона происходит нарушение двух процессов обмена меди в печени — биосинтез главного медьсвязывающего белка (церулоплазмина) и выведение меди с желчью, следствием чего становится повышение уровня несвязанной меди в крови. Концентрация меди в различных органах (чаще всего в печени, почках, роговице и головном мозге) увеличивается, что приводит к их токсическому поражению.
Согласно классификации Н.В. Коновалова различают пять форм болезни Вильсона:
- брюшная
- ригидно-аритмогиперкинетическая
- дрожательно-ригидная
- дрожательная
- экстрапирамидно-корковая
Симптомы
Для болезни Вильсона характерен клинический полиморфизм. Первые проявления заболевания могут появиться в детстве, юношестве, в зрелом возрасте и гораздо реже в зрелом возрасте. В 40-50% случаев Болезнь Вильсона манифестирует с поражения печени, в остальных — с психических и неврологических расстройств. С вовлечением в патологический процесс нервной системы обнаруживается кольцо Кайзера-Флейшера.
Брюшная форма развивается преимущественно до 40 лет. Характерный признак — тяжелое поражение печени по типу цирроза печени, хронического гепатита, фульминантного гепатита.
Ригидно-аритмогиперкинетическая форма манифестирует в детском возрасте. Начальные проявления — мышечная ригидность, амимия, смазанность речи, трудности при выполнении мелких движений, умеренное снижение интеллекта. Для этой формы заболевания характерно прогрессирующее течение, с наличием эпизодов обострения и ремиссии.
Дрожательная форма возникает в возрасте от 10 до 30 лет. Преобладающим симптомом является тремор. Кроме того, могут наблюдаться брадикинезия, брадилалия, тяжелый психоорганический синдром, эпилептические приступы.
Экстрапирамидно-корковая форма встречается весьма редко. Ее начало схоже с началом какой-либо из вышеперечисленных форм. Для нее характерны эпилептические припадки, экстрапирамидные и пирамидные нарушения и выраженный интеллектуальный дефицит.
Офтальмологическое исследование с помощью щелевой лампы выявляет кольцо Кайзера-Флейшера. Биохимические исследования мочи обнаруживают повышенную экскрецию меди в суточной моче, а также снижение концентрации церулоплазмина в крови. С помощью визуализационных методов (КТ и МРТ головного мозга) обнаруживают атрофию полушарий большого мозга и мозжечка, а также базальных ядер.
При диагностике болезни Вильсона неврологу необходимо дифференцировать ее от паркинсонизма, гепатоцеребрального синдрома, болезни Геллервордена-Шпатца. Основным дифференциально-диагностическим признаком этих заболеваний является отсутствие характерных для болезни Вильсона кольца Кайзера-Флейшера и расстройств обмена меди. Для подтверждения болезни Вильсона проводится генодиагностика.
Лечение болезни Вильсона
Основой патогенетического лечения является назначение тиоловых препаратов, в первую очередь — D-пеницилламина либо унитиола. Главное преимущество купренила — низкая токсичность и возможность длительного приема при отсутствии побочных эффектов. Его назначают по 0,15 г (1 капсула) в сутки (только после еды), в дальнейшем, в течение 2,5-3 месяцев дозу увеличивают до 6-10 капсул/сутки (оптимальная доза). Лечение D-пеницилламином проводится годами и даже пожизненно с небольшими перерывами (на 2-3 недели) в случае появления побочных эффектов (тромбоцитопения, лейкопения, обострения язвенной болезни желудка и т. д.).
Унитиол назначают в случае непереносимости (плохой переносимости) D-пеницилламина. Длительность одного курса лечения — 1 месяц, после чего лечение приостанавливают на 2,5-3 месяца. В большинстве случаев наступает улучшение общего состояния пациента, а также регресс неврологических симптомов (скованности, гиперкинезов). В случае доминирования гиперкинезов рекомендовано назначение небольших курсов нейролептиков, при ригидности — леводопы, карбидопы, тригексифенидила.
В случае тяжелого течения болезни Вильсона, при неэффективности консервативного лечения за рубежом прибегают к трансплантации печени. При положительном исходе операции состояние пациента улучшается, восстанавливается обмен меди в организме. В дальнейшем лечение пациента составляет иммуносупрессивная терапия. В России на сегодня постепенно внедряется в клиническую практику метод биогемоперфузии с изолированными живыми клетками селезенки и печени (т. н. аппарат «вспомогательная печень). Немедикаментозное лечение состоит в назначении диеты (стол №5) в целях исключения продуктов богатых медью (кофе, шоколад, бобовые, орехи и т. д.).
Прогноз и профилактика
В случае своевременного диагностирования болезни Вильсона и проведения адекватной медьснижающей терапии возможна нормализация общего состояние пациента и обмена меди в организме. Постоянный прием тиоловых препаратов по схеме, назначенной врачом-специалистом, позволяет поддерживать профессиональную и социальную активность пациента.
Для предотвращения рецидивов болезни Вильсона рекомендовано проведение лабораторных исследований крови и мочи пациента несколько раз в год. Необходим контроль следующих показателей: концентрация меди, церулоплазмина и цинка. Кроме того, рекомендовано проведение биохимического анализа крови, общего анализа крови, а также регулярные консультации у терапевта и невролога.
Читайте также:
