Осложнения люмбальной пункции у новорожденного
Добавил пользователь Alex Обновлено: 08.01.2026
Авторы: Насекин М.В. 1 , Бабаев Б.Д. 1, 2 , Острейков И.Ф. 1, 3 , Штатнов М.К. 3 , Мельникова Н.И. 3 , Логачева Т.С. 1
1 ФГБОУ ДПО РМАНПО Минздрава России, Москва, Россия
2 ГБУЗ «ДГКБ св. Владимира ДЗМ», Москва, Россия
3 ГБУЗ «ДГКБ им. З.А. Башляевой ДЗМ», Москва, Россия
Успешность люмбальной пункции с первой попытки у пациентов с нарушением анатомии позвоночника не превышает 80% даже при условии выполнения манипуляции опытным врачом.
Цель исследования: клиническая апробация методики проведения люмбальной пункции под ультразвуковым контролем у детей с нарушением анатомии позвоночника.
Материал и методы: на базе отделения реанимации и интенсивной терапии для инфекционных больных ДГКБ им. З.А. Башляевой ДЗМ проведена апробация методики ультразвукового (УЗ) сопровождения люмбальной пункции у детей с нарушением анатомии позвоночника. В исследование включали всех пациентов с сопутствующим диагнозом «органическое поражение ЦНС, спастический тетрапарез, деформация позвоночника». У 16 пациентов (9 мальчиков и 7 девочек) в возрасте от 3 до 10 лет (5,5±2,31 года) с массой тела от 12 до 21 кг (15,4±2,84 кг) и отягощенным преморбидным фоном проведена диагностическая люмбальная пункция под УЗ-контролем. Предварительное УЗ-сканирование позвоночного столба проводили с целью определения наилучшей точки входа пункционной иглы.
Результаты исследования: почти у всех детей удалось выполнить люмбальную пункцию на одном уровне. При этом у 3 пациентов потребовалась коррекция траектории продвижения иглы после контакта с костью. Только в 1 из 16 случаев в полученном ликворе присутствовало более 20 неизмененных эритроцитов в поле зрения, что трактовалось нами как осложнение. Среднее время проведения предварительного УЗ-сканирования позвоночного столба до начала люмбальной пункции составило 245±99 с (от 120 до 437 с). Сама процедура доступа к субдуральному пространству позвоночного канала занимала 111±45 с (от 67 до 202 с). В результате измерений, проведенных во время предварительного УЗ-сканирования позвоночника, средняя глубина расположения эпидурального пространства составила 17,7±2,5 мм (от 14,1 до 32,6 мм). При этом глубина введения иглы во время люмбальной пункции составляла 18,4±2,6 мм (от 15 до 34 мм).
Заключение: использование предварительного сканирования позвоночного столба у детей с нарушениями анатомии позвоночника позволяет увеличить вероятность успешной пункции твердой мозговой оболочки.
Ключевые слова: дети, люмбальная пункция, нарушения анатомии позвоночника, ультразвуковое сканирование, ультразвуковое сопровождение спинномозговой пункции.
Для цитирования: Насекин М.В., Бабаев Б.Д., Острейков И.Ф. и др. Проведение люмбальной пункции под ультразвуковым контролем у детей с нарушением анатомии позвоночника. РМЖ. Медицинское обозрение. 2019;3(11(I)):34-37.
M.V. Nasekin 1 , B.D. Babaev 1,2 , I.F. Ostreikov 1,2 , M.K. Shtatnov 2 , N.I. Mel’nikova 2 , T.S. Logacheva 1
1 Russian Medical Academy of Continuous Professional Education, Moscow
2 Z.A. Bashlyaeva City Children Clinical Hospital, Moscow
Even when lumbar puncture is performed by an experienced physician, success rate at the first attempt is less than 80% in patients with spine deformities.
Aim: to test a technique of ultrasound-assisted lumbar puncture in children with spinal deformities in clinical practice.
Patients and Methods: ultrasound-assisted lumbar puncture was performed in the Department of Emergency and Intensive Care in children with spinal deformities. All patients with CNS organic lesions, spastic tetraparesis, and spinal deformities were enrolled in the study. In 16 children (9 boys and 7 girls) aged 3–10 years (mean age 5.5±2.31 years) weighing 12–21 kg (mean weight 15.4±2.84 kg) with premorbidities, diagnostic ultrasound-assisted lumbar puncture was performed. Preliminary spinal ultrasound was performed to determine the best point of needle administration.
Results: lumbar puncture was performed at the same level almost in almost all children. Correction of needle steering after bone contact was required in one-third of the patients. More than 20 intact red blood cells in the liquor (regarded as a complication) were identified in 1 of 16 children only. The period between preliminary spinal ultrasound and lumbar puncture was, on average, 245±99 sec (120–437 sec). The approach to the subdural space of the spinal canal has taken, on average, 111±45 sec (67–202 sec). Mean epidural space location measured in the course of preliminary spinal ultrasound was 17.7±2.5 mm (14.1–32.6 mm) while mean needle administration depth in the course of lumbar puncture was 18.4±2.6 mm (15–34 mm).
Conclusions: preliminary spinal ultrasound in children with spinal deformities increases the chances of successful puncture of dura mater.
Keywords: children, lumbar puncture, spinal deformities, ultrasound, ultrasound-assisted lumbar puncture.
For citation: Nasekin M.V., Babaev B.D., Ostreikov I.F. et al. Ultrasound-assisted lumbar puncture in children with spinal deformities. RMJ. Medical Review. 2019;11(I):34–37.
В статье представлены результаты исследования, посвященного клинической апробации методики проведения люмбальной пункции под ультразвуковым контролем у детей с нарушением анатомии позвоночника
Введение
На сегодняшний день ультразвуковой (УЗ) аппарат стал незаменим в отделениях реанимации и интенсивной терапии у постели самых тяжелых пациентов. Врачи анестезиологи-реаниматологи используют УЗИ для визуального контроля процедур центрального венозного доступа, периферических нервных блокад, перикардиоцентеза и плевральной пункции [1]. УЗ-контроль повышает безопасность проводимых манипуляций за счет непосредственной визуализации анатомических особенностей области интереса, а также прямого контроля проведения иглы в режиме реального времени. И хотя большая часть коллег без труда и с высоким процентом успеха проводят люмбальные пункции пациентам любого возраста, существует категория пациентов, у которых эта стандартная процедура осложняется и может потребовать нескольких попыток. Это пациенты с нарушением анатомии позвоночника — со сколиозом или спастическим тетрапарезом. У пациентов этой группы вероятность успешной люмбальной пункции с первой попытки не превышает 80% даже при условии выполнения манипуляции опытным врачом [2]. Еще одним неблагоприятным прогностическим признаком для проведения люмбальной пункции является повышенная масса тела (ИМТ>35) [3, 4]. Мы считаем, что при помощи ультразвука можно решить эту проблему, т. к. УЗ-аппарат позволяет получить важную анатомическую информацию (глубина желтой связки, ширина межпозвонкового пространства и оптимальный угол для введения иглы) у каждого пациента из группы риска [5].
Целью настоящей работы явилась оценка эффективности проведения люмбальной пункции под УЗ-контролем у детей с нарушением анатомии позвоночника.
Материал и методы
С июня по декабрь 2018 г. на базе отделения реанимации и интенсивной терапии для инфекционных больных мы провели апробацию методики УЗ-сопровождения люмбальной пункции у детей с нарушением анатомии позвоночника: чаще всего сколиотической деформацией вследствие органического поражения ЦНС и детским церебральным параличом. У 16 пациентов (9 мальчиков и 7 девочек) в возрасте от 3 до 10 лет (5,5±2,31 года), с массой тела от 12 до 21 кг (15,4±2,84 кг) и отягощенным преморбидным фоном (органическое поражение ЦНС, спастический тетрапарез) планировалось выполнение диагностической люмбальной пункции. Мы использовали ультразвук для проведения предварительного сканирования позвоночного столба с целью определения наилучшей точки входа иглы.
После доставки пациента в манипуляционный зал проводилась стандартная газовая индукция в анестезию кислородно-воздушной смесью с севофлюраном (до 8 об%) и установка ларингеальной маски соответствующего размера. Затем больного укладывали на бок, с небольшим (максимально допустимым) сгибанием в поясничном отделе позвоночника. Поддержание анестезии: севофлюран 3,5–4 об%.
При помощи УЗ-аппарата GE LogiqBook с линейным датчиком изменяемой частоты 4–10 МГц производилось предварительное сканирование позвоночного столба на поясничном уровне.
В качестве стартовой точки мы пальпаторно идентифицировали крестцовую кость и располагали датчик над ней в поперечной плоскости (рис. 1).
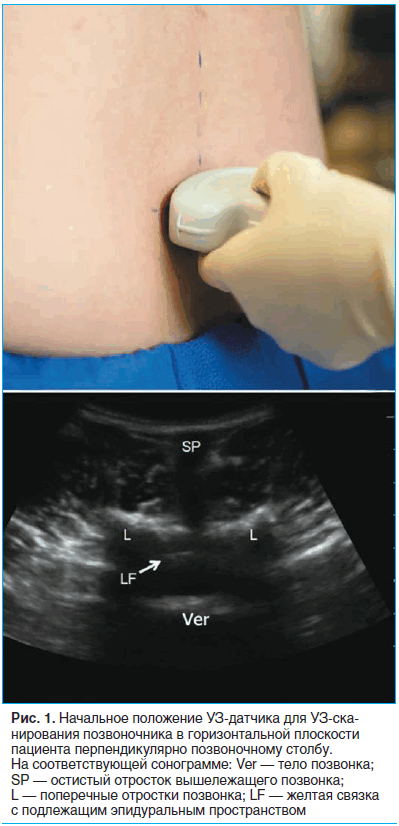
При этом на экране отображалась зубчатая структура кости с подлежащей акустической тенью. Затем, постепенно смещая датчик в краниальном направлении, мы отмечали остистые отростки L5, L4 и L3 позвонков. При УЗИ остистые отростки позвонков выглядят как небольшие острые с яркими гиперэхогенными краями образования, расположенные непосредственно под кожей. Обычно отросток L5 расположен несколько глубже, чем L4, но не всегда по средней линии у пациентов с выраженными скелетными деформациями. В любом случае мы отмечали медицинским маркером положение каждого остистого позвонка.
Далее с поворотом датчика на 90° по часовой стрелке мы получали продольное изображение позвоночника (рис. 2). Заметны полукруглые поперечные отростки поясничных позвонков с подлежащей акустической тенью, а также межпозвонковые промежутки между ними. В первом межпозвонковом промежутке отмечается яркая, гиперэхогенная линия желтой связки с подлежащим эпидуральным пространством и твердой мозговой оболочкой, укрывающей конус спинного мозга.
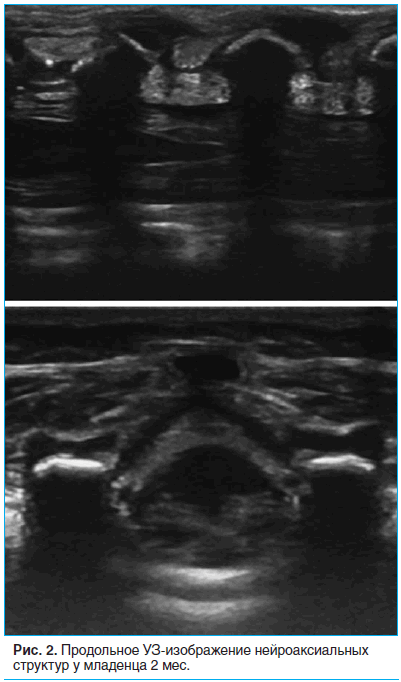
При этом соседние остистые отростки были видны как яркие, слегка наклоненные каудально, гиперэхогенные образования с выраженной акустической тенью. В межпозвонковом пространстве между ними распространению УЗ-луча ничто не мешает, поэтому оно выглядит как изоэхогенная серая полоса между темными анэхогенными тенями от остистых отростков. Смещая датчик выше или ниже, мы выбирали наиболее широкий межпозвонковый промежуток (L4–L5 или L3–L4) у каждого больного. На выбранном промежутке мы делали отметку в середине длинной оси датчика, получая вторую точку, от которой строился перпендикуляр к линии, соединяющей соседние остистые отростки на этом уровне. Таким образом мы получали наилучшую точку для проведения иглы при выполнении люмбальной пункции.
Затем, оставаясь в том же межостистом промежутке, мы возвращали датчик в поперечную плоскость и небольшим его наклоном добивались отчетливой визуализации твердой мозговой оболочки (ТМО). Дуральная оболочка при такой проекции имеет вид яркой, но тонкой, слегка закругленной линии, которая может колебаться в такт дыханию пациента. Этот феномен особенно заметен у маленьких детей и при выраженной гипотрофии. Мы измеряли расстояние от кожи до ТМО при помощи внутренней функции УЗ-аппарата.
Таким образом, после короткого УЗ-сканирования мы получали данные об оптимальной точке вкола иглы, глубине залегания ТМО и точно идентифицировали уровень проведения процедуры [6].
Затем датчик УЗ-аппарата откладывался в сторону и проводилась традиционная обработка поля процедуры и рук врача. Руководствуясь полученной при предварительном сканировании информацией, мы осуществляли люмбальную пункцию иглой Квинке 25G по стандартной методике в выбранной точке с наклоном 80–90° к плоскости поверхности тела.
Отмечали время проведения сканирования и время процедуры люмбальной пункции, количество попыток и количество перенаправлений иглы, глубину введения иглы и глубину ТМО по данным УЗИ, а также количество и тяжесть осложнений процедуры. Осложнением считали появление крови в павильоне иглы или большого количества неизмененных эритроцитов в полученном ликворе (больше 20 клеток в поле зрения).
Полученные результаты были обработаны при помощи пакета статистических программ Statitica (для Microsoft Windows) методами описательной статистики для непараметрических данных. Также мы провели сравнение фактической и предсказанной по УЗИ глубины введения иглы при помощи U-критерия Манна — Уитни.
Результаты исследования
Почти у всех детей удалось выполнить люмбальную пункцию на одном уровне. Также у 3 пациентов потребовалась коррекция траектории продвижения иглы после контакта с костью. И только в одном случае в полученном из лаборатории анализе ликвора присутствовало более 20 неизмененных эритроцитов в поле зрения, что трактовалось нами как осложнение.
Среднее время проведения предварительного сканирования позвоночного столба до начала люмбальной пункции составило 245±99 с (от 120 до 437 с). Сама процедура доступа к субдуральному пространству позвоночного канала занимала 111±45 с (от 67 до 202 с).
Измерения, проведенные во время предварительного УЗ-сканирования позвоночника, показали, что средняя глубина расположения эпидурального пространства составила 17,7±2,5 мм (от 14,1 до 32,6 мм). При этом глубина введения иглы во время люмбальной пункции составила 18,4±2,6 мм (от 15 до 34 мм) (рис. 3).
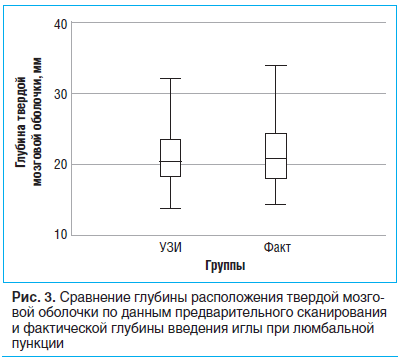
При сравнении двух зависимых выборок значение U-критерия Манна — Уитни составило 115,5, при этом критический уровень U-критерия при заданных объемах выборок составил 75 (p>0,05). Таким образом, можно констатировать отсутствие статистически значимых различий между прогнозируемой по УЗИ глубиной ТМО и фактической глубиной введения люмбальной иглы. Исследование показало, что УЗИ определяет истинную (вычисляемую по формулам) глубину ТМО и желтой связки и может быть использовано для повышения точности пункции ТМО с первой попытки без перенаправления иглы.
Хотя в нашем исследовании, как и во многих других [7–9], имелись доказательства эффективности предварительного сканирования позвоночника до проведения люмбальной пункции, мы по-прежнему сомневаемся в острой необходимости рутинного использования УЗИ у всех пациентов из-за достаточно низкого процента серьезных осложнений традиционной «слепой» методики у пациентов без нарушений анатомии позвоночника, а также правовой неоднозначности проведения УЗИ без соответствующего сертификата.
К тому же ультразвук всегда относился к оператор-зависимым медицинским технологиям, т. е. без должной подготовки УЗИ само по себе может быть фактором увеличения числа осложнений (главным образом, ошибка при измерении глубины ТМО или стороны датчика).
Однако существует достаточное количество доказательств, подтверждающих высокую эффективность УЗИ при проведении люмбальной пункции и эпидуральной анестезии у пациентов группы высокого риска: с избыточной или, наоборот, экстремально низкой массой тела, с нарушением анатомии позвоночника, после предшествующих хирургических операций на позвоночнике [10–13]. Наиболее показательны преимущества предварительного УЗИ позвоночника при выполнении люмбальной пункции опытным врачом, имеющим достаточную практику УЗ-ассистированных манипуляций.
В исследованных нами источниках не так много данных о проведении одномоментного УЗ-контроля при люмбальной пункции или эпидуральной анестезии [11]. Нет однозначного мнения и о наличии каких-либо серьезных преимуществ одномоментного контроля перед предварительным УЗИ позвоночного столба. Учитывая высокую сложность ориентирования иглы и ее удержания в плоскости датчика при проведении люмбальной пункции с одновременным УЗ-сопровождением процедуры, мы считаем, что необходимы дополнительные исследования в этой области для выявления каких-либо клинически значимых преимуществ.
По нашему мнению, еще одним неоспоримым преимуществом предварительного УЗИ позвоночного столба перед люмбальной пункцией является его наглядность: при обучении молодых врачей методике проведения люмбальной пункции наличие дополнительных данных о глубине ТМО, ширине выбранного межостистого промежутка и примерном направлении продвижения иглы обеспечивает большую скорость освоения техники манипуляции и большую уверенность в своих действиях. Однако для подтверждения гипотетической пользы использования УЗИ при обучении практическим навыкам в анестезиологии необходимы дополнительные исследования.
Заключение
В нашем исследовании мы показали, что использование предварительного сканирования позвоночного столба у пациентов с нарушениями анатомии позвоночника позволяет увеличить вероятность успешной пункции ТМО с первой попытки без перенаправления иглы. Кроме этого, мы уверены, что при помощи УЗИ можно до начала процедуры точно определить глубину, на которую необходимо провести иглу. Считаем, что использование УЗИ перед процедурой люмбальной пункции у пациентов высокого риска оправданно и не ведет к значительному увеличению времени процедуры.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Люмбальная пункция – показания и противопоказания, техника проведения
Что такое спинномозговая пункция, техника выполнения люмбальной пункции
Люмбальная (спинномозговая) пункция – это процедура, в ходе которой врач вводит специальную иглу в спинной мозг (непосредственно в его подпаутинное пространство) и осуществляет забор жидкости. Проводится она с диагностической или лечебной целью. Четкая техника выполнения люмбальной пункции позволяет избежать тяжелых последствий и осложнений, хотя они и не исключены.
Показания и противопоказания к проведению люмбальной пункции
Рассматриваемая процедура может быть проведена для диагностики или лечения определенных заболеваний. Если нужно получить точные диагностические данные, то люмбальная пункция назначается при необходимости:
- выявить или исключить присутствие инфекционного агента в спинномозговой жидкости (ликвор);
- уточнить показатели ликворного давления;
- выявить проходимость подпаутинного пространства спинного мозга.
В случае проведения лечебных мероприятий пункция может понадобиться для введения в ликвор антибактериальных средств, избавления от лишнего количества спинномозговой жидкости. Показания и противопоказания к проведению люмбальной пункции делят на обязательные и условные. В рамках диагностики и лечения процедуру показано проводить при:
- любых инфекционных заболеваниях центральной нервной системы;
- подозрении на истечение ликворной жидкости;
- злокачественных опухолях, локализованных непосредственно в структурах спинного мозга;
- кровоизлиянии в паутинную оболочку.
Допускается люмбальная пункция и при рассеянном склерозе, эмболии сосудов, системных заболеваниях, лихорадке в раннем детском возрасте. При перечисленных проблемах целесообразность проведения рассматриваемой процедуры определяет лечащий врач.
Нередко проводится пункция спинномозговой жидкости у недоношенных детей, и эта процедура может стать определяющей в постановке диагноза. У таких «сложных» новорожденных может присутствовать гидроцефалия без ярко выраженных симптомов, и как раз результаты диагностики по ликвору дадут ответы на вопросы врачей по поводу правильной постановки диагноза.
Противопоказаниями к проведению рассматриваемой процедуры с диагностической или лечебной целью являются:
- отек мозга, протекающий тяжело и с выраженными симптомами;
- высокое внутричерепное давление выясненной или невыясненной этиологии;
- диагностированные новообразования головного мозга;
- окклюзионная гидроцефалия;
- проблемы в работе системы свертывания крови;
- беременность;
- длительный прием антикоагулянтов.
В некоторых ситуациях, когда требуется точная диагностика, спинномозговая пункция может быть проведена и вопреки имеющимся противопоказаниям. Например, результаты анализа люмбальной пункции при менингите дают возможность установить тип инфекционного агента и подобрать эффективные лекарственные препараты. И если патология диагностирована или подозревается у беременной женщины, то врачи пренебрегают этим положением и делают все для спасения жизни пациентки.
Как проводится люмбальная пункция
Поскольку рассматриваемая процедура достаточно сложная, то ее проводит опытный врач и только после предварительной подготовки пациента. Алгоритм подготовки к спинномозговой пункции:
- кожу в области будущего прокола и введения специальной иглы обрабатывают медицинским спиртом и смазывают йодом;
- затем вводят новокаин или лидокаин (обезболивающие препараты) подкожно;
- сразу после формирования так называемой лимонной корки введение указанных препаратов продолжают уже внутрикожно и дальше вглубь будущего прокола.
Многие пациенты интересуются, больно ли делать спинномозговую пункцию. Неприятные (но не болевые) ощущения возможны только в период подготовки к процедуре, когда врач вводит обезболивающие препараты.
После подготовки начинается непосредственно процедура:
- Прокол делают между остистыми отростками между 3 и 4 позвонком (у пациентов в детском возрасте – между 4 и 5). Некоторые больные панически боятся люмбальной пункции, так как считают, что есть вероятность повреждения спинного мозга. Но прокол делается там, где его просто нет! Спинной мозг заканчивается между 1 и 2 позвонками, поэтому подобная угроза здоровью отсутствует.
- Врач вводит специальную иглу с приспособлением, которое закрывает ее просвет (мандрен), под небольшим углом. Как только игла попадает в подпаутинное пространство, специалист ощущает некий «провал». После этого можно вынуть мандрен – из иглы начнет выходить ликвор.
- Если спинномозговая жидкость не вытекает, то больного могут попросить приподнять верхнюю часть туловища для увеличения давления. Если рассматриваемая процедура проводилась часто, то врач может попробовать произвести забор ликвора для исследования немного выше указанного места – совершить быстрый и удачный прокол могут помешать спайки.
- При необходимости замерить давление спинномозговой жидкости к игле присоединяют специальную трубочку. Но опытный врач сделает такие замеры и без дополнительных инструментов – выход спинномозговой жидкости со скоростью 60 капель в минуту укажет на норму. Но нужно учитывать, что норма спинномозговой пункции у новорожденных при измерении давления будет несколько выше.
Осложнения и последствия люмбальной пункции
В первые 2-3 часа после процедуры пациент должен находиться в горизонтальном положении, возможен некий дискомфорт – например головная боль после люмбальной пункции, которая быстро исчезает и не требует употребления обезболивающих лекарственных препаратов. Нельзя поднимать тяжести и много ходить в первые 3-4 дня.
Возможные осложнения и последствия люмбальной пункции:
- раздражение мозговых оболочек;
- стойкие боли в области прокола;
- повреждение диска и формирование грыжи;
- кровотечения;
- инфицирование центральной нервной системы.
Более подробную информацию о правилах проведения процедуры и стоимости иглы для люмбальной пункции можно получить на страницах нашего сайта Добробут.ком.
Выполнение люмбальной пункции
При люмбальной пункции (ЛП) иглу вводят в субарахноидальное пространство спинного мозга поясничного отдела позвоночника с целью сбора спинномозговой жидкости (СМЖ) для лабораторных исследований, измерения давления в СМЖ, а иногда для интратекального введения диагностических или терапевтических агентов.
Если возникают трудности с пальпаторным определением ориентиров (например, из-за ожирения) нейрорадиолог может провести люмбальную пункцию под контролем рентгеноскопии. Ультросонграфию также можно использовать для определения ориентиров и, реже, для контроля правильного положения иглы в режиме реального времени, при наличии оборудования и персонала. Тем не менее ультрасонография все еще редко используется за пределами учебных центров.
(См. также Поясничная пункция Люмбальная пункция (поясничный прокол) Люмбальную пункцию используют для следующих целей: Оценка внутричерепного давления и состава цереброспинальной жидкости (ЦСЖ) (см. таблицу Аномалии состава спинномозговой жидкости при различных. Прочитайте дополнительные сведения , Обзор менингита Обзор менингита (Overview of Meningitis) Менингит – это воспалительное поражение мозговых оболочек и субарахноидального пространства. Это может быть результатом инфекции, других расстройств, или реакций на лекарственные препараты. Прочитайте дополнительные сведения и Субарахноидальное кровоизлияние Субарахноидальное кровоизлияние (САК) Субарахноидальное кровоизлияние – это внезапно возникающее кровотечение в субарахноидальное пространство. Самая частая причина спонтанного кровотечения – разрыв аневризмы. Субарахноидальное. Прочитайте дополнительные сведенияПоказания
Диагностические показания*
Подозрение на рассеянный склероз Рассеянный склероз (РС) Рассеянный склероз (РС) характеризуется появлением в головном и спинном мозге диссеминированных очагов демиелинизации. Характерные симптомы включают зрительные и глазодвигательные нарушения. Прочитайте дополнительные сведения Подозрение на спонтанное субарахноидальное кровоизлияние Субарахноидальное кровоизлияние (САК) Субарахноидальное кровоизлияние – это внезапно возникающее кровотечение в субарахноидальное пространство. Самая частая причина спонтанного кровотечения – разрыв аневризмы. Субарахноидальное. Прочитайте дополнительные сведенияПодозрение на внутричерепную гипотензию
Введении рентгеноконтрастного вещества для миелографии
* Заранее решите, какую информацию вам нужно получить из материала, взятого при поясничной пункции, и какие анализы вам нужно назначить. Перед началом процедуры в клинической лаборатории необходимо подтвердить требования к каким-либо нестандартным тестам.
Терапевтические показания
Снижение внутричерепного давления при идиопатической внутричерепной гипертензии
Введение интратекальных препаратов (например, спинальная или эпидуральная анестезия, интратекальная химиотерапия)
Противопоказания
Абсолютные противопоказания
Подозрение на инфекцию (например, флегмона, абсцесс) в месте введения иглы или рядом с ним: по возможности, используйте альтернативный, неинфицированный участок. Это проводится посредством субокципитального (цистернального) или шейного доступа (С1-С2) и всегда выполняется под рентгеноскопическим контролем.
Относительные противопоказания
Подозрение на повышенное внутричерепное давление вследствие внутричерепного новвобразования (например, опухоли, абсцесс мозга или кровь), которое может вызвать транстенториальное или мозжечковое вклинивание Вклинение головного мозга Дислокация головного мозга возникает при аномальном выпячивании мозговой ткани через отверстия ригидных преград внутри черепа (например, вклинение в тенториальную выемку), из-за повышенного. Прочитайте дополнительные сведенияСердечно-легочная недостаточность или респираторный дистресс-синдром, которые могут усугубляться при лежачем положении во время люмбальной пункции
Анатомические аномалии в месте введения (например, спондилодез, ламинэктомия, врожденные аномалии)
Было показано, что бактериемия не предрасполагает к менингиту после люмбальной пункции и, таким образом, не является противопоказанием.
* Если люмбальная пункция откладывается, лечение подозреваемого острого бактериального менингита Лечение Острый бактериальный менингит является быстро прогрессирующей бактериальной инфекцией мозговых оболочек и субарахноидального пространства. Симптомы, как правило, включают головную боль, лихорадку. Прочитайте дополнительные сведения или субарахноидального кровоизлияния Лечение Субарахноидальное кровоизлияние – это внезапно возникающее кровотечение в субарахноидальное пространство. Самая частая причина спонтанного кровотечения – разрыв аневризмы. Субарахноидальное. Прочитайте дополнительные сведения† Антикоагулянтная терапия (например, при тромбоэмболии легочной артерии) увеличивает риск кровотечения при катетеризации подключичной вены, однако этот риск должен быть сбалансирован с учетом повышенного риска тромбоза (например, инсульта) при отмене антикоагулянтной терапии. Если позволяет время, обсудите любые предполагаемые изменения с врачом, который контролирует антикоагулянтную терапию пациента.
Осложнения
Кровоизлияние в эпидуральное пространство (спинальная гематома)
Дискомфорт в нижней части спины или боль, которая может иррадиировать в задние отделы ног (самоограничивающая)
Эпидермоидная опухоль, возникает спустя годы после люмбальной пункции; риск увеличивается, если спинальная игла введена или извлечена без стилета (редко)
Вклинение головного мозга (редко)
Кортикальная слепота (редко)
Инфаркт спинного мозга в шейном отделе (редко)
Транзиторная или постоянная глухота (редко)
Ятрогенная инфекция (редко)
Транзиторная тошнота и/или звон в ушах
Головная боль развивается после люмбальной пункции примерно у 10% пациентов, обычно от нескольких часов до дня или двух после, и может быть тяжелой. Риск развития головной боли после ЛП повышен у лиц молодого возраста с небольшой массой тела. Использование более узких, нережущих игл может несколько уменьшить риск головной боли. Эти иглы вводят так, чтобы скос был обращен к правой или левой стороне пациента (его боков). Ни количество взятой СМЖ, ни длительность пребывания в лежачем положении после люмбальной пункции не влияют на частоту головной боли.
Оборудование
Во многих центрах имеются готовые наборы для люмбальной пункции. Если их нет, необходимое оборудование включает следующее:
Стерильные перчатки, халат, лицевая маска и головной убор
Стерильные хирургические простыни и/или полотенца
Раствор антисептика (например, хлоргексидин, повидон-йод, спиртовые салфетки)
Стерильную марлю (например, квадраты размером 10 см × 10 см [4 "× 4"])
Раствор для местной анестезии (например, 1% раствор лидокаина без адреналина, иглы 25-го и 20-го калибра, шприц 10 мл
Местные анестетики (стандартные для детей): безыгольное газовое инжекторное устройство с лидокаином, лидокаин-эпинефрин-тетракаиновый (ЛЭТ) гель или крем с лидокаином и прилокаином
Игла для спинномозговой пункции со стилетом: режущая игла (скошенный кончик) или нережущая (атравматическая) игла* (коническая); 20 или 22 * калибр; 9 см длиной для взрослых, 6 см для детей, 4 см для младенцев
Манометр и задвижка; опционально - короткая удлинительная трубка
* Использование специальных игл без режущих граней и игл меньшего калибра (т. е. 22-го калибра) снижает риск возникновения постпункционной головной боли.
Для ультразвукового контроля направления:
Прикроватное ультразвуковое устройство с высокочастотным линейным матричным зондом
Дополнительные факторы
При необходимости следует взять кровь на анализ глюкозы для сравнения с уровнем глюкозы в СМЖ; одновременно может быть взята кровь на олигоклональные полосы.
Краткосрочная седация (например, с применением пропофола или фентанила и/или мидазолама) может быть необходима для детей и взрослых с тревожностью.
Сопутствующая анатомия
Иглу желательно вводить в промежутках L3-L4 или L4-L5; таким образом, игла вводится ниже уровня спинного мозга.
Остистый отросток L4 лежит на воображаемой линии между верхушками задних верхних подвздошных гребней.
При введении по средней линии (наиболее распространенный подход) спинномозговая игла сначала пересекает надостистые и межостистые связки между остистыми отростками позвонков, прежде чем достигнет желтой связки.
Латеральное введение (например, на 1 см латеральнее и каудальнее от средней линии введения) не затрагивает связки в области средней линии и может облегчить люмбальную пункцию у пожилых пациентов, чьи связки кальцифицированы и склерозированы.
Желтая связка представляет собой толстую соединительнотканную структуру, при прохождении сквозь нее иглы может ощущаться "проваливание" (не всегда).
Затем игла проходит через эпидуральное пространство (жировую ткань и внутреннее позвоночное венозное сплетение) и через твердую мозговую оболочку (и одновременно через прилежащую арахноидальную оболочку), при этом снова может возникнуть ощущение "проваливания", после чего входит в субарахноидальное пространство (спинномозговой канал). Обратите внимание, что во многих случаях "проваливание" не ощущается.
У детей или младенцев, у которых соединительная ткань обладает низкой устойчивостью к проникновению, при прохождении иглой связки или твердой мозговой оболочки, "проваливание" не ощущается.
Положение пациента при проведении процедуры
Позвоночник следует согнуть в поясничном отделе с целью расширения пространств между позвонками. Пациент может находиться в положении лежа на боку или сидеть. Положение лежа на боку, в целом, более предпочтительно, его следует использовать, если желательно проведение манометрии СМЖ. Положение сидя может быть более эффективным для пациентов с ожирением и предпочтительнее для младенцев.
Положение лежа на боку: пациент лежит на боку в позе эмбриона, с согнутыми настолько, насколько это допустимо, бедрами. Убедитесь, что таз, спина и плечи перпендикулярны кровати. Положите одну подушку под голову, чтобы голова была на одном уровне с позвоночником, а другую подушку, если это необходимо для удобства, между коленями. Ассистент может помочь пациенту максимально свернуться. Прежде чем начать, примите удобное положение рядом с пациентом.
Положение сидя: пациент сидит на краю кровати с ногами на стуле или кресле, согнутыми в тазобедренных суставах, и наклоняется вперед, положив голову и плечи на прикроватный столик.
При выполнении процедуры у младенца помощник держит его руки и ноги спереди, удерживая младенца в сидячей позе эмбриона на кровати. Для предотвращения асфиксии из-за сгибания шеи также необходима поддержка головы.
Пошаговое описание методики
Определение и подготовка участка
Поместите пациента в правильное положение, используя помощника, если это необходимо.
Определите место введения иглы клинически: пальпируйте остистые отростки позвонков поясничного отдела позвоночника для выявления наиболее близкого к воображаемой линии между задними верхними подвздошными остями подвздошной кости; наиболее близким остистым отростком обычно является L4 (иногда L3 у женщин). Местом введения является углубление немного каудальнее этого остистого отростка (т. е. промежуток L3-L4 для отростка L4). Пометьте место вмешательства с помощью маркера для кожи. Хотя обычным местом введения является промежуток между L3-L4, промежутки между L4-L5 или L2-L3 также являются приемлемыми.
При проведении пункции детям, нанесите местный анестетик на кожу и подождите, пока он подействует.
Обработайте место введения антисептическим раствором от центра к периферии несколькими концентрическими кругами около 20 см в диаметре.
Дайте раствору антисептика высохнуть в течение по крайней мере 1 минуты. Если используется йод или хлоргексидин, вытрите его спиртом, чтобы предотвратить его попадание в субарахноидальное пространство со спинальной иглой.
Поместите стерильное оборудование на стерильный поднос и накройте стерильной салфеткой.
Наденьте стерильные перчатки. Если у вас есть какие-либо респираторные симптомы, носите маску. Если действуют протоколы изоляции, наденьте халат, маску и шапочку.
Соедините вместе манометр, кран и короткую соединительную трубку. Короткая соединительная трубка обеспечивает некоторую подвижность, помогая предотвратить неожиданное движение подключенного аппарата от смещения иглы, например, при неожиданном движении пациента.
Убедитесь, что кран, спинальная игла и стилет двигаются плавно.
Поместите стерильные простыни вокруг места операции.
С помощью иглы 25-го калибра введите анестетик в месте введения иглы, до образования папулы, а затем глубоко анестезируйте мягкие ткани вдоль предполагаемого пути введения иглы.
Введение спинальной иглы
Стилет должен полностью находиться на спинальной игле, когда она вводится или извлекается.
Удерживайте скошенную спинальную иглу таким образом, чтобы скос был обращен к правой или левой стороне пациента (т. е. направлен к пациенту, который находится в положении лежа на боку). Хотя иглу можно держать и одной рукой, фиксация двумя руками обеспечивает лучший контроль в случае, если пациент двигается или дергается.
Пропальпируйте гребень подвздошной кости и остистые отростки позвонков, чтобы убедиться в правильности места введения.
Вводите иглу, направленную в сторону пупка, примерно на 15° краниально, и продвигайте ее небольшими толчками примерно по 2–3 мм. При прокалывании иглой желтой связки (при попадании в эпидуральное пространство) и иногда при прокалывании твердой мозговой оболочки (при попадании в субарахноидальное пространство) может быть чувство "проваливания". При введении иглы детям такое ощущение обычно менее выраженно. Часто, для того чтобы попасть в субарахноидальное пространство, иглу необходимо продвинуть на большую часть ее длины. Удалите стилет во время дальнейшего продвижения иглы, чтобы проверить наличие тока СМЖ (указывающего на доступ к субарахноидальному пространству); повторно вставьте стилет перед продолжением продвижения иглы.
Если игла соприкасается с костью, выведите ее на подкожный уровень, направьте ее немного краниальнее, затем введите снова. Убедитесь, что игла направлена к спинномозговому каналу, а не в сторону.
Если при глубоком введении появляется кровь, то игла могла попасть в венозное сплетение в вентральной части спинного мозга. Извлекают иглу последовательными маленькими (например, 1 мм) движениями, проверяя возврат ЦСЖ при каждом движении.
Иногда кончик иглы блокируется нервными корешками или другими тканевыми структурами. Если СМЖ не получена, несмотря на успешное проникновение в субарахноидальное пространство, поверните иглу на 90° и выполните процедуру повторно.
Сразу после достижения субарахноидального пространства, повторно вставьте стилет и не продвигайте иглу дальше.
Люмбальная пункция
Люмбальная пункция выполняется пациенту в положении лежа на боку, игла для люмбальной пункции вводиться в промежуток между L3-L4.
Измерение давления СМЖ
Обычно проводят манометрию, но от нее можно отказаться, если пациенты находятся в критическом состоянии, и следует отказаться у пациентов, которые находятся в сидячем положении, потому что такие измерения будут неточными.
Снимите мадрен с иглы для спинальной пункции.
Прикрепите собранный манометр/кран/удлинительную трубку к игле.
Держите манометр на уровне спинальной иглы.
СМЖ поднимется в трубке манометра на высоту, соответствующую давлению СМЖ, которое можно определить по нанесенным на трубку делениям. Мениск СМЖ может незначительно колебаться в такт дыханию. Нормальная высота столба жидкости (давление СМЖ) составляет 7–18 см.
Если давление низкое, попросите пациента постепенно выпрямить ноги, чтобы улучшить течение СМЖ. Если нет изменений давления при дыхании, особенно если давление низкое, поверните иглу на 90°, чтобы уменьшить возможную обструкцию нервом, или если игла не полностью находится в субарахноидальном пространстве.
Сбор СМЖ
Никогда не аспирируйте СМЖ.
Если была выполнена манометрия СМЖ, следует отобрать СМЖ из манометра в первую пробирку для сбора. Когда манометр опустеет, снимите его.
Позвольте приблизительно 1–2 мл СМЖ стечь в каждую из 4 пробирок по порядку. Для некоторых тестов, таких как обнаружение кислотоустойчивых бацилл, грибов (например, Cryptococcus neoformans, Coccidioides immitis) или карциноматозного менингита, могут быть необходимы большие объемы (до 30–40 мл).
Необходимо провести подсчет клеток и разницу в их количестве в 1-й и 3-й пробирках, чтобы можно было сравнивать количество клеток, если присутствуют эритроциты. (Резкое снижение количества эритроцитов от 1-й до 3-й пробирки свидетельствует о травматической пункции).
Из 2-й пробирки и, при необходимости, из СМЖ, оставшейся от 1-й и/или 3-й пробирки, необходимо провести другие исследования, в том числе определение уровней белка и глюкозы, определение олигоклональных IgG ("олигоклональные полосы" [при необходимости]) и микробиологическое тестирование.
В случае, если позже станут необходимыми непредвиденные дополнительные исследования, рассмотрите возможность замораживания 4-й пробирки. Проконсультируйтесь с лабораторией на предмет того, как долго там хранятся образцы, и попросите их сохранить образец в течение более длительного периода времени, если это необходимо.
Информация по энтеровирусной инфекции.
Энтеровирусные инфекции у детей — острые инфекционные заболевания, возбудителями которых служат кишечные вирусы (энтеровирусы) из семейства пикорнавирусов. Клинические проявления энтеровирусной инфекции у детей полиморфны; заболевание может протекать в следующих формах: катаральной, гастроэнтеритической, энтеровирусной лихорадки, энтеровирусной экзантемы, герпангины, серозного менингита, миокардита, энцефаломиокардита новорожденных, конъюнктивита, увеита и др. Для обнаружения вирусов в биологических жидкостях используются методы ПЦР, ИФА, РПГА. Этиопатогенетическое лечение энтеровирусной инфекции у детей проводится интерферонами, иммуноглобулинами и другими препаратами.
- • Причины энтеровирусной инфекции у детей
• Классификация энтеровирусной инфекции у детей
• Симптомы энтеровирусной инфекции у детей
• Диагностика энтеровирусной инфекции у детей
• Лечение энтеровирусной инфекции у детей
• Прогноз и профилактика энтеровирусной инфекции у детей
• Цены на лечение
Энтеровирусная инфекция у детей
Энтеровирусные инфекции у детей – обширная группа заболеваний, вызываемых РНК-содержащими неполиомиелитными вирусами (Коксаки, ECHO, неклассифицированными энтеровирусами человека) и полиовирусом. В силу специфичности вызываемых поражений, полиомиелит стоит несколько обособленно в ряду энтеровирусных инфекций у детей, поэтому рассматривается нами отдельно. В рамках данного обзора остановимся на энтеровирусных инфекциях неполиомиелитной этиологии, распространенных среди детей.
Наряду с ОРВИ, энтеровирусные инфекции встречаются в педиатрии довольно часто. Ежегодно среди общего количества больных энтеровирусной инфекцией удельный вес детей составляет 80-90%; из них половина случаев заболевания приходится на детей младшего возраста. Учитывая полиморфизм клинических проявлений, энтеровирусные инфекции у детей представляют интерес не только для специалистов в области инфекционных болезней, но иневрологии, гастроэнтерологии, кардиологии, офтальмологии, отоларингологии.
Причины энтеровирусной инфекции у детей
Классификация энтеровирусной инфекции у детей
В зависимости ведущего клинического синдрома, различают типичные и атипичные энтеровирусные инфекции у детей. Типичные формы могут проявляться в виде изолированных или комбинированных поражений: герпетической ангины, катара верхних дыхательных путей,гастроэнтерита, эпидемической миалгии, энтеровирусной лихорадки, энтеровирусной экзантемы, гепатита. Поражение нервной системы при энтеровирусной инфекции у детей может протекать по типу энцефалита, серозного менингита, энцефаломиокардита новорожденных, параличей; поражение сердца – в виде миокардита и перикардита; поражение глаз – в виде геморрагического конъюнктивита и увеита; поражение мочеполовой системы – в форме геморрагического цистита, орхита, эпидидимита. К атипичным формам энтеровирусной инфекции у детей относятся случаи стертого и бессимптомного течения.
С учетом выраженности клинических признаков энтеровирусная инфекция у детей может иметь легкое, среднетяжелое и тяжелое течение. Критериями степени тяжести выступают выраженность местных изменений и интоксикационного синдрома. По характеру течения энтеровирусные инфекции у детей подразделяются на неосложненные и осложненные.
Симптомы энтеровирусной инфекции у детей
Несмотря на полиморфизм клинических проявлений, течению различных энтеровирусных инфекций у детей свойственны некоторые общие черты. Длительность инкубационного периода составляет от 2 до 10 дней (в среднем 2-4 дня). Манифестация заболевания происходит остро, с высокой лихорадки (39-40 °С), озноба, головной боли, слабости, нарушения сна, отсутствия аппетита, повторной рвоты.
При любой форме энтеровирусной инфекции у детей отмечается гиперемия кожи лица, шеи и верхней половины туловища, инъекция сосудов конъюнктивы и склеры. Возможно появление полиморфной пятнисто-папулезной сыпи, гиперемии слизистой миндалин дужек и задней стенки глотки, шейного лимфаденита. Считается, что внутриутробное инфицирование энетровирусами может послужить причиной синдрома внезапной детской смерти. Также доказана связь между энтеровирусной инфекцией у детей и развитием сахарного диабета 1 типа.
Кроме общей симптоматики, в клинике различных форм энтеровирусной инфекции у детей присутствуют свои специфические проявления.
Энтеровирусная лихорадка у детей (малая болезнь, летний грипп, трехдневная лихорадка) вызывается разными серотипами вирусов Коксаки и ECHO. Для инфекции характерна острая манифестация с лихорадки, миалгии, умеренных катаральных явлений. У ребенка выражены общие признаки энтеровирусной инфекции: инъекция сосудов склер, гиперемия лица, увеличение лимфоузлов и др.; может отмечаться увеличение печени и селезенки. Данная форма энтеровирусной инфекции у детей протекает легко, обычно не более 2-4 дней. В редких случаях энтеровирусная лихорадка продолжается 1-1,5 недели или имеет волнообразное течение.
Кишечная (гастроэнтеритическая) форма энтеровирусной инфекции чаще встречается у детей до 3-х лет. Заболевание протекает с незначительными катаральными явлениями (ринитом, заложенностью носа, гиперемией слизистых ротоглотки, кашлем) и диспепсическим синдромом (диареей, рвотой, метеоризмом). Тяжелая интоксикация, дегидратация и явленияколита не свойственны. Продолжительность кишечной формы энтеровирусной инфекции у детей составляет 1-2 недели.
Катаральная (респираторная) форма энтеровирусной инфекции у детей протекает по типу ОРЗ. Отмечается кратковременная лихорадка, ринофарингит, ларингит. Возможно развитие синдрома ложного крупа.
Энтеровирусная экзантема, ассоциированная с ECHO и Коксаки-вирусами, характеризуется появлением на высоте лихорадки кожной сыпи. По характеру сыпь может напоминать таковую при скарлатине, кори или краснухе; элементы располагаются преимущественно на коже лица и туловища. Реже встречаются пузырьковые высыпания в полости рта, напоминающие герпес(пузырчатка полости рта). Течение энтеровирусной инфекции у детей благоприятное; сыпь и лихорадка исчезают в течение 1-2 дней.
Эпидемическая миалгия (болезнь Борнхольма, плевродиния) – энтеровирусная инфекция у детей, вызываемая Коксаки и ECHO-вирусами. Ведущим проявлением заболевания служат интенсивные мышечные боли, сопровождающие высокую лихорадку. Чаще дети жалуются на боли в грудной клетке и верхней половине живота, реже – в спине и конечностях. При движении боли усиливаются, вызывая побледнение кожных покровов, обильное потоотделение, тахипноэ. Эпидемическая миалгия требует проведения дифференциальной диагностики с плевритом,острым аппендицитом или перитонитом. Вне болевого приступа дети чувствуют себя значительно лучше. Данная форма энтеровирусной инфекции у детей нередко протекает совместно с герпангиной и серозным менингитом.
Серозный менингит является типичной формой энтеровирусной инфекции у детей. Клиническая картина характеризуется высокой температурой тела, сильной головной болью, повторной рвотой, беспокойством и возбуждением ребенка, бредом и судорогами. Со стороны респираторного тракта отмечаются явления фарингита. С первых дней выражены менингеальные симптомы: положительные симптомы Брудзинского и Кернига, ригидность мышц затылка. Обычно через 3-5 дней симптоматика регрессирует, однако постинфекционная астенияи остаточные явления могут сохраняться в течение 2-3 месяцев.
Полиомиелитоподобная (паралитическая) форма энтеровирусной инфекции у детей является одной из наиболее тяжелых. Как и при полиомиелите, повреждение передних рогов спинного мозга может приводить к развитию вялых параличей и парезов нижних конечностей. В легких случаях прихрамывающая походка, слабость в ногах, снижение мышечного тонуса являются обратимыми и постепенно исчезают через 4-8 недель. При тяжелых формах энтеровирусной инфекции у детей возможен летальный исход вследствие нарушением функции дыхательного и сосудодвигательного центров.
Энцефаломиокардит новорожденных вызывается вирусами Коксаки типа В и характерен длянедоношенных и детей первых месяцев жизни. На фоне общей симптоматики (вялости, отказа от груди, субфебрилитета) нарастают явления сердечной недостаточности (тахикардия, одышка, цианоз, аритмия, расширение границ сердца и печени). При энцефалите развивается выбухание родничков и судороги. Летальность при данной форме энтеровирусной инфекции среди детей достигает 60-80%.
Геморрагический конъюнктивит вызывается энтеровирусом типа 70. Проявляется светобоязнью, слезотечением, ощущением инородного тела в глазах. Объективно определяются отек и гиперемия конъюнктивы, точечные кровоизлияния. При присоединении вторичной инфекции может развиваться бактериальный конъюнктивит, кератит. Обычно все симптомы энтеровирусной инфекции у детей стихают через 10-14 дней.
Энтеровирусный увеит преимущественно поражает детей 1-го года жизни. Данная форма энтеровирусной инфекции протекает с лихорадкой, интоксикацией, кишечным и респираторным синдромом. Поражение сосудистой оболочки глаза носит стойкий характер и может привести к дистрофии радужки, помутнению роговицы, развитию увеальной катаракты и глаукомы, субатрофии глазного яблока.
Особенности течения герпетической ангины проанализированы в соответствующем обзоре.
Диагностика энтеровирусной инфекции у детей
Энтеровирусные инфекции у детей диагностируются на основании типичного симптомокомплекса с учетом сезонности и эпидемиологических данных. Обязательным для установления диагноза является лабораторное подтверждение энтеровирусной инфекции у детей: обнаружение РНК энтеровируса методом ПЦР, определение титра специфических антител с помощью ИФА, РСК или РПГА и др.
Лабораторная верификация возбудителей может проводиться в различных биологических жидкостях: в крови, отделяемом конъюнктивы, смыве из носоглотки, соскобах с кожных высыпаний, образцах фекалий, спинномозговой жидкости (при наличии показаний длялюмбальной пункции), биоптатах органов и др.
В зависимости от ведущего клинического синдрома дети могут нуждаться в консультации педиатра, детского кардиолога, детского невролога, детского отоларинголога, детского офтальмолога и др. специалистов.
Различные формы энтеровирусной инфекции у детей требуют проведения дифференциальной диагностики с полиомиелитом, корью, краснухой, скарлатиной, эпидемическим паротитом, ОРВИ, ОКИ.
Лечение энтеровирусной инфекции у детей
Лечение легких изолированных форм энтеровирусной инфекции у детей проводится амбулаторно; госпитализация требуется при серозном менингите, энцефалите, миокардите, тяжелых комбинированных поражениях. В лихорадочном периоде показаны покой, постельный режим, достаточный питьевой режим.
Этиопатогенетическая терапия энтеровирусной инфекции у детей включает применение рекомбинантных интерферонов (альфа интерферона), интерфероногенов ( оксодигидроакридинилацетата, меглюмина акридонацетата), полиспецифических иммуноглобулинов (при тяжелом течении).
При миокардите, менингите и др. формах показано назначение глюкокортикостероидов. Одновременно проводится симптоматическое лечение (прием жаропонижающих, дезинтоксикационная терапия, орошение полости носа, полоскание зева и др.).
Читайте также:
