Осложнения при венозном зондировании сердца. Нарушение ритма сердца при венозной катетеризации
Добавил пользователь Дмитрий К. Обновлено: 20.01.2026
Венозный спазм при катетеризации сердца. Осложнения ретроградной артериальной катетеризации
Такие осложнения, как венозный спазм, вызванный длительными, грубыми манипуляциями, и петлеобразование встречаются очень редко и объясняются небрежной работой.
У больного Н-ва, 17 лет, 8/Х 1961 г. катетер, проведенный через правую бедренную вену, не удавалось ввести из правого предсердия в правое венозное устье из-за больших размеров полости предсердия. Пришлось прибегнуть к искусственному петлеобразованию с тем, чтобы конец зонда попал в желудочек сверху. Однако при этом катетер неожиданно «завязался узлом». Заметив это, оператор прекратил исследования, попытался развязать узел. Но только после 10 минут манипуляций зондом удалось распрямить катетер и подтянуть его в нижнюю полую вену. Во время второй попытки катетер легко провели в легочную артерию доступом через левую локтевую вену.
Среди инфекционных осложнений следует выделить флебиты, бактериальные эндокардиты, нагноение раны. У наших больных гнойных осложнений не было, однако в литературе встречаются отдельные их описания.
У больных с выраженным стенозом легочной артерии возможна остановка сердца вследствие закупорки катетером суженного отверстия.
Профилактикой осложнений служит внимательная работа под постоянным визуальным контролем электрокардиограммы и сокращений сердца. При появлении нарушений исследование следует приостановить или даже прекратить, ввести сердечные средства и выполнить реанимационные мероприятия (искусственное дыхание, наружный массаж сердца, дефибрилляция и другие).
Осложнения ретроградной артериальной катетеризации
Среди осложнений наиболее часто встречаются: 1) артериальный спазм из-за множественной и травматичной пункции, недостаточной анестезии, грубых манипуляций проводником или зондом и, наконец, продолжительного исследования;
2) местное кровотечение, гематома, ложная аневризма, артерио-венозная аневризма. Предрасполагающими факторами в возникновении их являются высокое артериальное давление, атеросклероз, диабет, недостаточное прижатие сосуда после пункции, длительное исследование, толстая игла или зонд, большое количество гепарина, полученное больным. Кровотечение может быть значительным и даже потребовать переливания крови. Среди наших наблюдений кровотечение, гематомы и аневризмы встречались лишь в период освоения методики чрескожной пункции артерии по Сельдингеру.
Лечение маленьких гематом консервативное; больших (особенно тогда, когда сдавливается сосудисто-нервный пучок) — хирургическое. Артерио-венозиые фистулы и аневризмы требуют оперативного лечения;
3) ложное проведение катетера или проводника возникает при перфорации стенки артерии или аорты концом катетера или проводника. Чаще это происходит у больных с атеросклеротическими изменениями или расслаивающими аневризмами, а также при грубых усиленных манипуляциях. В серии наших наблюдений в 4 случаях возникло паравазальное проведение катетера. В двух из них катетер вышел из просвета бедренной артерии в области ее прокола. У двух больных с заболеванием Лериша зонд перфорировал стенку подвздошной артерии и паравазально был проведен до уровня диафрагмы. Обычно в момент выхода зонда из просвета сосуда перестает регистрироваться артериальная кривая давления и через катетер не вытекает кровь.
Для уточнения положения зонда мы вводим небольшое количество контрастного вещества, которое в этом случае остается у конца зонда в тканях в виде пятна.
Кровотечение из мест прокола сосуда может быть большим и потребовать срочного оперативного вмешательства;
4) интрамуральное, субинтимальное введение контрастного вещества происходит при направлении конца катетера в стенку сосуда или левого желудочка;
5) закрытие просвета коронарной артерии катетером приводит к изменению электрокардиограммы. Ишемия иногда оказывается настолько значительной, что приводит к гибели больного.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Зондирование полостей сердца
Зондирование (или «катетеризация») сердца представляет собой инвазивную методику, которая практикуется в кардиохирургии и направлена на введение катетера в правые или левые отделы органа с диагностическими целями. В процессе хирург создаёт прокол в плечевой или бедренной артерии (для диагностики левых полостей) или локтевой или бедренной вены (для диагностики правых полостей). Через него под контролем рентген-аппарата и ЭКГ вводится катетер. Процедура позволяет оценить состояние перегородок и клапанов сердца, взять образцы крови и провести исследования камер со введением контрастного препарата.
Пройти зондирование полостей сердца в Москве приглашает отделение сердечно-сосудистой хирургии ЦЭЛТ. Оно начало свою работу почти три десятилетия тому назад и сегодня предлагает широкий спектр услуг по диагностике и лечению сердечно-сосудистых заболеваний. В нём ведут приём ведущие отечественные специалисты, кандидаты и доктора наук с опытом научной и практической деятельности, который исчисляется десятилетиями. В их арсенале имеется современное оборудование, позволяющее точно ставить диагноз и проводить лечение в соответствии с международными стандартами.
Зондирование полостей сердца: показания и противопоказания
На сегодняшний день катетеризация полостей сердца является одной из чаще всего проводимых манипуляций в кардиохирургии. Только в европейских странах каждый год её проводят почти миллиону пациентов! Использование современного оборудования и высокая квалификация наших специалистов позволяют свести к минимуму риск развития осложнений после неё. В зависимости от ситуации она может быть не только диагностической, но и лечебной.
- Оценка работы левого желудочка и определение степени ишемической болезни;
- Диагностика врождённых и приобретённых пороков сердца;
- Определение сужения или недостаточности аорты перед хирургическим вмешательством;
- Подтверждение/исключение диагноза «ишемия» у пациентов, которые страдают от болей в груди невыясненной этиологии;
- Сбор данных в процессе диагностики, которые подтверждают и дополняют результаты других исследований;
- Диагностика лёгочной гипертонии, определение её типа и тяжести;
- Оценка возможности проведения операции по трансплантации сердца или лёгкого.
Абсолютных противопоказаний к проведению данной процедуры не существует. Все они относительны и зависят от индивидуальных показаний пациента. Проводить её или нет – решает сам врач, оценивая и соотнося риски. Он может от неё и вовсе отказаться, если:
- Уровень электролитов в крови пациента не соответствует норме;
- Имеется диагноз острая почечная недостаточность;
- Пациент перенёс острый инсульт;
- Выявлено желудочно-кишечное кровотечение;
- У пациента имеется индивидуальная непереносимость контрастных препаратов;
- Уровень сердечных гликозидов в его крови превышает норму.
Типы катетеризации камер сердца
Их существует два: катетеризация правых и левых отделов сердца.
Позволяет определить анатомические особенности строения коронарной артерии и выявить ИБС. Благодаря ей можно определить и оценить следующие параметры:
- Функция аортального и митрального клапанов;
- Давление крови в аорте;
- Общее периферическое сосудистое сопротивление;
- Давление и функцию левого желудочка.
Позволяет оценить следующие параметры:
- Давление наполнения сердца;
- Сопротивление сосудов лёгких;
- Работа клапана лёгочной артерии.
Процедура применяется при трансплантации или механической поддержке сердца. Благодаря ей можно оценить давление в:
- Правом предсердии;
- Правом желудочке;
- Окклюзии лёгочной артерии.
Подготовка к зондированию полостей сердца
Она необходима для того, чтобы данная процедура не повлекла за собой никаких осложнений. В её рамках специалисты ЦЭЛТ назначают пациенту прохождение целого ряда диагностических исследований:
- Общий и биохимический анализы крови;
- Рентгенография грудной клетки;
- Электро- и эхокардиография; сердца.
Вышеперечисленное позволяет определить уровни тромбоцитов и гемоглобина в крови, а также правильность работы почек, печени, сердца, лёгких, аорты. Пациенту нужно обязательно сообщить лечащему врачу о своей индивидуальной непереносимости морепродуктов, контрастных веществ, йодсодержащих и любых других фармакологических препаратов. Вдобавок его следует поставить в известность о приёме средств от эректильной дисфункции или о беременности.
Дополнительная подготовка к зондированию полостей сердца требуется в возрасте до одного года или старше семидесяти лет, а также пациентам, которые страдают от:
- Сахарного диабета первого типа;
- Заболеваний кровеносных сосудов головного мозга;
- Тяжёлой лёгочной или почечной недостаточности.
Техника зондирования полостей сердца
Пациент принимает положение лёжа на спине, медицинский персонал фиксирует на нём электроды для электрокардиографии, устанавливает систему внутривенного вливания и запускает введение пятипроцентного раствора глюкозы или раствор натрия хлорида. Следующие этапы:
- После обезболивания области введения катетера хирург делает небольшой надрез кожного покрова и вводит его в кровеносный сосуд, аккуратно продвигая к сердцу и сверяя свои действия через рентгеновский аппарат;
- После того, как катетер достиг нужного места, он вводит контрастный препарат, который позволяет хорошо визуализировать сердечные структуры и артерии;
- Во время проведения процедуры каждые пятнадцать минут проводится мониторинг основных физиологических показателей (частоты сердечного ритма и сокращений, артериального давления и частоты дыхания);
- По завершении диагностики врач удаляет катетер и накладывает на полчаса тугую повязку.
Если во время процедуры пациента начинает тошнить, его просят покашлять, чтобы снизить эффект. Иногда после введения контраста может развиться аритмия, устранить которую помогает глубокое дыхание. Оно же даёт возможность легко установить катетер в лёгочную артерию и делает визуализацию сердца чётче.
Осложнения при венозном зондировании сердца. Нарушение ритма сердца при венозной катетеризации
Осложнения транссептальной пункции левого предсердия. Минутный объем кровообращения - метод Фика
1) прокол стенки предсердия и выход катетера в перикард — опасен при повышенном давлении в полости правого предсердия (Soulie с соавт., 1961). При этом возникает гемоперикард, который часто требует оперативного вмешательства. Описаний гемоперикарда при транссептальной пункции в литературе много (Веvegard с соавт., 1960; Paulin с соавт., 1962). Причиной его всегда служила погрешность в методике пункции, неправильно выбранная точка прокола или необычное расположение левого предсердия. При явлениях сдавливающего перикардита рекомендуется дренирование перикарда, а в некоторых случаях оперативное лечение.
Среди наших наблюдений у одного больного с сочетанным пороком сердца (митральным стенозом и недостаточностью трехстворчатого клапана среднее давление в правом предсердии равнялось 27 мм рт. ст.) после прокола стенки правого предсердия возник сдавливающий гемоперикард с падением артериального давления и прогрессирующей сердечной недостаточностью.
Обстоятельства потребовали подмечевидной пункций перикарда и проведения в него катетера, который соединили с системой для обратного переливания крови. Состояние больного по мере опорожнения перикарда улучшалось. За сутки через катетер выделилось около двух литров крови, которая была перелита больному. Одновременно введение гемостатических средств привело к остановке кровотечения. Через 2 суток состояние больного нормализовалось, рентгенологически тень сердца не изменилась по сравнению с исходной, признаков экссудативного перикарда не было.
У 4 больных во время операции обнаружен гемоперикард (до 150,0—200,0).
Сам по себе прокол межпредсердпой перегородки через 2—3 суток практически незаметен. Операции на открытом сердце показали полное заживление места пункции;
2) эмболия легочной артерии возникает не чаще, чем при обычном венозном зондировании (Soulie с соавт., Abroung с соавт., 1963). Осложнения, наблюдаемые при других методах пункции левого предсердия, намного более серьезны (Г. И. Астраханцева, В. С. Савельев, 1961).
Данные, полученные во время катетеризации, анализируются с применением формул для количественного определения показателен гемодинамики.
Минутный объем кровообращения - метод Фика
Для определения минутного объема сердца применяется метод Фика, позволяющий производить расчет артерио-венозных и венозно-артериальных шунтов при врожденных пороках сердца. Преимущество этого метода перед косвенными заключается в его большей точности.
В основе определения минутного объема лежат исследования крови на содержание кислорода и потребление кислорода больным. Диапазон ошибок метода всецело зависит от ошибок исследования крови и потребления кислорода. По литературным данным (Harvey и сотр., 1949; Cournand и сотр., 1949; Werko и сотр., 1949), средняя ошибка определения минутного объема по Фику составляет от 4,8% до 15%ю
Формула, предложенная Фиком, отражает прямую зависимость между МО и потреблением кислорода больным в 1 минуту и обратную между МО и артерио-венозной разницей в содержании кислорода крови в объемных процентах и имеет следующий вид: M=(Потребление О2 в 1 мин в см3 х 100) / (Об% О2 артерии - об% О2 вены) мл/мин.
Если большой и малый круг разобщены, их минутные объемы одинаковы.
Мерцательная аритмия – жизнь без лекарств

Мерцательная аритмия один из самых распространенных видов нарушений ритма сердца. При мерцательной аритмии предсердия не сокращаются, а хоатически мерцают, желудочки работают нерегулярно, что в значительной степени снижает эффективность сокращений сердца. Пациенты чувствуют перебои в работе сердца одышку, слабость и головокружение.
Но мерцательная аритмия таит в себе и другую угрозу. Когда предсердия перестают активно сокращаться, кровь в них заставиается, сгущается, что может привести к образованию тромбов в так называемых ушках предсердий (замкнутых пространствах). Тромб или его часть из ушка может отделиться, попадая в левый желудочек и оттуда разноситься в любой сосудистый бассейн - от головного мозга до пальцев ног, вызывая закупорку - эмболию артерии малого и большого калибра. Эмболия артерии перекрывает кровоток. Если это артерия головного мозга, то происходит инсульт, если артерия сердца - инфаркт, а эмболия артерий нижних конечностей может привести к гангрене ноги.
ПОЭТОМУ ПРОФИЛАКТИКА ТРОМБОЭМБОЛИИ ПРИ МЕРЦАТЕЛЬНОЙ АРИТМИИ НЕ МЕНЕЕ ВАЖНАЯ ЗАДАЧА, ЧЕМ ЛЕЧЕНИЕ САМОЙ АРИТМИИ. С этой целью во всем мире применяются препараты для снижения свертывания крови - т.н. антикоагулянты. Самые известные из них это производные Кумадина, в частности Варфарин. Прием Варфарина понижает уровень протромбина крови - белка-предвестника тромбина. В многочисленных наблюдениях показано, что прием Варфарина в адекватной дозе снижает риск развития инсульта и других катастрофических осложнений мерцательной аритмии в 7-10 раз. Но Варфарин обоюдоострое оружие. Снижая риск тромбоза, он одновременно повышает риск кровотечений, нередко жизнеопасных. Но самое трудное при лечении Варфарином - подобрать и сохранять адекватную дозу препарата. Для данного лекарства нет общепринятых схем, у каждого человека она строго индивидуальна. Систематический лабораторный контроль уровня протромбина необходим для эффективного действия препарата. Но в этом и главная сложность. Препарат легко передозировать, увеличивая риск кровотечения, также легко и потерять его лечебную дозу, тем самым увеличивая риск тромбоза. Кроме того, у части больных отмечается непереносимость препарата, а некоторые, например, престарелые или тяжелобольные, не могут адекватно контролировать дозу.
Проблема есть, но оказалось, что ее можно решить!
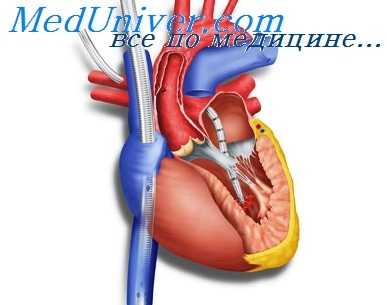
Закрытие ушка левого предсердия, т.е. ликвидация очага тромбоза, стала возможна без хирургического вмешательства. Кардиохирурги давно применяют ушивание ушка левого предсердия у больных с мерцательной аритмией при проведении операции на открытом сердце. Закрытие - изолирование «потаенных уголков» в сердце приводит к значительному снижению риска тробообразования и эмболии.
Как все это делается?
Контроль положения катетера и закрывающего устройства проводят рентгеном и ультразвуком. На этом операция заканчивается (примерно за 1 час), больного на следующие сутки отпускают домой. Несколько недель после этого он принимает препараты против свертывания крови. Вот, пожалуй, и все.
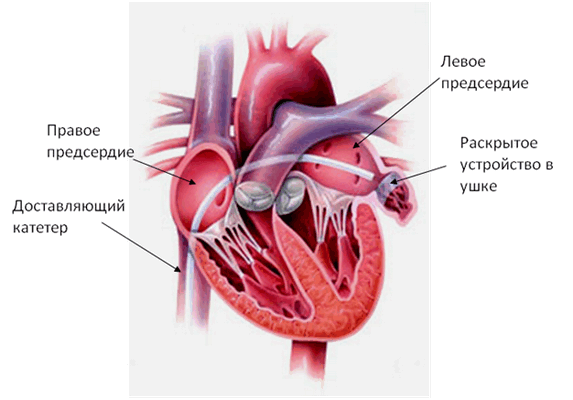
Возникает закономерный вопрос: а нет ли риска миграции устройства, как оно фиксируется. Практически во всех устройствах подобного рода предусмотрены небольшие крючки для надежной фиксации его к стенкам предсердия (Рис.3). Если диаметр устройства правильно подобран, то фиксация абсолютно надежная.
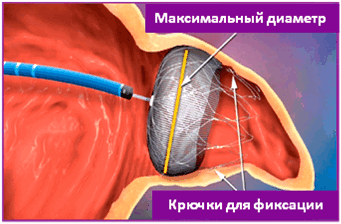
Что же происходит с устройством со временем? Как показывают наблюдения, спустя несколько недель поверхность «пробки» со стороны предсердия становиться совершенно гладкой, т.к. покрывается тонким слоем клеток, выстилающих внутреннюю поверхность предсердия. Полость ушка, своеобразная каверна, изолирована от кровотока, тромбы не образуются, эмболов не будет. УГРОЗЫ ИНСУЛЬТА ПРАКТИЧЕСКИ НЕТ. Не менее важно и то, что лекарства для профилактики тромбоза не нужны. Это маленькое чудо современной кардиологии .
1. На 5000 венозных катетеризации мы имели 2 летальных исхода. В обоих случаях во время проведения зонда через полость правого желудочка возникла асистолия, механизм которой в одном случае остался неясным, в другом — асистолии предшествовала кратковременная фибрилляция желудочков. Первый больной с дефектом межжелудочковой перегородки и синдромом Марфана. У второго больного были выраженные гемодинамические нарушения, вызванные полным артриовентрикулярным каналом. Американская сердечная ассоциация сообщила о 4 смертях на 5961 венозное зондирование.
При появлении асистолии желудочков па протяжении 15—20 секунд или их фибрилляции, определяемой по электрокардиоскопу и рентгеновскому изображению сердца, необходимо быстро подтянуть зонд в полую вену и начать наружный массаж сердца. Об эффективности массажа судят по величине венозного давления, которое не должно превышать исходное более чем в два раза, и по пульсации бедренных или шейных артерий. В это же время анестезиолог производит интубацию и переводит больного на искусственную вентиляцию легких, пользуясь сердечным катетером для введения необходимых наркотических препаратов и медикаментозных средств.
Иногда после трех-, пятиминутного массажа сердечная деятельность восстанавливается. Одновременно внутривенно вводят (при отсутствии противопоказаний) 10% раствор хлористого кальция (5—10 мл), 0,1 % раствора адреналина (0,1—0,3 мл).
Обычно к этому моменту успевают подготовить дефибриллятор. Производят наружную дефибрилляцию (ЭКГ-аппарат и электроманометр должны быть отключены). В случае неудачи процедуру повторяют несколько раз (до 5—8).
После восстановления сердечной деятельности, если нет атриовентрикулярной блокады, через катетер вводят, соответствующую возрасту и весу больного, дозу коргликона или строфантина. При полной нормализации сердечной деятельности больного переводят в реанимационную палату.
2. Наиболее часто встречающиеся осложнения в ходе венозной катетеризации — это нарушения сердечного ритма (экстрасистолии, блокады правой ножки пучка Гиса, атриовентрикулярные блокады — вплоть до полной, пароксизмальная тахикардия) в момент прохождения зондом области наджелудочкового гребня перегородки.
Нарушения ритма исчезают, как только катетер проходит опасную зону. В редких случаях стойких нарушений ритма приходится прибегать к дефибрилляции и кардиостимуляции.
При возникновении фибрилляции желудочков рекомендуется катетер подтянуть в нижнюю полую вену и активно проводить необходимые реанимационные мероприятия.
Так, например, больная Таня М-ва, 9 лет, 3/II 1969 г. была представлена на катетеризацию сердца с предполагаемым диагнозом «дефект межжелудочковой перегородки». Необходимо было уточнить диагноз и определить степень гемодииамических расстройств. Через бедренную вену в правое предсердие обычным путем проведен зонд. При попытке провести его дальше в правый желудочек и легочную артерию возникли правожелудочковые экстрасистолы, за которыми последовала асистолия. Через 25 секунд начат наружный массаж сердца. Больная интубирована и переведена на искусственное, дыхание. Зонд подтянули в нижнюю полую вену и через него ввели 10,0—10% хлористого кальция и 0,2—0,1% адреналина.
Через 2 минуты сердечная деятельность восстановилась, однако наблюдалась полная атриовентрикулярная блокада с желудочковым ритмом, равным 50 сокращениям в минуту. Внутривенно введено 3,0 дитилина и 5,0—1% гексенала, 1,0—0,1% атропина, 20,0—40% глюкозы, 1,0—0,6% витамина В1 5,0—0,5% аскорбиновой кислоты.
Через 10 минут на фоне искусственного дыхания полная атриовентрикулярная блокада перешла в неполную (2:1) с частотой желудочковых сокращений до 70 в минуту. Учитывая характер нарушений сердечного ритма, строфантин не вводили. Через 30 минут восстановился синусовый ритм, больная переведена в палату.
Исследование, таким образом, не было закончено ввиду его крайнего риска.
Читайте также:
