Осложнения трансплантации гемопоэтических стволовых клеток (ТГСК) - панцитопениния
Добавил пользователь Валентин П. Обновлено: 07.01.2026
Трансплантация гемопоэтических стволовых клеток (ГСК) – быстроразвивающаяся технология, которая потенциально может позволить добиться излечения при злокачественных заболеваниях крови ( лейкемиях Обзоры лейкемии (Overview of Leukemia) Лейкоз представляет собой злокачественное заболевание, характеризующееся производством избыточного количества незрелых или аномальных лейкоцитов, что в конечном итоге приводит к подавлению производства. Прочитайте дополнительные сведения , лимфомах Обзор лимфомы (Overview of Lymphoma) Лимфомы представляют собой гетерогенную группу заболеваний, происходящих из клеток ретикулоэндотелиальной и лимфатической системы. Основные варианты лимфом – лимфома Ходжкина и неходжкинские. Прочитайте дополнительные сведения , миеломах Множественная миелома Множественная миелома является злокачественной плазмоклеточной опухолью, продуцирующей моноклональные иммуноглобулины, которые внедряются в прилежащую костную ткань и разрушают ее. К характерным. Прочитайте дополнительные сведения , миелодисплазии Миелодиспластический синдром (МДС) Миелодиспластический синдром (МДС) представляет собой группу заболеваний, характеризующихся цитопенией в периферической крови, дисплазией гемопоэтических клеток-предшественников, гиперклеточностью. Прочитайте дополнительные сведения ). Трансплантация ГСК также иногда используется при солидных опухолях (например, некоторые опухоли зародышевых клеток), которые реагируют на химиотерапию. (См. также Обзор трансплантации (Overview of Transplantation) Обзор трансплантации (Overview of Transplantation) Трансплантатами могут быть собственные ткани пациента (аутотрансплантанты; например, кости, костный мозг и трансплантаты кожи) Генетически идентичная (сингенная [от монозиготных близнецов]). Прочитайте дополнительные сведения ).
Трансплантация ГСК содействует излечению путем:
Восстановления костного мозга после миелоаблативного уничтожения рака
Замены аномального костного мозга на нормальный костный мозг при доброкачественных гематологических заболеваниях
Трансплантация ГСК может быть аутогенной (с использованием собственных клеток пациента) или аллогенной (с использованием клеток от донора). Забор стволовых клеток могут проводится из
Периферическая кровь в значительной степени заменила костный мозг как источник стволовых клеток, особенно при аутотрансплантации ГСК, поскольку проводить забор стволовых клеток легче, а восстановление уровня нейтрофилов и тромбоцитов происходит быстрее. Трансплантация ГСК пуповинной крови зачастую используется только у детей, поскольку для взрослого человека в ней слишком мало стволовых клеток. Потенциальным будущим источником стволовых клеток являются плюрипотентные стволовые клетки (определенные клетки, взятые у взрослых и перепрограммированные, чтобы действовать как стволовые клетки).
Для аутогенной трансплантации ГСК нет противопоказаний.
Относительные противопоказания к аллогенной трансплантации ГСК включают возраст старше 50 лет, наличие предыдущих трансплантаций ГСК (ТГСК) и тяжелые сопутствующие заболевания.
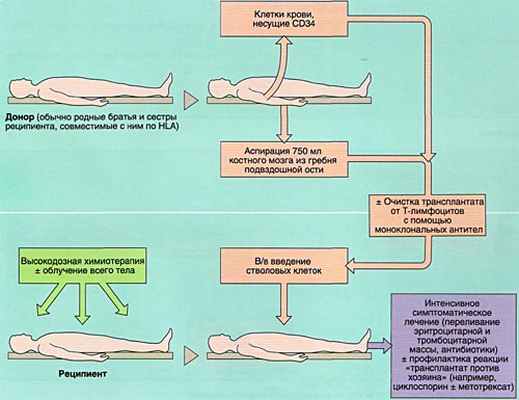
Аллогенная ТГСК ограничена, в основном, нехваткой тканесовместимых доноров. Идеальным донором является брат или сестра с идентичным главным комплексом гистосовместимости человека (НLA), далее следует брат или сестра с совместимым HLA. Поэтому часто используются родственные HLA-несовместимые доноры ГСК или неродственные совместимые (найденные в международных регистрах). Однако, уровень долгосрочной выживаемости без сопутствующих осложнений может быть ниже по сравнению с трансплантациями ГСК от HLA-идентичных родственных доноров.
Технология использования ГСК, выделенных из пуповинной крови, в стадии отработки, находится в зачаточном состоянии, но набирает интерес. Около 20 000 процедур трансплантаций пуповинной крови было сделано с момента введения этой процедуры в 1989 году. Поскольку пуповинная кровь содержит незрелые стволовые клетки, HLA-подбор не так важен, чем при других типах трансплантации гемопоэтических стволовых клеток. Одной из проблем, связанных с процедурой, является незрелая антигенная природа иммунных клеток в пуповинной крови, что приводит к увеличению процента необученных Т-клеток и увеличивает степени риска реактивации инфекций цитомегаловирусом или вирусом Эбштейна-Барр.
Методика
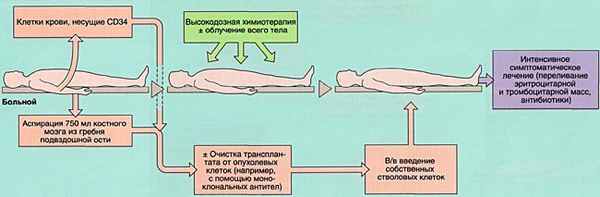
Для выделения костномозговых стволовых клеток аспирируется 700–1 500 мл (максимально 15 мл/кг) костного мозга из заднего гребня подвздошной кости донора; при этом используется местная или общая анестезия.
Для выделения стволовых клеток из периферической крови донору вводят рекомбинантные факторы роста (гранулоцит-колониестимулирующий фактор или гранулоцит-макрофаг-колониестимулирующий фактор) для стимуляции пролиферации и мобилизации стволовых клеток, последующий стандартный аферез проводится через 4–6 дней. Затем для идентификации и выделения стволовых клеток производится флуоресцентно-активированная сортировка клеток.
Стволовые клетки вводятся в течение 1–2 часов посредством центрального венозного катетера большого диаметра.
Режимы кондиционирования
Чтобы не произошло отторжения трансплантата, перед аллогенной трансплантацией гематопоэтических стволовых клеток в случае рака реципиенту для индуцирования ремиссии и супрессии иммунной системы в первую очередь назначают режим кондиционирования (например, миелоаблятивный режим, такой как назначение циклофосфамида 60 мг/кг/день 1 раз в день внутривенно в течение 2 дней с общим полнодозовым облучением всего тела, или бусульфан 1 мг/кг перорально 4 раза в день в течение 4 дней и циклофосфамид без общего облучения).
Подобные режимы кондиционирования используются при аллогенной ТГСК, даже если это при данном злокачественном заболевании не показано, для снижения частоты случаев отторжения и рецидива.
Такие схемы кондиционирования не используется до аутогенной ТГСК при заболевании раком; вместо этого используются специфические к раку лекарственные средства.
Немиелоаблативный иммуносупрессивный режим кондиционирования (например, циклофосфамид, облучение тимуса, антитимоцитарный глобулин [АТГ], и/или циклоспорин) может снизить риск заболевания и смерти и полезен пожилым пациентам, пациентам с сопутствующими заболеваниями и восприимчивым к реакции «трансплантат против опухоли» (например, с множественной миеломой).
Режимы с пониженной интенсивностью (например, флударабин с мелфаланом, пероральным бусульфаном или циклофосфамидом) по степени интенсивности и токсичности находятся между миелоаблативными и немиелоаблативными режимами кондиционирования. Цитопения, возникающая в результате лечения, может быть продолжительной и приводить к серьезным осложнениям и смерти, а также требует назначения терапии стволовыми клетками.
После трансплантации
После трансплантации гемопоэтических стволовых клеток, реципиент получает колониестимулирующие факторы для уменьшения продолжительности посттрансплантационной лейкопении, профилактический курс лекарственных средств Инфекция для защиты от инфекций, а при аллогенной ТКСК – профилактический курс иммуносупрессантов продолжительностью до 6 месяцев (обычно метотрексат и циклоспорин) для предупреждения реакции со стороны донорских Т-лимфоцитов по отношению к молекулам HLA реципиента (болезнь «трансплантат против хозяина»). Если пациент не лихорадит, от приема антибиотиков широкого спектра действия обычно воздерживаются.
Приживление трансплантата обычно происходит через 10–20 дней после ТГСК (раньше в случае трансплантации стволовых клеток из периферической крови) и определяется по абсолютному числу нейтрофилов > 500 мкл ( > 0,5 × 10 9 /л) на литр.
Осложнения трансплантации гемопоэтических стволовых клеток
Осложнения после трансплантации стволовых клеток могут возникнуть в раннем периоде (менее чем через 100 дней после трансплантации) или в позднем периоде. После аллогенной ТГСК риск инфекций увеличивается.
Ранние осложнения
Серьезные ранние осложнения включают:
Острая реакция «трансплантат против хозяина» (РТПХ)
Нарушение приживления и отторжение встречаются у 5% пациентов и проявляются персистирующей панцитопенией или необратимым снижением числа клеток крови. Лечение проводится глюкокортикоидами в течение нескольких недель.
Острая РТПХ отмечается у реципиентов при аллогенной трансплантацией КСК (у 40% пациентов, получивших клетки от HLA-совместимых сибсов, и у 80% – от неродственных доноров). При таком состоянии отмечается лихорадка, сыпь, гепатит с гипербилирубинемией, рвота, диарея, боли в животе (с возможным развитием кишечной непроходимости) и потеря веса.
Факторы риска острой РТПХ включают:
Несоответствие по половому признаку и системе НLA-антигенов
Пожилой возраст реципиента и/или донора
Предварительная сенсибилизация донора
Неадекватная профилактика БТПХ
Диагноз острой БТПХ ставится на основании данных анамнеза, объектвного обследования и результатов печеночных проб. Лечение: метилпреднизолон 2 мг/кг внутривенно 1 раз в день, с увеличением дозы до 10 мг/кг при отсутствии ответа в течение 5 дней.
Поздние осложнения
Серьезные поздние осложнения включают:
Хроническая БТПХ может возникать самостоятельно, развиваться из острой БТПХ или появляться после разрешения острой БТПХ. Хроническая БТПХ начинается обычно через 4–7 месяцев после ТГСК (период может варьировать от 2 месяцев до 2 лет). Хроническая БТПХ наблюдается у реципиентов при аллогенной ТГСК (у 35–50% реципиентов, получивших трансплантаты от HLA-совместимых родственных доноров, 60–70% – от неродственных доноров).
Хроническая БТПХ поражает в первую очередь кожу (например, лихеноидная сыпь, склеротические изменения кожи) и слизистые (например, сухой кератоконъюнктивит, периодонтит, орогенитальные лихеноидные реакции), а также желудочно-кишечный тракт и печень. Основной характеристикой является иммунодефицит; могут развиваться также облитерирующие бронхиолиты, подобные тем, которые развиваются при трансплантации легких. В конечном счете, БТПХ приводит к смерти 20-40% пациентов, у которых она развилась.
Лечение БТПХ, которая влияет на кожу и слизистые, необязательно; при более тяжелых состояниях лечение подобно таковому при острой БТПХ. Используя моноклональные антитела или механическую сепарацию, добиваются истощения Т-лимфоцитов в аллогенном донорском трансплантате, что снижает частоту и тяжесть БТПХ, но это также снижает реакцию «трансплантат против опухоли», что может усилить клеточную пролиферацию, улучшить приживание и снизить частоту рецидивов болезни. Частота рецидивов при использовании аллогенных ГСК выше из-за отсутствия влияния реакции "трансплантат против опухоли", и из-за того, что могут быть трансплантированы циркулирующие опухолевые клетки, случайно собраные вместе со стволовыми клетками. Ex vivo исследуются опухолевые клетки, выделенные перед аутогенной трансплантацией.
У пациентов без хронической БТПХ назначение всех иммуносупрессантов может быть прекращено через 6 месяцев после ТГСК; таким образом, поздние осложнения у этой группы пациентов редки.
Прогноз при трансплантации гемопоэтических стволовых клеток
Прогноз после трансплантации ГСК варьирует в зависимости от показаний и выполняемой процедуры.
В целом, рецидив заболевания происходит у
40-75% реципиентов аутогенных ГСК трансплантатов
10-40% реципиентов аллогенных ГСК трансплантатов
В целом, показатели успешного лечения (без рака костного мозга) составляют
30-40% пациентов с рецидивом лимфомы, чувствительной к химиотерапии
20-50% пациентов с острым лейкозом в стадии ремиссии
По сравнению с применением только химиотерапии, трансплантация ГСК улучшает выживаемость больных с множественной миеломой. Показатель успешного лечения ниже у пациентов с более запущенным заболеванием или с реактивным солидным раком (например, опухоли эмбриональных клеток). Частота рецидивирования снижается у пациентов с болезнью трансплантат против хозяина (БТПХ), но в целом смертность увеличивается, если БТПХ протекает тяжело.
Интенсивный режим кондиционирования, эффективная профилактика БТПХ, курс лечения на основе циклоспорина и качественная поддерживающая терапия (например, при необходимости, антибиотиками, профилактика инфицирования вирусом герпеса и ЦМВ) увеличивают длительную выживаемость после ТГСК без рецидива заболевания.
Авторское право © 2022 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.
Трансплантация гемопоэтических стволовых клеток
Трансплантация гемопоэтических стволовых клеток (ТГСК) – метод лечения, широко применяющийся при многих гематологических, онкологических и генетических заболеваниях. В обиходе для этого метода часто используется термин «трансплантация костного мозга», хотя в действительности сейчас далеко не всегда для ТГСК используется именно донорский костный мозг. Гемопоэтические стволовые клетки для трансплантации могут быть взяты из разных источников: как действительно из костного мозга (ТКМ), так и из периферической крови (ТПСК) или пуповинной крови.
Суть ТГСК заключается в следующем. Сначала больной получает терапию кондиционирования (как правило, это химиотерапия высокими дозами препаратов, иногда в сочетании с облучением всего тела), которая полностью подавляет его собственный костный мозг. Затем больному внутривенно вводятся суспензия гемопоэтических стволовых клеток (ГСК), которые постепенно заселяют его костный мозг и восстанавливают кроветворение.
Существуют два основных типа ТГСК.
I. При аутологичной трансплантации (аутотрансплантация, ауто-ТГСК) больному вводят его собственные ГСК, взятые у него заранее в ходе лечения (например, после нескольких блоков химиотерапии) и хранившиеся в замороженном виде до момента трансплантации. Ауто-ТГСК чаще всего применяется при лечении злокачественных солидных опухолей: различных лимфом, нейробластомы, опухолей головного мозга и др. Смысл этой процедуры заключается в том, что она позволяет проводить лечение очень высокими дозами химиопрепаратов. Такие дозы нельзя использовать при обычной химиотерапии, так как они приводят к необратимому повреждению костного мозга. Но если у больного было заранее взято достаточное количество ГСК, то можно провести высокодозную химиотерапию (ВДХТ), после чего ввести больному его собственные сохраненные клетки. Эти клетки приживаются в костном мозге и восстанавливают кроветворение. Так как используются собственные клетки, при ауто-ТГСК отсутствуют иммунные осложнения. К сожалению, ауто-ТГСК эффективна далеко не при всех болезнях.
II. При аллогенной трансплантации (аллотрансплантация, алло-ТГСК) больному вводят гемопоэтические стволовые клетки донора. Этот донор может быть совместимым родственным (например, брат или сестра больного), частично совместимым родственным (обычно кто-то из родителей) либо неродственным; в последнем случае необходима сложная процедура его подбора через регистры доноров гемопоэтических стволовых клеток.
Смысл проведения алло-ТГСК заключается в том, чтобы собственное кроветворение больного было полностью заменено донорским. В случае успеха алло-ТГСК приводит к излечению целого ряда заболеваний кроветворной системы – как врожденных, так и приобретенных. Аллогенные трансплантации широко применяются для лечения лейкозов, апластической анемии, миелодиспластических синдромов и многих наследственных заболеваний (таких как анемия Фанкони, анемия Блэкфана-Даймонда, синдром Вискотта-Олдрича, тяжелая комбинированная иммунная недостаточность и т.п.).
Трансплантации ГСК уже позволили спасти многие десятки тысяч жизней по всему миру. Однако сама процедура ТГСК связана со значительными рисками. Состояние панцитопении и низкого иммунитета в ранний период после трансплантации влечет за собой угрозу инфекций. В результате химиотерапии могут повреждаться различные органы – в частности, печень, легкие, сердце, кровеносные сосуды. Очень серьезным осложнением аллогенной трансплантации может стать острая или хроническая реакция «трансплантат против хозяина». Поэтому ТГСК проводится только в случаях жизненной необходимости, и врачи каждый раз взвешивают соотношение всех рисков и возможного положительного эффекта.
Проведение ауто-ТГСК: 1) подготовительная терапия, приводящая к снижению числа опухолевых клеток, 2) взятие ГСК из костного мозга или крови, 3) замораживание их суспензии для последующего использования, 4) ввод размороженной суспензии после кондиционирования пациента.
Проведение алло-ТГСК: 1) взятие донорских клеток, 2) при необходимости – дополнительная обработка трансплантата, 3) ввод клеток реципиенту, получившему кондиционирование.
Осложнения трансплантации гемопоэтических стволовых клеток (ТГСК) - панцитопениния
Осложнения трансплантации гемопоэтических стволовых клеток (ТГСК) - панцитопениния
В зависимости от сроков возникновения побочные эффекты подразделяются на осложнения раннего и позднего периодов после трансплантации гемопоэтических стволовых клеток.
В раннем периоде (до 100 дней после трансплантации гемопоэтических стволовых клеток) возникают мукозиты, геморрагический цистит, веноок-клюзионная болезнь печени, синдром слабости капилляров, острый гемолиз, токсическая энцефалопатия, острая РТПХ, первичное отторжение, различные инфекционные осложнения на фоне вторичного иммунодефицита.
Осложнениями позднего периода (через 100 дней и позже после трансплантации гемопоэтических стволовых клеток) могут быть интерстициальные пневмониты, инфекционные осложнения, хроническая РТПХ, аутоиммунные болезни, расстройства функции эндокринных органов и потеря фертильности, нарушение роста и формирования зубов (у детей), катаракта, пострадиационный нефрит, вторичные опухоли.
Панцитопения
Период аплазии костного мозга и периферической панцитопении после трансплантации гемопоэтических стволовых клеток имеет продолжительность 10—25 дней и зависит от вида трансплантации гемопоэтических стволовых клеток (аутологичная, аллогенная от родственного или неродственного донора), режима кондиционирования (миелоаблативный, «немиелоаблативный»), варианта и стадии болезни в момент трансплантации, степени совместимости по HLA-системе (совместимый, частично совместимый, гаплоидентичный донор), качественных и количественных характеристик трансплантата.
Скорость восстановления кроветворения определяет успех любого вида трансплантации гемопоэтических стволовых клеток и влияет на общую выживаемость. Приживление ГСК оценивают по восстановлению гранулоцитарного, тромбоцитарного и эритроидного ростков кроветворения, которое считается состоявшимся при содержании в крови гранулоцитов более 0,5 • 109/л в течение трех последовательных дней, тромбоцитов более 20 • 10 9 /л и эритроцитов более 90 г/л при условии отсутствия переливания компонентов крови.

Период аплазии костного мозга и панцитопении осложняется инфекциями, обусловленными гранулоцитопенией. После восстановления кроветворения определяющим фактором в развитии различных инфекций является выраженность лимфопении, продолжительность которой зависит от вида трансплантации гемопоэтических стволовых клеток (аллогенная, аутологичная), метода профилактики и терапии острой и хронической РТПХ, источника ГСК (родственный, неродственный донор), совместимости пары донор — реципиент по HLA-системе.
Для ускорения восстановления содержания гранулоцитов более 0,5 • 10 9 /л в крови после трансплантации гемопоэтических стволовых клеток можно назначать КСФ-Г или КСФ-ГМ (колониестимули-рующий фактор грануломоноцитарный) в средней дозе 5 мкг/кг ежедневно. Однако рекомендации о необходимости введения этих препаратов после трансплантации гемопоэтических стволовых клеток имеют неоднозначный характер.
Показано, что после алло-ТГСК применение КСФ-Г не только не влияет на общую выживаемость больных, но увеличивает вероятность развития острой РТПХ. Назначение КСФ-Г в отличие от КСФ-ГМ может повышать степень выраженности иммуносупрессии, что особенно актуально при проведении алло-трансплантации гемопоэтических стволовых клеток с Т-клеточным «истощением» и от гаплоидентичного донора.
Тромбоцитопения приводит к развитию геморрагического синдрома, коррекция которого возможна с помощью современных методов гемокомпонентной терапии.
Показания к трансфузии тромбоцитов при ауто- и алло-трансплантации гемопоэтических стволовых клеток:
— тромбоцитопения менее 10•10 9 /л при отсутствии инфекционных осложнений и проявлений геморрагического диатеза;
— тромбоцитопения 10—20•10 9 /л при наличии признаков нарушения коагуляции, инфекции с повышением температуры тела более 38 °С, локальных повреждений любого органа, тяжелого мукозита, повышенного содержания бластных клеток в костном мозге, необходимости выполнения биопсии;
— тромбоцитопения менее 50•10 9 /л при необходимости хирургического вмешательства.
Желательно, чтобы тромбоцитарный концентрат для переливания был получен путем автоматического афереза, однако возможно использование тромбоцитов, приготовленных от разных доноров. Одна терапевтическая доза должна содержать 3—6•1011 тромбоцитов. Для профилактики аллосенсибилизации показано переливание тромбоконцентратов, максимально лишенных примеси лейкоцитов (< 1•10 6 в дозе), что может быть достигнуто при использовании современных сепараторов (Spectra «Gambro» LRS, Trima), фильтрованием концентратов через специальные лейкоцитарные фильтры (Pall, Terumo, Baxter), воздействием ультрафиолетового излучения или у-лучами в дозе не менее 25 Гр.
Необходимо отметить, что дополнительным фактором, вызывающим развитие геморрагического синдрома у больных после трансплантации гемопоэтических стволовых клеток, является нарушение белково-синтетической функции печени, а вследствие этого синтеза основных факторов свертывания крови. Кроме того, повреждение целостности эндотелиальных клеток сосудов после высоко-дозной цитостатической терапии одновременно приводит к повышению прокоагулянтной и фибриноли-тической активности.
При осуществлении трансплантации гемопоэтических стволовых клеток необходимы ежедневный, а иногда и дважды в день контроль за показателями коагуляции (протромбин, фибриноген, время свертывания крови), регулярное выполнение коагу-лограммы. В случае появления признаков, свидетельствующих о наличии ДВС-синдрома, гипокоагуляции, нарушении белково-синтетической функции печени необходимо переливание свежезамороженной плазмы в адекватных количествах.
Содержание гемоглобина менее 80 г/л требует переливания эритроцитной массы, при этом реципиент, особенно после алло-трансплантации гемопоэтических стволовых клеток, получает ее с учетом фенотипа эритроцитов по индивидуальному подбору, максимально обедненную лейкоцитами.
Для профилактики посттрансфузионной РТПХ все компоненты крови перед трансфузией должны быть предварительно облучены у-лучами в дозе не менее 25 Гр. Эффективность терапии компонентами крови будет адекватной до развития признаков алло-сенсибилизации, появление которых необходимо постоянно контролировать.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Высокодозная химиотерапия и трансплантация
костного мозга в детской онкологии




Трансплантация (пересадка) гемопоэтических стволовых клеток (ТГСК) костного мозга и периферических стволовых клеток является одним из ведущих методов лечения детей, страдающих злокачественными опухолями.
Необходимо отметить следующие принципиально важные моменты, от которых зависит успех выполнения ТГСК:
• Современный уровень терапии компонентами крови (эритроцитарной массой, тромбоцитарной массой, свежезамороженной плазмой, альбумином).
• Применение высокоэффективных антибактериальных, противогрибковых и противовирусных препаратов для профилактики и лечения инфекционных осложнений.
• Медикаментозный контроль за возникновением иммунологического конфликта (между клетками донора и организмом реципиента) путем назначения иммуносупрессивной терапии в течение длительного периода времени после ТГСК.
• Адекватное парентеральное питание.
• Использование центрального (в основном подключичного) катетера для лекарственной терапии до и после ТГСК.
• Создание специальных палат, максимально приближенных к стерильным.
ВИДЫ ТРАНСПЛАНТАЦИИ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
Трансплантацией гемопоэтических стволовых клеток называется введение реципиенту (больному) взвеси гемопоэтических стволовых клеток (ГСК) после назначение ему миелоаблативных доз облучения и (или) максимально переносимых доз цитостатических (противоопухолевых) препаратов.
В зависимости от источника получения трансплантируемых клеток ТГСК подразделяется на следующие виды:
• Аллогенная трансплантация костного мозга (алло-ТКМ), при которой источником ГСК является костный мозг здорового человека (родственного или неродственного донора), полностью или частично совместимого по HLA-системе.
• Аллогенная трансплантация периферических клеток крови (алло-ТПСКК), когда в качестве источника ГСК используются периферические стволовые клетки крови здорового человека (родственного или неродственного донора), полностью или частично совместимого по HLA-системе, полученные после стимуляции костного мозга рекомбинантными факторами роста – гранулоцитарным/гранулоцитарно-макрофагальным колониестимулирующим фактором (Г-КСФ, ГМ-КСФ).
• Аутологичная трансплантация костного мозга (ауто-ТКМ), когда источником ГСК является костный мозг больного, находящегося в состоянии полной ремиссии.
• Аутологичная трансплантация периферических стволовых клеток крови (ауто-ТПСКК), при которой ГСК получены после стимуляции костного мозга Г-КСФ, ГМ-КСФ.
• Сингенная ТКМ или ТПСКК, при которой донором является однояйцевый близнец, полностью совместимый с реципиентом.
• Аллогенная трансплантация ГСК пуповинной крови.
Показания к выполнению алло-ТГСК у детей со злокачественными опухолями:
• Острый нелимфобластный лейкоз (в 1-й и последующих ремиссиях, при начинающемся рецидиве).
• Острый лимфобластный лейкоз (в 1-й ремиссии при высоком риске, во 2-й и последующих ремиссиях при стандартном риске, при начинающемся рецидиве).
• Неходжкинские лимфомы (лимфосаркомы).
Показания для проведения ауто-ТГСК у детей со злокачественными опухолями:
Злокачественные заболевания системы крови.
• Острый нелимфобластный лейкоз (в 1-й и последующих ремиссиях).
• Острый лимфобластный лейкоз (в 1-й ремиссии при высоком риске, во 2-й и последующих ремиссиях при стандартном риске).
• Болезнь (лимфома) Ходжкина (резистентные формы, состояние после рецидива).
• Неходжкинские лимфомы (резистентные формы).
• Опухоли головного мозга.
• Некоторые другие опухоли.
Абсолютными показаниями для выполнения алло-ТКМ при наличии HLA-совместимого донора костного мозга являются:
• Хронический миелолейкоз (ХМЛ).
• Острый лимфобластный лейкоз (ОЛЛ) (высокий риск).
• Острый нелимфобластный лейкоз (ОнеЛЛ) (высокий риск).
Безрецидивная выживаемость в течение 5 лет у больных ХМЛ, перенесших алло-ТКМ в хронической стадии, составляет 50-60%, ОЛЛ (высокий риск, 1-2 ремиссия) – 50-60%, ОнеЛЛ – 45-65%.
После ауто-ТКМ у детей 5-летняя безрецидивная выживаемость при экстрамедуллярном рецидиве ОЛЛ достигает 65%, а при ОнеЛЛ – 50%.
Тем не менее до настоящего времени нет однозначного времени о сроках выполнения алло-ТГСК и ауто-ТГСК у детей при ОЛЛ и ОнеЛЛ, болезни Ходжкина и неходжкинских лимфомах, поскольку результаты стандартной химиотерапии в некоторых случаях не уступают эффективности ТГСК.
Эффект цитостатической химиотерапии и лучевой терапии при злокачественных опухолях зависит от дозы назначаемых препаратов и дозы облучения. Режимом кондиционирования называется назначение миелоаблативных доз и (или) максимально переносимых доз цитостатических препаратов с целью достижения высокого уровня иммуносупрессии и по возможности полной эрадикации кроветворения (нормального и злокачественного клонов) реципиента перед введением ему ГСК костного мозга или периферической крови.
Степень иммуносупрессии определяет не только приживление аллогенного костного мозга, но вероятность реакции отторжения трансплантата после алло-ТГСК. Выбор комбинации различных цитостатиков и лучевой терапии перед ТГСК зависит от источника трансплантируемых клеток (аллогенный, аутологичный), типа и стадии заболевания )заболевания системы крови, солидные опухоли, рецидив, ремиссия).
Наиболее распространенные режимы кондиционирования
• Алло-ТКМ (заболевания системы крови):
- тотальное облучение тела (ТОТ) + циклофосфан;
- бусульфан + циклофосфан + вепезид
- бусульфан + циклофосфан + АЛГ (антилимфоцитарный глобулин).
• При ауто-ТКМ наиболее распространенными комбинациями являются:
- циклофосфан + кармустин + вепезид;
- кармустин + вепезид + цитозар + мелфалан.
Использование сверхвысоких доз цитостатиков и лучевой терапии часто приводит к развитию осложнений со стороны внутренних органов (сердца, печени, легких, почек и др.) как в ближайшие сроки после назначения высокодозной химиолучевой терапии, так и в отдаленном периоде.
ПОДБОР ДОНОРА КОСТНОГО МОЗГА (ПЕРИФЕРИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК)
Одним из основных факторов, определяющих успешность выполнения алло-ТКМ, является подбор совместимого по HLA- системе донора костного мозга (периферических стволовых клеток) Донором костного мозга может являться полностью совместимый по HLA-системе здоровый человек в возрасте до 50 лет.
В случае отсутствия полностью совместимого донора возможно использование частично совместимого донора. При выборе донора костного мозга не имеют различия по группе крови и половой хромосоме.
Подбор донора периферических стволовых клеток (ПСКК) осуществляется на основании принципов выбора донора костного мозга.
ВЗЯТИЕ КОСТНОГО МОЗГА
Забор костного мозга выполняется под общей анестезией (наркозом), хотя возможно использование перидуральной (спинномозговой) анестезией. Костный мозг получают с помощью игл с большим диаметром отверстия путем множественных пункций гребня крыла подвздошной кости с обеих сторон. Объем костного мозга, получаемы в результате этой процедуры, не должен превышать 10-15 мл/кг массы тела донора.
С целью профилактики развития острой реакции "трансплантат против хозяина" (РТПХ) возможно удаление Т-лимфоцитов с помощью моноклональных антител из аллогенного костного мозга перед его введением. Аутлогичный костный мозг может быть очищен от примеси злокачественных клеток с использованием цитостатиков.
Аутологичный костный мозг после взятия, как правило, подвергается криоконсервированию с использованием криопротектора диметилсульфоксида (ДМСО) и программного замораживания. Хранение замороженных клеток осуществляется при -196 гр.С в жидком азоте.
Процедура взятия (эксфузии) костного мозга не вызывает серьезных осложнений у 99% доноров, однако развитие осложнений может быть обусловлено влиянием наркоза или состоянием после быстрой кровопотери.
Инфузия (введение) костного мозга реципиенту при алло-ТКМ или сингенной ТКМ производится внутривенно, капельно, через 24-48 часов после окончания химио- или лучевой терапии. Введение аутологичного костного мозга проводится тем же способом, максимально быстро после его размораживания при температуре +42…+45 гр.С.
ВЗЯТИЕ ПЕРИФЕРИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК
До последнего времени основным источником ГСК при трансплантации был костный мозг (аллогенный, аутологичный).
Вместе с тем ТКМ имеет ряд недостатков:
• болевой синдром в месте забора костного мозга,
• высокая вероятность контаминации (загрязнения) опухолевыми клетками.
• кроме того, взятие костного мозга часто бывает невозможным у больных после лучевой и интенсивной химиотерапии.
В вязи с этим была предложена ТПСКК, физиологической основой которой явились данные о выходе стволовых клеток из костного мозга в кровь.
ТПСКК имеет ряд преимуществ по сравнению с ТКМ:
• при получении ПСКК нет необходимости в общей анестезии, а следовательно, существует возможность взятия ПСКК амбулаторно,
• восстановление после режима кондиционирования гранулоцитарного, тромбоцитарного и эритроидного ростков происходит быстрее в случае ТПСКК,
• при использовании ауто-ПСКК вероятность примеси злокачественных клеток в трансплантате (при ремиссии заболевания) меньше, по сравнению с аутологичным костным мозгом,
• отсутствие необходимости проведения компонентной терапии.
Мобилизация ПСКК может выполняться с помощью цитостатиков (циклофосфан, ифосфамид и др.). Однако у детей основным средством для мобилизации ПСКК являются рекомбинантные ростовые факторы (нейпоген, граноцит, лейкомакс).
Забор ПСКК проводят обычно на 4, 5, 6-й дни с начала введения колониестимулирующего фактора (КСФ). В это время наблюдается значительное повышение количества лейкоцитов периферической крови (в 4-10 раз) и ГСК.
Криоконсервация ПСКК осуществляется методом, аналогичным замораживанию костного мозга.
ОСЛОЖНЕНИЯ, СВЯЗАННЫЕ С ТРАНСПЛАНТАЦИЕЙ ГЕМОПОЭТИЧЕСКИХ СТВОЛОВЫХ КЛЕТОК У ДЕТЕЙ.
Осложнения раннего период после трансплантации (возникают в течение 100 дней после ТГСК).
1. Осложнения, связанные с назначением режима кондиционирования:
• панцитопения (снижение числа гранулоцитов, тромбоцитов и эритроцитов),
• поражение желудочно-кишечного тракта (тошнота, рвота, жидкий стул, язвы во рту и пр.),
• интерстициальный пневмонит (пульмонит) – повреждение легочной ткани при использовании тотального облучения,
• поражение сердечно-сосудистой системы,
• поражение почек и мочеполовой системы,
• кожные поражения и выпадение волос,
• нарушение водно-электролитного баланса.
2. Осложнения, связанные с инфекциями.
Развитие тяжелых иммунодефицитных состояний после ТГСК приводит к возникновению различных инфекций (бактериальных, вирусных, грибковых), возникающих почти у всех больных на том или ином этапе после ТКМ.
Для профилактики и лечения таких инфекций назначаются соответствующие препараты.
3. Острая реакция "трансплантат против хозяина".
При алло-ТКМ наиболее грозным осложнением и одной из основных причин смерти остается реакция "трансплантат против хозяина" (о.РТПХ), которая возникает в 30-60% случаев и обычно сопровождается появлением признаков приживления донорского (пересаженного) костного мозга.
При выполнении алло-ТКМ от неродственного совместимого донора костного мозга вероятность развития о.РТПХ возрастает до 80%. Острая РТПХ подразделяется на I, II, III и IV степени в зависимости от интенсивности клинических проявлений.
Существуют данные о взаимосвязи проявлений о.РТПХ с развитием в последующем рецидива злокачественного заболевания, поскольку параллельно о.РТПХ проходит так называемая реакция "трансплантат против лейкоза".
Таким образом, о.РТПХ I и II степени является желательной, т.к. ее течение либо не требует специального лечения, либо находится под контролем. Это же касается о.РТПХ III и IV степени, но ее появление крайне опасно, так как терапия этого состояния нередко бывает безуспешной (при о.РТПХ III и IV степени смертность достигает 80-100%).
Клиническими проявлениями о.РТПХ являются:
• поражение кожи в виде сыпи, в более тяжелых случаях – разрушение верхнего слоя кожи с образованием волдырей;
• нарушение функции желудочно-кишечного тракта (тошнота, рвота, жидкий стул, боли в животе);
• поражение печени (желтуха).
Для профилактики о.РТПХ используются циклоспорин или сочетание его с другими имунодепрссантами (метотрексат, гормоны, антилимфоцитарный глобулин - АТГ, иммуран), а также удаление Т-лимфоцитов из пересаживаемых клеток костного мозга.
Лечение о.РТПХ проводится большими дозами гормонов, возможно применение моноклональных антител.
4. Реакция отторжения (неприживления) донорских гемопоэтических стволовых клеток
Реакция отторжения (неприживления) донорских гемопоэтических стволовых клеток сопровождается развитием панцитопении и аплазии (снижение количества всех клеток крови и костного мозга) и возникает у 1-3% больных после алло-ТГСК.
Вероятность ее значительно возрастет (до 20%) у больных с анемией, после множественных переливаний крови, а также у получивших донорский костный мозг от частично совместимого донора или после удаления Т-лимфоцитов.
Мерами профилактики развития реакции отторжения являются проведение режима кондиционирования в полных дозах, а также назначение иимунодепрессантов в течение длительного периода времени после алло-ТГСК. При подозрении на отторжение трансплантата необходимо применение ростовых факторов (Г-КСФ, ГМ-КСФ, эритропоэтин).
5. Веноокклюзивная болезнь печени (ВОБ).
Тяжелое осложнение, возникающее у 10-60% больных после ТГСК. Заболевание обусловлено повреждением клеток печени высокими дозами цитостатических препаратов. Клинически ВОБ характеризуется желтухой, быстрым увеличением размеров печени, прибавкой веса, асцитом (скоплением жидкости в животе) и болями в брюшной полости.
При тяжелом течении ВОБ развиваются почечная недостаточность, снижение количества тромбоцитов, энцефалопатия (повреждение головного мозга). Первые признаки ВОБ могут появиться на 10-14 день после ТГСК.
Лечение ВОБ сложное и включает комплекс мероприятий, направленных на подержание вводно-электролитного баланса, мочегонных средств. При развитии почечной недостаточности показан гемодиализ (очищение крови с помощью аппарата искусственной почки).
В качестве мер профилактики развития ВОБ используют гепарин и простагландин Е.
Осложнения позднего периода после трансплантации (возникают позднее 100 дней после ТГСК).
1. Хроническая реакция" трансплантат против хозяина" (хр.РТПХ) наблюдается в 30% и более случаев после алло-ТКМ от HLA-совместимого донора костного мозга и может возникнуть как самостоятельно, так и быть продолжением в течении о.РТПХ.
Клиническими проявлениями хр.РТПХ являются склеротические изменения кожи, депигментация или гиперпигментация кожи, выпадение волос, поражение желудочно-кишечного тракта, легких, печени, суставов, мышц, глаз, атрофия лимфоидных органов.
Хроническая РТПХ подразделяется на ограниченную и распространенную в зависимости от степени вовлечения в процесс кожи и печени. Лечение хр.РТПХ проводится циклоспорином и гормонами. Возможно также сочетание с другими иммунодепрессантами (иммуран).
2. Задержка роста является особенностью течения посттрансплантационного периода у детей. Наиболее часто это осложнение встречается при включении в режим кондиционирования тотального облучения тела (ТОТ) и связано с влиянием больших доз облучения на выработку гормона роста (ГР).
Дефицит (нехватка) ГР наблюдается у 90% детей, подвегшихся облучению головы в момент режима кондиционирования и получавших эту терапию на этапе до ТГСК, а также у 40% детей. получавших облучение только в момент ТГСК.
3. Нарушение функции репродуктивных (воспроизводительных) органов и щитовидной железы. Изменение функции репродуктивных органов связано с непосредственным влиянием высокодозной химиотерапии и лучевой терапии. Менее чем у 10% женщин восстанавливается функция яичников в течение 3-7 лет после ТГСК. Сперматогенез (образование спермы) полностью отсутствует после проведения лучевой терапии, однако в течение длительного периода времени возможно его восстановление.
Нарушение функции щитовидной железы возможно у 40% больных после ТГСК и чаще всего развивается у детей с болезнью Ходжкина (лимфогранулематозом), получавших облучение шеи.
4. Поражение глаз наиболее часто сопутствует развитию хр. РТПХ. Возникновение катаракты является осложнением высокодозной лучевой терапии и выявляется у 20% больных, имевших в режиме кондиционирования ТОТ.
5. Возникновение второй злокачественной опухоли. У больных после ТГСК увеличен риск возникновения второй опухоли (лимфома, лейкоз, опухоль головного мозга, меланома, рак печени, остеогенная саркома, рак щитовидной железы), что связано с применением химиотерапии, облучения и иммунодепрессантов.
Вероятность развития второй опухоли больше у пациентов, возраст которых был менее 30 лет на момент ТГСК и увеличивается параллельно длительности жизни после ТГСК.
Рецидивы (возврат) основного заболевания являются нередкой причиной смерти после ТГСК.
В связи с этим все большее внимание уделяется использованию иммунотерапии (интерлейкин-2, интерфероны и пр.) после трансплантации, особенно после проведения ауто-ТГСК.
Трансплантация костного мозга и стволовых клеток
Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
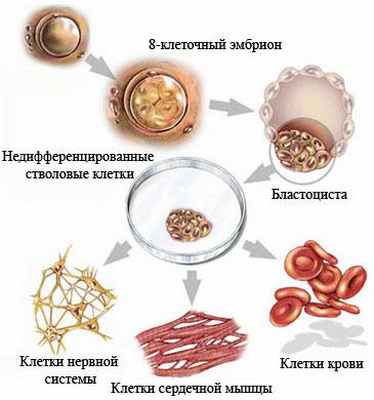
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
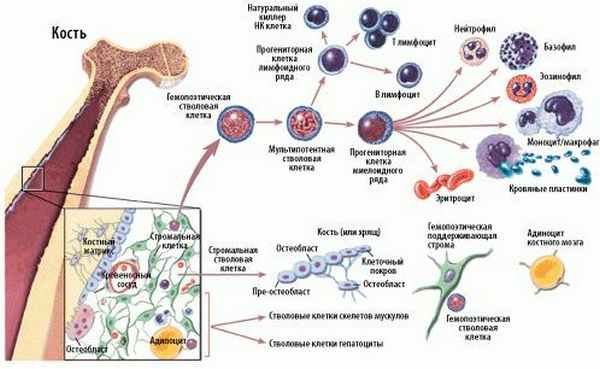
Схема кроветворения и дифференцировки стволовых клеток
 Колонии стволовых кроветворных клеток (электронная микроскопия) | 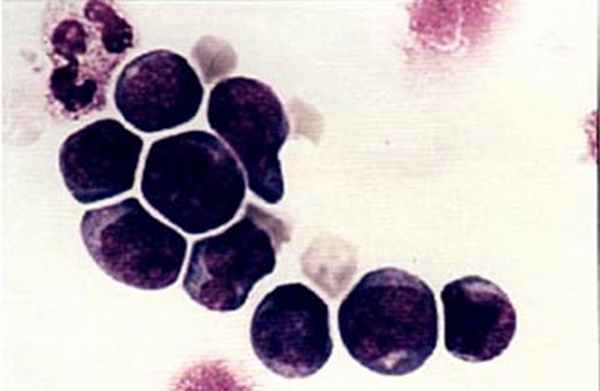 Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты. |
ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
Сепаратор клеток крови
Еще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
 А) |  Б) |
Б) извлеченный из сосуда контейнер с костным мозгом
Инфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.

Инфузия костного мозга пациенту
ИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Читайте также:
