Осложнения трансплантации поджелудочной железы. Ранние и поздние
Добавил пользователь Владимир З. Обновлено: 23.01.2026
Трансплантация поджелудочной железы обычно рассматривается только для небольшого числа больных с диабетом 1 типа, который возникает, когда иммунная система разрушает клетки поджелудочной железы, производящие гормон инсулин. Часто это заболевание можно контролировать с помощью инъекций инсулина, поэтому риски операции поджелудочной железы во многих случаях перевешивают преимущества.
Трансплантация поджелудочной железы обычно рассматривается только для небольшого числа больных с диабетом 1 типа, который возникает, когда иммунная система разрушает клетки поджелудочной железы, производящие гормон инсулин. Часто это заболевание можно контролировать с помощью инъекций инсулина, поэтому риски операции поджелудочной железы во многих случаях перевешивают преимущества. Пересадку донорского органа обычно могут рассмотреть, если:
- есть тяжелое заболевание почек, независимо от того, вызвано ли оно диабетом или нет - в этих случаях трансплантация поджелудочной железы может проводиться одновременно с трансплантацией почки
- бывают тяжелые эпизоды опасно низкого уровня сахара в крови, которые случаются без предупреждения, несмотря на хороший контроль инсулина.
Когда больному пересаживается здоровая поджелудочная железа, она должна немедленно начать вырабатывать инсулин, облегчая симптомы диабета и заменяя лечение инъекциями инсулина.
Как правильно подготовиться к пересадке поджелудочной железы
В центре трансплантации пациент пройдет подробный осмотр, чтобы узнать о состоянии здоровья и проверить, есть ли какие-либо основные проблемы, которые могут повлиять на пригодность больного для трансплантации поджелудочной железы. Обычно диагностика включает в себя следующие тесты:
- проверка артериального давления и частоты сердечных сокращений
- анализы мочи и крови ( хокардиограмма)
- тесты для измерения электрической активности сердца (электрокардиограмма)
Как проходит процедура пересадки поджелудочной железы
Трансплантация поджелудочной железы проводится под общим наркозом. Во время процедуры:
- На животе сделают разрез чуть ниже грудины до пупка.
- Донорская поджелудочная железа обычно располагается в правой части живота и связана с кровеносными сосудами, по которым кровь спускается к ноге.
- Небольшая часть тонкой кишки донора будет прикреплена либо к тонкой кишке, либо к мочевому пузырю, чтобы пищеварительный сок мог стекать из поджелудочной железы донора.
- Если проводить комбинированная трансплантация поджелудочной железы и почки, почка будет размещена внизу на левой стороне брюшной полости.
- Старая поджелудочная железа не будет удалена, поскольку она будет продолжать вырабатывать пищеварительный сок, в то время как донорская поджелудочная железа вырабатывает инсулин.
Операция по пересадке поджелудочной железы может занять от 4 до 5 часов. Если одновременно потребуется пересадка почки, операция длится от 6 до 8 часов. Новая поджелудочная железа должна сразу же начать вырабатывать инсулин.
Трансплантация островков
У небольшого числа людей с диабетом 1 типа могут провести другую процедуру пересадки, при которой только клетки, вырабатывающие инсулин (островковые клетки), трансплантируются из донорской органа в печень. Это называется операцией по трансплантации островков и обычно проводится под местной анестезией. В ходе манипуляции катетер вводится через живот и печень в вену, снабжающую печень кровью. Затем в него вводят донорские островковые клетки. Если операция прошла успешно, донорские клетки начнут вырабатывать инсулин. После трансплантации островков часто все еще требуется лечение инсулином, но эпизоды низкого уровня сахара в крови легче контролировать.
После операции по пересадке
Обычно после трансплантации поджелудочной железы больному необходимо оставаться в больнице в течение 2–3 недель. После выписки из больницы пациент будет приглашаться на регулярные контрольные встречи, чтобы следить за состоянием донорского органа. Во время посещений необходимо будет делать анализы крови и мочи и УЗИ брюшной полости, чтобы проверить, насколько хорошо работает новая и старая поджелудочная железа, а также исключить наличие каких-либо осложнений после пересадки поджелудочной железы.
Сразу после операции начнется лечение иммунодепрессантами. Без этих препаратов организм может распознать орган как чужеродный и атаковать его. Иммунодепрессанты - это сильнодействующие вещества, которое могут иметь ряд серьезных побочных эффектов, таких как повышенная вероятность заражения инфекциями. Хотя побочные эффекты могут вызывать беспокойство и дискомфорт, пациент никогда не должны прекращать прием иммунодепрессантов без консультации с врачом, иначе возникнет угроза отторжения донорского органа.
Возвращение к нормальной жизни
После трансплантации поджелудочной железы пациент сможет вернуться к своей обычной деятельности, хотя это может занять некоторое время. Понадобится несколько месяцев восстановления после операции:
- Швы нужно будет снять примерно через 3 недели.
- После пересадки больному, как правило, больше не нужно принимать инсулин, ограничивать диету и регулярно измерять уровень сахара в крови.
- Пациент может начинать делать легкие упражнения с 6 недель, если чувствует себя в хорошей форме.
- Более активные занятия, такие как контактные виды спорта, могут быть не рекомендованы, по крайней мере, в течение года, поскольку они могут повредить донорскую поджелудочную железу.
Осложнения
Пересадка поджелудочной железы - серьезная медицинская операция, и как и при любом хирургическом вмешательстве существует риски осложнений. Некоторые из них могут возникнуть вскоре после операции, другие - спустя месяцы или даже годы. Одним из наиболее частых осложнений трансплантации поджелудочной железы является отторжение донорского органа, когда иммунная система распознает пересаженную поджелудочную железу как чужеродную и атакует ее. Отторжение обычно происходит через несколько дней, недель или месяцев после операции по пересадке, хотя иногда это может произойти и спустя годы. Иммунодепрессанты могут снизить риск отказа. Симптомы отторжения включают:
- боль и опухоль в животе
- высокая температура
- озноб
- крайняя усталость
- опухшие лодыжки
- одышка.
При быстром обращении к врачу отторжение поджелудочной железы можно остановить, увеличив дозу иммунодепрессанта.
Иммунодепрессанты, которые необходимо принимать для предотвращения отторжения, могут иметь ряд серьезных побочных эффектов.Они могут включать:
- повышенный риск заражения инфекциями
- дрожащие руки
- трудности со сном
- повышенное артериальное давление
- выпадение или истончение волос
- перепады настроения
- увеличение веса
- расстройство желудка
- сыпь
- ослабленные кости (остеопороз)
- повышенный риск некоторых видов рака, особенно рака кожи.
Иммунодепрессанты ослабят иммунную систему и увеличат вероятность заражения, поэтому во время приема лекарства рекомендуется:
- немедленно сообщать лечащему врачу о любых возможных симптомах инфекции
- делать все прививки
- избегать тесного контакта с кем-либо, у кого есть инфекция, даже если это инфекция, к которой ранее был иммунитет, например, ветряная оспа.
Чтобы предотвратить распространение инфекции, пациенту могут назначить антибиотики, противогрибковые или противовирусные препараты в течение первых нескольких недель или месяцев после трансплантации.
Иногда в кровеносных сосудах, снабжающих новую поджелудочную железу, могут образовываться сгустки крови (тромбы). Риск тромбоэмболии наиболее высок в первые дни после операции, поэтому в больнице за пациентом будут внимательно наблюдать, чтобы проверить наличие каких-либо признаков тромбоза. Если в новой поджелудочной железе образовался тромб, как правило, потребуется еще одна операция по его удалению. Сгустки крови также могут образовываться в других кровеносных сосудах после операции, например, в ногах (тромбоз глубоких вен) или кровоснабжающих легких (тромбоэмболия легочной артерии), но прием разжижающих кровь лекарств должен помочь предотвратить это осложнение.
Панкреатит - это отек поджелудочной железы, который часто возникает в первые несколько дней после операции по пересадке. Это может произойти в результате хранения донорской поджелудочной железы на льду при подготовке к трансплантации. Симптомы панкреатита включают:
- тупая боль в животе
- плохое самочувствие
- рвота.
Панкреатит должен пройти в течение нескольких дней. Но иногда пациенту может потребоваться установка зондов в брюшной полости для отвода лишней жидкости из поджелудочной железы.
Осложнения трансплантации поджелудочной железы. Ранние и поздние
Наиболее серьезное осложнение раннего послеоперационного периода — сосудистые тромбозы пересаженной поджелудочной железы. До 20% трансплантатэктомий производится вследствие тромбоза сосудов.
Одна из возможных причин тромбоза — нарушение гемодинамики в трансплантате поджелудочной железы.
Реваскуляризация артерий достигается наложением анастомозов на крупные артериальные стволы. Поскольку после этого отток крови из крупных артерий происходит через мелкие сосуды поджелудочной железы, он замедляется.
Другой провоцирующий фактор — послеоперационный панкреатит.
На частоту тромбозов влияет также вариант артериальной реконструкции: Y-тип ассоциирован с наиболее низкой частотой осложнений. При правосторонней локализации трансплантата поджелудочной железы в брюшной полости тромбозы отмечаются значительно реже, чем при левосторонней или срединной трансплантации.
Начало тромбообразования может быть артериальным или венозным, но позже в процесс вовлекается все сосудистое русло трансплантата.
Для артериального тромбоза характерно резкое повышение уровня гликемии и падение содержания амилазы в сыворотке. При наличии катетера, дренирующего панкреатический проток, наблюдается внезапное прекращение выделения панкреатического сока. При дренировании в мочевой пузырь можно отследить резкое снижение уровня амилазы в моче.
Характерно, что больной не испытывает болей или неприятных ощущений в области трансплантата.
При венозном тромбозе уровень сахара в крови повышается, но не так резко, как при артериальном. Кроме того, уровень амилазы в сыворотке крови обычно увеличивается.
Выделение панкреатического сока по дренажному катетеру происходит медленно, с примесью крови в секрете. Типично появление или усиление болевых ощущений в области пересаженной поджелудочной железы.
В диагностике тромботических осложнений определенную помощь могут оказать допплеросонография и ЯМР, подтверждающие снижение кровотока в питающих трансплантат сосудах, а в ряде случаев — ангиография.
При возникновении сосудистого тромбоза в раннем послеоперационном периоде трансплантат подлежит удалению, в то время как ПДК с артериальным тромбозом, развившимся в поздний период, оставляют до появления местных симптомов.
Профилактика послеоперационного тромбообразования в сосудистом русле трансплантированной поджелудочной железы обычно сводится к адекватной антикоагуляционной терапии. При этом, однако, следует отметить, что снижение частоты тромбозов у больных напрямую связано с учащением случаев кровотечения. Поэтому большинство специалистов придерживается мнения, что антикоагулянтная терапия не показана, если реципиент не имеет документированного гиперкоагуляционного состояния.
Большинство осложнений, наблюдающихся после трансплантации поджелудочной железы, представляют собой хорошо известные панкреатические патофизиологические состояния. К их числу относятся панкреатит, перипанкреатический выпот, просачивание экзогенного секрета через швы анастомоза, образование панкреатических фистул и формирование пери- и внутрипанкреатических абсцессов. При этих состояниях весьма обычны и характерны раневые инфекции.
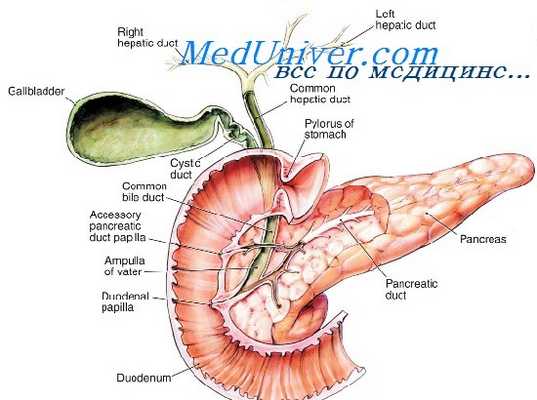
В первые сутки после трансплантации поджелудочной железы практически у всех больных наблюдаются симптомы и признаки панкреатита различной степени тяжести. Этот ранний послеоперационный панкреатит, по всей видимости, следствие ишемического повреждения органа на всех этапах трансплантационного процесса: в организме донора в период его кондиционирования, при изъятии ПДК, его консервации, пересадке и реваскуляризации.
Осложнение чаще развивается в первые 1—2 недели послеоперационного периода и характеризуется болевым синдромом в области трансплантата различной степени выраженности, болезненностью в зоне пересаженной поджелудочной железы, фебрильной гипертермией и повышением уровня амилазы сыворотки крови.
Гиперамилаземия служит ведущим признаком посттрансплантационного панкреатита. Болевой синдром в ряде случаев может отсутствовать или быть незначительным.
Чем длиннее период консервации, тем выше риск послеоперационного панкреатита. Однако тяжелый панкреатит, вплоть до панкреонекроза, может возникнуть и на фоне короткого периода холодовой ишемии.
При этом осложнении происходит также просачивание через капсулу серозной жидкости с высоким содержанием амилазы и других панкреатических ферментов, приводящее к накоплению выпота вокруг трансплантата. Этот процесс, как правило, прекращается спустя несколько дней после операции, но может продолжаться 1—2 недели. Опасность скопления перипанкреатического выпота можно уменьшить, если произвести дренирование области операции.
Лечение посттрансплантационного панкреатита аналогично лечению обычного: голодание и заместительная терапия.
При клинической картине перипанкреатического выпота и панкреонекроза следует произвести релапаротомию с удалением скопившейся перипанкреати-ческой жидкости, при необходимости выполнить некрэктомию на поверхности органа. Далее — перитонеальный диализ в течение нескольких дней.
В случаях очень тяжелого панкреонекроза трансплантат целесообразно удалить.
Иногда при перипанкреатическом выпоте, если нет необходимости в релапаротомии, можно выполнить чрезкожную пункцию, дренирование скопления жидкости и добиться излечения с использованием антибиотиков широкого спектра действия.
Эндокринная функция поджелудочной железы, как правило, не нарушается даже после тяжелых приступов послеоперационного панкреатита.
При трансплантации поджелудочной железы с дренированием внешнего секрета в просвет кишечника или мочевыводящих путей возможно подтекание панкреатического сока через анастомоз. Энзиматическое просачивание может произойти в результате возникновения реперфузионного отека и ишемии донорской двенадцатиперстной кишки или технических погрешностей при наложении соустья. Также фактором развития просачивания является иммуносупрессивная терапия.
В раннем послеоперационном периоде (первые 4 недели) подтекание происходит главным образом через зону дуоденоеюно- или дуоденоцистоанастомоза, позже — вследствие развития недостаточности культей двенадцатиперстной кишки. Исходом подтекания секрета являются формирование поверхностной панкреатической фистулы, перитонит, внутрибрюшное абсцедирование или сепсис.
Формирование поверхностной панкреатической фистулы отмечается, как правило, в первые 2 недели после операции. Характерно выделение неокрашенной жидкости с высоким содержанием амилазы, покраснение кожи вокруг фистулы, обусловленное действием пищеварительных ферментов. Нередко фистула сопровождается формированием перипанкреатических абсцессов, диагностика которых затруднена, так как отторжение трансплантата и непроходимость кишечника могут давать сходную симптоматику.
Своевременная диагностика помогает снизить заболеваемость и избежать последующей утраты функции железы.
Как правило, клиническая симптоматика проявляется на 2—6 неделе болью «неясного» происхождения в животе в области пересаженной ПЖ, субфебрильной температурой, лейкоцитозом. Эндокринная функция трансплантата не нарушается.
У пациентов с пузырным вариантом дренирования и мочевым катетером симптоматика может быть стертой. При диагностическом томографическом сканировании с контрастированием мочевого пузыря у этой группы больных можно выявить просачивание контраста в брюшную полость или малый таз.
Тем не менее у многих пациентов окончательный диагноз не может быть установлен до операции.
При подозрении на перитонит или формирование внутрибрюшинного абсцесса показано срочное оперативное вмешательство.
При небольшом просачивании пузырного анастомоза место подтекания может быть ушито, при обильном — выполнена операция кишечного дренирования с восстановлением целостности мочевого пузыря.
Просачивание панкреатического секрета у пациентов с кишечным дренированием — более сложная задача. Может потребоваться наложение нового межкишечного соустья на участке кишки, выключенном по Roux.
Возможность устранения анастомотического подтекания панкреатического сока и успешной эвакуации скопившейся жидкости значительно возрастает при своевременном выполнении операции.
У ряда больных через несколько недель после АТПДК (чаще через 6—10) развиваются внутрипанкреатические абсцессы. Клинические признаки: высокая температура, боли в области трансплантата и прогрессивное ухудшение показателей углеводного обмена. Уровень сывороточной амилазы при этом значительно не изменяется.
К развитию внутрипанкреатических абсцессов приводит, как правило, подострое или хроническое отторжение трансплантата, а также первичная цитомегаловирусная инфекция. При развитии внутрипанкреатического абсцесса трансплантат подлежит удалению.
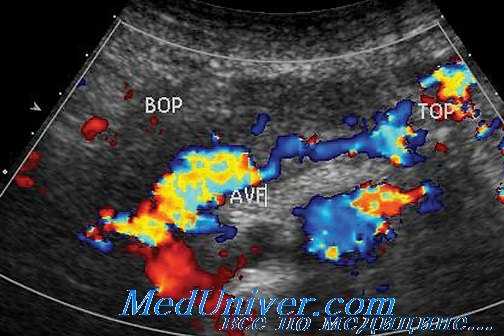
Как при любой условно-стерильной хирургической процедуре, при проведении АТПЖ имеется риск раневой инфекции. Пациенты после пересадки более предрасположены к инфекционным осложнениям вследствие иммуносупрессивной терапии и применения глюкокортикоидов. Частота развития раневой инфекции колеблется в пределах 8—10%.
Примечательно, что почти 80% реципиентов, посттрансплантационный период которых осложнился инфицированием раны, ранее получали лечение перитонеальным диализом.
Отмечается, что раневая инфекция развивается реже при включении кишечника реципиента в предоперационную подготовку, орошении просвета мочевого пузыря и дуоденального сегмента трансплантационного комплекса антибиотиками с противогрибковыми агентами, профилактической предоперационной антибактериальной терапии.
На частоту поверхностных раневых инфекций также влияет ишемизация краев раны при чрезмерном сдавлении швами или скрепками. Для этой категории больных характерна замедленная грануляция раны.
Лимфоцеле — достаточно редкое осложнение полостных процедур вследствие выраженных реабсорбционных свойств париетальной брюшины. Диагноз подтверждается с помощью УЗИ или томографии. Несмотря на то что зачастую выполнимо чрезкожное дренирование образования, для полноценного удаления лимфы и лигирования лимфатических протоков обычно необходимо оперативное вмешательство.
Поджелудочная дуоденоцистостома, как уже отмечалось выше, удобна для оценки функции трансплантата, так как позволяет контролировать амилазу мочи и допускает цистоскопию с биопсией стенки двенадцатиперстной кишки. Кроме того, отведение экзогенного секрета поджелудочной железы в мочевой пузырь исключает его обратное всасывание, что меньше иммунокомпрометирует реципиента. Но несмотря на свою популярность, пузырное дренирование при пересадке поджелудочной железы ассоциируется с многочисленными урологическими осложнениями, такими как уретрит, стеноз уретры, гематурия, мочевые инфекции.
Этиологические факторы инфекции мочевыводящих путей после дуоденоцистостомии: бактериальная флора двенадцатиперстной кишки, пролонгированная катетеризация и неполное опорожнение мочевого пузыря, ощелачивание мочи вследствие экзогенной секреции поджелудочной железы, внутрипузырное камнеобразование на шовном материале анастомоза, хотя последнее осложнение и сводится к минимуму использованием абсорбируемого шовного материала. Более половины пациентов с этим вариантом АТПДК страдают инфекциями мочевыводящих путей. Обычно при этом осложнении антибактериальная терапия весьма эффективна. Стационарное лечение необходимо при явлениях уро-сепсиса. Реконструктивное кишечное дренирование показано больным с повторными мочевыми инфекциями, резистентными к консервативной терапии.
Действие поджелудочных ферментов на слизистую оболочку уретры может привести к уретриту, стриктуре уретры и даже к уретральному свищу. Эти осложнения наблюдаются почти исключительно у мужчин и клинически проявляются дизурией, устойчивой к антибактериальной терапии. В таких случаях часто бывает достаточно провести катетеризацию уретры или наложить эпицистостому на несколько недель. До катетеризации уретры необходимо выполнить ретроградную уроцистографию для исключения повреждений на протяжении. Стеноз уретры является показанием к выполнению пластики мочеиспускательного канала. Если проведенное лечение неэффективно, следует решить вопрос о наложении кишечного дренажа.
Незначительная гематурия в первые сутки после операции — результат обработки пузыря и стенки двенадцатиперстной кишки и не требует специфической терапии, хотя выраженная гематурия может вызывать тромбоз мочевого катетера.
Хронические формы гематурии после трансплантации поджелудочной железы должны быть оценены цистоскопией.
Частыми причинами длительной гематурии бывают язвы двенадцатиперстной кишки и вторичные цитомегаловирусные язвы. Если консервативные методы остановки кровотечения оказываются неэффективными, показана реконструктивная операция, завершающаяся кишечным дренированием.
Характерным осложнением для АТПДК с отведением панкреатического сока в кишечник реципиента бывают эпизоды внутрикишечного кровотечения, обычно из сосудов межкишечного соустья. В большинстве случаев достаточна консервативная коррекция параметров коагулограммы. Для профилактики этого осложнения необходимо ограничивать размеры анастомоза и выполнять электрокоагуляцию краев кишки.
Реакция отторжения поджелудочной железы остается сложнейшей проблемой посттрансплантационного периода. По данным международного регистра трансплантаций поджелудочной железы, 32% случаев ухудшения функции и 3—7% случаев потери пересаженной поджелудочной железы в течение первого года обусловлены отторжением трансплантата.
Резистентны к стероидной пульс-терапии около 20% острых кризов отторжения пересаженной железы.
При реакции отторжения у больных, перенесших SKPT, признаки нарушения почечной функции (увеличение уровня креатинина и др.) обычно на несколько дней опережают появление симптомов нарушения функции поджелудочной железы.
Признаки отторжения ПДК могут и не появиться. Это можно объяснить, по видимому, либо меньшей предрасположенностью пересаженной поджелудочной железы к отторжению, либо более низкой чувствительностью параметров диагностики отторжения ТПЖ в сравнении с почечными. Можно также предположить, что превентивная терапия, применяемая для профилактики отторжения почки, оказывается эффективной и в отношении поджелудочной железы, что смазывает признаки ее отторжения. Между тем известны случаи отторжения трансплантата поджелудочной железы при хорошем приживлении одновременно пересаженной почки.
При трансплантации РАК и РТА диагноз отторжения ставится на основании критериев, отражающих состояние трансплантата поджелудочной железы. Выяснено, что повышение уровня сахара в крови служит поздним признаком отторжения: он проявляется тогда, когда почти 90% трансплантата поджелудочной железы уже разрушено. Кроме того, гипергликемия может быть обусловлена гетеротопической позицией трансплантата, нарушением иннервации органа, токсичностью СуА и другими причинами.
Более чувствительным маркером нарушения эндокринной функции служит С-пептид, однако определение его уровня занимает много времени и, как правило, не выполняется ежедневно.
В последнее время весьма перспективными маркерами считают параметры экзокринной функции, и интерес к их мониторингу после операции в большинстве центров особенно высок. Наиболее часто исследуемым маркером острого отторжения трансплантата поджелудочной железы служит уровень амилазы панкреатического сока. При операциях по BD-типу о содержании амилазы в экзогенном секрете можно судить по ее уровню в моче. Некоторые исследователи предпочитают в качестве диагностического критерия использовать для определения амилазы мочу, собранную в течение 12-ти часов, чтобы исключить влияние суточных колебаний темпа диуреза.
Ежедневное наблюдение за уровнем амилазы обеспечивается также выведением панкреатического сока на поверхность тела через катетер, при этом становится возможным цитологическое исследование секрета.
В первые дни после трансплантации панкреатический сок содержит большое количество гранулоцитов, что свидетельствует, по всей видимости, о явлениях ишемического панкреатита. Впоследствии эти клетки в соке пропадают. С началом отторжения в секрете появляются воспалительные клетки: сначала моноциты, а через 1—2 дня — лимфоциты и лимфобласты. После успешно проведенного лечения лимфобласты исчезают, и в соке не остается воспалительных клеток. Установлено, что этот признак на сутки-двое опережает падение уровня амилазы. Таким образом, цитология панкреатического сока, возможно, еще более чувствительный и специфичный маркер реакции отторжения трансплантата поджелудочной железы, чем уровень амилазы.
Для определения острого отторжения полезными могут оказаться и некоторые инструментальные методы диагностики: радионуклидная сцинтиграфия, ангиография, ультразвуковая допплероскопия, ядерно-магнитный резонанс и компьютерная томография. Для верификации и определения типа отторжения требуется микроскопическое исследование трансплантата. Биопсия может быть проведена чрезкожно, под контролем УЗИ, компьютерной томографии или ЯМР.
При дренировании экзокринного секрета в мочевой пузырь может использоваться цистодуоденоскопия с прицельной биопсией головки трансплантата. Результатом гистологического исследования может быть отсутствие патологических изменений, неспецифические воспалительные явления и характерные признаки отторжения, на основании которых определяется вид отторжения по классификации Banff и определяется лечебная тактика. При наличии отторжения в биоптате трансплантата поджелудочной железы чаще всего присутствует картина диффузной инфильтрации одноядерных клеток паренхимы, острого или хронического васкулита, ацинарного или лобулярного некроза. Несмотря на диагностическую ценность исследования, возможность его проведения имеется не всегда из-за угрозы хирургических осложнений.
Постоянное совершенствование хирургической техники, появление прогрессивных способов консервации органов, разработка новых протоколов им-муносупрессивной терапии с учетом последних достижений фармакологии в последнее десятилетие обусловили стремительное увеличение количества АТПДК в мире. Успешная пересадка поджелудочной железы каждый год позволяет радикально улучшать качество жизни все большему числу пациентов, а результаты операции не уступают таковым при трансплантации других солидных органов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Иммуносупрессия после трансплантации поджелудочной железы. Принципы
Большое значение в успешном исходе трансплантации поджелудочной железы приобретают послеоперационная терапия и мониторинг, в частности, профилактика инфекции и тромбоза, а также оценка состояния пересаженного панкреатодуоденального комплекса. Большинство хирургов во время операции и в течение 2—5 последующих суток в целях профилактики системно применяют антибиотики широкого спектра действия. Кроме того, используется весь арсенал антикоагуляционных и дезагреационных препаратов для снижения риска образования сосудистых тромбозов. Рекомендуются внутривенные инфузии реополиглюкина или его аналогов в течение нескольких дней с последующим приемом дезагрегантов. Для оценки внешнесекреторной деятельности ТПЖ систематически контролируется содержание глюкозы и уровень амилазы в сыворотке крови. Во многих клиниках используется динамическое измерение уровня С-пептида для оценки выработки инсулина трансплантатом.
Если трансплантация выполнена по BD-технологии, экскрецию амилазы определяют по ее уровню в моче. Если панкреатический сок в раннем периоде после ED-операции временно дренируется с помощью катетера наружу, содержание амилазы и воспалительных клеток измеряют непосредственно в пробах экзогенного секрета.
При дренированной брюшной полости следует ежедневно измерять активность амилазы в выделениях, поскольку к повышению уровня амилазы может привести просачивание панкреатического сока через швы в области дуоденоеюнального анастомоза.
Как правило, спустя несколько часов после реваскуляризации трансплантата достигается состояние эугликемии, и инсулинотерапия может быть прекращена. Однако иногда в первые дни и даже недели гипергликемия сохраняется, что требует применения экзогенного инсулина. Такая реакция может быть вызвана ишемическим повреждением трансплантата и отягощена внутривенными инфузиями глюкозы в раннем послеоперационном периоде.
Необходимость угнетения экзокринной функции ТПЖ также требует применения дополнительных лекарственных препаратов. Для этого используют системное или эндолимфатическое введение реципиенту ингибиторов протеолитических ферментов, что позволяет нормализовать уровень альфа-амилазы у большинства больных.
Иммуносупрессивная терапия в целом аналогична использующейся при изолированной трансплантации почек. Для индукционной иммуносупрессии широко используются антилимфоцитарные антитела. Обычно антитела назначаются внутривенно, во время или сразу по окончании оперативного вмешательства, что позволяет отсрочить использование потенциально нефротоксичных иммуносупрессантов. Как правило, курс индукционной иммуносупрессии антилимфоцитарными препаратами продолжается 5—14 дней. Первое введение антител нередко сопровождается явлениями лихорадки, озноба, тахикардии, желудочно-кишечных расстройств, бронхоспазма или нестабильностью системной гемодинамики.

Относительно недавно получили широкое распространение новые моноклональные антитела пролонгированного действия: даклизумаб (Zenapax) и базиликсимаб (Simulect), напрямую ингибирующие рецепторы к интерлейкину-2.
До середины 1990-х гг.основным препаратом, применявшимся практически у всех реципиентов поджелудочной железы наряду с антиметаболитами и гормонами, был циклоспорин. Однако все больше специалистов, начиная с 1994 г, при выборе препарата, ингибирующего кальциневрин, отдают предпочтение такролимусу (FK-506, Tacrolimus, Prograf). Это высокоспецифичный иммуносупрессант, обратимо ингибирующий кальциневрин Т-лимфоцитов, в результате чего прерывается транскрипция интерлейкина-2 в ядре клетки и предотвращается Т-клеточная активация. Кроме надежного иммуносупрессивного эффекта, препарат снижает необходимость в глюкокортикоидах, что позволяет через некоторое время полностью прекратить стероидную терапию. Кроме того, у препарата меньший в сравнении с циклоспорином нефротоксический эффект.
Основной недостаток препарата — его диабетогенность. Однако в результате постепенного снижения дозировки более чем у 80% больных, страдающих посттрансплантационным сахарным диабетом (ПТСД), удается добиться регресса нарушений углеводного обмена.
Достоинства Prograf (лучший иммуносупрессивный профиль и антиаутоиммунные свойства), по мнению большинства специалистов, превосходят его недостатки. Концентрации такролимуса в крови на уровне 8—15 нг/мл (адекватная иммуносупрессия) значительно снижает частоту развития ПТСД, особенно после отмены стероидной терапии.
В отличие от антиметаболита азатиоприна микофенолат мофетил (MMF, Cellcept, Mysept) и микофеноловая кислота (Майфортик) более сильные и специфичные иммуносупрессивные агенты и чаще используются при лечении реакций отторжения. Их применение уменьшает частоту и выраженность отторжения почечного трансплантата при SKPT по результатам пункционных биопсий, а также частоту гормонорезистентных кризов. Частота обнаружения бактериальных, вирусных и грибковых инфекций при применении препаратов микофеноловой кислоты не превышает таковые при использовании азатиоприна. Несмотря на гастроинтестинальную и миелотоксичность, в схемах иммуносупрессии после трансплантации поджелудочной железы в настоящее время они получили повсеместное распространение.
После пересадки поджелудочной железы проведение постоянной стероидной терапии сопровождается гипертензией, гиперхолестеринемией и инсулинорезистентностью.
С появлением новых мощных иммуносупрессивных препаратов, FK-506 и MMF, возрос клинический интерес к ранней редукции или полной отмене стероидной терапии. Недавние исследования показали, что у 50—70% реципиентов возможно полностью отказаться от приема стероидов, если в схеме супрессии присутствует такролимус. Они же свидетельствуют о прекрасной выживаемости трансплантатов и пациентов после отмены глюкокортикоидов.
Несмотря на то что рапамицин (Rapamune, Sirolimus), некальциневриновый ингибитор Т- и В-клеточного ответа на аллоантигенную презентацию, в последние годы успешно применяется при пересадках печени и почки, опыт его применения в трансплантации ПЖ до сих пор невелик. Однако результаты 10-месячного наблюдения за больными, получавшими в посттрансплантационном периоде лечение низкими дозами такролимуса и рапамицина, показывали 100% выживаемость как реципиента, так и трансплантированного ПДК. Несмотря на малое количество наблюдений, достоинства препарата — синергизм с СуА и такролимусом, возможность без снижения эффективности имуносупрессии уменьшить (при одновременном применении с рапамуном) их дозировку и, значит, токсичность — позволяют видеть отчетливые перспективы его широкого клинического применения в дальнейшем.
Трансплантация поджелудочной железы. Показания
Сахарный диабет (СД) по праву считается одной из самых драматичных страниц современной медицины, поскольку характеризуется исключительно ранней инвалидизацией и высоким уровнем смертности.
Заболеваемость диабетом растет так стремительно, что Всемирная организация здравоохранения рассматривает СД как эпидемическое заболевание неинфекционной природы.
В России сегодня живет порядка 8 млн. больных диабетом (около 5% населения), в США — свыше 15 млн. (почти 6%), в Великобритании — 4,5%. На всей планете сейчас насчитывается около 130 млн. больных сахарным диабетом, и каждые 12—15 лет их число удваивается. По мнению большинства экспертов, к 2025 г. общее число больных диабетом достигнет 300 млн. человек.
В структуре диализных пациентов диабетическая нефропатия составляет 20— 45% в разных странах, а ее лечение требует колоссальных капиталовложений.
Современная заместительная терапия сахарного диабета по-прежнему не способна надежно препятствовать диабетическим осложнениям, поскольку эффективна далеко не у всех больных и связана с определенными трудностями индивидуального подбора и дозирования препарата.
Увеличение заболеваемости, удельного веса сосудистых осложнений, тяжесть течения и исходов сахарного диабета, трудности коррекции нарушений углеводного метаболизма обусловили разработку новых подходов к лечению сахарного диабета, которые могли бы существенно повлиять на течение диабетических ангиопатий.
Учитывая, что метаболические нарушения при сахарном диабете — это следствие нарушения функции островковых клеток поджелудочной железы, вполне оправданным можно считать лечение данного заболевания свободной трансплантацией нормально функционирующих b-клеток — введением в организм реципиента инсулинопродуцирующей ткани. Недостаток метода — ограниченный срок функциональной активности культур островковых клеток поджелудочной железы, что требует неоднократных повторных трансплантаций.
Аллотрансплантация функционально полноценной поджелудочной железы больным сахарным диабетом — сложнейшая хирургическая задача. Тем не менее это единственный эффективный метод долговременной нормализации уровня гликемии, стабилизации, а нередко и регресса диабетических осложнений.
Несмотря на значительные трудности получения и консервации трансплантата поджелудочной железы, техническую сложность оперативного вмешательства, нередкие хирургические и иммунологические осложнения, число проводимых трансплантаций поджелудочной железы продолжает удваиваться с каждым годом. Сегодня в мире выполнено свыше 24 тысяч пересадок поджелудочной железы, и результаты операции уже не уступают результатам при трансплантации других солидных органов.
Из экспериментальной процедуры, сопряженной с большим количеством осложнений и высоким уровнем смертности, трансплантация поджелудочной железы превратилась в современную хирургическую технологию с впечатляющим уровнем выживаемости реципиентов и пересаженного панкреатодуоденального комплекса. Соответственно, постоянную эволюцию претерпевают и показания к клиническому использованию трансплантации поджелудочной железы.
Число пациентов, состояние которых может быть улучшено путем успешной аллотрансплантации панкреатодуоденального комплекса (АТПДК), постоянно увеличивается, и одновременно сужается спектр абсолютных противопоказаний к пересадке поджелудочной железы.
Несмотря на высокий процент смертности среди больных СД, непосредственной угрозы жизни это заболевание не несет. В связи с этим трансплантацию поджелудочной железы, в отличие от пересадки сердца или печени, нельзя отнести к разряду операций по жизненным показаниям. Поэтому при решении вопроса о трансплантации необходимо сопоставить возможность качественного улучшения жизни пациента, уменьшения тяжести диабетических осложнений с риском хирургического вмешательства и возможными послеоперационными осложнениями, а также адекватно оценить иммунологический статус больного ввиду необходимости иммуносупрессивной терапии в посттрансплантационном периоде.
Таким образом, больным ИЗСД, которым показана пересадка поджелудочной железы, как правило, предстоит и трансплантация почки.
При решении вопроса о пересадке поджелудочной железы больным с уже трансплантированной почкой показанием к операции служит отсутствие либо слабое отторжение почечного аллотрансплантата. Во внимание принимается также лабильность уровня гликемии и предрасположенность к прогрессированию диабетических осложнений.
Пересадка почки и ПЖ может быть проведена как одновременно (simultaneous kidney and pancreas transplantation — SPK), так и поэтапно (pancreas after kidney transplantation — PAKT).
На относительно ранних стадиях болезни для предотвращения вторичных патологических изменений, связанных с сахарным диабетом, целесообразно проводить изолированную пересадку поджелудочной железы (pancreas transplant alone — РТА). На поздних стадиях сахарного диабета изолированная трансплантация поджелудочной железы нежелательна.
При существенно сниженной почечной функции устранить имеющиеся деструктивные изменения почечной паренхимы, как правило, невозможно, и потому такие больные могут не перенести нефротического состояния, вызванного нефротоксическим действием циклоспорина в ходе посттрансплантационной иммуносупрессии.
Поскольку пересадка поджелудочной железы показана только при угрозе серьезных вторичных осложнений диабета, необходимо отметить некоторые прогностические факторы развития вторичных осложнений, важнейшее из которых — протеинурия.
При появлении устойчивой протеинурии почечная функция неуклонно ухудшается, хотя интенсивность прогрессирования процесса неодинакова у разных пациентов. Примерно в половине случаев начавшейся устойчивой протеинурии развивающаяся почечная недостаточность достигает терминальной стадии в течение 7 лет.
Противопоказания к трансплантации поджелудочной железы могут быть абсолютными и относительными.
К абсолютным противопоказаниям относится выраженная сердечно-сосудистая патология (недавно перенесенный инфаркт миокарда, снижение фракции выброса левого желудочка ниже 30%, инфекционный эндокардит, ангиографические признаки инкурабельной коронарной патологии).
Относительные противопоказания: недавно перенесенная или неустраненная онкологическая патология, СПИД, гепатит В, выраженное ожирение, психиатрические заболевания, тяжелая печеночная или легочная недостаточность.
Трансплантация поджелудочной железы
Более 90% трансплантаций поджелудочной железы включают трансплантацию почки.
Во многих центрах критериями выбора этого метода лечения также являются повторный отказ от контроля гликемии с применением стандартного лечения и случаи необъяснимой гипогликемии.
Относительными противопоказаниями являются возраст > 55 лет, серьезные сердечно-сосудистые атеросклеротические заболевания, предварительный инфаркт миокарда, хирургический шунт-трансплантат коронарной артерии, чрескожные коронарные вмешательства или положительный стресс-тест; эти факторы существенно повышают периоперационный риск.
Варианты трансплантации включают:
Одновременную трансплантацию поджелудочной железы, почек (ОПЖП)
Трансплантацию поджелудочной железы после почки (ПЖП)
Трансплантацию только поджелудочной железы
Преимуществами сочетанной трансплантации поджелудочной железы и почки являются одновременное воздействие иммуносупрессантов на оба органа сразу, потенциальная защита пересаженной почки от неблагоприятного воздействия гипергликемии и возможность контролировать отторжение почки, кроме этого почки более склонны к отторжению, нежели поджелудочная железа, чье отторжение трудно отследить.
Преимуществом трансплантации поджелудочной железы после почки является возможность оптимизировать подбор по главному комплексу гистосовместимости человека (HLA) и время выполнения трансплантации почек при использовании органа живого донора.
Трансплантация только поджелудочной железы используется главным образом для пациентов, не имеющих терминальной стадии заболеваний почек, но с тяжелой формой осложненного диабета, включая недостаточный контроль уровня глюкозы крови.
Доноры поджелудочной железы
Донорами являются недавно умершие пациенты в возрасте 10–55 лет, не имеющие в анамнезе непереносимости глюкозы и не злоупотреблявшие алкоголем.
Проводится небольшое количество (менее 1%) сегментарных трансплантаций от живых доноров, но такая процедура несет существенный риск для донора (например, инфаркт селезенки, абсцесс, панкреатит, подтекание панкреатического сока и псевдокиста, вторичный диабет), что ограничивает ее широкое применение.
Методика
Донору проводится антикоагуляция, и через чревную артерию вводится холодный консервирующий раствор. Поджелудочная железа охлаждается in situ ледяным солевым раствором, удаляется сразу вместе с печенью (для трансплантации разным реципиентам) и 2-ой частью двенадцатиперстной кишки, содержащей фатеров сосок. Подвздошная артерия также удаляется.
Донорская поджелудочная железа размещается интраперитонеально и латерально в нижней части брюшной полости.
В случае сочетанной трансплантации поджелудочной железы и почки поджелудочную железу располагают в правой средней зоне брюшной полости, а почку – в левом нижнем квадранте. Собственная поджелудочная железа остается на месте. Донорская подвздошная артерия используется для реконструкции в операционной, чтобы восстановить селезеночную артерию и верхнюю брыжеечную артерию поджелудочной железы трансплантата. Этот метод приводит к использованию одной артерии для подключения к кровеносным сосудам реципиента. Окончательные анастомозы формируются между донорской подвздошной артерией и подвздошной артерией реципиента и между донорской портальной веной и подвздошной веной реципиента. Таким образом, эндокринные секреты систематически поступают в кровоток, приводя к гиперинсулинемии; иногда формируют анастомозы между донорской панкреатической венозной системой и портальной веной, дополнительно для восстановления нормального физиологического состояния, хотя эта процедура более травматичная, и ее преимущества не вполне ясны. Двенадцатиперстная кишка подшивается к верхушке желчного пузыря или к тощей кишке для дренажа экзокринного секрета.
Курсы иммуносупрессивной терапии разнообразны, но обычно включают иммуносупрессивные иммуноглобулины, ингибиторы кальциневрина, ингибиторы синтеза пурина и кортикостероиды, доза которых постепенно снижается к 12-му месяцу (см. таблицу Иммуносупрессанты, применяемые для лечения реакции отторжения [Immunosuppressants Used to Treat Transplant Rejection] Иммуносупрессанты, применяемые при лечении реакции отторжения трансплантата ).
Читайте также:
- Лейомиома и лейомиосаркома тонкой кишки - диагностика, лечение
- Причины устойчивости опухолевых клеток к химиотерапии
- Роль начальника. Как критиковать подчиненных?
- Опухолеподобные поражения щитовидной железы. Эктопическая тиреоидная ткань.
- Надпочечники при ожоговой болезни. Паренхиматозные органы при ожогах
