Особенности клеточной оболочки грамотрицательных бактерий
Добавил пользователь Валентин П. Обновлено: 10.01.2026
• Периплазматическое пространство у грамотрицательных бактерий находится между цитоплазматической и наружной мембранами
• Белки, которые выходят через наружную мембрану, часто взаимодействуют в периплазматическом пространстве с молекулярными шаперонами
• Наружная мембрана представляет собой липидный бислой, препятствующий разупорядочению большинства молекул
• Липополисахариды являются компонентами ближайшего к поверхности слоя наружной мембраны
• При инфицировании грамотрицательными бактериями липополисахариды активируют воспалительную реакцию
В отличие от грамположительных бактерий, у грамотрицательных присутствует наружная мембрана. Промежуток между цитоплазматической и наружной мембранами называется у них периплазматическое пространство или периплазма.
В данной статье мы рассмотрим компоненты периплазмы и наружной мембраны, а также процессы, которые происходят в периплазме.
В периплазматическом пространстве находится много различных белков, включая деградативные ферменты, транспортные белки, и белки, участвующие в метаболизме. Наряду с этим, многие белки периплазмы включаются в наружную мембрану или при секреции проходят через нее. Здесь пойдет речь о периплазматическом пространстве как о «месте созревания» этих белков.
Электронная микрофотография тонкого среза клеточной оболочки E. coli К-12.
Периплазматическое пространство во многом напоминает эндоплазматический ретикулум в клетках эукариот, поскольку там также существует окислительная среда и происходит созревание белков. В периплазме находится много белков, которые функционируют как молекулярные шапероны. Шапе-роны осуществляют несколько функций: они могут препятствовать формированию у белков нативной структуры, а также способны предотвращать их протеолиз или нежелательные взаимодействия с другими белками, приводящие к агрегации.
Например, многие белки содержат свободные цистеиновые остатки, которые в условиях восстановительной среды цитоплазмы не могут образовывать дисульфидные связи. Образование дисульфидных связей служит критическим шагом в формировании нативной струткуры и в стабилизации многих периплазматических и внеклеточных белков. Процесс катализируется дисульфидизомеразой, находящейся в периплазме. На формирование нативной структуры периплазматических белков также влияет цис-транс изомеризация пролиновых остатков.
В белках, которые не приобрели нативную структуру, пролиновые остатки в основном находятся в транс-конфигурации, однако у нативных белков они существуют как в транс, так и в цис-форме. У Е. coli идентифицировано несколько пролил изомераз. Эти ферменты ускоряют медленно протекающий процесс цис-транс изомеризации пролиновых остатков.
Еще одним примером шаперонов служит белок DegP, который помогает стабилизировать белки, потерявшие в периплазме нативную структуру. Гомологи этого белка существуют в большинстве клеток прокариот и в некоторых эукариотических клетках. Белок DegP представляет собой распространенный шаперон, активный по отношению к белкам многих типов. Другие шапероны, содержащиеся в периплазме, например PapD, участвующий в биогенезе Р-пилий, проявляют специфичность к одному типу субстрата.
PapD связывается с субъединицами пилий, по мере их выхода в периплазму, и препятствует их взаимодействию друг с другом (что непродуктивно) или с другими субъединицами. Однако предотвращение несвоевременного взаимодействия субъединиц между собой отражает лишь одну сторону действия этого шаперона. Он также необходим для формирования правильной нативной структуры субъединиц пилий. Если этого не происходит, то субъединицы агрегируют и подвергаются протеолизу.
Несмотря на присутствие шаперонов, в периплазме еще может происходить агрегация белка, и при этом активируется система Срх. Как показано на рисунке ниже, система Срх состоит по крайней мере из трех белков. Предполагается, что периплазматический белок СрхР присоединяется к агрегировавшему или неправильно уложенному белку, находящемуся в периплазме, что приводит к активации белка СрхА, который присутствует в цитоплазматической мембране. При активации происходит фосфорилирование цитоплазматического домена СрхА, и затем эта фосфатная группа переносится на ДНК-связывающий белок, CpxR. Фосфорилированный CpxR индуцирует экспрессию многих генов, включая те, которые кодируют протеазы периплазмы.
Последние деградируют агрегированные или неправильно собранные белки. К числу прочих белков, индуцируемых при участии Срх, относятся белки, способствующие сборке нативных белковых структур, например дисульфид оксидаза DsbA, и пептидилпролилизомеразы PpiA и PpiD.
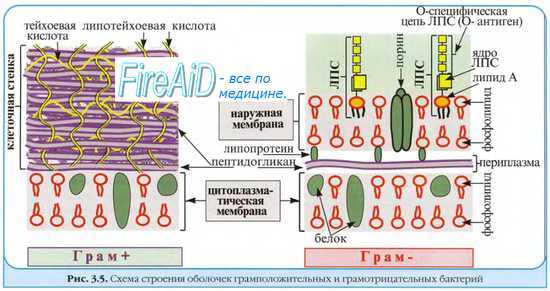
Наружная мембрана асимметрична. Внутренний ее слой, так же как и во внутренней мембране, состоит из фосфолипидов, а наружный из липополисахаридов (LPS). Состав LPS меняется в зависимости от организма. У большинства организмов, однако LPS содержат О-полисахарид, коровый полисахарид и остаток липида А. Последний содержит такие жирные кислоты, как капроновая, лауриновая, миристиновая, пальмитиновая и различные стеариновые кислоты. Липид А связан с О-полисахаридом через амидоэфирные связи к коровой области. Обычно О-полисахарид состоит из повторяющихся остатков галактозы, глюкозы, рамнозы и маннозы.
Эти сахара расположены в виде разветвленных повторяющихся 4-5-звенных последовательностей, которые образуют длинный О-полисахарид. Сердцевинный полисахарид состоит из N-ацетилглюкозамина, глюкозамина, фосфата, гептозы и кетодезоксиоктоната. Эта структура связана с пептидогликановым слоем через встроенные в мембрану липопротеины.
К числу важнейших биологических свойств LPS относится их токсичность для млекопитающих. Поэтому этот фактор является ведущим в возникновении заболеваний, распространяемых грамотрицательными патогенными микроорганизмами. Липид А представляет собой токсический участок LPS и обычно рассматривается как эндотоксин. У человека и животных лимфоциты и клетки эпителия обладают рецепторами, которые узнают LPS и активируют воспалительную реакцию. При этом наблюдается подъем температуры, падение числа лимфоцитов, других лейкоцитов и тромбоцитов и развивается общее воспаление.
Клеточная оболочка у грамотрицательных бактерий состоит из цитоплазматической (внутренней) и наружной мембран,
разделенных периплазмой, и клеточной стенки, состоящей из пептидогликана.
Обе мембраны существенно различаются по составу. В экстремальных условиях, вызывающих неправильную сборку и укладку мембранных белков,
у грамотрицательных бактерий активируется сигнальная система Cpx белка.
Активация этой системы приводит к усилению экспрессии генов,
участвующих в формировании нативной структуры белков, а также в их деградации. Структура липополисахарида Salmonella typhimurium.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Особенности клеточной оболочки грамотрицательных бактерий
Грамотрицательные бактерии. Клеточная стенка грамотрицательных бактерий. Строение клеточной стенки грамотрицательных бактерий.
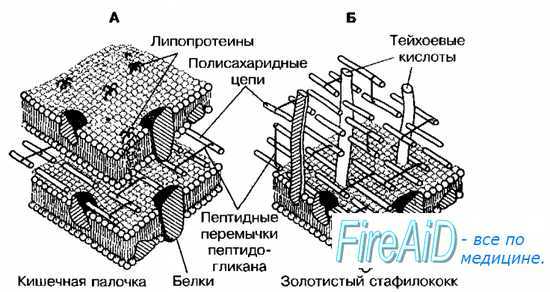
Грамотрицателъные бактерии имеют сравнительно тонкую клеточную стенку. В ней выделяют два слоя — пластичный и ригидный. Последний образован одним, редко двумя слоями пептидогликана, содержание которого составляет не более 20% сухой массы клеточной стенки. На пептидогликановом каркасе расположены фосфолипиды, липополисахариды (ЛПС) и белки, образующие пластичный слой. Толщина пластичного слоя значительно превышает размеры монослоя пептидогликана. Его компоненты расположены мозаично и могут образовывать дополнительную внешнюю мембрану либо переходить в капсулу.
• Фосфолипиды клеточной стенки пластичного слоя прикреплены к пептидогликану липопротеинами, пересекающими периплазматическое пространство. Обработка детергентами (например, додецилсульфатом натрия) приводит к нарушению этих связей. Основное отличие внешнего фосфолипидного слоя от внутреннего ригидного — высокое содержание липополисахариды.
• Липополисахариды клеточной стенки состоят из липидной части (липид А), базисной части молекулы полисахарида (сердцевина) и боковых полисахаридных цепей (рис. 4-5). Иммуногенные свойства проявляют боковые полисахаридные цепи и сердцевина. Боковые полисахаридные цепи отвечают за антигенную специфичность молекулы липополисахаридов и называются О-Аг. Липидная часть термоустойчива и отвечает за биологические эффекты ЛПС. Структура ЛПС имеет большое диагностическое значение, поскольку разные виды или серовары патогенных грамотрицательных бактерий отличаются друг от друга составом боковых цепей ЛПС внешней мембраны.
• Белки, входящие в состав пластичного слоя, подразделяют (в зависимости от выполняемых функций) на основные (мажорные) и второстепенные (минорные). К мажорным белкам относят порины, образующие трансмембранные каналы, вовлечённые в транспорт ионов и гидрофильных соединений из внешней среды в периплазму. Минорные белки также могут участвовать в транспорте веществ через пластичный слой (путём облегчённой диффузии или активного транспорта молекул). Некоторые белки играют роль рецепторов для вирусов бактерий и бактериоцинов, а также для донорских пилей при конъюгации.
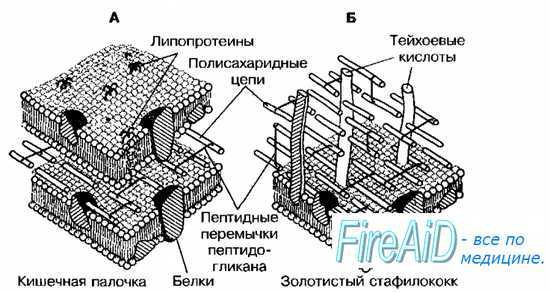
Рис. 4-4. Клеточная стенка грамотрицательных (А) и грамположительных (Б) бактерий.
Внешняя мембрана не пропускает молекулы с большой молекулярной массой, что можно рассматривать как фактор неспецифической устойчивости бактерий к некоторым антимикробным препаратам.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Основные функции клеточной стенки следующие.
• Клеточная стенка защищает бактерии от внешних воздействий, придаёт им характерную форму, поддерживает постоянство внутренней среды и участвует в делении.
• Через клеточную стенку бактерий осуществляется транспорт питательных веществ и выделение метаболитов,
• На поверхности клеточной стенки располагаются рецепторы для бактериофагов, бактериоци-нов и различных химических веществ.
• Структура и состав элементов клеточной стенки определяет антигенную характеристику бактерий (по структуре О- и Vi-Аг).
• Клеточная стенка способна по-разному воспринимать красители; на этом основаны тинкториальные свойства бактерий.
• Нарушение синтеза компонентов клеточной стенки приводит к гибели бактерии или образованию 1-форм.
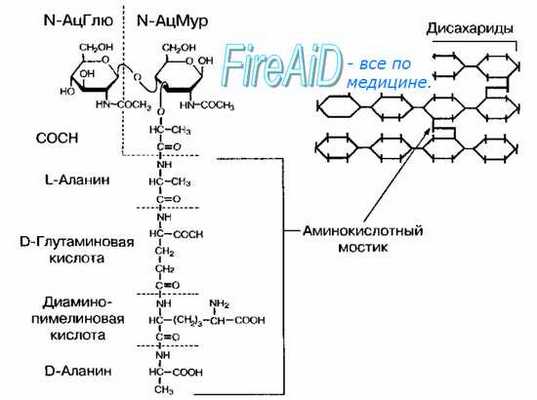
Рис. 4-3. Структура пептидогликана (муреина) Escherichia coll. Гетерополимерные цепочки, состоящие из чередующихся остатков N-ацитилглюкозамина (N-АцГлю) и N-ацетилмурамовой кислоты (N-АцМур), связаны между собой аминокислотными мостиками. Слева— детальное строение фрагмента пептидогликана. Справа — схематическое изображение структуры однослойного муреи-нового мешка.
Пептидогликан. Муреиновый мешок. Структура пептидогликана (муреина)
Опорный каркас клеточной стенки бактерий — пептидогликан (муреин) — гетерополимер, состоящий из повторяющихся дисахаридных групп, соединённых поперечными и боковыми цепочками (рис. 4-3). Остов молекулы пептидогликана — дисахарид. Его образуют N-ацетилглюкозамин и N-ацетилмурамовая кислота, соединённые через р-гликозидные связи. К молекуле N-ацетилмурамовой кислоты присоединяются олигопептиды, образующие боковые цепочки.
Связывание фрагментов пептидогликана заключается в образовании пептидной связи между терминальным остатком аминокислотного мостика (D-аланином) с предпоследним остатком примыкающего аминокислотного мостика (L-лизином или диаминопимелиновой кислотой в зависимости от вида бактерии). Боковые мостики образуют четыре аминокислоты, поперечные (вертикально связывающие слои пептидогликана) — пять аминокислот. В состав боковых мостиков также входят уникальные аминокислоты, присутствующие только у прокариотов, например диаминопимелиновая кислота (у большинства грамотрицательных бактерий) и D-изомеры глутаминовой кислоты и аланина. Эти соединения — «ахиллесова пята» бактерий, так как препараты, ингибирующие синтез компонентов клеточной стенки, обычно безвредны для растений и животных.
Пептидогликан лабилен к действию различных агентов. В частности, лизоцим гидролизует пептидогликан, расщепляя гликозидные связи между N-ацетилглюкозамином и N-ацетилмурамовой кислотой, то есть лизоцим действует как N-ацетилмурамидаза. Пептидазы расщепляют межпептидные связи, амидазы — связи между N-ацетилмурамовой кислотой и боковым пептидом (L-аланином). Лизостафин разрушает поперечные мостики пептидогликанов стафилококков. В-Лактамные антибиотики нарушают связывание боковых мостиков.
Гетерополимерные пептидогликановые цепочки, соединённые пептидными связями, образуют гигантскую мешковидную макромолекулу («муреиновый мешок»), покрывающую всё тело бактерии. На поверхности «муреинового мешка» и в его толще располагаются различные вещества, характер и содержание которых лежит в основе разделения бактерий на грамположительные и грамотрицателъные (рис. 4-4).
Грамотрицательные бактерии
Грамотрицательные бактерии – это бактерии не красящиеся по Граму. По структуре и химическому составу клеточной стенки грамположительные бактерии резко отличаются от грамотрицательных бактерий [3] [1] .
При окрашивании фиксированных клеток бактерий кристаллвиолетом или генцианвиолетом, с последующим протравливанием раствором Люголя, промывкой спиртом, водой и докрашивания 1%-ным водным фуксином грамотрицательные бактерии приобретают красный цвет. Подробнее технология окрашивания описана в статье «Окрашивание бактерий по Граму» [3] [1] .
Клеточная стенка грамотрицательных бактерий
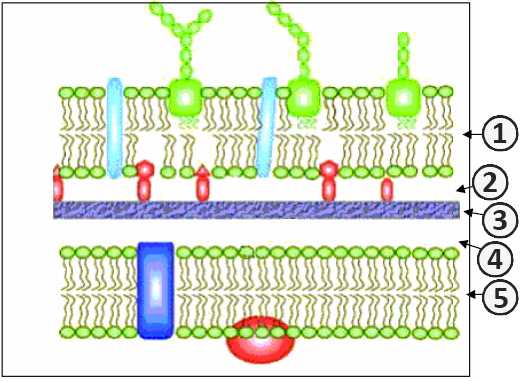
1. Наружная мембрана; 2. Периплазматическое пространство; 3. Муреин; 4. Периплазматическое пространство; 5. Цитоплазматическая мембрана [2] .
Особенности структуры и химического состава клеточной стенки
Клеточная стенка грамотрицательных бактерий многослойна, толщиной 14–17 нм. Внутренний слой клеточной стенки представлен муреином. На его долю приходится от 1 до 10% ее сухой массы [2] .
Структурные микрофибриллы пептидогликана грамотрицательных бактерий сшиты менее компактно. Поры в их пептидогликановом слое значительно шире, чем в молекулярном каркасе грамположительных бактерий [2] .
Внешний слой клеточной стенки грамотрицательных бактерий (наружная или внешняя мембрана) образован фосфолипидами, липопротеинами и белками [2] .
По строению наружная мембрана характеризуется типичной организацией, характерной для элементарных мембран. Основная фракция наружной мембраны – липиды. Они составляют в среднем 22% сухой массы клеточной стенки [2] .
В наружной мембране находятся трансмембранные белки, которые пронизывают мембрану насквозь. Они представляют собой заполненные водой каналы и гидрофильные поры в липофильной мембране и названы поринами. Существует несколько типов поринов, осуществляющих транспорт через мембрану гидрофильных низкомолекулярных веществ [2] .
Одна из отличительных особенностей грамотрицательных бактерий – отсутствие в клеточной стенке тейхоевых кислот [2] .
Компоненты клеточной стенки грамотрицательных бактерий разделены электронно-прозрачным слоем и четко отделены от цитоплазматической мембраны. Пространство между цитоплазматической и наружной мембраной получило наименование – периплазматическое пространство [2] .
В периплазматическом пространстве расположены белки, такие как протеиназы, нуклеазы, периферические белки цитоплазматической мембраны, рестриктазы, пермеазы (связующие белки, участвующие в переносе некоторых субстратов в цитоплазму) [2] .
Грамотрицательных фитопатогенные бактерий
В девятом издании определителя бактерий Берджи грамотрицательные эубактери, имеющие клеточные стенки, относятся к типу Gracilicutes. К их числу принадлежат многие фитопатогенные бактерии:
Клеточная стенка бактерии
Клеточная стенка бактерии – тонкая бесцветная структура, покрывающая клетку снаружи. На ее долю приходится от 5 до 50 % сухого вещества клетки [2] .
Клеточная стенка – обязательный структурный элемент бактериальной клетки, за исключением микоплазм и L-форм. У большинства бактерий клеточная стенка невидима в обычный микроскоп без специальной обработки. У крупных форм, в частности, у серобактерий, стенки заметны отчетливо. При помещении клеток в 1–2 %-ный гипертонический раствор NaCl или раствор глюкозы, происходит пазмолиз и контуры клеточной стенки приобретают четкость. В этом случае она хорошо видна при фазово-контрастной микроскопии [2] [1] .
Микрофотография клетки бактерии
Xylella fastidiosa – возбудитель бактериального
ожога листьев

Строение клеточной стенки
По строению клеточных стенок бактерии делят на две большие группы: грамположительные бактерии и грамотрицательные бактерии. Окраска бактерий по Граму позволяет экспериментально разделить бактерии на эти две группы [1] .
Строение и отличие клеточных стенок грамположительных бактерий и грамотрицательных бактерий рассмотрено в одноименных статьях.
Химический состав клеточной стенки
Основной компонент клеточной стенки большинства бактерий – муреин. Он относится к классу пептидогликанов [1] .
Муреин – это гетерополимер. Его основа – неразветвленные гетерополимерные цепочки, состоящие из чередования остатков N-ацетилглюкозамина и N-ацетилмурамовой кислоты, которые соединены между собой β-1,4-гликозидными связями [1] .
Остатки N-ацетилмурамовой кислоты лактильными группами соединены при помощи пептидной связи с аминокислотами. В составе муреина обнаружены следующие аминокислоты: L-аланин, мезо-диаминопимелиновая кислота и D-аланин, D-глутаминовая кислота. Диаминопимелиновая кислота находится в мезоформе [1] .
У некоторых бактерий мезо-диаминопимелиновая кислота может быть заменена на L- или D-орнитин, или 2,4-диаминомасляную кислоту, или гомосерин, или гидроксилизин. Все аминокислоты, включая мезо-диаминопимелиновую, играют важную роль в формировании межмолекулярных сшивок, поскольку в образовании пептидных связей принимают участие обе аминогруппы. Таким образом, две гетерополимерные цепи муреина связываются между собой и образуют мешкообразную гигантскую молекулу – муреиновы мешок. Эта молекула выполняет функцию опорного каркаса клеточной стенки [1] .
Строение клеточной стенки и ее химический состав являются постоянной характеристикой для определенного вида бактерий. Эти характеристики служат важным диагностическим признаком, использующимся для идентификации бактерий [1] .
Особенности клеточных стенок бактерий и их значение
Клеточные стенки бактерий, в отличие от клеточных стенок эукариот содержат особые структурные элементы:
- чередующиеся последовательности N-ацетилглюказамина и N-ацетилмурамовой кислоты;
- мезо-диаминопимелиновая кислота, D-формы аланина и гутаминовой кислоты [1] .
Данные структурные элементы являются слабым местом бактерий и используются в борьбе с вызываемыми ими инфекциями. Для этого применяют лекарственные препараты, воздействующие только на клеточные стенки бактерий или на процесс их синтеза, но не оказывающие влияния на клетки растений, человека и животных [1] .
Функции клеточной стенки
Клеточная стенка бактерии выполняет ряд важных функций:
- механическая защита от воздействия негативных факторов окружающей среды;
- обеспечивает форму клетки;
- обеспечивает возможность существования клетки в гипотонических растворах;
- обеспечивает осуществление транспорта веществ и ионов, что характерно для грамотрицательных бактерий с наружной мембраной, являющейся дополнительным барьером для их поступления. При этом основной барьер – цитоплазматическая мембрана;
- препятствует проникновению в бактериальную клетку токсических веществ, что также характерно для грамотрицательных бактерий с наружной мембраной;
- клеточная стенка является местом расположения рецепторов, на которых адсорбируются бактериоцины и бактериофаги;
- в клеточной стенке содержаться антигены (липополисахариды у грамотрицательных бактерий и тейховые кислоты у грамположительных бактерий);
- на клеточной стенке расположены рецепторы, которые отвечают за взаимодействие клеток донора и реципиента при конъюгации бактерий[1] .
Одновременно отмечается, что клеточная стенка у бактерий не является жизненно важной структурой, поскольку может быть удалена в определенных условиях. В этом случае бактериальные клетки существуют в виде сферопластов и протопластов [1] .
Читайте также:
