Острое нарушение сократимости миокарда. Острое сопротивление сократимости миокарда.
Добавил пользователь Алексей Ф. Обновлено: 18.01.2026
Рассмотрены подходы к дифференциальной диагностике синдрома боли в грудной клетке у пациента в отделении неотложной кардиологии. Выделены признаки, позволившие исключить диагноз острого коронарного синдрома и диагностировать с учетом критериев, предложенн
Difficult diagnosis. Acute myocardial Infarction or myopericarditis? E. A. Temnikova, A. I. Kondratiev, V. V. Savilova, A. S. Denisova, A. E. Kolyadko, M. V. Temnikov
The approaches to the differential diagnosis of chest pain syndrome for patients admitted to the emergency cardiology department were reviewed. The symptoms which allow to exclude the diagnosis of acute coronary syndrome and diagnose myopericarditis, based on the criteria of the European Society of Cardiology were highlighted.
Несмотря на совершенствование медицинских технологий, дифференциальный диагноз боли в грудной клетке остается сложной задачей, так как ее могут вызывать многие заболевания и состояния, а также их сочетания [1]. Особое значение имеет своевременное и точное распознавание прогностически неблагоприятных клинических ситуаций, требующих специальной тактики лечения. Острый коронарный синдром (ОКС) относится к патологии, актуальность максимально быстрой диагностики которой хорошо известна и не вызывает сомнений. Однако гипердиагностика ОКС также является существенной проблемой. За рубежом до 90% лиц с острой болью в груди, направленных в отделения неотложной помощи, не имеют острой коронарной патологии [2–4]. По отечественным данным, диагноз ОКС не подтверждается у трети пациентов, поступающих в стационар [5]. Необоснованное инвазивное и медикаментозное лечение значительно увеличивает затраты на лечение, ухудшает течение заболеваний, приведших к развитию болевого синдрома, а также создает дополнительные риски, связанные с госпитализацией и диагностическими манипуляциями, включая инфекционные и процедурные осложнения [6–8].
С согласия пациента нами представлен клинический случай дифференциального диагноза с исключением ОКС. Пациент К., 34 лет, доставлен в скоропомощную больницу бригадой скорой медицинской помощи (СМП). Боль в средней трети грудины с иррадиацией в обе стороны по передней грудной стенке и плечевые суставы впервые появилась без видимых причин накануне вечером дома. Она не сопровождалась одышкой и сердцебиением, не ограничивала значимо обычную физическую активность, но усиливалась при глубоком вдохе. Пациент дважды принял таблетированные обезболивающие препараты на основе метамизола натрия, но боль не прошла. В два часа ночи боль стала резкой, интенсивной, и пациент вызвал бригаду СМП. При осмотре на дому фельдшером состояние пациента описано как удовлетворительное, указаны уровень артериального давления (АД) 140/90 мм рт. ст., пульс — 82 в минуту. Клинические проявления и данные электрокардиограммы (ЭКГ) оценены как проявления ОКС, введены парентерально нитрат и наркотический анальгетик (морфин), купировавшие боль; даны внутрь ацетилсалициловая кислота и клопидогрел в нагрузочных дозах. Дополнительно в приемном отделении выяснено, что у пациента в 17 лет после дорожной травмы удалена селезенка, последние 10 лет постепенно нарастает масса тела, отягощен семейный анамнез (отец умер в 54 года внезапно, на аутопсии выявлен ранее не диагностированный постинфарктный кардиосклероз). Ранее пациент длительно работал машинистом электропоезда и регулярно проходил тщательные медицинские осмотры, которые не выявляли никаких других отклонений в состоянии здоровья и лабораторных показателях. Последние 7 лет работа связана с физическими нагрузками (контроль строящихся объектов на местности), затруднений при выполнении ее не ощущал.
При осмотре на момент госпитализации состояние удовлетворительное. Тип телосложения гиперстенический. Повышенного питания, индекс массы тела (ИМТ) 34 кг/м 2 . Отеков нет. Кожный покров чистый. Зев гиперемирован, миндалины не увеличены. Щитовидная железа не увеличена. Грудная клетка правильной формы. Над легкими перкуторный легочный звук. Дыхание везикулярное, в нижних отделах, под лопатками жесткое. Частота дыхательных движений 16 в минуту. Границы сердца перкуторно не расширены. Пульс одинаковый на обеих руках, хорошего наполнения, ритмичный 86 в минуту. АД 120/80 мм рт. ст. на обеих руках. Тоны сердца ритмичные, 86 в минуту, акцент 2 тона над легочной артерией. Живот увеличен за счет подкожно-жировой клетчатки, по средней линии послеоперационный шов, при пальпации мягкий, безболезненный. Размеры печени перкуторно по Курлову увеличены на 2 см, при пальпации ее край эластичный, безболезненный. Почки не пальпируются.
На ЭКГ при поступлении — синусовый ритм 86 в минуту, подъем сегмента ST во II, III, AVF и всех грудных отведениях (рис. 1). Обзорная рентгенография органов грудной клетки патологии не выявила (рис. 2). При лабораторном обследовании в анализе периферической крови: лейкоцитоз 12,55 × 10 9 л без сдвигов в лейкоцитарной формуле, повышение уровня тропонина (0,12 нг/мл при референсном значении 0–0,1 нг/мл).
Характер болевого синдрома у пациента (отсутствие связи с физической нагрузкой и усиление его при дыхании, постепенное нарастание боли в течение нескольких часов) и тип изменений на ЭКГ (элевация с вогнутостью сегмента ST в большинстве отведений конкордантно максимальному зубцу комплексa QRS) не укладывались в типичную клиническую картину инфаркта миокарда и в большей степени соответствовали проявлениям перикардита. Но имевшееся повышение уровня маркера некроза миокарда не позволяло исключить повреждение миокарда ишемического или воспалительного характера. При эхокардиографии (Эхо-КГ) отсутствовали признаки гипокинеза и перикардиального выпота, не было нарушений сократимости миокарда, но имелись признаки дилатации правых отделов сердца (расширение полостей правых желудочка (3,8 см) и предсердия в диастолу (5,2 см)), незначительное увеличение размеров левого предсердия в диастолу (4,2 см), утолщение межжелудочковой перегородки с толщиной в базальных отделах до 1,3 см в диастолу при нормальном индексе массы миокарда левого желудочка.
Пациент повторно тщательно опрошен, выяснено, что за 2 недели до госпитализации он «перенес на ногах», без лечения острое заболевание (общее недомогание, мышечная слабость, першение в горле без кашля и насморка), а ранее неоднократно болел ангинами с тяжелым течением, по поводу которых даже госпитализировался в инфекционную больницу (последний раз год назад).
Таким образом, на момент госпитализации в отделение первичное обследование пациента не позволяло точно дифференцировать у пациента острый миокардит или перикардит с острым инфарктом миокарда.
Диагноз определенного острого миокардита, по мнению всех авторитетных экспертных сообществ, необходимо обосновывать гистологическими, иммунологическими или иммуногистологическими критериями, доказывающими поражение сердца воспалительной природы [9–11]. Это делает практически невозможным достоверную диагностику миокардита в рутинной клинической практике и очень приблизительной оценку частоты заболевания. Последние статистические подсчеты предполагают развитие миокардитов в 22 случаях на 100 000 пациентов в год [12], хотя есть и сведения о том, что вирусный миокардит возможен у 1–5% пациентов с острыми вирусными инфекциями [13]. Вирусы в развитых странах считаются самой частой причиной миокардита [14–17]. Спектр вирусов, наиболее часто определяемых как причина миокардита, различен в зависимости от географического региона и меняется с течением времени [13, 18–20]. Важно, что при определенных клинических вариантах течения миокардита могут чаще выявляться определенные типы вирусов. Например, при клинической картине псевдокоронарного или инфарктоподобного течения миокардита в биоптатах миокарда часто определяется парвовирус B19 [21]. Именно его геном в настоящее время в Европейской популяции является одной из наиболее частых находок у пациентов с подтвержденным диагнозом миокардита [9].
В случае псевдокоронарного варианта миокардита, как и при ОКС, у пациентов имеются: острая боль в груди; изменения сегмента ST и зубца T на ЭКГ; могут определяться нарушения глобальной или очаговой сократимости или дисфункция желудочков, по данным Эхо-КГ, и повышаться уровни тропонинов T и I. Однако присутствуют анамнестические данные о перенесенной за 1–4 недели до болевого синдрома острой респираторной или кишечной инфекции и отсутствуют ангиографические данные об острых формах ишемической болезни сердца [9, 14, 22, 23]. Во всех случаях подозрения на миокардит экспертами рекомендуется обязательное исключение заболеваний, которые могли бы объяснить возникшие клинические проявления. При болевом синдроме в груди самым информативным методом для исключения ишемической болезни сердца (ИБС) является диагностическая коронароангиография (КАГ) [9, 23].
КАГ выявила у пациента протяженный (до 4 см) участок стеноза 90% просвета сосуда в проксимальном сегменте правой коронарной артерии (ПКА) (рис. 3) и ровные контуры всех остальных сосудов без признаков стенозирования. Для уточнения характера изменений во время КАГ проведена проба с введением нитроглицерина, однако ее результат оценен как сомнительный.
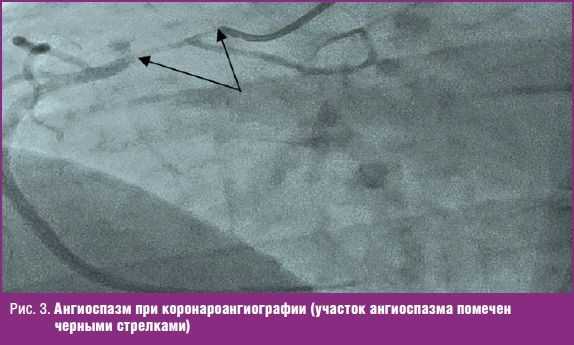
Таким образом, на этом этапе диагностики в пользу диагноза ОКС были неблагоприятный семейный анамнез по ИБС и сочетание приступа боли в груди с изменениями ЭКГ и повышением уровня тропонина. Сомнения в диагнозе острой коронарной патологии поддерживали: молодой возраст пациента и данные о тщательном наблюдении ранее, не выявлявшем каких-либо признаков заболеваний сердца и сосудов; характер болевого синдрома и его длительность; тип изменений на ЭКГ; протяженные ангиографические изменения только одного коронарного сосуда. Запись КАГ была пересмотрена с экспертами и обсуждена в консилиуме. Коллегиально изменения ПКА оценены как протяженный спазм.
В литературе широко представлен коронароспазм при вирусном миокардите, вызванном парвовирусом B19. Его связывают с вовлечением в воспалительный процесс эндотелиальных клеток сосудов и гиперкатехоламинемией. Повреждение кардиомиоцитов на небольших участках возникает вторично и обусловлено миграцией воспалительных клеток из коронарного сосуда в интерстиций. Клиническая картина в этих случаях проявляется псевдокоронарным болевым синдромом и, как правило, отсутствием симптомов выраженной сердечной недостаточности (СН) [24–27].
Вазоспазм коронарных артерий достаточно часто описан и при перикардите, и при миоперикардите [28–30]. Диагноз миоперикардита не часто используется в отечественной клинической практике. Между тем, с практической точки зрения, в ряде ситуаций он наиболее точно описывает патологию пациента. К тому же одновременное поражение перикарда и миокарда не является редкостью из-за их общей, чаще всего вирусной, этиологии. Термином «миоперикардит» обозначается перикардит с известным или клинически подозреваемым вовлечением миокарда [31]. Миоперикардит — наиболее частый вариант комбинации мио- и перикардитов в клинической практике. Его диагностируют при сочетании острого воспалительного перикардиального синдрома (ОВПС) с повышенными маркерами повреждения миокарда (тропонин I или Т, КФК-МВ) при отсутствии признаков новых нарушений функции левого желудочка (ЛЖ) по данным визуализации [31]. В свою очередь, ОВПС диагностируется при наличии хотя бы двух из четырех критериев: перикардитическая боль в груди, перикардиальные шумы, новый распространенный подъем ST или депрессия PR на ЭКГ, перикардиальный выпот (новый или ухудшившийся). Дополнительно подтверждать диагноз могут: повышение маркеров воспаления (т. е. С-реактивный белок (СРБ), скорость оседания эритроцитов (СОЭ), лейкоциты крови) и данные за воспаление перикарда методами компьютерной томографии и магнитно-резонансного исследования сердца. Для уточнения диагноза считается обязательным минимумом проведение аускультации, ЭКГ, Эхо-КГ, рентгенографии, обычных анализов крови, включая маркеры воспаления (т. е. СРБ или СОЭ) и поражения миокарда (КФК, тропонины). Подозрение на миоперикардит при отсутствии или незначительной дисфункции ЛЖ, без симптомов СН не требует проведения эндомиокардиальной биопсии. Однако для исключения ОКС при соответствующей клинической картине показана КАГ [31]. Анамнестически миокардиту, перикардиту и их сочетаниям часто предшествует или иногда сопутствует острая респираторная инфекция (особенно острый тонзиллит, пневмония) или гастроэнтерит.
В дальнейшем боли в груди пациента не беспокоили, состояние оставалось удовлетворительным, гемодинамика была стабильной (пульс на фоне назначенной терапии не чаще 60 в минуту, удовлетворительных свойств, АД не выше 120/80 мм рт. ст. на обеих руках). По литературным данным, динамика ЭКГ-изменений при остром миоперикардите не имеет четкой характеристики [31, 33]. На контрольных ЭКГ к концу первых суток от начала болезни уменьшилась элевация сегмента ST в V1-V2, но сохранялись изменения в других отведениях, отмечался транзиторный синдром WPW (рис. 4). Лабораторно оставался лейкоцитоз с уменьшением относительного количества сегментоядерных лейкоцитов и повышением лимфоцитов к концу первой недели госпитализации, с конца первых суток госпитализации отмечалось повышение общей КФК (516,0 ЕД/л) и ее МВ-фракции (30,6 ЕД/л). В день поступления и в дальнейшем отмечалось незначительное повышение уровня антистрептолизина О (не более полутора норм), что не позволяло расценивать эти изменения как свидетельство перенесенной острой стрептококковой инфекции. Уровень СРБ через 2 дня снизился вдвое, а к 10-му дню госпитализации нормализовался. Отклонений в белковых фракциях не выявлено.
При ультразвуковом исследовании (УЗИ) органов брюшной полости описаны признаки гепатомегалии с диффузными изменениями в печени, характерными для жирового гепатоза, и повышенная эхогенность поджелудочной железы, в ложе оперативно удаленной селезенки округлая добавочная долька. Мультиспиральная компьютерная томография (МСКТ) органов грудной полости, выполненная через неделю после КАГ, не выявила изменений органов грудной клетки, в том числе признаков кальциноза коронарных артерий (расчетный индекс кальциноза по Агатстон составил 0). С диагностической целью еще через неделю было выполнено МСКТ — исследование области сердца в низкодозовом объемном режиме с использованием проспективной ЭКГ-синхронизации. Признаков стойких и динамических стенозов просветов коронарных артерий выявлено не было.
Заключительный клинический диагноз пациента: «Основное заболевание: острый миоперикардит (I30.1). Осложнения: вазоспастическая стенокардия. Сопутствующие заболевания: ожирение абдоминального типа. ИМТ 35 кг/м 2 . Транзиторный синдром WPW. Травма селезенки. Спленэктомия (1998 г.). Хронический тонзиллит, ремиссия».
Исходя из клинических проявлений, наиболее вероятный этиологический фактор миоперикардита в данном случае — парвовирус В19. Подтверждения вирусной этиологии заболевания серологическими исследованиями современные рекомендации по перикардиту и миокардиту считают нецелесообразным [9, 23, 31].
Пациент изначально получал стандартную для ОКС терапию, затем основу терапии составили ацетилсалициловая кислота, ингибитор ангиотензинпревращающего фермента (периндоприла аргинин 10 мг) и бета-блокатор (метопролола тартрат 50 мг). Выписан из отделения в удовлетворительном состоянии без жалоб. На контрольных амбулаторных осмотрах в последующие 1,5 года жалоб не предъявлял, снижения толерантности к физической нагрузке не отмечал. Состояние оценивалось как удовлетворительное. Однако периодически отмечалось повышение уровня АД до первой степени артериальной гипертензии.
При лабораторном обследовании пациента повышение уровня лейкоцитов в общем анализе крови при нормальном уровне СОЭ и снижении СРБ сохранялось в течение месяца.
На ЭКГ покоя в динамике ритм синусовый, ЧСС 70 в минуту, синдром WPW (рис. 4); при суточном мониторировании ЭКГ кроме синдрома WPW отмечены редкие одиночные наджелудочковые и желудочковые экстрасистолы. Контроль ЭхоКГ через 2, 9 и 12 месяцев дополнительно к выявленным ранее изменениям определил наличие уплотнения листков перикарда по задней стенке левого желудочка и эхо-свободное пространство в полости перикарда размером до 5 мм по периметру сердца в диастолу; оставались признаки увеличения полости левого предсердия и правого предсердия, гипертрофии межжелудочковой перегородки и задней стенки левого желудочка при нормальных показателях индекса массы миокарда левого желудочка; зон гипокинеза не выявлено, сократительная способность миокарда оценена как удовлетворительная, нарушений глобальной систолической и диастолической функций левого желудочка не было. С учетом появления незначительного по объему выпота в перикард исключены нарушения функции щитовидной железы (тиреоидный профиль лабораторно) и проведено УЗИ щитовидной железы (патологии не выявлено). Таким образом, появление малого (менее 10 мм) выпота в перикарде [31] и уплотнение листков перикарда, по данным УЗИ сердца, можно рассматривать как определенную стадийность течения миоперикардита. В то же время симптомы увеличения предсердий и утолщения МЖП невозможно однозначно трактовать как проявления поражения сердца при артериальной гипертонии (диагноз установлен исходя из данных наблюдения после выписки) или проявления и последствия миоперикардита.
Правильность интерпретации данных КАГ при первичном обследовании пациента подтвердили не только отсутствие клинических признаков атеросклероза коронарных артерий в дальнейшем, но и данные проведенных в последующем МСКТ. Кроме этого УЗИ брахиоцефальных сосудов через год также не выявило признаков атеросклероза периферических сосудов.
Быстрое улучшение состояния и доброкачественное течение заболевания у пациента вполне укладывается в стандартное описание проявлений миоперикардита. Как правило, прогноз при вовлечении миокарда в воспалительный процесс перикарда благоприятный, в литературе не описано развитие СН с ухудшением гемодинамики или смерть больных с миоперикардитом [31].
Вывод. Для правильного врачебного заключения, определяющего выбор тактики ведения пациента, необходим тщательный критический анализ всех имеющихся у пациента симптомов и данных анамнеза, а также постоянная настороженность в отношении более редких причин развития синдрома болей в груди.
Литература
Е. А. Темникова* , 1 , доктор медицинских наук, профессор
А. И. Кондратьев*, кандидат медицинских наук
В. В. Савилова**
А. С. Денисова*
А. Е. Колядко*
М. В. Темников***
* ФГБОУ ВО ОмГМУ Минздрава России, Омск
** БУЗОО ГК БСМП № 1, Омск
*** ФГБВОУ ВО ВМА им. С. М. Кирова МО РФ, Санкт-Петербург
Трудный диагноз. Острый инфаркт миокарда или миоперикардит?/ Е. А. Темникова, А. И. Кондратьев, В. В. Савилова, А. С. Денисова, А. Е. Колядко, М. В. Темников
Для цитирования: Лечащий врач № 1/2019; Номера страниц в выпуске: 71-81
Теги: сердце, воспаление, парвовирус, диагностика
Острое нарушение сократимости миокарда. Острое сопротивление сократимости миокарда.
Диагностика острой сердечной недостаточности. Лечение острой сердечной недостаточности.
Диагностика острой сердечной недостаточности базируется на симптомах и клинических данных, верифицированных соответствующими обследованиями (ЭКГ, рентгенологическое обследование грудной клетки, ЭхоКГ, биомаркеры и др.). При проведении клинической оценки важно систематическое исследование периферического кровотока и температуры, венозного наполнения. Так, наполнение ПЖ при декомпенсации ПЖ обычно оценивают по ЦВД в яремной вене. При интерпретации данных следует учитывать, что высокое ЦВД при ОСН может быть следствием рефлекторного снижения согласованности вен и ПЖ при его неадекватном наполнении. По данным аускультации легких косвенно оценивают давление наполнения ЛЖ (при его повышении обычно выслушиваются влажные хрипы).
Определение качества тонов сердца, ритма галопа, клапанных шумов также весьма важны для диагностики и клинической оценки ОСН. Оценивают выраженность проявлений атеросклероза (это важно у пожилых людей), проявляющуюся недостаточным пульсом и наличием шумов на сонной артерии.
Нормальная ЭКГ не характерна для острой сердечной недостаточности. Изменения ЭКГ помогают оценить ритм и этиологический фактор ОСН, а также состояние и нагрузку отделов сердца. Изменения ЭКГ могут быть индикаторами острого повреждения миокарда, перимиокардитов, ранее существующей патологии (ГГОК, ГЛЖ или ДКМП).
Рентгенологическое обследование грудной клетки должно быть проведено в ранние сроки всем пациентам с ОСН для верификации ранее существующей патологии легких и наличия застойных изменений в них сердца (определение его размеров и формы). Данные рентгенографии позволяют дифференцировать диагноз левосердечной недостаточности воспалительного генеза и инфекционных заболеваний легких. Спиральная КТ легких помогает в диагностике ТЭЛА или легочной патологии ЭхоКГ помогает оценить региональную и глобальную сократимость ПЖ и ЛЖ, состояние клапанов, перикардиальную патологию, механические осложнения ИМ и уровень ЛГ.
Анализ газов крови позволяет оценить оксигенацию крови и КЩС (его можно заменить пульсоксиметрией в нетяжелых случаях острой сердечной недостаточности).
Всем больным с острой сердечной недостаточностью показано проведение следующих лабораторных тестов АЧТВ, СРП, Д-димер, кардиальный тропонин, оценка уровней мочевины, креатинина, калия и натрия, анализ мочи.
В сложных случаях ангиография и катетеризация легочной артерии (ДЗЛА) позволяют уточнить генез острой сердечной недостаточности.
Лечение острой сердечной недостаточности.
Цели лечения острой сердечной недостаточности — уменьшение выраженности симптомов (диспноэ, слабости, клинических проявлений СН, увеличение диуреза) и стабилизация гемодинамического состояния (увеличение сердечного выброса и/или ударного объема, снижение ДЗЛА).
Проводят мониторирование температуры тела, ЧД, ЧСС, АД, ЭКГ, уровня электролитов, креатинина и глюкозы.
Больные с острой сердечной недостаточностью часто подвержены инфекционным осложнениям (обычно респираторного тракта и мочевых путей), септицемии или назокомиальной инфекции грамположительными микробами. Поэтому при необходимости им рано назначается лечение АБ ОСН у больных с СД часто сопровождается метаболическими нарушениями (нередко возникает гипергликемия). Нормальный уровень гликемии увеличивает выживаемость пациентов с СД в тяжелом состоянии.
Отрицательный тепловой и азотистый баланс (из-за сниженной кишечной абсорбции) являются неблагоприятными прогностическими факторами при ОСН. Лечение должно быть направлено на поддержание теплового и азотистого баланса. Имеется связь между ОСН и почечной недостаточностью. Оба состояния могут быть причинными факторами, усугублять или влиять на исход другого состояния. Сохранение почечной функции является основным требованием при выборе адекватной лечебной тактики у больных ОСН.
Больным с острой сердечной недостаточностью нередко необходима неинвазивная вентиляционная поддержка с созданием положительного давления в дыхательных путях. Это позволяет улучшить оксигенацию и уменьшить проявления ОСН, избежать многих инфекционных и механических осложнений.
Общепринято назначать морфин и его аналоги (вызывающие венодилатацию, дилатацию мелких артерий и урежение ЧСС) на начальных этапах лечения тяжелой ОСН, особенно у больных с одышкой и психомоторным возбуждением.
Антикоагулянтная терапия показана при лечении ОКС с СН, а также при ФП Вазодилататоры (улучшающие периферическое кровообращение и снижающие преднагрузку) показаны большинству больных с ОСН как ЛС 1-й линии при гипоперфузии, сопровождающейся адекватным уровнем АД, застойными явлениями и низким диурезом. Нитраты уменьшают застойные явления в легких, существенно не влияя на ударный объем сердца и не приводя к росту потребности миокарда в кислороде, особенно у больных ОКС. Доза нитратов должна быть уменьшена, если САД стало менее 90 мм рт ст, и введение должно быть прекращено, если АД продолжает снижаться.
- Вернуться в оглавление раздела "Кардиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Острое нарушение сократимости миокарда (быстрое падение сердечного выброса):
1) нарушения систолической функции (уменьшения силы сердечных сокращений) — ИМ (снижение функционирующей массы миокарда), недостаточность митрального клапана (МК) любой этиологии с выраженной регургитацией (в том числе при отрыве папиллярных мышц или разрыве межжелудочковой перегородки), недостаточность аортального клапана (АК), миокардиты, токсические поражения сердца (алкоголь и его суррогаты, наркотики, ЛС), метаболические нарушения (ацидоз, тиреотоксикоз), диффузные заболевания соединительной ткани (СКВ, ССД, УПА, дерматомиозит), дилатационная кардиомиопатия (ДКМП), гипоперфузия миокарда при шоке любой этиологии (например, при тяжелой пневмонии);
2) нарушения диастолической функции (тяжелая гипертрофия миокарда любой этиологии, ГКМП — гипертрофическая кардиомиопатия);
3) острая, внезапная перегрузка ЛЖ объемом (острая аневризма сердца, остро возникшая недостаточность МК или АК с выраженной регургитацией, разрыв межжелудочковой перегородки или папиллярных мышц при ИМ, внутривенное введение больших объемов жидкости (более 2 л) при наличии сердечно-сосудистой патологии и пониженного диуреза;

4) острая, внезапная перегрузка ЛЖ давлением - гипертонический криз, особенно с АД более 220/130 мм рт. ст., стеноз митрального (МК) или аортального клапана (АК) сердца;
5) нарушения сердечного ритма (ПЖТ, ФЖ, ФП с тахиаритмией; СПТ; брадикардия с ЧСС менее 40 уд/мин; АВ-блокада III степени, в том числе при синдроме Морганьи—Адамса—Стокса (MAC); СССУ, в том числе при идиовентрикулярном ритме с ЧСС менее 30 уд/мин).
Остро возникшее препятствие сердечным сокращениям (перикардит, тампонада сердца, переломы грудной клетки, миксома сердца, напряженный пневмоторакс).
Иногда острая сердечная недостаточность может развиться даже при отсутствии патологии со стороны сердца (при нормальном функционировании ЛЖ), в связи с резким повышением давления в малом круге кровообращения. Так. может появиться некардиогенный ОЛ у больных с тяжелой пневмонией (вследствие повышения проницаемости альвеолокапиллярной мембраны из-за воздействия токсина), стенозом митрального клапана или с ОДГН — острым диффузным гломерулонефритом (очень быстро нарастает ОЦК, блокируется фильтрация, задерживается жидкость и резко повышается АД). Таким образом, ОСН может возникать не только при разных заболеваниях, но и под влиянием различных состояний.
Говоря об острой сердечной недостаточности, мы чаще подразумеваем ОЛЖН, реже — ОПЖН. Это связано с тем, что, во-первых, компенсаторные возможности большого круга кровообращения при застое крови значительно больше. Объем малого круга составляет 0,5 л, большого — 3,5 л. Значит, при одних и тех же темпах нарастания застоя крови клиническая картина будет проявляться по-разному. Кроме того, обычно самая острая ПЖ недостаточность (за исключением массивной ТЭЛА) протекает значительно медленнее; во-вторых, симптоматика недостаточности ПЖ кардинально отличается от симптоматики недостаточности ЛЖ.
Клиническая картина сердечной недостаточности. Клиника острой сердечной недостаточности.
Острая сердечная недостаточность с низким сердечным выбросом характеризуется недостаточной тканевой перфузией, ростом давления заклинивания легочной артерии и застоем в тканях. Основной механизм развития ОСН может быть как кардиальным, так и внесердечным; преходящим или разрешающимся в острый синдром, а также индуцировать повреждения, приводящие к ХСН. Кардиальная дисфункция может быть связана с изменением систолической или диастолической функции миокарда, вызванной ишемий, инфекцией, острой клапанной дисфункцией, нарушениями ритма сердца или несоответствием пред/постнагрузки. Различные заболевания способны приводить к развитию ОСН, изменяя состояние сердечной нагрузки, например:
• увеличение постнагрузки из-за системной или легочной гипертензии, массивной ТЭЛА;
• рост преднагрузки вследствие увеличения объема (массивные инфузии жидкости) либо снижения выделения из-за почечной недостаточности или эндокринной патологии;
• высокий сердечный выброс вследствие инфекции, тиреотоксикоза и анемии.
Тяжелая сердечная недостаточность может спровоцировать развитие синдрома полиорганной недостаточности, способной приводить к летальному исходу.
Острая сердечная недостаточность можно классифицировть на антеградную лево- правосердечную недостаточность (неспособность сердца прокачивать кровь в артериальное русло), ретроградную недостаточность (неспособность сердца откачивать кровь из венозного русла) правого или левого сердца или их комбинацию
Антеградная острая сердечная недостаточность может проявляться как умеренно выраженными симптомами (например, повышенной утомляемостью), так и тяжелыми признаками сниженной тканевой перфузии с формированием картины КШ (слабость в покое, спутанное сознание, сонливость, бледность кожных покровов, периферический цианоз, липкость холодной кожи, низкое АД, нитевидный пульс и олигоурия) Антеградная ОСН может развиваться вследствие ОКС, острого миокардита или клапанных дисфункций, легочных эмболии или тампонады перикарда
Ретроградная левопредсердная недостаточность может быть обусловлена левожелудочковой дисфункцией различной степени тяжести и проявляться умеренной симптоматикой (только одышка) или тяжелым состоянием (удушье, ОЛ с пенистой розовой мокротой, бледными кожными покровами, цианозом, холодной кожей, повышением АД, появлением влажных хрипов над всей поверхностью легких) Частые причины этого синдрома
• внутрисердечные - дисфункция миокарда, обусловленная хроническим заболеванием, острое повреждение (ишемия миокарда или ИМ), дисфункция аортального или митрального клапанов, аритмии или опухоли в ЛПр,
• внесердечные — тяжелая АГ, состояние высокого выброса (анемия, тиреотоксикоз), нейрогенная патология (опухоли мозга, травма)
Ретроградная правопредсердная недостаточность обусловлена легочной патологией (обострения ХОБЛ с высокой ЛГ массивная пневмония или ТЭЛА), дисфункцией правого серд ца (ИМ ПЖ, поражение трехстворчатого клапана инфекционного или травматического генеза, острые и подострые заболевания перикарда), прогрессированием недостаточности ЛЖ до развития недостаточности ПЖ, длительно существующими врожденными заболеваниями сердца с развитием недостаточности ПЖ, нефритическим, или нефротическим, синдромом и болезнями печени в терминальной стадии.
Типичные симптомы — усталость, отеки лодыжек, болезненность в правом подреберье (вследствие застоя крови в печени), одышка (с плевральным выпотом) и асцит. По мере прогрессирования данной СН появляется анасарка с дисфункцией печени и олигурией.
Клинические проявления сердечной недостаточности зависят от скорости возникновения симптомов (например, от накопления жидкости в интерстициальном пространстве легких) и особенно от того, достаточно ли времени для возникновения компенсаторных механизмов. Когда у ранее здоровых лиц внезапно развивается серьезная патология сердца (массивный ИМ или АВ-блокада с очень низкой ЧСС (до 35 уд/мин), или тахикардия (с ЧСС более 180 уд/мин), или разрыв клапана сердца на фоне инфекционного эндокардита (ИЭ), или окклюзия большого сегмента сосудистого ложа легких при ТЭЛА), возникает резкое снижение сократительной способности сердца и появляется симптоматика из-за неадекватной органной перфузии либо возникает острый венозный застой позади пораженного желудочка сердца.
Если анатомическое повреждение сердца развивалось постепенно или если больной благополучно пережил острый эпизод (ИМ), то возникают адаптивные механизмы. Например, гипертрофия желудочков сердца, которая позволяет больному адаптироваться и переносить не только возникшую анатомическую патологию сердца, но и заметное снижение его функции.
Эпизод острой сердечной недостаточности развивается быстро, поэтому нет времени на повышение уровня жидкости и соли в организме. Симптоматика ОЛ в большей степени обусловлена скоплением избыточной жидкости в легких (вследствие ее перераспределения в организме). Это подтверждается и частым появлением надпочечной ОПН (острой почечной недостаточности) у больных с кардиогенным ОЛ. Так, уже 50 мл избыточной крови, доставляемой из системного кровотока в легочный, достаточно, чтобы повысить давление в ЛА. Это соответствует разнице в 5 мл в систолическом выбросе обоих желудочков в течение 10 сокращений. При ХСН ситуация другая — постепенно повышается содержание жидкости и соли в организме.
Во многих случаях клинические проявления. Острая сердечная недостаточность и тяжелой декомпенсированной ХСН похожи. Нередко регистрируется эпизод появления выраженной симптоматики ОСН в ходе прогрессирования ХСН. В таких случаях этот эпизод трактуется не как ОСН, а как обострение ХСН.
Инфаркт миокарда: клиника, диагностика, лечение
Острый инфаркт миокарда (ИМ) — клинический синдром, возникающий в результате повреждения сердечной мышцы при несоответствии между потребностью миокарда в кислороде и возможностью его доставки. При этом возникает некроз кардиомиоцитов в зоне поврежде
Острый инфаркт миокарда (ИМ) — клинический синдром, возникающий в результате повреждения сердечной мышцы при несоответствии между потребностью миокарда в кислороде и возможностью его доставки. При этом возникает некроз кардиомиоцитов в зоне повреждения одновременно, что отличает данный процесс от других форм миокардиального повреждения.
Этилогия и патофизиология. Факторами риска являются гиперхолестеринемия, сахарный диабет, артериальная гипертензия, малоподвижный образ жизни, семейный анамнез, табакокурение и другие.
Основным в процессе принято считать атеросклероз коронарных артерий, включающий в себя разрыв или деэндотелизацию атеросклеротической бляшки, тромбоз, вазоконстрикцию, часто на фоне воспаления. Важную роль также играет нарушение свертываемости крови, уменьшение коронарного кровотока и недостаточная его компенсация коллатеральным кровообращением, нарушение обмена простагландинов, функции калликреин-кининовой системы, иммунологические нарушения. Независимо от причины, ИМ характеризуется наступлением необратимой гибели клеток миокарда. Зона инфаркта, которая изначально охватывает субэндокардиальный слой миокарда, начинает распространяться на более глубокие слои, направляясь к эпикарду. Даже при тотальной окклюзии коронарного сосуда, снабжающего зону инфаркта, наблюдается некоторый антеградный кровоток, что может позволить сохраниться в зоне поражения жизнеспособным кардиомиоцитам, поэтому считается, что существует временной период до 6–12 часов, когда возможно повлиять на размер зоны некроза путем увеличения кровотока в поврежденном участке.
У более 50% больных тотальная коронарная окклюзия развивается в области ранее существующей атеросклеротической бляшки. Тотальная окклюзия чаще развивается в проксимальных сегментах крупных артерий, что впоследствии на ЭКГ проявляется патологическими зубцами Q. При отсутствии тотальной тромботической окклюзии коронарного сосуда чаще возникает Q-необразующий ИМ (по ЭКГ).
Развитие ИМ сопровождается нарушением систолической и диастолической функции и ремоделированием левого желудочка (ЛЖ). Нарушение систолической функции обусловлено тем, что некротизированный участок миокарда не участвует в сокращении сердца, тогда как в неповрежденной ближайшей зоне имеется компенсаторная гиперкинезия. Диастолическая дисфункция связана со снижением эластичности и растяжимости миокарда. В результате диастола ЛЖ неполноценна, миокард недостаточно релаксируется, повышается конечное диастолическое давление. Данные нарушения возникают при поражении менее 10% массы миокарда левого желудочка. Ремоделирование ЛЖ обусловлено истончением миокарда и снижением тонуса миокарда в области некроза, компенсаторным расширением полости ЛЖ, развитием состояния гибернации в периинфарктной зоне, активизацией циркулирующей и местной ренин-ангиотензиновой и симпатоадреналовой системы, гиперпродукцией эндотелина. Ремоделирование сердца после ИМ может носить адаптивный и дезадаптивный характер. Адаптивный характер проявляется в уменьшении размеров ЛЖ, поддержании удовлетворительной сократительной способности ЛЖ, стабилизации миокардиального стресса. Сохраняется гемодинамически выгодная форма ЛЖ, поддерживается удовлетворительная сократительная способность ЛЖ и стабилизация миокардиального стресса. Дезадаптивный характер процесса ремоделирования ЛЖ заключается в прогрессированной дилатации ЛЖ с переходом к гемодинамически невыгодной сферической форме сердца, что приводит к развитию рестриктивного типа диастолического наполнения ЛЖ. Этот тип дисфункции является мощным предиктором сердечно-сосудистой смертности.
Клиническая картина. Проявления ИМ имеют множество вариантов. От бессимптомного течения и эпизодического дискомфорта в области сердца до развернутого болевого приступа с различными нарушениями ритма и проводимости. Чаще описываются ощущения «давления», «тяжести» и «жжения» в центральной части грудной клетки с иррадиацией в плечевой пояс, руку, челюсть, эпигастральную область. Больной беспокоен, прикладывает руку к грудине (симптом Левайна). Для пожилого больного с множественной сопутствующей патологией ИМ часто проявляется в признаках сердечной недостаточности (нарастание одышки, отеков, появление сердцебиения, атипичность стенокардитической боли).
Физикальные исследования варьируют от полной нормы до выраженных отклонений (расширение верхушечного толчка, появление 3 и 4 тона, ослабление тонов, появление влажных хрипов в легких и др.). Ни один из этих признаков не подтверждает, но и не исключает наличие ИМ. Диагностика ИМ основана на выявлении маркеров повреждения сердечной мышцы.
Маркеры повреждения кардиомиоцитов. В настоящее время наиболее убедительным маркером является тропонин. Он имеет более высокую чувствительность к ИМ, чем МВ-фракции креатинфосфокиназы (МВ-КФК). Современные методы анализа позволяют наделять тропонин практически абсолютной кардиоспецифичностью, но, учитывая это качество, тропонин может быть повышен и при неишемическом повреждении миокарда. Поэтому только комплексный подход (клинические данные, эхокардиографические и др.) позволяют доказать острую ишемию миокарда и развитие ИМ. Уровень тропонина повышается в первые 4–6 часов и держится повышенным в пределах 8–12 дней. Длительность выявления маркера позволяет диагностировать ИМ в поздние сроки, без исследования лактатдегидрогеназы (ЛДГ). Для более точного ориентирования в сроках ИМ целесообразно исследовать «короткоживущие» маркеры некроза. «Ранним» маркером некроза миокарда является повышение активности МВ-КФК. Активность МВ-КФК повышается в первые часы повреждения миокарда и превышает нормальные показатели между 6–12 часами болезни, достигая пика к 18–24 часу заболевания, а к 48 часу показатели маркера возвращаются к нормальным. Необходимо помнить о других причинах повышения МВ-КФК: повреждение скелетной мускулатуры, хронические миопатии, почечная недостаточность, гипотиреоз за счет снижения клиренса, а также то, что соотношение МВ-КФК и общей КФК не считается критерием диагностики ИМ.
Электрокардиография. Наиболее значимыми признаками ИМ являются изменения сегмента ST (подъем с выпуклостью вверх). При нижней локализации ИМ следует фиксировать ЭКГ на правой половине грудной клетки в отведениях V3R или V4R. Для огибающей окклюзии характерны изменения в так называемых задних отведениях (V7–V9), чаще в виде появления патологического зубца Q. При этом вышеуказанные признаки нельзя считать 100% обязательными. В большинстве случаев типичные изменения ЭКГ отсутствуют, что может быть обусловлено наличием нарушения внутрижелудочковой проводимости или изолированной депрессией сегмента ST.
Эхокардиография (ЭхоКГ). Диагностическая точность ЭхоКГ зависит от качества получаемого изображения. Отсутствие патологии при ЭхоКГ не может служить основанием для исключения ишемической болезни сердца или некроза сердечной мышцы. ЭхоКГ не позволяет отличить свежий очаг асинергии от зоны постинфарктного кардиосклероза. Исследование незаменимо для исключения осложнений ИМ и сопутствующей патологии.
Лечение. Для достижения максимального положительного результата лечение должно начинаться как можно раньше, начиная с первого часа заболевания, что позволит иметь значительно лучший прогноз. Как можно раньше должна быть проведена реперфузионная терапия путем тромболизиса или первичной ангиопластики. Доказано, что рано начатое лечение приводит к существенному снижению смертности при всех формах ИМ. Первичная ангиопластика на инфаркт-ассоциированной артерии в первый час заболевания позволяет восстановить естественную перфузию миокарда в зоне повреждения Чем позже проведена реперфузия, тем выше смертность. В настоящее время доступность ангиопластики остается невысокой.
В 1996 году Европейским обществом кардиологов и Американской коллегией предложены рекомендации по лечению больных острым инфарктом миокарда, состоящие из ряда принципиальных позиций.
1. Болевой синдром имеет важнейшее значение для течения ИМ. Чем выраженнее и продолжительнее болевой синдром, тем больше опасность развития тяжелых осложнений. При отсутствии противопоказаний со стороны гемодинамики для купирования ангинозного приступа можно использовать сублингвальную форму нитроглицерина (НТГ). В отдельных случаях это позволяет получить регресс острых ишемических изменений на ЭКГ. При этом следует с осторожностью использовать НТГ при нижней локализации ИМ, т. к. может развиться тяжелая артериальная гипотония. НТГ также может вызвать сосудистый коллапс и резкое урежение сердечного ритма (вазовагальная реакция). При получении эффекта от сублингвального НТГ можно применить внутривенную инфузию данного препарата в низких дозах (5–10 мкг/мин). Применение НТГ не исключает использования анальгетиков. Не рекомендовано использование мощных вазодилататоров (например, антагонистов кальция) из-за возникновения тяжелой гипотонии и рефлекторной тахикардии. При отсутствии быстрого обезболивающего эффекта от НТГ назначают наркотические анальгетики — морфин гидрохлорид в/в до 10 мг с повторением введения препарата до полного купирования болевого синдрома. Помимо основного эффекта морфин способствует уменьшению пред- и постнагрузки на сердце, уменьшает давление в сосудах малого круга кровообращения. Из побочных эффектов основными являются гипотония и относительная брадикардия, угнетение дыхательного центра, тошнота и рвота. С целью обезболивания используют также Промедол.
Для усиления обезболивающего эффекта используют сочетание морфина и нейролептика, чаще дроперидола, обладающего также мощным противорвотным эффектом. Для больных пожилого возраста данные схемы нужно использовать с осторожностью из-за сопутствующей патологии, т. к. часто возможны нарушения функции дыхания. Для данной возрастной группы больных рекомендуется применение комбинации наркотического анальгетика и транквилизатора, например, Фентанила 0,005% 2 мл и Седуксена 0,5% 2 мл.
Большим достижением в обезболивании некупирующегося ангинозного приступа стала эпидуральная блокада. Широкое применение затруднено из-за развития специфических осложнений и наличия технических трудностей при ее выполнении.
Применение ингаляционных средств наркоза в настоящее время используется редко, только по определенным показаниям (проведение кардиоверсии, искусственная вентиляция легких, выполнение болезненных манипуляций).
2. Восстановление кровотока (реканализация) по инфаркт-ассоциированной артерии существенно уменьшает размеры зоны поражения миокарда. Эффективность тромболитической терапии (ТЛТ) прямо зависит от времени начала лечения. Желательно, чтобы время обращения за помощью и начало ТЛТ не превышало 90 минут. Показанием к ТЛТ считается наличие смещения сегмента ST вверх от изоэлектрической линии более 0,1 мВ не менее чем в двух смежных отведениях ЭКГ или блокады ножки пучка Гиса у больных, поступивших в первые 12 часов после появления симптомов ИМ. Однако при сохранении боли и указанных выше изменений на ЭКГ считается целесообразным проведение ТЛТ и в более поздние сроки (вплоть до 24 часов после начала заболевания). Под блокадой ножки пучка Гиса подразумевается вновь возникшая или предположительно вновь возникшая полная блокада левой ножки пучка Гиса, затрудняющая интерпретацию ЭКГ. Наиболее доступным с доказанной эффективностью считается препарат стрептокиназа. Препарат активизирует плазминоген непрямым способом. Препарат не следует назначать пациентам, которые перенесли ранее тяжелую стрептококковую инфекцию или которым данный препарат вводился в течение последних 5–6 месяцев. Быстрое введение стрептокиназы может вызывать резкое снижение артериального давления. Рекомендуемая доза стрептокиназы составляет 1500000 ЕД в течение часа.
Урокиназа является прямым активатором плазминогена, имеет короткий период полувыведения, вызывает более быстрое восстановление проходимости инфаркт-ассоциированной артерии, чем эквивалентная доза стрептокиназы. Рекомендуемая доза 2000000 ЕД болюсно и 3000000 ЕД в/в капельно в течение 90 минут.
Тканевой активатор плазминогена (ТАП) считается фибрин-специфичным активатором плазминогена. По сравнению со стрептокиназой и урокиназой ТАП способствует более раннему восстановлению проходимости инфаркт-ассоциированной артерии, возможно, именно этот фактор обусловлено снижает смертность при его использовании. Режим назначения ТАП 100 мг в/в в течение 3 часов: 10 мг болюсно, далее 50 мг в течение первого часа и еще 40 мг в течение последующих 2 часов. При массе тела пациента менее 65 кг назначается препарат в дозе 1,25 мг/кг (за 3 часа), при этом 10% от общей дозы должны быть введены в виде первичного болюса. Применение более высоких доз (больше 100 мг) ТАП ассоциировано с риском внутричерепного кровотечения.
С течением времени были синтезированы и другие ТАП с несколько иным молекулярным строением: ретеплаза, тенектеплаза.
Противопоказания к применению ТЛТ определяются риском возникновения серьезных кровотечений, в особенности внутричерепных. Существуют абсолютные противопоказания: активное внутреннее кровотечение, любой сосудистый эпизод в течение последних 2 месяцев, новообразование центральной нервной системы, тяжелая травма, хирургическое вмешательство в течение 3 месяцев, беременность, тяжелая артериальная гипертензия. К относительным противопоказаниям относят подозрение на расслоение аорты, сердечно-сосудистую реанимацию в течение 2 недель, злокачественные новообразования, язвенную болезнь в стадии обострения, нарушения гемостаза, системные заболевания, эндокардит и ряд других заболеваний. Следует индивидуально решать вопрос по проведению ТЛТ у больных старшего возраста, в связи с наличием большого количества сопутствующей патологии.
Сопутствующее лечение
Аспирин необходимо назначать всем больным с подозрением на ИМ, при отсутствии противопоказаний. Его положительное влияние на выживаемость, частоту реинфарктов и ишемических инсультов продемонстрировано как при проведении ТЛТ, так и в ее отсутствие. При сочетании Аспирина с ТЛТ эффективность последней значительно возрастает. Доказано, что Аспирин ингибирует агрегацию тромбоцитов и ускоряет фибринолиз. Поэтому всем больным ИМ следует назначать Аспирин немедленно в дозе 160–325 мг (разжевывать).
Гепарин при внутривенном введении совместно с активаторами плазминогена способствует ускорению проходимости инфаркт-ассоциированной артерии, особенно при использовании ТАП. При использовании стрептокиназы внутривенная инфузия гепарина не является столь необходимой. Стандартная схема гепаринтерапии предлагает первоначальное болюсное введение 5000 ЕД нефракционированного гепарина, а затем инфузию со скоростью 1000 ЕД/час, пока активированное частичное тромбопластиновое время (АЧТВ) не увеличится в 1,5–2 раза по сравнению с исходным. В связи с трудностями точной титрации данной формы гепарина, рекомендуется использовать низкомолекулярные гепарины (НМГ) с расчетом дозы на кг веса пациента.
β-блокаторы снижают риск повторного ИМ у больных, пролеченных тромболитической терапией. β-блокаторы снижают риск смерти, модулируют нейрогуморальные и гормональные системы, замедляют ремоделирование сердечно-сосудистой системы, вызывают нормализацию функционального состояния тромбоцитов. Рекомендуется применять препараты данной группы в первые 12 часов после начала ИМ у всех больных, не имеющих противопоказаний (бронхиальная астма, сахарный диабет, брадикардия, гипотония). Используются суточные доза метопролола, пропранолола.
Ингибиторы ангиотензин-превращающего фермента (иАПФ). Сердечная недостаточность (СН) является частым осложнением и одной из основных причин смертности в острый период ИМ и в отдаленные сроки после его развития. Возникновение и прогрессирование СН у больных, перенесших ИМ, связано с процессом ремоделирования миокарда ЛЖ, патофизиологический процесс которого запускается уже в первые часы заболевания. Повреждение клеточных и структурных компонентов миокарда и расширение зоны инфаркта предрасполагает к дилатации и дисфункции ЛЖ, которая определяет высокую смертность больных ИМ. Изменения в структуре ЛЖ в первые 3 дня, а в последующем пролиферация фибробластов и синтез коллагена приводят к прогрессированию ремоделирования сердца. Активным участником этих процессов являетcя ангиотензин II, вызывающий спазм коронарных артерий, увеличение работы сердца, повышение потребления миокардом кислорода, а в последующем пролиферацию фибробластов. Таким образом, появились теоретические основания для использования иАПФ при ИМ. Ингибиторы АПФ, уменьшая синтез ангиотензина II, вызывающего вазоконстрикцию как артериального, так и венозного сосудистого русла, способствуют нормализации центральной и периферической гемодинамики, тем самым предотвращают развитие кардиогенного шока, снижая нагрузку на сердце существенно, подавляют процесс ремоделирования ЛЖ. Однако применение иАПФ в остром периоде ИМ ограничивается риском снижения системного артериального давления (АД). В связи с этим, несмотря на доказанную эффективность иАПФ, не утратил своей актуальности поиск безопасных препаратов данной группы, пригодных для применения с первых суток ИМ в сочетании с ТЛТ. К препаратам, не вызывающим резкого снижения АД, относится лизиноприл (Диротон). Эффективность Диротона как средства, препятствующего ремоделированию ЛЖ и развитию СН, а также уменьшающего риск смерти после развития ИМ, показана в условиях эксперимента и клиники. В отличие от большинства иАПФ Диротон не нуждается в биотрансформации в печени для образования активных метаболитов, а также не содержит сульфгидрофильной группы, являющейся причиной ряда побочных эффектов. Отсутствие печеночного метаболизма у Диротона позволяет рекомендовать его больным с патологией печени. Диротон уменьшает риск взаимодействия с другими лекарственными препаратами, которые подвергаются биотрансформации в печени. Исследование эффективности Диротона у пациентов с ИМ и в раннем постинфарктном периоде показало снижение смертности, уменьшение СН. Диротон доказал свою эффективность также у больных пожилого возраста.
Антиаритмические препараты. Обычно речь идет о применении Лидокаина, который ранее назначался всем с профилактической целью купирования желудочковых нарушений ритма. Впоследствии оказалось, что реканализация инфаркт-ассоциированной артерии уменьшает вероятность развития таких аритмий, и доказано, что рутинное применение препарата способствует увеличению смертности. Лидокаин следует назначать только при желудочковой тахикардии или фибрилляции желудочков.
Магния сульфат (магнезия сульфат) может применяется при наличии лабораторно доказанной гипомагнемии или других специфических показаний (например, полиморфная желудочковая тахикардия).
Н. В. Журавлева, кандидат медицинских наук
О. А. Поворинская
РНИИ геронтологии, Москва
Читайте также:
- Пандактилит - диагностика, лечение
- Саркома Капоши конъюнктивы: признаки, гистология, лечение, прогноз
- Глаза при аутоиммунном тиреоидите. Экзофтальм при микседеме
- Колоноскопия при псевдомембранозном колите. Эндоскопическая картина
- Декомпрессия орбиты. Латеральная и трансфронтальная декомпрессия глаза
