Декомпрессия орбиты. Латеральная и трансфронтальная декомпрессия глаза
Добавил пользователь Cypher Обновлено: 23.01.2026
В статье приведен исторический обзор развития знаний о хирургических методах декомпрессии орбиты за последние 100 лет у больных с эндокринной офтальмопатией (ЭОП). На основании литературных источников проводится анализ имеющихся хирургических доступов и методов декомпрессии орбиты, показаний к проведению данных операций, возможных осложнений.
Хирургические вмешательства при ЭОП включают в себя костную орбитотомию и внутреннюю декомпрессию орбиты, заключающуюся, как правило, в резекции периокулярной клетчатки. В настоящее время разработаны транспальпебральный, трансконъюнктивальный и эндоназальный доступы к содержимому орбиты и ее костным стенкам. Объем резекции костных стенок орбиты зависит от степени экзофтальма. Наименее травматичным видом оперативного лечения является удаление части внутренней и нижней стенок орбиты, при этом анализ эффективности существующих методов декомпрессии орбиты при ЭОП свидетельствует о достижении значительного регресса экзофтальма лишь при резекции двух и более стенок орбиты. В связи с этим наиболее предпочтительным является трансэтмоидальная эндоназальная декомпрессия орбиты с резекцией медиальной и нижней стенок, отличающаяся малой инвазивностью, отсутствием кожных разрезов и послеоперационных рубцов.
Выбор тактики и объема хирургического вмешательства при ЭОП в каждом конкретном случае зависит от тяжести клинической картины заболевания, планируемого клинико-функционального эффекта, с обязательным учетом риска развития возможных осложнений.
Ключевые слова: эндокринная офтальмопатия, отечный экзофтальм, декомпрессионная орбитотомия, наружная орбитотомия, трансэтмоидальная декомпрессионная орбитотомия, внутренняя декомпрессия орбиты.
Для цитирования: Крылова А.А., Кривошеина О.И. Современные тенденции декомпрессионной хирургии при эндокринной офтальмопатии. Клиническая офтальмология. 2019;19(3):154-158. DOI: 10.32364/2311-7729-2019-19-3-154-158.
Surgical decompression for endocrine ophthalmopathy:
state-of-the-art
A.A. Krylova, O.I. Krivosheina
Siberian State Medical University, Tomsk, Russian Federation
The article addresses historical overview of surgical techniques for orbital decompression in patients with endocrine ophthalmopathy over the last century. The authors discuss available surgical approaches and techniques for orbital decompression, indications, and potential complications.
Surgical techniques for endocrine ophthalmopathy include bony orbitotomy and internal orbital decompression which usually involves the resection of periocular fat. Currently, transpalpebral, transconjunctival, and endonasal approaches are used to reach orbit and its walls. Surgical volume of orbital wall resection depends on exophthalmos severity. Partial resection of internal and inferior orbital walls is less traumatic procedure. However, analysis of the efficacy of available techniques for orbital decompression for endocrine ophthalmopathy demonstrates that exophthalmos significantly improves after the resection of two or more orbital walls only. Considering this, trans-ethmoidal endonasal orbital decompression with the resection of medial and inferior orbital walls characterized by minimal invasiveness, lack of skin incisions and surgical scars is the first choice.
The choice of surgical strategy and surgical volume in endocrine ophthalmopathy depends on the s everity of clinical manifestations, expected clinical functional outcomes, and risks of potentional complications.
Keywords: endocrine ophthalmopathy, edematous exophthalmos, orbital decompression, external orbitotomy, trans-ethmoidal endonasal orbital decompression, internal orbital decompression.
For citation: Krylova A.A., Krivosheina O.I. Surgical decompression for endocrine ophthalmopathy: state-of-the-art. Russian Journal of Clinical Ophthalmology. 2019;19(3):154–158.
В статье приведен обзор развития знаний о хирургических методах декомпрессии орбиты у больных с эндокринной офтальмопатией.
Введение
Эндокринная офтальмопатия (ЭОП) представляет собой органоспецифическое аутоиммунное заболевание, при котором происходит воспалительная инфильтрация содержимого орбиты. Одной из клинических стадий ЭОП является отечный экзофтальм, который встречается в 62,74% случаев [1].
Согласно современным рекомендациям European Group On Grave`s Orbitopathy на данной стадии заболевания назначаются гипотиреоидные и кортикостероидные препараты, а также лучевая терапия на область орбит [2]. Однако в 27–40% случаев вышеописанное лечение не обеспечивает положительного результата, существенно повышая риск развития таких тяжелых осложнений, как компрессионная оптическая нейропатия или кератопатия с угрозой перфорации роговицы [1]. При отсутствии эффекта от консервативной терапии показано проведение декомпрессионных операций на орбите, направленных на уменьшение интраорбитального давления с целью сохранения глаза и зрительных функций [3], при этом в случае угрозы потери зрения хирургическое вмешательство должно быть проведено по ургентным показаниям, независимо от функционального состояния щитовидной железы [3, 4]. Кроме того, по мнению А.Ф. Бровкиной и соавт., резекция внутренней стенки орбиты показана и при липогенном варианте ЭОП, плохо поддающемся консервативному лечению [4]. Таким образом, основными показаниями для декомпрессионной хирургии орбиты являются: быстро нарастающий экзофтальм при отсутствии эффекта от консервативного лечения; угроза потери зрительных функций в результате компрессионной оптической нейропатии или перфорации роговицы при прогрессировании заболевания; невозможность проведения кортикостероидной терапии [1]. Дополнительными показаниями служат жалобы пациента на имеющийся эстетический недостаток и планирование операции на глазодвигательных мышцах.
Декомпрессионная орбитотомия:
история вопроса
Впервые декомпрессия орбиты при лечении отечного экзофтальма была применена в 1911 г. A. Dollinger, который предложил резецировать наружную стенку орбиты, адаптировав операцию Kroeinlein по удалению дермоидной орбитальной кисты. Хирургическое вмешательство было травматичным и не обеспечивало клинически значимого эффекта, поскольку регресс экзофтальма не превышал 2 мм. Однако оно послужило основой для формирования идеи декомпрессионной хирургии у больных ЭОП [1, 5, 6].
В 1912 г. для большего увеличения объема орбиты в ходе наружной орбитотомии была удалена часть ее нижней стенки. Позднее была предложена медиальная декомпрессия орбиты с удалением ее внутренней и нижней стенок через кожный разрез вдоль боковой поверхности носа, однако регресс экзофтальма не превышал 2–3 мм [7].
В целом концепция комбинированной орбитотомии с удалением двух и более костных стенок глазницы была сформулирована в 1930–1940-х гг.
В 1989 г. C.R. Leone впервые предложил метод глубокой латеральной декомпрессии, заключающийся в удалении наружной стенки орбиты, вплоть до большого крыла клиновидной кости, чрескожным доступом через верхнее веко [8]. Регресс экзофтальма в послеоперационном периоде достигал 6,3 мм [3, 9].
S.M. Graham et al. предложили в ходе костной декомпрессии использовать комбинированный доступ с удалением внутренней и наружной стенок орбиты при сохранении нижней стенки, что позволило бы уменьшить риск развития послеоперационной диплопии. В 2003 г. с применением данной методики было прооперировано 40 пациентов (63 орбиты). Период наблюдения составил 31,5 мес. Согласно клиническим данным регресс экзофтальма составил 4,1 мм, величина глазной щели уменьшилась на 2 мм (от 0 до 7 мм). Представленные результаты свидетельствуют об эффективности предлагаемой методики в прогнозированном регрессе экзофтальма. Однако у 4 больных (10%) возникла послеоперационная диплопия, по поводу которой 2 пациентам были выполнены корригирующие операции на глазных мышцах. Кроме того, в исследовании отсутствовала группа сравнения, что затрудняет объективную оценку полученных результатов [10].
В настоящее время данный метод используется как часть комбинированной — латеральной и медиальной — декомпрессии орбиты [10, 11], при этом внутренняя стенка орбиты удаляется эндоназальным доступом, а латеральная — чрескожным. В послеоперационном периоде отмечается улучшение остроты зрения, исчезает двоение, регресс экзофтальма составляет до 4,8 мм [12]. Однако удаление наружного края орбиты может сопровождаться стойким косметическим дефектом, что является существенным недостатком данной операции [13, 14].
Необходимо отметить, что при анализе эффективности латеральной и медиальной костной декомпрессий орбиты при угрозе развития компрессионной оптической нейропатии, проведенном C.H. Choe et al. в 2011 г., установлено уменьшение экзофтальма после латеральной декомпрессии на 6,3 мм, после медиальной — только на 3,1 мм [15].
Декомпрессионная орбитотомия: современные тенденции
Костная декомпрессия орбиты
На сегодняшний день при проведении костной декомпрессии орбиты в 95% случаев используется трансантральный доступ с удалением нижней и внутренней стенок глазницы, что, согласно литературным данным, обеспечивает уменьшение экзофтальма на 4,7–5,5 мм [16].
Тем не менее во время операции имеется риск повреждения инфраорбитального нерва с нарушением чувствительности в зоне иннервации, а в послеоперационном периоде — риск пролабирования орбитальной клетчатки и утолщенных нижней прямой, нижней косой глазодвигательных мышц в гайморову пазуху с ротацией глазного яблока книзу и кзади [1, 17].
С целью удаления верхней стенки орбиты разработан метод трансфронтальной декомпрессии орбиты, однако в связи с высоким риском повреждения лобной доли головного мозга в настоящее время он не применяется [17].
В последние годы предпочтение отдается декомпрессионным операциям, осуществляемым эндоскопическим доступом, впервые предложенным D. Kennedy в 1990 г. [18]. Во время оперативного вмешательства удаляется внутренняя и часть нижней стенки орбиты с сохранением инфраорбитального нерва. Согласно клиническим наблюдениям в послеоперационном периоде экзофтальм уменьшается на 3,65–4,4 мм, повышение остроты зрения отмечается у 89% больных.
В 2008 г. R. Mladina в ходе декомпрессии орбиты эндоназальным доступом выполнил резекцию внутренней стенки орбиты, вплоть до передней стенки клиновидной пазухи, и резекцию ее нижней стенки, что в общей сложности обеспечило регресс экзофтальма на 4,6 мм [19].
Однако подобный доступ к стенкам орбиты требует выполнения частичной резекции средней носовой раковины, широкого открытия верхнечелюстной пазухи, а в ряде случаев — резекции ячеек решетчатой кости, что в определенной степени повышает риск развития инфекционно-воспалительных осложнений в послеоперационном периоде [20].
В 2009 г. Chu E.A. et al. проведен сравнительный анализ эффективности двух доступов к орбите в ходе костной декомпрессии: эндоскопического и комбинированного (эндоскопического и наружного). В исследовании оценивались результаты хирургического лечения 69 больных ЭОП (112 орбитотомий). Согласно полученным данным регресс экзофтальма при использовании комбинированного доступа для декомпрессии орбиты составил 7,4±2,3 мм, при эндоскопическом доступе данный показатель уменьшился только на 4,6 мм. Исходя из результатов исследования было рекомендовано применение эндоскопического доступа в ходе декомпрессии орбиты при экзофтальме средней степени тяжести, комбинированного доступа — при экзофтальме тяжелой степени [21, 22].
В 2012 г. П.А. Кочетковым и соавт. оптимизирован метод эндоназальной декомпрессии орбиты [23, 24] путем разработки трансэтмоидальной декомпрессионной орбитотомии [25]. Объем эндоскопической операции включает расширенную полисинусотомию, тотальную этмоидэктомию, удаление передней стенки сфеноидального синуса с частичной резекцией медиальной стенки орбиты [25]. После создания достаточно широкого костного «окна» в стенке орбиты дополнительно вскрывается периорбита, что обеспечивает пролапс мягких тканей орбиты в хирургически сформированное отверстие. Степень резекции внутренней стенки орбиты определяется наличием асимметричного положения глазных яблок, одно- или двухстороннего экзофтальма, выраженности дегенеративных изменений
глазодвигательных мышц, а также анатомо-топографическими особенностями строения решетчатого лабиринта в каждом конкретном случае. При выраженном экзофтальме авторы рекомендуют удалять медиальную треть нижней стенки орбиты [25].
Анализ результатов клинических исследований свидетельствует о высокой эффективности трансэтмоидальной эндоназальной декомпрессионной орбитотомии. Так, например, регресс экзофтальма в послеоперационном периоде составляет 5,1 мм [24]. При этом отмечено улучшение зрительных функций и отсутствие косметического дефекта. Кроме того, по данным магнитной спиральной компьютерной томографии орбит, у пациентов, прооперированных данным методом, выявлено уменьшение объема глазных мышц и орбитальной клетчатки [24]. Однако необходимо отметить, что у 82% больных в раннем послеоперационном периоде развиваются диплопия и косоглазие. Вместе с этим, согласно опубликованным данным, в 64% случаев диплопия имеет транзиторный характер и полностью исчезает в течение 20–22 дней после хирургического вмешательства. В остальных 18% случаев с развитием постоянной диплопии и сходящегося косоглазия показана операция на глазодвигательных мышцах [24].
В 2017 г. О.В. Левченко и соавт. разработан метод костной декомпрессии орбиты и резекции орбитальной клетчатки с использованием нейронавигационной системы, которая позволяет хирургу запланировать объем резекции стенок орбиты на этапе предоперационной подготовки и выбрать наиболее безопасную траекторию хирургического доступа, обходя анатомически важные структуры [25].
Объем костной декомпрессии включал резекцию внутренней, нижней и наружной стенок орбиты. В раннем послеоперационном периоде регресс экзофтальма составил 4 мм, степень ретракции век не изменилась. При осмотре через 6 мес. регресс экзофтальма достиг 10 мм, ретракция век отсутствовала полностью [25]. Среди осложнений преобладала диплопия (30%), а также описаны единичные случаи ликвореи из клиновидной пазухи [26, 27].
В целом необходимо отметить, что уменьшение
экзофтальма после костной декомпрессии колеблется
от 2 до 7 мм. При этом в случае удаления 2 или 3 стенок орбиты регресс экзофтальма составляет от 3,65 до 5,9 мм. При удалении 4 стенок орбиты отмечается наиболее значительное уменьшение экзофтальма — до 7 мм, однако выполнение подобного объема орбитотомии сопряжено с необратимой деформацией глазницы [1].
Внутренняя декомпрессия орбиты
Альтернативой костной орбитотомии при декомпрессионной хирургии ЭОП является внутренняя декомпрессия орбиты, в ходе которой выполняют частичную резекцию орбитальной клетчатки. Данная операция используется в качестве неотложной помощи при декомпенсированном отечном экзофтальме, а также с косметической целью при стабилизации патологического процесса [1]. Доступ к орбитальной клетчатке осуществляется транспальпебрально или трансконъюнктивально, и объем удаляемой клетчатки варьирует от 2 до 12 см 3 [28, 29], при этом для достижения положительного эффекта необходимо эвакуировать не менее 5,8 см 3 орбитальной клетчатки.
При транспальпебральной внутренней декомпрессии, предложенной N. Olivary в 2001 г., предварительно выполняются два кожных разреза вдоль нижнего и верхнего век, открывающих доступ к 4 квадрантам орбиты. Во время операции в среднем удаляется 6,2 см 3 орбитальной клетчатки. Регресс экзофтальма в послеоперационном периоде составляет 5,9 мм [30].
Модификацией транспальпебральной внутренней декомпрессии орбиты является операция S. Trokel по удалению перибульбарной клетчатки через разрез кожи по нижнему веку. Однако в нижнем отделе орбиты размещается около 45% общего объема клетчатки глазницы, в связи с чем регресс экзофтальма после данной операции не превышает 1,8–3,3 мм [31].
Метод внутренней декомпрессии орбиты с трансконъюнктивальным подходом через конъюнктиву нижней переходной складки позволяет добиться регресса экзофтальма до 5,4 мм, сохранения или улучшения зрительных функций — в 86,1% случаев [1, 32, 33].
Необходимо отметить, что выполнение внутренней декомпрессии орбиты при ЭОП возможно только при сохранении нормальных анатомических параметров мягкотканного содержимого орбиты по данным компьютерной томографии или магнитно-резонансной томографии глазниц [34].
Осложнения декомпрессии орбиты
Декомпрессионная хирургия орбиты, как и всякое хирургическое вмешательство, сопряжена с риском развития интра- и послеоперационных осложнений, связанных как с видом операции, так и с хирургическим доступом. Среди осложнений после костной декомпрессии орбиты встречаются: послеоперационная диплопия (4–20%), синуситы (16%), фронтиты (2%), послеоперационное инфицирование орбиты (0,8%), парез супраорбитального нерва (3%) [4, 35].
После внутренней декомпрессии орбиты при ЭОП, по данным N. Olivary, наиболее часто встречаются: ретробульбарная гематома (0,6%), парез супраорбитального нерва (3%), послеоперационная ретракция нижнего века (1,7%), послеоперационная асимметрия положения верхних век (5,2%), послеоперационное инфицирование орбиты (0,8%), диплопия (4%) [27].
Заключение
Необходимо отметить, что на сегодняшний день разработано большое число модификаций декомпрессионной хирургии при ЭОП, различающихся доступом и объемом резекции костных стенок орбиты. Наиболее оптимальным доступом для проведения декомпрессионной орбитотомии является эндоназальный доступ, обладающий такими преимуществами, как малая инвазивность, отсутствие кожных разрезов и послеоперационных рубцов [18, 19, 21, 23–25].
Объем резекции костных стенок орбиты зависит от степени экзофтальма. Анализ эффективности существующих методов декомпрессии орбиты при ЭОП свидетельствует о достижении значительного регресса экзофтальма лишь при резекции двух и более стенок орбиты [17].
Таким образом, выбор метода декомпрессионной хирургии при лечении отечного экзофтальма у больных с ЭОП должен осуществляться сугубо индивидуально, с учетом тяжести клинической картины заболевания, планируемого клинико-функционального эффекта в послеоперационном периоде, а также возможных рисков развития осложнений.
Сведения об авторах:
Крылова Анна Андреевна — к.м.н., ассистент кафедры офтальмологии, ORCID iD 0000-0001-8009-6302;
Кривошеина Ольга Ивановна — д.м.н., профессор, заведующая кафедрой офтальмологии, ORCID iD 0000-0001-7509-5858.
ФГБОУ ВО СибГМУ Минздрава России. 634050, Россия,
г. Томск, Московский тракт, д. 2.
About the authors:
Anna A. Krylova — MD, PhD, Assistant of the Department of Ophthalmology, ORCID iD 0000-0001-8009-6302;
Olga I. Krivosheina — MD, PhD, Professor, Head of the Department of Ophthalmology, ORCID iD 0000-0001-7509-5858.
Siberian State Medical University. 2, Moscow tract, Tomsk, 634050, Russian Federation.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Декомпрессия орбиты. Латеральная и трансфронтальная декомпрессия глаза
Декомпрессия орбиты — срочная операция, направленная на предотвращение гибели глаза. История хирургической декомпрессии орбиты у больных эндокринной офтальмопатией начиналась в начале XX в., когда J. Dollinger для защиты роговицы впервые выполнил резекцию наружной стенки орбиты. Степень экзофтальма удалось уменьшить всего на 2 мм. Полного эффекта автору достичь не удалось, но была сформулирована идея скорой хирургической помощи таким больным. Год спустя М. Tinker для большего увеличения объема орбиты добавил к наружной остеотомии удаление части нижней стенки орбиты.
Дополнительную эвакуацию пролабированной в образовавшийся дефект орбитальной клетчатки предложил С. McCord для уменьшения экзофтальма. R. Moran, H. Welti и G. Offret в 30-40-х годах XX в. высказали идею об удалении двух и более костных стенок орбиты, т. к. резекция одной наружной стенки не позволяла добиться положительного результата.
За прошедшие почти 100 лет изменился подход к выбору резецируемых стенок. В целях декомпрессии удаляют не только наружную стенку орбиты (наружная орбитотомия), но и внутреннюю (этмоидальная орбитотомия), нижнюю (максиллярная орбитотомия), верхнюю (трансфронтальная орбитотомия), нижнюю и внутреннюю (трансан тральная орбитотомия) стенки. В США часто практикуют удаление трех стенок орбиты.
Результаты лечения неоднозначны. При резекции наружной стенки орбиты экзофтальм уменьшается на 2-4 мм, при удалении внутренней и части нижней — в среднем на 5,5 мм. При костной декомпрессии в последние два десятилетия приоритет отдастся трансаптральному доступу. В США при декомпрессивных операциях у больных эндокринной офтальмопатией его применяют в 95% случаев, с использованием в последние годы эндоскопической техники.
Остеотомия трех стенок выполняется значительно реже (чуть более 20% случаев), что обусловлено большим риском послеоперационных осложнений при практически равных показателях уменьшения экзофтальма. Декомпрессия с помощью резекции четырех стенок орбиты, по данным литературы, выполняется крайне редко. К примеру, в США, где костные декомпрессивные операции при эндокринной офтальмопатии используются достаточно широко, четыре стенки удаляют крайне редко (около 1,6% случаев), что сопряжено в первую очередь с возможными весьма серьезными осложнениями.
Наиболее проста латеральная декомпрессивная орбитотомия, которая не отличается от костно-пластической до этапа резекции костной стенки. Резецированная стенка должна быть полностью удалена, оставшиеся участки наружной стенки кусачками скусывают до толстого края сфепоидалыюй кости. Пepиopбиту вскрывают двумя разрезами по направлению от переднего края орбиты до се вершины. Содержимое орбиты обычно пролабируется в образовавшиеся отверстия. Швы на кожу узловые. Больной может быть выписан из стационара на 5-6-й день. Из осложнений отмечают косоглазие и диплопию.
В последние годы за рубежом широкое распространение получили эндоскопические доступы при декомирессивных операциях. Декомпрессию проводят через медиальную стенку орбиты, которую убирают вплоть до передней стенки сфеноидального синуса. Во время операции одновременно можно удалить медиальную и заднюю части нижней стенки орбиты, сохраняя при этом инфраорбитальный нерв. После эндоскопической декомпрессии острота зрения повышается у 89% больных, экзофтальм в среднем уменьшается на 3,65 4,4 мм.
Трансфронтальную декомпрессию орбиты предложил и описал в 1931 г. Naffziger. Увеличение объема орбиты доетигается путем удаления верхней стенки орбиты. Одним из существенных недостатков этой операции следует признать необходимость транскраниального доступа к верхней стенке орбиты. Образовавшийся коечный дефект после операции может стать источником послеоперационной пульсации глаза за счет передаточной пульсации головного мозга, имеется риск ранения лобной доли во время операции, внутричерепного кровоизлияния, менингита и послеоперационной ликвореи.
Чтобы уменьшить подобные осложнения, предлагаются корональные и птериоиальные доступы для декомпрессии орбиты. Кожный разрез при корональном доступе осуществляют от уха до уха на 1 см кзади от волосистой части головы. Необходима отсепаровка кожно-мышечного лоскута, надкостницы для обнажения края орбиты. Периорбиту по внутренней поверхности всех костных стенок удаляют. Резецируют все четыре стенки орбиты. Экзофтальм при этом удастся уменьшить на 7-10 мм.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Орбитальная хирургия. Хирургическое лечение опухолей глаза
В развитии орбитальной хирургии можно выделить три этапа: 1776—1876 гг. — эпизодические операции на орбите, удалению опухоли чаще предшествовала энуклеация здорового глаза; 1876-1975 гг. — развитие орбитальной хирургии на основе внедрения в практику асептики и антисептики; с 1976 г. W. Buschman и D. Linnert, Е. Mark и соавт., D. Kaufman, М. Lazar и соавт., D. Wofley, А.Ф. Бровкина начали разрабатывать органосохраняющие операции на орбите с использованием микрохирургической техники.
Несмотря на длительную историю, развитие совершенной диагностической и микрохирургической техники, до настоящего времени все еще дискутируются в литературе два вопроса: 1) кто должен оперировать на орбите; 2) тип орбитальной операции зависит от характера заболевания, его локализации или возможно использование унифицированной техники?
Советская и российская, американские школы орбитальных хирургов отдавали и отдаюг предпочтение офтальмохирургическим подходам, западные коллеги предпочитают нейрохирургические.
Орбитальные операции — это хирургические вмешательства высокой сложности, что обусловлено особенностями анатомии орбиты и ее топографического взаимоотношения с прилежащими областями.
Располагая опытом операций, выполненных более чем у 2300 больных с различными патологическими процессами в орбите, позволим себе обосновать ответы на эти вопросы, доказать большие возможности современной орбитальной микрохирургии и ее безопасность при правильном выборе типа операции, ее техники.
Прежде всего, операции на орбите можно проводить без возрастного ограничения (от 3 нед. до 90 лет) при условии общего обезболивания.
Орбитальные операции имеют, как правило, лечебную и реконструктивную цели. Что касается диагностических операций — так называемых эксплораторных орбитотомий, столь широко используемых в середине XX в., то развитие современных дооперационных методов исследования, позволяющих визуализировать не только костные стенки орбиты, но и ее мягкотканое содержимое, позволили максимально сузить показания к таким операциям.

С диагностической целью орбитотомию следует выполнять, только если опухоль не может быть удалена полностью и решается вопрос о других методах лечения.
Операции на орбите имеют ряд особенностей. К ним в первую очередь нужно отнести анатомо-топографические связи орбиты с прилежащими областями, а также высокие требования к самой операции на орбите (удаление патологического очага в пределах здоровых тканей с сохранением функциональных свойств орбитальных структур и хорошим косметическим эффектом в послеоперационный период).
Существующее множество различных методик могут быть сгруппированы с учетом хирургического доступа.
Наличие в орбите субпериостального, наружною и внутреннего хирургических пространств позволяет все виды орбитотомий подразделить на наднадкостпничную, когда в орбиту входят трапскутанно или трансконъюнктивально, не повреждая периорбиту, и поднадкостпничную, выполнение которой возможно только при использовании кожных разрезов с обязательным вскрытием периорбиты.
Ширина входа в орбиту колеблется от 3 1,5 до 40 мм, в средней ее части поперечник орбиты увеличивается до 45 мм, а у вершины не превышает 10 мм. При широком входе орбита имеет небольшую глубину, при узком входе (менее 33 мм) она становится более глубокой. Деление орбиты на широкую короткую и узкую длинную полезно при планировании хирургического доступа.
К примеру, при локализации патологического очага у вершины узкой глубокой орбиты показана костно-пластичсская орбитотомия, при широкой короткой — чаще можно ограничиться простой транскутанной или трансконъюнктивальной орбитотомией.
Из 23- 26 см3 объема костной орбиты 80% заняты нервно-мышечным аппаратом, сосудами, орбитальной клетчаткой, меньшая часть — глазом. В орбите хорошо развита поддерживающая фасциальная и септальная системы, основной функцией которых является обеспечение максимальной безопасности сосудисто-нервно-мышечного аппарата. От периорбиты (надкостницы внутренней поверхности костных стенок орбиты) концентрично и радиально костным стенкам орбиты расположены фасциальные перегородки, которые окутывают экстраокулярные мышцы, зрительный нерв, сосуды и нервы и как бы подвешивают их к орбитальным стенкам.
В переднем отделе орбиты в систему фасциальных перегородок входит и связка Локвуда (латеральная связка век), которая предупреждает чрезмерное растяжение содержимого орбиты по горизонтали. В средней трети орбиты септальная система развита в большей степени, фасциальные тяжи здесь идут от периорбиты к каждой мышце. Слабее представлена фасциальная система у вершины орбиты.
ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» Минздрава России, кафедра болезней уха, горла и носа, ул. Трубецкая, 8, стр. 2, Москва, Российская Федерация, 119991
НИИ глазных болезней РАМН, Москва
ЛОР-клиника Московского областного научно-исследовательского клинического института им. М.Ф. Владимирского, Москва
ФГБУ "НИИ глазных болезней" РАМН, Москва;
ГБОУ ВПО "Первый Московский государственный медицинский университет им. И.М. Сеченова" Минздрава РФ
ФГБУ "НИИ глазных болезней" РАМН, Москва
Трансэтмоидальная декомпрессия орбиты наружным доступом в комбинации с резекцией ее латеральной стенки при эндокринной офтальмопатии
Журнал: Российская ринология. 2016;24(1): 28‑33
Цель — представить методику комбинированного подхода к костной декомпрессии орбиты при эндокринной офтальмопатии. Пациенты и методы. Проведен анализ собственных результатов хирургических вмешательств на орбите с резекцией ее костных стенок. Пациентам выполнялись трансэтмоидальная декомпрессия орбиты эндоназальным доступом и резекция латеральной орбитальной стенки наружным доступом. Оба этапа хирургического вмешательства выполнялись одномоментно. В исследование были включены 13 пациентов (21 глаз), из них 12 женщин и 1 мужчина, средний возраст составил 45,5 года. Обследование до и после операции включало стандартное офтальмологическое обследование (наружный осмотр, визометрию, тонометрию, компьютерную периметрию, биомикроскопию, офтальмоскопию), а также использовались дополнительные методы (экзофтальмометрия, орбитометрия, биометрические измерения, фотографирование пациента). Активность эндокринной офтальмопатии оценивали по клинической шкале активности (Clinical Activity Score). Показаниями для операции были оптическая нейропатия и косметически неприемлемый экзофтальм. Проанализированы техника операций, особенности послеоперационного ведения пациентов и результаты лечения. Результаты. Продемонстрирована высокая эффективность комбинированного хирургического подхода к декомпрессивным операциям на орбите в отношении регресса экзофтальма. После сбалансированной костной декомпрессии ни в одном случае не было отмечено снижения остроты зрения, в среднем она составляла 0,97±0,04, разница с предоперационным показателем не была достоверной (p>0,05). Стойкое сходящееся косоглазие и бинокулярное двоение после сбалансированной декомпрессии орбиты, которые требовали в отдаленном периоде хирургического вмешательства на экстраокулярных мышцах, возникли в 4 (19%) случаях. Величина экзофтальма до операции составила 25±2,3 мм (от 21 до 30 мм). В результате сбалансированной декомпрессии орбиты было выявлено достоверное уменьшение экзофтальма в среднем на 4,8 мм (от 4 до 9 мм), его величина в среднем составила 20,2±1,9 мм. Данная методика показала высокую эффективность как в отношении зрительных функций (острота зрения, бинокулярное двоение), так и с точки зрения уменьшения экзофтальма в среднем на 4,8 мм, а послеоперационная диплопия при этом наблюдалась менее чем в 20% случаев.
Эндокринная офтальмопатия (ЭОП) — это аутоиммунное системное заболевание, основными симптомами которого являются стойкий экзофтальм с ограничением подвижности глазного яблока и ретракцией век, а также снижение зрения вследствие компрессии зрительного нерва. ЭОП остается заболеванием, хирургические методы лечения которого нуждаются в развитии и совершенствовании. Большинство пациентов с ЭОП успешно отвечают на медикаментозную терапию, в результате которой удается подавить воспаление в орбите. Однако остается довольно большая группа пациентов, у которых, несмотря на успешную терапию, сохраняется выраженный одно- или двусторонний экзофтальм [1]. Кроме того, в ряде случаев, когда консервативное лечение неэффективно, возможно значительное стойкое снижение зрительных функций в результате поражения роговицы или оптической нейропатии [2]. Все это наряду с нарушениями бинокулярного зрения значительно снижает качество жизни пациентов. Косметический дефект является причиной снижения социальной активности пациента и может привести к глубокой депрессии. Хирургическое лечение ЭОП связано с определенными сложностями, обусловленными целым рядом факторов.
Декомпрессия наружной стенки орбиты в сравнении с ТЭДО имеет низкий процент осложнений, в частности послеоперационной диплопии, однако регресс экзофтальма при этой методике, как правило, не превышает 2—4 мм [13, 14]. В силу особенностей чрескожного доступа возможно формирование рубцов в области наружного угла глазной щели [15].
Для минимизации указанных осложнений при максимально возможном уменьшении экзофтальма нами была использована методика хирургического вмешательства, при которой одномоментно производили удаление части латеральной и медиальной орбитальных костных стенок, так называемая сбалансированная декомпрессия орбиты.
Пациенты и методы
В исследование были включены 13 пациентов (21 глаз), из них 12 женщин и 1 мужчина, средний возраст составил 45,5±11,5 года.
Пациентам осуществлялось стандартное офтальмологическое обследование (наружный осмотр, визометрия, тонометрия, компьютерная периметрия, биомикроскопия, офтальмоскопия), а также использовались дополнительные методы (экзофтальмометрия, орбитометрия, биометрические измерения, фотографирование пациента). Активность ЭОП оценивали по клинической шкале активности (Clinical Activity Score), при этом наличие каждого из признаков оценивали в 1 балл, при сумме баллов 4 и более процесс считали активным.
Всем пациентам была выполнена мультиспиральная компьютерная томография орбит в двух проекциях (фронтальной и аксиальной), дополнительно измеряли величину поперечного сечения экстраокулярных мышц в месте наибольшей толщины брюшка.
Дополнительно до операции проводился оториноларингологический осмотр, включающий эндоскопию полости носа и носоглотки, фарингоскопию, также оценивалась компьютерная томография околоносовых пазух.
При отсутствии противопоказаний выполнялось хирургическое вмешательство. Операция выполнялась под интубационным наркозом в два этапа: латеральная костная декомпрессия наружным доступом и трансэтмоидальная декомпрессия с резекцией медиальной орбитальной стенки.
Латеральную костную декомпрессию орбиты выполняли чрескожным доступом. Разрез кожи производили одним из двух способов: через наружную кантотомию или разрез кожи по типу «lazy S». Мягкие ткани тупо отсепаровывали ножницами и ретракторами до надкостницы. Последнюю отсепаровывали распатором на наружной и внутренней поверхности костной стенки. Для защиты орбитального содержимого перед началом следующего этапа между внутренней поверхностью наружной стенки орбиты и надкостницей помещали зеркало. Далее при помощи сагиттальной пилы и долота удаляли фрагмент наружной стенки орбиты, ограниченный костными разрезами и передним костным швом большого крыла клиновидной кости (рис. 1, а). Далее борами различного диаметра и костными выкусывателями расширяли область остеотомии до «треугольника» клиновидной кости, дополнительно истончая его. Кровотечение из губчатой кости останавливали хирургическим воском.
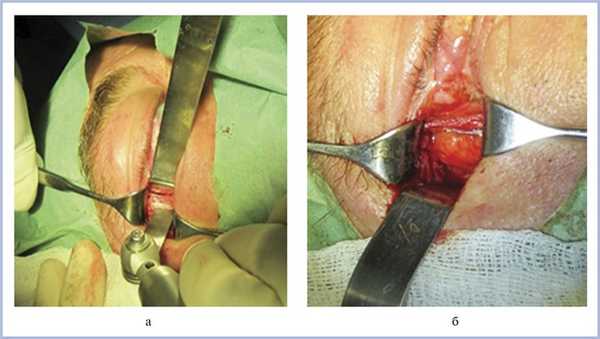
Рис. 1. Этапы наружной костной декомпрессии орбиты: разрез наружной стенки орбиты параллельно ее краю (а); сформированное костное окно с пролабировавшей жировой клетчаткой (б).
После формирования костного окна адекватного размера проводили вскрытие орбитальной надкостницы, при этом слезная железа и орбитальная жировая клетчатка пролабировали в образовавшееся дополнительное пространство (см. рис. 1, б). Орбитальный жир не удаляли. Рану ушивали послойно, при необходимости формируя наружный кантус.
Вторым этапом выполнялась ТЭДО. При этом при наличии выраженного искривления носовой перегородки предварительно выполнялась ее коррекция, это было необходимо для улучшения доступа к орбите на стороне хирургического вмешательства. Доступ к орбите предполагал проведение полисинусотомии в следующем объеме: под контролем торцевой и 30-градусной оптики выполняли медиапозицию средней раковины, после чего проводили тотальную резекцию крючковидного отростка. В случае буллезной гипертрофии средней раковины резецировали ее латеральную порцию. Соустье верхнечелюстной пазухи расширяли максимально, для чего резецировали заднюю фонтанеллу вплоть до задней стенки верхнечелюстной пазухи. Далее выполняли тотальную этмоидэктомию, в ходе которой обнажали медиальную стенку орбиты. Трансэтмоидально вскрывали клиновидную пазуху, выполняя резекцию латеральных двух третей ее передней стенки для максимального открытия. Ревизовали и оценивали проходимость соустья лобной пазухи. Убедившись в максимально открытом доступе к орбите, выполняли резекцию медиальной орбитальной стенки при помощи распатора и изогнутых ложек-кюреток. При этом не применяли острый инструментарий и коагуляцию во избежание преждевременного разрыва периорбиты.
Необходимый объем резекции медиальной стенки зависел от клинической ситуации и результатов декомпрессии латеральной стенки, а именно от размера костного окна и регресса экзофтальма после первого этапа, что определялось интраоперационной экзофтальмометрией, проводимой сразу после первого этапа операции. При выраженном экзофтальме дополнительно резецировали медиальную треть нижней орбитальной стенки через расширенное соустье верхнечелюстной пазухи, для этого использовали микроостеотом, таким образом создавали широкое костное окно.
Далее серповидным ножом проводили вскрытие периорбиты. Разрезы выполняли в сагиттальной плоскости спереди назад. В зависимости от высоты костного окна накладывали от 2 до 4 сагиттальных разрезов. При этом для улучшения визуального контроля слегка надавливали на глаз, смещая его кзади и медиально. Дополнительно рассекались фиброзные перемычки между дольками орбитального жира, таким образом достигался максимальный пролапс орбитальных мягких тканей в костное окно (рис. 2). Орбитальный жир не резецировали.
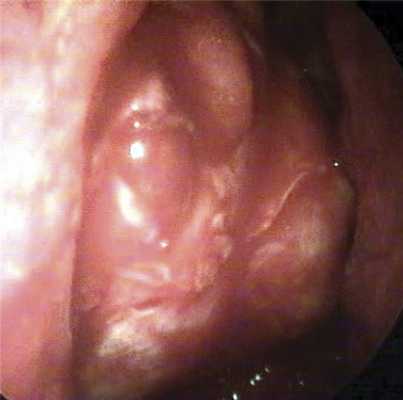
Рис. 2. Эндофото результата эндоназального этапа костной декомпрессии орбиты: орбитальный жир пролабирует в сформированное окно.
Завершали второй этап гемостазом и эластичной тампонадой полости носа. Латексные пальчиковые прошитые тампоны устанавливали в общие носовые ходы на 24 ч.
Продолжительность хирургического вмешательства при односторонней сбалансированной декомпрессии, как правило, не превышала 2 ч.
Для профилактики инфекционных осложнений интраоперационно вводили 1 мг амоксициллина/клавуланата.
В послеоперационном периоде после удаления тампонов выполняли туалет полости носа и анемизацию слизистой оболочки.
Срок нахождения пациента в стационаре не превышал 10 сут, в большинстве случаев он составлял 7 сут.
Результаты
Всем пациентам была выполнена сбалансированная декомпрессия орбиты по вышеописанной методике, причем у 7 пациентов вмешательство было проведено на обеих орбитах. Показаниями для операции были оптическая нейропатия (n=7) и косметически неприемлемый экзофтальм (n=8).
Для оценки эффективности и безопасности хирургического вмешательства учитывали остроту зрения, наличие косоглазия, бинокулярного двоения и величину экзофтальма (таблица). До операции острота зрения в среднем составила 0,84±0,19. После сбалансированной костной декомпрессии ни в одном случае не было отмечено снижения остроты зрения, в среднем она составляла 0,97±0,04, разница с предоперационным показателем не была достоверной (p>0,05).
Результаты офтальмологического обследования пациентов с ЭОП до и после декомпрессии орбиты
Стойкое сходящееся косоглазие и бинокулярное двоение после сбалансированной декомпрессии орбиты, которые требовали в отдаленном периоде хирургического вмешательства на экстраокулярных мышцах, возникли в 4 (19%) случаях. У 6 пациентов (7 глаз) косоглазие и бинокулярное двоение отмечались до операции, а в послеоперационном периоде изменения угла отклонения глаза и его подвижности у этих пациентов отсутствовали.
Величина экзофтальма до операции составила 25±2,3 мм (от 21 до 30 мм). В результате сбалансированной декомпрессии орбиты было выявлено достоверное уменьшение экзофтальма в среднем на 4,8 мм (от 4 до 9 мм), его величина в среднем составила 20,2±1,9 мм (рис. 3 и 4).
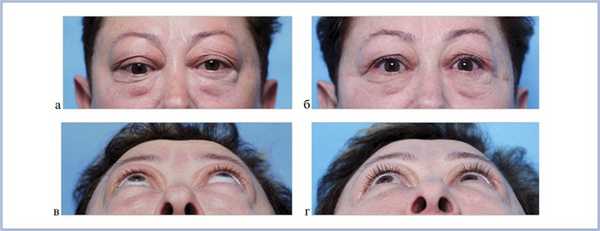
Рис. 3. Внешний вид пациентки: до (а, в) и после (б, г) двусторонней декомпрессии. Отчетливо виден регресс экзофтальма.
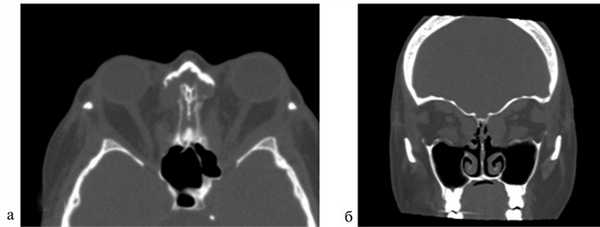
Рис. 4. Компьютерная томография после операции: аксиальный срез (а); фронтальный срез (б). Видны сформированные костные окна.
Ни у одного из оперированных пациентов не наблюдалось орбитальных инфекционных осложнений или других клинически значимых инфекций полости носа и околоносовых пазух.
Заключение
В статье представлены первые результаты одномоментной медиальной и латеральной костной декомпрессии орбиты при ЭОП. Особенностью оперативного вмешательства было одномоментное выполнение двух этапов хирургами разных специальностей: отоларингологом и офтальмологом. Медиальную декомпрессию осуществляли эндоназальным доступом, а латеральную — чрескожным, причем в первом случае выполняли резекцию наружной стенки, что способствовало снижению риска смещения глазного яблока при последующем этапе. Данная методика показала высокую эффективность как в отношении зрительных функций (острота зрения, бинокулярное двоение), так и с точки зрения уменьшения экзофтальма, который в среднем уменьшился на 4,8 мм, а послеоперационная диплопия при этом наблюдалась менее чем в 20% случаев.
Выполнение резекции медиальной стенки при сбалансированной декомпрессии требует тщательного предоперационного обследования пациентов в целях определения активности воспалительного процесса, показаний к хирургическому вмешательству, выявления противопоказаний и оценки рисков операции, а также высокой квалификации хирурга-оториноларинголога, имеющего большой опыт выполнения эндоскопических эндоназальных хирургических вмешательств на внутриносовых структурах и околоносовых пазухах.
Конфликт интересов отсутствует.
Участие авторов:
Концепция и дизайн исследования, сбор и обработка материала, статистическая обработка данных, написание и редактирование текста: П.К., Я.Г., В.С., Д.И., Н.К.
Костная декомпрессия орбиты в лечении эндокринной офтальмопатии
Журнал: Вестник офтальмологии. 2019;135(5): 248‑253
В статье проанализирована отечественная и иностранная литература, касающаяся костной декомпрессии орбиты при эндокринной офтальмопатии (ЭОП). Описаны показания к проведению, различные виды декомпрессии орбиты. Проанализированы преимущества и недостатки каждого метода. Отдельно описаны осложнения различных методик, их частота и последствия, а также эффективность.
Костная декомпрессия орбиты (КДО) является основой хирургического лечения эндокринной офтальмопатии (ЭОП) и подразумевает удаление одной или более стенок орбиты для увеличения ее объема и создания дополнительного пространства для мягких тканей. Проведение КДО при необходимости является первым вмешательством в многоэтапном процессе этого лечения, поскольку ее результаты могут влиять на другие симптомы, в частности она может приводить к изменению положения глазного яблока, век, а также может повлиять на положение мышц относительно глазного яблока, вызвать смещение мышечного конуса [1—2].
Помимо КДО, возможно проведение жировой декомпрессии орбиты, которая заключается в удалении жировой экстра- и интракональной орбитальной клетчатки [3]. Этот метод может быть достаточно эффективным в некоторых клинических ситуациях, однако у него существует немало ограничений, которые сужают круг показаний для проведения данного вида вмешательств.
Показания к КДО
Важной задачей при обследовании пациента с ЭОП является определение активности и тяжести воспалительного процесса. Декомпрессия орбиты — хирургическое вмешательство, проведение которого возможно как в активную, так и в неактивную стадию заболевания. Однако показания в этих случаях различные. Оптическая нейропатия и тяжелое поражение роговицы — грозные осложнения, которые могут привести к стойкому снижению зрения и возникают, как правило, на фоне активного орбитального воспаления. При неэффективности лечения высокими дозами глюкокортикоидов этим пациентам необходимо экстренное хирургическое лечение, которое заключается в проведении декомпрессии орбиты и, при поражении роговицы, реконструктивных операций на роговице и веках [3—8].
Тяжелая оптическая нейропатия развивается приблизительно у 5% пациентов с ЭОП, при этом в отсутствие лечения необратимая потеря зрения возникает в 30% [9]. Именно поэтому оптическая нейропатия — это состояние, требующее проведения неотложных лечебных мероприятий. В рандомизированном клиническом испытании было показано, что проведение срочной КДО не имеет преимуществ по сравнению с медикаментозной иммуносупрессивной терапией [10]. Поэтому в качестве терапии первой линии при оптической нейропатии рекомендовано внутривенное введение высоких доз метилпреднизолона (пульс-терапия). Однако при отсутствии улучшения зрительных функций в течение нескольких дней или их ухудшении КДО остается единственным способом предотвратить потерю зрения в результате атрофии зрительного нерва.
Основным патогенетическим механизмом возникновения оптической нейропатии при ЭОП принято считать сдавление зрительного нерва или кровоснабжающих его сосудов в вершине орбиты увеличенными экстраокулярными мышцами. Однако свой вклад нередко может вносить и так называемый орбитальный компартмент-синдром, в результате которого происходит экстремальное повышение давления в орбите. Это приводит к нарушению кровотока в задних цилиарных артериях, центральной артерии и/или вене сетчатки или vasa nervorum зрительного нерва, в результате чего может возникнуть ишемическая оптическая нейропатия или окклюзия сосудов сетчатки. Таким образом, важно всегда помнить, что отсутствие «скученности» в вершине орбиты не исключает наличия оптической нейропатии.
Поражение роговицы при ЭОП возникает в результате действия сразу нескольких факторов, таких как экзофтальм, расширение глазной щели, лагофтальм, синдром сухого глаза, а также активное орбитальное воспаление [11]. Это состояние нуждается в проведении срочной КДО и при необходимости операций, направленных на удлинение век и устранение лагофтальма. Кроме того, неконтролируемое повышение внутриглазного давления (ВГД) также является показанием для проведения КДО.
Благодаря значительному техническому прогрессу и накоплению большого опыта в последнее десятилетие показания для КДО значительно расширились. Так, появился термин «косметическая» декомпрессия орбиты, при которой показанием для вмешательства является выраженный экзофтальм в отсутствие угрозы снижения зрительных функций. Однако мы не совсем согласны с этим термином, поскольку в этом случае операция направлена на устранение последствий патологического процесса, который привел к выраженным изменениям внешности пациента. Поэтому хирургическое вмешательство, с нашей точки зрения, носит реконструктивный характер, а не эстетический. Крайне важно подчеркнуть, что в результате операции внешний вид пациента улучшается, однако не возвращается к тому, что был до заболевания.
Методики КДО
В зависимости от удаляемой стенки выделяют латеральную и медиальную КДО. При удалении одновременно латеральной и медиальной стенок методика носит название сбалансированной КДО. Зачастую при медиальной КДО удаляют и часть нижней стенки орбиты до подглазничного нерва, поэтому методику, при которой вмешательство проводят на латеральной, медиальной и нижней стенках называют также декомпрессией 3-х стенок.
Латеральная КДО
Латеральная КДО заключается в частичном удалении наружной стенки орбиты. Впервые латеральная КДО была предложена J. Dollinger в 1911 г., который модифицировал метод Kroenlein для удаления дермоидных кист в подвисочной ямке [12]. Далее методика претерпела значительные изменения, в частности, все последующие варианты предполагали сохранение края наружной стенки орбиты во избежание нежелательных осложнений и деформаций лица.
В настоящее время можно принципиально выделить два варианта подхода к латеральной стенке орбиты: ab interno (со стороны орбиты) и ab externo (со стороны височной ямки). Для первого возможны следующие способы доступа: чрескожный (скрытый по складке верхнего века или «lazy S»), корональный и трансконъюнктивальный («eyelid swing»), последний чаще используют при декомпрессии сразу нескольких стенок. Корональный доступ в настоящее время уступил свои позиции и применяется редко, например, в случаях выраженного периорбитального отека и/или хемоза, которые затрудняют другие способы доступа к наружной стенке орбиты. Ab externo доступ возможно осуществить при помощи кантотомии или непосредственного разреза кожи над височной ямкой.
Глубокая латеральная КДО была популяризирована R. Goldberg в 1998 г. и заключалась в дополнительном истончении наружной стенки орбиты в трех зонах: области ямки слезной железы, части скуловой верхнечелюстной кости вокруг нижней глазничной щели и толстой части треугольника большого крыла клиновидной кости, которая является стенкой нижней височной ямкой снаружи и средней черепной ямкой сзади [13]. Именно эта последняя зона и составляет большую часть объема кости, который возможно удалить при декомпрессии (5,6 мл) [14]. Эта методика предполагает доступ через складку верхнего века.
Глубокая латеральная КДО, разработанная G. Rose, также направлена на более эффективное использование «мертвого» пространства между верхней и нижней глазными щелями. При этой методике доступ осуществляют ab externo [15].
Медиальная КДО
Медиальная КДО впервые была предложена E. Sewall и заключалась в этмоидэктомии наружным доступом [16]. В 1950 г. O. Hirsh впервые выполнил резекцию нижней стенки для декомпрессии орбиты у пациента с ЭОП [17]. С 1957 г. до 1980-х годов наиболее распространенной методикой была комбинированная медиальная и нижняя декомпрессия трансантральным доступом, предложенная T. Walsh и J. Ogura [18]. Однако высокая частота послеоперационных осложнений, таких как диплопия и гипестезия подглазничного нерва, потенцировала поиск других более безопасных методов медиальной КДО. В течение последующих десятилетий было предложено множество различных доступов к стенкам орбиты для выполнения медиальной декомпрессии: эндоназальный (Kennedy, et al. 1990) трансконъюнктивальный (Paridaens, et al. 2000), «swinging eyelid» (C. McCord, 1981), корональный и др. [19—25]. Большинство хирургов в настоящее время вне зависимости от вида доступа сохраняют участок костной стенки («orbital strut») в нижнемедиальной части орбиты между верхнечелюстной и решетчатыми пазухами. Этот маневр позволяет снизить вероятность возникновения послеоперационного косоглазия и двоения [24, 26].
Сбалансированная КДО
В последние годы все большую популярность приобретает сбалансированная КДО, при которой одномоментно удаляют латеральную и медиальную стенки. При этой методике значительно снижается риск послеоперационного двоения, по сравнению с медиальной КДО, поскольку уменьшается степень смещения глазного яблока медиально книзу за счет равномерного распределения прямых мышц и орбитальной жировой клетчатки во вновь образованное пространство [27].
Декомпрессия 3-х стенок орбиты
При декомпрессии 3-х стенок орбиты производят резекцию стенок орбиты в максимальном объеме, т. е. латеральную, медиальную и часть нижней стенок. Эта методика применяется в случаях тяжелой оптической нейропатии и/или очень выраженном экзофтальме [28, 29].
Эффективность КДО
КДО показала свою эффективность в многочисленных исследованиях [15, 20, 30—33]. При оптической нейропатии это вмешательство позволяет достичь значительного улучшения зрительных функций в подавляющем большинстве случаев, различаться могут только время и степень восстановления зрения, что во многом зависит от того, на каком этапе течения заболевания было проведено вмешательство. Наилучших результатов удается достичь на ранних сроках, пока длительное сдавление зрительного нерва не привело к его атрофии. Таким образом, КДО при оптической нейропатии необходимо выполнять в максимально ранние сроки при отсутствии эффекта от пульс-терапии метилпреднизолоном.
Степень уменьшения экзофтальма напрямую зависит от объема вмешательства. Так, при максимальной декомпрессии 3-х стенок орбиты экзофтальм в среднем уменьшается на 10 мм и даже более, по 3—3,5 мм на стенку или 0,8 мм на каждый мл удаляемой кости [14, 34]. R. Goldberg et al. в ретроспективном исследовании показали, что глубокая латеральная КДО не уступает по эффективности сбалансированной (4,5 мм) при значительно меньшем уровне послеоперационного косоглазия, который при этой методике составил всего 7% против 33% при сбалансированной методике [27]. Критерием эффективности в этом исследовании было только уменьшение экзофтальма, то есть речь шла о выполнении КДО с косметической целью. P. Mehta и O. Durrani также показали высокую эффективность глубокой латеральной КДО (4,8 мм) при низком уровне осложнений, хотя применяли другую технику хирургического вмешательства [15].
Эффективность медиальной декомпрессии составляет 3,5—4,4 мм, однако высокий уровень послеоперационного косоглазия делает этот метод резервным для пациентов с оптической нейропатией и/или выраженным экзофтальмом [35, 36].
Одним из проявлений ЭОП, возникающих у 5—24% пациентов, является повышение внутриглазного давления (ВГД), которое может внести свой вклад в снижение зрительных функций из-за риска повреждения зрительного нерва [37]. В случаях предоперационного повышения ВГД выше 21 мм КДО, помимо всего прочего, обеспечивает его снижение в среднем на 8,5 мм рт.ст. [38]. Этот факт позволяет включить неконтролируемую офтальмогипертензию в ряд показаний для проведения КДО.
КДО также может влиять на активность воспалительного процесса в орбите, что было показано в клинических исследованиях [15, 39]. Механизм этого действия до конца не ясен, однако предполагают, что это происходит благодаря снижению внутриорбитального и гидростатического давления.
Немаловажным также является субъективная оценка пациентами эффективности декомпрессии орбиты. Повышение качества жизни пациентов было показано при использовании специально разработанного опросника, причем наибольшее значение для них имело улучшение внешнего вида после хирургического вмешательства [33].
Осложнения КДО
Самым частым осложнением КДО является возникновение или ухудшение существовавшего ранее бинокулярного двоения и косоглазия. Наиболее высок риск этого осложнения при выполнении нижнемедиальной декомпрессии, при этой методике частота вновь возникшего послеоперационного двоения составляет, по разным данным, от 15 до 74% (в среднем 40%) случаев [36, 40]. При сохранении участка костной стенки («orbital strut») в нижнемедиальной части орбиты между верхнечелюстной и решетчатыми пазухами частота осложнения, хотя и снижается, но все же остается достаточно высокой [41].
Двоение в основном связано со смещением вектора действия нижней прямой мышцы от орбитальной оси по направлению к нижней стенке орбиты и внутренней прямой мышцы в сторону решетчатой пазухи. Величина этого смещения напрямую связана с видом (горизонтальное и вертикальное) и степенью косоглазия. Так, двусторонняя недостаточность движения глазных яблок кверху приводит к вертикальному двоению гораздо реже, чем дефицит приведения — к горизонтальному двоению. Пациенты с предоперационным ограничением подвижности глазных яблок имеют гораздо больший риск возникновения послеоперационной диплопии по сравнению с пациентами с нормальным объемом движения [42].
Сбалансированная КДО также позволяет существенно снизить риск этого осложнения, при ней его частота варьирует от 10 до 40% [43, 44]. Это связано с тем, что уменьшается степень смещения глазного яблока медиально-книзу [45].
Минимальным риск возникновения или ухудшения послеоперационного двоения отмечают при латеральной КДО, при которой он составляет от 2 до 15% [27]. Интересно, что при глубокой латеральной костной декомпрессии также происходит смещение наружной прямой мышцы, однако это не оказывает существенного влияния на подвижность глазного яблока [46, 47]. Это можно объяснить тем, что при латеральной костной декомпрессии, в том числе глубокой, костное «окно» формируется более фронтально по отношению к экватору брюшка наружной прямой мышцы, поэтому риск смещения мышечного конуса минимален. При эндоназальной декомпрессии в области вершины орбиты кость удаляется в месте проекции увеличенного брюшка медиальной прямой мышцы, которое вставляется во вновь сформированное пространство соседних синусов, что и приводит к смещению мышечного конуса и, как следствие, послеоперационной эзотропии [48]. Пациент и орбитальный хирург должны понимать, что хирургическое лечение косоглазия при ЭОП — технически сложная задача, однако, как правило, оно позволяет достичь отсутствия двоения в первичном положении взора [49, 50]. Однако известно, что в случаях предшествовавшей декомпрессии орбиты вероятность успеха снижается и требуется проведение вмешательств на большем количестве мышц [49].
Безусловно, самым грозным осложнением КДО является ухудшение или даже потеря зрения вследствие повреждения зрительного нерва, кровотечения, чрезмерного давления на глазное яблоко во время операции. Однако частота этого осложнения крайне мала и исследований, посвященных этой проблеме, нет. Существуют лишь данные о том, что частота этого осложнения среди всех орбитальных вмешательств составляет 0,44—0,56% [50, 51].
Другие осложнения КДО также встречаются редко и включают повреждение твердой мозговой оболочки с последующей ликвореей, гипестезию подглазничного нерва, синусит, реактивацию орбитального аутоиммунного воспаления, менингоцеле [25, 52—54]. Снизить вероятность этих грозных осложнений помогают современные технические достижения, в частности интраоперационная навигация, которая в режиме реального времени позволяет оценивать положение инструментов в орбите, благодаря чему возможно проведение максимальной КДО с минимальным риском повреждения окружающих структур [55, 56].
Кроме общих, имеются также специфичные для определенных видов хирургического доступа осложнения. Так, при корональном доступе возможны повреждение лицевого нерва и нарушение роста волос в области послеоперационного рубца [28, 29]. При доступе через складку верхнего века или «swinging eyelid» существует вероятность временной (до одного года) потери чувствительности в области иннервации скуловых или височно-скуловых веточек тройничного нерва [24, 25, 54].
Основные принципы выбора стратегии
При таком разнообразии видов КДО встает вопрос о выборе вмешательства в той или иной ситуации. Безусловно, ответ во многом зависит от личных предпочтений и навыков хирурга. Однако существует несколько принципов планирования объема хирургического вмешательства при выполнении КДО.
Прежде всего выбор хирургической стратегии зависит от наличия оптической нейропатии и величины экзофтальма. При оптической нейропатии критически важным является увеличение объема в самой вершине орбиты, чего в наибольшей степени возможно достичь при медиальной декомпрессии, поскольку клетки решетчатого лабиринта распространяются очень глубоко вплоть до центра основания черепа. Таким образом, этот вид КДО является вмешательством выбора при оптической нейропатии. В наиболее тяжелых случаях проводят декомпрессию трех стенок орбиты.
Стратегия при выполнении КДО с целью уменьшения экзофтальма отличается и за последние годы претерпела некоторые изменения. Поскольку при медиальной КДО риск возникновения послеоперационного косоглазия очень велик, то первой стенкой, на которой проводят вмешательство, является наружная, при этом риск данного осложнения минимальный. Сбалансированная медиальная и латеральная декомпрессия снижает риск послеоперационного двоения и является наиболее часто используемой методикой косметической КДО. D. Kikkawa et al. предложили дифференцированный подход в зависимости от степени выстояния глазного яблока: при величине экзофтальма до 22 мм авторы рекомендуют удаление наружной стенки, дополнительную резекцию медиальной стенки выполняют при экзофтальме от 22 до 25 мм, а при экзофтальме более 25 мм проводят максимальный объем декомпрессии орбиты, включающий 3 стенки (латеральная, медиальная и нижняя) [57].
Костная декомпрессия орбиты занимает ведущее место в системе хирургической реабилитации пациентов с ЭОП. Существуют различные методики выполнения этого хирургического вмешательства, каждый из которых имеет свои преимущества и недостатки. Планирование выполнения костной декомпрессии орбиты, выбор определенного ? ?оступа в каждом случае индивидуальны и должны учитывать множество различных факторов.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
Сведения об авторах
Читайте также:
- Ингибиторы протонной помпы (ИПП) при язвенной болезни. Омепразол (омез) при язве желудка и двенадцатиперстной кишки
- Рецидивирующий отогенный менингит. Причины рецидивов ушного менингита
- Механизмы развития сепсиса. Патогенез сепсиса в ветеринарии
- Метастазы в позвоночнике. Боль в шее при метастазах позвоночника.
- Венозные мальформации. Голубой пузырчатый невус. Синдром Маффуччи.
