Пассивные реакции агглютинации. Непрямые реакции агглютинации. Реакция непрямой, или пассивной, гемагглютинации ( РНГА, РПГА ). Обратная РНГА. Реакция торможения пассивной гемагглютинации ( РТПГА ).
Добавил пользователь Morpheus Обновлено: 16.01.2026
Медицинская микробиология:
Методика проведения реакции пассивной гемагглютинации (РПГА)
Реакция пассивной (непрямой) гемагглютинации (РПГА/РНГА) основана на способности эритроцитов различных видов животных, птиц и человека (I(0) группы крови) адсорбировать на своей поверхности растворимые антигены бактерий или антитела.
Многие антигены бактерий способны спонтанно (антигены полисахаридной природы) или после предварительной обработки танином, бензидином или глюта-ровым альдегидом (антигены белковой природы) адсорбироваться на эритроцитах.
Такие комплексы называют эритроцитарными антигенными диагностикумами.
Иммуноглобулины также могут использоваться для сенсибилизации эритроцитов. В этом случае получают эритроцитарные антительные диагностикумы.
Участие эритроцитарных диагностикумов в специфических иммунных реакциях антиген—антитело обеспечивает пассивное скучивание и выпадение в осадок эритроцитов.
Реакции пассивной гемагглютинации (РПГА) применяют с целью:
— обнаружения антител в сыворотке крови путем использования известного эритроцитарного антигенного диагностикума;
— выявления неизвестного антигена на основе его взаимодействия с известным эритроцитарным антительным диагностикумом.
а) Методика РПГА для обнаружения антител в сыворотке крови больных. Для постановки реакции необходимы:
— исследуемая инактивированная сыворотка больного (прогретая при 56 °С 30 мин);
— эритроцитарный антигенный диагностикум;
— гомологичная антигену контрольная иммунная сыворотка для РПГА в разведении 1:10;
— изотонический раствор натрия хлорида pH 7,0 ± 0,5;
— 40% раствор формалина;
— 10-50% взвесь несенсибилизированных эритроцитов барана;
— планшеты для иммунологических реакций с 96 круглодонными лунками;
— микропипетки.
Антигенные эритроцитарные диагностикумы представляют собой лиофилизированную в фосфатно-буферном растворе 1-10% взвесь эритроцитов барана, предварительно формалинизированных и сенсибилизированных антигеном микроорганизмов. Консервантом является формалин в конечной концентрации 0,5%. Диагностикумы выпускают в жидком или лиофильно-высушенном виде. В последнем случае они представляют собой аморфную массу, сформированную в таблетки красно-коричневого цвета. Регидратированный препарат готовят путем разведения этих таблеток в 10 мл 0,9% раствора натрия хлорида и получают 1% рабочую взвесь. Диагностикумы выпускают в комплекте с гомологичной диагностической агглютинирующей сывороткой для РПГА в разведении 1:10 и 10-50% взвесью несенсибилизированных эритроцитов барана. Диагностическую сыворотку разводят в 10 мл изотонического раствора натрия хлорида и получают 10 мл сыворотки в разведении 1:100.
Взятую от больного на исследование сыворотку крови инактивируют прогреванием в инактиваторе (или на водяной бане) 30 мин при 56 °С. Готовят рабочее разведение сыворотки 1:100. Для этого вносят 0,1 мл цельной сыворотки в пробирку, содержащую 9,0 мл изотонического раствора натрия хлорида с 1 % формалина. Последний получают внесением 40% раствора формалина в 0,9% раствор натрия хлорида в соотношении 1:100. Тщательно перемешивают и используют в реакции.
Иногда в целях удаления гетерогенных антител к бараньим эритроцитам сыворотки предварительно обрабатывают 10-50% взвесью формалинизированных бараньих эритроцитов. Для этого эритроциты добавляют из расчета 2 капли (по 0,05 мл) на 1 мл сыворотки и тщательно перемешивают встряхиванием. Сыворотку оставляют до полного оседания эритроцитов, либо центрифугируют через 1 ч инкубации при комнатной температуре, после чего она готова к исследованию.
Эритроцитарный диагностикум используют в рабочем разведении смешивая 1 мл диагностикума и 5 мл изотонического раствора с 1 % формалина.
1. Техника постановки. Реакцию ставят в планшетах для иммунологических исследований. В начале в лунки первого ряда планшета вносят по 0,05 мл изотонического раствора натрия хлорида. Затем в первую лунку добавляют 0,05 мл исследуемой сыворотки в разведении 1:100, перемешивают. Получают разведение сыворотки 1:200, из этой лунки переносят во вторую 0,05 мл сыворотки. Перемешивают, получают разведение 1:400. Затем 0,05 мл сыворотки из второй лунки переносят в третью. Получают разведение сыворотки 1:800 и т. д., проводя двукратные последовательные разведения сыворотки до уровня удвоенного диагностического титра. Из последней лунки диагностического ряда отбирают 0,05 мл с тем, чтобы объем жидкости был одинаков во всех лунках. После этого к разведенной сыворотке добавляют по 0,05 мл эритроцитарного антигенного диагностикума. Внесение равного объема диагностикума приводит к дополнительному двукратному разведению сыворотки в каждой лунке. Так, в первой лунке разведение становится 1:400, во второй — 1:800, в третьей-1:1600 и т.д.
Ставят 3 контроля:
— контрольная иммунная сыворотка в разведении от 1:100 в объеме 0,05 мл + 0,05 мл 1% взвеси диагностикума (положительный контроль);
— отрицательный контроль—взвесь диагностикума с нормальной сывороткой в таких же дозах;
— отрицательный контроль —0,05 мл исследуемой сыворотки в разведении 1:50 + 0,05 мл 1% взвеси несенсибилизированных эритроцитов.
Планшет закрывают крышкой и выдерживают при 37 °С 2 ч. Проводят предварительный учет результатов. Затем оставляют при комнатной температуре на 20-24 ч и делают окончательное заключение.
2. Учет результатов начинают с контролей. Затем оценивают диагностические реакции по четырехплюсовой системе:
++++ резко положительная реакция; эритроциты покрывают дно лунки в виде перевернутого зонтика с неровными краями;
+++ положительная реакция; эритроциты покрывают дно лунки в виде перевернутого зонтика, в центре которого просматривается небольшое кольцо из эритроцитов, не вступивших в реакцию;
++ положительная реакция; размер перевернутого зонтика небольшой, так как количество скученных эритроцитов невелико; остается значительное количество не склеившихся эритроцитов;
+ отрицательная реакция; эритроциты, не вступившие в агглютинацию, оседают на дно лунки в виде маленького диска (пуговки), вокруг которого незначительный ореол скученных эритроцитов; отрицательная реакция; осадок эритроцитов на дне в виде компактного диска (пуговки).
Титром антител считают разведение сыворотки, в котором РПГА положительна не менее, чем на ++ в самом большом разведении при полном отсутствии гемагглютинации в отрицательных контролях. Однако, так же как и при реакции агглютинации, необходимо проследить за его нарастанием через 10-14 дней.
б) Методика РПГА для обнаружения антигена. Для постановки реакции необходимы:
— исследуемый материал, содержащий антиген;
— эритроцитарный антительный диагностикум;
— изотонический раствор натрия хлорида;
— нормальная сыворотка кролика;
— препараты для постановки контролей (см. ниже);
— планшеты для иммунологических реакций с 96 круглодонными лунками;
— микропипетки.
Диагностикум эритроцитарный антительный выпускают в виде сухой взвеси формалинизированных танизированных эритроцитов барана, сенсибилизированных иммуноглобулином сыворотки. Препарат ампулирован и имеет вид таблетки светло-коричневого цвета, легко растворимой в изотоническом растворе натрия хлорида.
Вместе со специфическим препаратом в коробке имеются контрольные препараты:
— ампула с формалинизированными танизированными, но не сенсибилизированными эритроцитами;
— 10-50% взвесь формалинизированных эритроцитов для адсорбции гетерогенных антител;
— взвесь стандартного антигена, гомологичного иммуноглобулинам сыворотки, использованной для сенсибилизации эритроцитов;
— иммунная сыворотка к искомому антигену.
1. Техника постановки. Предварительно из инактивированной нормальной сыворотки кролика в разведении 1:100 готовят раствор для разведения. Для этого в пробирку наливают 9,9 мл изотонического раствора натрия хлорида, к которому добавляют 0,1 мл сыворотки кролика. Этот раствор вносят микропипетками в дозе 0,05 мл в 7 лунок первого ряда планшета для иммунологических реакций. Затем в первую лунку добавляют 0,05 мл искомого антигена в разведении 1:5, получают разведение 1:10. Из этой лунки 0,05 мл переносят во вторую лунку, перемешивают, получают разведение 1:20 и так последовательно делают разведения антигена с шагом 2. Из последней лунки диагностического ряда выливают 0,05 мл раствора, чтобы объем антигена был одинаков во всех лунках. После этого в каждую лунку вносят по 0,05 мл эритроцитарного антителъного диагностикума в концентрации, указанной в наставлении к препарату. Это приводит к дополнительному разведению антигена, и в первой лунке конечное разведение антигена составит 1:20, во второй — 1:40, в третьей— 1:80 и т.д.
— положительный контроль — стандартный известный антиген в рабочем разведении + эритроцитарный антительный диагностикум;
— отрицательный контроль — аналогичный исследуемому материалу субстрат, но заведомо не содержащий антигена + эритроцитарный антительный диагностикум;
— отрицательный контроль — исследуемый материал + десенсибилизированные эритроциты для исключения неспецифического склеивания эритроцитов. При исследовании крови этот контроль может оказаться положительным. В этом случае перед постановкой реакции проводят сорбцию исследуемого образца десенсибилизированными эритроцитами.
2. Учет результатов проводят так же, как и в предыдущем методе. Титром антигена считают дозу, с которой эритроцитарный антительный диагностикум реагирует в реакции гемагглютинации на ++ в самом большом разведении при полном отсутствии гемагглютинации в отрицательном контроле.
в) РПГА для определения классов иммуноглобулинов. РПГА может применяться не только для обнаружения и установления титра антител в сыворотке крови, но и для определения их принадлежности к определенному классу иммуноглобулинов (IgM или IgG). Это бывает важно для выявления внутриутробного инфицирования, установления периода развития или рецидива болезни. Дифференцировка макро (IgM)- и микро (IgG) — глобулинов основана на различиях их свойств. Одним из методов является инактивация крупномолекулярных IgM редуцирующими веществами (цистеином или 2-меркаптоэтанолом). При этом происходит разрыв их дисульфидных связей с образованием неактивных субъединиц. Молекулы же IgG не меняют свою структуру и сохраняют антительную активность. Методика с использванием цистеина для этих целей (по Е. В. Чернохвостовой, 1965) описана ниже.
После инкубации сыворотки разводят двукратно и используют в РПГА. В одном ряду лунок ставят реакцию с сывороткой, не обработанной цистеином, в другом — с сывороткой, обработанной цистеином.
2. Учет результатов проводят как обычно по 4-плюсовой системе в обоих рядах лунок.
Если титры антител в обоих рядах совпадают, это свидетельствует о том, что антитела сыворотки относятся к классу IgG. Если же они в ряду, где использовалась сыворотка, обработанная цистеином, ниже в 4 раза и более, чем в ряду, где сыворотка не обрабатывалась цистеином, антитела относятся к классу IgM.
Для определения классов антител аналогичным способом может быть использована и РСК.
Пассивные реакции агглютинации. Непрямые реакции агглютинации. Реакция непрямой, или пассивной, гемагглютинации ( РНГА, РПГА ). Обратная РНГА. Реакция торможения пассивной гемагглютинации ( РТПГА ).
Развернутая реакция агглютинации ( РА ). Ориентировочная реакция агглютинации ( РА ). Реакции прямой гемагглютинации.
Развернутая реакция агглютинации ( РА ). Для определения AT в сыворотке крови больного ставят развёрнутую реакцию агглютинации ( РА ). Для этого к серии разведений сыворотки крови добавляют диагностикум — взвесь убитых микроорганизмов или частицы с сорбированными Аг. Максимальное разведение, дающее агглютинацию Аг, называют титром сыворотки крови.
Разновидности реакции агглютинации ( РА ) для выявления AT — кровяно-капельная проба на туляремию (с нанесением диагностикума на каплю крови и появлением видимых белёсых агглютинатов) и реакция Хаддльсона на бруцеллёз (с нанесением на каплю сыворотки крови диагностикума, окрашенного генциановым фиолетовым).
Ориентировочная реакция агглютинации ( РА )
Для идентификации выделенных микроорганизмов ставят ориентировочную РА на предметных стёклах. Для этого к капле стандартной диагностической антисыворотки (в разведении 1:10, 1:20) добавляют культуру возбудителя. При положительном результате ставят развёрнутую реакцию с увеличивающимися разведениями антисыворотки.
Реакцию считают положительной, если агглютинацию наблюдают в разведениях, близких к титру диагностической сыворотки.
О-Аг. Соматические О-Аг термостабильны и выдерживают кипячение в течение 2 ч. При взаимодействии с AT образуют мелкозернистые агрегаты.
Н-Аг. Н-Аг (жгутиковые) термолабильны и быстро разрушаются при 100 °С, а также под действием этанола. В реакциях с Н-антисывороткой через 2 ч инкубации образуют рыхлые крупные хлопья (образованы бактериями, склеившимися жгутиками).
Vi-Ar брюшнотифозных бактерий относительно термостабилен (выдерживает температуру 60-62 °С в течение 2 ч); при инкубации с Vi-антисывороткой образуется мелкозернистый агглютинат.
Реакции прямой гемагглютинации
Простейшая из подобных реакций — агглютинация эритроцитов, или гемагглютинация, применяемая для определения групп крови в системе AB0. Для определения агглютинации (или её отсутствия) используют стандартные антисыворотки с анти-А и анти-В-агглютининами. Реакция называется прямой, так как исследуемые Аг — естественные компоненты эритроцитов.
Общие с прямой гемагглютинацией механизмы имеет вирусная гемагглютинация. Многие вирусы способны спонтанно агглютинировать эритроциты птиц и млекопитающих, их добавление к суспензии эритроцитов вызывает образование агрегатов из них.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Непрямые (пассивные) реакции агглютинации.
Эти реакции называются непрямыми (пассивными), т.к. при их проведении используют антигены (или антитела), искусственно адсорбированные на поверхности различных корпускулярных частиц.
Реакция непрямой (пассивной) агглютинации основана на способности клеток (эритроцитов) или некоторых химических частиц (латекс) адсорбировать на своей поверхности антигены и гаптены бактерий, антигены вирусов, риккетсий. При этом носитель приобретает новую антигенную специфичность и вступает во взаимодействие с имунными сыворотками, специфичными для адсорбированного антигена.
Для получения сенсибилизированных эритроцитов (эритроцитарных диагностикумов), их обрабатывают танином, что повышает их адсорбционную способность.
Можно адсорбировать на сенсибилизированных эритроцитах не только антигены, но и специфические антитела. Такие препараты называют антительными эритроцитарными диагностикумами. Постановка реакции агглютинации с таким диагностикумом называется обратной РНГА (или РОНГА).
Антигенные и антительные эритроцитарные диагностикумы широко используются для постановки непрямой реакции гемагглютинации.
РНГА обычно ставят на плексигласовых планшетках с лунками. Исследуемую сыворотку предварительно инактивируют при 56°С в течение 30 минут для разрушения комплемента и разводят от 1:10 до 1:12 000 и более, разливают в лунки до 0,5 мл и добавляют по 0,1 мл эритроцитарного диагностикума. Реакцию выдерживают в течение двух часов в термостате и считают положительной, если осадок эритроцитов имеет форму "зонтика" с зубчатыми краями и покрывает почти все дно лунки. При отрицательном результате эритроциты оседают в центре дна лунки в виде компактного диска с ровными краями (см. демонстрацию).
Непрямые варианты реакции агглютинации делают ее более чувствительным методом и расширяют возможности ее применения. Реакции этого типа широко применяются для диагностики инфекционных заболеваний (выявление специфических антител в сыворотке больного при брюшном тифе, туляремии, гриппе, риккетсиозах, хламидиозах), а также для определения гонадотропного гормона в моче при установлении беременности, для выявления лекарственной аллергии, определения поствакцинального иммунитета при дифтерии и т.д.
Реакция преципитации (РП) - осаждение высокодисперсных антигенов (в коллоидном состоянии) - специфическими антителами (преципи-тинами) в присутствии электролита. Выпадение нерастворимого комплекса антиген-антитело в виде осадка наблюдается, если эти ингредиенты находятся в эквивалентных количествах. Антиген в реакция преципитации должен быть прозрачным.
Реакцию преципитации ставят с целью выявления антигена по известной преципитирующей сыворотке, содержащей антитела.
Для приготовления коллоидных антигенов, участвующих в реакции преципитации, используют различные методы их экстракции из исследуемого материала: физические, химические и биологические. Бактериальный антиген может быть получен путем его экстрагирования из чистых культур бактерий, из патологического материала или из объектов внешней среды, обсемененных микробами (диагностика сибирской язвы, чумы, туляремии). В судебно-медицинской практике с помощью реакция преципитации определяют видовую специфичность белка (крови, спермы), в санитарной практике - выявляют фальсификацию пищевых продуктов, в клинической иммунологии - уровень имунноглобулинов в сыворотке крови. Таким образом, знание этой реакции необходимо для врачей многих специальностей.
При постановке РП разводят не сыворотку, а антиген. За титр преципи-тирущей сыворотки принимают то наибольшее разведение антигена, которое при взаимодействии со стандартной иммунной сывороткой вызывает образование видимого преципитата.
Существует несколько вариантов постановки реакции преципитации:
Реакция кольцепреципитации: на слой антисыворотки наслаивают жидкость, содержащую растворимый антиген и через несколько секунд наблюдают образование кольца преципитата. Широкое распространение получила реакция термопреципитации (р.Асколи) на антиген возбудителя сибирской язвы, использующая антигены, экстрагированные кипячением из различного сельскохозяйственного сырья.
Реакция микропреципитации применяют для выявления низких титров антител. При ее постановке в исследуемую сыворотку крови вносят антиген в убывающей концентрации; при отсутствии антител разведение сыворотки крови антиген уменьшает ее оптическую плотность. Однако в присутствии минимальных количеств антител образуются микропреципитаты, повышающие оптическую плотность среды (учет результатов осуществляется нефелометрическим методом).
Реакция флокуляции - это РП в системах токсин-антитоксин или анатоксин-антитоксин. Проявляется появлением хлопьевидного осадка. Реакцию обычно применяют для определения активности антитоксических сывороток.
РП в геле (иммунодиффузия) в различных модификациях: простая иммунодиффузия (по Уанье), встречная иммунодиффузия (по Оухтерлони), радиальная иммунодиффузия (по Манчини).
Методы простой диффузии основаны на способности Аг, внесенного сверху в лунки или пробирки с агаром, диффундировать в гель. При постановке реакций двойной (встречной) диффузии Аг и Ат вносят в отдельные лунки. Обычно методы используют для выявления белковых Аг в различных жидкостях и тканевых экстрактах. Вариантом простой одномерной иммунодиффузии является тест Илека для выявления токсинообразования у возбудителя дифтерии.
Иммуноэлектрофорез. Метод объединяет РП в геле с элетрофорезом. Для этого слой агара наносят на предметное стекло; на его разных краях вырезают две лунки, а в центре - разделяющую их канавку. В лунки вносят смесь Аг и проводят электрофорез в течение 1-2 часов, различные Аг с разной скоростью перемещаются между катодом («старт») и анодом («финиш»). Затем в канавку вносят преципитирующую сыворотку и, в случае положительного результата, в геле образуются зоны преципитации.
Иммунофлюоресцентный метод основан на соединении антигенов со специфическими антителами, меченными флюорохромными красителями, благодаря чему с помощью люминесцентного микроскопа эти антигены (связанные с антителами) выявляются в виде светящихся изображений на несветящемся фоне препарата.
Основная сложность метода заключается в изготовлении люминесци-рующих (флюорохромных) сывороток. Для этого из исходной иммунной сыворотки выделяют и концентрируют глобулиновую фракцию (антитела), которая соединяется с флюорохромом (например, изотиоцианатом или другим хроматографически чистым красителелем).
При проведении исследований применяют прямой и непрямой методы иммунофлюоресценции. При прямом методе готовят препарат, содержащий исследуемые антигены (мазок из патологического материала, крови, отпечаток или срез различных органов и тканей, и др. материалы, содержащие микроорганизмы), фиксируют его жидким фиксатором и обрабатывают специфическим люминесцирующим иммуноглобулином. После инкубации отмытый от избытка иммуноглобулина и высушенный препарат рассматривают в люминесцентный микроскоп, возбуждая свечение ультрафиолетовым светом. Светящиеся изображения антигенов будут наблюдаться только при соответствии их взятому меченому иммунноглобулину.
Прямой метод технически прост и высокоспецифичен, но требует большого набора различных люминесцирующих иммуноглобулинов (на каждый антиген - отдельная специфическая сыворотка).
При непрямом методе препарат, приготовленный таким же образом, обрабатывают обычной (несветящейся) специфической сывороткой (полученной путем иммунизации кролика), промывают буферным раствором и затем заливают люминесцирующую антиглобулиновую сыворотку (содержащую антитела против глобулинов кролика) и снова промывают. При микроскопии видны светящиеся изображения антигена, если он соответствует взятой иммунной сыворотке, так как в этом случае к образовавшемуся комплексу антиген + антитело присоединяется люминесцирующая антиглобулиновая сыворотка. Следовательно, при непрямом методе иммунная сыворотка (в нашем случае кроличья) служит антителом для исследуемого антигена и, в свою очередь, является антигеном для соответствующей антиглобулиновой люминесцирующей сыворотки (содержащую антитела против иммуноглобулинов кролика, меченные флюорохромом). С помощью непрямого метода можно определять также наличие антител в сыворотках.
В практической микробиологии и вирусологии ИФ-метод является методом экспресс-диагностики многих инфекционных заболеваний бактериальной и вирусной природы.
Метод иммобилизации основан на обездвиживании подвижных микроорганизмов под действием специфических антител, например бледных трепонем при диагностике сифилиса.
Метод нейтрализации токсина антитоксином является биологическим методом, так как выполняется на лабораторных животных (чаще всего на мышах) и основан на исчезновении токсических (летальных) свойств исследуемого материала (например, при ботулиническом отравлении, при газовой гангрене) после добавлении к нему специфических антител.
Цели занятия:
1. Изучить механизмы взаимодействия антиген-антитело: принципы и методы постановки реакций агглютинации, преципитации и иммунофлюоресценции.
2. Уметь интерпретировать результаты серологических исследований.
Учебно-целевые задачи:
1. Реакции антиген-антитело: реакции прямой (ориентировочную и развернутую) и непрямой агглютинации (РНГА, РОНГА, р. Кумбса).
2. Реакции преципитации (кольцепреципитации, р.Асколи, микропреципитации, р. флокуляции, р. Манчини).
3. Р.иммобилизации, р. нейтрализации токсина, р. прямой и непрямой иммунофлуоресценции.
1. Учесть и оценить результаты серологических реакций.
1. Постановка реакции агглюцинации на предметном стекле для идентификации неизвестной культуры микробов по антигенным свойствам. Необходимо иметь: диагностическую агглютинирующую сыворотку, испытываемую культуру на МПА, физиологический раствор.
На одну половину предметного стекла нанести каплю диагностической сыворотки в разведении 1/10, на другую - каплю физиологического раствора (контроль). Петлей взять исследуемую культуру с МПА и внести ее сначала в каплю с физиологическим раствором, потом в каплю с иммунной сывороткой. Покачивая стекло, равномерно распределить ингредиенты реакции. Склеивание происходит в течение первых минут наблюдения, когда при покачивании стекла в мутной капле образуются хлопья (зернышки), которые, укрупняясь, перемещаются к периферии. В контрольной капле остается равномерная муть.
2. Поставить развернутую реакцию агглютинации в пробирках в целях установления титра агглютинирующей сыворотки. Необходимо иметь:
• агглютинирующую сыворотку для титрования;
• взвесь убитых микробов (диагностикум), специфичную для данной сыворотки;
Реакция непрямой (пассивной) гемагглютинации (рнга, рпга)
2) для выявления антител в сыворотках больных к этим высокодисперстным веществам и мельчайшим микроорганизмам.
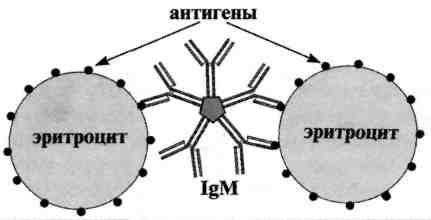
Под непрямой, или пассивной, агглютинацией понимают реакцию, в которой антитела взаимодействуют с антигенами, предварительно адсорбированными на инертных частицах (латекс, целлюлоза, полистерол, оксид бария и др. или эритроциты барана, I(0)-группы крови человека)
В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Сенсибилизированные антигеном эритроциты используют в РПГА как эритроцитарный диагностикум для обнаружения антител (серодиагностика). Если нагрузить эритроциты антителами (эритроцитарный антительный диагностикум), то можно применять для выявления антигенов.
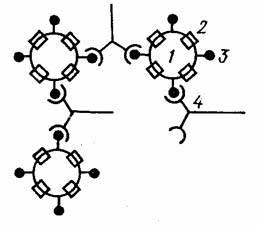
Рис. 3. Схема РПГА: эритроциты (1), нагруженные антигеном (3), связываются специфическими антителами (4).
Постановка. В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят - 0,5 мл заведомо положительной сыворотки и в последнюю 0,5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0,1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном - оседают в виде пуговки или колечка.
Рис.4. Учет РНГА (РПГА).
Учет результатов рнга, поставленной с целью обнаружения ботулотоксина.
Возбудитель ботулизма - Clostridium botulinum вырабатывает токсины семи сероваров (А, B, C, D, E, F, G), однако чаще других встречаются серовары А, В, Е. Все токсины отличаются по антигенным свойствам и могут быть дифференцированы в реакциях типоспецифическими сыворотками. Для этой цели можно поставить реакцию пассивной (непрямой) гемагглютинации с сывороткой больного, в которой предполагается наличие токсина, и эритроцитами, нагруженными антителами антитоксических противоботулинических сывороток типов А, В, Е. Контролем служит нормальная сыворотка.
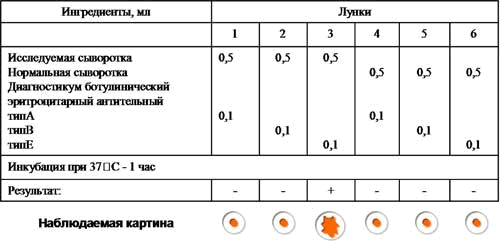
Рис. 3. Постановка и результат РНГА.
Вывод: В сыворотке больного обнаружен ботулотоксин тип Е.
Реакция торможения гемагглютинации (ртга).
Рис. 8. Реакция торможения гемагглютинации (РТГА) (схема).
Принцип реакции основан на способности АТ связывать различные вирусы и нейтрализовать их, лишая возможности агглютинировать эритроциты. Визуально этот эффект и проявляется в «торможении» гемагглютинации. РТГА применяют при диагностике вирусных инфекций для выявления специфических антигемагглютининов и идентификации различных вирусов по их гемагглютининам, проявляющим свойства Аг.
Типирование вируса проводят в реакции РТГА с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса типа А с антигенами H0N1, H1N1, H2N2, H3N2 и другие могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток
Рис. 9. Результаты РТГА при типировании вируса гриппа
Условные обозначения: - торможение гемагглютинации (пуговка) ; - гемагглютинация (зонтик).
Выводы: Исследуемый материал содержит вирус гриппа тип А с антигеном H3N2
2.Реакция гемагглютинации, пассивной гемагглютинации, реакция торможения гемагглютинации, их диагностическое значение при инфекциях.
В основе реакции прямой гемагглютинации лежит способность эритроцитов склеиваться при адсорбции на них определенных антигенов. Поскольку это происходит без участия иммунной сыворотки, реакция не является серологической. В серологических исследованиях реакцию прямой гемагглютинации применяют для выбора рабочего разведения антигена, используемого в реакции торможения гемагглютинации. В основе последней лежит задержка гемагглютинирующего действия антигена специфической сывороткой.
Реакция прямой гемагглютинации (РПГА) используется для выявления поверхностных антигенов микроорганизмов и эритроцитов, а также антител к ним. К стандартным сывороткам, содержащим антитела, добавляют исследуемый материал (кровь). Скорость прямой реакции агглютинации связана с количеством исследуемого материала, количеством и концентрацией сыворотки, температурой окружающей среды.
Реакция непрямой (пассивной) гемагглютинации (РНГА, РПГА) основана на использовании эритроцитов (или латекса) с адсорбированными на их поверхности антигенами или антителами, взаимодействие которых с соответствующими антителами или антигенами сыворотки крови больных вызывает склеивание и выпадение эритроцитов на дно пробирки или ячейки в виде фестончатого осадка.
Компоненты. Для постановки РНГА могут быть использованы эритроциты барана, лошади, кролика, курицы, мыши, человека и другие, которые заготавливают впрок, обрабатывая формалином или глютаральдегидом. Адсорбционная емкость эритроцитов увеличивается при обработке их растворами танина или хлорида хрома.
Антигенами в РНГА могут служить полисахаридные АГ микроорганизмов, экстракты бактериальных вакцин, АГ вирусов и риккетсий, а также другие вещества.
Эритроциты, сенсибилизированные АГ, называются эритроцитарными диагностикумами. Для приготовления эритроцитарного диагностикума чаще всего используют эритроциты барана, обладающие высокой адсорбирующей активностью.
Применение. РНГА применяют для диагностики инфекционных болезней, определения гонадотропного гормона в моче при установлении беременности, для выявления повышенной чувствительности к лекарственным препаратам, гормонам и в некоторых других случаях.
Механизм. Реакция непрямой гемагглютинации (РНГА) отличается значительно более высокой чувствительностью и специфичностью, чем реакция агглютинации. Ее используют для идентификации возбудителя по его антигенной структуре или для индикации и идентификации бактериальных продуктов — токсинов в исследуемом патологическом материале. Соответственно используют стандартные (коммерческие) эритроцитарные антительные диагностикумы, полученные путем адсорбции специфических антител на поверхности танизированных (обработанных танином) эритроцитов. В лунках пластмассовых пластин готовят последовательные разведения исследуемого материала. Затем в каждую лунку вносят одинаковый объем 3 % суспензии нагруженных антителами эритроцитов. При необходимости реакцию ставят параллельно в нескольких рядах лунок с эритроцитами, нагруженными антителами разной групповой специфичности.
Через 2 ч инкубации при 37 °С учитывают результаты, оценивая внешний вид осадка эритроцитов (без встряхивания): при отрицательной реакции появляется осадок в виде компактного.диска или кольца на дне лунки, при положительной реакции — характерный кружевной осадок эритроцитов, тонкая пленка с неровными краями.
Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови.
Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты.
РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных.
Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
Читайте также:
- Внутреннее дренирование общего желчного протока. ХДА - холедохоеюноанастомоз
- Менструальный цикл ( маточный цикл ). Фазы менструального цикла. Менструальная фаза. Пролиферативная фаза менструального цикла.
- Схемы химиотерапии болезни Ходжкина - монохимиотерапия, полихимиотерапия
- Лейкоцитный концентрат. Показания к применению лейкоцитного концентрата
- Диагностика экстравентрикулярной нейроцитомы по КТ, МРТ
