Патогенез поражений пневмококком. Факторы патогенности пневмококка. Капсула пневмококка. Субстанция С пневмококка.
Добавил пользователь Валентин П. Обновлено: 04.01.2026
Возбудителем пневмококковой инфекции является бактерия Streptococcus pneumoniae - диплоидная коккобактерия. Фактором патогенности бактерии пневмококка является капсульный полисахарид (основной антиген, к которому вырабатываются антитела при заболевании пневмококковой инфекцией или здоровом носительстве пневмококка). Исходя из химического строения и антигенных свойств полисахаридной капсулы бактерии, выделяют 93 серотипа S. pneumoniae. Серотип возбудителя во многих случаях определяет тяжесть заболевания.
Пневмококк является обычным представителем микрофлоры слизистой оболочки верхних дыхательных путей человека, и передается, как правило, воздушно-капельн ым путем. Резервуаром и источником возбудителя пневмококковой инфекции является инфицированный человек (больные любой клинической формой и, в первую очередь, здоровые носители). Спектр клинических форм заболевания очень широк, но преобладают заболевания верхних и нижних дыхательных путей.
Уровень носительства S. pneumoniae в человеческой популяции в целом варьирует в зависимости от эпидемических условий от 10% до 80%, а у детей - от 20% до 50%, но в условиях скученности и формирования новых детских коллективов может достигать 80%. Высок уровень носительства пневмококков в детских садах (до 70%), интернатах (до 86%). Дети первых лет жизни являются основными источниками пневмококковой инфекции, заражая окружающих взрослых. Так, при обычной частоте носительства у взрослых в 5-7%, среди проживающих с детьми она может достигать 30%.
Пневмококки 23, 19 и 6 серогрупп часто характеризуются повышенной устойчивостью к пенициллину и другим антибактериальны м препаратам, а также могут обладать полирезистентным и свойствами. Это затрудняет лечение пациентов с пневмококковой инфекцией, требует применения дорогих альтернативных антимикробных средств, увеличивает продолжительност ь госпитализации и медицинские расходы на лечение. Факторами, способствующими распространению антибиотикорезис тентных штаммов является скученность, посещение детских учреждений, отмечена связь между числом детей в группе и частотой выделения таких штаммов.
Различают инвазивные формы пневмококковой инфекции, при которых возбудитель обнаруживается в жидкостях и тканях организма, стерильных в нормальных условиях (кровь, спинномозговая жидкость, перитонеальная и плевральная жидкости и т.п.), и неинвазивные формы, к которым относится "небактериемичес кая" пневмония (при отсутствии возбудителя в крови), острый средний отит, синусит и т.п. К инвазивным формам пневмококковой инфекции относятся менингит, пневмония с бактериемий, септицемия, септический артрит, остеомиелит, перикардит, эндокардит, которые являются наиболее тяжелыми и наиболее исследованными формами пневмококковой инфекции. Выявление и диагностика иных форм пневмококковой инфекции крайне затруднены. Среди инвазивных форм пневмококковой инфекции около 20% случаев составляет пневмококковый менингит.
У детей самыми частыми клиническими формами пневмококковой инфекции являются острый средний отит (до 60%), синуситы (до 45%) и пневмония (до 65-80% случаев). Пневмококковые менингиты составляют 5-26% всех гнойных бактериальных менингитов у детей. Наиболее часто, инвазивными формами пневмококковой инфекции заболевают дети в возрасте от 1 месяца до 2 лет. У детей первого месяца жизни присутствуют материнские антитела против пневмококка, а у детей старше 2 лет успевает развиться приобретенный иммунитет. Дети первых 2 лет жизни не в состоянии вырабатывать антитела на полисахаридные антигены, что делает их практически беззащитными перед возбудителем. Повышенной восприимчивостью к пневмококковой инфекции обладают недоношенные дети, дети с иммунодефицитным и состояниями (в т.ч. ВИЧ-инфицированн ые), с нефротическим синдромом, диабетом, с серповидно-клето чной анемией и перенесшие спленэктомию. Другой группой риска по развитию инвазивных форм и летальных исходов при пневмококковой инфекции являются лица старше 65 лет.
По данным НЦЗД РАМН (2011 г.) у 47% детей младше 5 лет, госпитализирован ных по поводу острой пневмонии, острого гнойного отита и бактериемии из носоглотки высевается пневмококк. Кроме того, у детей до 5 лет острый гнойный отит в 75% случаев ассоциируется с присутствием пневмококка в носоглотке. Косвенно о распространении пневмококковой инфекции можно судить по высокому уровню заболеваемости органов дыхания, которая в структуре первичной заболеваемости детей 0-14 лет, по данным федеральной государственной статистической отчетности, в течение ряда лет занимает лидирующие позиции.
Профилактика направлена на снижение заболеваемости пневмококковой инфекцией, предупреждение генерализованных форм заболевания, снижение показателей инвалидности и смертности среди детей раннего возраста и взрослых. Большую часть пневмококковых заболеваний (до 50%) можно предупредить с помощью вакцинопрофилакт ики. Данные ВОЗ по разным странам убедительно показывают, что специфическая вакцинопрофилакт ика является наиболее доступным и экономичным способом влияния на заболеваемость пневмококковой инфекцией. Неспецифическая профилактика сводится к соблюдению правил личной гигиены и здорового образа жизни.
(c) Управление Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека по Ямало-Ненецкому автономному округу, 2006-2022 г.
Патогенез поражений пневмококком. Факторы патогенности пневмококка. Капсула пневмококка. Субстанция С пневмококка.
Инфекция вызванная пневмококком (Streptococcus pneumoniae): диагностика, лечение, профилактика
Streptococcus pneumoniae (пневмококк) — грамположительный кокк, который при росте на питательных средах образует ланцетовидные пары. Чувствителен к оптохину, подвержен лизису в присутствии солей жёлчи.
При росте на кровяном агаре штаммы пневмококка обычно обладают частичным гемолизом (а-гемолиз), в то же время гемолитическая активность различных штаммов может меняться. Инфекционные заболевания, вызванные пневмококком, — одна из самых распространённых причин смерти пациентов во всём мире. В группу риска входят дети, пожилые пациенты, а также лица с сопутствующими заболеваниями.
Патогенез пневмококковой инфекции (Streptococcus pneumoniae)
Пневмококки окружены полисахаридной капсулой, препятствующей фагоцитозу. Существует более девяноста различных капсульных серотипов возбудителя с различным уровнем патогенности и способностью к инвазии. Полисахарид, входящий в состав капсулы, обладает выраженными антигенными свойствами.
Антитела к капсульным полисахаридам у различных серотипов пневмококка — протективные, в то же время возможны перекрёстные иммунные реакции между различными серотипами. Компоненты клеточной стенки микроорганизма также способны вызывать выраженный воспалительный процесс.
Кроме того, пневмококки имеют несколько факторов адгезии, способствующих прикреплению возбудителя к полисахаридам поверхности клеток, что способствует колонизации организма.
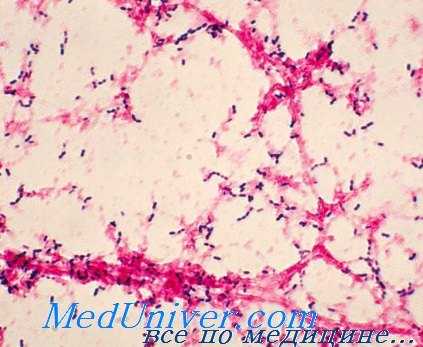
Колонизация пневмококковой инфекции (Streptococcus pneumoniae)
Единственный источник инфекции — человек; носительство обычно протекает бессимптомно. Распределение серотипов зависит от региона, возраста пациента и социальной группы. Наиболее подвержены острой пневмонии дети первого года жизни.
Факторы, предрасполагающие к развитию тяжёлой инфекции: недостаточность комплемента, агаммаглобулинемия, ВИЧ-инфекция, алкоголизм и спленэктомия (удаление селезёнки). Немаловажную роль в развитии инфекционного процесса играют пневмококковые токсины: пневмолизин, нейраминидаза, гиалуронидаза и адгезины (например, пневмококковый поверхностный белок типа А).
Бактерии способны прикрепляться к пневмоцитам и проникать в кровоток, связываясь с рецепторами фактора агрегации тромбоцитов и активируя выработку пневмолизина или комплемент-индуцированного повреждения альвеол.
Клинические признаки инфекции вызванной пневмококком (Streptococcus pneumoniae)
Чаще всего Streptococcus pneumoniae вызывает острые отиты, синуситы и пневмонию. В 50—70% случаев причиной возникновения внебольничной пневмонии становятся пневмококки, при этом у 25—30% пациентов развивается бактериемия.
Прямое или гематогенное распространение инфекции приводит к развитию менингита и реже к целлюлиту, абсцессам, перитониту и эндокардиту. Бактериемия — тяжелейшее осложнение пневмококковой инфекции с высокой летальностью даже при соответствующем лечении.
Пневмококк считают второй из наиболее распространённых причин развития внебольничного менингита у детей, вакци-низированных против Haemophilus influenzae типа В, и основной причиной менингита у пациентов старше сорока лет. При этом отмечают достаточно высокий уровень смертности и вероятности развития осложнений.
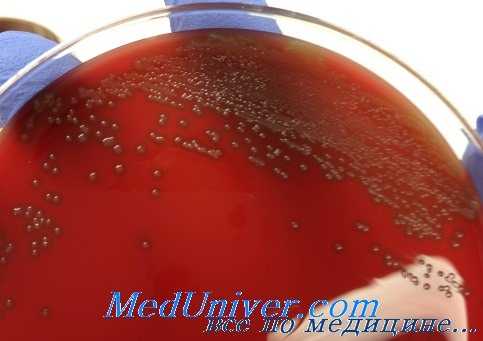
Чувствительность пневмококка (Streptococcus pneumoniae) к антибиотикам
Ранее при лечении пневмококковых инфекций самым эффективным препаратом был пенициллин, но позднее благодаря генетической модификации пенициллинсвязывающего белка большинство штаммов приобрело к нему устойчивость. В настоящее время в клинической практике используют эритромицин, цефалоспорины, тетрациклин, рифампицин и хлорамфеникол, но всё чаще сталкиваются с мультирезистентными штаммами.
Препаратом выбора продолжает оставаться пенициллин, а при менингите, вызванном менее чувствительными штаммами, применяют цефотаксим или цефтриаксон. В случае высокой устойчивости к пенициллину дополнительно назначают гликопептидные препараты (ванкомицин).
Профилактика заболевания вызванной пневмококком (Streptococcus pneumoniae)
Для профилактики пневмококковой инфекции применяют поливалентную капсульную полисахаридную вакцину для профилактики пневмококковых инфекций, эффективную при назначении пациентам в зрелом возрасте и менее действенную у лиц со сниженным иммунитетом и детей младше двух лет.
Недавно созданная конъюгированная вакцина обладает достаточно высокой иммуностимулирующей способностью у детей младшего возраста.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
- Вернуться в раздел "Микробиология"
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Чувствительность пневмококка к антибактериальным препаратам
Инфекции дыхательных путей (ИДП) являются основной причиной обращаемости за медицинской помощью и обусловливают наибольший объeм амбулаторного потребления антибактериальных препаратов (АБ).
Инфекции дыхательных путей (ИДП) являются основной причиной обращаемости за медицинской помощью и обусловливают наибольший объeм амбулаторного потребления антибактериальных препаратов (АБ). Типичными возбудителями нетяжeлых ИДП являются Haemophilus influenza, Streptococcus pneumoniae и Moraxella catarrhalis. Преобладание пневмококка при внебольничной пневмонии — факт, не вызывающий сомнений. В то же время при остром риносинусите и обострении хронической обструктивной болезни лeгких (хроническом обструктивном бронхите) пневмококк уступает этиологическую нишу грамотрицательным микроорганизмам, в том числе продуцирующим бета-лактамазы H. influenzae и M. catarrhalis. Очевидно, что на фоне неблагоприятной эпидемиологической обстановки для лечения указанной патологии обосновано применение препаратов, обладающих как высоким антигемофильным, так и антипневмококковым потенциалом.
В данном случае оправдано применение пероральных цефалоспоринов и ингибиторозащищeнных аминопенициллинов (ИЗА), устойчивых к действию гидролитических ферментов. Однако ситуация с эмпирическим применением ИЗА может осложняться присутствием H. influenzae, устойчивой к ИЗА за счет мутаций пенициллинсвязывающих белков (ПСБ-3; штаммы BLNAR — бета-лактамазонегативные, устойчивые к ампициллину, и BLPAСR — бета-лактамазопозитивные, устойчивые к ко-амоксиклаву).
Известно, что частота BLNAR-фенотипа в Европе достигает 8,8% (от 0% в Нидерландах и Франции (по другим данным 22,8%), до 11,8% в Германии, 12,8% в Польше, 33,9%–66,4% в Испании). Высока распространeнность BLNAR-фенотипа в Азиатско-Тихоокеанском регионе: 29,3% в Южной Корее, 40–65% в Японии. В то же время их распространeнность в России, по данным 6-летней давности, составляет 2,5% в Екатеринбурге и 1,8% в Москве. Вполне вероятно, что для достижения более неблагоприятной ситуации требуется некоторое, судя по мировой динамике, незначительное время. Этот факт определяет крайнюю необходимость оценки перспектив применения анти-BLNAR препаратов, в том числе цефиксима.
Цефиксим (CFX), пероральный цефалоспорин III поколения, в последние годы широко используется при лечении внебольничных ИДП, так как удовлетворяет вышеперечисленным требованиям. Универсально высокая активность против грамотрицательных бактерий, в том числе синтезирующих бета-лактамазы H. influenzae, M. catarrhalis, Escherichia coli и Klebsiella pneumoniae, а также против устойчивой к ко-амоксиклаву H. influenza определяет его эффективность при нетяжeлых ИДП: остром риносинусите, остром среднем отите и обострении хронической обструктивной болезни лeгких (оХОБЛ).
Поскольку одним из возбудителей перечисленных ИДП является S. pneumoniae, для безопасного применения CFX необходим постоянный мониторинг чувствительности клинических штаммов возбудителя.
Целью настоящего исследования явилась оценка чувствительности внебольничных штаммов S. pneumoniae к CFM и другим пероральным АБ, традиционно применяемым на амбулаторном этапе оказания медицинской помощи.
Материал и методы
Штаммы получены в 2005–2006 гг. от пациентов с нетяжeлыми ИДП в возрасте 18–60 лет. Условием включения являлось отсутствие в анамнезе предшествующей госпитализации и проведения антибактериальной терапии (АТ) в предшествующие 3 мес. От каждого пациента исследован штамм, полученный до начала АТ. Хранение и тестирование выделенных культур методом микроразведений в бульоне выполнено в соответствии с рекомендациями Института клинических и лабораторных стандартов США (Clinical and Laboratory Standards Institute) CLSI 2007 и по критериям Британского общества по антимикробной химиотерапии (BSAC), согласно которым к чувствительным отнесены штаммы с МПК ≤ 1 мкг/мл, к устойчивым — ≥ 4 мкг/мл.
Результаты исследования и обсуждение
Отобрано 250 респираторных штаммов S. pneumoniae. Структура клинического материала и обобщенные результаты определения чувствительности S. pneumoniae представлены в табл., распределение минимальных подавляющих концентраций цефиксима — на рис. 1.
Наблюдаемое с течением времени повышение резистентности S. pneumoniae к АБ определяет необходимость проведения систематического микробиологического мониторинга. Поскольку бета-лактамные антибиотики составляют основу терапии респираторных, в том числе пневмококковых инфекций, распространение резистентных штаммов оказывает существенное влияние на выбор АБ для эмпирической терапии.
На настоящий момент география распространенности устойчивых к АБ пневмококков не однозначна. Наибольшую актуальность устойчивость пневмококков приобрела в странах Юго-Восточной Азии, в ряде стран Европы (Испания, Франция). С другой стороны, существуют страны с низким уровнем пенициллинорезистентности, особенно высокой степени (R ≥ 2 мг/л). К ним традиционно относят Германию, Великобританию и Россию. По данным нашего исследования пневмококк характеризовался высокой чувствительностью к амоксициллину. В то же время данный препарат, как показано в ряде исследований, обеспечивает минимальный безинфекционный интервал при хроническом обструктивном бронхите, что ограничивает его применение при данной патологии. Аналогичные результаты, при коррекции на современные критерии CLSI, приводятся в исследовании Pegas.
Цефиксим, пероральный цефалоспорин III поколения, характеризуется крайне высокой бактерицидной активностью против грамотрицательных микроорганизмов, преобладающих при обострениях ХОБЛ, остром среднем отите и остром риносинусите. По антигемофильной активности практически не уступает респираторным фторхинолонам; его активность в 32 раза превышает таковую цефуроксима и в 128 раз цефаклора — распространенных в амбулаторной практике цефалоспоринов, в том числе используемых при внебольничной пневмонии.
Известно, что CFX эффективно подавляет жизнедеятельность чувствительных к пенициллину штаммов пневмококка, преобладающих в России. Активность CFX в отношении пневмококка, одного из потенциальных респираторных возбудителей, по результатам нашего исследования может быть оценена как высокая. При анализе распределения МПК видно, что данный показатель для большинства протестированных штаммов не приближается к верхней границе зоны чувствительности (рис. 1). С клинической точки зрения, практически одинаковый уровень чувствительности пневмококка к CFX, цефуроксиму и макролидам позиционирует его в один ряд с указанными АБ при лечении нетяжeлых случаев острого риносинусита, среднего отита и обострений хронического обструктивного бронхита, вызванных пневмококком. В то же время более высокая антигемофильная активность придаeт препарату определeнные преимущества. Последние, в частности, касаются полноты и длительности эрадикации возбудителя, а значит, и длительности безинфекционного интервала при хроническом обструктивном бронхите.
С фармакодинамической (ФД) точки зрения, эффективность CFX определяется временем, в течение которого концентрация несвязанного препарата в 4–5 раз превышает значение минимальной подавляющей концентрации (МПК) в очаге инфекции (fT > МПК). Для оптимального бактерицидного эффекта CFX необходимо, чтобы этот показатель перекрывал интервал между введениями не менее чем на 50–60%. С этой точки зрения препарат, даже при однократном суточном приeме, обеспечивает требуемые показатели в отношении основных возбудителей: Haemophilus spp. (МПК чувствительных штаммов ≤ 1 мкг/мл), чувствительного к пенициллину S. pneumoniae (МПК Ч ≤ 1 мкг/мл) и M. catarrhalis (рис. 1).
Цефиксим продемонстрировал достаточную антипневмококковую активность и в фармакодинамической/фармакокинетической модели. Показано, что симуляция воздействия реально достижимой сывороточной и тканевой концентрацией обеспечивает, к 12 часу, уверенное подавление роста микроорганизмов (рис. 2). В клинической практике это означает купирование инфекционно-воспалительного процесса, в том числе за счeт оптимизации саногенетических процессов на фоне блокированной логарифмической фазы роста бактерий.
Выводы
Среди пациентов с ИДП отмечен высокий, 82% уровень чувствительности пневмококка к цефиксиму, что сравнимо с показателями, выявленными для цефуроксима и макролидов. Выявленное распределение МПК CFX против пневмококка подтверждает возможность однократного суточного приeма препарата.
Применение цефиксима при внебольничных инфекциях, где преобладающими возбудителями являются грамотрицательные микроорганизмы, а роль пневмококка не исключается, является безопасным и эффективным.
Литература
Tristram S. G., Burdach J. G. Effect of cloned inhibitor-resistant TEM beta-lactamases on the susceptibility of Haemophilus influenzae to amoxicillin/clavulanate // J Antimicrob Chemother. Nov 2007; 60 (5):1 151–1154.
Farrell D. J., Couturier C. European survey of antibacterial activity against H. influenzae from 2006–2007: focus on fluoroquinolones [P2067] // Clin Microbiol Infect. 2008; 14 (Suppl. 7).
Alou L., Gimenez M. J,. Sevillano D. et al. Are beta-lactam breakpoints adequate to define non-susceptibility for all Haemophilus influenzae resistance phenotypes from a pharmacodynamic point of view? // The Journal of antimicrobial chemotherapy. Apr 2007; 59 (4): 652–657.
Dabernat H., Seguy M., Faucon G., Delmas C. Epidemiology of Haemophilus influenzae strains collected in 2004 in France and in vitro assessment of their susceptibility to antibiotics // Med Mal Infect. Jun 2007; 37 (6): 320–324.
5. Skoczynska A., Kadlubowski M., Wasko II., Fiett J., Hryniewicz W. Resistance patterns of selected respiratory tract pathogens in Poland // Clin Microbiol Infect. Apr 2007;13 (4): 377–383.
Jansen W. T., Verel A., Beitsma M., Verhoef J., Milatovic D. Longitudinal European surveillance study of antibiotic resistance of Haemophilus influenzae // The Journal of antimicrobial chemotherapy. Oct 2006;
58 (4): 873–877.
Garcia-Cobos S., Campos J., Lazaro E. et al. Ampicillin-resistant non-beta-lactamase-producing Haemophilus influenzae in Spain: recent emergence of clonal isolates with increased resistance to cefotaxime and cefixime // Antimicrobial agents and chemotherapy. Jul 2007; 51 (7): 2564–2573.
Kim II. S., Ki C. S., Kim S. et al. Diversity of ampicillin resistance genes and antimicrobial susceptibility patterns in Haemophilus influenzae strains isolated in Korea // Antimicrobial agents and chemotherapy. Feb 2007;51 (2): 453–460.
Hotomi M., Fujihara K., Billal D. S. et al. Genetic Characteristics and Clonal Dissemination of
Hasegawa K., Kobayashi R., Takada E. et al. High prevalence of type b beta-lactamase-non-producing ampicillin-resistant Haemophilus influenzae in meningitis: the situation in Japan where Hib vaccine has not been introduced // The Journal of antimicrobial chemotherapy. Jun 2006; 57 (6): 1077–1082.
Боронина Л. Г., Блинова С. М. Антибиотикорезистентность штаммов Н. influenzae, выделенных в Екатеринбурге в 2000–2005 гг. у детей с инфекцией различной локализации // Клиническая микробиология и антимикробная химиотерапия. 2007; 9 (2): 187–192.
Филимонова О. Ю., Грудинина С. А., Сидоренко С. В. et al. Антибиотикорезистентность штаммов Haemophilus influenzae, выделенных в Москве с 2002 по 2004 гг. // Антибиотики и химиотерапия. 2004; 49 (12): 14–20.
Clinical and Laboratory Standards Institute. Performance Standards for Antimicrobial Susceptibility Testing; Seventeenth Informational Supplement. CLSI document M100-S17 [ISBN 1–56238–625–5]. Clinical and Laboratory Standards Institute, 940 West Valley Road, Suite 1400, Wayne, Pennsylvania 19087–1898 USA, 2007.
Козлов Р. С., Сивая О. В., Шпынев К. В. et al. Антибиотикорезистентность Streptococcus pneumoniae в России в 1999–2005 гг.: результаты многоцентровых проспективных исследований ПеГАС-I и ПеГАС-II // Клиническая микробиология и антимикробная химиотерапия. 2006; 8 (1): 33–47.
Jansen W. T. M., Verel A., Beitsma M., Verhoef J., Milatovic D. Longitudinal European surveillance study of antibiotic resistance of Haemophilus influenzae // Journal of Antimicrobial Chemotherapy. 2006;
58 (4): 873–877.
16. Fenoll A., Robledo O., Lerma M. et al. [Activity of cefpodoxime and other oral beta-lactams against Haemophilus influenzae and Streptococcus pneumoniae with different susceptibilities to penicillin] // Rev Esp Quimioter. Mar 2006; 19 (1): 39–44.
Craig W. A., Ebert S. C. Killing and regrowth of bacteria in vitro: a review // Scand J Infect Dis Suppl. 1990; 74: 63–70.
Liu P., Rand K. H., Obermann B., Derendorf H. Pharmacokinetic-pharmacodynamic modelling of antibacterial activity of cefpodoxime and cefixime in in vitro kinetic models // International journal of antimicrobial agents. Feb 2005; 25 (2): 120–129.
Nakamura T., Takahashi H. Antibacterial activity of oral cephems against various clinically isolated strains and evaluation of efficacy based on the pharmacokinetics/pharmacodynamics theory // The Japanese journal of antibiotics. Dec 2004; 57 (6): 465–474.
И. А. Гучев, кандидат медицинских наук 421 Военный госпиталь Московского военного округа, Московская область
Пневмококковый менингит. Проблема высокой летальности
Пневмококковый менингит (ПМ) отличается тяжелым течением, высокими показателями летальности, развитием осложнений. Рассмотрены особенности заболевания, обусловленные низкой биодоступностью возбудителя, и подходы к лечению. Указаны основные направления сов
Pneumococcal meningitis (PM) is distinguished by severe clinical course, high indices of mortality, development of complications. Characteristics of the disease conditioned by low availability of the agent and approaches to the treatment were considered. Main directions of PM therapy improvement were stated.
Пневмококковый менингит (ПМ) по данным бактериологических исследований занимает второе, после менингококкового менингита (ММ), место в этиологической структуре бактериальных гнойных менингитов (БГМ). Так, в РФ удельный вес ПМ среди других гнойных менингитов составляет 9,5–26%, в г. Москве за период 2005–2011 гг. — от 10,4% до 21% [1–5]. Учитывая то, что ПМ не входит в РФ в число инфекционных заболеваний, подлежащих официальной регистрации, а также то, что частота бактериологического подтверждения диагноза БГМ составляет по РФ от 16% до 38%, истинная заболеваемость и смертность, а также многие актуальные аспекты патогенеза, клиники и лечения ПМ изучены недостаточно [6–11].
ПМ отличается тяжелым течением, высокими показателями летальности, развитием осложнений, нередко приводящих к инвалидизации больных [4, 12–14]. Особенности ПМ обусловлены свойствами возбудителя и характером патологического процесса. Наиболее контрастно эти различия видны при сравнении с ММ. Основными факторами патогенности пневмококка являются капсула и тейхоевая кислота клеточной стенки. Капсула препятствует фагоцитозу, поэтому в патологическом материале пневмококк всегда располагается внеклеточно. Таким образом, при пневмококковой инфекции фагоцитоз не выполняет своей роли — самого раннего механизма защиты при бактериальных инфекциях. Тейхоевая кислота взаимодействует с С-реактивным белком и таким образом инициирует активацию системы комплемента и продукцию медиаторов острой фазы воспаления. Это сопровождается резким повышением сосудистой проницаемости и формированием экссудата с высоким содержанием фибриногена, который в результате активации системы гемостаза образует сгустки фибрина. В их толще пневмококк не доступен действию антител против антигенов его капсулы, которые являются основным фактором защиты при пневмококковой инфекции. При менингококковой инфекции капсула менингококка не препятствует его фагоцитозу, поэтому менингококк располагается внутриклеточно, в цитоплазме лейкоцитов, причем, как было установлено нами иммунофлюоресцентным методом на раннем этапе инфекции, при низком содержании липополисахарида (ЛПС) фагоцитоз является завершенным и только при потреблении миелопероксидазы лейкоцитов становится незавершенным, а при потреблении компонентов системы комплемента при фульминантных формах менингококковой инфекции вообще подавляется. Основной фактор патогенности менингококка — ЛПС — является мощным инициатором системного воспаления, обладает высокой фибринолитической активностью, поэтому значительного образования фибрина не происходит и менингококк более доступен действию факторов защиты и тяжесть течения инфекционного процесса в большей степени обусловлена токсикозом, вплоть до развития инфекционно-токсического шока (ИТШ) [14, 15]. В связи с подавлением фагоцитоза пневмококк из оболочек мозга рано проникает по периваскулярным пространствам в вещество мозга. Экссудат формируется непосредственно на поверхности мозга, и, в отличие от ММ, при ПМ уже в ранние сроки развивается картина менингоэнцефалита с выраженным отеком-набуханием головного мозга (ОНГМ), снижением мозгового кровотока и повреждением вещества мозга (рис. 1).
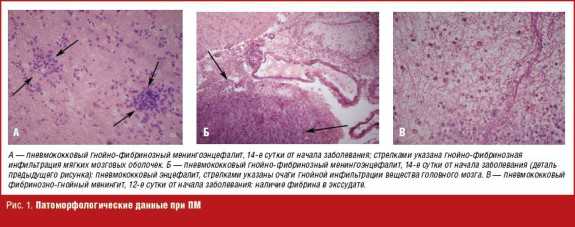
В то же время лихорадочно-интоксикационный синдром и поражение центральной нервной системы (ЦНС), свойственные менингококковой инфекции, при ПМ развиваются не столь бурно, как при ММ, примерно у половины больных развитию ПМ предшествует риносинусит, отит, пневмония, поэтому больные госпитализируются позже, что также отрицательно влияет на эффективность лечения. Так, при ММ больные госпитализируются в среднем через 1,7 ± 0,3 суток от начала болезни, при ПМ через 3,4 ± 0,4 суток (р < 0,01).
До разработки методов этиотропной терапии летальность при ММ была близка к 50%, а при ПМ составляла почти 100%, однако применение сульфаниламидов, а затем антибиотиков не привело при ПМ к столь впечатляющим, как при ММ, результатам. Показатели летальности при БГМ в зависимости от возраста пациента, клинических форм болезни и от этиологического агента в развитых странах составляют в среднем 3–19%, а в развивающихся — от 37% до 69%. По нашим данным (проанализированы 1876 историй болезни больных ММ и 384 истории болезни ПМ) за последние 40 лет летальность при ПМ снизилась с 27,6% до 17,9% за счет внедрения методов реанимации и интенсивной терапии. За тот же период времени летальность при ММ снизилась с 9,8% до 4,2%, однако при ММ летальность в основном связана с ИТШ, а менингит является причиной летальных исходов примерно у 1 из 10 умерших. При ПМ около 45% больным требуется оказание помощи в условиях отделения реанимации и интенсивной терапии [1, 16, 17].
Как уже говорилось, высокая летальность при ПМ обусловлена тяжестью поражения головного мозга, что видно при сравнении симптоматики с ММ в табл. 1.
Основной причиной этих различий является низкая биодоступность возбудителя при ПМ, что подтверждается исследованиями динамики уровня лактата СМЖ, наиболее информативного показателя биологической активности возбудителя, так как лактат является продуктом анаэробного гликолиза [19, 20]. Данные об уровне лактата СМЖ у 28 больных ПМ и 50 больных ММ представлены на рис. 2.
Как видно из рис. 2, при ПМ уровень лактата не снижается на 4–7 дни лечения, а на 2–3 неделе значительно превышает норму, в то время как при ММ наблюдается быстрое и резкое снижение уровня лактата и на 2–3 неделе он достигает референсного значения. Низкая доступность пневмококка обусловлена двумя факторами: 1) снижением мозгового кровотока в результате резко выраженного ОНГМ и уменьшения вследствие этого пассажа антибиотиков через гематоэнцефалический барьер, а также наличием зон бионедоступности возбудителя: очагов размягчения мозгового вещества, гематом, и особенно наличием фибринозно-гнойного экссудата на поверхности и в оболочках мозга, что хорошо подтверждается патоморфологическими данными (рис. 1) и исследованиями концентрации Д-димера фибрина (ДДФ) в СМЖ, который является основным продуктом фибринолиза и наиболее информативным показателем наличия фибринового сгустка в исследуемом субстрате [11, 21]. Результаты определения ДДФ в СМЖ у 28 больных ПМ и 49 больных ММ представлены на рис. 3.
При ПМ фибринолиз длительно находится на высоком уровне без тенденции к снижению, что говорит о сохранении большого количества фибрина в поздние сроки и хорошо соотносится с патоморфологической картиной ПМ. Следует также остановиться на значительном различии уровня летальности при симптоматическом лечении ММ и ПМ, что может быть связано с низкой эффективностью естественных факторов саногенеза. Как говорилось, при ПМ по сравнению с ММ имеет место более слабая лейкоцитарная реакция, отсутствует фагоцитоз. В отечественной и зарубежной литературе широко представлены работы об особенностях иммунопатогенеза БГМ [3, 10, 14, 22). Установленно значительное снижение фагоцитарной активности нейтрофилов, дефицит компонентов комплемента, клеток С0З+, С04+, С08+, что указывает на важную роль в патогенезе ПМ нарушения иммунного гомеостаза с депрессией местного и системного иммунитета. Нами исследованы показатели местного иммунитета в СМЖ. В табл. 2 представлены наиболее существенные различия показателей иммунитета у 22 больных ПМ и 36 больных ММ.
Как видно из табл. 1, при ПМ провоспалительная активность в СМЖ ниже. Снижение ИРИ за счет меньшей пролиферации Т-хелперов, снижения местной продукции иммуноглобулинов также может способствовать более тяжелому течению болезни. Представленные данные указывают на основные направления совершенствования терапии ПМ. Во-первых, учитывая низкую биодоступность возбудителя, следует использовать препараты, хорошо проникающие через гематоэнцефалический барьер (фторхинолоны, меропенем) или позволяющие использование сверхвысоких доз (бензилпенициллин до 500–1,0 мкл/кг массы, меропенем 6 г в сутки), при низкой проницаемости сочетать внутривенное и эндолюмбальное введение препарата (ванкомицин). Во-вторых, даже при отсутствии явного клинического эффекта не производить замены другим препаратом в течение 5–7 суток. Абсолютное показание для смены препарата — устойчивость к нему возбудителя, выявленная при определении чувствительности данного штамма возбудителя. В-третьих, при чувствительности возбудителя к применяемому препарату и отсутствии явного эффекта следует дополнительно назначить второй препарат из группы альтернативных или резервных препаратов. В-четвертых, отказаться от применения кортикостероидов, так как они снижают пассаж антибиотиков через гематоэнцефалический барьер. Важнейшее значение имеет раннее применение искусственной вентиляции легких до развития гипоксемии, по клиническим показаниям: глубокие расстройства сознания, судороги, снижение биоэлектрической активности мозга. Необходимо также применение препаратов, улучшающих мозговой кровоток (пентоксифиллин и др.). Необходимо проведение целенаправленных исследований о влиянии средств патогенетической терапии на проницаемость гематоэнцефалического барьера для антибиотиков, повышение биодоступности возбудителя, использование фибринолитиков, препаратов, активизирующих местные факторы саногенеза. Наконец, следует учитывать, что при наличии гнойного очага (отит, синусит и др.) необходима его экстренная хирургическая санация.
Литература
- Венгеров Ю. Я., Ченцов В. Б., Нагибина М. В. и соавт. Современные принципы диагностики и лечения больных БГМ // Consilium medicum. Хирургия (приложение), 2009, № 1, с. 26–38.
- Ералиева Л. Т. Ронколейкин в терапии гнойных бактериальных менингитов // Цитокины и воспаление. 2009, № 2, с. 11–19.
- Зенькова С. К., Семенов В. М., Скворцова В. В. Эпидемиологическая особенность гнойных менингитов и менингоэнцефалитов не менингококковой этиологии. В кн.: Актуальные аспекты военной медицины. Сб. научных трудов главного военно-медицинского клинического центра «ГВКГ» Украины. Киев, 2010, с. 147–152.
- Мартынова А. В., Туркутюков В. Б. Эпидемиологический анализ заболеваемости инвазивными и неинвазивными формами пневмококковых инфекций в различных группах населения // Вестник Российской АМН. 2007, № 9, с. 12–16.
- Kaplan S. L. Management of pneumococcal meningitis // Pediatr Infect Dis J. 2002. Vol. 21. № 6. P. 589–91; discussion P. 613–614.
- Белошицкий Г. В., Королева И. С., Кошкина Н. А. Менингиты пневмококковой этиологии в Российской Федерации. В кн.: Актуальные проблемы менингококковой инфекции и гнойных бактериальных менингитов. М., 2008, с. 15–16.
- Брико Н. И. Распространенность и возможности профилактики пневмококковой инфекции в мире и России. Бюллетень «Вакцинация». Пневмококковая инфекция. 2009, № 2.
- Шишов А. С., Григоревская У. Б., Гурьянов А. В. и др. Некоторые клинические особенности бактериальных инфекций с синдромом гнойного менингита // Журн. неврол. и психиат. 2011; 111: 4: 90–95.
- Tebruegge M., Curtis N. Epidemiology, etiology, pathogenesis, and diagnosis of recurrent bacterial meningitis // Clinical Microbiology Reviews. 2008, 21 (3): 519–537.
- Van de Beek D., de Gans J., Tunkel A. R., Wijdicks E. F. Community-acquired bacterial meningitis in adults // The New England Journal of Medicine. 2006, 354 (1): 44–53.
- Weisfelt M. et al. Procoagulant and fibrinolytic activity in cerebrospinal fluid from adults with bacterial meningitis // Journ. of Infection. 2007. Vol. 54, iss. 6. P. 545–550.
- Платонов А. Е., Николаев М. К. и др. Заболеваемость гнойными менингитами у детей в возрасте до 5 лет в регионах России // Жур. эпидемиология и инфекционные болезни. 2007, № 3, с. 11.
- Thabet F., Tilouche S., Tabarki B., Amri F. et al. Pneumococcal meningitis mortality in children. Prognostic factors in a series of 73 cases // Arch de Pediatric. 2007; 14: 334–337.
- Scheld W. M., Koedel U., Nathan B., Pfister H. W. Pathophysiology of bacterial meningitis: mechanisms of neuronal injury // J Infect Dis. 2002. Vol. 186. P. 225–533.
- Поздеев О. К. Медицинская микробиология / Под ред. В. И. Покровского. 2-е изд., испр. М.: Геотар-Мед. 2004, 768 с.
- Chavez-Bueno S., Mc. Cracken G. H. Bacterial meningitis in children // Pediatr. Clin. North Am. 2005. Vol. 52. P. 795–810.
- Pollard R. F., Pace D. Pneumococcal meningitis in children: prognostic indicators and outcome // Arch Dis Chil. 2007. Vol. 92. P. 909–915.
- Davis. L. E., Greenlee J. E. Pneumococcal meningitis: antibiotics essential but insufficient // Brain. 2003, May 1, 126 (5): 1013–1014.
- Венгеров Ю. Я., Нагибина М. В. и др. Клиническое значение лактат-ацидоза при гнойных менингитах // Клиническая медицина. 2008. Т. 86. № 10. С. 43–46.
- Венгеров Ю. Я., Нагибина М. В., Свистунова Т. С., Молотилова Т. Н. и др. Ликворологические исследования при нейроинфекциях. Материалы 1-го Всероссийского конгресса по инфекционным болезням «Инфекционные болезни» 2009, т. 7, пр. № 1, с. 41–42.
- Гильманов А. Ж. Д-димер: что? Как? У кого? С какой целью? // Клинико-лаб. консилиум. 2009. № 6 (31). С. 38–46.
- Лесков В. П., Чередееев А. Н., Горлина Н. К., Новоженов В. Г. В кн.: Клиническая иммунология для врачей. М., 2005. 144 с.
Ю. Я. Венгеров*, доктор медицинских наук, профессор
М. В. Нагибина*, кандидат медицинских наук
Е. П. Михалинова*
С. Е. Раздобарина*
Т. Н. Молотилова**, кандидат медицинских наук
Ю. Г. Пархоменко**, доктор медицинских наук, профессор
Н. В. Мозгалева**
Т. Ю. Смирнова**
Т. С. Свистунова**, кандидат медицинских наук
* ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, ** ГКУЗ ИКБ № 2 ДЗМ, Москва
Пневмококковая инфекция
Пневмококковая инфекция - группа инфекционных заболеваний человека, вызываемых пневмококком, имеющих всеобщую распространенность, поражающих преимущественно детское население и проявляющиеся разнообразными симптомами с возможным развитием менингита , пневмонии , сепсиса .
Возбудитель - пневмококк или Streptococcus pneumoniae. Пневмококки малоустойчивы во внешней среде. Погибают от действия обычных дезинфицирующих средств, при t - 600 погибают в течение 10 минут. Однако устойчивы к высушиванию. В высушенной мокроте сохраняют жизнеспособность в течение 2х месяцев.
На сегодня существует большая проблема устойчивости пневмококков к ряду антибактериальных препаратов, что создает дополнительные сложности в лечении заболевания.
Причины возникновения пневмококковой инфекции
Источником инфекции являются: 1) больные клинически выраженной формой болезни, 2) носители пневмококков.
Основной механизм заражения - аэрогенный, а путь - воздушно-капельный. Инфицирование происходит при чихании, кашле, разговоре с источником инфекции. Наиболее подвержены заражению лица, находящиеся в непосредственном контакте с источником инфекции (при чихании и кашле - это аэрозольное облако 3 метра в диаметре).
Восприимчивость человека к пневмококковым инфекциям высокая. Возможны семейные вспышки и вспышки в детских коллективах.
Группы риска заражения:
1) Дети до 2х лет, иммунные клетки которых не способны бороться с возбудителем. Дети первого полугодия жизни имеют материнские антитела, количество которых спустя 6 мес. жизни сильно снижается, в связи с чем увеличивается риск развития инфекции.
2) Дети и взрослые с иммунодефицитом (хронические заболевания органов дыхания, сердечнососудистой системы, сахарный диабет, почечная недостаточность, цирроз печени; ВИЧ-инфекция, онкологические болезни, заболевания крови).
3) Возрастной иммунодефицит (лица преклонного возраста старше 65 лет).
4) Лица с табачной и алкогольной зависимостью.
Симптомы пневмококковой инфекции
Инкубационный период (с момента заражения до развития болезни) - от 1 до 3х дней.
Проявления болезни: 1) Пневмококковая пневмония (воспаление легких)
2) Пневмококковый менингит (воспаление мягкой мозговой оболочки)
3) Пневмококковый отит (воспаление среднего уха)
4) Пневмококковый сепсис (заражение крови)
Пневмококковая пневмония
Пневмококковый менингит
Пневмококковый менингит начинается остро с повышения температуры тела до 40°, появляется диффузная головная боль распирающего характера. У большинства больных несколько позже присоединяются многократная рвота, повышенная чувствительность ко всем видам раздражителей. В течение первых 12-24 часов от начала заболевания менингитом формируется развернутая картина менингеального и общемозгового синдромов. Появляются и быстро нарастают менингеальные симптомы. Сознание сначала сохранено, а затем сменяется состоянием оглушенности, стопора, комы.
Пневмококковый отит
Пневмококковый отит характеризуется температурой, болью в области уха, гиперакузией (повышением чувствительности к слуховым раздражителям).
Пневмококковый сепсис
Пневмококковый сепсис проявляется инфекционно-токсическим синдромом (температура, слабость, головные боли), увеличением селезенки (что больной часто не чувствует), симптомы поражения различных органов и систем (легких, сердца, кишечника, почек, мозговых оболочек).
Осложнения пневмококковой инфекции
Осложнения связаны с развитием той или иной клинической формы заболевания. При развитии пневмонии стоит опасаться острой дыхательной недостаточности, сердечной недостаточности. При менингите - отек головного мозга с опасностью синдрома вклинения (остановка сердечной и легочной деятельности). В случае сепсиса летальность достигает до 50% и можно ожидать любого из осложнений.
После перенесенной пневмококковой инфекции формируется малонапряженный, кратковременный, типоспецифический иммунитет, который не защищает от повторного заражения другим серотипом пневмококка.
Профилактика пневмококковой инфекции
1) Специфическая - вакцинация детей раннего возраста.
Существует две вакцины для проведения иммунизации: Превенар-13 и Пневмо 23.
Превенар-13 используется для вакцинации детей с 2х месяцев до 5 лет, а Пневмо-23 с 2х лет и старше. Вакцины не содержат возбудителей, а содержат очищенные полисахариды наиболее часто встречаемых типов пневмококков. Кроме того, введение вакцины имеет лечебный эффект в виде санации от пневмококка дыхательных путей и снижения числа носителей пневмококка.
2) Неспецифическая (изоляция больных, поддержание иммунитета, витаминопрофилактика, своевременное лечение ОРЗ, занятия спортом, закаливание).
Читайте также:
- Ведение пациентов с почечной недостаточностью. Ведение пациента с острым тубулярным некрозом.
- Больной с воспалением. Доказательство в медицине.
- Суставы, кости при гемофилии - лучевая диагностика
- Вертельные и подвертельные переломы бедра. Диагностика и лечение
- Распространенность протезных стоматитов. Стоматиты без видимых проявлений
