Больной с воспалением. Доказательство в медицине.
Добавил пользователь Владимир З. Обновлено: 17.01.2026
Какова связь маркеров системного воспаления и ИБС? Какие выделяют фракции липопротеинов? Диагностика, лечение и профилактика атеросклероза остаются важнейшей задачей современной медицины, от решения которой во многом зависит успех борьбы с такими забо
Какова связь маркеров системного воспаления и ИБС?
Какие выделяют фракции липопротеинов?
Диагностика, лечение и профилактика атеросклероза остаются важнейшей задачей современной медицины, от решения которой во многом зависит успех борьбы с такими заболеваниями, как инфаркт, инсульт и другие сердечно-сосудистые осложнения. Доказанная в ходе Фрамингамского исследования, проведенного в начале 60-х годов, взаимосвязь между нарушениями липидного обмена и развитием атеросклероза, в частности коронарной (ишемической) болезни сердца, была подтверждена во многих последующих работах.
В настоящее время выявлен целый ряд факторов риска развития атеросклероза и ишемической болезни сердца (ИБС), к которым относятся:
- нарушения липидного обмена;
- артериальная гипертензия;
- курение;
- избыточная масса тела;
- наследственность;
- нарушение толерантности к углеводам;
- мужской пол;
- повышение уровня маркеров, указывающих на наличие воспалительных изменений.
У одного пациента чаще всего выявляются два или более фактора риска. При этом, даже если каждый в отдельности показатель увеличен незначительно, но налицо два-три или более факторов риска, то вероятность развития сердечно-сосудистых заболеваний возрастает в геометрической прогрессии [1].
В практике для оценки этого суммарного риска используются рекомендованные Европейским обществом кардиологов таблицы, в которых учитываются такие факторы, как пол пациента, курение, возраст, уровень АД, уровень холестерина. Эти показатели выражаются в процентах и указывают на вероятность развития осложнений ИБС или летального исхода за десять лет. Оценка этого суммарного риска является решающей для определения тактики профилактических и лечебных мероприятий. В качестве величины, указывающей на необходимость активных профилактических и лечебных мероприятий, принят риск в 20% за десять лет. Особенно важное значение эти факторы риска приобретают у пациентов, уже страдающих ИБС.
К сожалению, в таблицах не могут быть учтены все факторы риска. При наличии этих факторов у больных с сахарным диабетом еще более возрастает опасность развития осложнений. До сих пор нет полной определенности относительно значения таких факторов, как гиподинамия, возраст больных. В ходе исследования LA-VA Study (Los-Angeles Veteran Administration Dietary Study) проводилось лечение энтеросорбентом холестирамином в сочетании с ниацином (лекарственной формой никотиновой кислоты с медленным высвобождением) на фоне строгой гипохолестериновой диеты. На протяжении восьми лет было выявлено снижение смертности у лиц моложе 65 лет, тогда как у лиц старше 70 лет эффект отсутствовал. Многие исследователи по-разному оценивают значимость дислипидемии как одного из важнейших факторов риска сердечно-сосудистых заболеваний у пациентов старше 80 лет. Исследования эффективности гипохолестеринемической терапии в этой возрастной группе проводятся в настоящее время.
В последнее время большое значение придается наличию маркеров, указывающих на воспалительные изменения. Классические патофизиологические исследования продемонстрировали присутствие воспалительных клеток, таких как моноциты, макрофаги и Т-лимфоциты, на всех стадиях развития атеросклероза. Эти морфологические изменения предшествовали дисфункции эндотелиальных клеток, вызывая адгезию молекул при взаимодействии с воспалительными клетками.
В последние годы доказано, что появление маркеров системного воспаления, таких как СРБ (С-реактивный белок), фибриноген и др., предшествует развитию сердечно-сосудистых осложнений [6, 7]. Эти изменения могут выявляться и у больных с нестабильной стенокардией еще до развития очаговых изменений миокарда. Их наличие у больных с высоким уровнем общего холестерина (ОХС) и холестерина липопротеинов низкой плотности (ХС-ЛПНП) резко повышает риск возникновения осложнений. Исследование ЕСАТ (European Concerted Action on Thrombosis and Disabilities Angina Pectoris Study) продемонстрировало увеличение риска развития сердечно-сосудистых осложнений у больных со стабильной стенокардией и высоким уровнем СРБ по сравнению с аналогичными больными и низким уровнем СРБ [5]. По данным Berk, у 90% больных с нестабильным течением стенокардии был выявлен повышенный уровень СРБ, а при стабильной стенокардии этот показатель оказался повышен только у 13% больных [4]. Liuzzo показал, что у больных с нестабильной стенокардией и повышенным уровнем СРБ чаще наблюдались ишемические атаки, такие пациенты нуждались в хирургическом лечении и у них в большем проценте случаев развился острый инфаркт миокарда (ОИМ), чем у аналогичной группы больных с нестабильной стенокардией и пониженным уровнем СРБ [8]. В ходе проведенного в 1998 году исследования SHHS (Scottish Heart Health Study) на примере почти 10 тыс. пациентов была доказана тесная взаимосвязь повышенного уровня фибриногена плазмы крови с развитием ИБС и смертностью от сердечно-сосудистых заболеваний [10]. Возможно, именно эти изменения помогут объяснить случаи развития атеросклероза у больных с нормальными показателями ОХС и ХС-ЛПНП.
Для более адекватного анализа нарушений липидного обмена важно оценивать не только уровень ОХС в крови, но и уровень ХС-ЛПНП, холестерина липопротеинов высокой плотности (ХС-ЛПВП), их соотношение, индекс атерогенности, уровень триглицеридов (ТГ), а также уровень Апо-белков А и В, от которых зависит транспортная функция липопротеинов. По своим физическим свойствам липопротеины плазмы крови подразделяются на следующие фракции: хиломикроны, липопротеины очень низкой плотности (ЛПОНП), липопротеины промежуточной плотности (ЛППП), ЛПНП, ЛПВП.
Индекс атерогенности определяется как отношение разности ОХС и ХС-ЛПВП к ХС-ЛПВП. Еще более важным является определение уровня не липопротеинов, а Апо-белков, входящих в их состав. Однако в настоящее время эти методы только начинают внедряться в клиническую практику. Нормальные показатели уровня основных липидов представлены в табл. 1.
Для удобства запоминания нормальных показателей можно использовать правило один-два-три-четыре-пять, в котором:
- менее 5 — уровень общего холестерина;
- менее 4 — индекс атерогенности;
- менее 3 — уровень ХС-ЛПНП;
- менее 2 — уровень ТГ;
- более 1 — уровень ХС-ЛПВП.
Данные нормативы, кроме индекса атерогенности, представлены в ммоль/л. В литературе также встречаются измерения показателей холестерина и триглицеридов в мг/дл. Для перевода мг/дл в ммоль/л необходимо величину, измеряемую в мг/дл, разделить на 38,7 (для холестерина) и на 88,5 (для триглицеридов).
Однако в практической медицине у большинства больных с ИБС или с многочисленными факторами риска развернутое исследование липидного профиля не проводится или проводится не в полном объеме. Так, количество больных с ИБС, у которых исследовался липидный профиль, в США в 1999 году составило всего 44% (из 48 586 больных); целевой уровень ХС-ЛПНП менее 100 ммоль/л (100 мг/дл), рекомендованный Американской ассоциацией кардиологов, был достигнут лишь у 25% этих больных [9]. Достижение данного уровня всего у одной четверти больных демонстрирует отсутствие настороженности и недооценку важности значения своевременной коррекции этих показателей. Мы не располагаем аналогичными данными по России, но трудно себе представить, чтобы результат оказался более обнадеживающим.
Крайне важным, на наш взгляд, является отношение к нормативным показателям. Описываемой во многих руководствах и учебниках тактики, предусматривающей назначение пациентам с гиперхолестеринемией немедикаментозного лечения в течение двух месяцев с последующим повторным исследованием липидограммы, следует придерживаться лишь в случаях, когда речь идет о первичной профилактике ИБС или больных ИБС со стабильным течением стенокардии. В случаях выраженной дислипидемии, сочетающейся с клинической картиной прогрессирующего течения стенокардии и/или изменениями при функциональных пробах, необходимо проводить быстрое и достаточно агрессивное лечение. Соглашаясь с важностью проведения немедикаментозного лечения у данного контингента больных в полном объеме, мы вынуждены акцентировать внимание на необходимости одновременного начала лекарственной терапии. При выраженной гиперхолестеринемии у таких больных возлагать надежды на эффективность немедикаментозного лечения означает упустить время и подвергнуть больного дополнительному риску. То же можно сказать о медикаментозном лечении гипохолестеринемическими средствами у больных с острым коронарным синдромом (нестабильной стенокардией и Q-необразующим ИМ) при нормальных или незначительно повышенных уровнях ОХ и ХС-ЛПНП. Это объясняется тем, что статины обладают не только гипохолестеринемическим действием. Так, у пациентов с нестабильной стенокардией понижение уровня ОХ при терапии статинами сопровождалось улучшением эндотелиальной функции сосудов, отмечавшимся через шесть недель (Dupurs J. et al, 1999) [11].
В зависимости от повышения той или иной фракции холестерина и/или триглицеридов выделяют пять типов дислипидемий (по Фридриксону) [2]. Классификация ВОЗ с предположительной степенью риска развития атеросклероза, основанная на классификации Фридриксона, представлена в табл. 2.
Наиболее атерогенны, опасны в плане развития сердечно-сосудистых заболеваний и широко распространены дислипидемии IIА, IIБ и IV типа. Если невозможно провести развернутый анализ липидограммы, эти типы дислипидемий можно выявить и путем определения только ХС и ТГ.
Данные, позволяющие выявить тип дислипидемий по уровню этих показателей, представлены в табл. 3.
Эта классификация, достаточно простая и понятная для клиницистов, все же имеет ряд недостатков. Так, в нее не вошел ХС-ЛПВП, значение которого для решения вопроса о тактике лечения и прогнозе является крайне важным.
Не менее значимым представляется и определение причин возникновения дислипидемии, которые подразделяются на первичные и вторичные [3].
Первичные гиперхолестеринемии обусловлены наследственными нарушениями липидного обмена. При семейной гиперхолестеринемии по наследству передаются «дефектные» гены, ответственные за синтез рецепторов к ЛПНП. При гомозиготной форме синтез рецепторов полностью нарушен. Это приводит к невозможности захвата ЛПНП и быстрому накоплению их в крови. Для этой формы характерны клинические проявления уже в раннем детстве, она сопровождается развитием сосудистых осложнений и образованием сухожильных ксантом. При гетерозиготной форме количество рецепторов значительно снижено, но они все-таки имеются, поэтому заболевание развивается медленнее и атерогенные осложнения проявляются к 25-30 годам. Это чаще всего IIA тип дислипидемии со значительным повышением уровня ОХ, ХС-ЛПНП и нормальным уровнем ТГ. В клинической картине у таких больных часто встречаются ксантомы и ксантелазмы. Также весьма распространена в этой группе семейная комбинированная и полигенная гиперхолестеринемия. Семейная гиперлипидемия III типа встречается значительно реже. Случаи семейной гиперальфахолестеринемии обычно не сопровождаются развитием атеросклеротических заболеваний и не представляют угрозы для больного.
Вторичные дислипидемии встречаются значительно чаще. Они либо обусловлены нарушением питания, когда имеет место избыточное потребление пищи, богатой холестерином, либо возникают в результате таких заболеваний, как гипотиреоз, нефротический синдром, подагра, сахарный диабет, ожирение и др. Нарушения липидного обмена могут возникнуть или усугубиться на фоне лечения других заболеваний такими препаратами, как тиазидовые диуретики, иммуносупрессоры. Роль b-блокаторов ограничивается повышением уровня ТГ и некоторым снижением уровня ХС-ЛПВП. Отрицательное проатерогенное действие при этом значительно уступает положительному эффекту b-блокаторов как антиишемических, антиаритмических и гипотензивных средств [3].
Дислипидемии являются одной из наиболее важных причин развития атеросклероза, поэтому их своевременная диагностика и правильное лечение могут замедлить процесс развития атеросклероза и уменьшить риск сердечно-сосудистых осложнений.
Литература
1. Либов И. А., Черкесова С. В., Ройтман А. П. Современные аспекты дислипопротеинемий и практические подходы к их лечению // Московский медицинский журнал. № 3. 1998. С. 34-37.
2. Томпсон Г. Р. Руководство по гиперлипидемии. MSD, 1990.
3. Шпектор А. В., Васильева Е. Ю. Кардиология: ключи к диагнозу. Видар, 1996, с. 295-309.
4. Berk B. C., Weintraub W. S., Alexander R. W. Elevation of C-reactive protein in «activ» coronary artery disease // Am. J. Cardiol. 1990: 98: 2219-2222.
5. Haverkate F., Thompson S. G., Pyke S. D. M. et al, for the European Concerted Action on Thrombosis and Disabilities Angina Pectoris Study Group. Prodaction of C-reactive protein and risk of coronary events in stable and unstable angina // Lancet. 1997; 349: 462-466.
Больной с воспалением. Доказательство в медицине.
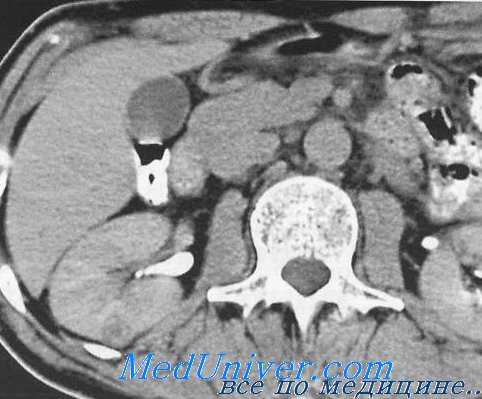
Абдоминальная компьютерная томография. Предостережения при обследовании хирургических больных.
Использование компьютерной томографии (КТ) в диагностике острого живота остается предметом споров. Пока КТ не входит в алгоритм обследования большинства пациентов с острыми болями в животе, однако новая технология — спиральная КТ, когда она доступна для срочных исследований, обладает большой разрешающей способностью и представляет определенный соблазн для не очень опытных клиницистов.
Особенно это касается острого дивертикулита. Если клинические проявления местного перитонита в левом нижнем квадранте живота идентифицированы, то начинают лечение с консервативных мер. КТ может показать воспалительный процесс и даже околокишечный гнойник, но не поможет отличить дивертикулит от перфорации опухоли толстой кишки. Во всяком случае в подобных клинических ситуациях КТ не является обязательным исследованием, так как независимо от результатов КТ большинство хирургов начинают лечение с внутривенного введения антибиотиков.
Истинное значение компьютерной томографии, когда она действительно может сыграть решающую роль, проявляется в «клинических головоломках». Нередко хирург встречается с острой болью в животе, которая никак не укладывается в ситуации, описанные в предыдущей главе. При вполне очевидном плохом состоянии больного диагноз остается неясным. Порой острая внутрибрюшная патология может быть заподозрена у пациента в бессознательном состоянии. В этих обстоятельствах КТ может очень помочь в разрешении абдоминальной проблемы и даже исключить ее (абсолютно нормальная КТ). Это исследование часто показано больным после тупой (закрытой) травмы живота), оно играет определенную роль в послеоперационном периоде. Избирательное использование КТ в других обстоятельствах рассмотрено в последующих главах.
Предостережения при обследовании хирургических больных
У большинства больных с острыми болями в животе излишние дополнительные исследования связаны лишь с материальными затратами и потерей времени. Однако в двух случаях такие ненужные исследования нередко оказываются роковыми.
• Острая мезентериальная ишемия — настолько угрожающее жизни состояние, что никак не может рассматриваться в рамках клинических ситуаций, описанных в соответствующей статье. По этой причине, а также вследствие того, что возможности спасения жизнеспособных кишок очень ограничены, вы обязаны постоянно держать в уме этот диагноз. Лучшим шансом для спасения таких больных будет подтверждение диагноза соответствующими объективными средствами и прежде всего — мезентериальной ангиографией. Нет необходимости подчёркивать, что если у пациента картина диффузного перитонита, нужды в каких-либо дополнительных исследованиях нет, следующим шагом должна быть экстренная лапаротомия. Наиболее трагической ошибкой для этих больных является неспособность даже опытных клиницистов нацелить свое внимание на ургентную ангиографию; вместо этого пациента посылают на длинную се-pию не имеющих к нему прямого отношения исследований, и в результате возможности для спасения ишемизированного кишечника оказываются утраченными.
• Еще одним примером, когда злоупотребление диагностическими исследованиями нередко ведет к летальному исходу, является разрыв аневризмы брюшной аорты. Разорвавшаяся аневризма брюшной аорты может проявляться не болями в животе и шоком, а просто сильными болями в спине, к тому же она может не пальпироваться у полных больных. Когда вероятность разрыва напряженной аневризмы возрастает у больного со стабильной гемодинамикой, показано только одно вспомогательное исследование — ургентная КТ брюшной полости. К сожалению, больные часто проводят несколько часов в приемном отделении в ожидании неуместных анализов крови и медленно продвигаясь от обзорной рентгеноскопии(графии) брюшной полости (которая обычно ничего не дает) к УЗИ (которое выявляет аневризму, но часто не распознает разрыва), они долго ждут ненужный контрастный материал для заполнения кишечника, чтобы КТ-изображение было более качественным. Трагическим исходом этого промедления нередко становится гемодинамическии коллапс перед абдоминальной КТ или в процессе ее выполнения.
- Вернуться в оглавление раздела "Неотложная хирургия."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Воспалительные заболевания кишечника. Проблемы дифференциальной диагностики и лечения
Для цитирования: Хавкин А.И., Рачкова Н.С. Воспалительные заболевания кишечника. Проблемы дифференциальной диагностики и лечения. РМЖ. 2006;3:154.
В группу ВЗК объединены два заболевания – болезнь Крона и неспецифический язвенный колит (НЯК). Для этих заболеваний характерны различная распространенность патологического процесса в ЖКТ, разная глубина поражения слизистой оболочки кишки, определенные морфологические признаки, а также различное течение и прогноз. Несмотря на это некоторые сходные особенности, такие как общность патогенетических механизмов развития этих заболеваний, и вследствие этого единые подходы к лечению, а также сходные клинические проявления позволяют объединять эти два заболевания в одну группу.
Эпидемиология НЯК и болезни Крона очень схожи. При обоих заболеваниях наиболее низкая распространенность наблюдается в африканских и азиатских странах. Частота язвенного колита в России составляет 20 на100 000 населения (из них около 10% – дети), а болезни Крона 3,5 на 100 000 (20-25% дети). В США распространенность НЯК у детей в возрасте 10 – 19 лет составляет 2 на 100 000 населения. Распространенность в Великобритании и Швеции возросла вдвое, достигнув 16,6 на 100 000.
Этиология и патогенез ВЗК до настоящего времени до конца не определены. При ВЗК возникает иммунопатологический процесс в слизистой оболочке ЖКТ, при БК в любом его отделе и при неспецифическом язвенном колите только в толстой кишке. В качестве триггеров обсуждается роль некоторых вирусов, бактерий. В настоящее время доказана роль CARD15/NOD2 гена в предрасположенности к развитию БК. При этом показано, что активизация CARD15, возникающая под воздействием компонентов бактериальной стенки, вызывает активацию провоспалительных молекул.
Диагностика ВЗК очень сложна. В среднем на установление диагноза уходит около 5 лет. Диагноз ВЗК основывается на клинических данных и данных обязательных обследований, включающих рентгенологическое, эндоскопическое и гистологическое исследования.
Одним из важных этапов дифференциальной диагностики является исключение кишечных инфекций, паразитов. Обычные кишечные инфекции могут вызывать сходные клинические симптомы (диарея, боли в животе, кровь в стуле), внекишечные проявления (реактивный артрит, узловатая эритема), а также в ряде случаев сходные эндоскопические и гистологические изменения (отек и воспаление слизистой, крипт абсцессы, крипт язвы).
Наиболее часто ВЗК приходится дифференцировать с иерсиниозами, вызываемыми Yersinia Enterocolitica и Yersinia pseudotuberculosis. Иерсиниозы протекают с болями в животе, диарейным синдромом, в ряде случаев наблюдается артралгии, нодозная эритема. У некоторых больных боли в животе локализуются в правой подвздошной области, и наблюдается аппендицитоподобный синдром, обусловленный терминальным илеитом, мезаденитом. При эндоскопическом исследовании выявляются афтоидные и продольные язвы в терминальном отделе подвздошной кишки, слепой и восходящей ободочной кишке. В некоторых случаях иерсиниоз приобретает хроническое течение, имитируя развитие ВЗК. При дифференциальной диагностике используют бактериологический и серологический методы. Возбудитель иерсиниоза выделяется из кала, мочи, крови, гноя, операционного материала. Решающее значение в диагностике имеет нарастание титра антител.
Кампилобатерная инфекция вызывается Campylobacter jejuni и Campylobacter fetus. При кампилобактерной инфекции часто развивается энтерит, энтероколит, сопровождающийся диареей, болями в животе, повышением температуры тела, рвотой. Стул часто с прожилками крови, иногда содержит свежую кровь. Возможно развитие реактивного артрита. Эндоскопическая картина слизистой оболочки прямой и сигмовидной кишки, при кампилобактерной диарее может быть практически такой же, как и при неспецифическом язвенном колите и при болезни Крона.
Диагностика основана на выделении кампилобактеров из фекалий больного, а также на определении в крови специфических антител в диагностических титрах.
Salmonella обладает выраженной инвазивностью и цитотоксичностью к эпителию кишечника, но может проникать и внутрь эпителиоцитов в собственную пластинку слизистой оболочки. Нередко отмечаются глубокие воспалительные изменения, доходящие до подслизистого слоя. Эндоскопические изменения при сальмонеллезном колите трудно отличить от таковых при НЯК, но при сальмонеллезе часто наблюдается терминальный илеит. В диагностике помогает выделение сальмонеллы из кала, мочи, желчи и нарастание титра антител в крови.
Шигеллез. Симптомами шигеллеза являются, боли в животе, лихорадка, диарея, тенезмы с выделением слизи, крови. При эндоскопическом исследовании больных шигеллезом выявляются выраженное поражение ректосигмоидного отдела толстой кишки и различное по интенсивности поражение проксимальных отделов толстой кишки. Эндоскопическая картина приблизительно в 15% случаев при инфицировании Shigella поражается вся толстая кишка. В некоторых случаях, как правило, у ослабленных детей инфицирование Shigella вызывает затяжное течение заболевания. Шигеллез иногда развивается как суперинфекция при БК.
Escherichia coli. Взаимоотношения E.coli и БК сложные. Кишечную инфекцию, вызываемую штаммом O157:H7 E.coli, крайне трудно отличить клинически и эндоскопически от БК. Дифференциальная диагностика проводится с помощью бактерилогического метода. Однако при иммуногистохимическом исследовании биоптатов кишечника больных с БК на поверхности эпителия, в язвах, крипт абсцессах, в собственной пластинке слизистой в макрофагах часто обнаруживаются E.coli. E.coli часто выделяется из операционного материала от больных БК, кроме того, у больных БК часто выявляются высокие титры антител к различным штаммам E.coli (скорее всего, это связано с развитием суперинфекции).
К более редким патогенам, вызывающим сходную картину заболевания, относятся Entamoeba histolytica, Chlamidia trahomatis, Aeromonas hydrophilia, Blastocystis hominis, Mycobacterium avium intracellulare.
Entamoeba histolytica может вызывать острый амебный колит, напоминающий БК. Однако в ряде случаев у больных БК может происходить суперинфицирование дизентерийной амебой. При этом исследование стула и биоптатов, а также серологические методы могут быть отрицательными. У больных, получающих стероидную терапию, возможно развитие фульминантного колита, связанного с суперинфекцией. В связи с этим некоторыми исследователями считается целесообразным назначать больным БК, получающим стероидную терапию, антибактериальные препараты (например, метранидазол).
Aeromonas hydrophila может вызывать развитие диареи с примесью крови в стуле. Последняя в тяжелых случаях может продолжаться до нескольких недель. При этом во время эндоскопического исследования выявляется хронический сегментарный колит, напоминающий БК. Дифференциальная терапия проводится с помощью бактериологического метода.
Blastocystis hominis в ряде случаев может вызывать терминальный илеит. Основными клиническими проявлениеми бластоцистоза являются диарея и боли в животе. Заболевание развивается как по типу простого энтерита, так и в виде энтероколита или колита.
БК нужно также дифференцировать с абдоминальной формой туберкулеза, такими заболеваниями, как гистоплазмоз, криптококкоз, актиномикоз, базидиоболомикоз.
Цитомегаловирусная инфекция (ЦМВ) у иммунокомпрометированных больных может вызывать поражения кишечника, напоминающие ВЗК. Поражения кишечника часто наблюдаются при врожденной ЦМВ инфекции. Однако чаще ЦМВ наблюдается как оппортунистическая инфекция у больных с НЯК и БК, причем при НЯК цитомегаловирус выявляется чаще, чем при БК.
Большие сложности возникают при дифференцировании БК и неспецифического язвенного колита. Известно, что при БК поражается любой отдел пищеварительного тракта, при НЯК только толстая кишка. Для НЯК характерно поражение прямой кишки. Перианальные поражения, свищи, стриктуры характерны для БК. Рецидив после удаления пораженного сегмента толстой кишки при НЯК встречается крайне редко, тогда как при БК процесс прогрессирует, часто наблюдается рецидив заболевания. Однако основными критериями диагностики являются гистологические изменения. При БК воспалительный процесс начинается в подслизистом слое и распространяется на все слои кишечной стенки, (в отличие от НЯК, при котором воспалительные изменения ограничиваются только слизистой оболочкой). Специфическим гистологическим признаком при БК является формирование эпителиоидных гранулем, состоящих из эпителиоидных и гигантских многоядерных клеток. Однако гранулемы встречаются только в 40-60% случаев. Для ВЗК характерна лимфоплазмоцитарная инфильтрация. Присоединяющееся изъязвление эпителия сопровождается инфильтрацией нейтрофилами. Неравномерная плотность инфильтрата собственной пластинки слизистой оболочки также является характерной для БК. Лимфоидные фолликулы нагнаиваются и изъязвляются. При БК язвы чаще бывают глубокие и узкие, могут проникать до субсерозного слоя и окружающей клетчатки, с формированием свищей и спаек с соседними органами.
В последние годы были выявлены специфические маркеры ВЗК. У больных с НЯК в 70% случаев в крови определяются антинейтрофильные цитоплазматические антитела (рANCA). У больных БК – антитела к грибам Saccharomyces cerevisiae (ASCA).
Неясность этиологии ВЗК обусловливает отсутствие этиотропной терапии. Поэтому в настоящее время проводится патогенетическая и симптоматическая терапия этих заболеваний. Основными целями лечения служат достижение и продление ремиссии заболевания, снижение риска развития осложнений, а также улучшение качества жизни пациентов, страдающих ВЗК.
На сегодняшний день основными классами препаратов, использующимися при лечении ВЗК, являются препараты 5-аминосалициловой кислоты (5-АСК), глюкокортикоиды и цитостатики. В последние годы активно разрабатывается молекулярная терапия, включающая препараты, содержащие антитела к ФНО-a, рекомбинантные гуманизированные антитела к а4-интегрину, антиCD3 моноклональные антитела, ИЛ-10, ИЛ-11. Однако многие из этих препаратов пока ограничены в применении, в связи с тем, что некоторые из них до настоящего времени находятся на стадии клинических испытаний, другие имеют высокую стоимость.
При низкой активности заболевания и для поддержания ремиссии применяют препараты, содержащие месалазин (5-АСК). С чем связана эффективность месалазина, до конца не изучено. Однако установлено, что месалазин способен ингибировать циклооксигеназу и подавлять таким образом продукцию простагландинов. Установлено также, что месалазин подавляет липооксигеназный путь метаболизма арахидоновой кислоты активированных нейтрофилов, ингибирует образование цитокинов (ИЛ-1, ИЛ-6), подавляет рецепторы ИЛ-2. Кроме того, показано, что месалазин стимулирует апоптоз клеток колоректального рака, подавляет митоген-активированную протеинкиназу и уменьшает пролиферацию колоректальной слизистой оболочки у больных со спорадическими полипами. Первым препаратом этой группы был сульфасалазин. Сульфасалазин состоит из двух компонентов – сульфапиридина и месалазина. Сульфапиридин играет роль транспортного агента для месалазина. Расщепление сульфасалазина с высвобождением месалазина происходит только в толстой кишке под действием микрофлоры. Рекомендуемая доза сульфасалазина у детей – 50 мг/кг массы тела, ее можно повысить до 80 мг/кг. Неактивный сульфапиридин не обладает терапевтической активностью, а напротив вызывает ряд побочных эффектов, поэтому предпочтительнее использовать препараты, содержащие только месалазин.
Первый чистый препарат месалазина (Салофальк) был создан в 1984 году, в форме ректальных свечей. В настоящее время Салофальк производится в таблетках, гранулах, свечах, клизмах. Таблетки и гранулы, содержащие месалазин, покрыты кишечнорастворимой оболочкой, которая препятствует высвобождению препарата при рН менее 6,0. В отличие от таблеток, гранулы имеют несколько слоев. Внешняя оболочка, содержащая скользящее вещество (любрикант), облегчает проглатывание и транзит гранул. Кишечнорастворимая пленочная оболочка из эудрагита L обеспечивает высвобождение месалазина в дистальных отделах тонкой кишки. Внутреннее ядро на основе полимерной матрицы обеспечивает пролонгированное высвобождение действующего вещества. Салофальк в таблетках выпускается в дозе 250мг и 500мг, салофальк в гранулах – 500мг и 1000 мг. Рекомендуемая доза у взрослых при активных формах НЯК – 1,5-3 г в сутки, при активной форме БК – 3-4,5 г в сутки. Для профилактики рецидивов ВЗК Салофальк назначается в дозе 1,5 г в сутки. У детей рекомендованная доза Салофалька при активной форме ВЗК – 20 мг на 1 кг массы тела, при необходимости доза может быть повышена до 50 мг/кг. Наличие гранул Салофалька в 1000 мг уменьшает общее число приемов препарата. Преимущество гранул Салофалька перед таблетками состоит также в том, что маленькие размеры гранул не позволяют им задерживаться в желудке, гранулы могут приниматься независимо от приема пищи.
При дистальном колите месалазин (Салофальк) можно применять местно через прямую кишку в свечах (1–2 г/сут) и в виде клизм (2 г ежедневно или 4 г через день).
У больных ВЗК при относительно легком течении и для поддержания ремиссии возможна монотерапия препаратами 5-АСК. При тяжелых и распространенных формах заболевания, при недостаточной эффективности от лечения месалазином следует дополнять кортикостероиды. У пациентов БК, имеющих длительный анамнез заболевания с продолжительной кортикостероидной терапией при предыдущих обострениях, лечение 5-АСК неэффективно.
До настоящего времени кортикостероидная терапия является наиболее эффективным методом лечения острых форм БК. Глюкокортикоиды эффективны при любой локализации процесса. Преднизолон назначают в стандартной дозе 1-2 мг/кг в сутки с постепенным уменьшением и отменой в течение 3-4 месяцев. Пероральный прием глюкокортикоидов приводит к развитию таких побочных эффектов, как диабет, гипертензия, остеопороз и повышенная восприимчивость к инфекциям, а также косметические дефекты. В настоящее время широко используется топический кортикостероид – будесонид (Буденофальк). Буденофальк обладает в пять раз большей активностью, чем преднизолон, а 90% всосавшегося Буденофалька быстро инактивируется в печени, благодаря чему побочные глюкокортикоидные эффекты сводятся к минимуму. Доза будесонида для перорального применения составляет 9 мг в сутки, для поддерживающей терапии 3 и 6 мг через день. В индукции ремиссии Будесонид (буденофальк) лишь на 13% менее эффективен, чем системные кортикостероиды, при этом не вызывает характерных для стероидов побочных эффектов. При тяжелом поражении дистальных отделов толстой кишки применяются традиционные глюкокортикоиды в виде клизм или пены, будесонид в клизмах. Отмена будесонида, как и традиционных форм глюкокортикоидов должна проводиться постепенно. Исследования показали, что применение будесонида (буденофальк) при БК, как и других кортикостероидов в качестве поддерживающей терапии во время ремиссии, удлиняет ремиссию, но не предотвращает появление рецидива.
В случае если длительная кортикостероидная терапия не приводит к ремиссии или в случае возникновения резистентности или непереносимости, в терапии используют иммуносупрессанты. Механизм их действия включает супрессию функции лимфоцитов (преимущественно Т-клеток). При ВЗК используются азатиоприн или его метаболит 6-меркаптопурин. Суточная доза у взрослых составляет 2-3 мг /кг, у детей 1-2 мг/кг. У детей поддерживающая доза назначается в течение 2 лет после последнего рецидива. При НЯК, рефрактерном к лечению кортикостероидами, применяют метотрексат, циклоспорин. Метотрексат обладает выраженной гепатотоксичностью. Применение метортрексата возможно только с подросткового возраста в дозе 25 мг внутримышечно один раз в неделю или перорально 5 мг через день. При стероидорезистентных формах НЯК применяют также циклоспорин в дозе 2 мг/кг. Эффективность циклоспорина при БК очень низкая. В случае развития бактериальных инфекций применяют антибактериальные препараты – ципрофлоксацин, метронидазол. При отсутствии эффекта от консервативного лечения, а также при возникновении осложнений проводится хирургическое лечение.
Имеются данные о повышенном риске развития рака толстой кишки в случае возникновения НЯК в детском и юношеском возрасте, при тотальном колите, а также при продолжительности заболевания более 10 лет. Клинические исследования показали, что регулярный прием месалазина (Салофалька) снижает риск развития рака у больных НЯК.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Воспаление – причины развития воспалительных реакций

Разработчик сайтов, журналист, редактор, дизайнер, программист, копирайтер. Стаж работы — 25 лет. Область интересов: новейшие технологии в медицине, медицинский web-контент, профессиональное фото, видео, web-дизайн. Цели: максимально амбициозные.
- Запись опубликована: 19.07.2020
- Reading time: 2 минут чтения
Воспаление (лат. inflammatio) – это сложный процесс реакции организма на внешний или внутренний повреждающий (болезненный) фактор. Воспаление направлено на устранение этого фактора, восстановление поврежденных тканей и защиту от развития заболеваний.
Таким образом, воспаление выполняет защитную функцию в организме, но только тогда, когда оно острое. Хроническое воспаление перестает быть физиологическим фактором и становится патогеном, ведущим к аутоиммунным заболеваниям и раку.
Воспаление – это естественный процесс, который происходит на определенных этапах. Без воспалительной реакции, которая активирует иммунную систему для борьбы с патогеном, например, вирусом, бактериями, травмированными участками, мы не смогли бы пережить даже самую маленькую инфекцию.
Сложность воспалительного процесса отражается в часто используемых терминах – состояние, процесс или воспалительная реакция.
Симптомы воспаления
Симптомы острого воспаления были впервые описаны римским ученым и энциклопедистом Аврелием Цельсом (25 г. до н.э. – 50 г. н.э.). в единственной работе «Медицина», которая сохранилась до наших дней, он описал четыре основных симптома острого воспаления, которые иногда называют тетрадой Цельса:
- боль (лат. dolor);
- повышенная температура (лат. calor);
- покраснение (лат. rubor);
- отек (лат. tumor).
Пятый признак воспаления – потеря функции и повреждение органов (лат. Functiolaesa) был добавлен немного позже, возможно, греческим врачом и философом Галеном (129-200 н.э).
Покраснение кожи является результатом увеличения кровотока в области, пораженной патогенными микроорганизмами, отек – это результат проникновения белка и клеток из сосудов в ткани – все это вызывает боль. Температура также является следствием увеличения кровотока. В свою очередь, «потеря функции» означает, что орган не функционирует должным образом.
В развитии воспалительной реакции участвуют многие физиологические механизмы, связанные как с клетками – гранулоцитами, моноцитами, тромбоцитами, лимфоцитами Т и В, тучными клетками, эндотелиальными клетками кровеносных сосудов, макрофагами, фибробластами, так и с веществами, выделяемыми ими – медиаторами воспаления. Со временем могут быть поражены целые органы и могут возникнуть системные симптомы – повышение температуры тела, потеря веса, мышечная атрофия, чувство общей слабости.
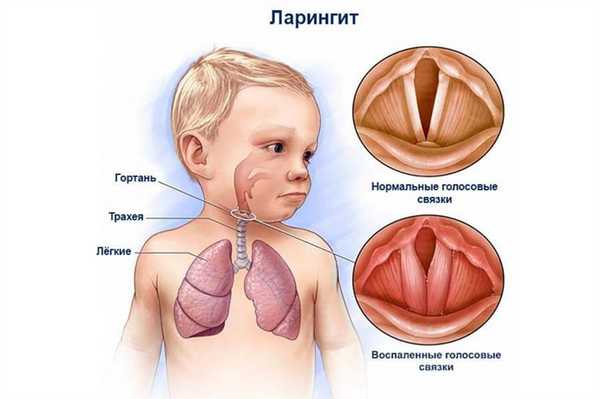
Воспаление при ларингите
Как возникает воспаление?
Чаще всего повреждающий фактор, который инициирует воспалительный процесс, приходит извне. Это может быть:
- физическое повреждение – химическое, тепло или холод, механическая травма;
- биологический агент – бактерии, вирус, чужеродный белок.
Также бывает, что причиной воспаления является процесс, происходящий внутри организма – эмболия артерии, сердечный приступ или развитие рака.
Изменения в кровеносных сосудах всегда являются корнем воспалительной реакции. Сосуды расширяются, и их проницаемость увеличивается. Это приводит к проникновению медиаторов и воспалительных клеток в окружающие ткани.

Составляющие воспаления
Острое воспаление выполняет важную защитную функцию – оно удаляет возбудителя и восстанавливает нормальную функцию органа. Переход острой фазы в хроническую фазу часто связан с потерей контроля организма над воспалительными механизмами и, следовательно, с функциональными нарушениями и даже повреждением пораженной ткани. Этот процесс можно сравнить с превращением острой боли (защитной функции) в хроническую боль, которая становится самой болезнью.
Патогенез воспалительного процесса
Воспалительная реакция неразрывно связана с иммунным ответом. Начинается с контакта патогена со специализированными клетками иммунной системы, так называемыми антигенпрезентирующие клетки. Когда клетки стимулируются, они продуцируют и высвобождают медиаторы воспаления, которые имеют решающее значение для инициации и поддержания воспалительного процесса.
Медиаторы оказывают про-и противовоспалительное действие на клетки-мишени, модулируя течение воспаления. Со временем адаптивная иммунная система (специфическая реакция) также участвует в борьбе с повреждающим фактором. Работа этой системы чрезвычайно точна – взаимодействие лимфоцитов Т и В приводит к выработке специфических антител, которые селективно нейтрализуют возбудителя.
Правильно функционирующая иммунная система эффективно распознает патогены и эффективно уничтожает их, не повреждая свои собственные клетки и ткани. Однако в определенных ситуациях иммунорегуляторные механизмы могут работать с дефектом – возникает воспалительная реакция на аутоантигены.
Это состояние встречается при многих аутоиммунных заболеваниях (диабет 1 типа, ревматоидный артрит, красная волчанка, целиакия, болезнь Хашимото).
Воспаление. Распространение. Последствия. Принципы лечения. Часть 8

- Запись опубликована: 26.11.2020
- Reading time: 4 минут чтения
Воспаление всегда начинается с изменения. Через некоторое время процессы инфильтрации, протеолиза, некроза и синяков уменьшаются или прекращаются, и на первый план выходит регенерация тканей.
Наибольшее повреждение тканей вызывает гнойное воспаление. После эвакуации гноя в тканях остается полость (тканевой дефект), которая постепенно заполняется соединительнотканными элементами – происходит разрастание соединительной ткани.
Разрастанию соединительной ткани в месте воспаления способствует особый материал, присутствующий в повышенных количествах в воспаленных тканях и экссудате, активаторы роста, возникающие в результате процессов изменения, снижение хилона (ингибиторы пролиферации), пролиферация cAMF и слабый ацидоз.
В условиях слабого ацидоза для диссоциации оксигемоглобина на ткани требуется более высокое парциальное давление кислорода, чем обычно – кривая диссоциации Hb02 смещается вправо. Это уже начало следующей фазы – регенерации. Все интенсивно пролиферирующие ткани нуждаются в большом количестве воды, и регенерация соединительной ткани также начинается в гипергидратационных условиях (фаза гипергидратации).
Микрофаги в очаге воспаления постепенно погибают, и начинают преобладать макрофаги. Повышается фагоцитарная активность этих клеток, они фагоцитируют мертвые клетки и другие продукты изменения. В очаге воспаления один тип клеток заменяет другой (микрофаги – макрофаги – фибробласты), каждый из которых выполняет свою функцию, а затем отдает свое место другому типу клеток.
Таким образом, основные изменения соединительной ткани в очаге воспаления – это разрастание макрофагов, фибробластов и гистиоцитов, образование капилляров (2-3 дня) и развитие волокон соединительной ткани (3-6 дней). Дефект ткани постепенно заполняется грануляционной тканью – новой, энергично растущей и богатой сосудами тканью, которая окружает очаг воспаления.
В условиях повышенной активности фагоцитоза, ацидоза, протеолитических и липолитических ферментов уничтожаются микроорганизмы и элементы омертвевшей ткани, ограничивается воспаление, уменьшается экссудация и площадь гиперемии.
После заполнения дефекта ткани кровеносные сосуды и лимфатические сосуды начинают опорожняться (лимфатические сосуды выполняют дренажную функцию для устранения воспалительного отека). Воспалительный отек исчезает, наступает фаза гипогидратации. Происходит регенерация не только соединительной ткани, но и клеток органов и тканей. Однако по мере увеличения числа дифференцированных клеток, интенсивность регенерации снижается.
Если повреждение ткани невелико, регенерация часто бывает полной, тогда как при большом повреждении возникает рубцевание. Клетки высокодифференцированной паренхимы органов (головной мозг, миокард) неспособны к регенерации после травмы. Соединительная ткань часто перерастает в некротическую массу, например, после инфаркта миокарда, плеврита, операций на брюшной полости. Особенно интенсивно разрастается соединительная ткань вокруг инородного тела – вокруг него образуется плотная капсула.
Асептическая рана, края которой соприкасаются, заживает в первую очередь. В этом случае происходит выраженное разрастание макрофагов и интенсивное образование соединительнотканных волокон, которые вместе с эпителиальными клетками замещают фибрин тромба в ране.
Иногда поврежденные клеточные элементы, такие как слизистые оболочки, кожа, способны регенерировать и заполнить дефект определенными тканями, и тогда рана заживает без рубца. Напротив, инфицированные раны, а также асептические раны, если их края не совпадают, заживают вторично, и образуется рубец.
Последствия воспаления
Если регенерация ткани, поврежденной при воспалении, завершена, то функции также полностью восстанавливаются (restitutio ad integrum). Когда определенные ткани заменяются соединительной тканью, функции восстанавливаются только частично (restitutio incpleta). В результате такого воспаления образуется рубе ц, а функции тканей остаются ограниченными (замещение).
Рубец
Большой рубец часто негативно влияет на организм. По мере сокращения рубцовой ткани развивается значительная дисфункция органа или конечности. Спайки и рубцы, например, в брюшной полости после перитонита или хирургического вмешательства, стеноз пищевода и желудка после ожога кислотой или щелочью, деформируют органы и нарушают их функцию. Распространены нарушения движений конечностей из-за воспаления нервов, сухожилий и суставов. Также в паренхиматозных органах (легких, печени, поджелудочной железе, почках) часто возникают тяжелые функциональные нарушения после воспаления.
Процессы изменения, которые убивают высокодифференцированные клетки жизненно важных органов, могут угрожать существованию организма. Очень опасны рубцы, например, после воспаления сердечных клапанов или мозговых оболочек.
Биологическое значение воспаления в организме
Уже И. Мечников доказал, что воспаление, усложняющееся в ходе эволюции, является одним из неспецифических механизмов защиты всех организмов от действия патогенного агента. Даже сегодня воспаление считается типичным патологическим процессом, при котором компоненты повреждения и защиты связаны в неразрывное целое, а также во взаимной борьбе.
Вредные для организма процессы – это ухудшение функции и интоксикация, когда нарушаются функции воспаленного органа (ткани). Например, при воспалении сустава движения в нем болезненны и ограничены или даже невозможны.
Воспаление как защитная реакция организма проявляется по-разному. Уже во время смены высвобождаются биологически активные вещества, которые участвуют в сосудистых реакциях и процессах пролиферации. Спазм сосудов предотвращает дальнейшее распространение инфекционного агента в организме. В условиях венозной гиперемии уменьшается кровоток и лимфоток, поэтому токсические и пирогенные вещества дольше задерживаются в очаге воспаления.
Также важен для защиты воспалительный экссудат.
- Из-за кислой среды экссудат является бактерицидным. Его белки связывают бактериальные токсины.
- Экссудат разжижает и ферментативно расщепляет, препятствуя абсорбции и дальнейшему распространению токсинов в организме.
- Экссудат используется для доставки антител к специфическим антигенам в месте воспаления.
Особое значение имеет фагоцитарная и пролиферативная функция клеток соединительной ткани. Грануляционная ткань , образующаяся в процессе пролиферации, и соединительнотканный барьер изолируют воспаление от окружающих тканей. Благодаря этим защитным механизмам подопытному животному можно вводить токсины в очаге воспаления, но заметной реакции организма не происходит. С другой стороны, в здоровых тканях токсины вызывают у животного значительную реакцию или даже гибель.
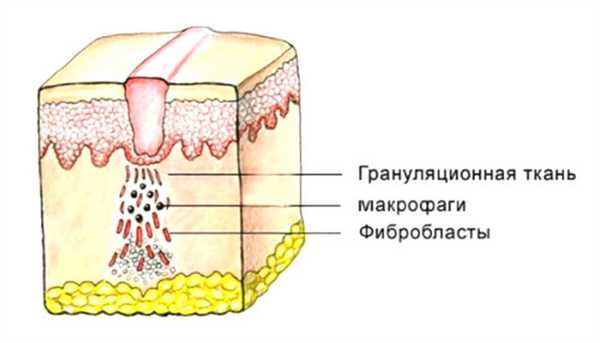
Грануляционная ткань
Как и другие типичные патологические процессы в организме, защитная функция воспаления не безгранична. Если действие вредного агента сильное, защитные реакции могут стать ненормальными, вредными для организма. Например, тяжелый фурункулез, разлитой гнойный перитонит, септическое состояние и т. д. нельзя считать положительной защитной реакцией.
Способность реагировать на действие болезнетворных агентов воспалением – очень важный типичный патологический процесс в организме, нарушение которого может иметь опасные последствия. Эти нарушения могут быть связаны с уменьшением количества нейтрофилов (нейтропения) и проблемами с их функцией.
В свою очередь, наиболее частыми причинами тяжелой нейтропении являются лекарственный агранулоцитоз и лейкоз. В редких случаях возникает так называемая циклическая (периодическая) нейтропения, когда каждые 21 день наблюдается значительное снижение количества нейтрофилов. Эта нейтропения чаще встречается у пациентов с инфекционными кожными заболеваниями, отитом и артритом.
Дисфункция лейкоцитов может включать хемотаксис, эмиграцию и фагоцитоз. Например, нарушения хемотаксиса и эмиграции лейкоцитов возникают при диабете, пародонтите, терапии кортикостероидами и других.
Также описаны многие наследственные дефекты фагоцитарной системы. Некоторые дефекты – это нарушения бактерицидной активности фагоцитов, другие – нарушения подвижности фагоцитов.
- К первой группе относится хронический гранулематоз у детей, в основе которого лежит снижение активности НАДН2-зависимой оксидазы. В результате в клетке не образуется H 2 O 2 и не повреждается мембрана фагоцитирующего объекта. Процесс фагоцитоза не завершается, и из гистиоцитов развиваются гранулемы (чаще всего в легких). Гранулемы разрушаются, лейкоциты и микроорганизмы оставляют очаги воспаления, развивается сепсис.
- Вторая группа наследственных дефектов включает синдром Чедиака-Хигаси. Признаки включают лейкоцитарные аномалии и нарушения пигментации кожи, склонность к рецидивам, гнойные инфекции, анемию, лейкоцитопению, тромбоцитопению и т. д.
Воспаление развивается плохо из-за нарушения фагоцитоза. Снижается сопротивляемость организма инфекции, и ухудшается состояние больного. Например, в случае пониженной реактивности смертность больных пневмонией намного выше.
Принципы противовоспалительной терапии
Поскольку воспаление и часто связанная с ним лихорадка являются защитными, с ними не всегда нужно бороться. Иногда эти типичные патологические процессы изолируют возбудителя болезни, иногда – благотворно влияют на течение некоторых хронических заболеваний. Однако при многих острых воспалительных заболеваниях (фурункулез, тромбофлебит, острый аппендицит, острый панкреатит и т. д.) Необходимо бороться с воспалением, чтобы избежать опасных для организма осложнений.
Воспалительная терапия бывает этиологической и патогенетической.
- Цель этиологической терапии – устранить биологический агент воспаления (антибиотики, противотуберкулезные препараты, терапевтические сыворотки и т. д.) Или подавить действие аллергена.
- Задача патогенетического лечения – предотвратить или полностью заблокировать один из этапов воспалительного патогенеза.
- Противовоспалительные препараты (салицилаты, глюкокортикоиды) стабилизируют лизосомальную мембрану, снижают активность ферментов (трансаминаз, дегидрогеназ, эстераз, протеаз) и тем самым уменьшают образование биологически активных веществ.
- Индометацин подавляет синтез простагландинов. Гиперосмолярные растворы (как местные, так и внутривенные) используются для уменьшения воспалительного отека.
- Глюкокортикоиды подавляют фагоцитоз, пролиферацию клеток и иммунологические процессы. В результате течение воспаления ослабевает и замедляется. Эти препараты широко используются при лечении аллергических воспалений.
Чтобы создать наиболее благоприятные условия для развития воспаления как защитного процесса организма, воспаленным тканям нужен покой. В случае острого воспаления механические движения могут помешать локализации воспаления и способствовать распространению инфекции.
В лечении воспалений играют роль различные тепловые процедуры: они улучшают кровообращение и циркуляцию лимфы в воспаленных тканях и стимулируют экссудацию, тем самым усиливая и ускоряя воспалительные процессы. Холод снижает интенсивность этих процессов.
Основная задача хирургических методов лечения – удаление внутренних ограниченных инфекционных очагов воспаления (флегмонозный отросток, желчный пузырь), а также вскрытие и дренирование гнойной полости (абсцесс, флегмона).
В современной медицине, в том числе при лечении воспалений, успешно применяются каликреин и препараты ингибиторов каликреина.
Ингибиторы протеаз, обладающие широким спектром действия, участвуют в регуляции хининов и фибринолитической системы. Эти ингибиторы играют защитную роль при различных заболеваниях, включая панкреатит. Они препятствуют образованию калькреина и прогрессированию воспаления. Многие ингибиторы каликреина содержатся в бычьей печени, слюнных железах, поджелудочной железе. Препараты-ингибиторы (трасилол, калол, контральтик) используются при лечении острого панкреатита.
Препараты каликреина (падутин, депокаликреин, дилминал D, ангиотропин) расширяют кровеносные сосуды и играют важную роль в лечении облитерирующего эндартериита.
В период разрастания соединительной ткани для борьбы с негативными последствиями рубцевания, особенно контрактур, движения следует выполнять постепенно, увеличивая их амплитуду до максимума.
Читайте также:
- Показания для шва и реконструкции сухожилия трехглавой мышцы
- Признаки болезни Севера
- Зависимость от гашиша-марихуаны (гашишизм) - клиника, лечение
- Замедление кровотока как причина сладжирования. Нарушения коагуляции - тромбогеморрагический синдром
- Дренирование кисты панкреаз. Наружное дренирование псевдокисты поджелудочной железы.
