Патоморфология гипоксии новорожденного. Нарушение зрительного анализатора
Добавил пользователь Евгений Кузнецов Обновлено: 29.01.2026
Патоморфология гипоксии новорожденного. Нарушение зрительного анализатора
Изменения мозга в острый и отдаленный периоды кислородного голодания различны. Если ребенок погибает от асфиксии в первые дни жизни, при макроскопическом исследовании обнаруживают отек мозга, расширение сосудов, переполнение их кровью. Микроскопически — периваскулярный и перицеллюлярный отек, микрогеморрагии. Отек и тканевая гипоксия вызывают различные изменения в тканях мозга: исчезновение нейронов, глиоз, набухание и размягчение тела нервной клетки и ее отростков, растворение нисслевской субстанции. Поэтому в мозге детей, перенесших асфиксию и умерших в более позднем возрасте, обнаруживают дистрофические изменения, вызванные циркуляторными расстройствами: очаговый глиоз, кистозные полости, обызвествление ганглиозных клеток, нарушение процессов миелинизации.
В. A. Benker, J. С. Zarroshe (1962) полагают, что для гипоксии, наиболее характерны размягчение перивентрикулярного белого» вещества и диффузная потеря клеток. Нарушение целостности corona radiata является причиной дефекта полей зрения.
Неврологические проявления у новорожденных зависят от степени тяжести и длительности кислородного голодания при рождении, наличия или отсутствия внутриутробной гипоксии, а также от особенностей формирования нервной системы во внутриутробный период.
Неврологические симптомы у детей, родившихся в асфиксии, условно можно подразделить на две группы. К первой относят локальные признаки, связанные со структурными нарушениями мозга. У новорожденных наиболее четко выявляются неврологические изменения, обусловленные поражением стволовых образований, поскольку к моменту рождения они являются наиболее зрелыми. Другую группу симптомов составляют неспецифические общемозговые нарушения, связанные с расстройством гемо- и ликвородинамики.
Нарушение функции черепномозговых нервов. Поражение черепномозговых нервов у детей, родившихся в асфиксии, наблюдается довольно часто. Оно может быть следствием отека мозга, локальной ишемии, повреждения ядер и нервных стволов.
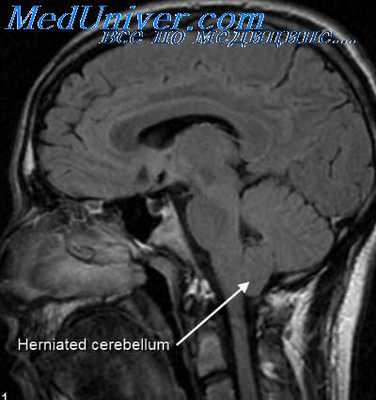
Нарушение зрительного анализатора возникает в результате кровоизлияний в сетчатую оболочку глаза, которые можно обнаружить при офтальмоскопическом обследовании уже в родильном доме. Кровоизлияния, чаще мелкоточечные, располагаются по ходу артериол, реже они бывают крупными и имеют вид полос или пятен. Иногда наблюдаются геморрагии в зрительный нерв. Рассасываются кровоизлияния к концу первой недели жизни, иногда наблюдаются повторные эпизоды на 7—9-й день.
Ретинальные кровоизлияния могут быть причиной снижения зрения, косоглазия, нистагма, дегенеративных изменений в сетчатке.
Глазодвигательные нарушения наблюдаются у 37% детей, родившихся в асфиксии. Они проявляются преимущественно сходящимся косоглазием. Это связано с анатомической локализацией отводящего нерва, который на большом протяжении проходит на основании мозга и чаще травмируется. Реже наблюдается расходящееся косоглазие вследствие поражения глазодвигательного нерва. Косоглазие может быть легким, преходящим, обусловленным общемозговыми нарушениями.
Грубое, постоянно выраженное косоглазие в сочетании с другими неврологическими симптомами свидетельствует о тяжелом поражении нервной системы.
Наряду с косоглазием иногда отмечается смещение глазных яблок вниз (симптом Грефе). Между верхним веком и радужной оболочкой видна широкая полоса склеры. Симптом Грефе указывает на повышение внутричерепного давления.
Анизокория бывает преходящей в результате отека мозга. Постоянная анизокория наблюдается при поражении глазодвигательного нерва, его вегетативных ядер, цилиоспинального центра и связанных с ним симпатических волокон.
Вялая реакция зрачков на свет или ее резкое угнетение в сочетании с миозом или мидриазом бывает при тяжелом поражении мозга с утратой сознания и нарушением жизненно важных функций организма.
Птоз как изолированный признак при асфиксии наблюдается редко. Он входит в симптомокомплекс поражения глазодвигательного нерва или его ядра. В меньшей степени он выражен при синдроме Клода Бернара-Горнера. У новорожденных птоз значительно чаще связан с врожденной аплазией ядер глазодвигательного нерва.
Нистагм у детей, родившихся в асфиксии, может быть горизонтальным, вертикальным и ротаторным. Непостоянный, мелкоразмашистый горизонтальный нистагм, выявляющийся при крайних отведениях глазных яблок, наблюдается при легких степенях асфиксии и прогностически благоприятен. Грубо выраженный постоянный нистагм может быть связан с повреждением вестибулярных ядер ствола, заднего продольного пучка, лабиринтов.
Периферический парез лицевого нерва у детей, родившихся в асфиксии, обусловлен, как правило, его травматическим повреждением при наложении полостных щипцов. При легких парезах мышцы лица страдают минимально, сосание не нарушено. Выраженные парезы сопровождаются асимметрией лица и расстройством акта сосания. Восстановление функции паретичных мышц при травматических повреждениях лицевого нерва наступает обычно в первые 2—3 нед. В редких случаях восстановительный период может быть более длительным. Центральные парезы лицевого нерва при асфиксии наблюдаются редко.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Гипоксия новорожденного
Гипоксия новорожденных не считается отдельным заболеванием, а относится лишь к патологическим состояниям, то есть является проявлением какой-либо врожденной/приобретенной патологии или неблагоприятного течения беременности и родов.
Гипоксия обязательно сопровождает респираторный дистресс-синдром, который часто развивается у недоношенных детей. Причем, чем меньше срок гестации, тем тяжелее проявляется данный синдром.
Итак, гипоксией новорожденного называется кислородное голодание головного мозга, что приводит к его дисфункции, а также другим системным нарушениям. Гипоксия головного мозга представляет огромную опасность для новорожденного и может привести к его инвалидизации и даже гибели.
Причины
Факторы, которые провоцируют развитие гипоксии новорожденного, весьма многочисленны. Условно их можно разделить на 4 большие группы:
Антенатальные причины (действующие во время беременности)
К ним относятся:
- тяжелые соматические болезни матери (сердечно-сосудистая, дыхательная, эндокринная патология),
- хроническая интоксикация беременной (курение, прием алкоголя, употребление наркотиков, профессиональные вредности, нарушенная экология).
Также в этот список входят:
- недоношенная и переношенная беременность, ,
- сильные ярко выраженные анемии,
- кровотечения во время беременности (предлежание, отслойка плаценты),
- внутриутробное инфицирование плода хроническими материнскими инфекциями и перенесенная во время беременности острая инфекция,
- многоводие и маловодие,
- многоплодная беременность.
Кроме того, виной гипоксии могут быть:
- резус-конфликтная беременность и антифосфолипидный синдром,
- перманентная угроза прерывания беременности и развитие фетоплацентарной недостаточности,
- постоянные стрессы, неблагоприятные условия проживания, неполноценное питание.
Интранатальные причины (осложненное течение родов)
В данную группу входят:
- затяжные или наоборот, стремительные роды,
- родовая травма плода (повреждение головного или спинного мозга),
- родостимуляция окситоцином,
- оперативное родоразрешение (наложение акушерских щипцов, кесарево сечение).
Также в данную группу входят:
- падение кровяного давления в родах, и эклампсия в родах,
- отслойка плаценты в родах,
- гипоксия женщины во время общего наркоза,
- разрывы матки,
- аномалии родовой деятельности (дискоординация родовых сил).
Патология со стороны пуповины
- истинные узлы и их затягивание пуповины,
- разрыв пуповинных сосудов,
- обвитие пуповины,
- сжатие пуповины.
Плодовые причины (со стороны плода).
К данным причинам относятся:
- гемолитическая болезнь плода и новорожденного (анемия вследствие гемолиза эритроцитов),
- пороки развития плода (аномалии сердечно-сосудистой и легочной систем),
- инфекционные внутриутробные заболевания,
- кровоизлияния в головной мозг, надпочечники.
Асфиксия новорожденного
Асфиксия, переходящая впоследствии в гипоксию новорожденного развивается в результате закупорки дыхательных путей (заглатывание ребенком околоплодных вод и мекония, закупорка слизью, тугое обвитие пуповины, длительное и проблематичное рождение головки и другие).
Признаки гипоксии. Шкала Апгар
Оценка состояния ребенка проводится сразу после рождения, на первой минуте и спустя 5 минут. С этой целью используют шкалу, разработанную Виржинией Апгар, учитывая и суммируя следующие показатели, каждый из которых оценивается от 0 до 2 баллов:
- окраска кожи;
- частота дыхания;
- рефлекторная активность;
- частота сердечных сокращений;
- тонус мышц.
По полученной сумме баллов определяется отсутствие или наличие гипоксии и ее степень:
Гипоксия легкой степени определяется практически у всех новорожденных на первой минуте жизни и исчезает в течение 5 минут самостоятельно.
Среднетяжелая гипоксия новорожденного требует определенного лечения, состояние ребенка приходит в норму через несколько дней. При тяжелой гипоксии или асфиксии проводятся немедленные реанимационные мероприятия, назначается комплексное лечение и наблюдение за ребенком в дальнейшем.
Клиника гипоксии новорожденного, как правило, ярковыражена и диагноз устанавливается сразу после появления ребенка на свет. К признакам данного состояния относятся тахикардия, с постепенной заменой на брадикардию (менее 100 ударов в минуту), нарушение ритма сокращений сердца, аускультация шумов в сердце, бледность кожи и синюшность носогубного треугольника и конечностей.
Отмечается нерегулярное дыхание или его отсутствие, двигательная активность снижена или отсутствует (ребенок вялый или не шевелится), присутствие в околоплодных водах мекония (зеленые воды). Увеличиваются показатели свертываемости крови, что ведет к тромбообразованию в сосудах и кровоизлиянию в ткани.
В дальнейшем, если гипоксия была пропущена на первых минутах жизни ребенка, присоединяются следующие признаки:
- постоянная сонливость;
- беспокойный сон, вздрагивания;
- мраморный оттенок кожи конечностей;
- ребенок быстро замерзает (при купании, переодевании);
- беспокойное, капризное поведение, беспричинный плач;
- дрожание мышц лица во время плача или в покое.
Гипоксическая энцефалопатия
Гипоксия новорожденного ведет к развитию гипоксической энцефалопатии (поражение головного мозга), которая подразделяется на степени тяжести:
легкая – сонливость или возбуждение новорожденного, исчезающие через 5-7 суток;
среднетяжелая – кроме сонливости и/или возбуждения наблюдается плач без причины, судороги, неприятие ношения на руках, быстрое замерзание;
тяжелая – сильная сонливость и заторможенность, развитие психомоторного возбуждения или коматозного состояния с непрекращающимися судорогами.
Лечебная тактика гипоксии
При возникновении гипоксии плода в потужном периоде или во время схваток (урежение сердцебиения) принимают решение о скорейшем завершении родов: проведение кесарева сечения или наложение акушерских щипцов (в случае родостимуляции окситоцином введение препарата прекращают). После рождения ребенка приступают к немедленному оказанию медицинской помощи:
- освобождение дыхательных путей от слизи, мекония и вод (отсасывание специальным аспиратором);
- подача смеси кислорода с воздухом или чистого увлажненного кислорода через маску, носовой катетер или аппарата искусственной вентиляции легких (в случае тяжелой гипоксии новорожденного помещают в кувез, интубируют и начинают ИВЛ);
- обогрев ребенка лучистым теплом (на специальном пеленальном столике), а при тяжелой гипоксии помещение малыша в инкубатор;
- введение препаратов, стимулирующих кровообращение и повышающих кровяное давление (камфара, дофамин) и средств, возбуждающих дыхательный центр (этимизол);
- внутривенные инфузии физ. раствора, гидрокарбоната натрия (нейтрализация углекислоты в крови), глюкозы для восстановления сниженного объема сосудистого русла;
- переливание препаратов крови при необходимости (гемолитическая болезнь новорожденного);
- назначение антибиотиков для профилактики легочных инфекций в случае тяжелой гипоксии или внутриутробном инфицировании плода, а также при респираторном дистресс-синдроме при преждевременных родах;
- назначение противосудорожных препаратов (фенобарбитал, феназепам);
- для снижения внутричерепного давления показано введение диакарба, верошпирона (мочегонные с эффектом понижения продукции ликвора).
Реабилитация после выписки
Дальнейшее лечение после выписки из роддома (удовлетворительное состояние ребенка) проводится участковым неонатологом, который назначает массаж, лечебную гимнастику, режим кормления и объясняет женщине правила ухода за ребенком, испытавшим гипоксию после рождения.
Из лекарственных препаратов назначаются средства, улучшающие кровообращение и питание головного мозга (винпоцетин, пирацетам, церебролизин), препараты, снижающие внутричерепное давление (диакарб, аспаркам, калийсодержащие средства), противосудорожные лекарства по показаниям.
Ребенок находится на диспансерном учете у педиатра и регулярно должен осматриваться неврологом.
Последствия и прогноз
Гипоксия легкой и средней степени тяжести при своевременном и качественном лечении не приводит к серьезным последствиям, но тяжелая гипоксия опасна развитием следующих состояний:
- тревожность, беспокойство ребенка и лабильность психики;
- отставание в физическом и психическом развитии, головные боли и развитие нейроциркуляторной дистонии; ;
- развитие эпилептического синдрома и гидроцефалии;
- образование кист головного мозга;
- поражение черепно-мозговых нервов и исчезновение их функций.
К редким последствиям тяжелой гипоксии новорожденного относятся инвалидизация ребенка или летальный исход.
Прогноз зависит от степени гипоксии. При легкой и среднетяжелой гипоксии и адекватной терапии прогноз благоприятный, при тяжелой гипоксии мозга прогноз сомнительный.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Бульбарный синдром при гипоксии. Нарушение мышечного тонуса
Нарушение бульварной группы черепномозговых нервов в первые дни после рождения бывает приблизительно у 40% родившихся в асфиксии и характеризуется угнетением функции глотания, сосания. Дети поперхиваются, молоко выливается через нос. Голос становится глухим, с носовым оттенком. Неврологические изменения могут сочетаться с расстройством дыхания и сердечной деятельности. Нарушается синхронность актов дыхания, сосания и глотания.
Бульбарный паралич обычно наблюдается при асфиксии, осложненной внутричерепной родовой травмой. В этих случаях он обусловлен либо кровоизлиянием в ствол мозга, либо дислокацией последнего в результате отека.
Псевдобульбарные нарушения обусловлены двусторонним поражением кортико-нуклеарпых путей при асфиксии и проявляются нарушением глотания и фонации. Дети испытывают чувство голода, кричат, но к груди «присосаться» не могут. Сделав несколько сосательных движений, они бросают грудь, затем опять пытаются сосать. Рефлексы орального автоматизма усиливаются. В дальнейшем у этих детей развиваются расстройства речи в форме псевдобульбарной дизартрии, которые наблюдаются значительно чаще, чем бульбарные.

Нарушение мышечного тонуса — один из наиболее частых патологических неврологических синдромов периода новорожден-ности. Изменение тонуса мышц у детей, перенесших асфиксию, обусловлено антенатальным повреждением центральной и периферической нервной системы, комплексом гуморальных и биохимических нарушений в организме ребенка.
Мышечная гипотония различной степени наблюдается в острый период у 75—90% детей, родившихся в асфиксии. Мышечная гипотония может быть тотальной или односторонней. Последняя наблюдается при очаговом поражении мозга. Сухожильные рефлексы угнетены, но полностью никогда не исчезают. В некоторых случаях они высокие, с расширенной зоной, сопровождаются клонусами.
Выраженность и динамика мышечной гипотонии являются важными показателями степени тяжести неврологических нарушений у новорожденного. Быстрое восстановление физиологического мышечного тонуса свидетельствует о функциональных расстройствах и прогностически благоприятно. Чем тяжелее и длительнее была мышечная гипотония в неонатальный период, тем с большей вероятностью в дальнейшем развиваются двигательные нарушения в форме детского церебрального паралича.
Мышечная гипертония, превышающая в значительной степени физиологическое повышение мышечного тонуса у новорожденных, также является патологическим признаком при асфиксии. Мышечная гипертония может сочетаться с общим выраженным беспокойством ребенка, нарушением сна, тремором подбородка и рук, срыгиваниями, рвотой. Сухожильные рефлексы высокие, клонус стоп. Выраженная стойкая мышечная гипертония с первых дней жизни с преобладанием экстензорного тонуса характерна для детей с антенатальной патологией нервной системы, осложнившейся асфиксией в родах. У таких детей в дальнейшем формируются тяжелые двигательные нарушения. Преходящая мышечная гипертония прогностически более благоприятна.
Патология безусловных рефлексов. Исследование безусловных рефлексов у детей, перенесших асфиксию, важно для определения степени вовлечения мозга в патологический процесс. При легких степенях асфиксии и нарушениях мозгового кровообращения наблюдается угнетение безусловных рефлексов в течение первых 2—4 дней, а затем они постепенно оживляются. Длительное угнетение (свыше 8—15 дней) и сочетание его с нарушением мышечного тонуса, нистагмом, косоглазием свидетельствуют о тяжелом поражении центральной нервной системы и неблагоприятном прогнозе. У таких детей спустя 4—5 нед безусловные рефлексы оживляются и наряду с повышенным мышечным тонусом и патологической тонической рефлекторной активностью препятствуют психомоторному развитию.
Оценка безусловнорефлекторной сферы должна проводиться комплексно с учетом состояния двигательного анализатора и других отделов нервной системы.
- Вернуться в оглавление раздела "Неврология."
Синдром Мебиуса. Асфиксия новорожденного
В основе заболевания лежит врожденное недоразвитие ядер лицевого нерва. Многие случаи синдрома Мебиуса спорадические, но имеются описания семей с аутосомно-доминантным и аутосомно-рецессивным наследованием.
Синдром описан Мебиусом в 1888 г. Аплазия может распространяться и на ядра V, VI, IX, XII пар черепномозговых нервов. Паралич лицевого нерва иногда сопровождается врожденной глухотой. Поражение чаще двустороннее.
С рождения лицо ребенка маскообразное, с открытым ртом и неплотно закрывающимися глазами; глазные яблоки не отводятся в стороны. Кожа натянутая, гладкая, без морщин даже при плаче. Она не смещается по отношению к подкожной клетчатке. Углы рта опущены. У этих детей могут быть и другие аномалии развития: гипертелоризм, макрогнатия, деформация ушных раковин, нёба, дефекты мышц лица, груди. Иногда наблюдаются аномалии конечностей: косолапость, синдактилия, брахидактилия, добавочные пальцы. Интеллект снижен примерно у 10% больных, степень его снижения варьирует.
Дифференциальный диагноз следует проводить с бульбарным параличом, а при одностороннем поражении — с травматическим поражением лицевого нерва в родах.
Течение благоприятное. Прогноз для жизни хороший. Консервативное лечение малоэффективно, но с возрастом степень выраженности патологии несколько уменьшается.
Профилактика пороков развития нервной системы, как и других пороков развития, складывается из общегигиенических мероприятий по охране окружающей среды, труда на производствах, связанных с воздействием на организм химических и физических факторов, охране беременности, медико-генетического консультирования, а также ранней антенатальной диагностики с помощью таких современных методов исследования, как рентгеноскопия и рентгенография плода, сонография, определение альфа-фотопротеина в амниотической жидкости.
Асфиксия новорожденного
Асфиксия новорожденного — кислородная недостаточность в родах, сопровождающаяся комплексом клинических и биохимических нарушений. Для обозначения состояния кислородной недостаточности плода применяются термины «внутриутробная гипоксия» или «гипоксия плода». В большинстве случаев внутриутробная гипоксия сочетается с асфиксией новорожденною. В структуре перинатальной смертности асфиксия составляет 40%.
Гипоксия плода возникает при осложненном течении беременности (инфекционные, эндокринные и соматические заболевания матери, токсикозы беременности, иммунологическая несовместимость крови матери и плода, перенашивание, инфицирование плода и др.). Причинами развития асфиксии при рождении являются нарушения маточно-плацентарного кровообращения, обусловленные патологией пуповины, плаценты; несоответствие размеров головки плода и таза матери, внутричерепные кровоизлияния и др. Хроническая гипоксия плода нарушает его компенсаторные механизмы, замедляет и извращает процессы физиологического созревания нервной системы. В связи с этим присоединившаяся в родах асфиксия может вызвать грубые необратимые изменения в центральной нервной системе. Наряду с внутриутробной гипоксией могут быть и другие причины, предрасполагающие к возникновению асфиксии новорожденных — пороки развития центральной нервной системы, сердца, легких, болезнь гиалиновых мембран.
Таким образом, асфиксия — это полиэтиологический клинический синдром, возникающий у новорожденных вследствие действия различных вредных факторов. Асфиксия является одной из частых причин перинатальной смертности. Частота асфиксии в популяции новорожденных составляет 5—6%.
Патогенез. Различают четыре типа кислородной недостаточности плода. Гипоксическая гипоксия возникает при недостаточном насыщении крови плода кислородом, при легочных процессах у матери, истинных узлах пуповины, выпадении или прижатии ее к костям таза, дегенеративных процессах в плаценте, перенашивании беременности, поздних токсикозах, сахарном диабете у матери, преждевременном отхождении околоплодных вод.
Гемическая гипоксия развивается у плода в результате резус-конфликта, анемии у матери. Причиной гипоксии в этих случаях является снижение концентрации кислорода, доставляемого тканям, вследствие уменьшения количества гемоглобина в крови. При гемолитической болезни плода поступающий в кровь непрямой билирубин, кроме того, является блокатором тканевого дыхания.
Циркуляторная гипоксия обусловлена снижением скорости циркуляции крови. Кровь в достаточной мере насыщена кислородом, но ткани все же страдают от гипоксии в результате замедленного кровотока. Циркуляторная гипоксия наблюдается при длительном стоянии головки плода в родовых путях, брадикардии.
Тканевая гипоксия связана с тем, что клетки не могут использовать кислород вследствие нарушения функции ферментных систем, катализирующих окислительные процессы в тканях. Этот тип гипоксии наблюдается при токсикозах беременности в сочетании с другими заболеваниями (поражение почек, сердца), отравлении матери сильными ядами, непрямой билирубинемии.
В клинической практике чаще встречается сочетание различных видов гипоксии.
Кислородная недостаточность и усиливающийся метаболический ацидоз вызывают специфические сосудистые нарушения: расширение сосудов, переполнение их кровью, венозный застой. Под влиянием ацидоза увеличивается проницаемость сосудистых стенок, развиваются отек и набухание мозга, нарушается мозговое ъровообращение. Сосуды мозга расширены, общее количество крови в них увеличено. Вены сетчатки также расширены, развивается отек соска зрительного нерва. В таких условиях часто наступает разрыв сосудов, особенно при высоком венозном давлении. В результате снижения симпатического тонуса сосудов, их тромбоза, кровопотери или нарушения сердечной деятельности возникает ишемия мозга. При ишемии накапливаются недоокисленные продукты обмена, которые не могут быть удалены, что приводит к выраженному внутриклеточному ацидозу. Нервная клетка погибает.
В условиях недостатка в крови кислорода и избытка углекислоты происходит раздражение дыхательного центра. У плода появляются дыхательные движения по типу внеутробного дыхания. Это приводит к аспирации околоплодных вод, слизи, крови и мекония из родовых путей матери и еще больше усугубляет тяжесть состояния.
Устойчивость различных отделов центральной нервной системы плода к кислородной недостаточности не одинакова. В большей степени поражаются те образования, которые функционально наиболее активны в этот период. У новорожденных, особенно недоношенных, в значительной степени страдают клетки коры, базальные ганглии, ядра вестибулярных нервов, зрительный бугор, оливы, ядра черепномозговых нервов, расположенные в каудальном отделе ствола мозга. Клетки передних рогов спинного мозга также чувствительны к действию гипоксии. Степень повреждения мозга зависит от тяжести и продолжительности внутриутробной гипоксии и асфиксии.
Синдром двигательных расстройств восстановительного периода перинатальных поражений нервной системы
Для цитирования: Зыков В.П. Синдром двигательных расстройств восстановительного периода перинатальных поражений нервной системы. РМЖ. 2006;1:76.
Восстановительный период неонатальной гипоксическо–ишемической энфалопатии (НГИЭ) среднетяжелой степени и перивентрикулярных кровоизлияний (ПВК) II–III степени протекает с наличием стойких двигательных расстройств в 46–50% случаев, при которых у 70% выявляются нарушения психомоторного развития, а у 30% больных развивается эпилепсия [Ахтанина Е.А, с соавт., 1997, Голеницкая Е.С. с соавт., 1997].
Эволюция двигательных нарушений связана с этапами онтогенеза двигательной коры: пик миелинизации кортико–спинального тракта приходится на 4–6 месяцы постнатального развития, что создает условия клинической манифестации спастического синдрома к первому полугодию жизни.
В настоящее время отсутствуют стандарты клинической и лабораторно–инструментальной диагностики двигательных расстройств (ДР) у детей грудного возраста, поэтому в данной статье мы попытались систематизировать собственные и литературные данные, касающиеся этой проблемы.
Клиническая диагностика
Особенностью ДР детей грудного возраста являются гипотонические синдромы при центральных парезах. Ранним клиническим симптомом ДР у большинства больных является задержка психомоторного развития, в связи с чем хронология моторных навыков и редукции врожденных рефлексов, а также тщательный анализ анамнестических и соматических сведений играют важную роль в клинической диагностике. В первую очередь собирается перинатальный анамнез, связанный с гипоксией, инфекцией, токсико–метаболическими нарушениями, для решения вопроса об этиологии ДР, в том числе будет важна информация о проводимой терапии и эффективности реабилитации. Из анамнестических сведений особое внимание обращают на те, которые характерны для неонатальной гипоксической энцефалопатии, последствиями которой являются ДР: оценка по шкале Апгар менее 5 баллов, ИВЛ в остром периоде более 2–х суток, pО2 менее 40 мм рт.ст., неонатальный шок, судороги в остром периоде, включая угнетение, кому. А также на некоторые соматические симптомы – краниофациальные аномалии (микроцефалия, макро–гидроцефалия), более 3 стигм, плато росто–весовых показателей, рвоты, летаргия, пигментные аномалии, ангиоматозы, необычные запахи.
Отсутствие ответа на проводимое лечение позволяет заподозрить дизгинезию мозга, генный или хромосомный синдром, прогрессирование ДР направляет диагностику в сторону нейрометаболических заболеваний.
При осмотре ребенка обращают внимание на следующие неврологические нарушения:
– ограничение объема движений конечностей, нарушения мышечного тонуса, изменения рефлекторной сферы – первичные неврологические критерии;
– нарушения саккадических движений глаз, фиксации взора, нистагм; задержка или отсутствие редукции врожденных шейно–тонических и лабиринтно–тонических рефлексов к 2–3 месяцу у доношенных; задержка программы вертикализации, цепных рефлексов на голову, туловище и конечности – вторичные неврологические критерии.
Двигательные нарушения могут быть представлены следующими синдромами:
• гипотонический – чаще встречается у недоношенных, при мультинфарктном поражении головного мозга. Трансформируется в спастический к 3–6 месяцам. Другой вариант трансформации – в атонически–астатический синдром (значительное симметричное ограничение обьема движений во всех конечностях, низкий мышечный тонус, низкие рефлексы, минимальные моторные навыки, сочетание с тяжелой формой нарушения психомоторного развития);
• спастический – снижение объема движений, мышечной силы, повышение мышечного тонуса, гиперрефлексия, клонус стоп, контрактуры, синкинезии, часто сочетается с дистонией;
• дистонический – повышение тонуса связано с изменением положения тела, в основном смена горизонтального на вертикальное, что связано с паттерном шейных и лабиринтных тонических рефлексов; сочетается с проявлением спастического синдрома;
• гиперкинетический – атетоз и дистонии, которые дебютируют в 3–5 месяцев, что связано, вероятно, с миелинизацией стриарной системы к первому полугодию жизни. У больных синдромом «двойной атетоз» гиперкинезы дебютируют на первом месяце жизни;
• восковая ригидность – мышечный тонус повышен по пластическому типу, активные движения замедлены, при пассивных движениях сопротивление равномерное, возврат во флексорную позу замедленный, наблюдаются застывания в неестественной позе. Встречается у больных с тяжелой степенью НГИЭ, декортикации;
• опистотонус – повышение мышечного тонуса по спастическому типу, проявляющееся в резком разгибании спины и шеи;
• шейный радикулярный синдром – характерный симптом цервикальной родовой травмы, проявляющийся ригидностью затылочных мышц иногда с приподниманием плечевого пояса;
• синдром «гибкого ребенка», «вялого ребенка» – наблюдается у больных спинальной амиотрофией, родовой травме, органических ацидуриях, аплазии мозжечка. Ноги полностью разведены, руки разогнуты, отсутствует флексорная реакция на тракцию за руки, при вертикальном и горизонтальном подвешивании голова и конечности ребенка свисают вниз;
• доброкачественные моторные феномены – дистоническая реакция стоп на опору при вертикализации длительностью до 1–3 минут с последующим выведением стопы, флексорный гипертонус в сгибателях локтевых и коленных суставов до 3–4 месяцев у доношенных, доброкачественная пароксизмальная дистония (тортиколис головы или туловища).
Оценку психомоторного развития предлагается проводить по календарю критических сроков (соответствует балльной оценке психомоторного развития (ПМР) Л.Т. Журба, Е.А. Мастюкова, 1985) в 1, 3, 6, 9 и 12–й месяцы. Календарный метод состоит в определении соответствия хронологического возраста ребенка (возраст на данный момент обследования) к возрастному стандарту психомоторных навыков.
При отклонении хронологического возраста от календарного не более 3 месяцев диагностируется легкая степень нарушений ПМР или задержка ПМР, или «темповая» задержка (встречается у недоношенных, при рахите; исходом, как правило, является полное восстановление моторных и психических функций, если отсутствуют признаки повреждения мозга по данным нейровизуализации).
Отставание от календарного возраста от 3 до 6 месяцев признается как нарушение ПМР средней степени, что определяет тактику детального обследования для поиска причины заболевания. Средняя степень ПМР встречается у больных НГИЭ с лейкомаляцией, ПВК II ст., перенесших менингит, при эпилепсиях, генных синдромах, дизгенезии мозга. Тяжелая степень нарушения ПМР – отставание в развитии от календарного более 6 месяцев из–за пороков развития головного мозга (аплазия лобных долей, мозжечка), ГИЭ и ПВК III степени, нарушения обмена амино– и органических кислот, некротической энцефалопатии, лейкодистрофии, туберозном склерозе, хромосомных и генных аномалиях, внутриутробных энцефалитах, врожденном гипотиреозе.
В приведенном календаре (табл. 1) представлена хронология редукции шейных и лабиринтных тонических рефлексов, с одной стороны, и программа вертикализации цепных установочных рефлексов на голову и туловище с другой. Календарь построен с акцентом на важные этапы двигательного и психического развития. В левой части таблицы помещены нормативы окружности головы и веса ребенка, что позволяет врачу не упускать информацию и своевременно проводить скриннинг у маловесных детей с микроцефалией на хромосомные и генетические синдромы, при рвотах исключать нейрометаболические заболевания: аминацидопатии, органические ацидурии, митохондриальные и пероксикомные болезни.
Инструментально–
лабораторная диагностика
1. Нейрофизиологические методы:
– электро–энцефалография с топографическим картированием (ЭЭГТК) позволяет проследить формирование возрастных ЭЭГ ритмов. С 2 месяцев должны появиться сонные веретена и исчезнуть дельта–активность;
– слуховые вызванные потенциалы (СВП) необходимы для определения слуха у ребенка на основе анализа проведения звукового сигнала от периферии до коры височной доли;
– зрительные вызванные потенциалы (ЗВП) помогают оценить состояние зрительного анализатора от зрительного нерва до коры;
– электромиография и электронейромиография (ЭМГ) позволяют обнаружить снижение скорости проведения по нервам верхних конечностей (в норме до 6–месячного возраста скорость на руках выше, чем на ногах), снижение амплитуды осцилляций у больных атонически–астатическим синдромом и грубой спастикой [И.А. Скворцов, 2000].
2. Нейровизуализация – нейросонография (НСГ) определяет перивентрикулярную лейкомаляцию (ПВЛ), субкортикальный некроз, спиномозговую грыжу. Компьютерная томография, магнитно–резонансная томография необходимы для диагностики аномалий развития лобных, височных долей, мозжечка, мозолистого тела, ликворной системы.
3. Лабораторная диагностика проводится больным с нарушением психомоторного развития (отставание от календаря на 3 и более месяца):
– уремический аминокислотный тест: на гипераланинемию, гистидинемию, фенилкетоннурию, гомоцистинурию, глицинемию, органические кислоты, лактат–пируват и др.;
– анализы на внутриутробные инфекции, тиреоидные гормоны, тесты на лейкодистрофии, мукополисахаридозы;
– цитогенетическое исследование, показаниями к которому являются дисморфии (3–5), отставание умственного развития неясной этиологии, микроцефалия при отсутствии перинатального поражения, повторные мертворождения или смерти новорожденных.
Терапия двигательных расстройств
и нарушений психомоторного развития
Наиболее часто используются физиотерапевтические и медикаментозные методы лечения. Из физиотерапевтических хорошо себя зарекомендовала кинезотерапия. Согласно методике Войта у больных с гемипарезом ежедневно по 6 ч в течение 21 дня воспроизводят движения в паретичных конечностях (методика разработана в Университете штата Алабама, Taub E., Ramey S.L., DeLuca S., Echols K., 2004). Также могут быть рекомендованы массаж, лечебная гимнастика, лазеротерапия (пунктурная методика для плексопатий), «сухой» бассейн.
Из медикаментозных средств используются пиритинол (с 3 дня жизни дозу повышают еженедельно на 1 мл или 20 мг до 5 мл или 100 мг 2–3 месяца), церебролизин 1,0–2,0 мл в/м с 4 недели N 20, актовегин 0,5–1,0 мл в/м N 20.
Сочетание леводопа + карбидопа 0,05–0,1 мг/кг 2–кратный прием 2–3 месяца, толперизон 5 мг/кг 2–кратный прием, тизанидин у детей старше 6 месяцев 1–2 мг/сут. 2–кратный прием, тепловые процедуры используют при наличии ригидности и спастичности.
Прием Кальция гопантената в дозе 125–500 мг/сут. через 15 минут после еды в течение 1–4 месяцев с повторным курсом через 3–6 месяцев рекомендуется в том числе при наличии атетоидных движений. Препарат хорошо проникает в течение часа через гематоэнцефалический барьер, оказывает положительное влияние на обменные процессы и кровообращение головного мозга. Сочетает стимулирующую активность в отношении различных проявлений церебральной недостаточности экзогенно–органического генеза с противосудорожными свойствами. Препарат приводит к уменьшению моторной возбудимости, оказывает активизирующее влияние на работоспособность и умственную активность. Кальция гопантенат также используют в лечении нарушений развития речи, при клоническом заикании, нарушении мочеиспускания. Препарат малотоксичен и обычно хорошо переносится, не подвергается метаболизму и выводится в неизмененном виде. Не рекомендуется одновременное применение других ноотропных средств.
3–кратный прием клоназепама в дозе до 0,005–0,01 мг/кг рекомендован в случаях атетоза и дистонии.
Для терапии опистотонуса назначают дифенин до 5 мг/кг в сутки.
Терапия органических ацидурий подразумевает также постоянное соблюдение низкобелковой диеты, прием карнитина 100 мг на кг ежедневно.
Заключение
Двигательные нарушения, наблюдаемые в восстановительном периоде более 2–3 месяцев, целесообразно рассматривать как стойкие. Современные методы исследования позволяют сократить сроки клинического наблюдения до постановки диагноза церебрального паралича. Для этого целесообразно внедрить шкалы психомоторного развития на уровне нормативных документов МЗ РФ СР и организовать современные диагностические центры двигательных расстройств грудного и раннего возраста на базе поликлиник из расчета 1 центр на 1 млн. населения.
Литература
1. Бондаренко Е.С., Зыков В.П. РМЖ, Перинатальная гипоксическая энцефалопатия,1999, №4
2. Зыков В.П., Ширеторова, Д.Ч., Шадрин В.Н.,и др. Лечение болезней нервной системы у детей. М.2003. 286 стр.
3. Зыков В.П., Ширеторова, Д.Ч., Шадрин В.Н.,и др. Методы исследования в детской неврологии. М.2004, 127 стр.
4. Пальчик А.Б. Эволюционная неврология.С.–Петербург., 2002, .383 стр.
5. Регистр лекарственных средств в России. М.2005,1440 стр.
6. Скворцов И.А. Развитие нервной системы у детей.М.2000,200 стр.
7. Таскаева Т.В.. Михнович В.И., Дутова Н.Я. Лечение детского церебрального паралича препаратами L–дофа.
Вопросы современной педиатрии.приложение №3,2004,стр.90
8. Pediatria. Taub E, Ramey SL,DeLuca S, Echols K 2004 ; 113 (2):305–12.
9. L.–W. Wang, K.–M. Xu», H. Cai», C. Qian, J.–X. Wu», C.–H. Zhang, I. Matsumoto . Diagnoses and treatment of methylmalonic aciduria (MMA) J. Br & Dev, 2003.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Читайте также:
- Психогенный дерматоз - нейродермит. Причины и диагностика
- Корь. Вирус кори. Свойства вируса кори. Эпидемиология кори. Антигены вируса кори.
- Идиопатическое негранулематозное воспаление глазницы (воспалительный псевдотумор, синдром идиопатического воспаления глазницы): признаки, гистология, лечение, прогноз
- Клиника хронического идиопатического миелофиброза (ХИМФ) - спленомегалия, портальная гипертензия, анемия, асцит
- Строение яичек. Клетки Лейдига и Сертоли
