Печень как депо витаминов. Билирубин желчи в диагностике
Добавил пользователь Владимир З. Обновлено: 16.01.2026
Для цитирования: Zaat J.O.M., van Bavel Р.С., de Bruin H.J. и др. ИССЛЕДОВАНИЯ КРОВИ ПРИ ПОДОЗРЕНИИ НА ЗАБОЛЕВАНИЯ ПЕЧЕНИ: СТАНДАРТ ГОЛЛАНДСКОГО СООБЩЕСТВА СЕМЕЙНЫХ ВРАЧЕЙ. РМЖ. 1996;2:5.
В данном стандарте определены случаи, когда семейный врач при подозрении на заболевание печени должен направлять больного на лабораторное обследование, и даны рекомендации относительно интерпритации результатов обследования. Стандарт не определяет критерии, на основании которых может возникнуть подозрение на заболевание печени, и лишь в ограниченной мере касается вопросов дальнейшего сбора анамнеза и обследования при заболеваниях печени. Обсуждаются наиболее распространенные в практике семейного врача заболевания и состояния: желтуха; гепатиты А, В и С; повреждение печени при злоупотреблении алкоголем и использовании некоторых медикаментов. Кроме того, обсуждается ценность определения функций печени при жалобах на общее недомогание, инфекционном мононуклеозе и при подозрении на метастазы в печени.
Стандартизация позволит оптимизировать обследование и избежать чрезмерного и/или рутинного обследования. Изучение состояния печени необходимо при желтухе и подозрении на инфекционный гепатит (А, В и С), инфекционный мононуклеоз и метастазы в печени, а также при злоупотреблении алкоголем. Метастазы в печени встречаются, в основном, у пациентов с подтвержденным диагнозом карциномы. Метастазы в печени редко бывают первым проявлением карциномы. Повреждения печени могут возникнуть при приеме многих медикаментов.
Аланинаминотрансфераза (АлАТ) и аспартатаминотрансфераза (АсАТ). Уровень этих трансаминаз рассматривается в качестве меры функции печени, но они активны и в других тканях. АлАТ встречается, главным образом, в клетках печени, но также активна, хотя и в меньшей степени, в скелетных и сердечных мышцах, в ткани почек и поджелудочной железы. АсАТ встречается в клетках печени, в скелетных и сердечных мышцах и в меньших количествах в других органах. Определение уровня АлАТ является наиболее специфичным тестом при расстройствах функции печени. Поэтому в данном стандарте отдается предпочтение определению уровня АлАТ.
g -Глютамалтрансфераза ( g -Г T ) встречается в клетках печени. Уровень g -ГТ сильно повышен при застое желчи. В отсутствие повреждения печени уровень g -ГТ может быть немного повышен вследствие употребления алкоголя или приема определенных медикаментов, а также при стеатозе и ожирении.
Щелочные фосфатазы (ЩФ) обнаруживаются в плаценте, костях и ткани печени. При заболеваниях печени уровень ЩФ является мерой застоя желчи. Определение ЩФ, однако, характеризуется низкой специфичностью, поэтому лучше определять уровень g -ГТ. Одновременное определение уровня ЩФ и g -ГТ чрезмерно.
Билирубин образуется, в основном, при распаде гемоглобина. В печени билирубин сцепляется с глюкуроновой кислотой, образуя конъюгированный билирубин (ранее называвшийся прямым билирубином). Если в направлении содержится запрос на определение билирубина, то определяют общий билирубин (совокупность конъюгированного и свободного билирубина, ранее называвшегося непрямым билирубином).
Уровень конъюгированного билирубина не может быть нарушен изолированно, т. е. на фоне нормального уровня общего билирубина и трансаминаз. Определение уровня конъюгированного билирубина имеет смысл только для дальнейшей диагностики желтухи новорожденных и при подозрении на изолированную гипербилирубинемию (болезнь Кильбера).
Желтуха (icterus) представляет собой клиническое проявление повышенного содержания билирубина. Она возникает при уровне билирубина выше 100 мкмоль/л.
Границы нормы для вышеназванных показателей зависят от лаборатории, где проводятся определения.
Рекомендации
Когда при анализе жалоб пациента и данных общго осмотра у семейного врача возникает подозрение на заболевание печени, он направляет больного на лабораторное обследование.
Общее недомогание
Общее недомогание редко является признаком какого-либо заболевания печени. Поэтому определение функции печени при этой жалобе имеет ограниченную диагностическую ценность. Если при сборе анамнеза и общем осмотре не обнаруживаются признаки заболевания печени, то направлять пациента на обследование бессмысленно .
Инфекционный мононуклеоз
Инфекционный мононуклеоз не является специфическим заболеванием печени. Однако практически у всех пациентов с инфекционным мононуклеозом изза слабовыраженного гепатита слегка изменены показатели трансаминаз. Желтуха наблюдается у 5- 10 % больных. Нарушенная функция печени спонтанно восстанавливается через 5 - 6 нед, поэтому выявление этих расстройств и наблюдение не имеют диагностических и терапевтических последствий. При инфекционном мононуклеозе не развиваются хронический гепатит или цирроз печени.Таким образом, определение функции печени при этом заболевании не имеет смысла. Для подтверждения диагноза выполняют тест Пауля - Буннелля или производный от него.
Желтуха новорожденных
При всех типах гепатита могут наблюдаться желтуха, тошнота, боль справа в верхней части живота, темная моча и обесцвеченные испражнения. Однако часто гепатит протекает субклинически. Для точного определения причины гепатита в первой инстанции наиболее важными являются данные анамнеза.
Заражение происходит фекально-оральным путем; чаще всего инфицируются дети.
При подозрении на гепатит А, особенно при изолированных случаях заболевания, может быть необходимо серологическое обследование на анти-HVA-lgM. Необходимость в этом тесте отпадает, если диагноз установлен на основании данных анамнеза (например, при эпидемиях). Тест на анти-HVA-lgM становится положительным через 3 - 7 нед после заражения; к этому моменту уже наблюдаются четкие клинические проявления заболевания. Тест на lgM продолжает оставаться положительным в течение 1 - 4 мес. Ложноотрицательные результаты наблюдаются редко. Ложноположительные результаты могут иметь место при ревматоидном артрите. lgM как признак перенесенной инфекции продолжает обнаруживаться в течение многих лет, возможно, пожизненно. Кроме того, может быть полезным определение уровня АлАТ. В начале заболевания он повышен до 300 ед. и более. В ходе дальнейшего наблюдения уровень АлАТ рекомендуется определять с интервалом 3 нед.
Печень как депо витаминов. Билирубин желчи в диагностике
Функции и задачи печени. Анатомия печени с точки зрения физиологии
Печень как самостоятельный орган выполняет многообразные функции, которые часто оказы ваются взаимосвязанными. Это становится особенно заметным при заболеваниях печени, которые сопровождаются одновременными нарушениями многих функций. Цель данных статей по физиологии на сайте — дать обзорные представления об основных функциях печени, включая:
(1) фильтрацию и депонирование крови;
(2) метаболизм белков, жиров, углеводов, гормонов и чужеродных веществ;
(3) образование желчи;
(4) депонирование витаминов и железа;
(5) образование факторов коагуляции.
Печень является самым крупным органом тела, ее масса составляет около 2% общей массы тела, или 1,5 кг у взрослого человека. Основной функциональной единицей печени является печеночная долька, представляющая собой структуру цилиндрической формы длиной несколько милли метров, диаметр дольки колеблется от 0,8 до 2 мм. Печень человека состоит из 50000-100000 отдельных долек.
Срез дольки печени располагается вокруг центральной вены, открывающейся в печеночную вену, которая, в свою очередь, впадает в полую вену. Сама долька состоит из многочисленных печеночных клеточных пластинок (две из них показаны на рисунке ниже), которые ради ально отходят от центральной вены наподобие спиц в колесе.
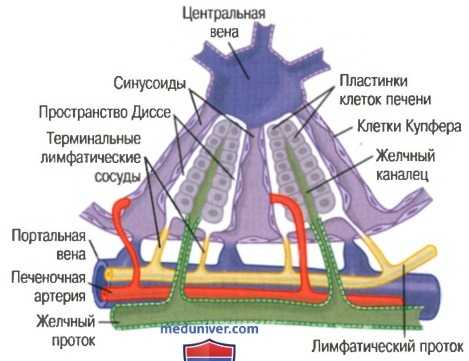
Основные структуры дольки печени. Показаны клеточные пластинки печени, кровеносные сосуды, система желчных ходов, лимфатическая система, состоящая из пространств Диссе и внутридольковых лимфатических сосудов
Каждая клеточная пластинка состоит из двух рядов клеток, между ними располагается мелкий желчный каналец, который опорожняется в желчный проток, лежащий в фиброзной перегородке, разделяющей соседние печеночные дольки.
В перегородке располагаются мелкие портальные венулы, которые получают кровь главным образом от гастроинтестинального тракта, оттекающую по воротной вене. Отсюда кровь течет в плоские ветвящиеся печеночные синусоидные капилляры, которые находятся между печеночными пластинками, а затем поступает в центральную вену. Таким образом, клетки печени длительно контактируют с венозной кровью, оттекающей по воротной вене.
В междольковой перегородке проходит печеночная артериола. Эти ар-териолы обеспечивают артериальной кровью ткани перегородки между соседними дольками. Многие мелкие артериолы несут кровь непосредственно в печеночные синусоидные капилляры, при этом наиболее частым вариантом является их впадение в синусоидные капилляры в области, расположенной на 1/3 расстояния от междольковой перегородки до центральной вены.
Кроме печеночных клеток, между двумя синусоидными капиллярами расположены два типа клеток:
(1) типичные эндотелиальные клетки;
(2) крупные купферовы клетки (также называемые ретикулоэндотелиальными клетками), которые являются макрофагами, постоянно присутствующими на границе между синусоидными капиллярами и способными фагоцитировать бактерии и прочие чужеродные вещества в крови печеночных синусоидных капилляров.
Эндотелий синусоидных капилляров снабжен чрезвычайно большими порами, диаметр некоторых из них равен 1 мкм. За этим слоем, располагаясь между ним и печеночными клетками, находятся узкие пространства, названные пространствами Диссе, или перисинусоидальными пространствами. Миллионы пространств Диссе связаны с лимфатическими сосудами в межлобулярных перегородках, поэтому избыток жидкости в этих пространствах имеет возможность перемещаться в лимфатическую систему. В связи с наличием крупных пор в эндотелии синусоидных капилляров вещества из плазмы легко проникают в пространства Диссе, и большая часть белков плазмы легко диффундирует в эти пространства.
Учебное видео анатомии печени, строения и схемы печеночной дольки
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Желтуха. Причины и варианты желтухи
Желтуха обусловлена прокрашиванием в желтый цвет кожи и глубоких тканей. Обычно причиной желтухи является присутствие во внеклеточной жидкости большого количества билирубина — как свободного, так и связанного. В норме концентрация билирубина в плазме составляет приблизительно 0,5 мг/дл, который при этом представлен почти полностью в свободной форме. При некоторых патологических состояниях его концентрация в плазме может повышаться до 40 мг/дл, при этом может преобладать конъюгированная форма. Когда концентрация билирубина почти в 3 раза превышает норму, приближаясь к 1,5 мг/дл, кожа обычно приобретает желтоватый оттенок.
К наиболее частым причинам желтухи относят:
(1) повышенное разрушение красных клеток крови, когда билирубин быстро высвобождается в кровь;
(2) перекрытие желчного протока или повреждение клеток печени, в результате даже обычное количество билирубина не может экскретироваться в желудочно-кишечный тракт.
Эти два типа желтухи называют гемолитической желтухой и обструктивной желтухой, соответственно. Отличить один вид желтухи от другого можно следующими способами.
а) Гемолитическая желтуха вызывается гемолизом красных клеток крови. При гемолитической желтухе экскреторная функция печени не снижена, но красные клетки крови лизируют так быстро, что клетки печени просто не успевают экскретировать билирубин по мере его образования, поэтому концентрация свободного билирубина в плазме начинает превышать его нормальную концентрацию. В силу этого скорость образования уробилиногена в кишечнике резко повышается, большое количество уробилиногена всасывается в кровь и затем экскретируется с мочой.
б) Обструктивную желтуху вызывает повреждение желчных протоков или заболевания печени. Обструктивную желтуху вызывают или перекрытие желчных протоков, что часто встречается при желчнокаменной болезни, или рак, приводящий к блокаде общего желчного протока, или повреждения клеток печени (как это бывает при гепатитах). При этом скорость образования билирубина остается нормальной, но образовавшийся билирубин не может поступать из крови в кишечник. Свободный билирубин поступает в клетки печени и становится связанной формой. Но в этих случаях конъюгированная форма возвращается в кровь, возможно, в связи с повреждением переполненных желчью канальцев или прямым поступлением желчи в лимфу, минуя печень. Таким образом, в плазме крови в этом случае присутствует преимущественно конъюгированная форма билирубина, а не свободная.
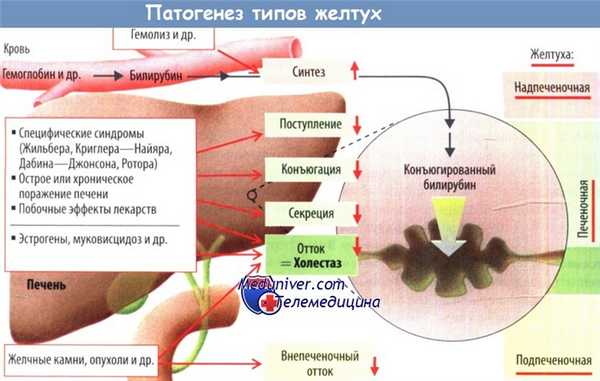
в) Дифференциальная диагностика гемолитической и обструктивной форм желтухи. Для того чтобы отличить свободную форму билирубина от связанной в плазме крови, можно использовать химические лабораторные методы. При гемолитической желтухе почти весь билирубин в плазме крови представлен свободной формой, а при обструктивной форме преобладает связанная форма. Используемый для различения этих форм лабораторный метод называют реакцией Ван-ден-Берга.
Если возникает полное прекращение поступления желчи в кишечник, то билирубин не может превращаться с помощью микрофлоры в уробилиноген, поэтому уробилиноген не может реабсорбироваться в кровь и выделяться почками с мочой. Следовательно, только при обструктивной форме желтухи тест на уробилиноген полностью отрицательный. Стул становится цвета глины в связи с отсутствием стеркобилина и других желчных пигментов.
Другое существенное отличие свободной формы от связанной заключается в том, что почки могут экскретировать небольшое количество высокорастворимого связанного билирубина, но не могут экскретировать связанную с альбумином свободную форму, следовательно, при тяжелой обструктивной желтухе значительное количество связанного билирубина появляется в моче. Это можно заметить, просто встряхивая склянку с мочой и наблюдая пену, которая в этом случае окрашивается в интенсивно желтый цвет, Таким образом, понимая физиологию экскреции билирубина печенью и используя простые тесты, можно отличить гемолитические болезни от заболеваний печени, а заодно оценить тяжесть состояния больного.
а) Печень - депо витаминов. Печень обладает особым свойством запасать витамины, необходимые для лечения некоторых заболеваний. Таким витамином, запасаемым в огромном количестве в печени, является витамин А. Кроме него в печени запасаются витамин D и витамин B12. Запасов витамина А, достаточных для предупреждения его дефицита в организме, хватает на 10 мес, запасов витамина D — на 3-4 мес, а витамина B12 — по крайней мере, на год или даже несколько лет.
б) Печень запасает железо в виде ферритина. По сравнению с количеством железа, являющегося составной частью гемоглобина, существенно большее его количество депонируется в печени в виде ферритина. Клетки печени содержат большое количество белка, названного апоферритином, который может обратимо соединяться с железом, поэтому если железо в жидких средах организма присутствует в больших количествах, оно объединяется с апоферритином, образуя ферритин, и в такой форме хранится в клетках печени до тех пор, пока не будет востребовано на какие-либо нужды организма. Как только уровень железа в крови снижается, железо из ферритина высвобождается. Таким образом, апоферритинферритиновая система печени ведет себя как буферная система железа крови, выступая в качестве способа хранения и извлечения железа. Другие функции печени, относящиеся к метаболизму железа в связи с образованием красных клеток крови, рассмотрены в отдельной статье на сайте (просим вас пользоваться формой поиска выше).
в) Печень образует большую часть факторов свертывания крови. Вещества, образующиеся в печени и используемые в процессах свертывания (коагуляции), включают фибриногену протромбину акцелера-тор-глобулину фактор VII и некоторые другие. Для метаболических процессов, происходящих в печени в связи с образованием факторов коагуляции, необходим витамин К, особенно при образовании протромбина и факторов VII, IX и X. При отсутствии витамина К концентрация всех этих факторов снижается настолько, что может предотвратить свертывание крови.
г) Печень преобразует или экскретирует лекарственные препараты, гормоны и некоторые другие вещества. Роль печени как органа с высокой биохимической активностью хорошо известна, особенно в связи с ее способностью к дезинтоксикации или экскреции с желчью многих лекарственных препаратов, включая сульфонамиды, пенициллин, ампициллин и эритромицин.
Сходным образом различные гормоны, секретируемые эндокринными железами, либо претерпевают химические преобразования, либо экскретируются печенью, в особенности тироксин и стероидные гормоны (эстрогены, кортизол и альдостерон). Повреждение печени ведет к накоплению все большего количества гормонов в жидких средах организма и в связи с этим — чрезмерно высокой активности гормональных систем.
Наконец, одним из главных путей экскреции кальция из организма является его выведение печенью в составе желчи с последующим прохождением через кишечник и выведением с каловыми массами.
Использование определения билирубина желчи в качестве клинического диагностического средства
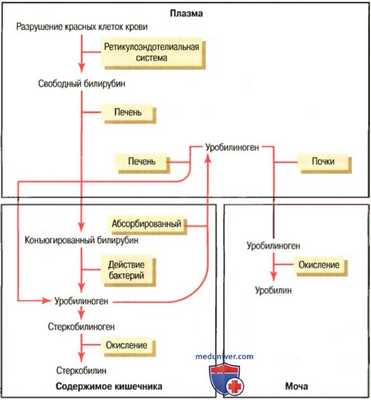
Образование и экскреция билирубина
Образование печенью желчи, роль солей желчных кислот в пищеварении и процесс их всасывания в кишечнике обсуждались в наших соответствующих статьях. Здесь можно только добавить, что многие вещества экскретируются желчью, а затем удаляются вместе с фекалиями. Одним из таких веществ является желчный пигмент билирубин, имеющий зеленовато-желтый цвет. Он является конечным продуктом расщепления гемоглобина. Кроме того, это вещество является исключительно ценным средством дифференциальной диагностики гемолитических заболеваний и различных видов заболеваний печени. Далее приводим пояснение к рисунку выше.
Когда красные клетки крови проживут положенный жизненный срок (около 120 сут) и станут слишком хрупкими, чтобы продолжать существовать в кровеносной системе, их клеточные мембраны разрушаются и высвобождающийся гемоглобин фагоцитируется тканевыми макрофагами (относящимися к ретикулоэндотелиальной системе). Прежде всего гемоглобин расщепляется на гем и глобин. Разомкнутое кольцо отдает: (1) свободное железо, которое, соединяясь с трансферрином, транспортируется кровью; (2) прямую цепочку из 4 пиррольных ядер, служащих субстратом, из которого в итоге образуется билирубин. Первым веществом, образующимся из этого субстрата, является биливердин, но вскоре он превращается в свободный билирубин, который постепенно выделяется из макрофагов плазмы крови. Свободный билирубин немедленно и прочно связывается с альбумином плазмы крови и в таком виде циркулирует в крови, попадая в интерстициальное пространство. Несмотря на то, что билирубин связан с белками плазмы, его еще называют свободным билирубином, в отличие от связанного билирубина, о котором говорится далее.
Через несколько часов свободный билирубин проходит через мембраны гепатоцитов. Проникая внутрь печеночных клеток, он освобождается от альбуминов плазмы крови; вскоре после этого около 80% билирубина связываются с глю-куроновой кислотой, образуя глюкуронид билирубина. Около 10% связываются с сульфатами, образуя сульфаты билирубина, а оставшиеся 10% — с самыми разными веществами. В таких формах билирубин выделяется из гепатоцитов путем активного транспорта в желчные ходы и попадает в кишечник.
а) Образование и дальнейший метаболизм уробилиногена. Попав в кишечник, почти половина связанного билирубина под влиянием микрофлоры превращается в высокорастворимое вещество уробилиноген. Часть уробилиногена реабсорбируется слизистой кишечника, опять попадая в кровь. Большая часть реабсорбированного уробилиногена вновь экскретируется печенью в кишечник, но около 5% переводится почками в мочу. При контакте с воздухом присутствующий в моче уробилиноген окисляется, превращаясь в уробилин, а присутствующий в каловых массах уробилиноген разрушается и окисляется, образуя стеркобилин.
Интерпретация биохимического анализа крови при патологии печени. Синдром цитолиза. Часть 1.
М. Г. Ипатова 1, 2 к.м.н., Ю. Г. Мухина 1 д.м.н. профессор, П. В. Шумилов 1 д.м.н., профессор
1 Российский национальный исследовательский медицинский университет им. Н. И. Пирогова
МЗ РФ, Москва
2 Детская Городская Клиническая Больница № 13 им. Н. Ф. Филатова, Москва
Ключевые слова: печень, синдром цитолиза, аланинаминотрансфераза, аспартатамино-трансфераза, гепатопротективные препараты
В статье изложены биохимические лабораторные показатели и их клиническое значение при заболеваниях печени, протекающих с синдромом цитолиза. Отдельное внимание уделено механизмам действия гепатопротективных препаратов, применяемых при цитолитическом синдроме.
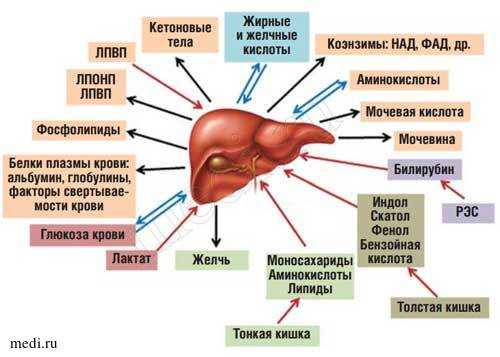
Рис. 1. Роль печени в обмене веществ.
Сокращения: ЛПВП - липопротеиды высокой плотности; ЛПОНП - липопротеиды очень низкой плотности; РЭС ретикуло-эндотелиальная система; НАД - никотинамидадениндинуклеотид; ФАД - флавинадениндинуклеотид.
Печень представляет собой центральный орган химического гомеостаза организма, где создается единый обменный и энергетический пул для метаболизма почти всех классов веществ [1]. К основным функциям печени относятся: метаболическая, депонирующая, барьерная, экскреторная, гомеостатическая и детоксицирующая [2]. Печень может обезвреживать как чужеродные экзогенные вещества, обладающие токсическими свойствами, так и синтезированные эндогенно.
Таблица 2. Причины повышения уровня аминотрансфераз
Печеночные причины
Внепеченочные причины
•Вирусные гепатиты (В, С, ЦМВ и др.)
•Хронические инфекции и паразитарные
заболевания (эхинококкоз, токсоплазмоз и др.)
•Неалкогольный стеатогепатит
•Аутоиммунные заболевания печени
•Злоупотребление алкоголем
•Прием лекарственных препаратов
(статины, некоторые антибиотики, противогрибковые препараты, нестероидные
противовоспалительные препараты,
глюкокортикостероиды, другие)
•Метаболические заболевания печени
(галактоземия, фруктоземия, гликогенозы,
дефицит альфа1-антитрипсина,
аминоацидопатии, нарушение цикла мочевины, нарушение окисления жирных кислот, митохондриальная гепатопатия, некоторые лизосомные заболевания (болезнь
Гоше, болезнь Ниманна-Пика, дефицит кислой липазы и др.), муковисцидоз, синдром Швахмана-Даймонда, гемохроматоз, болезнь Вильсона и др.)
•врожденные и приобретенные дефекты
сосудов системы воротной вены (болезнь
Бадда-Киари и др.)
•Цирроз печени
•Опухоли печени
•Патология сердца (острый инфаркт
миокарда, миокардит)
•Повышенная физическая нагрузка
•Наследственные нарушения мышечного
метаболизма
•Приобретенные мышечные заболевания
•Травма и некроз мышц
•Целиакия
•Гипертиреоз
•Тяжелые ожоги
•Гемолиз эритроцитов
•Нарушение кислотно-щелочного равновесия
•Сепсис
Находясь между портальным и большим кругами кровообращения, печень выполняет функцию большого биофильтра. Через воротную вену в нее поступает более 70% крови, остальная кровь попадает через печеночную артерию. Большая часть веществ, всасывающихся в пищеварительном тракте (кроме липидов, транспорт которых в основном осуществляется через лимфатическую систему), поступает по воротной вене в печень [2]. Таким образом, печень функционирует как первичный регулятор содержания в крови веществ, поступающих в организм с пищей (рис 1).
Большое разнообразие функций гепатоцитов приводит к тому, что при патологических состояниях печени нарушаются биохимические константы, отражающие изменения многих видов обмена. Поэтому стандартный биохимический анализ крови включает определение различных параметров, отражающих состояние белкового, углеводного, липидного и минерального обмена, а также активность некоторых ключевых ферментов.
Концентрация ферментов в клетках значительно выше, чем в плазме крови; в норме только очень незначительная часть определяется в крови. Наиболее частыми причинами повышения уровня ферментов в сыворотке крови являются: прямое поражение клеточных мембран, в частности вирусами и химическими соединениями, гипоксия и ишемия тканей. Иногда активность ферментов увеличивается в результате их повышенного синтеза в тканях. Определение активности тех или других ферментов в сыворотке крови позволяет судить о характере и глубине поражения различных компонентов гепатоцитов [3, 4].
Ферменты в зависимости от их локализации можно разделить на несколько групп:
1) универсально распространенные ферменты, активность которых обнаруживается не только в печени, но и в других органах – амино-трансферазы, фруктозо-1-6-дифосфатальдолаза;
2) печеночноспецифические (органоспе-цифические) ферменты; их активность исключительно или наиболее высоко выявляется в печени. К ним относятся холинэстераза, орнитин-карбамилтрансфераза, сорбитдегидрогеназа и др.;
3) клеточноспецифические ферменты печени относят преимущественно к гепатоцитам,
купферовским клеткам или желчным канальцам (5-нуклеотидаза, аденозинтрифосфатаза);
4) органеллоспецифические ферменты, являются маркерами определенных органелл
гепатоцита: митохондриальные (глутаматде-гидрогеназа, сукцинатдегидрогеназа, цитохромоксидаза), лизосомальные (кислая фос фатаза, дезоксирибонуклеаза, рибонуклеаза), микросомальные (глюкозо-6-фосфатаза).
Специфичность ферментов и их диагностическое значение представлено в таблице 1 [5].
Исходя из выше изложенного, следует, что в большинстве случаев отклонения активности сывороточных ферментов от «нормы» неспецифичны и могут быть вызваны различными причинами. Поэтому нужно с большой осторожностью относиться к интерпретации этих отклонений, сопоставляя их с клинической картиной заболевания и данными других лабораторных и инструментальных методов исследования [5, 6].
В связи с использованием в клинических лабораториях разных методов исследования ферментов и единиц измерения их активности целесообразно каждый раз, получив результаты анализа, уточнить, каким методом и в каких единицах была измерена активность фермента, и сопоставить полученное значение с «нормой», принятой в данной лаборатории.
Отдельное место занимает макроэнзиме-мия – редкое и крайне сложное для дифференциальной диагностики состояние, при котором происходит комплексирование молекул того или иного энзима с иммуноглобулинами или небелковыми веществами. Описаны клинические наблюдения макро-КФК-емии, макро-ЛДГ-емии, макро-АСТ-емии, макро-ГГТ-емии, макроамилаземии. Макро-энзимемии сложны для диагностики и дифференциальной диагностики и ведут к проведению инвазивных методов обследования и необоснованному лечению.
В основе выявления макроэнзимемии лежит выявление отличий молекулы макрофермента от молекулы обычного энзима. Некоторые из этих методов являются прямыми, т. е. такими, которые позволяют непосредственно определить присутствие в крови ферментного комплекса, имеющего гораздо более высокий молекулярный вес, чем молекула нормального фермента. В основу прямого метода положено разделение белков сыворотки по молекулярному весу. Другие же методы являются непрямыми, так как выявление макроэнзима в крови проводится не путем выявления самого ферментного комплекса, а основываются на выявлении какого-либо из свойств макроэнзима. Прямые тесты имеют большее диагностическое значение и влекут за собой меньше технических и диагностических ошибок.
В некоторых ситуациях повышение ферментов является физиологическим: уровень щелочной фосфатазы повышен у подростков в период вытяжения (период ускорения роста), у здоровых женщин во время третьего триместра беременности (за счет плаценты). Однако очень высокую активность щелочной фосфатазы наблюдают у женщин с преэк-лампсией, что связно с нарушением кровообращения плаценты [7].
Большое значение в диагностике заболеваний печени имеют анамнестические данные и клиническая картина заболевания. Из анамнеза следует попытаться узнать о факторах риска заболеваний печени, обращая особое внимание на семейный анамнез, прием лекарств, витаминов, растительных добавок, наркотиков, алкоголя, трансфузии препаратов крови, патологические результаты печеночных проб в прошлом и симптоматику заболеваний печени. Клиническое обследование позволяет диагностировать до 50–60% патологических состояний. Более детальная дифференциальная диагностика основана на иммунохимических методах. Они позволяют детализировать характер вирусной, а также паразитарной инфекции, определить локализацию неопластического процесса, определить этиологию аутоиммунного заболевания, уточнить вид нарушения наследственных заболеваний обмена веществ.
При патологии печени в биохимическом анализе крови выделяют 4 синдрома:
• Синдром печеночно-клеточной недостаточности
• Мезенхиально-воспалительный синдром.
В данной статье мы подробно разберем по
казатели, характерные для синдрома цитолиза.
Синдром цитолиза – это синдром, обусловленный нарушением проницаемости клеточных мембран, распадом мембранных структур или некрозом гепатоцитов с выходом в плазму ферментов (АЛТ, АСТ, ЛДГ, альдолазы и др.).
АМИНОТРАНСФЕРАЗЫ: аспартатаминотрансфераза и аланинаминотрансфераза
Референтные значения: у новорожденных детей до 1 мес. – менее 80 Ед/л; от 2 мес. до 12 мес. – менее 70 Ед/л., с 1 года до 14 лет – менее 45 Ед/л, у женщин – менее 35 Ед/л, у мужчин – менее 50 Ед/л.
В клинической практике широко применяется одновременное определение уровня двух трансаминаз – аспартатаминотрансферазы (AСT) и аланинаминотрансферазы (АЛТ) в сыворотке крови.
Ферменты АЛТ и АСТ содержатся практически во всех клетках человеческого организма. Однако самый высокий уровень фермента АЛТ содержится в печени, поэтому уровень данного энзима служит специфическим маркером поражения печени. В свою очередь, АСТ помимо печени (в порядке снижения концентрации) содержится в сердечной и скелетных мышцах, почках, поджелудочной железе, легких, лейкоцитах и эритроцитах [6, 7, 8].
В печени АЛТ присутствует только в цитоплазме гепатоцитов, а АСТ – в цитоплазме и в митохондриях. Более 80% печеночной АСТ представлено именно митохондриальной фракцией [6, 7, 8].
В норме постоянство концентрации транс-аминаз в плазме крови отражает равновесие между их высвобождением вследствие физиологического апоптоза состарившихся гепатоци-тов и элиминацией. Соотношение синтеза АСТ/ АЛТ в печени равно 2,5/1. Однако при нормальном обновлении гепатоцитов уровни АСТ и АЛТ в плазме крови практически одинаковы (30–40 Ед/л) из-за более короткого периода полувыведения АСТ (18 ч против 36 ч у АЛТ).
При заболеваниях печени в первую очередь и наиболее значительно повышается активность АЛТ по сравнению с АСТ. Например, при остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных, однако преобладает уровень АЛТ, содержащейся в цитоплазме, вследствие ее быстрого выхода из клетки и поступления в кровяное русло. Таким образом, по уровню АЛТ судят о биохимической активности заболевания печени. Повышение показателя в 1,5–5 раз от верхней границы нормы свидетельствует о низкой активности процесса, в 6–10 раз – об умеренной и более 10 раз – о высокой биохимической активности. Повышение активности трансаминаз более 6 месяцев является биохимическим признаком хронического гепатита [6, 7].
Некоторые лекарственные препараты (например, вальпроевая кислота) метаболизируются в митохондриях гепатоцитов [9], поэтому ранним лабораторным маркером гепатотоксичности может быть лишь изолированное повышение АСТ.
Помимо патологии печени АСТ служит одним из ранних маркеров повреждения сердечной мышцы (повышается у 93–98% больных инфарктом миокарда до 2–20 норм); специфичность его не высока. Уровень ACT в сыворотке крови возрастает через 6–8 часов после начала болевого приступа, пик приходится на 18–24 часа, активность снижается до нормальных значений на 4–5 день. Нарастание активности фермента в динамике может свидетельствовать о расширении очага некроза, вовлечении в патологический процесс других органов и тканей, например, печени [7].
Интенсивные мышечные упражнения с чрезмерной нагрузкой также могут вызвать преходящее увеличение уровня ACT в сыворотке крови. Миопатии, дерматомиозиты и другие заболевания мышечной ткани вызывают повышение трансаминаз, преимущественно за счет АСТ.
Умеренное увеличение активности АСТ (в 2–5 раз от верхней границы нормы) отмечается при острых панкреатитах и гемолитических анемиях.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах цирроза стойкий незначительный подъем аминотрансфераз выявляют в 74–77% случаев, и, как правило, преобладает активность АСТ над АЛТ в два и более раз.
Снижение активности АЛТ и АСТ имеет место при недостаточности пиридоксина (витамина В6), при почечной недостаточности, беременности.
Ниже приведены печеночные и внепеченочные причины повышения активности аминотрансфераз в сыворотке крови (табл. 2).
Помимо оценки уровня трансаминаз в клинической практике широко применяется коэффициент де Ритиса – отношение АСТ к АЛТ (АСТ/АЛТ). В норме значение этого кэффициента составляет 0,8–1,33. Следует отметить, что расчет коэффициента де Ритиса целесообразен только при выходе АСТ и/или АЛТ за пределы референтных значений.
У новорожденных детей соотношение АСТ/АЛТ обычно превышает 3,0, однако к пятому дню жизни снижается до 2,0 и ниже.
При поражениях печени с разрушением гепатоцитов преимущественно повышается АЛТ, коэффициент де Ритиса снижается до 0,2–0,5. При патологии сердца преобладает уровень АСТ, и коэффициент де Ритиса повышается. Однако для точной дифференциальной диагностики этот коэффициент непригоден, так как нередко при алкогольном поражении печени, неалкогольном стеатогепатите, циррозе печени также преобладает повышение АСТ и коэффициент де Ритиса составляет 2,0–4,0 и более. Значение данного коэффициента выше нормы часто наблюдается при обтурационных желтухах, холециститах, когда абсолютные значения АЛТ и АСТ невелики.
1. При остром вирусном и хроническом гепатитах, особенно на ранних стадиях, активность АЛТ выше, чем АСТ (коэффициент де Ритиса меньше 1,0). Тяжелое поражение паренхимы печени может изменить это соотношение.
2. При алкогольном гепатите и циррозе нередко активность АСТ оказывается выше, чем АЛТ (коэффициент де Ритиса больше 1,0).
3. При остром ИМ активность АСТ выше, чем АЛТ (коэффициент де Ритиса больше 1,5).
ЛАКТАТДЕГИДРОГЕНАЗА
Референтные значения ЛДГ для новорожденных – до 600 Ед/л, у детей с 1 года до 12 лет активность ЛДГ – 115 – 300 Ед/л, для детей старше 12 лет и у взрослых норма ЛДГ – до 230 Ед/л.
Лактатдегидрогеназа (ЛДГ) – гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пируват, широко распространен в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза [7].
При электрофорезе или хроматографии удается обнаружить 5 изоферментов ЛДГ, отличающихся по своим физико-химическим свойствам. Наибольшее значение имеют два изофермента – ЛДГ1 и ЛДГ5. Фракция ЛДГ1 более активно катализирует обратную реакцию превращения лактата в пируват. Она в большей степени локализуется в сердечной мышце и некоторых других тканях, в норме функционирующих в аэробных условиях. В связи с этим миокардиальные клетки, обладающие богатой митохондриальной системой, окисляют в цикле трикарбоновых кислот не только пируват, образующийся в результате протекающего в них самих процесса гликолиза, но и лактат, образующийся в других тканях. Фракция ЛДГ5 более эффективно катализирует прямую реакцию восстановления пирувата в лактат. Она локализуется преимущественно в печени, в скелетных мышцах. Последние нередко вынуждены функционировать в анаэробных условиях (при значительной физической нагрузке и быстро наступающем утомлении). Образующийся при этом лактат с кровотоком попадает в печень, в которой он используется для процесса глюконеогенеза (ресинтеза глюкозы), а также в сердце и другие ткани, где происходит его преобразование в пируват и вовлечение в цикл трикарбоновых кислот (цикл Кребса). Любое повреждение клеток тканей, содержащих большое количество ЛДГ (сердце, скелетные мышцы, печень, эритроциты), приводит к повышению активности ЛДГ и ее изо-ферментов в сыворотке крови. Наиболее частыми причинами повышения активности ЛДГ являются:
1. Поражение сердца (острый инфаркт миокарда, миокардит, застойная сердечная недостаточность); в этих случаях обычно преобладает повышение активности ЛДГ1 и/или ЛДГ2.
2. Поражение печени (острые и хронические гепатиты, цирроз печени, опухоли и метастазы печени), когда преимущественно увеличивается изофермент ЛДГ5, ЛДГ2, ЛДГ4.
3. Повреждение скелетных мышц, воспалительные и дегенеративные заболевания
скелетных мышц (преимущественно увеличение изофермента ЛДГ1, ЛДГ2, ЛДГ3).
4. Заболевания крови, сопровождающиеся распадом клеток крови: острый лейкоз, гемолитическая анемия, В12-дефицитная анемия, серповидноклеточная анемия, а также заболевания и патологические состояния, сопровождающиеся разрушением тромбоцитов (массивная гемотрансфузия, эмболия легочной артерии, шок и др.). В этих случаях может преобладать повышение активности ЛДГ2, ЛДГ3.
5. Острый панкреатит.
6. Заболевания легких (пневмония и др.)
7. Инфаркт почки.
8. Опухоли (повышенный уровень ЛДГ наблюдается в 27% случаев опухолей в I стадии и в 55% – метастатических семином).
Следует помнить, что многие заболевания сердца, скелетных мышц, печени и крови могут сопровождаться повышением активности в сыворотке крови общей ЛДГ без отчетливого преобладания какого-либо из ее изоферментов.
Таблица 3. Эффективность гепатопротекторов при синдроме цитолиза (по С. В. Морозову с соавт., 2011 г. и Н. Б. Губергриц, 2012 г.) [10]
Читайте также:
