Строение и функции протеинтриозинкиназ - PDGF, IRS
Добавил пользователь Алексей Ф. Обновлено: 16.01.2026
1. Введение. Общие принципы построения протеинкиназ. Биологическая роль.
Большая группа ферментов, объединенная под названием “протеинкиназы”, катализирует перенос концевого остатка фосфата с АТФ на различные группы в структуре белка. Протеинкиназы разделены на пять больших классов в зависимости от того, на какие группы в структуре белка переносится остаток фосфата. Протеинкиназы первого класса переносят фосфат на спиртовые группы серина и треонина. Протеинкиназы второго класса переносят фосфат на спиртовые группы тирозина. Протеинкиназы третьего класса образуют фосфоамидные связи, перенося остаток фосфата на атомы азота гистидина, лизина или аргинина. Протеинкиназы четвертого класса фосфорилируют остатки цистеина в структуре белка. Наконец, протеинкиназы пятого класса способны фосфорилировать остатки аспарагиновой и глутаминовой кислот.
Протеинкиназы, фосфорилирующие спиртовые группы серина, треонина и тирозина, наиболее подробно исследованы и имеют много общего в структуре и свойствах.
В ходе реакции, катализируемой протеинкиназами двух первых классов, нейтральная спиртовая группа белка превращается в сложный эфир, несущий большой отрицательный заряд. Введение отрицательного заряда в ранее нейтральную область может приводить к значительным изменениям в структуре белка, а значит, и к изменению его свойств.
Простая химическая модификация молекулы белка, происходящая под действием протеинкиназ, является эффективным и широко распространенным способом регуляции активности многих ферментов и других внутриклеточных белков. Остаток фосфорной кислоты, перенесенный протеинкиназой на спиртовую группу белка, может быть удален под действием другого фермента – фосфатазы. Таким образом, протеинкиназы и фосфатазы образуют две группы ферментов-антагонистов, способных осуществлять обратимую ковалентную модификацию белков-мишеней и тем самым регулировать их активность.
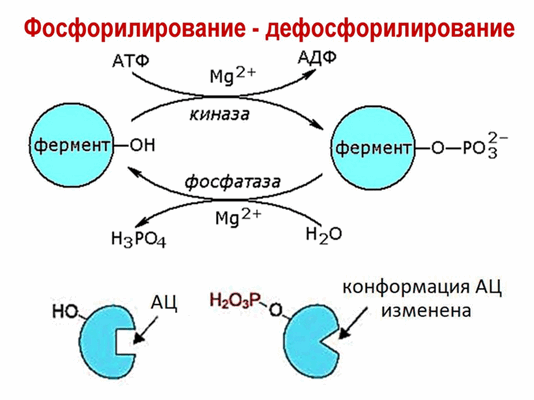
Рис. 1 Обратимая ковалентная модификация белков-мишеней,
Протеинкиназы относятся к группе сложно устроенных ферментов, так как они должны взаимодействовать , как минимум, с двумя субстратами. Протеинкиназы должны иметь специальный центр связывания АТФ или других нуклеозидтрифосфатов, которые используются в качестве доноров остатков фосфата, а также специальный центр связывания белка-субстрата, на который осуществляется перенос фосфатной группы.
Для того чтобы осуществить перенос фосфата с АТФ на белок, нужен специальный активный центр, содержащий определенные аминокислотные остатки, которые непосредственно участвуют в переносе фосфата от АТР на белок. Два субстрат связывающих участка (участок связывания АТФ и участок связывания белка-субстрата) должны располагаться поблизости и быть соответствующим образом ориентированы относительно друг друга. Только в этом случае становится возможным эффективный перенос остатка фосфата. Субстрат связывающие участки должны обладать достаточно высокой специфичностью.
Регуляторные участки протеинкиназ крайне разнообразны, поэтому активность этих ферментов может точно и тонко регулироваться. Вследствие всех перечисленных свойств протеинкиназы играют исключительно важную роль в передаче сигнала внутрь клетки.
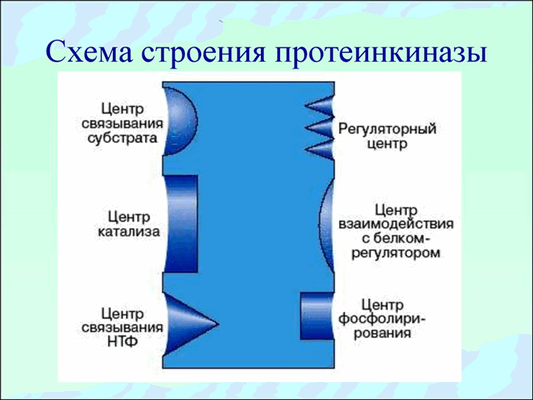
Рис.2 Общая схема строения протеинкиназ
Субстратами протеинкиназ являются белки ионных каналов, ферменты, регулирующие метаболические процессы, белки рибосом, ядерные белки, белки цитоскелета и т.д.
2. Протеинкиназа А, строение, участие в регуляции обмена гликогена и триацилглицеридов, CRE.
Протеинкиназа А - строение, участие в регуляции обмена гликогена и триацилглицеридов, CRE.
Протеинкиназа А, или цАМФ-зависимая протеинкиназа (КФ 2.7.11.1), относится к семейству ферментов, активность которых зависит от уровня циклического АМФ (цАМФ) в клетке. Протеинкиназа А является самой изученной из всех протеинкиназ, её функции разнообразны, она участвует в регуляции метаболизма гликогена и липидов, её субстратами могут быть другие протеинкиназы или другие ферменты.
В неактивном состоянии молекула протеинкиназы А является является тетрамером — состоит из двух регуляторных ( R ) и двух каталитических субъединиц. Если уровень цАМФ в клетке низкий, то фермент остается интактным, и каталитическая активность отсутствует. При возрастании концентрации цАМФ в клетке он связывается с двумя сайтами связывания на регуляторных субъединицах протеинкиназы А, в результате происходят конформационные изменения фермента, в результате которых тетрамер протеинкиназы А диссоциирует на два димера (2 R и 2С). Открытые активные центры каталитических субъединиц переносят концевой фосфат молекулы АТФ на остатки серина или треонина белков - субстратов протеинкиназы А.
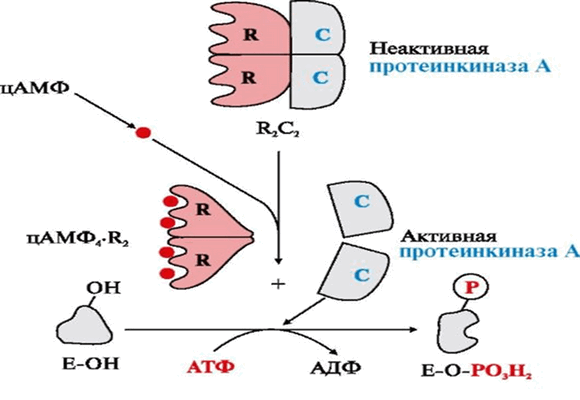
Рис. 1. Активация протеинкиназы А путем диссоциации тетрамера.
Протеинкиназы А представлены во многих типах клеток и проявляют каталитические активности в отношении разных субстратов.
Например, субстратами ПК А являются ферменты, участвующие в метаболизме гликогена. Действие гормонов на синтез и распад гликогена опосредовано изменением в противоположном направлении активности двух ключевых ферментов: гликогенсинтазы (гликогеногенез) и гликогенфосфорилазы (гликогенолиз) при помощи их фосфорилирования/дефосфорилирования. Так фосфорилирование гликогенфосфорилазы приводит к активации фермента, а фосфорилирование гликогенсинтазы, наоборот, к инактивации фермента.
Это переключение происходит при переходе из абсорбтивного состояния в постабсортивное, а также при смене состояния покоя на режим физической работы. В печени оно осуществляется при участии гормонов инсулина, глюкагона и адреналина, а в мышцах — инсулина и адреналина.
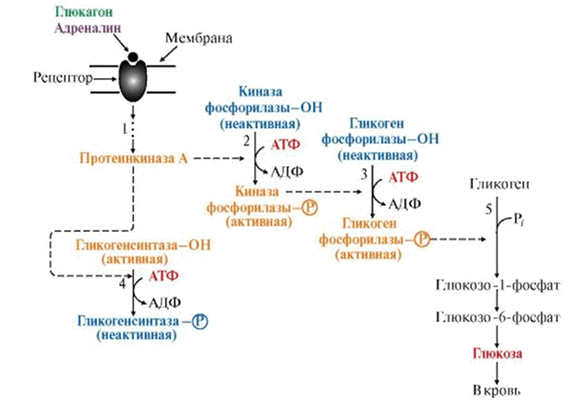
Рис. 2. Участие ПК А в регуляции синтеза и распада гликогена.
ПК А принимает участие и в мобилизации триглицеридов. Мобилизация депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматотропным, кортизолом). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая фосфорилирует и, таким образом, активирует диацилглицерол липазу или гормончувствительную липазу ( HSL ), что инициирует липолиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который действует через β-адренергические рецепторы адипоцитов, активирующие аденилатциклазную систему.
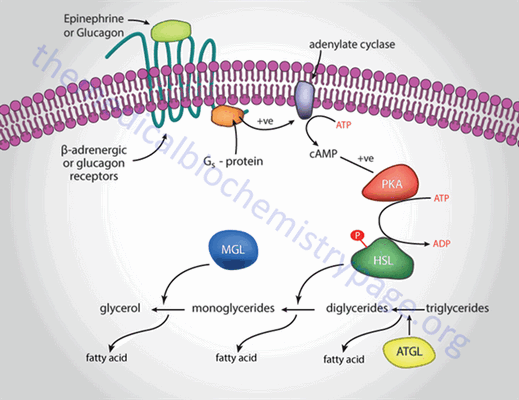
Рис. 3. Гормональная регуляция мобилизации жиров в постабсорбтивном периоде, при голодании и физической работе.
Следует отметить, что действие протеинкиназы А, вызванное фосфорилированием белков-субстратов, как правило, кратковременное, так как протеинфосфатазы, сопряженные с протеинкиназами, быстро дефосфорилируют белки-мишени, ранее фосфорилированные протеинкиназой А.
Протеинкиназа А участвует в цАМФ-стимулируемой транскрипции генов, которые имеют цАМФ-реактивный элемент в регуляторном участке. Повышение концентрации цАМФ ведет к активации протеинкиназы А, которая в ответ фосфорилирует транскрипционный фактор CREB по остатку серина 133; CREB своим фосфорилированным участком связывает коактиватор транскрипции и стимулирует транскрипцию.
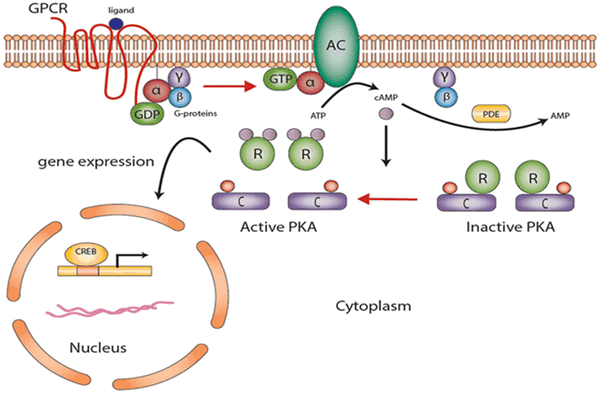
Рис. 4. Участие протеинкиназы А в цАМФ-стимулируемой транскрипции генов.
При прямом фосфорилировании белка ПK A напрямую увеличивает или снижает активность белка. При синтезе белка ПКА сначала непосредственно активирует CREB, который связывает элемент ответа cAMP (CRE), изменяя транскрипцию, и, следовательно, синтез белка. Как правило, этот механизм требует больше времени (от часов до дней).
Активность протеинкиназы А регулируется и по механизму отрицательной обратной связи. Одним из субстратов, активируемых протеинкиназой А, является фосфодиэстераза, которая быстро превращает цАМФ в АМФ, тем самым уменьшая количество цАМФ, которое может активировать протеинкиназу А.
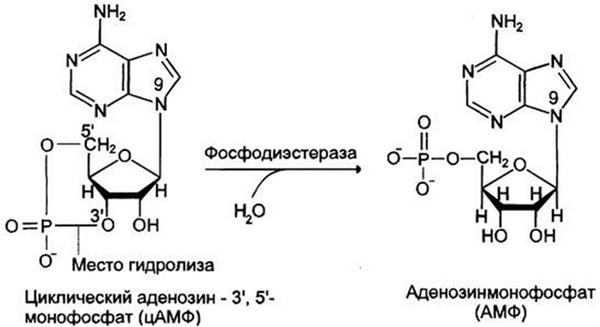
Рис. 5. Фосфодиэстераза гидролизует фосфодиэфирную связь и превращает цАМФ в АМФ.
Строение и функции протеинтриозинкиназ - PDGF, IRS
Строение и функции протеинтриозинкиназы Src
• Src активируется при снятии внутристерического ингибирования
• Активация Src включает высвобождение модульных связывающих доменов для их взаимодействий с другими белками
• Src часто ассоциирует с рецепторами, включая рецепторную тирозинкиназу
Первой из обнаруженных протеинтирозинкиназ был фермент Src, идентифицированный как трансформирующее начало вируса саркомы Рауса. Src является прототипом многих аналогичных ферментов, входящих в семейство киназ Src. Эта киназа участвует во многих путях передачи сигналов, находящихся под контролем рецепторов на поверхности клетки, в том числе и тех, у которых отсутствует собственный киназный домен.
Src связывается с плазматической мембраной посредством N-концевой миристильной группы. В неактивном состоянии остаток Tyr527, расположенный на С-концевом участке каталитического домена Src, фосфорилируется с участием CSK (С-концевая Src киназа).
На представлена структура Src и механизм регуляции ее активности. Фосфорилирование Tyr527 вызывает его связывание с собственным доменом киназы, SH2. Домены SH2 и SH3 подавляют активность фермента за счет взаимодействия на поверхности молекулы белка.
Домен SH3 связывается со своим сайтом, расположенном на некотором расстоянии от активного сайта. Активация Src при дефосфорилировании Tyr527 приводит к диссоциации SH2. Это вызывает конформационные изменения в домене SH3, и он отщепляется от своего сайта. У препаратов вирусной Src, участок, расположенный до Tyr527, часто бывает утрачен, что служит причиной их повышенной активности.
Конформационные изменения киназного домена, наступающие после диссоциации SH3, приводят к аутофосфорилированию остатка Tyr416 в петле активации Src, и к дальнейшему увеличению протеинкиназной активности. Важным последствием взаимодействия Src со своими собственными SH2 и SH3 доменами является то, что когда эти домены заингибированы, они не могут связывать никаких белков.
Поэтому взаимодействия с другими белками становятся возможны только после высвобождения доменов SH2 и SH3 из связи с киназным доменом Src. Гетерологичные взаимодействия доменов SH2 и SH3 способствуют соответствующей локализации Src и передаче сигнала.
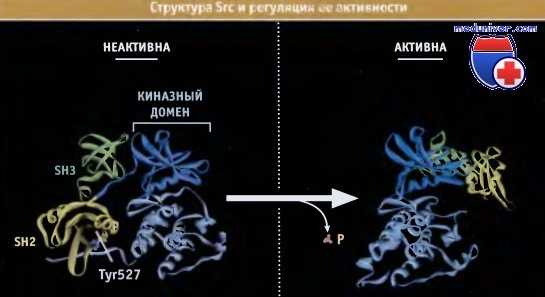
Структура активной и неактивной форм Src.
Неактивный белок связан со своими доменами SH2 и SH3 и находится в заингибированном состоянии.
Домен SH2 связан с фосфорилированным остатком Tyr527.
Домен SH3 связывается с неканонической последовательностью связывания SH3 на противоположной стороне домена активности киназы.
В отличие от стерического ингибирования РКА, вызванного субъединицей R, ингибирование Src доменами SH2 и SH3 носит аллостерический характер.
В активной структуре домены SH2 и SH3 не связаны с киназным доменом и могут принимать участие в гетерологичных взаимодействиях.
Структуры построены по данным Protein Data base files 1FMK и 1Y57.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
• Протеинкиназы представляют собой большое семейство белков
• Протеинкиназы фосфорилируют Ser и Thr либо Tyr или же все три аминокислотных остатка
• Протеинкиназы узнают последовательность аминокислот, окружающую сайт фосфорилирования
• Протеинкиназы преимущественно узнают сайты фосфорилирования, расположенные в скрученных доменах
Фосфорилирование белков представляет собой наиболее распространенную форму их регуляторной посттрансляционной модификации. Оно происходит у всех организмов, и показано, что примерно 1/3 всех белков в клетке млекопитающих в определенные моменты времени подвергается фосфорилированию. Фосфорилирование может стимулировать или ингибировать каталитическую активность ферментов, сродство, с которым белок связывается с другими молекулами, его внутриклеточную локализацию и способность к дальнейшим ковалентным модификациям, или изменять его стабильность. При фосфорилировании одного остатка активность белка может измениться в 500 и более раз, и часто белки фосфорилируются по нескольким сайтам сложными и взаимозависимыми путями.
Большинство белков клеток эукариот и практически все в клетках животных фосфорилируются с участием протеинкиназ; их дефосфорилирование катализируется фосфопротеинфосфатазами. Оба класса ферментов находятся под контролем различных механизмов. Часто, наряду с этим, белки фосфорилируются несколькими протеинкиназами, что приводит к возникновению фосфорилированных форм, обладающих различной активностью. Это позволяет интегрироваться различным входным сигналам, обеспечивая активацию белков-мишеней.
У бактерий, растений и грибов важную роль играет еще одна система фосфорилирования белков, которая называется двухкомпонентной сигнальной системой. Участвующие в этой системе протеинкиназы отличаются от соответствующих ферментов эукариот и фосфорилируют остатки аспарагиновой кислоты, а не серина, треонина или тирозина.
Протеинкиназы переносят фосфатную группу с АТФ на остатки Ser, Thr и Tyr в белковых субстратах, образуя химически устойчивые фосфорные эфиры.
У животных фосфатные группы неравномерно распределяются среди трех остатков аминокислот: 90-95% приходится на остатки Ser, 5-8% на Thr, и менее 1% — на Tyr. В геноме человека содержится примерно 500 генов, кодирующих протеинкиназы, и для многих их мРНК характерен альтернативный сплайсинг. Это делает семейство генов протеинкиназ одним из наиболее представительных. Количество протеинкиназ и их разнообразие служат подтверждением широкого участия этих ферментов в регуляции клеточных функций. Хотя некоторые протеинкиназы характеризуются ограниченным тканевым распределением и участвуют не во всех процессах развития, многие из них распространены достаточно широко.
Классификация протеинкиназ основывается на их специфичности по отношению к остаткам аминокислот. Киназы, которые фосфорилируют остатки Ser, обычно также узнают остатки Thr; отсюда их название Ser/Thr киназы. У многоклеточных организмов Tyr киназы специфичны только по отношению к остаткам Tyr. Протеинкиназы, обладающие двойной специфичностью, могут фосфорилировать Ser, Thr и Tyr при строго определенной конформации субстрата и обычно являются наиболее селективными из протеинкиназ.
Анализ киномов нескольких организмов привел к более подробной классификации киназ, основанной на степени гомологии их первичной структуры. В какой-то степени эта классификация также отражает специфику регуляторных механизмов и субстратную специфичность киназ. Например, группа AGC называется в соответствии с входящими в нее цАМФ-зависимой протеинкиназой (РКА), циклоГМФзависимой протеинкиназой (PKG), Са2+ и фосфолипидзависимой проотеинкиназой (РКС). Эти протеинкиназы регулируются с участием вторичных мессенджеров и предпочитают субстраты, которые содержат остатки основных аминокислот, расположенные рядом с сайтом фосфорилирования.
Наряду со специфичностью по отношению к остаткам аминокислот, большинство протеинкиназ проявляет селективность в отношении локальных последовательностей, окружающих субстратный сайт. Разработаны методы скрининга, позволяющие выяснить, содержат ли белки в субстратном сайте консенсусную последовательность для широкого набора протеинкиназ. Для идентификации и общей оценки степени фосфорилирования белков в специфических сайтах можно использовать антитела. Наряду с узнаванием отдельных белков, протеинкиназы могут обнаруживать заметную субстратную специфичность среди родственных белков, например основанную на их общей трехмерной структуре, или среди белков, которые были дифференциально ковалентно модифицированы, например фосфорилированы или убиквитинилированы.
Некоторые протеинкиназы клеток млекопитающих представляют собой гормональные рецепторы, проходящие через плазматическую мембрану. Рецепторы некоторых протеинкиназ представляют собой такие серин/треонин киназы, как рецептор трансформирующего фактора роста-b (TGF-b). Однако в большинстве случаев они являются протеин-тирозинкиназами, включая инсулиновые рецепторы, эпидермальный ростовой фактор (PDGF), и другие регуляторы роста и дифференцировки клеток. Прочие протеинкиназы представляют собой растворимые внутриклеточные ферменты, хотя они могут связываться с мембраной одной или нескольких органелл.
В результате рентгеноструктурного исследования кристаллической структуры протеинкиназ было получено мнгого информации относительно механизма их активации. Минимальный размер консервативного каталитического ядра протеинкиназ составляет около 270 аминокислот, что соответствует минимальной молекулярной массе примерно 30 000 Да. В этом ядре находятся скрученные домены, образующие на границе раздела активный сайт. Один или несколько остатков лизина (Lys) или аспарагиновой кислоты (Asp), которые необходимы для фосфорилирования, часто мутируют, что приводит к потере активности киназой. Последовательность, расположенная рядом с активным сайтом, называется петлей активации и часто изменяет свою конформацию, образуя активные формы протеинкиназы. Эта последовательность в семействе протеинкиназ представляет собой наиболее частый сайт регуляторного фосфорилирования. На поверхности молекул протеинкиназ находятся уникальные участки, которые определяют специфичность локализации ферментов, их взаимодействие с другими регуляторными молекулами, и узнавание субстратов. Эти участки обеспечивают возможность классификации протеинкиназ и проведения с ними генетических процедур.
В дополнение к разнообразию и полифункциональности киназ, у этих ферментов выработалось множество разнообразных регуляторных механизмов. Эти механизмы включают аллостерическую активацию и ингибирование липидами, небольшими растворимыми молекулами и белками, фосфорилирование, оказывающее активирующее и ингибирующее действие, и другие ковалентные модификации, включая протеолиз, а также связывание с каркасными и адаптерными структурами, приводящее к увеличению их активности или ограничивающее неспецифическую активность. Многие из этих факторов могут регулировать одну протеинкиназу в составе сложного комплекса. Более того, многие протеинкиназы действуют в цепи процессов, как в протеинкиназном каскаде (см. рис. 14.38), и могут создавать уникальный комплекс процессов передачи сигналов.
Протеинкиназы переносят у-фосфатную группу от АТФ на остатки серина, треонина или тирозина в белковых субстратах. У человека протеинкиназные гены в соответствии с первичной структурой подразделяются на семь основных групп.
Одна большая группа содержит тирозинкиназы. Остальные группы специфичны к Ser/Thr, или проявляют двойную специфичность, и называются в соответствии с наиболее известными их представителями.
Группа AGC называется по РКА, PKG, и РКС.
САМК — по кальций, калмодулин-зависимым киназам,
CMGC — по CDK, МАРК, GSK3, Glks,
СК1 — по казеинкиназе-1;
STE — по Ste20, Ste11 и Ste7;
МАРК4К, МАРКЗК и МАРК2К участвуют в спаривании дрожжей;
и TKL — ферменты, напоминающие Tyr киназу. Структуры нефосфорилированной, неактивной формы МАРК, ERK2, и фосфорилированной, активной ERK2.
ERK2 обладает типичной структурой протеинкиназы. Меньший, N-концевой домен состоит в основном из b-листов, а более крупный С-концевой домен имеет структуру а-спирали.
Активный сайт формируется на границе двух доменов.
Петля активации выходит из активного сайта и после фосфорилирования остатков Tyr и Thr повторно скручивается,
что изменяет положение аминокислотных остатков в активном сайте. АТФ (не показан) связывается с внутренней частью активного сайта;
связывание белковых субстратов с поверхностью С-концевого домена облегчается реорганизацией петли активации.
Структуры построены по данным Protein Data Bank files 1ERK и 2ERK.
Большая группа протеинтирозинкиназ представляет собой рецепторы, которые проходят через плазматическую мембрану и способны связывать внеклеточные лиганды. Обычно рецепторы активируются под действием ростовых факторов, нормальная физиологическая функция которых состоит в обеспечении роста, пролиферации, развития или процесса дифференцировки.
К этой группе относятся рецепторы инсулина, эпидермального (EGF) и тромбоцитарного (PDGF) факторов роста. Эти рецепторы контролируют активность представителей многих других семейств протеинкиназ и непосредственно регулируют другие сигнальные белки.
Поскольку рецепторные тирозинкиназы играют роль регуляторов роста, мутации, которые приводят к их активации, часто оказываются онкогенными. Например, онкоген erbВ возникает в результате мутации, приводящей к утрате домена, связывающего внеклеточный лиганд и находящегося в молекуле киназы, родственной рецептору EGF.
В результате этой мутации происходит конститутиваная активация домена протеинкиназы. Точечные мутации, затрагивающие трансмембранный домен, также могут вызывать активацию онкогенов, как это, например, имеет место для онкогена neu/HER2, близкого к рецептору EGF.
Рецепторные тирозинкиназы различаются по внеклеточным доменам связывающим лиганды и, исключая консервативный тирозинкиназный домен, по их внутриклеточным регуляторным областям. Обычно эти рецепторы, в расчете на мономер, один раз проходят через мембрану, однако некоторые из них проходят два раза.
Это, например, имеет место для инсулинового рецептора, представляющего собой гетеротетрамер, связанный дисульфидными связями. Связывание лиганда с рецептором тирозинкиназы способствует его олигомеризации и увеличивает активность киназы. При этом усиливается фосфорилирование Tyr во внутриклеточном домене рецептора и связанных с ним молекул. Эти последовательности, содержащие сайты фосфорилированного тирозина, создают места связывания для дополнительных передатчиков сигналов и адаптеров.
Сравнение PDGF и инсулиновых рецепторов выявляет общие характеристики и свойства рецепторных тирозинкиназ. Два рецептора PDGF представляют собой мономерные рецепторные тирозинкиназы. Инсулиновый рецептор существует в двух формах, образующихся при альтернативном сплайсинге, каждая из которых является гетеротетрамером двух а- и двух b-субъединиц. В каждом случае изоформы рецептора используют уникальные механизмы передачи сигналов.
PDGF как и инсулин стимулируют активность киназы своих рецепторов, что приводит к образованию олигомеров и к аутофосфорилированию. Как показано на рисунке ниже, в PDGF рецепторе фосфорилируются семь или более сайтов, и каждый остаток фосфотирозина образует сайт связывания для одного или нескольких белков, содержащих SH2 домен. PDGF рецептор связывает РI3-киназу, р190 Ras GAP, фосфолипазу С-у, Src (который может катализировать фосфорилирование дополнительных остатков Tyr рецептора), и SH2 тирозин фосфатазу, которая сама связывает адаптер Grb2.
Все эти белки, за исключением Src, также являются субстратами для рецептора. Таким образом, отбор субстратов для связывания с рецептором происходит при специфическом взаимодействии их SH2 доменов с фосфотирозиновыми рецепторами, что приводит к изменению активности и характера распределения многочисленных внутриклеточных передатчиков сигнала. В результате прохождения всех сигнальных событий, в процессе развития и при заживлении ран усиливается пролиферация соединительной ткани.
Как показано на рисунке ниже, инсулиновый рецептор подвергается аутофосфорилированию, в результате чего он стабилизируется в активном состоянии и на нем образуется небольшое количество сайтов связывания. Ключевым событием является фосфорилирование Tyr белковых субстратов инсулинового рецептора (IRS), а именно IRS1, которое происходит, по крайней мере, по двенадцати сайтам.
IRS1 взаимодействует с несколькими сигнальными эффекторами, которые, в случае PDGF непосредственно связываются с рецептором. К числу этих мишеней относится PI-3 киназа, активирующая Akt-2. Также при этом затрагиваются несколько существенных метаболических эффектов инсулина. Белки IRS также фосфорилируются серин/треонинпротеинкиназой, что модулирует их способность к передаче сигналов.
Фосфорилирование остатков Tyr часто приводит к усилению ферментативной активности белков. Часть белков активируется, главным образом, вследствие того что становится ближе к своим мишеням. Это происходит за счет связывания их SH2 доменов с фосфотирозиновыми сайтами рецептора или IRS авдаптера. Детали функционирования многих рецепторов тирозинкиназы определяются перекрывающимся набором передатчиков сигнала, с которыми они взаимодействуют, различиями в количестве этих передатчиков и дополнительных адаптерных белков, а также характером экспрессии рецептора.
PDGF связывается со своим рецептором и индуцирует его аутофосфорилирование.
Фосфорилированный рецептор связывает белки-мишени, содержащие домены SH2. Связывание инсулина со своим рецептором приводит к активации рецепторной протеинтирозинкиназы и к ее аутофосфорилированию.
Рецепторная киназа также фосфорилирует IRS1, большой адаптерный белок, содержащий много потенциальных сайтов фосфорилирования.
IRS1 является необходимым промежуточным компонентом действия инсулина.
PI 3-киназа связывается с IRS1 через SH2 домен, находящийся в субъединице р85.
Akt и PDK1 связываются с PIР3, который образуется активированной PI 3-киназой таким образом, что PDK1 может фосфорилировать и активировать Akt.
Молекулярная регуляция метаболизма и клеточного цикла
Читайте также:
- Липома головного мозга на МРТ
- Объединенные корешки спинного мозга на МРТ, миелограмме
- Пассивные реакции агглютинации. Непрямые реакции агглютинации. Реакция непрямой, или пассивной, гемагглютинации ( РНГА, РПГА ). Обратная РНГА. Реакция торможения пассивной гемагглютинации ( РТПГА ).
- Диагностика аденовирусной инфекции. Лечение и профилактика аденовирусной инфекции
- Гипертонический криз. Причины и патогенез гипертонического криза.
