Перикраниальный синус на КТ, ангиограмме
Добавил пользователь Владимир З. Обновлено: 29.12.2025
Авторы: Савватеева Д.М. 1 , Джафарова М.З. , Свистушкин В.М. 2
1 ГБОУ ВПО «Первый МГМУ им. И.М. Сеченова» МЗ РФ, Москва
2 ФГАОУ ВО «Первый МГМУ им. И.М. Сеченова» Минздрава России (Сеченовский Университет)
Для цитирования: Савватеева Д.М., Джафарова М.З., Свистушкин В.М. Синдром «молчащего» синуса (клиническое наблюдение). РМЖ. 2014;9:700.
Синдром «молчащего» синуса (СМС) включает в себя безболезненную инволюцию верхнечелюстной пазухи (ВЧП) вследствие окклюзии решетчатой воронки (РВ) (образование латеральной стенки носа, относится к переднему отделу решетчатой кости). СМС сопровождается энофтальмом в отличие от простого ателектаза ВЧП [1, 2] (рис. 1, 2). Впервые эти клинические симптомы были описаны профессором Гарвардской медицинской школы W.W. Montgomery в 1964 г. [3].
Сам термин «синдром ”молчащего” синуса» был предложен Soparkar et al. в 1994 г. [4]. С тех пор в литературе описано не более 100 наблюдений [5]. В большинстве случаев поражается ВЧП, однако в зарубежной и отечественной литературе есть описания СМС решетчатого лабиринта и лобной пазухи [6–9]. Первичный, или спонтанный, СМС, возникает в зрелом возрасте, первые симптомы его могут проявляться в течение нескольких месяцев или лет. Причинами развития вторичного СМС являются травмы лица, хронический риносинусит, функциональные эндоскопические эндоназальные вмешательства, а также декомпрессия орбиты у пациентов с эндокринной офтальмопатией (менее чем в 1% случаев) [10]. В клиническом наблюдении C.G. Hobbs et al. СМС развился вследствие введения назогастрального зонда. Как известно, назальная интубация может вызывать развитие острого синусита [11]. Посттравматические случаи СМС встречаются гораздо реже спонтанных, хотя имеют схожую патофизиологию. В зарубежной литературе описано всего 3 таких случая после травмы орбиты. Причем 1 пациент прожил с СМС 30 лет после момента травмы [12].
По мнению большинства авторов, в основе развития СМС лежит длительная гиповентиляция ВЧП, которая развивается по причине анатомических нарушений структур остиомеатального комплекса, в частности крючковидного отростка [4, 9, 13–16]. Аномалии строения крючковидного отростка (гипер- или гипоплазия, парадоксальный изгиб) при дыхании способствуют изменению его положения на вдохе и на выдохе по типу клапанного механизма, а затем и хроническому понижению давления в ВЧП. Со временем гиповентиляция приводит к резорбции газов и секреции. Вследствие этого пазухи заполняются транссудатом, который в дальнейшем преобразуется в густую слизь. Таким образом развивается вялотекущее хроническое воспаление слизистой оболочки. Поскольку давление в пазухе остается пониженным, стенки ее начинают истончаться и втягиваться в просвет – развивается ателектаз ВЧП. Указанная теория считается наиболее приемлемой и подтверждена в исследованиях на животных и людях [9]. VanderMeer et al. предложили различные возможные этиологические факторы блока соустья ВЧП: блок за счет густой слизи, латерализации РВ или средней носовой раковины, назальных полипов, воспаления слизистой оболочки пазухи, гипоплазии ВЧП, наличия клетки Галлера [16].
Согласно классификации Kass, существуют 3 стадии развития ателектаза ВЧП:
1-я стадия, или деформация мембраны, характеризуется латерализацией фонтанеллы;
2-я – костная деформация – втяжением одной или нескольких стенок пазухи;
при 3-й стадии, или стадии клинических проявлений, появляются энофтальм, асимметрия лица [17].
В клиническом наблюдении I. Yiotakis et al. СМС развился у пациента, занимающегося дайвингом в течение 10 лет, максимальная глубина погружения составляла 15 м, при этом больной испытывал неприятные ощущения в проекции левой ВЧП [18].
«Золотым стандартом» диагностики СМС является компьютерная томография (КТ) околоносовых пазух (ОНП), что обеспечивает высокую детализацию костных структур, в отличие от магнитно-резонансной томографии [19]. Однако и на стандартной рентгенограмме ОНП можно определить затемнение и уменьшение в объеме ВЧП. При подозрении на СМС необходимо проводить дифференциальную диагностику с такими заболеваниями, как диффузная липодистрофия, линейная склеродермия, синдром Парри–Ромберга, или прогрессирующая гемиатрофия лица (болезнь неясной этиологии, проявляющаяся в детском или юношеском возрасте односторонней атрофией кожи, подкожной клетчатки и мышц лица, языка, голосовой складки и гортани, выпадением волос, ресниц и бровей, синдромом Горнера, атрофией костей лицевого черепа) [20], врожденная асимметрия лица, различные виды опухолей [21].
Выделяют 2 этапа лечения СМС: санация пазухи для создания нормальной аэрации при помощи эндоскопической операции и реконструкция нижней стенки орбиты при сохранении энофтальма [22]. В большинстве случаев достаточно выполнения только первого этапа для достижения аэрации и регресса энофтальма. Так, в исследовании R.D. Thomas et al. в послеоперационном периоде было отмечено уменьшение энофтальма на 1–2 мм, а на повторной КТ ОНП через 9 мес. объем ВЧП увеличился на 16% [23].
Нами был проведен ретро- и проспективный анализ частоты встречаемости СМС у пациентов с латерализацией РВ. В исследование вошли 35 пациентов, оперированных в клинике болезней уха, горла и носа Первого МГМУ им. И.М. Сеченова. Среди них было 67% женщин (21 пациентка) и 33% мужчин (14 пациентов) в возрасте от 19 до 73 лет (средний возраст – 44±3 года). В ходе исследования по данным КТ ОНП у 14 больных помимо затемнения ВЧП было выявлено уменьшение ее в размерах за счет втяжения костных стенок. Всем пациентам выполнена эндоскопическая операция на ВЧП. Четверым пациентам через 1 год после эндоскопической операции повторно выполнена КТ ОНП – у всех отмечено увеличение объема пазухи на 20%. Исходя из этого можно сделать вывод, что латерализация РВ или всей фонтанеллы является одним из прогностических факторов развития СМС.
Приводим клиническое наблюдение.
Больная Т., 24 г. При поступлении в УКБ № 1 Первого МГМУ имени И.М. Сеченова предъявляла жалобы на боли в области глазного дна справа, дискомфорт при движении правого глазного яблока, косметический дефект со стороны правого глаза. Данные жалобы возникли в январе 2013 г. на фоне относительного здоровья. При осмотре: энофтальм со стороны правого глаза. При передней риноскопии: носовое дыхание не затруднено, слизистая оболочка розовая, влажная, перегородка носа существенно не искривлена, нижние носовые раковины не отечные, отделяемого в полости носа нет. Остальные ЛОР-органы без особенностей. При эндоскопическом осмотре отмечалась выраженная латерализация РВ. На КТ ОНП: затемнение ВЧП и уменьшение ее в размерах за счет втяжения костных стенок (рис. 3). Пациентка консультирована офтальмологом, рекомендована санация хронического очага воспаления. Была проведена эндоскопическая операция на правой ВЧП. Под контролем торцевого эндоскопа осмотрена полость носа справа, проведена медиапозиция средней носовой раковины, РВ латерализована, при помощи обратного выкусывателя резецирован нижний отдел крючковидного отростка, идентифицировано естественное соустье, расширено при помощи щипцов Блексли до 1,5 см. Из пазухи аспирирован густой муцин, отмечено выраженное нависание нижней стенки орбиты. Послеоперационный период протекал без осложнений, проводились туалет полости носа, промывание правой ВЧП через расширенное естественное соустье раствором хлоргексидина, симптоматическая терапия. На фоне проведенного лечения больная отметила исчезновение боли в области глазного дна справа, дискомфорта при движении правого глазного яблока. На повторном КТ ОНП через 1 год отмечалась пневматизация всех ОНП, объем правой ВЧП увеличился на 20% (рис. 4). Также отмечено уменьшение энофтальма.
У данной больной, как и у всех 35 пациентов, удалось добиться достаточного расширения соустья и полной санации пазухи. Ни одному из них не потребовалось проведения реконструкции нижней стенки орбиты.
- Пискунов Г.З., Пискунов С.З. Клиническая ринология. М.: МИА, 2006. 560 с.
- Bossolesi P., Autelitano L., Brusati R., Castelnuovo P. The silen tsinus syndrome: diagnosis and surgical treatment // Rhinology. 2008. Vol. 46. Р. 308–316.
- Montgomery W. Mucocele of the maxillary sinus causing enophtalmos // EyeEarNoseThroatMon. 1964. Vol. 43. Р. 41—44.
- Soparkar C., Patrinely J., Cuaycong M. et al. The silent sinus syndrome. A cause of spontaneous enophtalmos // Ophtalmology. 1994. Vol. 101. Р. 772—778.
- Monos T., Levy J., Lifshitz T., Puterman M. The silent sinus syndrome // IMAJ. 2005. Vol. 7. Р. 333–335.
- Naik R.M., Khemani S., Saleh H.A. Frontal Silent Sinus Syndrome // Otolaryngol Head Neck Surg. 2013 Feb. Vol. 148 (2). Р. 354–355.
- McArdle B., Perry C. Ethmoid silent sinus syndrome causing inward displacement of the orbit: case report // J Laryngol Otol. 2010. Vol. 124. Р. 206–208.
- Braganza A., Khooshabeh R. Ethmoidal involvement in "imploding" (silent) sinus syndrome // Ophthal Plast Reconstr Surg. 2005 Jul. Vol. 21 (4). Р. 305–307.
- Аллахвердиев С.А., Лопатин А.С., Кочетков П.А. Синдром «молчащего» синуса: обзор литературы и описание двух клинических наблюдений // Вестник оториноларингологии. 2010. № 6. С. 81–84.
- Rose G.E., Lund V.J. Clinical features and treatment of late enophthalmos after orbital decompression. A condition suggesting cause for idiopathic imploding antrum (silent sinus) syndrome // Ophthalmology. 2003. Vol. 110. Р. 819–826.
- Hobbs C.G., Saunders M.W., Potts M.J. Spontaneousen ophthalmos: silent sinus syndrome // JLaryngolOtol. 2004 Apr. Vol. 118 (4). Р. 310–312.
- Pawar S.S., Hong S., Poetker D.M. Delayed presentation of silent sinus syndrome after orbitaltrauma // AmJOtolaryngol. 2010 Jan-Feb. Vol. 31 (1). Р. 61–63.
- Blackwell K.E., Goldberg R.A., Calcaterra T.C. Atelectasis of the maxillary sinus with enophthalmos and midfacedepression // Ann Otol Rhinol Laryngol. 1993. Vol. 102. Р. 429–432.
- Gillman G.S., Schaitkin B.M., May M. Asymptomatic Enophthalmos: The Silent Sinus Syndrome // Am J Rhinol. 1999. Vol. 13. Р. 459–462.
- Boyd J.H., Yaffee K., Holds J. Maxillary Sinus Atelectasis with enophthalmos // Ann Otol Rhinol Laryngol. 1998. Vol. 107. Р. 34–39.
- VanderMeer J.B., Harris G., Toohill R.J., Smith T.L. The Silent Sinus Syndrome: A Case Series and Literature Review // Laryngoscope. 2001. Vol. 111. Р. 975–978.
- Kass E.S., Salman S., Rubin P.A., Weber A.L., Montgomery W.W. Chronic maxillary atelectasis // Ann OtolRhinolLaryngol. 1997. Vol. 106. Р. 109–116.
- Yiotakis I., Papanikolaou V., Alatzidou Z., Manolopoulos L., Nikolatou-Galiti O., Ferekidis E. Silent Sinus Syndrome, a case presentation // Rhinology. 2005. Vol. 43. Р. 313–315.
- Gaudino S., DiLella G.M., Piludu F., Martucci M., Schiarelli C., Africa E., Salvolini L., Colosimo C. CT and MRI diagnosis of silent sinus syndrome // Radiol Med. 2013 Mar. Vol. 118 (2). Р. 265–275.
- Гусев Е.И. Нервные болезни / Е.И. Гусев, В.Е. Гречко, Г.С. Бурд. М.: Медицина, 1988. С. 394– 396.
- Burroughs J.R., Hernandez Cospin J.R., Soparkar C.N., Patrinely J.R. Misdiagnosis of silent sinus syndrome // Ophthal Plast Reconstr Surg. 2003 Nov. Vol. 19 (6). Р. 449–454.
- Sesenna E., Oretti G., Anghinoni M.L., Ferri A. Simultaneous management of the enophthalmos and sinus pathologyin silent sinus syndrome: a report of three cases // J Craniomaxillofac Surg. 2010 Sep. Vol. 38 (6). Р. 469–472.
- Thomas R.D., Graham S.M., Carter K.D., Nerad J.A. Management of the orbital floorin silent sinus syndrome // Am J Rhinol. 2003 Mar-Apr. Vol. 17 (2). Р. 97–100.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Перикраниальный синус на КТ, ангиограмме
Диагностика пиальной артериовенозной фистулы по КТ, МРТ, ангиограмме
а) Терминология:
1. Синонимы:
• Пиальная артериовенозная фистула (пАВФ)
2. Определение:
• Пиальная сосудистая мальформация с прямым артериовенозным (АВ) шунтированием:
о Одна или несколько пиальных (корковых) артерий соединяются с единственным венозным сосудом
о Капиллярное ложе или ядро (nidus) между артериями и веной отсутствуют
• Редко (1-2% всех сосудистых мальформаций головного мозга)
б) Визуализация:
1. Общие характеристики пиальной артериовенозной фистулы:
• Лучший диагностический критерий:
о Дилатированная корковая артерия, дренирующая вена; фокальное ядро (nidus) отсутствует
• Локализация:
о На поверхности коры, в паренхиме мозга
о Может встречаться в любом участке головного или спинного мозга:
- Редко в задней черепной ямке
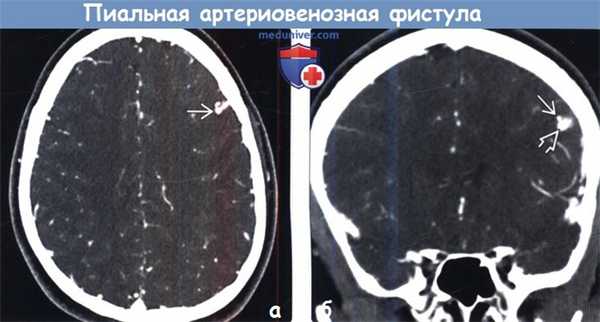
(а) КТ-ангиография, аксиальный срез: у пациента с НГТ определяется расширенный сосуд, лежащий в борозде вдоль поверхности полушария головного мозга.
(б) КТ-ангиография, корональный срез: у того же пациента определяется маленький пучок крошечных артерий, дренируемых в дила тированную вену. Интраоперационно была диагностирована пиальная АВФ.
2. КТ при пиальной артериовенозной фистуле:
• Бесконтрастная КТ:
о Изо-/гиперденсные серпантинные сосуды
• КТ-ангиография:
о Визуализация питающих артерий, дренирующих вен/варикоз-но расширенных вен
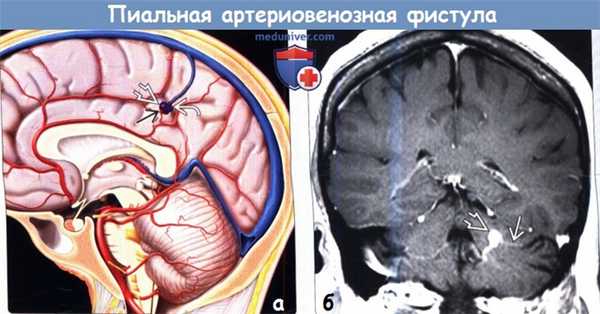
(а) На рисунке показана прямая пиальная артериовенозная фистула, изображенная в виде резкого изменения калибра сосудов: питающие артерии переходят в дилатированную дренирующую вену, которая имеет внешние признаки варикоза. Ядро между артериями и веной отсутствует, что отличает пиальную АВФ от АВМ.
(б) МРТ, постконтрастное Т1-ВИ, корональный срез: определяется пАВФ мозжечка с единственной питающей артерией, дренирующейся в варикозно расширенную вену.
5. Рекомендации по визуализации:
• Лучший инструмент визуализации:
о ЦСА обеспечивает наилучшую визуализацию ангиоархитектоники
• Совет по протоколу исследования:
о КТ-ангиография/контрастная МР-ангиография-лучшие неинвазивные методы
в) Дифференциальная диагностика:
2. Дуральная артериовенозная фистула (дАВФ):
• АВ шунты внутри стенки проходимого/частичнотромбированного синуса твердой мозговой оболочки (СТМО)
• Дренирование в синус твердой мозговой оболочки
• Дифференциальные критерии, отличающие дАВФ от пАВФ:
о Фистулы тесно связаны с СТМО, располагаются внутри его стенки
о Питание преимущественно из артерий твердой мозговой оболочки (менингеальные артерии) >> артерий мягкой мозговой оболочки:
- например, передняя, средняя и задняя менингеальные артерии, тенториальные ветви пещеристого сегмента ВСА, затылочная артерия, восходящая глоточная артерия
3. Аневризмальная мальформация вены Галена:
• Муральный тип-пАВФ вены Галена
• Единственное отличие-локализация:
о Кровоснабжение из срединных задних хориоидальных ветвей в прозенцефалическую вену
о Дренаж через прямой синус или сохраненный синус серпа
г) Патология:
1. Общие характеристики пиальной артериовенозной фистулы:
• Этиология:
о Факторы развития пАВМ: нарушение регуляции ангиогенеза
о Травма
• Генетика:
о Спорадические пАВФ, такие как пАВМ, могут иметь множественные позитивно/негативно-регулируемые гены
о Синдромальные пАВФ ассоциированы с мутацией ННТ1 (ген эндоглина)
2. Макроскопические и хирургические особенности:
• «Артериализация» дренирующих вен:
о Утолщенные стенки + стеноз, вызванная интенсивным кровотоком флебопатия
о Могут иметься варикозные «аневризмы»
д) Клиническая картина пиальной артериовенозной фистулы:
1. Проявления:
• Наиболее частые признаки/симптомы:
о Головная боль
о Шум при аускультации черепа
2. Течение и прогноз:
• ↑↑ риск кровоизлияния по сравнению с АВМ:
о Смертность > 60% при консервативной тактике
3. Лечение:
• Эмболизация:
о Целесообразна при окклюзии вены в участке фистулы
• Микрохирургическое разобщение
Диагностика перикраниального синуса по КТ, МРТ, ангиограмме
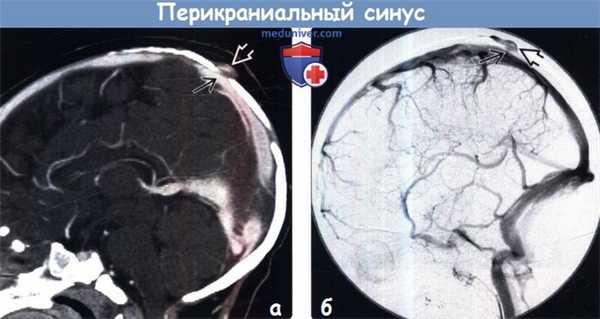
(а) КТ-венография, сагиттальная реформация: у того же пациента наглядно определяется варикозно расширенное венозное образование в мягких тканях головы, сообщающееся через дефект костей свода черепа с подлежащим ВСС.
(б) ЦСА, поздняя венозная фаза: у другого пациента определяется варикозно расширенное венозное образование, сообщающееся с ВСС через крошечную чрескостную вену. Здесь представлен добавочный тип перикраниального синуса (ПС).
2. КТ при перикраниальном синусе:
• Бесконтрастная КТ:
о Объемное образование в мягких тканях головы мягкотканной плотности:
- Септальные перегородки, кисты, флеболиты наблюдаются редко (как правило, при ВМ)
о Костное окно:
- Один/несколько четко очерченный(х) дефект(ов) кости
- Эрозия от давления, оказываемого вышележащей варикозно расширенной веной/ВМ
• КТ с контрастированием:
о Интенсивное хорошо очерченное контрастирование:
- Гетерогенное контрастирование при наличии тромба или ВМ
• КТ-венография: лучший метод визуализации компонентов сосудов
3. МРТ при перикраниальном синусе:
• Т1-ВИ:
о Большинство имеют изо-, гипо- или неоднородный изо-/гипоинтенсивный сигнал:
- Гиперинтенсивный сигнал наблюдается при подостром тромбозе
- Зоны потери сигнала за счет эффекта потока в варикозно расширенных венах/ВМ с интенсивным кровотоком
• Т2-ВИ:
о Большинство имеют гиперинтенсивный сигнал
Неоднородный сигнал от варикозно расширенных вен/ВМ обусловлен турбулентным кровотоком:
- Участки потери сигнала за счет эффекта потока встречаются в варикозно расширенных венах/ВМ с интенсивным кровотоком
• Постконтрастное Т1-ВИ:
о Интенсивное резко отграниченное контрастирование:
- Гетерогенный сигнал при наличии тромба
- При ВМ наблюдается сплошное/периферийное контрастирование
• МР-венография:
о Визуализация всех сосудистых компонентов ПС
4. УЗИ:
• В-режим:
о Визуализация гипоэхогенного объемного образования в мягких тканях головы, а также чрескостных питающей(их) артерии(й)
о Акустическое затенение костями черепа ограничивает оценку внутричерепных структур
• Цветовое допплеровское картирование:
о Визуализация направления кровотока
(а) МРТ, Т2-ВИ, аксиальный срез: объемное образование мягких тканей в лобной области. Обратите внимание на выступающие «участки потери сигнала за счет эффекта потока», а также кортикальную дисплазию в подлежащей ткани мозга.
(б) МРТ, постконтрастное Т1-ВИ, аксиальный срез: у этого же пациента определяется контрастирование сосудистых структур в объемном образовании в мягких тканях головы и подлежащем мозге. (а) МРТ, постконтрастное Т1-ВИ, более краниальный аксиальный срез: у этого же пациента определяются контрастированные тубулярные структуры, расположенные в объемном образовании в мягких тканях головы, а также обращающие на себя внимание медуллярные вены в белом веществе обоих полушарий.
(б) МРТ, постконтрастное Т1-ВИ, сагиттальный срез: у этого же пациента определяется хорошо заметная вена, дренирующая объемное образование в мягких тканях в лобной области.
5. Ангиография:
• Визуализация связи между СТМО и экстракраниальными венами в венозную фазу
6. Другие методы исследования:
• Чрескожная венография (ЧВ):
о Визуализация вен мягких тканей головы о Визуализация чрескостных вен, СТМО непостоянна
7. Рекомендации по визуализации:
• КТ-венография, МРТ с контрастированием (Т1-ВИ)/МР-венография:
о Оба метода подходят для визуализации ПС, ассоциированных внутричерепных аномалий
о Костный дефект лучше всего визуализируется на КТ
• Советы по протоколу исследования:
о Для предоперационной оценки внутричерепного венозного оттока может потребоваться ЦСА
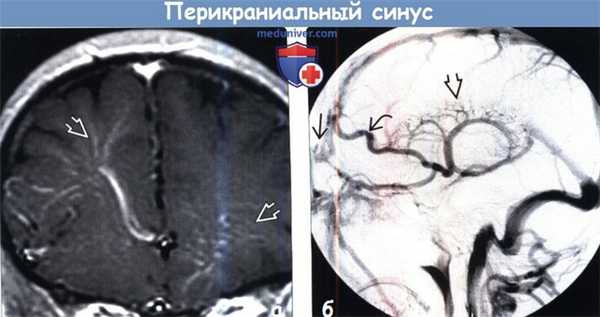
(а) МРТ, постконтрастное Т1 -ВИ, корональный срез: у этого же пациента определяется двусторонние венозные аномалии развития.
(б) ЦСА, венозная фаза, боковая проекция: определяется гигантская венозная аномалия развития (ВАР) и крупная дренирующая вена, сообщающаяся с прекраниальным синусом (ПС). Здесь представлен доминантный тип прекраниального синуса (ПС).
в) Дифференциальная диагностика перикраниального синуса:
1. Атретическое цефалоцеле:
• Небольшое грыжевое выпячивание содержимого черепа через его дефект
• Контрастирование отсутствует до тех пор, пока сосуды/СТМО также не подвергнутся грыжевому выпячиванию
• Может быть трудно отличить от ПС только при МРТ
2. Дермоидная киста:
• Хорошо очерченное образование с плотностью, характерной для жидкости или жира
• Классическая локализация в области переднего родничка/темени
3. Гемангиома:
• Интенсивно контрастируемое объемное образование с участками потери сигнала за счет эффекта потока
• Характерна эволюция
4. Рабдомиосаркома, гистиоцитоза из клеток Лангерганса, метастазы нейробластомы:
• Контрастируемое образование с участками распада
• Инвазия в СТМО визуализируется как дефект наполнения
2. Стадирование и классификация перикраниального синуса:
• На основе внутричерепного венозного оттока выделяют следующие типы:
о 25% -доминирующий тип (ПС осуществляет основную часть внутричерепного венозного оттока)
о 75 % - добавочный тип (ПС осуществляет меньшую часть оттока)
3. Макроскопические и хирургические особенности:
• Варикозное расширение вен/ВМ в мягких тканях головы: синеватый наполненный кровью мешочек или сеть мешочков под > выше надкостницы свода черепа
4. Микроскопия:
• Варикозное расширение вен/ВМ в мягких тканях головы: безмышечный(е) венозный(е) канал(ы):
о Эндотелиальная выстилка = врожденное происхождение
о Волокнистая выстилка/капсула = травматическое происхождение
о ± нагруженные гемосидерином макрофаги, тромб
д) Клиническая картина перикраниального синуса:
1. Проявления:
• Наиболее частые признаки/симптомы:
о Безболезненное непульсирующее объемное образования в лобной области/мягких тканях головы (10%-голубоватый цвет):
- Уменьшаются в размере в вертикальном положении
- Надуваются в положении лежа, при пробе Вальсальвы или плаче
о Редко: локальная боль, головная боль, тошнота, головокружение
• Клинический профиль:
о Ребенок с длительным анамнезом безболезненного вправимого объемного образования скальпа
2. Демография:
• Возраст:
о Диапазон: 0-70 лет:
- Обычно выявляется у детей, молодых людей
• Пол:
о Легкое преобладание встречаемости у женщин
• Эпидемиология:
о Редко:
- 11% пациентов наблюдаются для лечения краниофациальных ВМ
3. Течение и прогноз:
• Нет четкого понимания:
о Обычно стабильное доброкачественное течение; спонтанная регрессия встречается редко
о Неизвестен потенциальный риск возникновения в течение жизни кровоизлияния, воздушной эмболии при хирургическом вмешательстве на ПС
• Отличный прогноз после хирургического удаления
4. Лечение перикраниального синуса:
• Оценить всю систему СТМО для обеспечения возможности удаления перикраниального синуса (ПС):
о Хирургическое вмешательство противопоказано при доминантном типе ПС
• Хирургическое вмешательство:
о Лигирование чрескостной(ых) эмиссарной(ых) вен(ы), удаление образования в мягких тканях головы, закрытие костного (ых) отверстия(ий) с применением костного воска
• Эндоваскулярное вмешательство:
о Применимо при добавочном типе ПС
о Трансвенозная или прямая чрескожная эмболизация (coil-эмболизация, клей)
е) Диагностическая памятка:
1. Обратите внимание:
• Синдром голубых эластичных (резиновых) пузырчатых невусов диагностируется при сочетании ПС с множественными внутричерепными ВАР
2. Советы по интерпретации изображений:
• Оценка сочетанных внутричерепных венозных аномалий (ВАР), вариантов развития венозных структур
• Перед удалением перикраниального синуса необходима оценка всей системы СТМО
• Характеристика признаков, выявляемых при диагностической визуализации:
о При отсутствии тромбирования дифференциальный диагноз должен проводиться, в первую очередь, с цефалоцеле с грыжей СТМО
3. Советы по отчетности:
• Опишите вклад ПС в систему внутричерепного венозного оттока
ФГБНУ «Научный центр неврологии»
Тромбоз и варианты строения синусов твердой мозговой оболочки
Журнал: Журнал неврологии и психиатрии им. С.С. Корсакова. Спецвыпуски. 2021;121(3‑2): 5‑9
Известно большое число различных вариантов строения синусов твердой мозговой оболочки (ТМО), причем они обнаруживаются настолько часто, что трактовка их только как аномалий маловероятна. Исключение представляют такие варианты, как аплазия синуса или удвоение, которые могут быть отнесены к аномалиям венозной системы. Уменьшение диаметра (гипоплазия) поперечного и сигмовидного синусов наблюдается относительно часто. В случаях выявления аномалий синусов ТМО обязательно оцениваются синусы на контралатеральной стороне в качестве основного источника компенсации. При диагностике тромбоза синусов ТМО необходимо иметь четкое представление о вариантах строения венозной системы головного мозга, чтобы ошибочно не принять гипоплазию или аплазию синуса за тромбоз. Наш собственный опыт основан на результатах нейровизуализационного исследования мозговых вен (МВ) и венозных синусов (ВС) у 103 пациентов (средний возраст 35±10 лет) с головной болью напряженного типа. Гипоплазия поперечного и сигмовидного синусов выявлена в 21 (22,4%) случае. В 10 случаях (6 мужчин, 4 женщины) установлена связь между гипоплазией синусов ТМО и тромбозом. У 4 пациентов выявлена гипоплазия правых поперечного и сигмовидного синусов, у 6 — гипоплазия левых поперечного и сигмовидного синусов. У 9 пациентов тромбоз развился на стороне гипоплазии синусов, у 1 пациента — на контрлатеральной стороне. Ранняя диагностика тромбоза МВ и ВС имеет решающее значение, т.к. использование антикоагулянтов снижает риск развития неблагоприятного исхода, тяжелой инвалидизации без дополнительного увеличения риска развития внутричерепных кровоизлияний.
Дата принятия в печать:
Цереброваскулярные заболевания из-за высокой распространенности и тяжелых последствий для состояния здоровья населения представляют важнейшую медицинскую и социальную проблему. Основные патологические процессы, возникающие при нарушениях мозгового кровообращения, до последнего времени связывали с артериальной системой головного мозга [1, 2].
История изучения нарушений кровообращения в венозной системе головного мозга полна противоречивых оценок как патогенетической роли анатомических вариантов строения различных отделов этой системы, так и значения патофизиологических механизмов нарушений гемодинамики в ней. Диапазон этих оценок исключительно широк [3—7].
До сравнительно недавнего времени венозную патологию мозга связывали с застойным стазом крови и воспалением [3]. На протяжении нескольких последних десятилетий были выдвинуты следующие положения: во-первых, о том, что нарушения кровообращения в венозной системе головного мозга в 30% случаев обусловлены асептическим тромбозом, во-вторых, о безопасности гипоплазии и аплазии венозных синусов (ВС) [4—11].
Асептический тромбоз мозговых вен (МВ) и ВС чаще встречается у женщин молодого и среднего возраста. Возможным объяснением этому является высокий риск развития тромбоза в раннем послеродовом периоде и при приеме комбинированных пероральных контрацептивов [8, 11—13]. В 34% случаев причиной тромбоза МВ и ВС являются тромбофилии и состояния гиперкоагуляции. Тромбофилия может быть наследственной или приобретенной [5, 12]. Риск развития церебрального венозного тромбоза у носителей полиморфизма гена фактора свертывания крови V (Leiden/G 1691A) увеличивается в 2,4 раза, у носителей полиморфизма гена протромбина (G20210A) — в 5,48 раз, при приеме пероральных контрацептивов — в 22 раза [13, 14]. При проведении молекулярно-генетического тестирования у 51 пациента с асептическим тромбозом МВ и ВС протромбогенные полиморфные варианты генов системы гемостаза были выявлены в 94% случаев, генов метионин-гомоцистеинового обмена ― в 86% случаев [15].
Существует мнение, что в основе патогенеза тромбоза артерий лежат структурные и функциональные изменения сосудистой стенки. Причиной тромбоза МВ и ВС являются гемодинамические факторы (замедленный кровоток, низкий тонус стенок), которыми объясняют тромбогенез [1].
Вопрос о первичной роли изменения функционального состояния гемостаза в патогенезе тромбоза МВ и ВС нельзя считать полностью решенным. В значительной мере такое положение обусловлено разобщенностью подходов к исследованию единой по своей структурной и функциональной организации венозной системы головного мозга. Не менее важным представляется как дифференцированная, так и комплексная оценка с позиций клинициста не только роли тромбоза МВ и ВС, но также и некоторых анатомо-физиологических предпосылок нарушений кровообращения в венозной системе головного мозга.
Венозная система значительно отличается от строения артериальной системы. В венах головного мозга более выражена ветвистость, поэтому одна вена может принимать кровь из бассейнов нескольких артерий. Для них характерно также впадение большого числа коротких притоков, образующихся из посткапиллярной сети. Это обусловлено необходимостью удаления продуктов обмена из головного мозга. Относительная устойчивость венозного кровообращения объясняется возможностью тока крови в венах в нескольких направлениях [16, 17]. Неравномерность кровотока и столкновение потоков создают, как известно, условия, способствующие тромбозу [9, 10].
Варианты строения и расположения МВ весьма многочисленны, что связано с особенностями редукции первичной венозной сети в пренатальном и постнатальном периодах. Особенностью венозной системы является также «дорсальная направленность» вен и локализация их «корней» в нижних отделах мозга. Своеобразными венозными анатомическими образованиями являются синусы твердой мозговой оболочки (ТМО) — «жесткие» вставочные структуры между «мягкими» мозговыми и магистральными венами — внутренними яремными венами [1].
Вены, расположенные на поверхности мозга, имеют тонкие стенки, состоящие из эндотелия, субэндотелиального слоя, аргирофильных, коллагеновых и немногочисленных эластических волокон, мышечная оболочка в венах отсутствует. В крупных венах коллагеновые волокна имеют продольное и циркулярное направление и образуют довольно широкий слой. Внутримозговые вены имеют небольшой диаметр (в 5—10 раз меньше диаметра вен поверхностей мозга), тонкую стенку, состоящую из эндотелия и слоя коллагеновых и аргирофильных волокон. В стенках глубоких вен имеется небольшое количество миоцитов, не образующих сплошного слоя [18].
Индивидуальная изменчивость развития венозной системы головного мозга может проявляться уменьшением (гипоплазия) диаметра или отсутствием (аплазия) синусов ТМО и крупных МВ [19—22].
Одной из анатомо-физиологических особенностей является неравномерность диаметра ВС. В значительном большинстве случаев один из них, обычно правый, шире левого. Степень различия их диаметра весьма значительна: в 70% случаев левый поперечный синус и левая внутренняя яремная вена меньше по диаметру, чем правые в 1,5— 2 раза [23]. Выключение поперечного синуса может стать причиной либо неустойчивой компенсации, либо нарушения кровообращения в венозной системе головного мозга. При гипоплазии одного поперечного синуса выключение другого ставит венозное кровообращение на грань катастрофы. Это происходит обычно в результате тромбоза [24, 25].
Методы нейровизуализации сделали возможным раннюю диагностику тромбоза МВ и ВС. В большинстве случаев выявляется множественный тромбоз с вовлечением двух и более ВС [7, 10].
При проведении МРТ в стандартных режимах признаки тромбоза синусов ТМО выражаются в повышении интенсивности сигнала в режимах Т1 и Т2, а также T2-FLAIR. Признаками тромбоза церебральных ВС при КТ являются симптом «шнура» и симптом «пустой дельты» (дефект наполнения в области слияния синусов). КТ и МРТ позволяют выявлять отек мозга и очаги некротических изменений в ткани мозга, что имеет исключительно важное значение для адекватной оценки клинической ситуации и принятия решения о необходимости экстренных мероприятий в пределах острого периода тромбоза, например проведения тромболитической терапии [5, 7, 9, 10].
Данные МР-веносинусографии соответствуют результатам рентгеноконтрастной ангиографии и спиральной КТ-ангиографии [26]. В соответствии с феноменами in-flow (во время потока) и phase-shift (фазового сдвига), влияющими на МР-сигнал, существуют два принципиально разных способа получения изображений: time-of-flight (времяпролетное TOF) и phase-contrast (фазо-контрастное PS) соответственно. При выявлении аномалий синусов ТМО обязательно оцениваются синусы на контрлатеральной стороне в качестве основного источника компенсации. При тромбозе синусов ТМО наблюдается отсутствие сигнала кровотока. Ультразвуковые технологии позволяют также визуализировать и оценивать количественные параметры кровотока по МВ и ВС. Признаком тромбоза верхнего сагиттального синуса является увеличение скорости кровотока по базальным венам и прямому синусу. При тромбозе прямого синуса или синусного стока регистрируется ретроградный кровоток по базальным венам [27]. У пациентов с тромбозом поперечного синуса при транскраниальном дуплексном сканировании выявляется асимметричный кровоток или отмечается отсутствие сигнала кровотока, что может соответствовать гипоплазии поперечного синуса или его тромбозу [28].
Для того чтобы избежать чрезмерной диагностики тромбоза ВС головного мозга, необходимо иметь представление о различиях в анатомии церебральных синусов, в том числе по данным МР-веносинусографии. Так, при бессимптомном течении тромбоза ВС достаточно трудно дифференцировать его от гипоплазии.
На сегодняшний день имеются ограниченные данные об анатомических вариантах строения синусов ТМО.
В индийском ретроспективном исследовании [29] анализировались данные МРТ головного мозга у 1654 пациентов (582 мужчин и 1072 женщин) в возрасте от 19 до 86 лет. Основанием для проведения МР-веносинусографии являлась головная боль (75,4%), реже с головокружением (13,1%) и рвотой (3,2%). Эпилептические приступы наблюдались в 5,3% случаев, чувствительные нарушения — в 0,5% случаев.
У 352 (21,3%) пациентов была выявлена гипоплазия левого поперечного синуса, которая чаще встречалась у мужчин, чем у женщин (24,9% против 19,3%, p=0,009). Аплазия левого поперечного синуса была обнаружена в 67 (4,1%) случаях. Гипоплазия правого поперечного синуса наблюдалась у 91 (5,5%) пациента, аплазия — у 12 (0,7%) пациентов. В 1,6% случаев выявлена гипоплазия поперечных синусов с обеих сторон. Гипоплазия или аплазия левого сигмовидного синуса наблюдалась у 189 (11,4%) пациентов. Гипоплазия правого сигмовидного синуса обнаружена у 40 (2,4%) пациентов, аплазия — у 4 (0,2%) пациентов. У 3 пациентов гипоплазия сигмовидных синусов была двусторонней.
Вариантами строения верхнего сагиттального синуса являлись аплазия передней трети синуса (15 пациентов, 0,9%), гипоплазия средней трети синуса (13 пациентов, 0,7%), гипоплазия передней трети синуса (6 пациентов, 0,4%), гипоплазия передних двух третей синуса (3 пациентов, 0,2%) и гипоплазия передней половины синуса (1 пациент, 0,1%). Гипоплазия прямого синуса наблюдалась у 4 (0,2%) пациентов (у 1 (0,2%) мужчины и 3 (0,3%) женщин). Таким образом, авторы пришли к заключению, что гипоплазия левого поперечного синуса наиболее часто встречается у мужчин.
F. Alper и соавт. [30] были проанализированы данные TOF МР-веносинусографии у 105 пациентов (у 60 мужчин и 45 женщин) в возрасте от 19 до 46 лет. У 21 (20%) здорового добровольца была обнаружена аплазия левого поперечного синуса, у 41 (39%) — гипоплазия левого поперечного синуса, у 4 (4%) — аплазия правого поперечного синуса, у 6 (6%) — гипоплазия правого поперечного синуса. Авторы данного исследования высказали предположение, что среди здорового населения в 24% случаев может наблюдаться аплазия поперечных синусов.
В исследовании N. Surendrababu и соавт. [31] у 35% пациентов была выявлена гипоплазия левого поперечного синуса, у 13% — гипоплазия правого поперечного синуса, в одном случае — аплазия левого поперечного синуса.
Анатомические особенности строения сигмовидных синусов изучали L. Savelyeva и соавт. [32] при использовании PS МР-ангиографии. Установлено, что в группе женщин частота гипоплазии правого сигмовидного синуса была несколько выше, чем в группе мужчин. В группе мужчин с возрастом увеличивалась частота гипоплазии левого сигмовидного синуса, а в группе женщин — частота гипоплазии правого сигмовидного синуса.
N. Monigaric и соавт. [33] обнаружили редкий врожденный вариант строения правого поперечного ВС у 30-летней женщины с мигренью без ауры. При МРТ головного мозга в режиме Т1 выявлено отсутствие кровотока по правому поперечному синусу, при МР-веносинусографии — удвоение правого поперечного синуса в сочетании с гипоплазией левого поперечного синуса.
Наш собственный опыт основан на результатах нейровизуализационного исследования МВ и ВС у 103 пациентов (средний возраст 35±10 лет) с головной болью напряженного типа. Ее течение было острым (менее 48 ч) в 10 случаях, подострым (от 48 ч до 30 дней) в 36 случаях и хроническим (более 30 дней) в 57 случаях. Пациенты описывали головную боль как монотонную тупую, ноющую, сдавливающую с локализацией в форме «шлема». Во всех случаях головная боль характеризовалась умеренной интенсивностью и повышенной тревожностью. При осмотре пациентов отмечалось повышенное напряжение височных, подзатылочных и трапециевидной мышц.
Гипоплазия поперечного и сигмовидного синусов выявлена в 21 (22,3%) случае. Она была обнаружена с одинаковой частотой у мужчин и женщин (у 10 и 11 соответственно).
В 10 случаях (у 6 мужчин и 4 женщин) установлена связь между гипоплазией синусов ТМО и тромбозом. У 4 пациентов выявлена гипоплазия правых поперечного и сигмовидного синусов, у 6 — гипоплазия левых поперечного и сигмовидного синусов. У 9 пациентов тромбоз развился на стороне гипоплазии синусов, у 1 пациента — на контрлатеральной стороне. Разумеется, тромбоз является результатом сложных биохимических нарушений, прежде всего изменений свертывающих и противосвертывающих механизмов. Вместе с тем на развитие этого процесса, по-видимому, оказывают патогенетическое влияние местные анатомические и функциональные факторы, значение которых часто недооценивается. Полученные данные позволяют предположить, что гипоплазия синусов ТМО, вызывая изменение гемодинамики в них, может способствовать тромбогенезу.
Заключение
При диагностике тромбоза синусов ТМО необходимо иметь четкое представление о вариантах строения венозной системы головного мозга, чтобы ошибочно не принять гипоплазию или аплазию синуса за тромбоз. Ранняя диагностика тромбоза МВ и ВС имеет решающее значение, так как использование антикоагулянтов снижает риск развития инвалидизации без дополнительного увеличения риска развития внутричерепных кровоизлияний.
Перикраниальный синус (Sinus pericranii -SP) - редкая патология экстра-, интракраниальной венозной системы головного мозга. В настоящее время в мире описано около 170 случаев Sinus pericranii [29]. Представляем два наблюдения больных с SP, которым было проведено микрохирургическое удаление.
Наблюдение 1
Больной М., 7 лет, поступил в РНХИ им. проф. А.Л. Поленова в отделение нейрохирургии детского возраста в 2012 г. Из анамнеза известно, что в возрасте 2 лет родители отметили наличие мягкотканого образования в правой заушной области. На транскраниальной допплерографии была заподозрена артериовенозная мальформация правой заушной области. При проведении магнитно-резонансной томографии (МРТ) головного мозга заподозрена дуральная венозная мальформация. Жалобы на момент поступления: наличие мягкотканого образования в правой затылочной области. В неврологическом статусе отмечалась легкая координаторная дисфункция. Локально - справа на 3 см выше сосцевидного отростка объемное образование 4,0×4,0 см, мягкоэластичное, при придавливании к костям черепа незначительно уменьшает свой объем. Кожа над образованием не изменена, легко смещаема (рис. 1, д).
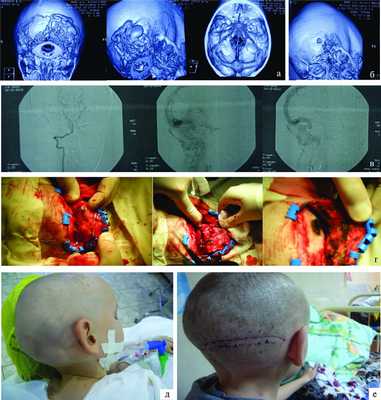
Рисунок 1. Наблюдение 1 (больной М.). а - спиральная КТ-ангиография; б - спиральная КТ с 3D костной реконструкцией; в - селективная церебральная ангиография; г - интраоперационные фотографии (этапы операции); д, е - внешний вид больного до и после операции. При проведении спиральной компьютерной томографии (СКТ) с ангиографией с 3D-реконструкцией костей свода и основания черепа определяются гипертрофированные с наличием крупных лакун вены затылочной области справа, которые через дефект в лямбдовидном шве размером 12×9,4 мм дренируются в правую половину поперечного синуса через атипичную эмиссарную вену (см. рис. 1, б). При селективной церебральной ангиографии в артериальную фазу (см. рис. 1, в) данных о наличии артериовенозной мальформации головного мозга не выявлено. Определяется атипичная вена, отходящая от правой половины поперечного синуса, дренирующаяся в экстракраниальную венозную лакуну в правой затылочной области. Больному было проведено оперативное вмешательство, которое заключалось в разобщении правой половины поперечного синуса и экстракраниальных варикозно-расширенных вен и венозных лакун. Интраоперационно отмечалось их спадание (см. рис. 1, г). Трофических изменений кожного лоскута не выявлялось. Больной был выписан под наблюдение невролога (см. рис. 1, е).
Наблюдение 2
Больной Д. поступил в отделение нейрохирургии детского возраста ФГУ РНХИ в 2012 г. с жалобами на наличие патологического образования в области большого родничка, возвышающегося над кожными покровами, синюшного цвета. Анамнез болезни: с рождения в области большого родничка выявлено патологическое образование с синюшным оттенком, венозной сетью. Сразу после рождения отмечалось кровотечение из образования, которое на фоне проводимых мероприятий было остановлено. Увеличение образования, со слов матери, с 2-месячного возраста. В горизонтальном положении ребенка, а также при плаче объемное образование увеличивалось в размере. Местно: в проекции большого родничка объемное образование, синюшного цвета, размером 5×7×4 см (рис. 2, г).
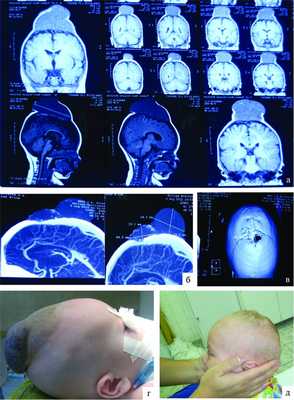
Рисунок 2. Наблюдение 2 (больной Д.). а - спиральная КТ-ангиография; б - спиральная КТ с 3D костной реконструкцией; в - МРТ; г, д - внешний вид больного до и после операции.
При МРТ головного мозга в мягких тканях головы (см. рис. 2, а) выявляется образование, состоящее из двух частей - 30×48 и 40×17 мм. На спиральных компьютерных ангиограммах (см. рис. 2, б) определяется экстракраниальное образование в задних отделах лобной области и медиальных отделах обеих теменных областей, состоящее из двух частей размером 30×48 и 40×17 мм, вызывающих атрофию от давления обеих теменных костей (костный дефект чешуи лобной кости (см. рис. 2, в) в области большого родничка размером 128×25 мм), дренирующееся из передней камеры в среднюю треть верхнего сагиттального синуса; приводящих артериальных сосудов не выявлено. Больному было проведено двухэтапное микрохирургическое вмешательство. В послеоперационном периоде признаков венозной гипертензии не отмечалось, очаговая симптоматика не выявлена, косметический дефект отсутствует (см. рис. 2, д).
По мнению C. Marras и соавт. [28], первое упоминание о SP зафиксировано в 1760 г. и связано с именем Percivall Pott, который впервые дал описание сформировавшегося мягкотканого образования над местом перелома костей черепа. В 1845 г. А. Hecker [9] представил данную патологию под названием «varix spurius circumscriptus venae diploicae frontalis». В 1850 г. G. Stromeyer [45] впервые использовал термин Sinus pericranii для обозначения «резервуара, наполненного кровью, расположенного на костях черепа, который через диплоэтические вены связан с синусами твердой мозговой оболочки». Встречаются различные термины для обозначения этого патологического состояния: простое варикозное расширение (varix simplex), гроздевидное варикозное расширение (varix racemosus), варикозный герниоз (varix herniosis), варикозная аневризма (cirsoid aneurysm), венозная ангиома (venous angioma), варикозно-расширенная вена (varix cirsoideus), остеососудистый свищ (fistule osteovasculaire), венозная опухоль костей черепа, варикоз вен черепа [39].
SP, однако, является не просто дополнительным чрескостным венозным каналом, соединяющим экстра- и интракраниальные венозные системы. Такая «эмиссарная вена» соединяет интракраниальный синус и сеть варикозно-расширенных венозных тонкостенных сосудов, расположенных на наружной поверхности черепа, в которой происходит депонирование крови с разнонаправленным кровотоком. С учетом этого, C. Gandolfo и соавт. [16] разделили SP по ангиоархитектонике на две основные группы: 1) доминантный тип, при котором основное дренирование паренхимы мозга осуществляется через вены, дренирующие в SP; 2) дополнительный тип, при котором только часть венозного оттока происходит в экстрадиплоэтические сосуды.
Этиология SP до конца не изучена. Чаще SP может быть врожденной патологией, но травма также может быть вероятным причинным фактором развития SP [12, 21, 47 и др.].
SP разделяют на врожденный, приобретенный и посттравматический [35].
SP врожденного генеза чаще локализуется на «средней линии» в лобной области, однако описаны случаи локализации врожденного SP в теменной области, височно-затылочной области [26].
S. Nomura и соавт. [31] указывают, что в период эмбриогенеза, когда эмбрион достигает 40 мм, с ростом полушарий большого мозга в каудальном направлении, на фоне трансформации плексиформных интерпериоостеодуральных предшественников верхнего сагиттального и поперечного синусов в линейные структуры вследствие дизэмбриогенетических нарушений происходит неполная инволюция мелких вен, входящих в состав интерпериоостеодурального сплетения. Такие вены в постнатальном периоде участвуют в системе венозного оттока, однако представляют собой developmental venous anomaly (DVA - аномалия венозного развития), ранее называвшиеся венозными ангиомами [27] (рис. 3).
Рисунок 3. Пример венозной ангиомы («интрадуральная» DVA) левой лобной доли (больная 12 лет). S. Nomura и соавт. [31] полагают, что DVA могут быть как интрадуральными, так и экстрадуральными.
Перикраниальный синус представляет собой экстрадуральную DVA [31]. Это объясняет частое сочетание SP и DVA, не только при врожденном, но и при травматическом и спонтанном вариантах [4, 9, 13, 22 и др.]. Также описаны случаи сочетания SP c артериовенозными мальформациями [4] и каверномами [6, 30].
Согласно K. Sakai и соавт. [40], формирование SP происходит в позднем эмбриональном периоде вследствие явлений венозной гипертензии, на фоне окклюзии венозного оттока. В связи с частым сочетанием SP c краниостенозом C. Gandolfo и соавт. [16] считают, что формирование врожденного SP на фоне краниостеноза происходит вследствие образования дополнительных путей оттока (на фоне внутричерепной гипертензии и нарушения венозного оттока), что также соответствует данным N. Mitsukawa и соавт. [29].
Общепринятым критерием для установления первопричины данной патологии является тип ткани, выстилающей мешок. Эндотелиальная выстилка характерна для врожденного SP, тогда как приобретенное образование имеет выстилку из соединительной ткани [39]. C. Wen и соавт. [50] считают, основываясь на работе E. Hahn [19], что гистологически спонтанный и травматический типы не различаются. Данные гистологического заключения в случае больного Д. (наблюдение 2, см. выше) (рис. 4) указывают на наличие кавернозной ангиомы (каверномы).
Рисунок 4. Гистологическая характеристика каверномы мягких тканей головы, сочетающаяся с перикраниальным синусом (Sinus pericranii). а - пещеристые сосудистые полости с соединительнотканными перегородками разной толщины выстланы эндотелием; б - вена в перегородке между кавернозными полостями; в - фрагмент волоса в перегородке мальформации. Окраска гематоксилином и эозином. а, в - ув. 100; б - ув. 200. Однако, учитывая наличие гемодинамического феномена, характерного для SP, данный патологический процесс рассматривается как сочетание двух видов патологии - SP и каверномы.
SP может встречаться в любом возрасте [7, 22, 38]. Однако, по данным M. Sheu и соавт. [43], манифестация заболевания (прогредиентное увеличение образования, неврологический дефицит) при врожденных случаях наблюдается в основном у детей младшего возраста; почти половина описанных случаев относится к пациентам до 20 лет, а в общем числе описанных случаев пациенты до 40 лет и младше составляют 88%.
Некоторые авторы считают, что у мальчиков SP встречается чаще, но T. Ohta и соавт. [35] полагают, что большая частота встречаемости SP у мальчиков обусловлена высокой частотой посттравматических случаев.
Необходимо дифференцировать SP и другие подкожные образования черепа, включая подапоневротическую гематому, атретическое менингоцеле, растущий перелом, дермоидную кисту, опухоль костей черепа. Характерной особенностью данного образования является зависимость размеров от положения тела. В горизонтальном положении больного образование имеет наибольшие размеры, а в вертикальном положении уменьшается. Однако в вертикальном положении и при компрессии яремных вен с двух сторон или проведении теста Вальсальвы размеры образования увеличиваются [7, 21].
Но не для всех вариантов SP данная особенность является обязательной, что в своей классификации отразил J. Volkmann (1950). У пациента М. (наблюдение 1) размеры образования не зависели от положения тела. У пациента Д. (наблюдение 2) отмечалось значительное увеличение размеров образования в горизонтальном положении.
При нейросонографическом исследовании SP представляет собой анэхогенную структуру [24]. Допплерографическое исследование позволяет провести дифференциальный диагноз между сосудистой и несосудистой патологией, верифицировать венозный характер кровотока, направление тока крови в эмиссарных венах, двунаправленный турбулентный кровоток в самом патологическом образовании [52], что было выявлено в 2 наших наблюдениях.
При КТ без контрастного усиления SP имеет большую плотность по отношению к окружающим структурам мозга. Также КТ позволяет выявить наличие дефекта костей свода черепа. При КТ с внутривенным контрастированием SP имеет такую же плотность, как другие венозные структуры, исключением являются случаи тромбированного SP [26].
МРТ дает информацию о содержимом синуса на основании характеристик сигнала и взаимосвязи патологического образования и подлежащего синуса [39]. Данные МРТ больного Д. указывали на наличие патологического образования, характеризующегося сигналом со смешанной интенсивностью. Это было обусловлено турбулентным кровотоком. Для определения взаимосвязи образования и синусов твердой мозговой оболочки используют магниторезонансную или компьютерную венографию [7].
В случае пациента Д. проведения МРТ и спиральной компьютерной ангиографии головного мозга явилось достаточным для установления диагноза. В случае пациента М. данные спиральной КТ неубедительно указывали на отсутствие артериовенозного шунтирования.
Целью селективной церебральной ангиографии при SP является исключение другой сосудистой патологии, характеризующейся артериовенозным шунтированием, а при обнаружении SP - подробное изучение его ангиоархитектоники, идентификация всех венозных коллекторов, соединяющих синус и экстракраниальное образование [1, 25]. В редких случаях проводится венография путем прямой пункции образования [46, 49]. Проведенная селективная церебральная ангиография больному М. позволила верифицировать SP.
Хирургическое лечение
Основная цель хирургического лечения - предотвращение массивного кровотечения и травматической воздушной эмболии, а также устранение косметического дефекта. В настоящее время в хирургии SP применяются как эндовазальные, так и микрохирургические методы [4, 12, 16, 31 и др.].
Наличие доминантного типа, по классификации C. Gandolfo и соавт. [16], является противопоказанием к любому виду хирургии, так как это может привести к осложнениям, таким как выраженный венозный застой и/или инфаркт мозга. При дополнительном паттерне тактика хирургического лечения зависит от особенностей дренирования паренхимы мозга. По данным зарубежной литературы [12], до 30% описанных случаев относились к доминантному типу и не были оперированы.
Микрохирургические методы можно разделить на два вида: 1) радикальная операция, которая заключается в широкой краниотомии, окклюзии венозных коллекторов, соединяющих синус и экстракраниальное сосудистое образование, краниопластике [28,49]; 2) удаление экстракраниального компонента, окклюзия венозных коллекторов, соединяющих синус и экстракраниальное сосудистое образование, без проведения краниотомии [29].
К возможным осложнениям данного вида хирургического вмешательства относятся воздушная эмболия и кровотечение [2, 5, 14, 15, 25].
Описанные нами наблюдения (больной М. и больной Д.) по классификации C. Gandolfo и соавт. (2007) относились к дополнительному типу.
Особенностью у больного М. являлась гипоплазия левой половины поперечного синуса. По данным церебральной ангиографии, не отмечалось стенозов правой и левой половины поперечного синуса, не был выявлен стеноз яремных вен. В случае больного Д. данные МРТ и спиральной КТ-ангиографии, транскраниальной допплерографии не выявляли значимого дренирования паренхимы мозга с участием SP. В обоих случаях была выбрана хирургическая тактика. С учетом малого возраста, высокого риска развития тяжелой постгеморрагической анемии вследствие кровопотери хирургическое лечение у больного Д. было разделено на два этапа.
В тех случаях, когда основное дренирование мозга осуществляется через вены, дренирующие в SP, хирургическое лечение не показано. В случаях, когда только часть венозного оттока происходит в экстрадиплоэтические сосуды, показано хирургическое лечение. Методом выбора хирургического лечения является удаление экстракраниального компонента, окклюзия венозных коллекторов, соединяющих синус и экстракраниальное сосудистое образование, без проведения краниотомии. Однако, если рассматривать перикраниальный синус как экстракраниальную DVA, то выбор тактики в пользу хирургии должен основываться на балансе между предполагаемым эффектом и вероятностью послеоперационных осложнений, таких как венозный застой и/или инфаркт мозга.
Комментарий
Sinus pericranii - редкое патологическое состояние. Работа освещает вопросы его этиологии, клинические проявления и приемы хирургического лечения. Анализируется весьма обширная литература и приводятся различные точки зрения на патогенез, морфологию, классификацию и показания к операции. Авторы описывают два собственных наблюдения хирургического лечения детей с этой патологией, и успешно излечив их, в одном из них, как им кажется, обнаружили сочетание двух видов патологии: врожденного Sinus pericranii и кавернозной мальформации. Возможно это и так, но в действительности приведенные на рис. 4 микрофотографии демонстрируют лишь маленький кровеносный сосуд (при этом какой именно - артериальный или венозный - на использованном увеличении около ×100 определить невозможно), а также 4 пещеристые полости, не заполненные кровью. Непонятно, как эти полости встроены в аномальную венозную сеть и каким образом участвуют в кровотоке по ней.
В любом случае работа освещает сравнительно редкую и малоизвестную проблему и вызывает интерес.
Читайте также:
- Диагностика туберкулеза. Принципы микробиологической диагностики туберкулеза. Выделение возбудителя туберкулеза.
- Лечение овариальной недостаточности при гипоплазии яичников. Циклическая гормональная терапия
- Отравление альфа-хлоралозом и его лечение
- Кости при эмболии - лучевая диагностика
- Поведение при иммобилизационном стрессе. Изменение психики при иммобилизационном стрессе
