Перитонеальный диализ. Биосовместимость диализных мембран
Добавил пользователь Алексей Ф. Обновлено: 08.01.2026
Для лечения острой почечной недостаточности в гуманитарной и ветеринарной медицине используют перитонеальный диализ.
Перитонеальный диализ (от греч. dialisis – отделение, разложение) – это интракорпоральный метод детоксикации, основанный на свойствах париетальной и висцеральной брюшины выполнять функции диализной мембраны, через которую из микроциркуляторного русла брюшины в диализирующий раствор переходят токсичные метаболиты и вода, а из диализата в кровь – вещества, составляющие его основу.
Перитонеальный диализ стал впервые применяться около 80 лет назад при уремии (Ganter G., 1923), однако широко вошел в медицинскую практику лишь в последние годы. В 80-х годах этот метод, как дополнительный начали использовать и в ветеринарной медицине.
Показания:
- Острая почечная недостаточность
- Хроническая почечная недостаточность
- Отравления лекарственными препаратами, ядовитыми химическими веществами
Противопоказания:
- Постановка катетера противопоказана при воспалении брюшной стенки
- При установленных дренажах в брюшной полости
- Эффективность перитонеального диализа резко снижается при наличии опухолей или спаек брюшной полости, которые уменьшают объем брюшной полости.
Осложнения:
- Диализный перитонит
- Инфекции места выхода катетера
- Подтекание диализата из места выхода катетера
Самой важной и чувствительной составляющей перитонеального диализа является установка катетера. Идеально установленный катетер должен позволять свободно входить и выходить жидкости диализата, обладать высокой биосовместимостью. Должна обязательно соблюдаться асептика и антисептика.
При проведении диализа раньше использовали венозные катетеры, центральные венозные катетеры и дыхательные трубки. Они имеют преимущество перед остальными так, как их можно поставить без применения общей анестезии. Из-за риска заражения катетер не должен оставаться в брюшной полости больше, чем на 72 часа. (Parker, 1984).
C 2000 года стали доступны катетеры долговременного использования. В брюшную полость имплантируется тонкая силиконовая однопросветная трубка (катетер Тенкхоффа), которая имеет две манжеты Darcon, которые помещаются в подкожную клетчатку и в области прямой мышцы живота (M.rectus), где они срастается c тканями. Таким образом выстраивается определенный защитный барьер от внешней среды. После имплантации катетера, это место обрабатывают антибиотиками и накладывают стерильную повязку. (Garcia-Lacaze et al., 2002).
Как было замечено ранее, задачей диализата является собрать имеющиеся токсины и вывести их из организма. Идеальный диализат должен быть стерильным, без пирогенов и биологически совместимым с организмом пациента. Состав диализата должен собирать уремические токсины, и из-за большой вероятности обезвоживания организма, корректировать кислотно-щелочный и электролитный баланс. (Cowgill, 1995). Таким требованиям отвечают растворы для перитонеального диализа с содержанием в них глюкозы от 1,36%, 2,27%. 3,86%, до 4,5%.
В первые 48 часов проведения диализа или при наступлении перитонита к диализату добавляют 250-1000 МЕ/л гепарина (Cowgill, 1995; Labato, 2000). Никогда не стоит забывать о том, что возможность заражения присутствует в любых условиях, поэтому следует проводить данные процедуры в условиях строгой асептики.
На начальном этапе проведения диализа, следует проводить непрерывные циклы диализа в течение 48 часов, каждый цикл должен длиться около 60 мин. Объем обмена для первых 10-12 циклов должен составлять 15-20 мл/кг. Однако если после первого цикла не происходит утечки диализата, объемы можно увеличить до 30-40 мл/кг.
Когда через 24-48 часов концентрация мочевины становится ниже, корректируется кислотно-щелочной баланс, баланс электролитов, а также баланс жидкости, рвота и понос находятся под контролем, циклы диализа можно уменьшить до 3-6 часов. Уровень электролитов, альбумина, мочевины, креатинина и кислотно-щелочного баланса на начальном этапе нужно проверять каждые 12 часов, на дальнейших этапах эти показатели контролируют ежедневно. Катетер должен проверяться ежедневно, на наличие всякого рода утечек. Также ежедневно стоит обновлять повязку на брюшной стенке животного. Диализат всегда должен проверятся на предмет мутности, инородных тел или крови. В таких случаях проводятся цитологические и микробиологические исследования. При стабилизации состояния животного катетер Тенкхоффа удаляется.
Цель исследовании: оценить эффективность перитонеального диализа у собак с острой почечной недостаточностью
Материалы и методы: перитонеальный диализ выполняли 5 собак с клиническими симптомами анурии или олигоурии. Все животные на момент постановки перитонеального катетера проходили терапию по поводу заражения бабезиозом (пироплазмозом). Масса тела животных составила 20-30кг, возраст пациентов варьировался от 3 до 6 лет, показатели мочевины в крови были более 20
ммоль/л; креатини более 600 мкмоль/л.
Все животные перед проведением перитонеального диализа прошли сонографию, лабораторные исследования (клинический анализ крови, мочи, биохимический анализ крови, анализ концентрации газов крови и электролитов).
Всем животным под общей анестезией была выполнена постановка катетера Тенкхоффа. У всех животных была выполнена оментэктомия. Диализ начинали через 4-6 часов после хирургического вмешательства.
Все собаки проходили интенсивную инфузионную терапию, антибиотикотерапию, получали парентеральное питание. У всех животных стоял уретральный катетер, для контроля над диурезом.
Объем диализного раствора варьировался от 15-30 мл/кг веса животного. Минимальная экспозиция раствора длилась 60 мин, максимально 240 минут. Количество циклов диализа составило от 12 до 6 за сутки. Для диализа использовали растворы фирмы Baxter или Fresenius c концентрацией глюкозы 1,36%, 2,27%. 3,86%, 4,5%. Ежедневно производился контроль диализного раствора.
Результаты:
Перитонеальный диализ у собак в 100% случаев (n=5) с острой почечной недостаточностью показан для восстановления функции почек.
У всех животных через 24 — 48 часов была зафиксировано регрессия показателей мочевины и креатинина в крови.
Максимальный срок эксплуатации перитонеального катетера составил 90 суток.
У всех животных до и во время перитонеального диализа наблюдалась гипоальбуминемия, гипокалиемия.
В 60% случаев (3 из 5) был выявлен диализный перитонит.
Отмечена 100% выживаемость животных после проведенного перитонеального диализа при острой почечной недостаточности.
Выводы:
- Перитонеальный диализ показан животным с острой почечной недостаточностью.
- Обязателен контроль электролитов, кислотно-щелочного баланса, показателей биохимического и клинического анализа крови и мочи
- Необходимо ежедневно оценивать диализный раствор на появление в нем инородных частиц, мутности, крови.
© Анестезиологическое ветеринарное общество «Институт развития ветеринарной интенсивной терапии, анестезиологии и реаниматологии – ВИТАР»
Биосовместимые диализные жидкости для перитонеального диализа
Перитонеальный диализ является одной из форм диализной терапии, проводимой дома, для людей с почечной недостаточностью. Пациенты должны использовать растворы для перитонеального диализа, чтобы провести диализ путем введения раствора в брюшную полость. При перитонеальном диализе в качестве фильтра используется слизистая оболочка брюшной полости, так называемая «брюшная мембрана», через которую токсины и жидкости выводятся из организма. Долговечность перитонеального диализа может быть ограничена повреждением перитонеальной мембраны, что частично является результатом биологически "недружественных" растворов для перитонеального диализа, являющихся кислыми и содержащими высокие уровни глюкозы и токсичные продукты распада глюкозы. Для преодоления этих препятствий были разработаны биосовместимые растворы для перитонеального диализа (т.е. с нейтральным pH и низким уровнем продуктов распада глюкозы или с альтернативным глюкозе икодекстрином) для обеспечения пользы для пациента.
Что мы сделали?
Мы провели обзор литературы с целью изучения пользы и вреда от использования биосовместимых растворов для перитонеального диализа.
Что мы обнаружили?
Мы выявили 42 исследования (3262 участника), изучающих влияние этих растворов на результаты лечения пациентов (исходы у пациентов). По сравнению с обычными растворами для перитонеального диализа мы обнаружили, что растворы для перитонеального диализа с нейтральным pH и низким уровнем продуктов распада глюкозы приводят к лучшему сохранению собственной функции почек пациента, включая диурез. Пациенты, получавшие растворы для перитонеального диализа, основанные не на глюкозе (икодекстрин), достигали большего удаления жидкости с помощью диализа и на 70% реже испытывали неконтролируемые эпизоды перегрузки жидкостью. Ни один из биосовместимых растворов для перитонеального диализа не причинил значительного вреда. Многие из исследований были ограничены малыми размерами выборки, короткой продолжительностью наблюдения, субоптимальным методологическим качеством и непоследовательным (противоречивым) представлением результатов. Следовательно, влияние биосовместимых растворов для перитонеального диализа на отрезок времени, в течение которого пациент может оставаться на перитонеальном диализе или оставаться в живых, неопределенно.
Выводы
По сравнению с пациентами на перитонеальном диализе, которые получают традиционные растворы для перитонеального диализа, пациенты, получающие лечение биосовместимыми растворами, получают важную пользу, включая лучшее сохранение их собственной функции почек и объема мочи с нейтральным pH, растворы для перитонеального диализа с низким уровнем продуктов распада глюкозы и более эффективно предупреждают перегрузку жидкостью за счет увеличения удаления жидкости, связанной с диализом, с помощью икодекстрина. Помогают ли эти преимущества пациентам дольше оставаться на перитонеальном диализе или дольше жить, остается не определённым и требует дальнейшего изучения.
Перитонеальный диализ. Биосовместимость диализных мембран
Перитонеальный диализ. Биосовместимость диализных мембран
Перитонеальный диализ (ПД) подразделяется на острый и хронический ПД. В отделениях реанимации используют острый ПД для коррекции уремии, нарушений водно-электролитного и кислотно-основного гомеостаза. Преимуществом ПД перед другими методами диализа и фильтрации является возможность лечения ОПН у пациентов с высоким риском применения антикоагулянтов, технически сложно осуществляемым сосудистым доступом и без применения дорогостоящего диализного оборудования и специальной водоподготовки.
Кроме того, перитонеальный диализ (в сравнении с интермиттируюшим ГД) обеспечивает стабильность гемодинамики, не вызывает развития «диализной» артериальной гипотензии.
Показанием к применению перитонеального диализа является ОПН у новорожденных, детей и больных с невысокой массой тела.
Ограничения метода: недостаточно эффективен при гиперкатаболизме; высокой стадии гипергидратации, значительном снижении остаточной функции почек (клиренс эндогенного креатинина > 15 мл/мин).
Противопоказания: повреждения, деформация, хронические заболевания передней брюшной стенки, позвоночника и органов брюшной полости; перитонит.
Осложнения, связанные с катетеризацией брюшной полости: инфекция выходного отверстия, обструкция, перегибы, «всплытия»; внутрибрюшное кровотечение; грыжи; перитонит. Нарушения водно-электролитного баланса (гипергидратация, гипо/гипернатриемия), гипергликемия.
Методика острого перитонеального диализа:
1. Имплантация катетера в брюшную полость:
а) пункционная имплантация стилет катетера длительностью до 3 суток;
б) хирургическая имплантация катетера Тенкхоффа при проведении ПД более 1 недели.
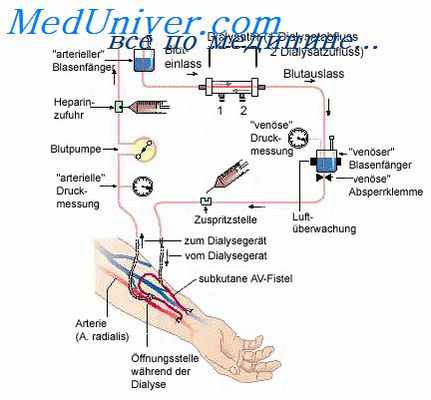
Выбор дозы процедуры (объем и кратность введения раствора в брюшную полость, длительность лечения ПД) производят с учетом остаточной функции почек, весом, поверхностью тела пациента. При проведении ПД рассчитывают следующие индексы: D/P по креатинину или мочевине (отношение концентрации креатинина/мочевины диализата к его концентрации в крови); D/DO (отношение концентрации глюкозы диализата к ее исходной концентрации); индекса KT/V по мочевине (где К — клиренс мочевины, Т — время процедуры, V — общее количество воды в организме, которое рассчитывается по номограмме).
D/DO — характеризует скорость ультрафильтрации через перитонеальную мембрану. При D/DO > 0,2 (интенсивное всасывание глюкозы) скорость ультрафильтрации низкая и следует использовать диализирующие растворы с высокой концентрацией глюкозы.
KT/V (индекс адекватности) — характеризует эффективность проводимого ДД. Снижение данного индекса в процессе лечения ОПН свидетельствует о низкой эффективности перитонеального диализа и служит рекомендацией к пересмотру методики или метода ЗПТ.
ПРОБЛЕМЫ БИОСОВМЕСТИМОСТИ ДИАЛИЗНОЙ ТЕРАПИИ
В статье рассматриваются представления о биологической совместимости современных полимерных материалов. Особое внимание уделено биосовместимости полимерных диализных мембран, их воздействию на систему гемостаза и выживаемость пациентов на гемодиализе. Рассмотрены некоторые перспективные подходы к созданию и использованию композитных и полимерных материалов для гемодиализа.
Ключевые слова
Об авторах
г. Ростов-на-Дону, пр. 40 лет Победы, д. 210. Тел. 8 (863) 302-02-97
Ростовский государственный медицинский университет
Россия
Кафедра внутренних болезней с основами физиотерапии №2
Ростовский государственный медицинский университет
Россия
Кафедра внутренних болезней с основами физиотерапии №2
Список литературы
1. Antisoner RH. Biomaterials science: an introduction to materials in medicine. CA: Academic Press, San Diego, 2004; 5–69
2. Brodbeck K, Neubauer M, Schnitzer S, Dietrich R, Hulko M, Krause B. Real-time PCR as a new in vitro biocompatibility method to measure leukocyte response to surface contact in dialysis filter devices. Int J Artif Organs 2013; 36 (4): 240–250
3. Bruck SD. Biomaterials. Med Dev Art Organs 1973; (1): 65–79Buemi M, Coppolini G, Bolignano D. Arrhythmias and hemodialysis: role of potassium and new diagnostic tools. Ren Fail 2009; (31): 75–80
4. Caballo C, Palomo M, Cases A, Galán AM, Molina P, Vera M, Bosch X, Escolar G, Diaz-Ricart M. NFκB in the development of endothelial activation and damage in uremia: an in vitro approach. PLoS One 2012; 7 (8): 65–84
5. Chadi S, Iskandar B, Yorg Al A, Ali N, Marc S, Suzanne El, Sayegh. Relationship between platelet count and hemodialysis membranes.Int J Nephrol Renovasc Dis 2013; (6): 143–147
6. Chen HA, Wang JJ, Chou CT, et al. Predictors of longterm mortality in patients with and without systemic lupus erythematosus on maintenance dialysis: a comparative study. J Rheumatol 2011; (38): 2390–2394
7. Davenport A. Pyrexia of unknown origin in a haemodialysis patient. NDT Plus 2008; Vol. 2 (3): 76–89
8. De Prada L, Lee J, Gillespie A, Benjamin J. Thrombocytopenia associated with one type of polysulfone hemodialysis membrane: a report of 5 cases. Am J Kidney Dis 2013 Jan; 61(1): 131–133
9. Désormeaux A, Moreau ME, Lepage Y, Chanard J, Adam A. The effect of electronegativity and angiotensin-converting enzyme inhibition on the kinin-forming capacity of polyacrylonitrile dialysis membranes. Am J Kidney Dis 2007; May 49 (5): 642–649
10. Eds B Ratner, Hiffman AS, Schoen FJ, Lemon JE. Biomaterials science: an introduction to materials in medicine, 2nd ed. CA: Academic Press, San Diego, 2004; 851
11. Evenepoel P, Dejagere T, Verhamme P, Claes K, Kuypers D, Bammens B, Vanrenterghem Y. Heparin-coated polyacryloni trile membrane versus regional citrate anticoagulation: a prospective randomized study of 2 anticoagulation strategies in patients at risk of bleeding. Biomaterial 2005; Apr; 26 (12): 1437-1444
12. Ficheux A, Gayrard N, Szwarc I, Andress D, Soullier S, Duny Y, Goubert G, Thomas M, Bismuth-Mondolfo J, Daurès JP, Brunet P, Servel MF, Argilés A. The use of SDS-PAGE scanning of spent dialysate to assess uraemic toxin removal by dialysis. Nephrol Dial Transplant 2011; 26 (7): 2281-2289
13. Hayashi K, Fukumura H, Yoshikava S, et al. Kobunshi Robunshu. Chem Abstrs 1987; 44 (12): 917–924
14. Heidari B. C-reactive protein and other markers of inflammation in hemodialysis patients. Caspian J Intern Med 2013; 4 (1): 611–616
15. Heidari B. Knee osteoarthritis prevalence, risk factors, pathogenesis and features: Part I. Caspian J Intern Med 2011; (2): 205–112
16. Heidari B. The importance of C-reactive protein and other inflammatory markers in patients with chronic obstructive pulmonary disease. Caspian J Intern Med 2012; (3): 428–435
17. Heidari B. Undifferentiated arthritis: predictive factors of persistent arthritis and treatment decisions. Caspian J Intern Med 2010; (1): 79–88
18. Knezevic MZ, Djordjevic VV, Radovanovic-Velickovic RM, Stankovic JJ, Cvetkovic TP, Djordjevic VM. Influence of dialysis modality and membrane flux on quality of life in hemodialysis patients. Ren Fail 2012; 34 (7): 849-855
19. Lee KS, van Holsbeeck MT, Abbud A. Atypical rapid progression of osteoarticular amyloidosis involving the hip in a patient on hemodialysis usingpolyacrylonitrile membranes. Biomaterials 2008; 29 (9): 1139-1146
20. Liu TY, Lin WC, Huang LY, Chen SY, Yang MC. Hemocompatibility and anaphylatoxin formation of protein-immobilizing polyacrylonitrile hemodialysis membrane. Skeletal Radiol 2010; 39 (1): 79–83
21. Martello M, Di Luca M. Acetate-free biofiltration. G Ital Nefrol 2012; 29 [Suppl 55]: 62–71
22. Matsuda K, Moriguchi T, Harii N, Yanagisawa M, Harada D, Sugawara H. Comparison of efficacy between continuous hemodiafiltration with a PMMA high-performance membrane dialyzer and a PAN membrane hemofilter in the treatment of septic shock patients with acute renal failure. Contrib Nephrol 2011; (173): 182-190
23. Nakano A. Ethylene vinyl alcohol co-polymer as a highperformance membrane: an EVOH membrane with excellentbiocompatibility. Contrib Nephrol 2011; (173): 164–167
24. Nasr R, Saifan C, Barakat I, Azzi YA, Naboush A, Saad M, Sayegh SE. Relationship between platelet count and hemodialysis membranes. Int J Nephrol Renovasc Dis 2013; 14 (6): 143–147
25. Nusair MB, Rajpurohit N, Alpert MA. Chronic Inflammation and Coronary Atherosclerosis in Patients with End-Stage Renal Disease. Cardiorenal Med 2012; (2): 117–124
26. Olafiranye F, Kyaw W, Olafiranye O. Resolution of dialyzer membrane-associated thrombocytopenia with use of cellulose triacetate membrane: a case report. Case Rep Med 2011; 20 (11): 134–145
27. Palmer SC, Rabindranath KS, Craig JC, Roderick PJ, Locatelli F, Strippoli GF. High-flux versus low-flux membranes for end-stage kidney disease. Cochrane Database Syst Rev 2012; 12 (9): CD005016 pub 2
28. Panichi V, Rizza GM, Paoletti S, et al. Chronic inflammation and mortality in haemodialysis: effect of different renal replacement therapies. Results from the RISCAVID study. Nephrol Dial Transplant 2008; 17 (23): 2337–2343.
29. Piroddi M, Pilolli F, Aritomi M, Galli F. Vitamin E as a functional and biocompatibility modifier of synthetic hemodialyzer membranes: an overview of the literature on vitamin E-modified hemodialyzer membranes. Am J Nephrol 2012; 35 (6): 559–572
30. Poon PY, Szeto CC, Kwan BC, et al. Relationship between serum levels of tumour necrosis factor-related apoptosis-inducing ligand and the survival of Chinese peritoneal dialysis patients. Nephrology (Carlton) 2012; 25 (17): 466–471
31. Post JB. Thrombocytopenia associated with use of a biocompatible hemodialysis membrane: a case report. Am J Kidney Dis 2010; 55 (6): 25–28
32. Puchades MJ, Saez G, Muñoz MC, Gonzalez M, Torregrosa I, Juan I, Miguel A. Study of oxidative stress in patients with advanced renal disease and undergoing either hemodialysis or peritoneal dialysis. Clin Nephrol 2013; 80 (9): 177–186
33. Rao M, Jaber BL, Balakrishnan VS. Inflammatory biomarkers and cardiovascular risk: association or cause and effect? Semin Dial 2006; 28 (19): 129–135
34. Ridker PM, Buring JE, Shih J, Matias M, Hennekens CH. Prospective study of C-reactive protein and the risk of future cardiovascular events among apparently healthy women. Circulation 1998; 4 (98): 731–733
35. Ridker PM, Rifai N, Clearfield M, et al. Measurement of C-reactive protein for the targeting of statin therapy in the primary prevention of acute coronary events. N Engl J Med 2001; (344): 1959–1965
36. Sakai Y. Polymethylmethacrylate membrane with a series of serendipity. Contrib Nephrol 2011; (173): 137-147
37. Sawires HK, Mohamed WA, Schaalan MF. High-flux and low-flux dialysis membranes and levels of intercellular adhesion molecule-1 and vascular cell adhesion molecule-1 in children with chronic kidney failure. Iran J Kidney Dis 2012; 6 (5): 366–372
38. Scand J. Traditional risk factors as contributors to atherosclerotic cardiovascular disease in end-stage renal disease. Urol Nephrol. 2004; (38): 405–416
39. Senthilkumar S, Rajesh S, Jayalakshmi A, Mohan D. Biocompatibility studies of polyacrylonitrile membranes modified with carboxylatedpolyetherimide. Mater Sci Eng C Mater Biol Appl 2013; 33 (7): 3615–3626
40. Shtilman MI. Immobilzation on polymer. VSP. Utrecht – Tpkyo., 1993; 3–496
41. Shum HP, Chan KC, Kwan MC, Yan WW. Application of endotoxin and cytokine adsorption haemofilter in septic acute kidney injury due to Gram-negative bacterial infection. Hong Kong Med J 2013; 3 (12): 320–327
42. Sniderman AD, Solhpour A, AlamA , Williams K, Sloand JA. Cardiovascular death in dialysis patients: lessons we can learn from AURORA. Clin J Am Soc Nephrol 2010; (5): 335–340
43. Stanković-Popović V, Popović D, Dimković N, Maksić D, Vasilijić S, Colić M, Vucinić Z, Radjen S, Milicić B. Influence of peritoneal dialysis solution biocompatibility on long-term survival of patients on continuous ambulatory peritoneal dialysis and the technique itself. Vojnosanit Pregl 2013; 70 (4): 352– 362
44. Taylor SP, Taylor BT. Healthcare-associated pneumonia in hemodialysis patients: Clinical outcomes in patients treated with narrow versus broad spectrum antibiotic therapy. Respirology 2012; 5 (12): 243–250
45. Urbani A, Lupisella S, Sirolli V, Bucci S, Amoroso L, Pavone B, Pieroni L, Sacchetta P, Bonomini M. Proteomic analysis of protein adsorption capacity of different haemodialysis membranes. Mol Biosyst 2012; 8 (4): 1029–1039
46. Williams D. The role of nitric oxide in biocompatibility. Med Device Technol 2008; 19 (7): 8–10
47. Yoo HH, Martin LC, Kochi AC, et al. Could albumin level explain the higher mortality in hemodialysis patients with pulmonary hypertension? BMC Nephrol 2012; (13): 80–85
48. Басов НИ, Земсков ВН. Комплемент и его роль в регуляции иммунологических реакций. Успехи соврем биол 1982; (24): 51–58
49. Валуев ЛИ. Итоги науки и техники [Химия и технология высокомолекулярных соединений. Т. 16], pед. Н.А. Платэ, ВИНИТИ, М., 1976; 3–210
50. Васильев АН, Губарь НЯ, Смирнов АВ, Суглобова ЕД. Опыт применения предилюционной онлайн гемодиафильтрации у больных с терминальной почечной недостаточностью. Нефрология 2008; 4 (12): 18–25
51. Даугирдас ДТ, Блейк ПД, Инг ТС. Руководство по диализу. 3-е изд., Триада, Тверь, 2003; 6–386
52. Жозефович М, Жозефонвич ЖЖ. Полимерные материалы. Всес Химич Общ 1985; 30 (4): 410–419
53. Зорчева РИ, Икономов ВХ, Паскалев ДН. Онлайн гемодиафильтрация и удаление фосфатов у больных с терминальной почечной недостаточностью, получающих лечение гемодиализом. Нефрология 2013; 1 (17): 9–14
54. Зубаиров ДМ. Биохимия свертывания крови. Медицина, М., 1978; 3–58
55. Казарян ПА, Баблоян АС, Егиазарян КВ. Мембранные аспекты патогенеза терминальной почечной недостаточности. Нефрология 2008; 4 (12): 26–31
56. Килстейн ЯТ, Флизер Д. Продленный ежедневный диализ. Нефрология 2008; 2 (12): 5–15
57. Кузнецов АЮ, Петров АК, Макрянский ВА. Синтетические полимеры медицинского назначения. Тез Всес симпоз. 1989; (1): 103–104
58. Перепечко ИИ. Введение в физику полимеров. Химия, М., 1978; 5–312
59. Полухина ЕВ, Москаленко НВ, Канин ЕС и др. Случай выраженной метастатической кальцификации периаортикулярных тканей у пациента на хроническом гемодиализе. Нефрология 2013; 4 (17): 23–27
60. Разъяснение для использования территориальными органами ФАС России при определении товарных границ рынка медицинского оборудования и рынка расходных материалов для гемодиализа, 2009 г.
61. Севастьянов ВИ, Ласкина ОВ, Новикова СП, и др. Современные гемосовместимые материалы для сердечнососудистой хирургии. В: Шумаков ВИ, ред. ВНИИМИ, М., 1987; 3–73
62. Севастьянов ВИ. Биоматериалы медицинского назначения. Трансплантология и искусственные органы. Тезисы докладов I Всероссийского съезда по трансплантологии и искусственным органам (Москва, 8–10 октября 1998 г.). М., 1998; 100
63. Севастьянов ВИ. Биосовместимость. Медицина, М., 1999; 4–368
64. Смурова ЕВ, Доброва НВ. Итоги науки и техники (Серия: Химия и технология высокомолекулярных соединений). ВИНИТИ, М., 1976; 3–60
65. Уорд АМ, Уичер ДжТ. Иммунохимия в клинической лабораторной практике. Медицина, М., 1981; 3–236
66. Штильман МИ. Полимеры медико-биологического назначения. ИКЦ Академкнига, М., 2006; 5–400
67. Шумаков ВИ. Искусственные органы. Медицина, М., 1990; 4–80
68. Яковенко АА, Яковлев ВД, Асанина ЮЮ, Кучер АГ. Роль хронического воспаления в патогенезе «уремической недостаточности питания» у пациентов с терминальной почечной недостаточностью, получающих лечение хроническим гемодиализом. Нефрология 2009; 1 (13): 20–24
Перитонеальный диализ. Биосовместимость диализн
Перитонеальный диализ. Биосовместимость диализных мембран
Перитонеальный диализ (ПД) подразделяется на острый и хронический ПД. В отделениях реанимации используют острый ПД для коррекции уремии, нарушений водно-электролитного и кислотно-основного гомеостаза. Преимуществом ПД перед другими методами диализа и фильтрации является возможность лечения ОПН у пациентов с высоким риском применения антикоагулянтов, технически сложно осуществляемым сосудистым доступом и без применения дорогостоящего диализного оборудования и специальной водоподготовки.
Кроме того, перитонеальный диализ (в сравнении с интермиттируюшим ГД) обеспечивает стабильность гемодинамики, не вызывает развития «диализной» артериальной гипотензии.
Показанием к применению перитонеального диализа является ОПН у новорожденных, детей и больных с невысокой массой тела.
Ограничения метода: недостаточно эффективен при гиперкатаболизме; высокой стадии гипергидратации, значительном снижении остаточной функции почек (клиренс эндогенного креатинина > 15 мл/мин).
Противопоказания: повреждения, деформация, хронические заболевания передней брюшной стенки, позвоночника и органов брюшной полости; перитонит.
Осложнения, связанные с катетеризацией брюшной полости: инфекция выходного отверстия, обструкция, перегибы, «всплытия»; внутрибрюшное кровотечение; грыжи; перитонит. Нарушения водно-электролитного баланса (гипергидратация, гипо/гипернатриемия), гипергликемия.
Методика острого перитонеального диализа:
1. Имплантация катетера в брюшную полость:
а) пункционная имплантация стилет катетера длительностью до 3 суток;
б) хирургическая имплантация катетера Тенкхоффа при проведении ПД более 1 недели.
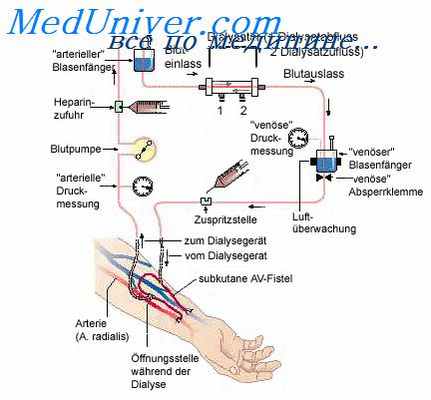
Выбор дозы процедуры (объем и кратность введения раствора в брюшную полость, длительность лечения ПД) производят с учетом остаточной функции почек, весом, поверхностью тела пациента. При проведении ПД рассчитывают следующие индексы: D/P по креатинину или мочевине (отношение концентрации креатинина/мочевины диализата к его концентрации в крови); D/DO (отношение концентрации глюкозы диализата к ее исходной концентрации); индекса KT/V по мочевине (где К — клиренс мочевины, Т — время процедуры, V — общее количество воды в организме, которое рассчитывается по номограмме).
D/DO — характеризует скорость ультрафильтрации через перитонеальную мембрану. При D/DO > 0,2 (интенсивное всасывание глюкозы) скорость ультрафильтрации низкая и следует использовать диализирующие растворы с высокой концентрацией глюкозы.
KT/V (индекс адекватности) — характеризует эффективность проводимого ДД. Снижение данного индекса в процессе лечения ОПН свидетельствует о низкой эффективности перитонеального диализа и служит рекомендацией к пересмотру методики или метода ЗПТ.
Оглавление темы "Гемодиализ в хирургии и в реаниматологии":
1. Заместительная почечная терапия в реаниматологии. Доступ для экстракорпорального контура
2. Антикоагулянты. Антикоагуляция при проведении гемодиализа
3. Перитонеальный диализ. Биосовместимость диализных мембран
4. Постоянный гемодиализ. Гемофильтрация
5. Гемодиализ при хронической сердечной недостаточности. Показания к гемофильтрации при сердечной недостаточности
6. Эффективность гемофильтрации при сердечной недостаточности. Гемофильтрация при ревматизме
7. Клинический пример гемофильтрации при ревматизме. Ультрафильтрация крови при сердечной недостаточности
8. Ультрафильтрация с инотропной поддержкой. Пример комбинации добутамина и гемофильтрации
9. Гемодиализ в кардиохирургии. Функция легких и гемофильтрация
10. Гемофильтрация при сосудистой недостаточности. Клинический пример гемодиализа при сосудистой недостаточности
Читайте также:
