Персистирующая легочная гипертензия новорожденных
Добавил пользователь Владимир З. Обновлено: 27.01.2026
Легочная гипертензия. Персистирующая легочная гипертензия новорожденных.
Сердечно-легочный дистресс является одной из наиболее частых причин артериальной гипоксемии у новорожденных. Важнейшим вариантом патологии, приводящим к дисфункции правых отделов сердца, является персистирующая легочная гипертензия новорожденных (ПЛГН). Данный синдром отражает нарушения адаптации легочного кровообращения к постнатальной жизни и характеризуется высоким давлением в легочном артериальном русле. Основная роль в происхождении ПЛГН принадлежит гипоксическим поражениям легких (различной этиологии), диафрагмальной грыже, врожденным порокам сердца; в редких случаях она является идиопатической. Следствием заболевания являются повышение давления в правых полостях сердца и сброс крови справа налево через открытое овальное окно или ОАП, что сопровождается соответственно общим или дифференцированным цианозом.
Частота патологии составляет приблизительно 1,9/1000 новорожденных. Основное количество диагнозов (97%) ставят в первые 72 часа жизни.
Независимо от этиологии ПЛГН в большинстве случаев стенка внутрилегочных артерий имеет структуру, сходную со структурой сосудов у плода, так как ее нормальная эволюция нарушена. Существуют три основных типа изменений легочных сосудов при ПЛГН.
1. Нормальное развитие легочного сосудистого русла, но с выраженными спастическими реакциями. Как правило, данный вариант сопровождает перинатальную асфиксию, аспирацию, гипогликемию, стрептококковую пневмонию, циркуляторный шок, ацидоз. При этом можно обнаружить в крови повышенную концентрацию тромбоксанов, сосудосуживающих простагландинов, лейкотриенов, эндотелина.
2. Гипертрофия стенки легочных артериол без уменьшения суммарной площади поперечного сечения легочных сосудов. Основными причинами данного состояния являются хроническая внутриутробная гипоксия, нарушения питания матери, длительное употребление нестероидных противовоспалительных препаратов (аспирин, индометацин).
3. Гипертрофия стенки легочных артериол с уменьшением суммарной площади поперечного сечения легочных сосудов. Данный вариант сопровождает гипоплазию легкого или патологию, приводящую к уменьшению объема легких (например диафрагмальную грыжу).
Первый тип изменений является обратимым, второй - обратимым в меньшей степени, третий - практически необратимым.
Персистирующая легочная гипертензия сопровождается повышенной нагрузкой на правый желудочек, приводящей к его дисфункции и развитию трикуспидальной недостаточности. Факторами, ухудшающими ситуацию, являются гипогликемия и гипокальциемия.
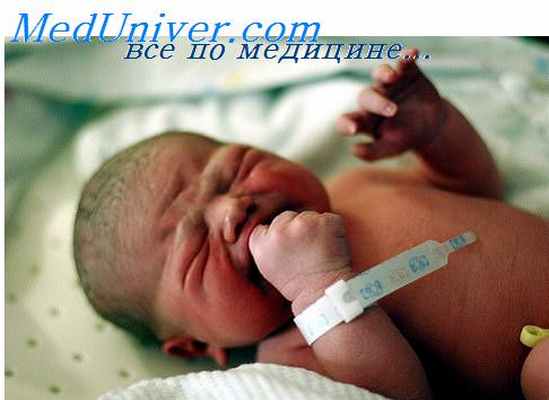
Клиническая симптоматика легочной гипертензии.
У больных в анамнезе имеются указания на неблагоприятное течение беременности, нарушения ритма плода (фетальная бради- или тахикардия), отмечаются осложнения в родах (мекониевая аспирация, оценка по Апгар менее 5). Стойкие симптомы в виде цианоза и диспноэ появляются через несколько часов после родов. Можно обнаружить усиленную пульсацию в прекордиальной зоне, усиленный второй тон, шум трикуспидальной регургитации. При выраженном ограничении легочного кровотока (и возврата крови к левому сердцу) существует вероятность снижения сердечного выброса и артериального давления.
Электрокардиография при легочной гипертензии.
Так как у новорожденного ребенка и в норме имеется правограмма, изменения ЭКГ малоинформативны. Можно отметить несколько более выраженную гипертрофию правого желудочка для данного возраста. Однако в случаях выраженной дисфункции правого желудочка вероятно появление признаков его ишемии.
Рентгенография грудной клетки при легочной гипертензии.
В большинстве случаев определяется кардиомегалия за счет увеличенных правых отделов сердца. Легочный рисунок может быть нормальным и даже усиленным, но в большинстве наблюдений он ослаблен.
Эхокардиография.
При эхокардиографии необходимо отвергнуть наличие каких-либо врожденных пороков сердца, особенно цианотического характера. Исключением являются ОАП и открытое овальное окно, через которые регистрируется право-левый или двунаправленный сброс крови. Правый желудочек и правое предсердие расширены; иногда как признак повышенного давления в них отмечают прогибание перегородок в левые отделы. Диагноз легочной гипертензии ставят, если давление в правом желудочке превышает 2/3 от системного давления. Однако у 20-30% больных трикуспидальную регургитацию, с помощью которой определяют давление в правом желудочке, не выявляют. В этих случаях целесообразно исследовать среднее давление или глобальную функцию правого желудочка (Тей-индекс). При наличии ПЛГН Тей-индекс повышается почти в 1,5 раза по сравнению с нормой. Этот показатель может быть использован для контроля за течением заболевания и эффективностью терапии.
Лечение при легочной гипертензии.
Лечение направлено на релаксацию легочных сосудов и снижение в них давления. Основные методы следующие.
1. Проведение искусственной вентиляции легких в режиме гипервентиляции (максимальное давление на вдохе ~ 35 см вод. ст., максимальная частота вентиляции 45—65 в минуту с достижением рС02 менее 35 мм рт. ст. и рН более 7,4). Следует помнить, что при выраженной гипервентиляции возможен такой нежелательный эффект как снижение мозгового кровотока из-за спазма мозговых сосудов.
2. Введение легочных вазодилататоров (толазолин, нитропруссид натрия, простагландины группы Е, ингибиторы фосфодиэстеразы). В процессе лечения необходимо контролировать степень снижения системного артериального давления.
3. Вентиляция легких с добавлением оксида азота (N0) в дыхательную смесь — сравнительно новое и эффективное средство лечения больных с высокой легочной гипертензией. Терапия основана на селективном расслабляющем действии оксида азота, в норме вырабатывающегося в эндотелиальных клетках, на легочные сосуды.
4. Использование экстракорпоральной мембранной оксигенации (ЭКМО). Данную методику обычно применяют в специализированных стационарах в случаях, не купирующихся остальными методами. Если требуется ЭКМО, летальность составляет 15-20%. В среднем среди больных с ПЛГН она равна 11 %.
Дополнительные мероприятия включают седацию, введение щелочных растворов для поддержания дыхательного алкалоза и снижения сопротивления легочных сосудов (гидрокарбонат натрия, трисбуфер), введение инотропных препаратов в случаях сердечной недостаточности (допамин, добутамин, изупрел, адреналин), введение сурфактанта.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Легочная гипертензия новорожденных
Легочная гипертензия новорожденных – состояние рефрактерного повышения сосудистого сопротивления в легких и шунтирования крови в обход малого круга кровообращения с развитием гипоксемии. Основными проявлениями являются стойкий центральный цианоз, учащение дыхания и положительная реакция на кислородотерапию. Диагностируется с помощью определения газового состава крови, а также на ЭКГ и ЭхоКГ, которые подтверждают гипертрофию правых отделов сердца и факт шунтирования крови в обход легких. Лечение комплексное, направлено на расширение сосудов легких с целью нормализации оксигенации, поддержание артериального давления, коррекцию водно-электролитного баланса и др.
Общие сведения
Легочная гипертензия новорожденных – достаточно распространенное патологическое состояние. В норме легочная гипертензия присутствует до рождения. С началом легочного дыхания давление в сосудах легких должно снизиться, чего в данном случае по различным причинам не происходит. Частота заболевания – 1-6 случаев на 1000 новорожденных, дети обычно доношенные. Актуальность легочной гипертензии новорожденных в педиатрии связана достаточно высокой смертностью (10-20% случаев), которая лишь незначительно снижается по мере развития современных медицинских технологий. Высоким остается также процент инвалидизации вследствие длительной гипоксемии и продолжительной искусственной оксигенации. Растет количество форм заболевания, связанных с генетическими синдромами, и в целом число ассоциированных форм, что осложняет терапию.
Причины и классификация легочной гипертензии новорожденных
В большинстве случаев легочная гипертензия новорожденных является следствием дефекта адаптации сосудов легких к изменению концентрации кислорода после рождения. Способствовать высокому сосудистому давлению в легких могут многие факторы, например, внутриутробные инфекции плода, прием матерью различных препаратов во время беременности, гипоксия в родах и др. Кроме того, причиной развития заболевания нередко становятся синдром аспирации мекония, респираторный дистресс-синдром и пневмония. Легочная гипертензия новорожденных регистрируется при гипоплазии легких и диафрагмальных грыжах. Оба этих состояния ведут к снижению общей площади альвеол и легочных капилляров, что вызывает повышение сосудистого давления.
Согласно современной классификации, принятой Институтом изучения заболеваний сосудов легких в 2011 году, выделяют две основные группы легочной гипертензии новорожденных: врожденную и персистирующую. Врожденная легочная гипертензия новорожденных может быть связана:
- С материнскими причинами (хориоамнионит, преэклампсия и др.).
- С нарушением развития легочных сосудов ребенка (гипоплазия легких, диафрагмальные грыжи, альвеолярная дисплазия, аномалии легочных сосудов).
- С врожденными пороками сердечно-сосудистой системы (преждевременное закрытие овального окна или артериального протока и др.).
Персистирующая легочная гипертензия новорожденных обусловлена стойким дефектом адаптации легочных сосудов и может быть идиопатической (когда причина неизвестна), либо связанной с синдромом аспирации мекония, сепсисом, пневмонией, приемом некоторых лекарственных препаратов и другими обстоятельствами.
Симптомы и диагностика легочной гипертензии новорожденных
В 77% случаев заболевание развивается в первые сутки жизни малыша. Основным проявлением легочной гипертензии новорожденных является стойкий центральный цианоз, который, как правило, не соответствует степени выраженности патологических изменений в легких. Дыхание ребенка учащено, но не критически. Артериальное давление чаще в норме, по мере развития состояния постепенно снижается. Патогномоничным признаком считается разница оксигенации в большом и малом кругах кровообращения от 20% и выше. Определить это можно, одновременно измерив парциальное давление кислорода в большом и малом круге кровообращения. Также при легочной гипертензии новорожденных отмечается положительная реакция на кислородотерапию. Кроме цианоза и тахипноэ в ряде случаев обнаруживаются симптомы аспирации мекония, пневмонии и других заболеваний, которые могут вызвать повышение сопротивления в легочных сосудах.
Первичный физикальный осмотр педиатра позволяет выявить цианоз кожных покровов. Аускультативные изменения в легких выражены, как правило, незначительно. При аускультации сердца характерным является систолический щелчок над легочной артерией и акцент второго тона там же. Легочная гипертензия новорожденных подтверждается лабораторными методами диагностики. Общий и биохимический анализ крови обнаруживают полицитемию, гипокальциемию и гипогликемию. Гипоксемия определяется анализом газов крови. Рентгенограмма легких чаще в норме, кроме случаев пневмонии. ЭКГ и ЭхоКГ свидетельствуют о гипертрофии правых отделов сердца, которым при легочной гипертензии новорожденных приходится работать фактически на оба круга кровообращения.
Патологию помогают диагностировать гипероксические тесты, позволяющие достоверно определить наличие сброса крови через открытые эмбриональные отверстия (артериальный проток, овальное окно) из малого круга кровообращения в большой, минуя легкие. Для детей, находящихся на искусственной вентиляции легких, возможно проведение гипервентиляционного гипероксического теста. Для этого частоту дыхания повышают до 80-100 в минуту на 5-10 минут. Диагноз легочной гипертензии новорожденных подтверждается, если цианоз исчезает. Если же цианоз остается, можно заподозрить у ребенка порок сердца «синего типа».
Лечение и прогноз при легочной гипертензии новорожденных
Терапия направлена на снижение сосудистого сопротивления в легких и лечение сопутствующего заболевания. Показан строгий лечебно-охранительный режим, количество манипуляций с ребенком стараются свести к необходимому минимуму. Как правило, речь идет о кювезном режиме в палате интенсивной терапии или реанимации. Независимо от причины легочной гипертензии новорожденных, лечение начинают с введения обезболивающих и седативных препаратов. Это позволяет минимизировать нагрузку на легкие и сердце.
Проводят инфузионную терапию с целью поддержания адекватного сердечного выброса и концентрации электролитов. Для поддержания артериального давления показаны инотропные препараты. Коррекцию гипоксемии осуществляют с использованием кислородотерапии, методом выбора в первые 2-3 суток является конвекционная ИВЛ. Для нормализации сосудистого давления в легких применяют вазодилататоры, которые могут назначаться ингаляционно в составе дыхательной смеси для ИВЛ, вводиться внутривенно или перорально. С этой же целью используют простагландины. В тяжелых случаях требуется экстракорпоральная мембранная оксигенация крови.
Осуществляют терапию основного заболевания, при патологии инфекционного генеза показаны антибиотики. Даже без подтвержденной пневмонии или сепсиса антибиотикотерапию часто назначают превентивно. В случае гипоплазии легких, диафрагмальной грыжи или подтвержденных врожденных пороков сердца и легких необходимо оперативное лечение. Методику выбирают в зависимости от типа патологии, в отдельных случаях выполняют пересадку легких или комплекса «легкие-сердце».
Прогноз легочной гипертензии новорожденных неблагоприятный. Кроме высокой смертности, о которой было сказано выше, примерно 25% выживших детей в дальнейшем имеют признаки отставания в физическом и умственном развитии. Часто возникают хронические легочные заболевания и нейросенсорные расстройства слуха. Профилактики заболевания не существует.
Первичная легочная гипертензия у новорождённого. Клинический случай
Первичная легочная гипертензия новорождённых – тяжелое прогрессирующее заболевание неизвестной этиологии с неблагоприятным прогнозом, которое в связи с особенностями кровообращения плода выделяется в отдельную клиническую категорию – персистирующая легочная гипертензия новорождённых. На долю идиопатической персистирующей легочной гипертензии приходится до 20% от всех случаев легочной гипертензии у новорожденных. В настоящее время этиология и патогенез данного заболевания мало изучены в связи с редкой частотой его встречаемости, что обуславливает актуальность описания клинических случаев данного заболевания.
Ключевые слова
первичная легочная гипертензия, легочное сердце, открытое овальное окно, открытый артериальный проток, перимембранозный дефект межжелудочковой перегородки.
Статья
Первичная легочная гипертензия (ПЛГ) – болезнь Айэрсы – является редким тяжелым прогрессирующим заболеванием неизвестной этиологии и характеризуется неблагоприятным прогнозом [1, 2]. Легочная артериальная гипертензия (ЛАГ) диагностируется при повышении среднего давления в легочной артерии до и более 25 мм рт. ст. в покое и 30 мм рт. ст. при нагрузке [3].
По данным литературы встречаемость идиопатической легочной гипертензии составляет 1 – 1,7 случаев на миллион человек населения [2], причем заболевание встречается чаще у женщин, чем у мужчин почти в 2 раза. Возраст пациентов с таким диагнозом в среднем составляет 36,4 года [1]. Не утешительны данные статистики выживаемости пациентов с ПЛГ – при отсутствии интенсивного лечения средняя продолжительность жизни составляет около 3 лет с момента постановки диагноза [2].
Несмотря на активное изучение проблемы, этиология ПЛГ остается невыясненной, однако исследователи предполагают важную роль генетических нарушений в развитии заболевания [4]. В частности, развитие ПЛГ ассоциируют с мутацией гена BMPR2, локализованном во второй хромосоме, однако патогенетическая связь между данным нарушением и ПЛГ не открыта [11].
Несмотря на то, что факторы, приводящие к запуску патологических изменений в легочных сосудах, точно не установлены, на сегодняшний день исследователи основной в вопросах этиологии и патогенеза данного заболевания считают теорию эндотелиальной дисфункции (ЭД), которая свидетельствует, что повреждение и дисфункция эндотелия легочных сосудов приводит к развитию вазоконстрикции и ремоделированию сосудистого русла. В патогенезе выделяют четыре основных патофизиологических феномена: вазоконстрикция, редукция легочного сосудистого русла, снижение эластичности легочных сосудов, их облитерация вследствие тромбоза и пролиферация гладкомышечных клеток (ГМК). Эти процессы индуцируются возникающим при ЭД дисбалансе выработки вазоактивных медиаторов, который заключается в усиленном синтезе эндотелиоцитами вазоконстрикторных веществ (тромбоксан А2, эндотелин-1) и дефиците выработки вазодилатирующих (NO, простациклин). Играет роль также нарушение работы потенциал-зависимых калиевых каналов ГМК, которое вызывает вазоконстрикцию и пролиферацию ГМК вследствие повышенного внутриклеточного содержания ионов кальция. Ключевое значение в развитии и прогрессировании ЛАГ отводится дефициту NO, который способствует хроническому вазоспазму, клеточной пролиферации, внутрисосудистому тромбообразованию [5].
Таким образом, замыкается порочный круг – прогрессирующее повреждение эндотелия приводит к ремоделированию сосудов [11].
Патологические процессы при ЛАГ затрагивают все слои сосудистой стенки, различные типы клеток (эндотелиальные, ГМК, фибробласты). Структурные нарушения начинаются с артерий мышечного типа и артериол легких. Процесс начинается с гипертрофии и мускуляризации средней оболочки артериол. Кроме того, наблюдается миграция ГМК в интиму сосуда, в которой происходит активная пролиферация клеточных элементов. Сначала утолщение интимы обратимо, однако вскоре развиваются необратимые изменения – фиброз и фиброэластоз. В ряде случаев концентрический фиброз интимы полностью закрывает просвет сосуда. При этом могут определяться плексогенные и плексиморфные структуры, которые, как правило, возникают проксимальнее места обтурации. В адвентиции наблюдается повышенная продукция экстрацеллюлярного матрикса, включая коллаген, эластин, фибронектин и тенасцин. Секреция медиаторов выраженного сосудосуживающего действия трансформирует состояние сосудистого русла из обычного антикоагулянтного в прокоагулянтное и способствует развитию тромбоза [10, 11].
Современные функциональные исследования с помощью различных неинвазивных методик оценки состояния периферического кровотока не подтверждают генерализацию эндотелиальной дисфункции у пациентов с ПЛГ, однако отмечается повышенная констрикторная способность ГМК [6].
Рост сосудистого сопротивления в малом круге кровообращения (МКК) инициирует возникновение синдрома гипердинамии миокарда с развитием гипертрофии правого желудочка (ПЖ). Данное явление обусловлено физиологической реакцией, описанной Старлингом, которая заключается в увеличении силы сердечного сокращения в ответ на нагрузку объемом или сосудистым выходным сопротивлением [7]. Легочное сердце (ЛС) развивается при первичной или вторичной ЛАГ, возникшей в результате нарушения функции эндотелиоцитов сосудов легких, структурных и функциональных изменений легочных сосудов [8]. В развитии легочного сердца выделяют несколько стадий. В начальную стадию происходит увеличение резистентности легочных сосудов, является следствием ЛАГ. Во вторую стадию выявляются изменения в ПЖ в ответ на повышение легочного артериального давления. Третья стадия заключается в выраженной гипертрофии и дилатации ПЖ, происходят изменения в васкуляризации последнего, может наблюдаться правожелудочковая сердечная недостаточность (ПЖСН) [9].
При формировании ЛС наблюдаются изменения миокарда в виде гипертрофии, дистрофии, атрофии и некроза кардиомиоцитов ПЖ. В мышечных волокнах ПЖ могут наблюдаться атрофически-склеротические процессы, в правом предсердии и ПЖ – выраженный фиброэластоз эндокарда. Реже отмечается расширение полости левого желудочка [12].
Диагностика ПЛГ затруднена, поскольку жалобы пациентов носят неспецифический характер и могут напоминать врожденный порок сердца. В большинстве случаев клинические проявления формируются после развития необратимых изменений в легких. Отмечают слабость, усталость, одышку, кровохарканье, ангинозную боль в области сердца, головокружение, абдоминальный дискомфорт. При осмотре обнаруживаются пульсация шейных вен, гепатомегалия, периферические отеки, асцит. Пальпаторно определяется пульсация в четвертом межреберье слева от грудины, увеличение правого желудочка. Аускультируется усиление второго тона во втором межреберье справа [13].
Консервативное лечение ПЛГ предусматривает, в первую очередь, назначение антагонистов кальция, проведение антикоагулянтной терапии, применение диуретиков при ПЖСН. Силденафила цитрат (действующее вещество «Виагры») имеет одинаковые вазодилатирующие способности как в сосудах гениталий, так и легких, в связи с чем был одобрен в США в качестве препарата для лечения ПЛГ [4]. Возможно и хирургическое лечение – трансплантация органокомплекса «сердце-легкие» [11]. Однако полное устранение ПЛГ на данный момент не представляется возможным, лечение носит поддерживающий характер.
В отдельную категорию относят персистирующую легочную гипертензию новорождённых (ПЛГН) в связи с наличием характерных патогенетических и клинико-морфологических аспектов, связанных с особенностями кровообращения плода и отличающими её от ПЛГ. ПЛГН – заболевание, характеризующееся аномально повышенным давлением в легочных сосудах и, как следствие, право-левым шунтированием крови через овальное отверстие и (или) открытый артериальный проток при отсутствии других пороков сердца. Среди вариантов ПЛГН, в свою очередь, выделяют идиопатическую (первичную) и осложняющую различные неонатальные сердечно-легочные осложнения (вторичную) [14]. ПЛГН встречается в 0,2-0,3 случаях на 1000 новорождённых, однако идиопатический вариант составляет до 20% от всех случаев ПЛГН [15].
Ведущей этиологией идиопатической ПЛГН является длительная внутриутробная гипоксия, которая приводит к ремоделированию сосудистого русла, которое выражается в гиперплазии гладких мышц сосудов, распространяющейся на внутридольковые артерии, что приводит к повышению сосудистого сопротивления [15].
У здоровых новорождённых в ответ на многочисленную стимуляцию, происходящую во время рождения, в том числе на увеличение парциального давления кислорода, изменения pH крови, меняется активность вазоактивных веществ [14]. Основным патогенетическим звеном идиопатической ПЛГН также считается дисбаланс синтеза вазоконстрикторных и вазодилатирующих веществ [15].
Таким образом, первичная легочная гипертензия – редкое и тяжелое, с крайне неблагоприятным прогнозом заболевание. Однако накопившийся клинический опыт предоставляет возможности открывать механизмы его патогенеза и разрабатывать новые методы диагностики и лечения, позволяющие не только продлить жизнь пациентам, но и улучшить ее качество. В этой связи актуальным является описание клинических случаев идиопатической легочной гипертензии.
Клинический случай
Из анамнеза известно, что мальчик Е.Д. родился от пятой беременности (вторые роды), протекающей на фоне угрозы прерывания беременности, отеков беременных, низкой плацентации, частичной прогрессирующей отслойки низкорасположенной плаценты, отягощённого акушерско-гинекологического анамнеза, хронической внутриутробной гипоксии плода. Преждевременные роды при сроке гестации 32-33 недели были разрешены путем операции кесарева сечения в экстренном порядке.
Новорождённый находился в тяжелом состоянии с оценкой по шкале Апгар 4-5-6-6 баллов. Тяжесть состояния была обусловлена дыхательными нарушениями, неврологической симптоматикой на фоне недоношенности и морфофункциональной незрелости. Антропометрические данные ребенка при рождении: масса тела 2530 г, рост 47 см, окружность груди 31 см, окружность головы 33 см.
С рождения находился на ИВЛ. На этапе родильного дома проводилась респираторная, инфузионная, антибактериальная и гемостатическая терапия. С целью дальнейшего обследования, лечения и выхаживания мальчик был переведён бригадой санитарной авиации из роддома в отделение реанимации и интенсивной терапии новорождённых Саратовской Областной Детской Клинической больницы (СОДКБ).
На основании проведенных обследований был поставлен основной конкурирующий клинический диагноз: 1. Врождённая пневмония. 2. Церебральная ишемия 3 степени, острый период. Синдром угнетения. Осложнения: синдром полиорганной недостаточности (отек головного мозга, кома 3 степени; дыхательная недостаточность 3 степени; острая сердечно- сосудистая недостаточность 3 степени; острая почечная недостаточность в стадии олигоанурии; отечный синдром; геморрагический синдром; легочная гипертензия). Сопутствующие заболевания: дефект перимембранозный подтрикуспидальный межжелудочковой перегородки 0,24 см; открытый артериальный проток: 0,30см; открытое функционирующее овальное окно: 0,42см, лево-правый сброс. Фоновый диагноз: респираторный дистресс-синдром новорождённых; недоношенность 32-33 недели.
В условиях проводимой терапии (инотропная поддержка, сурфактанты, увеличение параметров вентиляции до максимально возможных) состояние ребенка оставалось тяжелым с динамикой ухудшения. На фоне прогрессирующей полиорганной недостаточности была отмечена асистолия, констатирована биологическая смерть ребенка.
При вскрытии грудной полости отмечено обычное расположение органов, однако легкие полностью выполняют плевральную полость. Форма сердца конусовидная, расположение обычное. Величина и расположение вилочковой железы без особенностей. В мягких тканях имеются кровоизлияния ярко-красного цвета размерами до 1 см.
При исследовании дыхательных путей отмечены обычных размеров отечные розовые небные миндалины. В просвете гортани, трахеи и бронхов определяется небольшое количество слизистого содержимого. Слизистая оболочка указанных органов отечная, гладкая по всей длине. Листки париетальной и висцеральной плевры гладкие, бледно-розового оттенка. Легкие темно-красного цвета, плотной консистенции, легочная ткань на разрезе однородная, обильно пропитана кровью, при надавливании выделятся жидкая кровь и отечная жидкость. Масса левого легкого 40 грамм, правого легкого 37 грамм. Кусочки, вырезанные из легких, при погружении в воду тонут. На гистологическом исследовании легких в просветах альвеол обнаружены очаговые скопления эритроцитов, формирующиеся гиалиновые мембраны; в сосудах отмечена гипертрофия мышечного слоя артерий и вен более чем на 25%, выявлены пролиферация интимы с фиброзом, а также тромботические массы.
При вскрытии полости черепа обнаружено, что твердая мозговая оболочка тонкая, с перламутровым блеском. Мягкие мозговые оболочки отечные, полнокровные. Извилины головного мозга уплощены, борозды сглажены. Боковые желудочки немного увеличены в размерах, содержат прозрачный ярко-желтый ликвор. В полости правого желудочка имеется небольшой сверток крови ярко-красного цвета объемом около 5 мл. Сосудистые сплетения полнокровные, с прозрачным содержимым. Белое и серое вещество больших полушарий различимо, на поверхности разрезов определяются темно-красные точки, легко смываемые водой. Остальные структуры головного мозга без видимых изменений. Масса головного мозга 265 грамм. На гистологическом исследовании выявлено неравномерное кровенаполнение сосудов головного мозга.
При вскрытии брюшной полости выделилось около 5 мл желтой жидкости. Петли тонкого кишечника в нижних отделах темно-красного цвета, немного увеличены в размерах; сосуды кишечника полнокровны. Слизистая тонкого кишечника со сглаженным рисунком, темно-красного цвета. В просвете нижних отделов тонкого кишечника геморрагическое содержимое. Печень массой 105 грамм красного цвета, на поверхности и на разрезе имеет обычную структуру. На гистологическом исследовании печени обнаружена дистрофия гепатоцитов, полнокровие печеночных синусов.
При вскрытии почек отмечено, что на разрезе корковое вещество синюшно-красного цвета, а мозговое – темно-красное; паренхима плотной консистенции; слизистая лоханок гладкая, чистая с единичными мелкими кровоизлияниями. Слизистая оболочка мочеточников и мочевого пузыря без особенностей. На гистологическом исследовании почек обнаружена дистрофия эпителия извитых почечных канальцев, а также неравномерное кровенаполнение сосудов.
При вскрытии остальных органов и систем значимых особенностей выявлено не было.
На основе проведенного вскрытия и гистологического исследования был поставлен патологоанатомический диагноз – первичная легочная гипертензия; осложнения основного заболевания – гипертрофия миокарда правого желудочка сердца; вторичные гиалиновые мембраны; кровоизлияния в легких; паренхиматозная дистрофия внутренних органов.
В данном случае ПЛГ у новорожденного сочеталась с открытым овальным окном и открытым артериальным протоком, а также перимембранозным дефектом межжелудочковой перегородки, что привело к существенным изменениям гемодинамики в неонатальном периоде. Следствием длительной гипоксии стало ишемическое повреждение различных органов, развитие паренхиматозной дистрофии и полиорганной недостаточности, что и обуславливало тяжесть состояния пациента. Непосредственной причиной смерти больного стала дыхательная недостаточность.
Заключение
Таким образом, ПЛГ – тяжелое прогрессирующее заболевание, плохо поддающееся лечению, – у новорожденных осложняется особенностями гемодинамики и неминуемо приводит к летальному исходу. Изучение этиологии и патогенетических механизмов идиопатической легочной гипертензии позволит найти новые пути помощи больным, страдающим от данной болезни.
Литература
1. Породенко Н.В., Скибицкий В.В., Запевина В.В. Диагностика и лечение первичной легочной гипертензии: современный взгляд на проблему // Кубанский научный медицинский вестник. 2014. №3 (145). С. 140-144.
2. Пациент с первичной легочной гипертензией – кто он и как ему помочь? / С.В. Гарькина, Е.В. Адонина, Д.В. Дупляков и др. / Клиницист. 2011. №3. С. 103-106.
3. Dweik RA, Erzurum SC. Update on pulmonary vascular diseases 2010. Am J Respir Crit Care Made 2011; 184: 26-31
4. Редкий случай в практике врача терапевта – первичная легочная гипертензия / О.А. Ефремова, С.И. Логвиненко, М.А. Бочарова, Н.А. Губарева / Научные ведомости Белгородского государственного университета. Серия: Медицина. Фармация. 2011. Т. 16, №22. С. 281-284.
5. Парамонов В.М. Оценка эффективности длительной терапии бозентаном, силденафилом и их комбинация у больных с идиопатической легочной гипертензией : дис. … канд. мед. наук. Российский кардиологический НПК МЗ РФ, Институт клинической кардиологии им. А.Л. Мясникова. М., 2016.
6. Долгова Е.В. Особенности микроциркуляции сосудов кожи в зависимости от тяжести клинического течения различных форм легочной гипертензии и возможности воздействия терапии силденафилом у пациентов с идиопатической легочной гипертензией: дис. … канд. мед. наук. Российский кардиологический НПК МЗ РФ, Институт клинической кардиологии им. А.Л. Мясникова. М., 2017.
8. Кароли Н.А., Ребров А.П. Легочная гипертензия и легочное сердце в клинической практике // Клиницист. 2007. №4. С. 4-10.
9. Агапитов Л.И., Белозеров Ю.М. Хроническое легочное сердце у детей // Российский вестник перинатологии и педиатрии. 2010. Т. 55, №2. С. 50-59.
10. Лазуткина В.К., Цаллагова З.С., Елфимова Е.М. Рентгеноморфологическая характеристика первичной (идиопатической) легочной гипертензии // Медицинская визуализация. 2010. №5. С. 96-102.
11. Клинические рекомендации по диагностике и лечению легочной гипертонии / И.Е. Чазова, С.Н. Авдеев, Н.А. Царева и др. / Терапевтический архив. 2014. №9. С. 4-23.
12. Хроническое легочное сердце / В.С. Задионченко, И.В. Погонченкова, З.О. Гринева и др. / Российский кардиологический журнал. 2003. №4 (42). С. 6-11.
13. Породенко Н.В., Скибицкий В.В., Запевина В.В. Диагностика и лечение первичной легочной гипертензии: современный взгляд на проблему // Кубанский научный медицинский вестник. 2014. №3 (145). С. 140-144.
15. Иванов Д.О., Сурков Д.Н., Цейтлин М.А. Персистирующая легочная гипертензия // Бюллетень Федерального Центра сердца, крови и эндокринологии им. В.А. Алмазова. 2011. №5. С. 94-112.
Неонатальный скрининг жизнеугрожающих состояний – персистирующей легочной гипертензии новорожденных и критических врожденных пороков сердца – методом пульсоксиметрии
Цель исследования: оценить диагностическую значимость пульсоксиметрии, проводимой новорожденным на 3-м часу жизни для выявления критических состояний и обосновать целесообразность дальнейшего внедрения этой технологии в работу родовспомогательных учреждений.
Результаты. В 5 родовспомогательных учреждениях Республики Татарстан в период с апреля 2016 г. по февраль 2017 г. пульсоксиметрическим скринингом было охвачено 8358 (88,4%) новорожденных. Положительные результаты были получены у 95 (1,14%) пациентов. Благодаря скринингу у 13 новорожденных в первые часы жизни были выявлены врожденные пороки сердца, не диагностированные внутриутробно, из них у 5 они оказались критическими. Все новорожденные с критическими врожденными пороками сердца были успешно оперированы. Кроме того, у 20 пациентов была выявлена персистирующая легочная гипертензия, у 30 – внутриутробная пневмония.
Выводы. Измерение сатурации на 3-м часу жизни новорожденного позволяет избежать жизнеугрожающих осложнений у детей с критическими врожденными пороками сердца и персистирующей легочной гипертензией и в стабильном состоянии перевести их на дальнейший этап лечения.
Ключевые слова
Об авторах
д.м.н., проф., зав. кафедрой педиатрии с курсом поликлинической педиатрии Казанской государственной медицинской академии
420012 Казань, ул. Муштари, д. 11
к.м.н., асс. кафедры педиатрии с курсом поликлинической педиатрии Казанской государственной медицинской академии Бабинцева Анна Анатольевна – к.м.н., асс. кафедры педиатрии с курсом поликлинической педиатрии Казанской государственной медицинской академии
420012 Казань, ул. Муштари, д. 11
Отдел организации медицинской помощи детям и службы родовспоможения Минздрава Республики Татарстан
Россия
начальник отдела организации медицинской помощи детям и службы родовспоможения Министерства здравоохранения Республики Татарстан
420111 Казань, ул. Островского, д. 11/6
аспирант кафедры педиатрии с курсом поликлинической педиатрии Казанской государственной медицинской академии
420012 Казань, ул. Муштари, д. 11
Список литературы
1. Peterson C., Ailes E., Riehle-Colarusso T., Oster M.E., Olney R.S., Cassell C.H. et al. Late Detection of CCHD among US infants. JAMA Pediatrics 2014; 168 (4): 361–370. DOI: 10.1001/jamapediatrics.2013.4779
2. Mahle W.T., Newburger J.W., Matherne G.P., Smith F.C., Hoke T.R., Koppel R. et al. Role of Pulse Oximetry in Examining Newborns for Congenital Heart Disease: A Scientific Statement from the AHA and AAP. Pediatrics 2009; 124 (2): 823–836. DOI: 10.1542/peds.2009–1397
3. Liberman R.F., Getz K.D., Lin A.E., Higgins C.A., Sekhavat S., Markenson G.R. et al. Delayed diagnosis of critical congenital heart defects: Trends and associated factors. Pediatrics 2014; 134: e373. DOI: 10.1542/peds.2013–3949
4. Ailes E.C., Gilboa S.M., Honein M.A., Oster M.E. Estimated Number of Infants Detected and Missed by Critical Congenital Heart Defect Screening. Pediatrics 2015; 135 (6): 1000–1008. DOI: 10.1542/peds.2016–3258
6. Nair J., Lakshminrusimha S. Update on PPHN: mechanisms and treatment. Semin Perinatol 2014; 38: 78–91. DOI:10.1053/j.semperi.2013.11.004
8. De-Wahl Granelli A., Wennergren М., Sandberg K., Mellander M., Bejlum C., Ingana S.L. et al. Impact of pulse oximetry screening on the detection of ductdependent congenital heart disease: a Swedish prospective screening study in 39 821 newborns. BMJ 2009; 338: a3037. doi: 10.1136/bmj.a3037
9. Kemper A.R., Mahle W.T., Martin G.R., Cooley W.C., Kumar P., Morrow W.R. et al. Strategies for implementing screening for critical congenital heart disease. Pediatrics 2011; 10: 1259– 1267. DOI: 10.1542/PEDS.2011-1317
10. Thangaratinam S., Brown K., Zamora J., Khan K.S., Ewer A.K. et al. Pulse oximetry screening for critical congenital heart defects in asymptomatic newborn babies: a systematic review and meta-analysis. Lancet 2012; 379 (9835): 2459–2464. DOI:10.1016/S0140-6736(12)60107-X
11. Школьникова М.А., Бокерия Е.Л., Дегтярева Е.А., Ильин В.Н., Шарыкин А.С., Абдулатипова И.В. Неонатальный скрининг с целью раннего выявления врожденных пороков сердца. Методические рекомендации (№ 12). М: Департамент здравоохранения города Москвы 2012; 36. [Shkol’nikova M.A., Bokerija E.L., Degtjareva E.A., Il’in V.N., Sharykin A.S., Abdulatipova I.V. Neonatal screening for the early detection of congenital heart disease. Guidelines (№ 12). Moscow: Departament zdravoohranenija goroda Moskvy 2012; 36. (in Russ)]
12. Kemper A.R., Mahle W.T., Martin G.R., Cooley W.C., Kumar P., Morrow W.R., Kelm K., Pearson G.D., Glidewell J., Grosse S.D., Howell R.R. Strategies for implementing screening for critical congenital heart disease. Pediatrics 2011; 128: 1259–1267. DOI: 10.1542/PEDS.2011-1317
13. Карпова А.Л., Бокерия Е.Л., Николаева Т.Н., Спивак Е.М., Карпов Н.Ю., Мостовой А.В., Марасина А.В. Скрининг сатурации крови кислородом как метод выявления врожденных пороков сердца у новорожденных: современные подходы, проблемы, мнения. Детские болезни сердца и сосудов 2015; 4: 30–37. [Karpova A.L., Bokerija E.L., Nikolaeva T.N., Spivak E.M., Karpov N.Yu., Mostovoj A.V., Marasina A.V. Screening of saturation as a method of detection of congenital heart defects in newborns: modern approaches, problems, opinions. Detskie bolezni serdca i sosudov 2015; 4: 30–37. (in Russ)]
14. Mahle W.T., Martin G.R., Beekman R.H. III, Morrow W.R. Section on Cardiology and Cardiac Surgery Executive Committee. Endorsement of Health and Human Services recommendation for pulse oximetry screening for critical congenital heart disease. Pediatrics 2012; 129: 190–192. DOI:10.1542/peds.2011-3211
Персистирующая легочная гипертензия новорожденных
М.В. Фомичев
САМ - Синдром аспирации мекония
ОАП - Открытый артериальный проток
ВДГ - Врожденная диафрагмальная грыжа
Персистирующая легочная гипертензия (ПЛГ, персистирующая фетальная циркуляция - ПФК) - синдром, который характеризуется выраженной легочной гипертензией и, вследствие этого, право-левым внутрисердечным шунтированием крови и гипоксемией. Шунтирование происходит через ОАП и/или овальное окно при отсутствии сопутствующих пороков сердца. Приблизительно в 20% случаев шунт происходит только через овальное окно. ПЛГ может быть идиопатической или осложнять различные неонатальные сердечно-легочные нарушения. Большинство новорожденных с ПЛГ имеют сопутствующую легочную патологию: САМ, пневмонию или сепсис, ВДГ и др. Частота синдрома широко варьирует между клиническими центрами, от менее 1 до более 6 случаев на 1000 живорожденных. Длительное время считалось, что недоношенные дети имеют недостаточно развитый мышечный слой в артериолах для того, чтобы поддерживать высокое легочное сосудистое сопротивление после рождения, но, по современным представлениям, около 15%-35% детей с ПЛГ составляют недоношенные дети.
Патогенез
У здорового новорожденного легочное сосудистое сопротивление после рождения снижается в ответ на повышение РАО2, РаО2, повышение рН крови, изменение концентрации вазоактивных медиаторов (рис. 1). Все эти факторы понижают давление в легочной артерии и правом желудочке, и, таким образом, прекращается право-левый сброс крови через овальное окно и артериальный проток.
Регуляция тонуса легочных сосудов является комплексным процессом и представляет собой баланс между действием констрикторов и дилататоров. Основными медиаторами вазодилятации после рождения выступают простагландины и оксид азота, высвобождаемые эндотелием легочных сосудов (рис. 2). Главные ферменты, вовлеченные в перестройку постнатального кровообращения - циклооксигеназа и NO-синтетаза. Активность этих ферментов очень сильно возрастает в ответ на многочисленную стимуляцию, происходящую во время рождения.
NO синтезируется нитроксид синтетазой (NOS) из терминальных нитрогеновых групп L-аргинина. NO стимулирует гуанилат циклазу для увеличения внутриклеточной cGMP. Простациклин (PGI2) - метаболит арахидоновой кислоты, который формируется циклооксигеназой (COX-1) и простациклин синтетазой (PGIS) в сосудистом эндотелии. PGI2 стимулирует аденилат циклазу в гладкомышечной клетке сосудов, которая повышает внутриклеточный сАМР. сGMP и сАМР не напрямую снижают концентрацию кальция, что приводит к миорелаксации и, затем, к вазодилятации. Специфические фосфодиэстеразы гидролизируют сGMP и сАМР и т.о. регулируют интенсивность и продолжительность их сосудистых эффектов [Farrow K. 2005].
При некоторых состояниях (альвеолярная гипоксия, гипоксемия, ацидоз, шок, полицитемия, и т.д.) переход к нормальному кровообращению задерживается - давление в легочных сосудах и легочной артерии превышает системное артериальное давление, поддерживая право-левый сброс неоксигенированной крови через овальное окно и артериальный проток.
Различной степени дисфункция миокарда часто встречается при перинатальной асфиксии, гипоксемии, ацидозе, гипогликемии и гипокальциемии, что способствует появлению порочного круга: гипоксемия - дисфункция миокарда - снижение АД - ацидоз.
Длительная внутриутробная гипоксия может быть причиной гипертрофии мышечного слоя легочных артериол и может приводить после рождения к ПЛГ. Этот случай постнатальной гипоксемии наиболее устойчив к проводимой терапии. Посмертный осмотр легочных сосудов у детей, умерших от ПЛГ, показывает повышение толщины их мышечной стенки, которая происходит еще антенатально и нарушает послеродовую адаптацию. Некоторые химические медиаторы обладают вазоконстрикторными свойствами: лейкотриены, тромбоксан, фактор, активирующий тромбоциты, и их концентрация повышена в сыворотке крови и секрете ТБД при ПЛГ (табл. 1).
Факторы, модулирующие легочное сосудистое сопротивление у доношенных детей во время перестройки легочной циркуляции. [Kinsella J, Abman S. 1995].
Снижение ЛСС
Повышение ЛСС
Эндогенные медиаторы и механизмы
Кислород.
Оксид азота.
Простагландины: I2 , E2 , D2
Аденозин, АТФ.
Магний.
Брадикинин.
Предсердный натриуретический фактор.
Алкалоз.
Активаторы калиевых каналов.
Гистамин.
Стимуляция n. vagus
Ацетилхолин.
Стимуляция beta-адренорецепторов.
Механические факторы
Раздувание легкого.
Структурные изменения легочных сосудов.
Изменение объема интерстициальной жидкости.
Перепады давления.
Эндогенные медиаторы и механизмы
Гипоксия.
Ацидоз.
Эндотелин -1.
Лейкотриены
Тромбоксаны
Фактор активации тромбоцитов.
Активатор кальциевых каналов.
Стимуляция alpha-адренорецепторов.
Простагландин F2alpha
Механические факторы
Избыточный или недостаточный объем легких.
Чрезмерная мускулинизация, перестройка сосудов.
Изменение механических свойств гладкой мускулатуры.
Гипоплазия легких.
Альвеолярная капиллярная дисплазия.
Тромбоэмболия легких.
Расширение легочной артерии.
Дисфункция желудочков, венозная гипертензия.
Классификация ПЛГ [по: Whitsett J. 1999].
Функциональная вазоконстрикция при нормальном развитии легочных сосудов.
Гипоксия и ацидоз при:
- Тяжелой асфиксии в родах.
- САМ
- Сепсис и пневмония (особенно стрептококк группы В).
- РДС.
- Гипотермия.
- Гипогликемия.
Фиксированное снижение диаметра вследствие гипертрофии дистальной легочной сосудистого гладкомышечного слоя.
- Хроническая гипоксия вследствие плацентарной недостаточности или переношенности.
- Чрезмерный легочный кровоток из-за внутриутробного закрытия ОАП (прием матерью нестероидных противовоспалительных средств).
Снижение общей площади поперечного сечения легочных сосудов.
- Гипоплазия легких.
- Диафрагмальная грыжа.
Повышение вязкости крови и функциональная обструкция легочному кровотоку.
Некоторые больные с ПЛГ имеют низкую концентрацию в плазме крови аргинина и метаболитов NO, что говорит о возможных мелких дефектах эндогенной продукции NO.
Развитие гладкой мускулатуры, окружающей легочные артериолы, происходит ближе к концу гестации (более 28 недель), поэтому легочная гипертензия - проблема, обычно встречающаяся у доношенных и почти доношенных детей (старше 34 недель), чем у недоношенных (менее 34 недель).
В зависимости от главного патогенетического механизма ПЛГ предложена следующая классификация.
Большинство детей с ПЛГ рождены в срок, перенесли перинатальную асфиксию, САМ (около 50% детей с ПЛГ имеют околоплодные воды окрашенные меконием) или неонатальную инфекцию (табл. 3).
Факторы риска ПЛГ
Материнские
Постнатальные
- Меконий в околоплодной жидкости.
- Прием матерью НПВС.
- Длительный безводный промежуток.
- Курение табака.
- Введение ГК антенатально с целью профилактики РДС.
- Низкий уровень образования.
- Лихорадка.
- Инфекция мочевыделительных путей.
- Сахарный диабет
- Кесарево сечение.
- Черная и желтая раса.
- Прием антидепрессантов (fluoxetine).
- Аспирация мекония.
- Пневмония.
- Сепсис.
- Пол (мальчик).
- Тяжелый РДС.
- Диафрагмальная грыжа.
- Гипоплазия легких.
- Перинатальная асфиксия.
- Полицитемия.
- Гипогликемия.
- Выпот в плевральной полости.
По данным Walsh-Sukys и соавт. [2000] ПЛГ встречается в первые 24 часа жизни у 77% больных, 93% в первые 48 часов, 97% в первые 72 часа. Levine и соавт. [2001] отметили, что частота ПЛГ почти в 5 раз чаще встречается у детей после Кесарева сечения по сравнению с детьми, рожденными вагинально. При ПЛГ возможны следующие респираторные заболевания [Konduri G. 2004]: САМ (встречается у 50% больных), пневмония/сепсис (20%), РДС (5%), другие (5%). Идиопатическая легочная гипертензия наблюдается в 20% случаев.
В течение первых нескольких часов жизни происходит прогрессивное ухудшение оксигенации. При тяжелых заболеваниях легких повышается РаСО2. При идиопатической легочной гипертензии, наоборот, вероятна гипокапния. Характерными признаками являются цианоз, тахипное, возможно наличие систолического шума вследствие трикуспидальной регургитации. Гипоксемия и ацидоз могут приводить к дисфункции миокарда и кардиогенному шоку. Прогрессирующая гипоксемия становится плохо поддающейся на дальнейшее повышение FiO2, а эпизоды тяжелой гипоксемии становятся все продолжительнее. Часто наблюдается диспропорция между степенью поражения легких и тяжестью гипоксемии, что нередко служит основой для постановки диагноза ВПС. Очень характерны большие флюктуации в РаО2 (розовый/цианоз) в ответ на различные манипуляции, но они могут встречаться и спонтанно.
Обследование
- КОС в артериальной крови. Участок артериального забора крови будет влиять на показатели газов.
- Клинический анализ крови. Наличие полицитемии увеличивает вязкость крови и способствует ПЛГ. Концентрация лейкоцитов и тромбоцитов поможет установить наличие инфекционного заболевания. Тромбоцитопения иногда встречается после перенесенной асфиксии или при САМ.
- Глюкоза и электролиты сыворотки крови.
- Рентгенограмма органов грудной клетки. Поможет подтвердить или исключить легочную патологию, ВДГ. При идиопатической ПЛГ сосудистый рисунок обеднен ("черные" легкие). Размеры сердца чаще не увеличены, но возможна некоторая степень кардиомегалии.
- Эхокардиография. Поможет исключить ВПС. ПЛГ характеризуется высоким давлением в легочной артерии, право-левым шунтированием через артериальный проток и/или овальное окно, трикуспидальной регургитацией, возможно отклонение межпредсердной перегородки в сторону левого предсердия. Единственной структурной аномалией сердца при ПЛГ является ОАП с право-левым или бидиректоральным шунтом.
- Пульсоксиметрия или транскутанный мониторинг кислорода на участках кожи кровоснабжающейся предуктальной (правая рука) и постдуктальной кровью (левая рука, ноги, грудь, живот).
- Пре- и постдуктальная разница по кислороду. Получить артериальные газы крови из правой лучевой и пупочной артерий. Разница в показателе РаО2 более 20 мм рт. ст. клинически и диагностически значима. Лечение, которое приводит к повышению легочного кровотока, повышает постдуктальную оксигенацию. Транскутанной и артериальной разницы в РО2 не будет, если шунтирование происходит через овальное окно.
Широко известные гипероксический и гипергиперветиляционный тесты (см главу "Респираторный дистресс") имеют невысокую чувствительность и специфичность, и, поэтому, их диагностическая ценность невелика.
Дифференциальный диагноз следует проводить c пневмонией, ВДГ, САМ, ARDS пневмотораксом, ВПС, гипоплазией легких, РДС, легочной секвестрацией, сепсисом, врожденным дефицитом протеина В сурфактанта, альвеоло-капиллярной дисплазией. Все эти заболевания могут осложняться ПЛГ.
Лечение
Все лечебные мероприятия можно разделить на две большие группы: поддерживающие и направленные на дилятацию легочных сосудов.
- Коррекция гипоксемии. Поддерживать РаО2: 60-80 мм рт. ст. SaO2 95%-100%.
- Коррекция метаболического ацидоза. Поддерживать рН: 7.35-7.45. Применение соды для коррекции ацидоза является мероприятием неоднозначным. Лечение, в первую очередь, должно быть направлено на повышение сердечного выброса и АД.
- Минимальное количество любых манипуляций.
- Поддержание нормальной температуры тела, нормогликемии, коррекция гипокальциемии, гипомагниемии, полицитемии, анемии (следует поддерживать Ht более 40%).
- Нормализация АД. Сердечный выброс и АД повышаются с помощью объемной нагрузки (0.9% NaCl) и с применением инотропных и вазопрессорных препаратов: допмина, добутамина, изопротеренола, адреналина.
- Седатация, обезболивание наркотическими анальгетиками. Мышечная релаксация в случае "борьбы" с вентилятором. В некоторых случаях может наступить ухудшение состояния вследствие возможного отрицательного влияния миорелаксации и глубокой седатации на гемодинамику и обмен газов в легких. Ретроспективный анализ [Walsh-Sukys M. 2000] показал, что применение миорелаксантов больным с ПЛГ увеличивает смертность.
- Антибиотики при сепсисе или пневмонии.
В большинстве случаев ПЛГ этого лечения будет достаточно. Многие (почти все) эпизоды гипоксемии проходят самостоятельно. Выберете выжидательную тактику, не хватайтесь сразу за более агрессивное лечение. Единственная манипуляция, которую часто приходится делать в первые несколько суток, переводить больного на дыхание 100% кислородом. Не спешите быстро уходить с высоких концентраций кислорода, дыхание несколько дней даже 100% кислородом относительно безопасно. Уровень SaO2 80%-85% при стабильных показателях гемодинамики и отсутствии анемии безопасен для здоровья больного как минимум несколько часов, а возможно и дней.
Респираторная поддержка
Вне зависимости от вида респираторной поддержки, которым вы пользуетесь (оксигенотерапия, СРАР, ИВЛ, ВЧ ИВЛ), основной задачей будет поддерживать приемлемый уровень оксигенации. Гипоксемию часто невозможно купировать в кислородной палатке, и если больному требуется FiO2 более 60%, вероятно, безопаснее его перевести на ИВЛ. Некоторые авторы считают минимально приемлемым уровнем РаО2 - 50 мм рт ст, другие предпочитают 60-80 мм рт ст, третьи - не менее 100 мм рт ст. Если для поддержания более высокой оксигенации необходимо увеличение FiO2, это одна ситуация. Но если для этого необходимо ужесточать параметры ИВЛ, вероятно, следует сравнить пользу и вред от этих манипуляций. Если возможно, следует поддерживать РаСО2 35-45 мм рт ст. Все больные ПЛГ тяжелой степени будут, безусловно, нуждаться в интубации и переводе на ИВЛ. Стратегии ИВЛ при ПЛГ см. таблицу 4.
Клиническая картина
Большинство детей с ПЛГ рождены в срок, перенесли перинатальную асфиксию, САМ (около 50% детей с ПЛГ имеют околоплодные воды окрашенные меконием) или неонатальную инфекцию (табл. 3).
Две стратегии ИВЛ при ПЛГ
Гипервентиляция или
⌠агрессивный подход■
Нормовентиляция или
⌠консервативный подход■
Достигнуть следующих показателей КОС:
рН: 7.45√7.55
РаО2: 80√100 мм рт. ст
РаСО2: 25√35 мм рт. ст,
или достижение ⌠критического■ уровня
РаСО2 манипулируя
PIP и ЧД
рН: около 7.40
РаО2: 60√80 мм рт. ст
РаСО2: 35√45 мм рт. ст.
Или по Wung и соавт:
рН - 7.25
РаО2: 50√70 мм рт. ст,
РаСО2: 40√60 мм рт. ст.
Читайте также:
