Пигментососудистый факоматоз: признаки, гистология, лечение, прогноз
Добавил пользователь Валентин П. Обновлено: 31.01.2026
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований.
На сегодняшний день частота выявления доброкачественных образований яичников не снижается, что объясняется широким применением в гинекологии современных информативных методов исследований. В течение нескольких десятилетий для дифференциации опухолей матки и придатков с успехом применяется ультразвуковая диагностика [1]. Однако не всегда при трансвагинальной эхографии можно определить характер опухоли, особенно на ранних стадиях развития опухоли яичника [2]. Возможность дифференциации доброкачественных и злокачественных образований яичников появилась с применением цветного доплеровского картирования [1, 3].
Длительность существования доброкачественной опухоли яичника и ее способность к малигнизации имеют самый различный диапазон и частоту. Так, известно, что малигнизации подвергается каждая третья серозная кистома яичника [2, 3, 4, 5]. Вместе с тем не исключено и длительное существование этих опухолей без каких-либо пролиферативных изменений в капсуле.
Известно, что образования яичников небольших размеров часто принимаются за опухолевидные образования и подвергаются консервативной противовоспалительной терапии. Отсутствие же эффекта от лечения рассматривают как показание для оперативного вмешательства. Однако распознать грань перехода пролиферации эпителия капсулы в атипический эпителий и своевременно предотвратить опасное для жизни заболевание является довольно сложной задачей. Окончательный диагноз о характере образования яичника устанавливается путем гистологического исследования удаленной капсулы.
Целью исследования явилось изучение клинических проявлений и морфологических особенностей доброкачественных опухолей яичников для своевременного решения вопроса о необходимости их оперативного лечения. Материал и методы исследования. Нами изучено клиническое течение доброкачественных образований яичников у 170 больных, поступивших в гинекологическое отделение акушерского комплекса № 9 г. Ташкента по поводу объемного образования яичника на оперативное лечение.
Возраст обследованных женщин колебался от 25 до 45 лет. Наиболее частым возрастом выявления опухолей яичников у наших пациенток является 20–29 лет (около половины), затем возрастная группа 30–39 лет. Меньше всего среди больных было пациенток в возрасте до 20 лет (около 5%).
Дооперационное обследование включало ультразвуковое исследование с цветовым доплеровским картированием сосудов яичника и определение в крови онкомаркера СА-125. Онкомаркер СА-125 является антигеном, определяемым с помощью моноклональных антител к клеткам рака яичников, и наиболее специфичным маркером при опухолях яичников, особенно в постклимактерическом периоде [5, 6]. Интерпретация результатов определения величины онкомаркера СА-125 проводилась в соответствии с результатами гистологического исследования.
При резко повышенных показателях проводилось повторное исследование в послеоперационном периоде и после реабилитационного лечения. Верификация диагноза проводилась в послеоперационном периоде гистологическим исследованием капсулы кистомы.
Для гистологического исследования из резецированных стенок кист готовили гистологические препараты по общепринятой методике. Результаты исследования и их обсуждение. Наиболее частой жалобой пациенток было бесплодие. Из 77 (45,3%) больных с нарушением репродуктивной функции у 46 (60,0%) пациенток наблюдалось первичное бесплодие длительностью от двух до шести лет, у 31 (40%) — вторичное бесплодие длительностью от двух до четырех лет.
Второй по частоте жалобой были ноющие боли внизу живота и альгоменорея (у 71 больной — 41,8%). Около одной трети больных (55 пациенток — 32,4%) до поступления в стационар получали консервативную противовоспалительную терапию без особого успеха.
Нарушения менструаций были отмечены чаще у больных с опухолевидными образованиями воспалительного характера, что было подтверждено результатами гистологического анализа удаленной капсулы образования. Из нарушений менструально-овариального цикла, кроме альгоменореи, были выявлены гиперменорея (12,3%), гипоолигоменорея (16,8%), в некоторых случаях — дисфункциональные кровотечения в анамнезе (у 9,2%).
Доплерометрические исследования кровотока характеризовались низкой скоростью кровотока в маточных и яичниковых сосудах и повышенными значениями индекса резистентности. Определение онкомаркера СА-125, проведенное до операции, показало, что, несмотря на разброс цифр (от 8,3 до 60,3), средняя цифра не превышала принятую норму 35 Ед/мл. Оперативное лечение проведено практически всем женщинам путем лапароскопии. Послеоперационное реабилитационное лечение зависело от результатов гистологического исследования и величины онкомаркера.
Интерес представляет также полиморфизм гистологических изменений в капсуле удаленных образований. Большую часть (33%) составили опухолевидные образования (фолликулярные и лютеиновые кисты). Доброкачественные эпителиальные опухоли составили 25% случаев, из них в 11,7% случаев — серозные и в 13,3% случаев — эндометриоидные. В 5% случаев наблюдали герминогенную опухоль в виде зрелой тератомы. Вместе с тем в двух случаях гистологическое исследование выявило аденокарциному яичника. Значительная часть кистозных образований (31,7%) не имела эпителиальной выстилки, что затрудняло установление гистогенеза и характера новообразования яичника.
Фолликулярные кисты были представлены чаще как одностороннее однокамерное и тонкостенное образование с гладкой внутренней стенкой. Гистологически соединительнотканная стенка была выстлана многорядным фолликулярным эпителием, под которым располагаются клетки theca interna, в некоторых случаях наблюдалась ее гиперплазия и лютеинизация.
Лютеиновые кисты чаще выявлялись в виде двусторонних и одиночных образований. Внутренняя поверхность стенки кисты выстлана слоем текалютеиновых клеток, под которыми расположена гранулеза без лютеинизации.
Среди эпителиальных опухолей чаще встречались серозные и муцинозные. Серозные опухоли были представлены серозной цистоаденомой, обычно крупных размеров. Капсула опухоли в основном была грубоволокнистой, выстилающий стенку эпителий был однорядным кубическим или уплощенным, в некоторых случаях обнаруживался цилиндрический эпителий.
Муцинозные опухоли были представлены муцинозной цистоаденомой (или сецернирующая муцинозная кистома), обычно многокамерной и крупных размеров. Внутренняя поверхность стенки выстлана однорядным высоким призматическим эпителием, цитоплазма которых содержала слизь.
Эндометриоидные опухоли яичников были схожи с опухолями эндометрия и характеризовались выстилкой стенки кисты однорядным низким цилиндрическим эпителием эндометриального типа. Вокруг стенки часто наблюдались кровоизлияния и накопление гемосидерина.
Зрелая кистозная тератома (или дермоидная киста) яичника была обычно однокамерной и заполнена салом и волосами. Гистологически обнаруживались кожа, волосяные фолликулы, сальные и потовые железы, редко — хрящ.
Аденокарциномы яичников были представлены серозной папиллярной цистоаденокарциномой. Нами выявлены две больные с аденокарциномой, у которых онкомаркер СА-125 был соответственно в 11 и 15 раз выше нормы.
Таким образом, исследования показали, что доброкачественные опухоли и опухолевидные образования яичников чаще встречаются среди женщин активного репродуктивного возраста — от 20 до 39 лет, что несколько отличается от данных литературы [4, 5]. Клиническая картина доброкачественных опухолей неспецифична и проявляется в некоторых случаях нарушениями менструального цикла, бесплодием. Наши исследования показали, что определение онкомаркера СА-125 позволяет в предоперационном периоде с высокой степенью вероятности прогнозировать характер образования яичника и определить хирургическую тактику, что подтверждается результатами других исследователей [6].
Выводы:
Скудная и неспецифичная клиническая симптоматика объемных образований и многообразие их гистологических форм указывают на необходимость тщательного дооперационного обследования, включая определение онкомаркера СА-125.
Необходимо проведение экспресс-диагностики во время операции лапароскопии для решения вопроса об объеме оперативного вмешательства и дальнейшей тактики.
Литература
Сидорова И. С., Гуриев Т. Д., Саранцев А. И., Капустина И. Н., Ардус Ф. С. Цветное доплеровское картирование в предоперационной диагностике и прогнозировании при объемных образованиях придатков матки / Акуш. и гинек. 2003. № 3. С. 41–46.
Соломатина А. А., Степанов К. И., Курбатская О. И., Демина Л. Н., Пашкова А. В. Цветное доплеровское картирование в диагностике опухолей и опухолевидных образований яичников / Акуш. и гинек. 2003. № 2. С. 54–57.
Патолого-анатомическая диагностика опухолей человека. Руководство для врачей. Под редакцией Н. А. Краевского, А. В. Смолянникова, Д. С. Саркисова: М.: Медицина, 1993. В 2-х томах.
Серов С. Ф., Иржанов С. И., Бейсебаев А. А. Эпителиальные опухоли яичников. Алма-Ата: Казахстан. 1991.
Zeimet A. G., Muller-Holzner E., Marth C. Tumor marker CA-125 in tissuer of the female reproductive tract and serum during the normal menstrual cycle // Fertil. Steril. 1993.
Л. М. Абдуллаева, кандидат медицинских наук Ташкентская медицинская академия, Ташкент
Пигментососудистый факоматоз: признаки, гистология, лечение, прогноз
Пигментососудистый факоматоз (phacomatosis pigmentovascularis) представляет собой сочетание сосудистых мальформаций кожи, чаще всего это пламенеющий невус («пятно портвейна»), с меланоцитарным невусом, в большинстве случаев с глазным и/или кожным меланоцитозом.
Описания серий клинических наблюдений этого редкого заболевания относительно немногочисленны (1-4). В литературе по дерматологии по этой проблеме опубликованы описания лишь небольших серий наблюдений. В офтальмологической литературе указывается на связь этого синдрома с глаукомой и меланомой.
а) Клиническая картина. Пигментососудистый факоматоз проявляется комбинацией симптомов синдрома Стерджа-Вебера и глазного меланоцитоза (невус Ота).
Пигментососудистый факоматоз обычно проявляется уже при рождении пламенеющим невусом и/или окулодермальным меланоцитозом. Пациенты должны в течение всей жизни находиться под наблюдением на предмет развития гемангиомы и меланомы хориоидеи.
Младенец с двусторонним пламенеющим невусом. Тот же ребенок в более старшем возрасте: после проведенного лечения лазером пламенеющий невус регрессировал. Глазное дно правого глаза ребенка, показанного на рисунке выше: наблюдается глазной меланоцитоз. Глазное дно левого глаза ребенка, показанного на рисунке выше: меланоцитоз и гемангиома отсутствуют. Пожилой мужчина с существующим в течение всей жизни пламенеющим невусом и малозаметным глазным меланоцитозом. Глазное дно левого глаза пациента, показанного на рисунке выше: отмечаются меланома и кровоизлияние в стекловидное тело.
б) Диагностика. Это редкое состояние диагностируется при внешнем осмотре кожи и офтальмоскопии. У пациента могут наблюдаться пламенеющий невус, гемангиома и/или меланома хориоидеи.
Диагностике могут способствовать флюоресцентная ангиография, ангиография с индоцианином зеленым, ультразвуковое исследование и магнитная резонансная томография. Для ранней диагностики опухолей и скоплений субретинальной жидкости используется оптическая когерентная томография высокого разрешения.
в) Патологическая анатомия. О патологической анатомии этого редкого состояния доступно очень мало информации.
г) Лечение. Такие больные требуют ежегодного обследования на предмет развития как гемангиомы, так и меланомы хориоидеи. Информативными методами диагностики являются ультразвуковое исследование и оптическая когерентная томография.
д) Список использованной литературы:
1. Shields CL, Kligman BE, Suriano M, et al. Phacomatosis pigmentovascularis of cesioflammea type in 7 cases. Combination of ocular pigmentation (melanocytosis, melanosis) and nevus flammeus with risk for melanoma. Ophthalmology 2011; 129:746-750.
2. Happle R. Phacomatosis pigmentovascularis revisited and reclassified. Arch Dermatol 2005;141:385-388.
3. Teekhasaenee C, Ritch R. Glaucoma in phacomatosis pigmentovascularis. Ophthalmology 1997;104:150-157.
4. Tran HV, Zografos L. Primary choroidal melanoma in phacomatosis pigmentovascularis IIa. Ophthalmology 2005; 112:1232-1235.
- Вернуться в оглавление раздела "Онкология"
Редактор: Искандер Милевски. Дата публикации: 15.6.2020
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Ксантоматоз
Ксантоматоз – обменное заболевание, при котором на поверхности кожных покровов и в некоторых других тканях формируются отложения липидов, главным образом холестерола и холестанола (ксантомы). Симптомами этого состояния являются желтоватые безболезненные бляшки и наросты на коже лица, нижних век (ксантелазма), конечностей и туловища без признаков воспаления. Диагностика ксантоматоза осуществляется по результатам осмотра кожных покровов, а также изучения основных показателей липидного обмена (уровня холестерина и липопротеидов в крови). Лечение разделяется на общее – коррекция липидного обмена – и местное, при котором производят удаление ксантом хирургическим путем или средствами медицинской косметологии.
Общие сведения
Ксантоматоз представляет собой множественные отложения липоидных веществ в коже (в некоторых случаях – в костях, твердой мозговой оболочке, сухожилиях), которые обусловлены гиперлипидемией. Одним из первых исследователей, который сумел верно описать и охарактеризовать это дерматологическое состояние еще в 1835 году, был французский врач П. Райе. Ксантоматоз кожи является лишь частью проявлений при нарушенном липидном обмене, помимо этого у больных могут наблюдаться также ксантелазмы, атеросклероз, липоидная дуга роговицы и даже пороки сердца, обусловленные отложением липидов на клапанах. Это состояние не является распространенным, может быть обусловлено, как первичными (генетическими) нарушениями, так приобретенными расстройствами метаболизма жиров. В некоторых случаях ксантоматоз обусловлен возрастными изменениями. В зависимости от типа и характера нарушений липидного обмена, это кожное заболевание может проявиться в разном возрасте – от детского и подросткового до преклонного и старческого.
Причины ксантоматоза
Главной причиной развития ксантоматоза является нарушение липидного обмена с развитием гиперлипидемии – состояния, при котором в крови резко увеличивается количество различных фракций липопротеидов. Такие изменения могут иметь различную природу – например, первичное расстройство метаболизма жиров имеет пять разновидностей. Каждая из них обусловлена нарушением работы определенного звена транспорта жиров и холестерина в организме, но все они имеют примерно одинаковый итог – триглицериды и холестерол в виде липопротеидов начинают накапливаться в крови, изменяя ее реологические свойства.
В результате сложных процессов липиды начинают проникать в клетки и межклеточное пространство тканей кожи и сухожилий, формируя там скопления, которые визуально определяются как ксантомы. Множественное образование таких скоплений на кожных покровах и носит название ксантоматоза.
Помимо первичных или наследственных нарушений липидного обмена, ведущих к гиперлипидемии и ксантоматозу, существуют и приобретенные факторы, способные увеличивать уровень триглицеридов и холестерина в крови. К ним относят сахарный диабет, высокое поступление жиров с пищей, гипотиреоз, воспаление поджелудочной железы (панкреатит), поражение печени (тяжелый гепатит, цирроз). В некоторых случаях гиперлипидемия с развитием ксантоматоза возникает в преклонном возрасте как часть комплекса старческих изменений в организме. Как правило, вторичные, или приобретенные, формы ксантоматоза чаще встречаются у лиц старшего или пожилого возраста, тогда как первичные могут развиваться как у детей, так и у взрослых. Патогенез отложения липидов в коже при вторичных гиперлипидемиях не имеет характерных отличий.
Симптомы ксантоматоза
Сами ксантомы при этом состоянии могут иметь различный внешний вид, который во многом зависит от причин, обусловивших развитие ксантоматоза. Так, выделяют эруптивные ксантомы, которые имеют сначала красный, затем желтоватый цвет, но багровый ободок сохраняется вокруг них еще долгое время. Они имеют четкие границы и полусферическую форму. Туберозные ксантомы характеризуются симметричным образованием, имеют желтый или коричневый цвет и могут достигать довольно крупных размеров – до 2-3 сантиметров. Плоские ксантомы, выявляемые при некоторых типах ксантоматоза, представляют собой пятна или бляшки желтого цвета, довольно часто возникают на ладонных поверхностях кисти. Также в отдельные типы иногда выделяют сухожильные ксантомы и ксантелазмы – жировые отложения на веках.
Классификация такого состояния, как ксантоматоз неотрывно связана с разновидностями нарушений липидного обмена. От типа подобных расстройств зависит характер липидных образований на коже и в других тканях, возраст их развития, клиническое течение и ряд других факторов. Все причины гиперлипидемии, ведущей к ксантоматозу, делят на две группы – первичные и вторичные. Первичные, в свою очередь, подразделяются на пять разновидностей, которые характеризуются патологиями разных звеньев липидного обмена:
- Первый тип – в крови при этом наблюдается высокий уровень триглицеридов и хиломикронов. Ксантоматоз при этом состоянии представлен эруптивными ксантомами, которые могут распространяться по всему телу, но их преимущественная локализация – ягодицы и сгибательные поверхности локтей и коленей. Особенностью такой формы заболевания является самопроизвольное исчезновение липидных отложений на кожных покровах при снижении уровня триглицеридов. Ксантоматоз этого типа наиболее часто поражает детей.
- Второй тип гиперлипидемии диагностируется при одновременном повышении уровня липопротеидов очень низкой плотности и холестерола. Для этого ксантоматоза в основном характерны сухожильные ксантомы размером от нескольких миллиметров до 3-4 сантиметров, но возможны и плоские или туберозные кожные отложения липидов. Чаще всего этот типа заболевания поражает лиц старше 20 лет.
- Третий тип – при нем в крови наблюдаются аномальные формы липопротеидов (бета-липопротеиды) и высокий уровень триглицеридов и холестерола. Ксантоматоз при этой гиперлипопротеидемии характеризуется развитием плоских ксантом на ладонях и верхних конечностях, крайне редко бывают сухожильные и эруптивные скопления липидов. Может диагностироваться у лиц старше 30 лет.
- Четвертый тип гиперлипидемии характеризуется очень высоким уровнем триглицеридов и липопротеидов очень низкой плотности на фоне нормального содержания холестерола. При нем ксантоматоз развивается в виде эруптивных и туберозных ксантом различной локализации. Возраст манифестации кожных проявлений – 30-40 лет.
- Пятый тип диагностируется при высоком уровне хиломикронов и липопротеидов очень низкой плотности, а также высокой концентрации триглицеридов. Характерное для этого состояния клиническое течение ксантоматоза – многочисленные эруптивные ксантомы на фоне гепатоспленомегалии, пороков сердца и выраженного атеросклероза коронарных сосудов.
Таким образом, если причиной ксантоматоза выступают первичные формы гиперлипидемии, то по характеру высыпаний, возрасту больного и другим симптомам можно примерно определить ее тип. В отношении вторичных типов нарушения липидного обмена такой четкой взаимосвязи не выявляется. Течение ксантоматоза при этом зависит от тяжести расстройства метаболизма липидов и реактивности организма – возможно появление как одиночных ксантом небольшого размера, так и множественных отложений жироподобных веществ по всему телу диаметром до 3-4 сантиметров. В случае вторичного ксантоматоза к клинической картине заболевания всегда добавляются симптомы основной патологии, которая стала причиной сбоя обмена жиров (сахарный диабет, цирроз печени и другие).
Диагностика ксантоматоза
Обычно в дерматологии диагностика такого состояния, как ксантоматоз, не представляет особых трудностей. Для этого используют метод осмотра кожных покровов пациента, биохимический анализ крови или исследование липидограммы, в спорных случаях могут производить биопсию ксантом для гистологического изучения. При осмотре дерматологом выявляются различные по форме, размерам и локализации образования от желтого до коричневого цвета, которые могут быть окружены багрово-красной каймой или неизмененной кожей. Они безболезненны и не вызывают у пациента никакого беспокойства, за исключением эстетического дефекта. Нередко обращает на себя внимание ожирение пациента или, наоборот, его чрезмерная худоба (при сахарном диабете первого типа).
Липидограмма указывает на высокий уровень различных фракций липидов крови – липопротеидов очень низкой плотности, хиломикронов, холестерина или триглицеридов. Увеличивается значение индекса атерогенности, что указывает на преобладание вредных фракций липопротеидов в крови больного. Сочетание гиперлипидемии и наличия ксантом на коже уже достаточно четко свидетельствует в пользу ксантоматоза у пациента. При гистологическом изучении тканей в очагах поражения определяется большое количество пенистых клеток с их преимущественной локализацией вокруг кровеносных сосудов. При окраске суданом-3 клеточные включения в них становятся оранжевого цвета, что говорит об их липидной природе. Эпидермис в области развития скоплений жироподобных веществ при ксантоматозе мало изменен, иногда отмечается незначительный гиперкератоз.
Лечение и прогноз ксантоматоза
Общее лечение ксантоматоза сводится к снижению уровня липоидных компонентов в крови и нормализации обмена жиров. Для этой цели используют как диету с низким содержанием липидов, так и специальные противоатеросклеротические препараты – например, аторвастатин. В тех случаях, когда гиперлипидемия обусловлена другим заболеванием, необходимо начинать его лечение – например, устранять гипотиреоз, гепатит, контролировать сахарный диабет. В некоторых случаях, особенно при молодом возрасте пациента, и если ксантоматоз проявлялся эруптивными ксантомами, после нормализации уровня липидов в крови кожные проявления заболевания способны самостоятельно исчезать. В других случаях ксантомы необходимо убирать хирургическими методиками, криодеструкцией, лазерным прижиганием или электрокоагуляцией.
Прогноз ксантоматоза напрямую зависит от причин гиперлипидемии, так как некоторые ее формы способны проявляться не только кожными симптомами, но и пороками сердца, атеросклерозом коронарных и мозговых сосудов, гепатомегалией. Ксантомы сами по себе не представляют угрозы жизни пациента и могут создавать только косметические неудобства. Прогноз относительно выздоровления и полного устранения ксантоматоза в ряде случаев благоприятный – при поддержании оптимального уровня липидов в крови новые образования не появляются, а уже сформировавшиеся можно убрать косметологическими методами. Однако если по различным причинам снова будет иметь место гиперлипидемия, то возможен рецидив заболевания.
Факоматозы
Факоматозы — это группа прогрессирующих генетически детерминированных патологий, проявляющихся полиморфными симптомами с преимущественным поражением нервной системы, кожи, органа зрения и сопровождающихся появлением различных новообразований висцеральных органов. Диагностировать факоматоз возможно усилиями многих специалистов и только путем комплексного обследования пациента (МРТ, КТ, УЗИ, ЭКГ, ЭЭГ, офтальмоскопия и пр.). Лечение факоматоза симптоматическое: антиконвульсантное, нейрометаболическое, дегидратационное, психотерапевтическое, хирургическое. Прогноз зависит от формы и тяжести факоматоза.
МКБ-10
Отдельные клинические варианты факоматозов были описаны различными авторами в конце XIX столетия. Впервые объединить в одну группу заболевания с сочетанным поражением нервной системы, глаз и висцеральных органов, сопровождающиеся кожными проявлениями в виде гипо- и гиперпигментаций, нейрофибром и ангиом, предложил в 1923 году нидерландский офтальмолог Ван дер Хуве. Он же ввел определение «факоматоз».
В настоящее время термин «факоматоз» не является нозологической единицей и не может быть диагнозом, он лишь обозначает принадлежность заболевания к определенной группе патологий. К наиболее распространенным нозологиям этой группы относится нейрофиброматоз Реклингхаузена и туберозный склероз. Всего группа включает около 30 нейрокожных синдромов, в том числе синдром Луи-Бар, болезнь Гиппеля-Линдау, синдром Бонне-Дешома-Блана, синдром Стерджа-Вебера, ангиоматоз Ван-Богарта-Диври, гипомеланоз Ито, синдром недержания пигмента.
Причины факоматоза
Факоматоз — это генетическое заболевание, обусловленное нарушениями в процессах дифференцировки и развития клеток в раннем эмбриональном периоде. С развитием генетики и методов ДНК-анализа для некоторых заболеваний были установлены гены, аберрации в которых детерминируют данный факоматоз. Зачастую мутации приводят к снижению синтеза факторов, блокирующих онкогенез, что считают вероятной причиной множественного опухолевого роста, в большинстве случаев характеризующего факоматоз. Исследования показали, что факоматозы имеют в основном аутосомно-доминантное наследование с неполной пенетрантностью, благодаря которой болезнь проявляется не в каждом поколении.
Патогенез
Нарушения касаются преимущественно эктодермального зародышевого листка, который дает начало всей нервной ткани, наружным слоям кожных покровов, придаткам кожи (ногтям, волосам), сетчатке, эпителию слизистой рта и полости носа. Клетки, которые остались в фазе перманентной эмбрионизации, т. е. не продолжили свое развитие, образуют врожденные опухолевые образования — гамартомы. Эти эмбриональные опухоли различной локализации часто сопровождают любой факоматоз.
В связи с тем, что факоматоз детерминируется преимущественно сбоем в развитии эктодермальных структур, в литературе по генной патологии, педиатрии и неврологии он часто носит название нейроэктодермальная дисплазия. Однако нередким при факоматозе является сочетание эктодермальной дисплазии с нарушениями дифференцировки мезо- и энтодермального зародышевых листков. Проявлениями мезодермальной дисплазии служат аневризмы, ангиомы, рабдомиомы, лейомиомы, костнотканные пороки (например, дисплазия тазобедренного сустава). Наиболее распространенным клиническим симптомом энтодермальной дисплазии выступает полипоз различных отделов ЖКТ (полипы желудка, полипы кишечника, полипы прямой кишки).
Симптомы факоматоза
Типичной чертой факоматоза выступает сочетанное полиморфное поражение кожи, нервной системы и соматических органов. Причем одни клинические синдромы, чаще всего неврологические и дерматологические, являются врожденными или манифестируют в раннем детском возрасте, а другие — намного позже. В отдельных случаях факоматоз сочетается с врожденным иммунодефицитом, преждевременным старением и/или риском развития злокачественных образований.
Неврологические проявления
Морфология поражений нервной системы сводится к образованию в веществе и оболочках мозга туберов, кист, субэпендимальных узлов, нейрофибром, кальцификатов, участков глиоза, атрофии или демиелинизации; наличию врожденных аномалий питающих мозг сосудов (аневризм, АВМ, ангиом). Клинически наиболее часто наблюдается судорожный синдром, который может иметь различное течение и большую вариабельность пароксизмов. В раннем детстве зачастую отмечается синдром Веста, у детей постарше — синдром Леннокса-Гасто, генерализованные и парциальные сенсомоторные эпиприступы, абсансы.
Вследствие эпилепсии и поражения церебральных структур факоматоз зачастую сопровождается задержкой психического развития, нарушениями речи, олигофренией, анормальным поведением. Умственное недоразвитие варьирует от дебильности до идиотии, степень его выраженности прямо коррелирует с тяжестью и частотой эпиприступов. Часто наблюдаются нарушения со стороны черепно-мозговых нервов (глазодвигательные расстройства, нарушения слуха, лицевой парез и пр.), пирамидная недостаточность (чаще по гемитипу), экстрапирамидная симптоматика (атетоз, брадикинезия, гиперкинезы, тонические мышечные симптомы), мозжечковая атаксия, расстройства сна (сомнамбулизм, инсомния). Нарушения поведения носят вариативный характер: от СДВГ до аутизма.
Кожные проявления
Дерматологические изменения, сопровождающие факоматоз, обычно выявляются в первые несколько месяцев жизни. Они бывают единичные или диффузные, вариабельные по цвету и величине, как правило, асимметричные. Наиболее часто встречаются пигментные пятна, участки гипопигментации, дерматофибромы, нейрофибромы, папилломы, шагреневые бляшки, ангиомы.
Эндокринные расстройства
В ряде случаев факоматоз протекает с эндокринно-обменными расстройствами (несахарным диабетом, гипотиреозом, ожирением, задержкой или преждевременным половым созреванием) и нарушениями вегетативной сферы и трофики (ломкостью ногтей, сухостью кожи, выпадением волос).
Офтальмологические проявления
В некоторых вариантах факоматоз включает поражение органа зрения. Обычно офтальмологические проявления имеют врожденный характер или ранний дебют. Осмотр глазного дна в таких случаях может выявить ангиоматоз или гамартомы сетчатки, телеангиэктазии конъюнктивы. Возможно их инаппарантное течение или проявление в виде снижения остроты зрения.
Другие проявления
Сопутствующие факоматозу поражения соматических органов обусловлены преимущественно развивающимися в них новообразованиями. Последние обычно имеют доброкачественный характер, но склонны к рецидивированию и прогредиентному росту. Зачастую такими образованиями являются гамартомы. Кроме того, у имеющих факоматоз детей отмечается склонность к инфекционным заболеваниям, которые, в свою очередь, усугубляют течение основной патологии.
Диагностика
Широкая вариативность симптомов и их манифестация в различные возрастные периоды обуславливают те трудности, которые приходится преодолевать врачам, чтобы выявить и верифицировать факоматоз. Диагностический поиск осуществляется усилиями многих специалистов: невролога, педиатра, офтальмолога, дерматолога, кардиолога, нефролога, гастроэнтеролога, генетика, эндокринолога и др. При подозрении на факоматоз проводится биохимический анализ крови и мочи, генеалогическое исследование и ДНК-анализ, широкое инструментальное и нейропсихологическое обследование.
- Неврологическая диагностика.Электроэнцефалография позволяет установить характер эпиактивности головного мозга. Эхо-ЭГ выявляет признаки гидроцефалии. При помощи МРТ и КТ головного мозга визуализируются морфологические изменения церебральных тканей, при помощи ангиографии головного мозга или МРА — пороки церебральных сосудов.
- Офтальмологическая диагностика.Офтальмоскопия проводится в обязательном порядке, позволяет диагностировать поражение органа зрения даже в случае его субклинического течения.
- Исследование внутренних органов. Кардиологические исследования включают ЭКГ и УЗИ сердца, гастроэнтерологические — УЗИ брюшной полости, при необходимости рентгенографию желудка, рентгенконтрастное обследование тонкого и толстого кишечника. Исследование почек проводится при помощи УЗИ, урографии и КТ.
Лечение факоматоза
Медикаментозная терапия
На сегодняшний день ни один факоматоз не имеет специфического лечения. Проводится симптоматическая терапия. По показаниям применяется антиконвульсантное (вальпроаты, леветирацетам, карбамазепин, топирамат), дегидратирующее (ацетазоламид), нейрометаболическое (витамины группы В, глицин) лечение. Зачастую эпиприступы оказываются резистентными к проводимой противосудорожной терапии, в связи с чем приходится менять препарат или переходить на комбинированные схемы, включающие 2 антиконвульсанта. При наличии эписиндрома противопоказаны нейрометаболиты стимулирующего действия (к-та гамма-аминомасляная, пирацетам, пиритинол).
Хирургическое лечение
По показаниям проводится хирургическое лечение, целью которого является удаление возникшего новообразования. Вмешательства проводятся при подозрении на злокачественность опухоли, при нарастании обусловленных ею клинических проявлений, быстром росте образования, развитии компрессионного синдрома. Если речь идет о внутримозговых опухолях, то операцию проводят нейрохирурги. При опухолях соматических органов оперируют соответствующие специалисты.
Психологическая коррекция
Наряду с фармакотерапией в лечении факоматоза большую роль играет психокоррекция. Она направлена на развитие умственных и психических способностей ребенка, индивидуальную коррекцию имеющихся отклонений, обучение ребенка в доступном для него формате и его социальную адаптацию. В зависимости от вида и степени психических нарушений рекомендованы занятия с психологом, детская психотерапия, игровая терапия, АВА терапия, нейропсихологическая коррекция. Осуществляется психологическое консультирование родителей. Возможно комплексное психологическое сопровождение ребенка.
Прогноз и профилактика
В основном факоматозы относятся к прогностически неблагоприятным заболеваниям. Исход зависит от типа факоматоза, возраста, в котором он дебютировал, и тяжести патологии. Усугубить течение факоматоза может инфекционное заболевание или травма.
Прогностически неблагоприятными факторами выступают: ранняя манифестация, тяжелый эписиндром, глубокая олигофрения, развитие злокачественных новообразований. Гибель пациентов происходит при возникновении отека головного мозга, эпилептического статуса, раковой кахексии, сепсиса вследствие интеркуррентной инфекции.
Основным средством предупредить факоматоз является исключение возможности рождения больного ребенка. С этой целью проводится генетическое консультирование пар, планирующих беременность. Вероятность рождения ребенка с факоматозом является основанием для ограничения деторождения.
Клинические признаки ABCDE в диагностике диспластического невуса с признаками прогрессирования и начальной меланомы
В статье приведены наблюдения успешной диагностики диспластического невуса с признаками прогрессирования и «тонкой» меланомы на основании клинических признаков ABCDE. Авторы наблюдали 13 больных, обратившихся к онкологу с пигментными образованиями в 2015–
ABCDE clinical signs in diagnostics of dysplastic nevus with the signs of progression, and melanoma on the first stage
The article presents observations of successful diagnosis of dysplastic nevi with signs of progression and «thin» melanoma on the basis of ABCDE clinical signs. The authors observed 13 patients who visited oncologist with pigment formations in 2015–2016.
Меланома кожи — редкая, но опасная опухоль, которая происходит из меланоцитов, клеток базального слоя эпидермиса, синтезирующих пигмент меланин. Опухоль в большинстве случаев продолжает синтезировать пигмент, благодаря чему ее можно диагностировать визуально на ранней стадии заболевания. В России в отличие от других стран отмечается высокая смертность от меланомы. По данным МНИОИ им. П. А. Герцена заболеваемость меланомой в России в 2013 г. составила 6,25, смертность — 2,41 на 100 000 населения [1]. В Австралии, Новой Зеландии, США смертность составляет 10–20%. Причиной высокой смертности от меланомы в России является тот факт, что в нашей стране меланома диагностируется в поздней стадии заболевания, когда имеется изъязвление и кровотечение.
В настоящее время выделяют три основные формы меланомы кожи: лентиго-меланома, поверхностно-распространяющаяся и узловая меланома. Первые две формы проходят две фазы развития — фазу горизонтального роста и фазу вертикального роста. В фазе горизонтального роста меланома распространяется в пределах эпидермиса, лишь местами прорастая в дерму, и пока еще не способна давать лимфогенные и гематогенные метастазы. Пятилетняя выживаемость в этой фазе составляет 95–98%. В фазе вертикального роста, когда опухоль возвышается над поверхностью и прорастает в дерму, выживаемость снижается до 30–50%, так как больные погибают от гематогенных метастазов во внутренние органы. Основным фактором прогноза меланомы является толщина опухоли по Бреслоу, которая измеряется в миллиметрах при гистологическом исследовании. «Тонкие» меланомы (толщина опухоли по Бреслоу менее 1 мм) имеют хороший прогноз — 95% пятилетней выживаемости. При толщине опухоли 2–4 мм — пятилетняя выживаемость составляет 63–79%, при меланоме толщиной 4 мм и более — 45%.
Меланома может возникать как на неизмененной коже, так и из диспластического невуса. Диспластический невус был впервые описан W. H. Clark с соавт. [2]. Авторы выявили пигментные образования, которые характеризовались пролиферативной активностью эпидермальных меланоцитов с нарастанием их атипии: неправильно ориентацией, плеоморфизмом, гиперхромными ядрами, изредка фигурами митозов, сегрегацией, склонностью к проникновению как в вышележащие слои эпидермиса, так и в дерму; в последней имелись меланофоры, выраженная лимфоидно-плазмоклеточная инфильтрация, ангиоматоз и нежная фиброплазия. Позже эту картину D. E. Elder с соавт. назвали лентигинозной меланоцитарной дисплазией (ЛМД), так как подобная картина имеет место при простом лентиго [3]. Гольберт с соавт. выделила 3 степени развития ЛМД и показала, что 3-я степень ЛМД приближается к картине меланомы in-situ [4].
Мы наблюдали два типа диспластических невусов [5, 6, 8]. Невусы первого типа обычно наследственные, появляются в детстве или в подростковом возрасте и представляют собой крупные плоские меланоцитарные образования от 0,5 до 1,5 см в диаметре, коричневого, рыжеватого или розового цвета [2, 7]. Феномен множественных диспластических невусов под названием В-К-моль-синдром описали W. H. Clark с соавт. у двух больных меланомой кожи [2]. Позже синдром наследственных родинок при наличии меланомы у родственников получил название FAMM-синдром (Familial Atypical Mole and Melanoma). При наличии этого синдрома риск возникновения меланомы кожи резко возрастает, что хорошо иллюстрировано в литературе [7].
Диспластические невусы второго типа появляются в конце полового созревания и в дальнейшей жизни. Они представляют собой множественные мелкие меланоцитарные образования 0,1–0,4 см в диаметре, однородной окраски коричневого цвета [5–8]. Появление невусов второго типа связано с ультрафиолетовым облучением в детстве или подростковом возрасте в результате частого пребывания на солнце или в солярии. Большинство невусов второго типа располагается на открытых солнцу областях (наружная поверхность верхних конечностей, верхняя часть спины и грудной стенки) и нередко сочетаются с множественными веснушками. Больные с диспластическими невусами как первого, так и второго типа должны быть под наблюдением онколога или дерматолога и осматриваться врачом 1 раз в год.
При гистологическом исследовании диспластических невусов отечественные патоморфологи выделяют три степени ЛМД [4, 7] независимо от того, имеется ЛМД в сочетании с невусными клетками, расположенными внутридермально (смешанный диспластический невус) или при отсутствии невусных клеток в дерме (лентигинозный невус). Определение степени дисплазии невуса очень важно для клинициста, поскольку риск малигнизации возрастает от 1-й к 3-й степени [4, 7]. В последнее время зарубежные авторы также стали выделять высокую и низкую степень дисплазии невуса.
По размерам диспластические невусы подразделяются на малые — до 0,3 см в диаметре, средние — 0,4–0,8 см и крупные — 0,9 см в диаметре и более [7]. Удаление всех диспластических невусов не целесообразно, поскольку они являются доброкачественными образованиями. Опасность представляют диспластические невусы с признаками прогрессирования, т. е. невусы с лентигинозной меланоцитарной дисплазией 2–3 степени, которые имеют высокий риск трансформации в меланому. Наши предыдущие исследования показали, что невусы с признаками прогрессирования можно диагностировать по клиническим признакам ABCDE, которые характерны и для меланомы в фазе горизонтального роста: А (asymmetry) — неправильная форма, В (border) — неровные, волнистые края, С (color) — неравномерная окраска с присутствием коричневых, темно-коричневых или черных тонов, D (diameter) — размеры более 0,4 см, E (evolving) — эволюция, т. е. изменения очага [5, 6, 8]. Чем более выражены клинические признаки ABCDE, тем выше степень дисплазии, определяемая при гистологическом исследовании, вплоть до перехода в меланому in situ [5, 6, 8]. Особое значение имеет признак Е — изменения невуса, которые наблюдаются на протяжении последних 5 лет. Изменения невуса, замеченные в последние 6–12 месяцев, или появление невуса на чистой коже и дальнейший рост его на протяжении 6–12 месяцев характерны для дисплазии 3-й степени или начальной меланомы [5, 6, 8].
В ЗАО «Центральная поликлиника Литфонда» мы с 2009 г. производим эксцизионную биопсию диспластических невусов с клиническими признаками прогрессирования [5, 6, 8]. Иссечение невусов проводим под местной анестезией, иссекая лоскут с подкожной клетчаткой, отступая от видимых границ образования 0,5–1,0 см. Зарубежные клиницисты производят биопсию невуса с отступлением от границ 2–3 мм, при выявлении меланомы они производят реоперацию [9]. Мы отступаем от границ невуса 0,5 см, чтобы избежать повторной операции при выявлении меланомы in situ. При наличии выраженных клинических симптомов ABCDE отступаем от границ 1,0 см, чтобы избежать реоперации при обнаружении «тонкой» меланомы. Согласно рекомендациям ВОЗ при наличии меланомы in situ отступление от границ образования при биопсии должно составлять 0,5 см, а при наличии «тонкой» меланомы — 1,0 см [10]. Перед операцией мы предупреждаем больных, что при необходимости может быть произведена повторная операция — иссечение послеоперационного рубца.
Дерматоскопия применялась нами как вспомогательный метод и подтверждала клинический диагноз. Необходимо отметить, что мы удаляли средние диспластические невусы, в которых клинические симптомы ABCDE были хорошо выражены. Что касается мелких образований — менее 0,4 см, то роль дерматоскопии при принятии решения о биопсии диспластического невуса будет возрастать.
Материалы и методы исследования
С января 2015 г. по апрель 2016 г. в ОАО «Центральная поликлиника Литфонда» произведена эксцизионная биопсия 13 пигментных образованиий с клиническим диагнозом «диспластический невус с признаками прогрессирования». Женщин было 11, мужчин — 2. В возрасте 21–30 лет было 6 больных, 31–40 — 4, 51–60 — 3. Возраст больных обусловлен контингентом, который обслуживается поликлиникой, — в основном это молодые, работающие пациенты. Локализация пигментных образований была различной: брюшная стенка — 4, грудная стенка — 2, поясничная область — 1, ягодичная — 1, верхняя конечность — 4, бедро — 1. У 12 больных имелись пигментные образования средних размеров: от 0,4 до 0,9 см, у одного — более 1,0 см. Неправильная форма образования отмечена у 6 больных, волнистые края — у 7, неравномерная окраска — у 8. У двух больных невус имел правильную округлую форму, ровные края, в этих случаях поводом для иссечения невуса послужило появление его на неизмененной коже (в одном случае 10 месяцев назад, в другом 2 года назад) и увеличение образования от 0,2 до 0,5 см в диаметре в одном случае и до 0,7 см в диаметре в другом.
Результаты исследования
Из 13 удаленных образований в 7 случаях выявлен диспластический невус с признаками прогрессирования: ЛМД 2-й степени — 5 случаев, ЛМД 3-й степени — 2 случая. ЛМД без признаков прогрессирования выявлен в одном случае, внутридермальный невус также в одном случае. В 4 случаях выявлена меланома: в одном — меланома in situ на фоне диспластического невуса, в 3 — «тонкая» меланома (толщина по Бреслоу менее 1,0 мм, уровень инвазии по Кларку — 2 и 3).
Приводим выписки из истории болезни.
Больная К., 22 лет, обратилась к онкологу 23.03.2015 по поводу «родинки» на правой ягодице, которая появилась 6 месяцев назад в виде «точки», постепенно увеличивалась. При осмотре: в правой ягодичной области имеется диспластический невус темно-коричневого, почти черного цвета, 0,4 × 0,3 см, неправильной формы, с неровными границами (рис. 1). Клинический диагноз «диспластический невус с признаками прогрессирования». Образование иссечено под местной анестезией, отступя от видимых границ 1,0 см. Гистологическое исследование — смешанный пигментный невус с ЛМД 2-й степени.
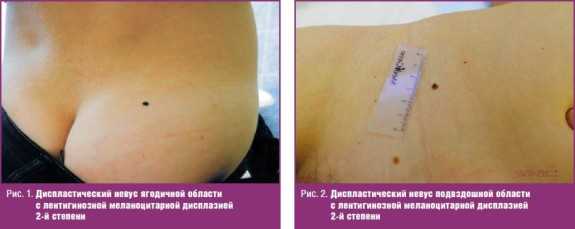
Больная П., 39 лет, обратилась к онкологу 10.04.2015 по поводу «родинки» в правой подвздошной области, которая существует много лет, а в последние 2 года во время беременности стала увеличиваться в размерах, потемнела. При осмотре: в правой подвздошной области имеется диспластический невус в виде пятна 0,5 см в диаметре, темно-коричневого цвета с примесью черного, с неровными границами (рис. 2). Клинический диагноз «диспластический невус с признаками прогрессирования». Образование иссечено под местной анестезией, отступя от границ 1,0 см. Гистологическое исследование — смешанный невус с ЛМД 2-й степени.
Больная К., 51 год, обратилась к онкологу 23.05.2015 по поводу пигментного образования на грудной стенке, которое в последние годы стало увеличиваться, менять очертания. При осмотре: на грудной стенке справа имеется слегка возвышающееся пигментное образование 0,9 × 0,8 см, неправильной формы, с неровными границами, неравномерной окраски коричневых и черных тонов (рис. 3). Клинический диагноз «диспластический невус с признаками прогрессирования». Образование иссечено под местной анестезией, отступя от видимых границ 1,0 см. Гистологическое исследование — смешанный пигментный невус с ЛМД 2–3 степени.
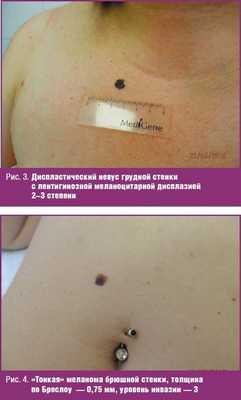
Больная Ш., 28 лет, обратилась к онкологу 11.09.2015 по поводу «родинки» на брюшной стенке, которая появилась 8 лет назад, была маленькой, а в последний год стала увеличиваться, темнеть, менять очертания. При осмотре: на брюшной стенке, справа от пупка, имеется пигментное пятно 0,8 × 0,8 см, слегка возвышающееся, неправильной формы, с волнистыми краями, неравномерной окраски — темно-коричневой в центре, светло-коричневой по периферии (рис. 4). Клинический диагноз «диспластический невус с признаками прогрессирования». Образование иссечено под местной анестезей, отступя от границ 1,0 см, с подкожной клетчаткой. Гистологическое исследование — эпителиоклеточная лентиго-меланома, 3-й уровень инвазии по Кларку, толщина по Бреслоу — 0,75 мм.
Больная Н., 23 лет, обратилась к онкологу 27.11.2015 по поводу «родинки» на правой кисти, которая появилась 10 месяцев назад, медленно увеличивалась. При осмотре: на тыльной поверхности правой кисти имеется слегка возвышающийся невус правильной округлой формы, 0,5 см в диаметре, коричневого цвета, более темный в центре (рис. 5). При дерматоскопии — пигментная сеть, пигментные глобулы. Клинический диагноз «диспластический невус с признаками прогрессирования». Образование удалено под местной анестезией, отступя от видимых границ 0,5 см. Гистологическое исследование — смешанный пигментный невус с ЛМД 3-й степени.
Больная К., 39 лет, обратилась к онкологу 26.07.2015 по поводу множественных «родинок» на теле. При осмотре: в поясничной области слева имеется диспластичекий невус коричневого цвета, равномерной окраски, 0,6 × 0,4 см. На туловище и конечностях — множественные диспластические невусы 0,1–0,3 см в диаметре, коричневого цвета, равномерной окраски. Диагноз «диспластический невус поясничной области». Рекомендовано динамическое наблюдение, повторный осмотр через 6 месяцев. При осмотре 18.12.2015 — невус в поясничной области увеличился, его размеры составляли 0,8 × 0,5 см, окраска не изменилась. Клинический диагноз «диспластический невус с признаками прогрессирования». Невус иссечен под местной анестезией, отступя от границ 0,5 см, с подкожной клетчаткой. Гистологическое исследование — эпителиоидно-клеточная пигментная лентиго-меланома in situ на фоне диспластического смешанного невуса, удалена в пределах здоровых тканей.
Больной Б., 55 лет, обратился к онкологу 26.02.2016 по поводу «родинки» на левом плече, которая появилась 10 лет назад, в последний месяц стала меняться. При осмотре: в области левого плеча имеется пигментный невус 1,2 × 0,8 см, с четкими неровными контурами, неравномерной окраски — от светло-коричневого до темно-коричневого, почти черного цвета. Клинический диагноз «диспластический невус с признаками дисплазии 2–3 степени, не исключена малигнизация». Произведено иссечение невуса под местной анестезией 2% — 2,0 лидокаина, отступя от краев образования 1,2 см. Гистологическое исследование — эпителиоидно-клеточная неизъязвленная меланома, 2-й уровень инвазии по Кларку, толщина по Бреслоу — менее 0,75 мм, с очагами самопроизвольной резорбции, выраженной лимфоидно-плазмоклеточной инфильтрацией.
Больная З., 29 лет, обратилась к онкологу 15.04.2016 по поводу «родинки» на левом бедре, которая появилась 2 года назад, первоначально имела размеры 0,2 см в диаметре, постепенно увеличивалась, ничем не беспокоила. При осмотре — в средней трети левого бедра на передней поверхности имеется пигментное образование 0,7 см в диаметре, округлой формы, с ровными краями, слегка возвышающееся, коричневого цвета, более темное в центре (рис. 6). При дерматоскопии — пигментные глобулы. Клинический диагноз «диспластический невус с признаками прогрессирования». Под местной анестезией раствором лидокаина 1% — 10,0 образование иссечено, отступя от видимых границ 1,2 см. Гистологическое исследование — пигментная неизъязвленная лентиго-меланома толщиной по Бреслоу менее 1,0 мм, уровень инвазии — 3.
Таким образом, наш опыт показывает, что при наличии среднего или крупного пигментного образования клинические признаки ABCDE дают достаточно оснований для диагностики диспластического невуса с признаками прогрессирования и выполнения эксцизионной биопсии. При биопсии необходимо отступить от видимых границ невуса не менее 0,5 см, так как диспластический невус с ЛМД 2–3 степени и меланома in situ имеют схожую клиническую картину. При наличии выраженных клинических признаках ABCDE, когда можно заподозрить малигнизацию, следует отступать от границ невуса 1,0 см. В наших наблюдениях реоперация ни в одном случае не понадобилась, так как меланома in situ была иссечена, отступя от границ образования 0,5 см, а «тонкая» меланома — 1,0 и 1,2 см.
Выводы
- Клинические признаки ABCDE при наличии пигментного образования 0,4 см и более дают достаточно оснований для диагностики диспластического невуса с признаками прогрессирования и выполнения эксцизионной биопсии.
- Эксцизионную биопсию невуса следует производить, отступя от видимых границ 0,5 см, а при наличии выраженных клинических признаков ABCDE — 1,0 см, чтобы избежать повторной операции при выявлении начальной меланомы.
Литература
- Каприн А. Д., Старинский В. В., Петрова Г. В. Злокачественные новообразования в России в 2013 году (заболеваемость и смертность). М., 2015.
- Clark W. H., Reimer R. R., Greene M., Ainsworth A. M., Mastrangelo M. J. Origin of Familial Malignant Melanomas from Heritable Melanocytic Lesions. The B-K mole Syndrom // Archives of Dermatology. 1978. Vol. 114, № 5, 732–739.
- Elder D. E., Leonardi J., Goldman J., Goldman S. C., Greene M. H., Clark W. H. Displastic Nevus Syndrome. A Pfenotypic Assotiation of Sporadic Cutaneous Melanoma // Cancer. 1980, № 8.
- Гольберт З. В., Червонная Л. В., Клепиков В. А., Романова О. А. Лентигинозная меланоцитарная дисплазия как предшественник развития злокачественной меланомы // Архив патологии. 1982, 12, 36–41.
- Романова О. А., Артемьева Н. Г. Хирургическая профилактика меланомы кожи // Онкохирургия. 2013, № 3, с. 12–18.
- Романова О. А., Артемьева Н. Г., Ягубова Э. А., Марычева И. М., Рудакова В. Н., Вещевайлов А. А. Тактика ведения пациента с диспластическм невусом // Клиническая дерматология и венерология. 2015, № 2, т. 14, 92–97.
- Червонная Л. В. Пигментные опухоли кожи. М., 2016.
- Романова О. А., Артемьева Н. Г., Ягубова Э. А., Марычева И. М., Рудакова В. Н., Вещевайлов А. А. Принципы эксцизионной биопсии диспластического невуса в амбулаторных условиях // Онкология. 2016, № 1, т. 5, 36–41.
- Smith M. A. Диспластический невус. Дерматология. Атлас-справочник практикующего врача. Пер. с англ. 2012. С. 288–291.
- Richard P., Usatine M. Меланома. Дерматология. Атлас-справочник практикующего врача. Пер. с англ. 2012. С. 324–335.
О. А. Романова 1 , кандидат медицинских наук
Н. Г. Артемьева, кандидат медицинских наук
М. Г. Солохина
Читайте также:
- Повреждения связочного аппарата позвоночника. Переломы отростков позвонков
- Признаки дизентерии. Клиника дизентерии. Клинические проявления дизентерии. Ректальный плевок.
- Неонатальный гепатит - клиника, диагностика
- Переломы костей предплюсны. Переломы фаланг пальцев стопы
- Рентгенограмма, КТ, МРТ при плазмоцитоме
