Пионефроз на УЗИ. УЗИ диагностика анальгетической нефропатии.
Добавил пользователь Дмитрий К. Обновлено: 30.01.2026
Гидронефроз на УЗИ. УЗИ диагностика нарушения проходимости мочеточника.
Клинические проявления: возможна болезненность в боку, медленно прогрессирующее нарушение функции почки.
Диагностика:
• Анамнез: расспросите пациента о наличии сопутствующих заболеваний, которые могут сопровождаться нарушением оттока мочи, дисфункцией или атонией мочевого пузыря.
• Ультразвуковое исследование.
Ультразвуковые данные:
• Переполненный мочевой пузырь у пациентов с дисфункцией мочевого пузыря.
• Нарушение проходимости мочеточника.
• Может определяться препятствие для оттока мочи из мочеточника (камень внутри просвета мочеточника или сдавливание снаружи опухолью/метастазом или лимфатическим узлом).
• Расширение чашечно-лоханочной системы.
• Смещение почечного синуса.
• Истончение паренхимы почки.
Точность ультразвуковой диагностики: ультразвуковое исследование позволяет обнаруживать обструкцию с достоверностью, достигающей 98%, однако точную причину обструкции не всегда удается установить.
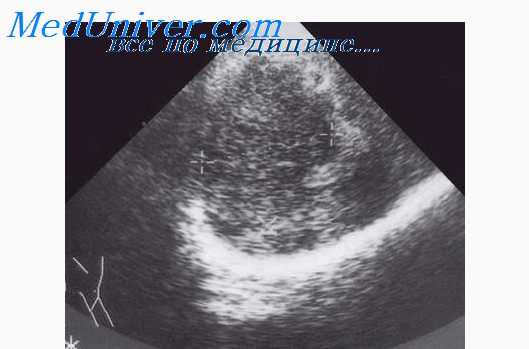
УЗИ диагностика нарушения проходимости мочеточника.
Клинические проявления: коликообразные боли в боку, олиго- или анурия. При перемежающейся обструкции может возникать периодическая полиурия. При длительной обструкции и рефлюксе происходит атрофия почечной паренхимы, что приводит к почечной недостаточности и задержке в организме растворимых веществ.
Диагностика:
• Лабораторные исследования: развернутый общий анализ крови, определение содержания в крови креатинина, электролитов, мочевины и мочевой кислоты.
• Анализ мочи: бактериурия, лейкоцитурия (в случае присоединения инфекции), гематурия (при наличии камня или опухоли), кристаллурия.
• Ультразвуковое исследование.
• Комплекс диагностических мероприятий может включать ВПГ и КТ. Внимание: при почечной недостаточности ВПГ следует использовать с осторожностью. Ультразвуковые данные:
• Расширение мочеточника или нарушение его проходимости.
• Возможно расширение чашечно-лоханочной системы.
• В зависимости от выраженности изменений степень обструкции может быть ранжирована.
• Закупорка просвета мочеточника камнем, гноем, сгустком крови или опухолью.
• Сдавливание извне за счет опухоли, метастаза, забрюшинного фиброза (болезнь Ормонда) или злокачественной лимфомы.
• Пустой мочевой пузырь будет определяться лишь при двусторонней обструкции.
Точность ультразвуковой диагностики: в случаях, когда нарушение проходимости мочеточника сопровождается расширением собирательной системы почки (данное обстоятельство необходимо для развития почечной недостаточности), точность ультразвуковой диагностики очень высока (почти 100%). Причина обструкции часто остается неизвестной. В связи с ретроперитоне-альным расположением мочеточника его визуализация затруднена и его ход может быть прослежен лишь при расширении мочеточника. При подозрении на высокую обструкцию мочеточника и невозможности выявить причину последней при ультразвуковом исследовании состояние может быть ошибочно принято за фибролипоматоз или мелкую околотазовую кисту.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Пионефроз на УЗИ. УЗИ диагностика анальгетической нефропатии.
Клинические проявления: в течение длительного времени отмечаются сонливость, инфекции мочевых путей, лихорадка. Системные проявления обычно имеют крайне тяжелую степень, вплоть до сепсиса.
Диагностика:
• Лабораторные исследования: биохимический анализ крови, СОЭ; бактериологическое исследование мочевого осадка; выявление возбудителя и определение его чувствительности к антибиотикам.
• Ультразвуковое исследование.
• Аспирация и дренирование гноя под контролем ультразвука; абсолютно показано при нарушении оттока мочи.
Ультразвуковые данные:
• Расширение собирательной системы почки.
• Иногда внутренние эхо-сигналы высокой интенсивности, указывающие на гной или детрит.
Точность ультразвуковой диагностики: ультразвуковое исследование позволяет предположить правильный диагноз, для подтверждения которого проводится чрескожная аспирационная биопсия. Ответ на терапевтические мероприятия и последующий ультразвуковой контроль также подтверждают диагноз.
Анальгетическая нефропатия
Клинические проявления: разнообразные жалобы, включая боль, психические расстройства, возможные коликообразные боли в животе (вследствие прохождения верхушек некротизированных сосочков) и дизурию. Медленно прогрессирующая почечная недостаточность обычно помогает установить верный диагноз. Патогенез: аналгезирующие вещества нарушают кровоток в почках.
Диагностика:
• Анамнез: большинство пациентов не упоминают об интенсивном использовании анальгетиков, отчасти из-за того, что не придают этому большого значения. Следует внимательно опрашивать пациентов.
• Анализ мочи: легкая протеинурия, микрогематурия, стерильная лейкоцитурия. Потеря солей более 30 ммоль/сут. при бессолевой диете, ацидоз почечных канальцев. В моче определяются метаболиты фенацетина (парацетамол, N-ацетил-бета-аминофенол).
• Анализ крови: повышение уровня креатинина, анемия (также вследствие желудочно-кишечных кровотечений).
• Ультразвуковое исследование: также может использоваться для определения направления при чрескожной биопсии.
• Следует исключить диабетическую нефропатию, серповидно-клеточную анемию, туберкулез почки и острый пиелонефрит
Ультразвуковые данные:
• Размытость контуров почки.
• Неравномерное повышение эхогенности паренхимы.
• Кольцевидные кальцинаты на кончиках сосочков.
• Вторичные кисты.
На заметку: изменения начинаются в верхушках сосочков и распространяются по направлению к кортикальному слою. Некроз верхушек сосочков также может возникать при хроническом пиелонефрите, сахарном диабете, серповидно-клеточной анемии и обструктивной уропатии.
Точность ультразвуковой диагностики: при обнаружении некроза верхушек сосочков при ультразвуковом исследовании вероятность наличия анальгетической нефропатии очень высока. Факт злоупотребления анальгетиками в анамнезе подтверждает диагноз.
Анальгетическая нефропатия ( Анальгетический интерстициальный нефрит )
Анальгетическая нефропатия – это поражение почек тубулоинтерстициального характера, обусловленное длительным приемом нестероидных противовоспалительных средств (главным образом на основе фенацетина, в меньшей степени – ибупрофена, индометацина, метамизола натрия, ацетилсалициловой кислоты). Характеризуется медленно прогрессирующей почечной недостаточностью на фоне поражения иных органов, вызванного побочными действиями НПВС – болями в желудке, слабостью, головокружениями, болями в области поясницы и правом подреберье. Диагностика основывается на лабораторном и инструментальном исследовании почек (анализы мочи, УЗИ, КТ). Лечение сводится к прекращению приема анальгетиков и симптоматической терапии.
МКБ-10
Общие сведения
Анальгетическая нефропатия, или анальгетический интерстициальный нефрит (АИН), является неблагоприятным последствием приема обезболивающих препаратов из группы противовоспалительных средств. Ранее считалось, что таким серьезным побочным эффектом обладает только фенацетин (фенацетиновая нефропатия), однако позже было установлено, что менее активно поражение выделительной системы могут провоцировать и другие анальгетики схожей химической структуры. Распространенность патологии зависит от популярности обезболивающих средств – в основном она встречается в странах Скандинавии, Западной Европы, США, Австралии (в последней доля АИН достигает 20% от всех нефропатий). Женщины в среднем болеют в 6-8 раз чаще мужчин – это обусловлено более частым потреблением анальгетиков представительницами женского пола (в период менструаций, мигреней).
Причины
Главной причиной развития анальгетической нефропатии в современной урологии считается длительный прием лекарственных препаратов, содержащих противовоспалительные средства нестероидного характера. На примере фенацетина доказано, что потребление порядка 1 грамма вещества в сутки на протяжении 1-3 лет практически гарантированно приводит к поражению выделительной системы. Имеются указания, что комплексные препараты, содержащие несколько типов НПВС или их сочетание с кофеином и кодеином, способны еще быстрее вызывать нарушение функции почек. Предполагаются следующие причины нефротоксического воздействия анальгетических средств:
- Прямое нефротоксическое действие. Препараты изменяют процессы метаболизма в тканях мозгового слоя почек и влияют на характер микроциркуляции в данных органах. Это приводит к атрофии одних нефронов с компенсаторной гипертрофией других. На сегодняшний момент прямое воздействие НПВС считается ведущим механизмом развития анальгетической нефропатии.
- Системное воздействие. Злоупотребление противовоспалительными средствами приводит к нарушениям со стороны системы крови (анемия), желудочно-кишечного тракта (язвы желудка и двенадцатиперстной кишки), печени (анальгетический гепатит). Эти заболевания могут увеличивать нагрузку на выделительную систему и ускорять развитие патологии почек.
- Иные факторы. Установлена различная скорость развития проявлений нефропатии у разных больных при потреблении схожих доз НПВС. Кроме того, некоторые специалисты утверждают, что более частое выявление состояния у женщин нельзя объяснить лишь постоянным приемом анальгетиков, что говорит о влиянии полового фактора. Несмотря на аналогичное по уровню потребление обезболивающих, в северо-восточных регионах США и Канаде АИН встречается намного реже, чем в других регионах со сходным уровнем жизни населения.
Преобладает точка зрения, что анальгетическая нефропатия является мультифакторным состоянием, в развитии которого использование собственно НПВС играет главную, но далеко не единственную роль. Пока неизвестна степень в лияния возраста человека, использования иных лекарственных средств, климатических и географических факторов. Но большинство ученых не сомневаются, что эти обстоятельства способны существенно менять продолжительность развития и выраженность симптомов при АИН.
Патогенез
Наиболее изучен патогенез прямого нефротоксического воздействия фенацетина и сходных с ним препаратов. Являясь ингибитором фермента циклооксигеназа-2 (ЦОГ-2), он изменяет процессы обмена веществ в клетках эпителия канальцев и интерстициальной ткани почек, что приводит к уменьшению образования простагландинов и целого ряда иных биологически активных веществ. Ацетилсалициловая кислота в составе комплексных обезболивающих и жаропонижающих средств может ускорять возникновение анальгетической нефропатии. Это обусловлено ее способностью разобщать процессы окислительного фосфорилирования в митохондриях клеток канальцев, что усугубляет патологию еще и дефицитом энергии.
Снижение количества простагландинов в интерстициальной ткани приводит к ишемическим явлениям – недостаточному кровоснабжению глубоких слоев мозгового вещества почек. Происходит некроз и обызвествление сосочков с гибелью и слущиванием эпителия петель Генле. В конечном итоге это ведет к отмиранию отдельных нефронов и гиалинозу их клубочков. Перечисленные процессы усугубляются влиянием системных факторов – анемией, поражением ЖКТ, печени, нарушением обмена веществ. Длительность развития нефропатии зависит от огромного количества обстоятельств – дозировки НПВС, питьевого режима, характера питания и ряда других.
Классификация
Не существует разделения анальгетической нефропатии по такому признаку, как использование какого-либо конкретного лекарственного средства. Современная классификация построена на клинических стадиях патологического состояния, так как оно имеет прогрессирующий характер (при продолжении использования противовоспалительных препаратов). Длительность каждой стадии различается у разных пациентов, зависит от типа и дозировки анальгетического средства, сопутствующих заболеваний и иных факторов. В большинстве случаев в течении АИН определяются следующие этапы:
- Стадия компенсации. Продолжается от начала приема НПВС до появления первых лабораторных признаков поражения почек. В этот период повреждение нефронов полностью компенсируется, никаких признаков нефротоксического действия не наблюдается, продолжительность этапа колеблется от нескольких месяцев до 2-3 лет. Некоторые исследователи отрицают необходимость выделения этого этапа патологии.
- Стадия поражения почек. Характеризуется первыми изменениями мочи, выявляемыми посредством лабораторных анализов. Возникает через несколько месяцев или лет с начала употребления анальгетиков, каких-либо субъективных симптомов или жалоб со стороны выделительной системы не наблюдается. Часто регистрируются другие признаки злоупотребления обезболивающими средствами: анемия, боли в желудке, язвы двенадцатиперстной кишки, ранний атеросклероз.
- Стадия почечной недостаточности. Развивается через 7-15 лет после начала регулярного приема нестероидных анальгетиков. Проявления типичны для хронической почечной недостаточности: бледность кожных покровов, слабость, расстройства диуреза (никтурия, олигурия), головные боли. Для анальгетической нефропатии характерно медленное прогрессирование ХПН, поэтому продолжительность данной стадии может составлять много лет.
- Стадия добавочной инфекции. Возникает при присоединении бактериальной инфекции мочевыделительных путей и почек на фоне хронической почечной недостаточности. Клинически характеризуется сильной лихорадкой, болями в пояснице, бурым цветом мочи. Инфекция имеет рецидивирующий характер, через 2-3 года после первого приступа выявляется тотальная почечная недостаточность.
По поводу последнего этапа патологии в научной среде существуют разногласия – одни считают добавочную инфекцию закономерным и почти неизбежным итогом развития АИН, тогда как другие воспринимают ее как осложнение нефропатии. На данный момент не существует достоверных и общепризнанных подтверждений правоты сторонников первого или второго мнения.
Симптомы анальгетической нефропатии
Длительное время клинические проявления отсутствуют – на стадии поражения почек изменения выявляются только при лабораторном исследовании мочи. На этом этапе более показательны экстраренальные симптомы злоупотребления НПВС: боли в животе, слабость, бледность кожи и сердцебиение вследствие анемии. Собственно почечные признаки патологии начинают проявляться в начале стадии недостаточности – возникают нарушения диуреза (полиурия, никтурия), слабость мышц или судороги, обусловленные электролитными нарушениями. Симптоматика прогрессирует, на терминальных этапах развивается метаболический ацидоз и остеодистрофия.
У трети больных манифестация нефропатии сопровождается резким повышением температуры, появлением видимой крови в моче (макрогематурия), гипертоническими кризами, почечными коликами с признаками преходящей острой почечной недостаточности. Почечные нарушения сочетаются с воспалениями суставов в результате отложений кристаллов мочевой кислоты – мелкие сочленения пальцев ног и рук деформируются, становятся болезненными, кожа над ними краснеет. Часто наблюдается присоединение вторичной инфекции, возникают пиелонефриты, циститы и другие поражения мочевыделительных путей. Патологию утяжеляет развитие мочекаменной болезни вследствие гиперуратемии.
Осложнения
Наиболее частым осложнением анальгетической нефропатии является присоединение бактериальной инфекции с тяжелой лихорадкой, гематурией, пиелонефритом. Некоторые исследователи считают этот процесс одним из вариантов исхода заболевания. Другим серьезным отдаленным последствием патологии является переходноклеточный рак лоханки почки – риск развития этого онкологического заболевания у людей, злоупотребляющих анальгетиками, в 20 раз выше, чем в популяции.
На фоне бесконтрольного приема НПВС возможно образование тяжелых язв желудка, двенадцатиперстной кишки с кровотечением. Страдает сердечно-сосудистая система, поскольку обезболивающие средства способны вызывать атеросклероз, а нефропатия провоцирует повышение давления крови. Это повышает риск инфарктов и инсультов в дальнейшем.
Диагностика
Доказать наличие анальгетической нефропатии можно только при тесной кооперации врача-нефролога и пациента – последний должен честно сообщать специалисту о причинах, сроках употребления и примерной дозировке принимаемых противовоспалительных препаратов. Используют также ряд лабораторных и инструментальных методов исследования для оценки степени повреждения почек, наличия или отсутствия иных нарушений, вызванных НПВС. Алгоритм диагностики включает следующие этапы:
- Сбор анамнеза жизни больного. Особое внимание уделяется количеству принимаемых анальгетических препаратов и причинам их использования. Заподозрить наличие патологии можно в случае многолетнего систематического приема НПВС.
- Лабораторные исследования. Общий анализ мочи на латентной стадии выявляет микрогематурию, абактериальную лейкоцитурию и незначительное (до 1 г/сут) выделение с мочой белка – увеличение последнего показателя служит плохим прогностическим признаком. Анализ крови обнаруживает анемию, причем ее степень превышает уровень поражения почек, что характерно для данной нефропатии.
- Функциональные пробы. Ранним функциональным признаком патологии является снижение плотности мочи и изменения диуреза – гипостенурия и никтурия. Проба Реберга выявляет снижение скорости клубочковой фильтрации, степень снижения зависит от выраженности поражения почечной ткани.
- Ультразвуковое исследование. На УЗИ почек в стадиях поражения или недостаточности заметно уменьшение размеров органа и уплотнение мозгового слоя, определяются обызвествленные сосочки у лоханки. Допплерография (УЗДГ сосудов почек) подтверждает снижение активности кровотока. На конечных этапах в лоханке или мочеточниках могут определяться конкременты.
- Рентгеноконтрастные исследования.Урография обнаруживает уменьшение фильтрационной способности выделительной системы, деформирование чашечек, кольцевидные тени в лоханках (некротизированные сосочки, окруженные контрастом). Назначать экскреторную урографию при анальгетической нефропатии следует с осторожностью, учитывая функциональные возможности почек и степень их поражения.
Дифференциальный диагноз проводят с другими типами нефропатий. Определяющим фактором в пользу анальгетической формы будет длительное многолетнее злоупотребление НПВС.
Лечение анальгетической нефропатии
Лечение заключается в полной отмене приема любых нестероидных противовоспалительных препаратов – на первоначальных этапах поражения почек этого может быть достаточно для восстановления работы выделительной системы. При наличии сопутствующих нарушений проводят симптоматическую терапию, чаще всего включающую в себя следующие компоненты:
- Устранение гипертензии. Для снижения артериального давления используют ингибиторы АПФ, бета-адреноблокаторы, блокаторы рецепторов к ангиотензину 2.
- Устранение анемических проявлений. Малокровие при данной патологии имеет железодефицитный характер, поэтому для восстановления нормальной картины крови используют препараты железа и минерально-витаминные комплексы.
- Коррекция электролитного баланса. Потеря электролитов с мочой сильно осложняет течение нефропатии. Для коррекции баланса ионов применяют инфузионную терапию, после которой рекомендуют поддерживать оптимальный водный режим.
- Выведение продуктов обмена. В далеко зашедших стадиях заболевания с развитием ХПН для снижения нагрузки на почки показано применение гемодиализа.
По показаниям проводят терапию заболеваний других органов, вызванных длительным систематическим приемом НПВС – желудка, сердца, печени. Тактику лечения определяют с учетом выявленных патологических изменений.
Прогноз и профилактика
При выявлении анальгетической нефропатии на этапе бессимптомного периода прогноз патологии однозначно благоприятный – простой отмены противовоспалительных препаратов будет достаточно для улучшения состояния почек. При возникновении признаков ХПН или добавочной инфекции прогноз несколько ухудшается, однако при правильно построенной терапии и грамотной коррекции выживаемость больных очень высока. После постановки диагноза следует регулярно обследоваться у врача-нефролога на предмет развития отдаленных осложнений – в первую очередь рака почки. Раннее выявление злокачественного процесса обеспечивает более высокую эффективность его лечения.
1. Анальгетическая нефропатия. Современный взгляд на проблему/ Поселюгина О.Б.// Кубанский научный медицинский вестник. - 2019.
Почечный папиллярный некроз ( Некроз почечных сосочков , Некротический папиллит )
Почечный папиллярный некроз — это разрушение сосочков почек, обусловленное ишемией мальпигиевых пирамид. Проявляется эпизодами почечных колик, тянущими болями в пояснице, гематурией, отхождением некротизированных сосочков. Диагностируется с помощью общего и бактериологического анализа мочи, экскреторной урографии, уретеропиелоскопии. Для лечения назначают антибактериальную терапию, периферические вазодилататоры, антикоагулянты, антиагреганты, мембраностабилизаторы, антиоксиданты, гемостатики, венотоники. При необходимости выполняют катетеризацию и стентирование мочеточника, лоханок, декапсуляцию почки, нефростомию, частичную и тотальную нефрэктомию.
Заболевание впервые было описано в 1877 году немецким терапевтом и патологом Николаусом Фридрейхом. Папиллярный почечный некроз (некротический папиллит, некроз почечных сосочков), по разным данным, диагностируется у 0,3-1% пациентов урологических и нефрологических стационаров. У страдающих пиелонефритом распространенность патологии достигает 3%.
Женщины заболевают вдвое чаще мужчин. В половине случаев папиллярный некроз возникает в 30-40-летнем возрасте. У 75% пациентов некротический папиллит развивается хронически с постепенным прогредиентным нарастанием почечной дисфункции. В 58% случаев воспалительно-деструктивный процесс является двухсторонним. По результатам наблюдений, ишемическая деструкция верхней части мальпигиевых пирамид ассоциирована с сахарным диабетом и серповидно-клеточной анемией, однако в последние годы все чаще возникает при других патологических состояниях.
Некротический папиллит является полиэтиологическим заболеванием, развивающимся на фоне других патологических состояний или приема нефротоксичных веществ. Предпосылкой к возникновению некроза считаются особенности анатомического строения медуллярного вещества – гипоксии почечных сосочков способствует сочетание относительно бедной васкуляризации анатомической структуры и высокого осмотического давления в данной зоне. Специалистами в сфере современной урологии и нефрологии установлено несколько групп причин, вызывающих папиллярную деструкцию:
- Нарушение кровоснабжения мозгового вещества. Недостаточное поступление крови к сосочковому аппарату наблюдается при изменениях сосудистой стенки у пациентов с атеросклерозом, сахарным диабетом, васкулитами. Ишемию папиллярных структур провоцируют заболевания, при которых возможен тромбоз почечных микрососудов, чаще всего некротическим папиллитом осложняется серповидно-клеточная анемия, реже — коагулопатии, ДВС-синдром и другие гиперкоагуляционные состояния.
- Повышение внутрилоханочного давления. При обструкции мочевыводящих путей нарушается отток мочи с ее накоплением в лоханочной системе. Возникающий пиелоренальный рефлюкс способствует обсеменению почечных сосочков бактериями, которые содержатся в урине, и началу воспалительной реакции. В большинстве случаев лоханочная гипертензия формируется при обтурации мочеточника камнем, новообразованием, случайной перевязке во время операции, наличии уретеровагинального свища.
- Гнойные заболевания почек. Вторичное воспаление верхушек почечных пирамид осложняет течение тяжелых гнойно-деструктивных процессов. Массивное размножение инфекционных патогенов, выделяющих протеолитические экзотоксины, способствует образованию гнойных инфильтратов и расплавлению паренхимы почек, вовлечению в процесс деструкции сосочков. Папиллярный некроз может развиться на фоне пиелонефрита, апостематозного нефрита, пионефроза, почечного карбункула, абсцесса.
- Лекарственная нефропатия. Длительный неконтролируемый прием некоторых безрецептурных анальгетиков и антипиретиков приводит к нарушению медуллярного кровотока, ухудшению перфузии коркового и мозгового слоя и развитию анальгетической нефропатии. В наиболее тяжелых случаях на фоне выраженных изменений прямых сосудов, питающих почечные сосочки, возникает их грубая ишемическая деструкция. НПВС также оказывают прямой токсический эффект на мозговое вещество почек, что усугубляет папиллярные некротические процессы.
Существует три основных патогенетических механизма развития почечного папиллярного некроза — ангиопатический, вазокомпрессионный, инфекционный, которые зачастую сочетаются между собой, приводя к ишемическому инфаркту мозгового слоя с его последующим гнойным расплавлением и отторжением некротизированных масс. Уменьшение просвета сосочковых артериол вследствие утолщения интимы, уплотнения стенки, сдавления гнойными очагами или инфильтрированным мочой интерстицием, полная обтурация их просвета тромбами способствуют возникновению ишемии и деструкции тканей.
Ситуация усугубляется сужением диаметра сосудов, кровоснабжающих сосочки, по направлению к вершине, что повышает вязкость поступающей крови. Дополнительным фактором, усиливающим ишемические процессы при обструкции мочевыделительных органов, становятся воспаление и венозная гиперемия жировой клетчатки, в которую проникает моча. Ишемизированный сосочек может подвергаться полной или частичной деструкции с повреждением отдельных участков по центру или периферии. В тяжелых случаях некротизируется вся мальпигиева пирамида, при множественной локализации — медуллярный слой пораженной почки на всем протяжении. При присоединении инфекции некротический процесс осложняется воспалительной реакцией.
Систематизация форм папиллярного некроза учитывает механизм и динамику развития заболевания, выраженность клинической симптоматики. Специалисты-нефрологи различают первичный некротический папиллит, возникающий в результате нарушения кровоснабжения без предшествующей инфекционно-воспалительной патологии, и вторичный, обусловленный ишемией мозгового вещества на фоне воспалительно-склеротических изменения паренхимы и почечного синуса.
При изначальном поражении сосочка говорят о папиллярной форме деструкции, при первичном формировании очаговых инфарктов во внутренней мозговой зоне с последующим вовлечением верхушек мальпигиевых пирамид — о медуллярной. С учетом особенностей течения выделяют:
- Острый папиллярный некроз. Заболевание отличается бурной клинической картиной, выраженной интоксикацией, неоднозначным прогнозом. Острое течение более характерно для папиллитов, осложнивших пиелонефрит, другие гнойные нефрологические заболевания, нефролитиаз.
- Хронический папиллярный некроз. Обычно симптомы выражены слабо, неспецифичны. Возможно рецидивирующее течение. Зачастую хронический папиллит выявляется при ангиопатиях, серповидно-клеточной анемии и диагностируется только после тщательного обследования пациента.
Симптомы почечного папиллярного некроза
Клиническая картина заболевания характеризуется разнообразием признаков, большинство из которых являются неспецифичными. Часто при папиллярном некрозе встречается почечная колика вследствие отделения некротизированного сосочка, которая может сопровождаться тошнотой, рвотой, задержкой стула. Типичны постоянные тянущие боли в поясничной области, выделение крови с мочой.
У пациентов наблюдается интоксикационный синдром различной степени выраженности: субфебрильная или фебрильная лихорадка, ознобы, головная боль, повышенная потливость, слабость. Патогномоничный признак некротического папиллита, обнаруживающийся только на поздней стадии болезни, — выделение с мочой омертвевших участков почечной паренхимы в виде сероватых масс с включениями солей извести. При хроническом течении могут преобладать лабораторные симптомы при маловыраженной или отсутствующей клинической симптоматике.
В случае присоединения бактериальной инфекции возникает апостематозный пиелонефрит, проявляющийся образованием небольших гнойников в корковом слое почки. При обширном поражении выявляется клиническая картина острой почечной недостаточности – олигурия или анурия, повышение уровня мочевины и креатинина плазмы, нарушение сознания вследствие азотемии.
Хроническое течение некротического папиллита зачастую приводит к ХПН, которая осложняется развитием декомпенсированного метаболического ацидоза и полиорганной недостаточности. В 40% случаев у пациентов диагностируется почечнокаменная болезнь с высоким риском образования коралловидных камней. Массивный папиллярный некроз часто сопровождается профузными кровотечениями, которые представляют опасность для жизни больного и требуют неотложной помощи.
Из-за полиморфности клинической картины и отсутствия патогномоничных признаков на ранних стадиях заболевания постановка диагноза зачастую затруднена. Сложности в диагностике также обусловлены скрытым развитием почечного папиллярного некроза на фоне другой патологии мочевыделительной системы (пиелонефрита, нефролитиаза). План обследования пациента с подозрением на некротический папиллит включает следующие лабораторные и инструментальные методы:
- Клинический анализ мочи. Для папиллярного некроза характерны микро- и макрогематурия, лейкоцитурия, бактериурия, появление клеток Штернгеймера-Мальбина. На поздних стадиях обнаруживаются некротические массы в виде кусочков ткани серого цвета продолговатой или треугольной формы. Метод дополняют бактериологическим исследованием мочи с определением чувствительности флоры.
- Внутривенная урография. На снимках полученных при экскреторной урографии, просматриваются смазанные очертания зоны форникса, мелкие тени кальцификатов, кольцевидная тень в просвете почечной лоханки, форникально-медуллярные свищи. При полном отторжении сосочка на рентгенограмме выявляется дефект наполнения. Характерный признак тотального некроза – затекание контраста в паренхиму почек (симптом «пламени костра»).
- Уретеропиелоскопия. Для проведения нефроскопии используют гибкий эндоскоп, который вводят ретроградно (через уретру) или антеградно (через брюшную стенку), что позволяет оценить состояние мочеточников и чашечно-лоханочной системы почек. При папиллите наблюдаются множественные деструкции почечных сосочков, что нередко сопровождается кровотечением из форникальной зоны.
В клиническом анализе крови при папиллярном почечном некрозе определяются признаки бактериального воспаления: нейтрофильный лейкоцитоз с повышением числа палочкоядерных клеток, увеличение СОЭ. Для комплексной оценки состояния мочевыделительной системы выполняют УЗИ и КТ почек и других органов забрюшинного пространства. Эти методы менее информативны в диагностике некроза почечных сосочков, но позволяют выявить сопутствующие патологические состояния — мочекаменную болезнь, пиелонефрит.
Дифференциальная диагностика некротического папиллита проводится с острым и хроническим пиелонефритом, туберкулезом почек, нефролитиазом, аномалиями развития (медуллярной гипоплазией, почечной дисплазией, тубуломедуллярной дилатацией), гидронефрозом, лоханочно-почечным рефлюксом, злокачественными новообразованиями. Кроме наблюдения уролога или нефролога пациенту может потребоваться консультация онколога, инфекциониста, эндокринолога, гематолога.
Лечение почечного папиллярного некроза
Выбор врачебной тактики определяется причинами возникновения и особенностями течения некротического папиллита. По возможности лечение должно быть этиопатогенетическим, направленным на коррекцию первичного расстройства, которое осложнилось папиллярным некрозом, восстановление нормальной гемоперфузии почечной паренхимы, борьбу с уроинфекцией. При остром течении важную роль играет купирование возникших симптомов — почечной колики, окклюзии лоханок и мочеточника некротическими массами, кровотечения из поврежденных сосочков.
Комбинированная терапия острого папиллярного почечного некроза предусматривает стандартную схему лечения основного заболевания, на фоне которого развился папиллит, в сочетании с такими медикаментозными средствами и инвазивными методами, как:
- Антибактериальные препараты. Антибиотикотерапия по возможности назначается с учетом чувствительности возбудителя, вызвавшего воспалительный процесс. Наиболее эффективным является применение уроантисептиков без нефротоксического действия — фторхинолонов, нитрофуранов, цефалоспоринов, фосфомицинов, макролидов, производных налидиксовой и пипемидиновой кислот.
- Средства для улучшения почечной гемодинамики. При выборе медикамента учитывают причины ишемии. В качестве базовых рекомендованы периферические вазодилататоры, которые при необходимости дополняют прямыми антикоагулянтами, антиагрегантами. Вспомогательными препаратами являются антиоксиданты и мембраностабилизаторы, повышающие ишемическую стойкость папиллярных структур.
- Гемостатическая терапия. Средства для остановки кровотечения показаны при преобладании в клинической картине признаков выраженной и массивной гематурии. Обычно применяются свежезамороженная или антигемофильная плазма, препараты аминокапроновой кислоты, ингибиторы фибринолиза, аналоги этамзилата. Использование гемостатиков ограничено при папиллярных некрозах, вызванных тромбозами.
- Удаление некротических масс. Если отторгающаяся ткань сосочков вызывает окклюзию почечных лоханок и мочеточников, производится их катетеризация. Последующее стентирование мочеточника позволяет уменьшить лоханочную гипертензию и обеспечить нормальный пассаж мочи. Некротические массы также могут удаляться ходе уретероскопии, ретроградной или чрескожной нефроскопии (пиелоскопии).
При нарастании симптоматики на фоне проводимой консервативной терапии, возникновении терапевтически резистентного острого пиелонефрита, длящегося более 2-3 дней, некупируемой профузной гематурии рекомендовано оперативное лечение. При двухстороннем некротическом процессе предпочтительны органосохраняющие вмешательства — нефростомия, декапсуляция почки, резекция (частичная нефрэктомия) для удаления участка с кровоточащими папиллярными структурами. Радикальная нефрэктомия выполняется только при одностороннем папиллите с тотальным необратимым некрозом медуллярного слоя и достаточной функциональностью контрлатеральной почки.
При ранней диагностике и проведении патогенетической терапии возможна регенерация эпителия с восстановлением всех функций почек. Прогноз при некрозе почечных сосочков относительно благоприятный. Благодаря использованию современных антибактериальных препаратов летальность при остром некротическом папиллите удалось сократить с 50% до 10%.
Профилактика папиллярного некроза заключается в своевременном лечении инфекционных процессов мочевыделительной системы, нефролитиаза, системных васкулитов, токсических поражений почек, обоснованном назначении НПВС. Важное звено в предупреждении заболевания — диспансерное наблюдение за пациентами из группы риска с тщательным медикаментозным контролем сахарного диабета, серповидно-клеточной формы анемии.
1. Инфекции мочевыводящих путей у больных сахарным диабетом/ Е.В. Хайкина, Г.К. Решедько, М.В. Морозов// Клиническая микробиология антимикробная химиотерапия. - 2008 - Т.10, №3.
2. Острый папиллярный некроз почек у девочки 5 лет/Т.А. Романова, И.Г. Винжего, А.П. Ничипоренко и др.// Научные ведомости БелГУ. Сер. Медицина. - 2004.
3. Лекарственные поражения почек/ С.С. Постников, А.Н. Грацианская, М.Н. Костылева// Детская нефроурология. - 2016.
Пионефроз ( Гнойная почка )
Пионефроз — это гнойно-деструктивное заболевание почек, представляющее собой некроз почечной ткани на завершающей стадии острого воспалительного процесса мочевыводящих путей. Проявляется постоянной ноющей болью в области поясницы, повышенной температурой тела, выраженными симптомами общей интоксикации. При открытой форме пионефроза выделяется мутная моча с примесью гноя. Диагностика проводится с помощью физикальных методов, лабораторных тестов (общего анализа и посева мочи), инструментальных исследований (УЗИ и КТ почек, урографии, нефросцинтиграфии). Основной метод лечения ‒ хирургический, с полным удалением пораженной почки (нефрэктомией).
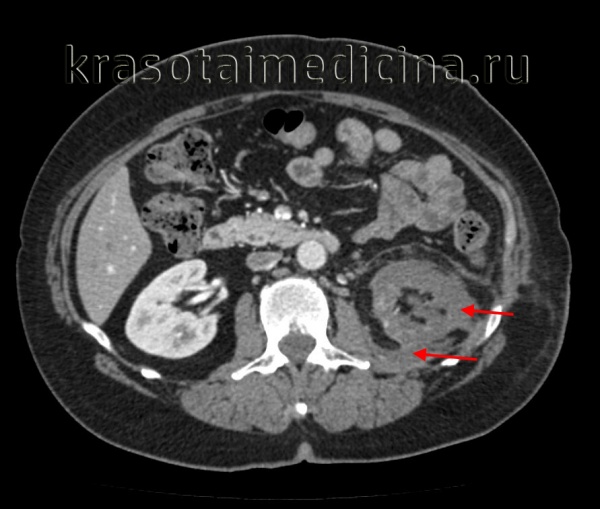
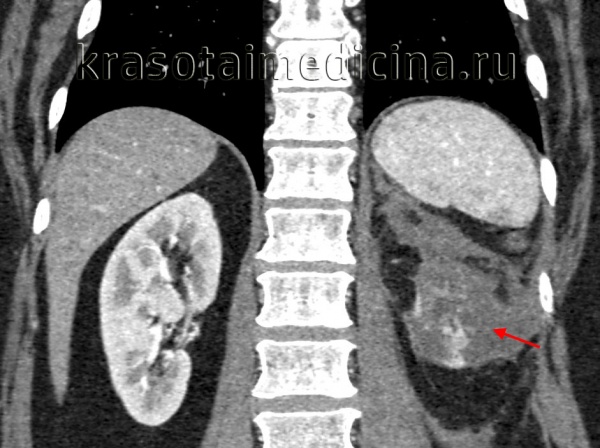
Пионефроз, или гнойная почка, — серьезная проблема современной урологии, связанная с высоким процентом инвалидизации (70%) и летального исхода (до 28%). Частота встречаемости пионефроза в России составляет 200 тыс. случаев в год или 2 больных на 100 тыс. населения, однако последние пять лет наблюдается рост заболеваемости. Пионефроз осложняет воспалительные заболевания почек в 20% случаев, имеет положительную корреляцию с полом и возрастом пациентов.
Женская выделительная система анатомически более предрасположена к инфекционным заболеваниям, поэтому пионефроз у женщин встречается в 5 раз чаще. У пациентов мужского пола патология развивается в основном в возрасте старше 40 лет на фоне простатита и хронического цистита.
Причины пионефроза
Главный этиологический фактор — условно-патогенная или патогенная микрофлора, вызывающая воспаление, а затем нагноение, повреждающее фильтрационный аппарат почек. Основные возбудители — стафилококк, стрептококк, микобактерии туберкулеза. На фоне иммунодефицита или неадекватной терапии инфекционных заболеваний мочевыделительной системы пионефроз быстро прогрессирует с образованием полостей, заполненных гноем, первичной мочой, продуктами некроза тканей. По данным клинических наблюдений, основными причинами гнойной почки являются:
- Инфекции мочевыводящей системы. Пионефроз завершает течение пиелонефрита, туберкулезного поражения почек, восходящего уретрита, цистита. Причинами прогрессирования гнойного процесса могут быть выбор неверной тактики антибактериальной терапии или неточное соблюдение пациентом врачебных назначений.
- Катетеризация мочевого пузыря. Инфекционный процесс часто манифестирует после использования нестерильного урологического катетера, особенно жесткого, или вследствие нарушения правил его постановки с повреждением стенок мочевыделительных путей.
- Аномалии мочеполовой системы. Удвоение почки и мочеточников, формирование подковообразной почки или ее опущение нарушают физиологическую динамику движения мочи. Застойные процессы — благоприятная среда для развития инфекции.
- Мочекаменная болезнь. Формирование камней в почечных лоханках или мочеточниках создает преграду для нормального прохождения мочи. Мочекаменная болезнь ухудшает уро- и гемодинамику, что осложняет местный иммунитет, увеличивает риск инфицирования.
Инфекционный агент вызывает развитие воспалительного процесса в почечной ткани. Усиливается приток крови, повышается проницаемость почечных сосудов, формируется отек. Появляются гнойные полости в паренхиме. Дальнейшее развитие воспаления приводит к формированию рубцов, расширению лоханок, нарушению притока крови и оттока постоянно продуцирующейся мочи, что ухудшает течение болезни. При пионефрозе почка доступна для пальпации, бугристая, увеличенная в размерах.
Если на данном этапе проводится хирургическое удаление органа, то на разрезе обнаруживаются полости с толстыми стенками, заполненные густым, зловонным гноем. Иногда в процессе течения пионефроза собственная ткань почки замещается плотной жировой. Жировая дистрофия — реакция нефральных структур на ухудшение кровоснабжения и кислородное голодание тканей. Пионефроз чаще развивается как односторонний процесс, но при выраженном иммунодефиците может носить двусторонний характер.
Симптомы пионефроза
Клинические симптомы зависят от проходимости мочевыделительных путей. Наслаивание симптомов пионефроза на проявления основного заболевания представляет дополнительную диагностическую сложность. Общее состояние больных в первые 24 часа заболевания удовлетворительное. Отмечается постоянная боль в пояснице средней интенсивности с иррадиацией во внутреннюю часть бедра или половые органы. Температура тела нормальная или повышена до 37-38°С.
При развитии нагноения наступает острая фаза заболевания с усилением боли, изменением ее характера на приступообразный. Температура тела повышается до 40-41°С, появляются симптомы общей интоксикации: озноб, головная боль, слабость, рефлекторная тошнота и рвота. При двустороннем характере процесса развиваются симптомы почечной недостаточности и общего истощения организма. Снижаются функции иммунной системы, что часто приводит к присоединению вторичной инфекции — гриппа, пневмонии, стоматита.
Основной симптом открытой формы пионефроза — выделение мутной мочи, содержащей продукты распада и воспаления тканей (пиурия). Содержание гноя на общий объем мочи может достигать 10%. Степень пиурии и клиническая симптоматика зависят от формы пионефроза. При закрытом характере течения боли в поясничной области большей интенсивности, иногда по типу почечной колики. Моча прозрачная, но при переходе закрытой формы в открытую становится мутной. Вскрытие капсулы гнойного фокуса приводит к улучшению самочувствия, снижению температуры тела. Открытая форма, при которой в течение всего заболевания сохраняется нормальный отток гноя, лихорадка и общая интоксикация организма выражены слабее или вовсе отсутствуют.
Поздняя диагностика или отсутствие полноценной терапии гнойного процесса приводят к необратимым изменениям почечной ткани, повышая риск смертельно опасных осложнений. Односторонний пионефроз характеризуется повышенной нагрузкой на здоровую почку с постепенным нарушением метаболических процессов. Формируется амилоидоз почек с внутриклеточным накоплением особого белково-углеводного комплекса, что ведет к почечной недостаточности. К осложнениям также приводит формирование большого очага, повреждение капсулы которого с прорывом гноя в брюшную полость и забрюшинное пространство ведет к потенциально летальным состояниям: паранефриту, перитониту, сепсису.
При возникновении признаков заболевания необходимо обратиться к хирургу или урологу для прохождения обследования. Физикальная диагностика пионефроза складывается из сбора жалоб, проведения пальпации почек и мочевого пузыря. При нагноении орган болезненен, увеличен в размерах, имеет неоднородную поверхность и ограниченную подвижность в забрюшинном пространстве.

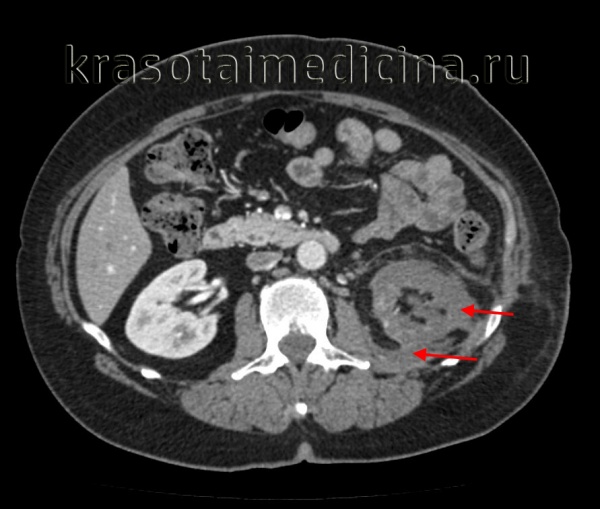
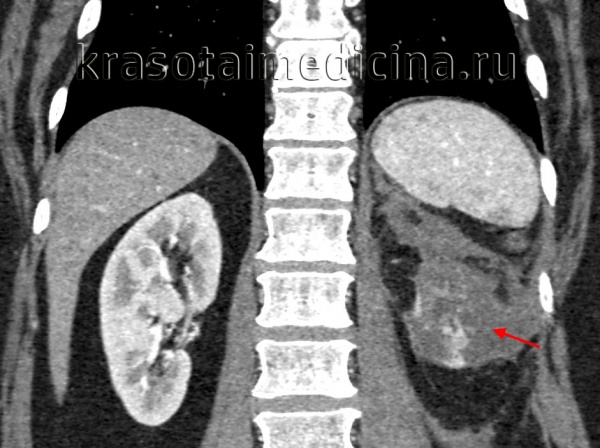
КТ ОБП/ЗП. Гнойное расплавление левой почки с формированием «мешка», заполненного гноем, с воспалительными изменениями прилежащей клетчатки.
Из методов диагностики используются:
- Общий анализ мочи. С помощью исследования диагностируется воспалительный процесс в почках, признаками которого является мутность мочи со значительным осадком, большое содержание лейкоцитов, выраженная протеинурия, бактериурия, специфические белковые цилиндры, слизь.
- Общий анализ крови. Показывает наличие воспаления и активацию иммунитета в организме, для которых характерны высокий уровень лейкоцитов, увеличенная скорость оседания эритроцитов.
- Биохимический анализ крови. Выявляет повышенный уровень мочевины, креатинина, электролитов — индикаторов снижения способности почек фильтровать кровь от токсинов.
- Посев мочи. Исследование позволяет идентифицировать микроорганизм, вызвавший инфекцию. При выборе схемы лечения это помогает назначить адекватную антибактериальную терапию, направленную на конкретного возбудителя.
- Рентгенодиагностика. При обзорной урографии на рентгенограмме видна тень увеличенной почки с четкими контурами. Часто обнаруживаются камни в почечной лоханке или мочеточнике, создающие механическую преграду для оттока гноя. Дополнительно используется ангиография почечных сосудов, оценивающая уровень кровоснабжения органа. КТ почек также определяет очаг, но позволяет отличить полость, заполненную гноем, от опухоли или кисты.
- УЗИ почек. Помогает локализовать воспалительный очаг, определить его форму, оценить качество уродинамики в лоханках и мочеточниках.
- Радиоизотопная ренография.Нефросцинтиграфия, назначается для оценки функции почек и степени почечной недостаточности.

Лечение пионефроза
Лечение патологии оперативное — нефрэктомия или нефроуретерэктомия, если нагноение возникло из-за сужения просвета нижнего отдела мочеточника. Способствует скорейшему заживлению, уменьшению риска осложнений удаление не только самой почки, но и околопочечной жировой клетчатки. В тяжелых случаях ткань органа и гнойные очаги удаляются малоинвазивными способами внутри капсулы. Подготовка к плановой нефрэктомии проходит в течение 1-1,5 недель в условиях стационара. Необходима комплексная оценка состояния пациента, консультации терапевта, нефролога, кардиолога, анестезиолога.
Больным с напряженной закрытой формой пионефроза проводится экстренное оперативное вмешательство для предупреждения развития перитонита и сепсиса. У пациентов с тяжелыми сопутствующими заболеваниями, нарушением работы второй здоровой почки или двусторонним пионефрозом первый этап операции заключается в наложении нефростомы, позволяющей дренировать гнойный очаг. Дополнительно назначается интенсивная антибактериальная, детоксикационная терапия, выполняется плазмаферез. При стабилизации состояния становится возможна радикальная операция.
После грамотно проведенного радикального оперативного вмешательства и при правильном поведении пациента прогноз благоприятный, риск развития осложнений сводится к минимуму. Назначается пожизненная диета, сокращается прием жидкости до 1,5 литров в сутки, ограничиваются физические, эмоциональные нагрузки. Диспансерное наблюдение включает контроль за функцией оставшейся почки, регулярные анализы мочи и крови. При двусторонней нефрэктомии необходимо прохождение гемодиализа в течение всей жизни либо трансплантация почки.
Профилактика пионефроза направлена на предупреждение развития воспалительных заболеваний мочеполовой системы: следует избегать переохлаждения, вовремя и в полном объеме лечить возникшие очаги инфекции в организме. Адекватная терапия строится на применении антибактериальных препаратов узкого спектра после лабораторного определения конкретного возбудителя.
4. Диагностика и лечение острого гнойного пиелонефрита: Автореферат диссертации/ Донсков В.В. – 2004.
Читайте также:
- Запасание аминокислот. Физиология белков плазмы крови
- Сироп ипекуаны (рвотного корня) для вызывания рвоты и очищения желудка при отравлении
- Выраженная артериальная гипертензия. Лечение артериальной гипертензии.
- Клиника и проявления ГЛПС. Диагностика ГЛПС
- Диагностика перимезенцефального субарахноидального кровоизлияния на КТ, МРТ
