Показания к аутологичной трансплантации гемопоэтических стволовых клеток (ауто-ТГСК)
Добавил пользователь Валентин П. Обновлено: 29.01.2026
Отделение химиотерапии и трансплантации стволовых клеток при онкологических и аутоиммунных заболеваниях
Контактная информация:
Телефон: 338 69 76
Адрес: Санкт-Петербург, ул. Льва Толстого, 17, корпус 54, 5 этаж НИИ нефрологи
О нас в СМИ
Мы специализируемся на лечении аутоимммунных и онкологических заболеваний, имеем многолетний опыт работы в составе многопрофильного станционара.
Специалисты отделения проводят диагностику и лечение следующих заболеваний:
- Неврологические заболевания
- Рассеянный склероз
- Оптиконейромиелит (болезнь Девика)
- Хроническая воспалительная демиелинизирующая полиневропатия (ХВДП)
- Системная красная волчанка (СКВ)
- Воспалительные миопатии (полимиозит/дерматомиозит)
- Системная склеродермия (СС)
- Болезнь Шегрена
- болезнь Крона легкой и среднетяжелой активности
Блок специализируется на проведении:
- высокодозной иммуносупрессивной терапии с последующей аутологичной трансплантацией гемопоэтических стволовых клеток. ВИСТ-АТГСК является высокоэффективным и достаточно безопасным методом лечения аутоиммунных заболеваний. В исследованиях показано сокращение почти на 90% частоты обострений по сравнению с дотрансплантационным периодом. Безрецидивное течение пациентов после ВИСТ-АТГСК на сегодняшний день в отдельных случаях достигает 20 лет, а суммарная эффективность при всех подтипах рассеянного склероза оценивается в 75-95%. Срок лечения в среднем составляет 30 суток.
- полихимиотерапии различной степени интенсивности. При проведении ПХТ (например, R-CHOP, CHOEP, ABVD, BEACOPPesc) 1 линии срок пребывания в стационаре в среднем составляет 1-5 дней, при использовании интенсивных режимов ПХТ (ICE, DHAP, IGEV) срок лечения может занимать 10-14 суток.
- таргетной терапии (моноклональные антитела, ингибиторы тирозинкиназы и контрольных точек) при онкологических и аутоиммунных заболеваниях. Данная процедура может проводиться в рамках дневного стационара; срок лечения при этом может составлять 1-3 дня.
- вспомогательной терапии при онкологических заболеваниях, включающей трансфузии эритроцитарной взвеси и тромбоконцентрата для последующего безопасного проведения химиоиммунотерапии. Срок проведения 1-2 дня.
В составе отделения находятся специалисты с опытом проведения аллогенных ТГСК при онкологических и гематологических заболеваниях, аутологичных ТГСК при аутоиммунных, неврологических заболеваниях, в том числе, повторных трансплантаций, а также проведения таргетной терапии с последующим динамическим наблюдением, профилактикой и лечением осложнений проведения высокотехнологичной помощи особым категориям пациентов.Специалисты отделения:
Полушин Алексей Юрьевич
Руководитель блока химиотерапии и ТСК при онкологических и аутоиммунных заболеваниях, к.м.н.
Область научных интересов: неврологические осложнения после аллогенной ТГСК и применения checkpoint-ингибиторов контрольных иммунных точек при злокачественных гематологических заболеваниях; отдаленные последствия аутологичной трансплантации при АИЗ; эффективность режимов кондиционирования ВИСТ при рассеянном склерозе и других аутоиммунных заболеваниях; проблема рецидива после всех видов терапии рассеянного склероза. Фармакологическое и немедикаментозное ведение пациентов после ВИСТ-АТГСК.
Залялов Юрий Ринатович
Заведующий блоком химиотерапии и ТСК при онкологических и аутоиммунных заболеваниях им. акад. И.П.Павлова, к.м.н.
Окончил Луганский государственный медицинский университет в 2002 г. В 2004 г. окончил ординатуру по терапии и ревматологии на кафедре терапии №1 им. Э.Э. Эйхвальда СПб МАПО. После аспирантуры (2004-2007 г.) на кафедре гематологии, трансфузиологии и трансплантологии ПСПбГМУ им. акад. И.П. Павлова защитил диссертацию на соискание ученой степени к.м.н. на тему: «Роль АТГ в повышении эффективности аллогенных трансплантаций гемопоэтических стволовых клеток». С 2007 г. работает врачом-гематологом в НИИ ДОГиТ им. Р.М.Горбачевой. С 2016 г. по 2020 г. руководил отделением онкологии №2 (химиотерапии и трансплантации костного мозга) НИИ ДОГиТ им. Р.М.Горбачевой.
Область научных интересов: иммунологические механизмы патогенеза аутоиммунных заболеваний, изучение механизмов «пластичности» различных субпопуляций лимфоцитов, таргетная терапия при различных онкологических, онкогематологических и аутоиммунных заболеваниях.
Цынченко Александр Александрович
Врач-гематолог блока химиотерапии и ТСК при онкологических и аутоиммунных заболеваниях.
В 2018 г. окончил Первый Санкт-Петербургский Государственный Медицинский Университет им. акад. И.П. Павлова. Проходил ординатуру по специальности «гематология» в НМИЦ им. В.А. Алмазова (Санкт-Петербург).
Область научных интересов: разработка новых подходов и принципов терапии при различных аутоиммунных заболеваниях. Клеточные и молекулярно-генетические механизмы регуляции процессов активации, дифференцировки и самоподдержания иммунной памяти. Мультипараметрические исследования патогенеза аутоиммунных заболеваниях на клеточном, молекулярно-генетическом уровнях.
Какоулина Евгения Ивановна
Врач-невролог блока химиотерапии и ТСК при онкологических и аутоиммунных заболеваниях.
В 2018 г. окончила Санкт-Петербургский государственный педиатрический медицинский университет по специальности «педиатрия». Проходила ординатуру по специальности «неврология» в Военно-медицинской академии им. С.М. Кирова.
Область научных интересов: токсические поражения центральной и периферической нервной системы после применения иммуносупрессивных, противоопухолевых, экстракорпоральных методов лечения неврологических, гематологических, нефрологических заболеваний; дифференциальная диагностика парапротеинемических, воспалительных аутоиммунных, токсических полиневропатий.
Врачи отделения специализируются на вопросах диагностики аутоиммунных, гематологических, онкологических, неврологических заболеваний. В условиях отделения возможно выполнение спинномозговых пункций в амбулаторном режиме с анализом образцов ликвора и крови в лаборатории аутоиммунных заболеваний ПСПбГМУ им. акад. И.П.Павлова. При взаимодействии с клиниками университета возможна первичная диагностика лимфопролиферативных заболеваний, биопсия лимфатических узлов, обследование пациентов с анемиями неясного генеза, включающее обследование ЖКТ, костного мозга и т.д.
Специалисты отделения активно обмениваются опытом терапии аутоиммунных заболеваний с коллегами из трансплантационных центров Европы: Charité (Берлин, Германия), Imperial College (Лондон, Англия), Hospital Clinic (Барселона, Испания), Uppsala University (Уппсала, Швеция), Careggi University Hospital (Флоренция, Италия) и другими.
Отделение оказывает медицинскую помощь в рамках ПМУ, ОМС, ОМС-ВТ, ВМП, что обеспечивает доступность лечения для всех социальных групп населения. В случае необходимости получения квоты на оказание высокотехнологичной помощи, специалисты клиники подготовят все документы для ее оформления. При выполнении терапевтических вмешательств используются передовые технологии с использованием европейских протоколов в комбинации с профилактическими средствами осложнений лечения. Наши палаты оборудованы в соответствии с современными требованиями комфорта с учетом проведения высокодозной иммуносупрессивной терапии.
Европейский опыт аутологичной трансплантации
Справочная информация
Аутоиммунные заболевания (АИЗ) развиваются на основе генетически обусловленного нарушения регуляции иммунной системы, приводящего к образованию множества антител к собственным клеткам и их компонентам и возникновению хронического иммунокомплексного воспаления с вовлечением многих органов и систем. По современным представлениям в основе аутоиммунных заболеваний лежат сложные процессы, связанные с нарушением селекции Т- и В-клеток, приводящие к «патологическому» иммунному ответу против собственных тканей (аутоантигенов), который развивается задолго до клинической манифестации заболеваний и может ассоциироваться с увеличением риска лимфопролиферативных заболеваний. На сегодняшний день описано более 100 синдромов и болезней аутоиммунной природы, что определяет нынешнее состояние данного вопроса в мире как эпидемию аутоиммунных заболеваний, среди которых наиболее распространенными являются рассеянный склероз, склеродермия, лимфома, системная красная волчанка, ревматойдный артрит и т.д. Ими страдают около 10% населения земного шара. С этиопатогенетической точки зрения механизм этих заболеваний един, что предполагает использование иммуносупрессивных средств в рамках стандартизированных протоколов терапии. Лишь стаж заболевания и тяжесть течения определяют выбор таргетной (целенаправленной) терапии. Однако, несмотря на достигнутые успехи, лечение больных аутоиммунными заболеваниями сопровождается определенными сложностями. Течение заболеваний носит часто непредсказуемый характер. Кроме того, у некоторой части больных при наличии высокой активности заболевания отмечаются неэффективность стандартной терапии или ее осложнения, что существенно лимитирует ее дальнейшее применение. В этих случаях прогрессия аутоиммунного заболевания неуклонно ведет к неблагоприятному исходу. Таким образом смертность больных с АИЗ по-прежнему в 3-5 раз выше, чем в общей популяции, что и определяет необходимость поиска новых терапевтических подходов при аутоиммунных заболеваниях. В последние годы все шире внедряются новые методы лечения, среди которых наиболее сложный – высокодозная иммуносупрессивная терапия с последующей трансплантацией аутологичных гемопоэтических стволовых клеток (ВИСТ с АТГСК). Для этого используют стволовые клетки периферической крови (СКПК) с целью «репрограммирования» иммунной системы. За последние годы этот метод все шире используется для лечения АИЗ. Мировой опыт свидетельствует о более высокой эффективности ВИСТ-АТГСК по сравнению со стандартной терапией при ревматологических (системная красная волчанка, системная склеродермия, ревматоидный артрит, системный васкулит) и неврологических (рассеянный склероз, миастения и др.) заболеваниях.
ВИСТ/ВИСТ-АТГСК на ранних этапах АИЗ позволяет приостановить дальнейшую прогрессию заболевания, достичь длительного безрецидивного течения аутоиммунного процесса, сохранить качество жизни и независимость от посторонней помощи. При своевременном проведении высокодозной/таргетной терапии в дебюте заболевания существует вероятность возврата утраченных функций или уменьшения выраженности имеющихся проявлений АИЗ на фоне иммунной реконституции.
Кроме того, ВИСТ-АТГСК является эффективным методом лечения пациентов с множественной миеломой и различных вариантов лимфом. По данным Европейского общества по трансплантации крови и костного мозга (ЕВМТ) более половины ауто-ТГСК выполнены пациентам с лимфопролиферативными заболеваниями.
На нашем отделении на основании анамнеза, стажа, типа и характера течения заболевания, рекомендаций ЕВМТ (European Society for Blood and Marrow Transplantation) и CIMTR (Center for International Blood and Marrow Transplant Research), при совместном обсуждении каждого пациента мультидисциплинарной бригадой в составе гематолога, невролога, ревматолога, онколога принимается решение о применении персонализированного протокола высокодозной иммуносупрессивной терапии, а также посттрансплантационных протоколах ведения пациентов. Оценка состояния (клинический статус, шкалы, лабораторно-инструментальные исследования) в обязательном порядке проводятся до начала терапии и в отдаленных периодах после проведения лечения. Лечащий врач постоянно находится на связи с пациентами после выписки.
Как записаться на консультацию или лечение
Преимущества лечения в нашем отделении
Мы используем персонализированные протоколы терапии с учетом анализа всех факторов риска, имеющихся у конкретного пациента. Мультидисциплинарный состав специалистов (гематолог, невролог, ревматолог, онколог) позволяет выносить грамотные решения на стыке наук.
Специалистами ведутся тщательный отбор пациентов при взаимодействии с главными профильными учреждениями города, а также посттрансплантационное ведение пациентов с анализом иммунологических, гематологических, неврологических и радиологических параметров.
Несмотря на мировой кризис, мы стараемся удерживать ценовую политику в пользу пациентов.
Отзывы пациентов
От всего сердца благодарю всю команду блока химиотерапии и трансплантации костного мозга во главе с А.Ю.Полушиным. Большое спасибо Алексею Юрьевичу за то, что он дал возможность пролечиться моему сыну. Алексей Юрьевич очень внимательный, обходительный, добрый, умный доктор. Это огромное счастье, что мы попали именно к нему, поскольку он, действительно, профессионал своего дела.
Также хочу поблагодарить заведующего отделением гематолога доктора Юрия Ринатовича Залялова, врача-невролога Какоулину Евгению, гематолога доктора Цынченко Александра Александровича. Очень повезло, что такие замечательные, компетентные и заботливые люди работают именно там, где они больше всего нужны. От всей души желаю вам и вашим близким здоровья и счастья!
Мы также очень благодарны медсестрам и медбратьям за их доброту, терпение и заботу. Спасибо вам всем! Удачи всему коллективу в нелегком, но благородном деле! Наше лечение прошло успешно! Прогрессия остановлена. Постараемся поддерживать это состояние еще долгие годы.
С наилучшими пожеланиями Марина и Кирилл Калачовы
Германия, Фульда
15 июня 2021 г.Показания к аутологичной трансплантации гемопоэтических стволовых клеток (ауто-ТГСК)
Трансплантация гемопоэтических стволовых клеток при лимфоме Ходжкина - показания, эффективность
Лимфома Ходжкина (лимфогранулематоз) относится к группе злокачественных заболеваний, при которых у большинства больных (детей и взрослых) удается добиться полного излечения с помощью современных программ химио- и лучевой терапии. Наибольшие сложности составляет лечение группы больных с первичной резистентностью (5—10 %) и рецидивами заболевания, особенно ранними (в пределах года с момента достижения ремиссии). Рецидивы наблюдаются у 10—15 % больных лимфомой Ходжкина, из которых приблизительно у половины удается достичь состояния повторной ремиссии даже при использовании резервных схем цитостатической терапии.
В настоящее время стандартом в лечении взрослых больных лимфомой Ходжкина является комбинированная химио- и лучевая терапия. С помощью современных протоколов около 95 % больных с I—II стадией и 70—80 % с III—IV стадией лимфомы Ходжкина могут быть излечены.
В целом эффективность терапии при лимфоме Ходжкина зависит от стадии болезни в момент постановки диагноза и IPI. К неблагоприятным факторам относятся возраст больного 45 лет и старше, мужской пол, IV стадия, содержание гемоглобина менее 105 г/л, альбумина менее 4 г/л, лимфоцитов менее 0,6 • 109/л, количество лейкоцитов в момент постановки диагноза 15- 109/л или более. Другими прогностическими факторами, имеющими значение, являются индекс Карновского, невозможность достижения ПР при использовании стандартных доз химиотерапии. До сих пор не установлено статистически достоверного влияния гистологического варианта лимфомы Ходжкина на отделенные результаты лечения.
С увеличением длительности жизни больных с лимфомой Ходжкина возрастает значение адекватности доз при проведении цитостатической и лучевой терапии, поскольку вероятность развития вторичных опухолей, наиболее часто возникающих в областях рядом с местом лучевого воздействия, зависит от интенсивности цитостатической и лучевой нагрузки. Проблемой отдаленного периода может быть развитие сердечной и легочной недостаточности.
Таким образом, высокодозная цитостатическая терапия с последующей трансплантации гемопоэтических стволовых клеток представляется оправданной только при следующих вариантах течения лимфомы Ходжкина: наличии прогностически неблагоприятных значений IPI, отсутствии ремиссии при проведении стандартной химиотерапии, развитии рецидива лимфомы Ходжкина или первичной резистентности. В подобных случаях терапия иногда бывает безуспешной и не зависящей от дозы применяемых препаратов.
К прогностически неблагоприятным вариантам течения лимфомы Ходжкина относятся III—IV стадии заболевания.
До последнего времени основным вариантом трансплантации гемопоэтических стволовых клеток, используемым у больных с лимфомой Ходжкина, являлась ауто-трансплантации гемопоэтических стволовых клеток (преимущественно ауто-ТПСКК).![трансплантация стволовых клеток при лимфоме Ходжкина]()
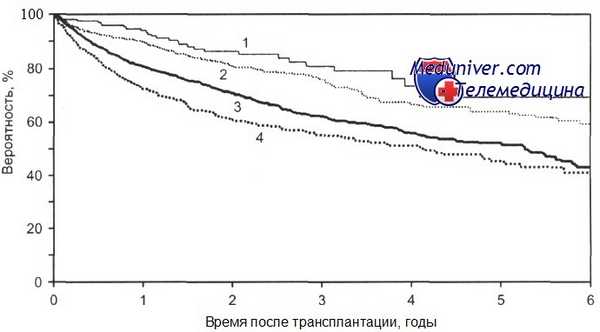
Общая выживаемость после ауто-ТГСК больных с лимфомой Ходжкина в зависимости от стадии болезни.
1-ПР1 (n = 184); 2-ПР2+ (n = 734); 3 - рецидив (n = 1806); 4 — ремиссия не достигнута (n = 632); р = 0,0001.Проведение ауто-трансплантации гемопоэтических стволовых клеток больным лимфомой Ходжкина I—II стадии возможно только при наличии признаков рецидива, особенно раннего, или первичной резистентности заболевания.
У части больных использование высокодозной химиотерапии с трансплантацией гемопоэтических стволовых клеток ограничено быстрой прогрессией заболевания, возрастом, низким индексом Кар-новского, а также невозможностью получения ауто-логичного трансплантата вследствие значительного снижения клеточности КМ и изменения функционального состояния гемопоэтических стволовых клеток после многочисленных курсов химиотерапии. Наиболее часто это связано с тем, что значительному большинству больных с лимфомой Ходжкина ранее проводилась лучевая терапия, что затрудняет получение аутотрансплантата из костного мозга (КМ). В связи с этим трансплантация гемопоэтических стволовых клеток, выделенных из крови (ауто-ТПСКК), стала при лимфоме Ходжкина методом выбора.
Выживаемость после ауто-ТГСК больных с первично-резистентным течением лимфомы Ходжкина
Обозначения: ОВ — общая выживаемость; БРВ — безрецидивная выживаемость; БСВ — бессобытийная выживаемость.Автор Количество больных Результаты Sweetenham J. et al. 290 30 % 5-летняя БРВ,
34 % 5-летняя ОВChopra R. et al. 46 33 % 5-летняя БРВ Reece D. et al. 30 42 % 5-летняя БРВ,
60 % 5-летняя ОВYahalom J. et al. 28 33 % 5-летняя БРВ Moreau P. et al. 28 31 % 3-летняя БСВ,
50 % 5-летняя ОВGianni A. et al. 7 31 % 6-летняя БРВ,
42 % 6-летняя ОВНаряду с указанным установлено отрицательное влияние следующих прогностических факторов на общую выживаемость больных с лимфомой Ходжкина при ауто-трансплантации гемопоэтических стволовых клеток: наличие В-симптомов, признаки экстранодального поражения, длительность полной ремиссии менее 1 года, низкий индекс Карновского (менее 80 %), отсутствие химиочувствительности и эффекта от двух-трех предшествующих курсов химиотерапии.
По данным CIBMTR, у больных лимфомой Ходжкина без учета стадии заболевания 3-летняя общая выживаемость после ауто-трансплантации гемопоэтических стволовых клеток в ПР1 была 81 %, во второй и последующих ремиссиях —76 %, при рецидиве — 63 %, при первичной резистентности — 55 %.
Факт рецидива отрицательно влияет на общую и безрецидивную выживаемость больных лимфомой Ходжкина. Несмотря на это, по данным различных исследований, у пациентов с рецидивом лимфомы Ходжкина 5-летняя общая выживаемость после ауто-трансплантации гемопоэтических стволовых клеток колеблется в пределах 65—85 % и зависит от интенсивности примененной перед ауто-трансплантации гемопоэтических стволовых клеток химиотерапии. Сохранение химочувстви-тельности опухоли имеет принципиальное значение. В случае отсутствия химиочувствительности лимфомы Ходжкина 5-летняя общая выживаемость после ауто-трансплантации гемопоэтических стволовых клеток составила 26,1 %, при сохранении химиочувствительности — 73,7 %.
Выживаемость после ауто-ТГСК больных с лимфомой Ходжкина в зависимости от срока возникновения рецидива
Автор Количество больных рецидив менее чем через 12 мес рецидив более чем через 12 мес Chopra R. et al. 52 41 % 57 % Bierman P. et al. 85 32% 47% Reece D. et al. 58 48 % 85 % Эффективность ауто-трансплантации гемопоэтических стволовых клеток при лимфоме Ходжкина исследовали многократно. Изучено прогностическое значение многих факторов. Так, установлено, что отдаленные результаты зависят от стадии болезни и места рецидива в момент проведения трансплантации. При выполнении ауто-трансплантации гемопоэтических стволовых клеток в первом рецидиве 10-летняя безрецидивная выживаемость составила 60 %, при рецидиве в первично-вовлеченной области — 38 %, при IIIВ—IV стадии лимфомы Ходжкина —21 %. По данным другого исследования, при первично-резистентном варианте лимфомы Ходжкина 10-летняя общая выживаемость и безрецидивная выживаемость после ауто-ТГСК составили 55 и 36 % соответственно. Общие результаты ауто-трансплантации гемопоэтических стволовых клеток при неблагоприятных вариантах течения лимфомы Ходжкина представлены в таблицах
Наиболее часто при лимфоме Ходжкина используются режимы кондиционирования: CBV (цикло-фосфан, BCNU, этопозид) и BEAM (BCNU, этопо-зид, цитозар, мелфалан), возможно применение VIP (этопозид, ифосфамид, цисплатин). При режиме кондиционирования CBV 5-летняя общая выживаемость больных с первичной рефрактерностью или рецидивом лимфомы Ходжкина достигает 67 %, при использовании BEAM она составляет 47—70 %.
Экспериментальные данные свидетельствуют о том, что клеточный субстрат опухоли лимфомы Ходжкина отвечает на воздействия, обусловленные реакцией «трансплантат против лимфомы». В связи с этим разрабатываются показания к алло-трансплантации гемопоэтических стволовых клеток у больных с лимфомой Ходжкина, что может быть актуально в случае резистентных форм заболевания. Особенно перспективным представляется использование при этом «немиелоаблативных» режимов кондиционирования. Первые полученные данные подтверждают существование такой возможности. Так, при сравнении аутологичной и аллогенной трансплантации гемопоэтических стволовых клеток у больных с химиочувствительным рецидивом лимфомы Ходжкина 5-летняя общая выживаемость составила 44 и 63 % соответственно.
Таким образом, показанием к трансплантации гемопоэтических стволовых клеток у больных лимфомой Ходжкина являются прогностически неблагоприятные варианты течения болезни. Эффективность трансплантации гемопоэтических стволовых клеток при лимфоме Ходжкина колеблется в среднем от 25 до 80 %, что зависит от индекса IPJ, стадии болезни, места рецидива и сохранения химиочувствительности опухоли.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Наиболее часто ауто-трансплантации гемопоэтических стволовых клеток используется при следующих вариантах злокачественных заболеваний системы крови: НХЛ, ЛХ, ММ, ОМЛ, ОЛЛ. В настоящее время этот метод все чаще применяют при ХЛЛ и ХМЛ.
Применение ауто-трансплантаций гемопоэтических стволовых клеток ограничено при ряде заболеваний системы крови. Так, выполнение ауто-трансплантаций гемопоэтических стволовых клеток при ХМЛ и ХЛЛ возможно, однако в связи с низкой вероятностью достижения состояния полной клинико-гематологической ремиссии на фоне их лечения до последнего времени производилось редко.
Проведение ауто-трансплантаций гемопоэтических стволовых клеток при ХМЛ и ХЛЛ требовало использования различных методов «очистки» трансплантата от примеси злокачественных клеток как in vivo (интенсивная химиотерапия, циторедуктивная терапия), так и ex vivo (цитостатики, моноклональные антитела, длительное культивирование).
В последние годы прогресс в этой области связан с эффективным применением аналогов пуриновых оснований (флударабин, 2-CDA) при ХЛЛ и ингибиторов тирозинкиназы (гливек) при ХМЛ. Высокая частота ремиссий (гематологических, цитогенетических, молекулярно-биологических) при ХЛЛ и ХМЛ на фоне современной терапии создает условия для использования ауто-трансплантаций гемопоэтических стволовых клеток у данной категории больных.
При ХИМФ проведение ауто-трансплантаций гемопоэтических стволовых клеток затруднено ввиду сложности получения аутологичного трансплантата адекватного качества на фоне развития фиброзных изменений костного мозга.
На результаты ауто-трансплантаций гемопоэтических стволовых клеток при острых лейкозах большое влияние оказывает выбор оптимального времени получения гемопоэтических стволовых клеток после достижения ремиссии. Длительность полной ремиссии перед эксфузией (аферезом) гемопоэтических стволовых клеток, рассматриваемая как наиболее благоприятная, составляет более 6 мес. При получении гемопоэтических стволовых клеток и проведении ауто-трансплантаций гемопоэтических стволовых клеток у больных с неходжкиновскими лимфомами и множественной миеломой определяющее значение имеет степень инфильтрации костного мозга злокачественными клетками.
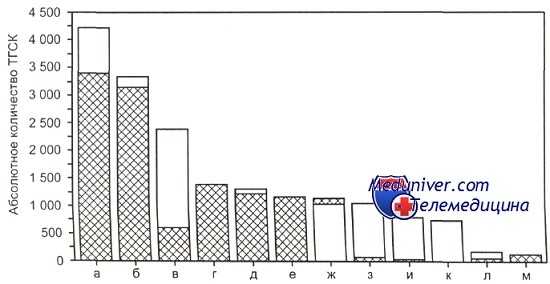
![показания к трансплантации стволовых клеток]()
Основные показания к проведению ТГСК в США.
а — неходжкинские лимфомы; б — множественная миелома; в —ОМЛ; г — рак молочной железы; д — болезнь Ходжкина; е —другие опухоли; ж —ХМЛ; з — ОЛЛ; и — МДС/другие лейкемии; к — незлокачественные заболевания; л — ХЛЛ; м — рак яичников. Светлая часть столбиков - алло-ТГСК (n = 6700), заштрихованная — ауто-ТГСК (n= 11 000).Необходимо отметить, что при попытке сравнения химиотерапии и различных видов трансплантации гемопоэтических стволовых клеток у больных со злокачественными заболеваниями системы крови достаточно сложно выделить сопоставимые данные. Так, например, при острых лейкозах в первой или второй ремиссии эффективность ауто-трансплантаций гемопоэтических стволовых клеток или алло-трансплантаций гемопоэтических стволовых клеток часто анализируют совместно с трансплантацией гемопоэтических стволовых клеток у детей, подростков и взрослых (например, данные CIBMTR) либо без учета прогностических факторов.
Включение в одно исследование пациентов, которым трансплантация гемопоэтических стволовых клеток была выполнена от десятков до нескольких лет назад, может не отражать реальной ситуации. В связи с совершенствованием методов
HLA-типирования, сопроводительной терапии, профилактики токсических, инфекционных и иммунологических осложнений за последние годы показатели выживаемости больных после родственной и неродственной алло-трансплантацией гемопоэтических стволовых клеток и ауто-трансплантацией гемопоэтических стволовых клеток значительно улучшились по сравнению с данными, которые были получены на начальных этапах внедрения трансплантации гемопоэтических стволовых клеток как метода лечения. Это позволяет некоторым авторам рассматривать результаты трансплантации гемопоэтических стволовых клеток, исходя из различных исторических периодов.
При оценке отдаленных результатов трансплантации гемопоэтических стволовых клеток фактор отбора больных оказывает решающее значение. До настоящего времени не получено данных об эффективности трансплантации гемопоэтических стволовых клеток при заболеваниях системы крови из рандомизированных исследований, выполненных на основании анализа современных прогностических критериев.
При использовании алло-трансплантации гемопоэтических стволовых клеток проведение рандомизированных исследований в принципе невозможно, поскольку, как правило, в этом случае имеет место «биологическая» рандомизация пациентов, связанная с наличием родственного или неродственного донора гемопоэтических стволовых клеток. В подобных случаях чем позднее ставится вопрос о выполнении алло-трансплантации гемопоэтических стволовых клеток, тем больше вероятность развития у больного различных осложнений в раннем и позднем периодах после трансплантации.
Факт предшествовавшего рецидива острого лейкоза и высокий уровень «минимальной остаточной болезни» перед трансплантацией гемопоэтических стволовых клеток увеличивают риск возникновения рецидива, в том числе после алло-трансплантации гемопоэтических стволовых клеток.
Необходимо отметить, что не существует экстренных показаний для выполнения того или иного вида трансплантации гемопоэтических стволовых клеток, которая всегда требует подготовки, особенно психологической, реципиента и его родственников.
При выборе программ лечения больных со злокачественными заболеваниями постоянно возникает дилемма между использованием методов терапии, приводящих к полному излечению больного, но в то же время более опасных, особенно на ранних этапах применения (условно к этой группе можно отнести трансплантацию гемопоэтических стволовых клеток), и терапии менее интенсивной и безопасной, но менее эффективной по результатам долгосрочного прогноза. По результатам лечения этих групп больных кривые выживаемости имеют «перекрещивающийся» характер.
При наличии проблемы «перекрещивающихся» кривых выживаемости окончательный выбор метода лечения остается за больным и его родственниками.Таким образом, одним из основных вопросов, от ответа на который зависит будущее применение трансплантации гемопоэтических стволовых клеток, является более детальное выяснение роли и места различных видов трансплантации гемопоэтических стволовых клеток в лечении онкологических заболеваний.
Трансплантация костного мозга и стволовых клеток
Трансплантация костного мозга (ТКМ) / стволовых кроветворных клеток периферической крови (ТСКК) - метод лечения гематологических, онкологических и аутоиммунных заболеваний, при котором пациенту после проведения интенсивной иммуносупрессивной терапии с применением больших дозы цитостатических препаратов (иммуносупрессантов), вводят предварительно заготовленный костный мозг или стволовые кроветворные клетки периферической крови (СКК). Ежегодно в мире выполняется около 150 000 ТКМ и ТСКК, причем количество операций постоянно увеличивается.
ОБЩАЯ ИНФОРМАЦИЯ О СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТКАХ
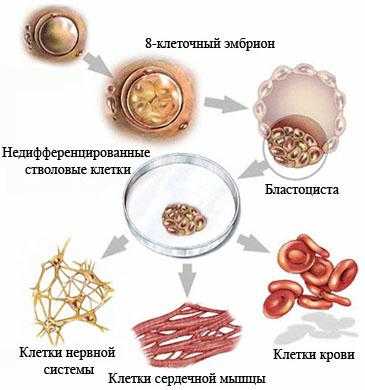
Недифференцированная стволовая клетка, происходящая из бластоцисты, является родоначальницей всех клеток организма, в том числе и стволовой кроветворной клетки (СКК).
![Недифференцированная стволовая клетка]()
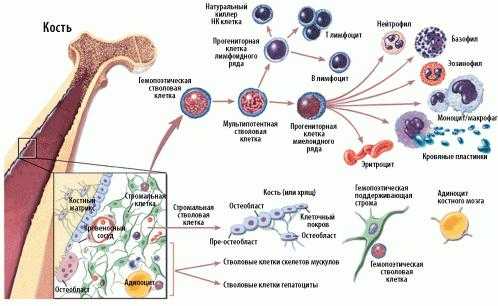
Основными свойствами стволовой кроветворной клетки являются возможность дифференцироваться в направлении любого из ростков кроветворения и способность к самоподдержанию.
![Схема кроветворения и дифференцировки стволовых клеток]()
Схема кроветворения и дифференцировки стволовых клеток![Колонии стволовых кроветворных клеток (электронная микроскопия)]()
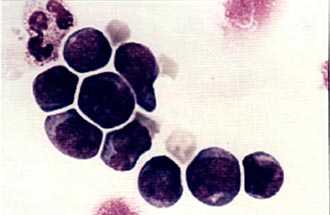
Колонии стволовых кроветворных клеток (электронная микроскопия)![Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты]()
Мононуклеарная фракция, обогащенная клетками CD34, окрашена по Маю-Грюнвальду с докраской по Гимзе. Стволовые клетки, несущие маркер CD34, внешне напоминают малые и средние лимфоциты.ИСТОРИЧЕСКАЯ СПРАВКА
Первые работы, посвященные терапевтическому использованию костного мозга, были выполнены в последней декаде XIX века, независимо друг от друга Brown-Sequard, d"Arsonval, Fraser, Billings и Hamilton, которые применяли экстракт костного мозга животных для лечения больных различными видами анемий. Несмотря на положительный эффект, отмеченный всеми авторами, в течение последующих пятидесяти лет использование данной методики носило спорадический характер и не выходило за рамки клинического эксперимента до 1937 года когда Schretzenmayr впервые произвел парентеральное (внутримышечное) введение костного мозга, а в 1939 году Osgood выполнил первое внутривенное введение костного мозга.
Результаты экспериментальных исследований привели клиницистов к идее использования ТКМ при заболеваниях, связанных с поражением костного мозга (лейкозы, апластическая анемия), а также при радиационных воздействиях и проведении химиотерапии, однако основные теоретические и практические проблемы проведения ТКМ удалось преодолеть в 60-е годы. С этого времени ТКМ является одним из методов лечения различных заболеваний крови и иммунной системы.
ВИДЫ ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
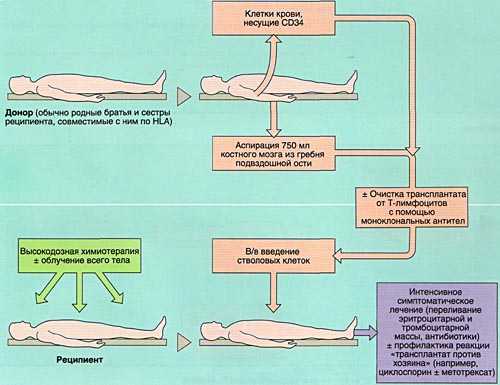
- 1)аллогенную (АллоТКМ) - при которой больному вводится костный мозг от родственного или неродственного совместимого донора;
![Аллогенная трансплантация костного мозга]()
Разновидностью АллоТКМ является сингенная ТКМ (трансплантация от однояйцевого близнеца).
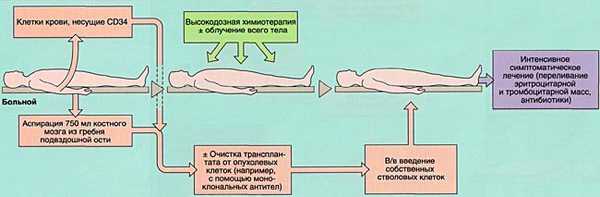
- 2)аутологичную (АутоТКМ) - когда реципиент получает предварительно заготовленный собственный костный мозг;
![Аутологичная трансплантация костного мозга]()
ПОКАЗАНИЯ К ТРАНСПЛАНТАЦИИ КОСТНОГО МОЗГА
- 1) острые лейкозы;
- 2) хронический миелолейкоз;
- 3) тяжелая апластическая анемия;
- 4) гемоглобинопатии;
- 5) врожденные иммунодефициты и нарушения метаболизма.
- 1) злокачественные лимфомы;
- 2) некоторые солидные опухоли;
- 3) аутоиммунные заболевания.
С развитием появлением колониестимулирующих факторов и развитием технологий клеточной сепарации с 70-х годов для получения гемопоэтических клеток крови вмести костного мозга стали использовать стволовые клетки периферической крови.
Применение клеточных сепараторов значительно упростило проведение процедуры получения стволовых клеток крови, уменьшило число осложнений связанных с дачей наркоза и травматическим повреждения костной ткани.
![Схема кроветворения и дифференцировки стволовых клеток]()
Сепаратор клеток кровиЕще одним потенциальным источником СКК является пуповинная кровь, основным преимуществом которой является меньшая иммуногенность, однако малое количество стволовых клеток в материале ограничивает ее применение и используется преимущественно в педиатрии или у пациентов с массой тела до 50 кг.
Методика проведения миелотрансплантации различается в зависимости от ее вида (аллогенная или аутологичная), нозологической формы заболевания и ряда других факторов.
ПРАКТИЧЕСКИЕ АСПЕКТЫ МИЕЛОТРАНСПЛАНТАЦИИ
- 1) определение показаний и противопоказаний;
- 2) выбор донора (при аллогенной трансплантации);
- 3) получение костного мозга/стволовых клеток их обработка, хранение и введение;
- 4) кондиционирование (иммуносупрессивная терапия);
- 5) профилактика и лечение осложнений периода цитопении;
- 6) профилактика и лечение поздних осложнений.
ОПРЕДЕЛЕНИЕ ПОКАЗАНИЙ И ПРОТИВОПОКАЗАНИЙ
Наиболее частыми показаниями к ТКМ/ТСКК являются онкогематологические и гематологические заболевания (лейкозы, злокачественные лимфомы, апластическая анемия, врожденные иммунодефициты и нарушения метаболизма).
Чаше всего ТКМ или ТСКК проводится во время полной ремиссии (ПР), частичной ремиссии (ЧР) или при рецидиве опухоли, чувствительном к химиотерапии. При первичной резистентности к цитостатической терапии результаты ТКМ резко ухудшаются, поэтому в этих случаях операция выполняется относительно редко.
При некоторых заболеваниях трансплантация является методом выбора (тяжелые формы апластической анемии, гемоглобинопатии, врожденных иммунодефицитов и нарушений метаболизма). В ряде случаев ТКМ/ТСКК проводится при солидных опухолях и аутоиммунных заболеваниях. Данная методика имеет возрастные ограничения: АутоТКМ/ТСКК может быть выполнена у лиц моложе 65 лет, АллоТКМ от HLA-идентичного родственника - моложе 55 лет, неродственная АллоТКМ - моложе 50 лет.
- 1) нарушении функции внутренних органов (почек, печени, легких, сердечно-сосудистой системы);
- 2) активной инфекции;
- 3) плохом общесоматическом статусе (индекс ВОЗ > I)
- 4) резистентном к химиотерапии рецидиве солидной опухоли или
- онкогематологического заболевания;
- 5) рефрактерности к трансфузиям тромбоцитов.
ВЫБОР ДОНОРА
Совместимость костного мозга определяет результаты АллоТКМ. Родственными донорами считаются совместимые по системе HLA братья или сестры реципиента (сибсы). Родители и дети гаплоидентичны (имеют одну общую хромосому из каждой пары, т. е. совпадают между собой на 50%) и не могут быть донорами аллогенного костного мозга. Совместимые сибсы имеются лишь у 20-25% больных, в связи с чем в последние 10 лет активно внедряется АллоТКМ от неродственных HLA-идентичных доноров или частично совместимых родственных доноров.
МОБИЛИЗАЦИЯ, ОБРАБОТКА И ИНФУЗИЯ СТВОЛОВЫХ КРОВЕТВОРНЫХ КЛЕТОК
Аспирация костного мозга производится под эндотрахеальным наркозом из задних гребней подвздошной кости, при необходимости - также из передних гребней и грудины. Для этого используют удлиненные иглы типа иглы Кассирского и шприцы объемом 20 см3, содержащие гепарин. Во избежание значительного разведения периферической кровью из каждого прокола кости аспирируют не более 5-6 мл костномозговой взвеси, которую фильтруют и помещают в специальные контейнеры. В каждом контейнере подсчитывают количество ядросодержащих клеток. Для восстановления кроветворения при АутоТКМ требуется получить не менее 1,5x106 ядросодержащих клеток на кг массы тела реципиента, при родственной АллоТКМ - не менее 2х106/кг (у больных апластической анемией - не менее 3х106/кг), при неродственной АлТКМ - не менее 3х106/кг. Объем аспирируемой костномозговой взвеси составляет около 1,5 л.
Для сохранения жизнеспособного костного мозга перед АутоТКМ (между аспирацией и инфузией клеток проходит от 2-3 недель до нескольких лет) после фракционирования его консервируют в жидком азоте под защитой криопротектора (чаще всего - диметилсульфоксида).
А) специальный сосуд (дюар) с жидким азотом для транспортировки контейнеров с костным мозгом![]()
А)![]()
Б)
Б) извлеченный из сосуда контейнер с костным мозгомИнфузия аллогенного, размороженного аутологичного костного мозга или СКК периферической крови проводится внутривенно, капельно после предварительного введения антигистаминных препаратов для предотвращения аллергических реакций.
![Инфузия костного мозга пациенту]()
Инфузия костного мозга пациентуИММУНОСУПРЕССИВНАЯ ТЕРАПИЯ (КОНДИЦИОНИРОВАНИЕ)
Задача кондиционирования - обеспечить глубокую депрессию иммунной системы, а при онкологических заболеваниях и уничтожение оставшихся опухолевых клеток при умеренной токсичности для других органов и систем, а также создании условий для успешного приживления трансплантата.
Для проведения кондиционирования используются стандартные протоколы, в которых указываются дни, часы, дозы и длительность введения цитостатиков, симптоматических препаратов (антибактериальных, седативных, противорвотных и др., объем и характер инфузии), при необходимости - порядок проведения лучевой терапии. Протоколы кондиционирования различаются в зависимости от характера заболевания и типа трансплантации.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ ОСЛОЖНЕНИЙ ПЕРИОДА ЦИТОПЕНИИ
Вскоре после окончания кондиционирования и введения СКК у больного развивается аплазия костного мозга (период отсутствия костного мозгового кроветворения), которая проявляется практически полным отсутствием клеток крови (панцитопенией) и продолжается в среднем 4 недели. Этот период опасен развитием тяжелых осложнений (инфекции, кровоточивость и т.д.).
Основную опасность в периоде цитопении представляют инфекционные осложнения, поэтому их профилактика, своевременное и адекватное лечение являются необходимым условием успешной ТКМ.
- 1) помещение больного в стерильный бокс и проведение необходимых санитарно-гигиенических мероприятий (обработка кожи, слизистых оболочек и перианальной области дезинфицирующими растворами);
- 2) подавление микрофлоры кишечника с помощью антибактериальных и противогрибковых препаратов.
Также по показаниям проводится переливание компонентов крови (эритроцитарная масса, тромбомасса, плазма).
Трансплантация гемопоэтических стволовых клеток у детей.
Что такое Трансплантация костного мозга?
Трансплантация костного мозга (ТКМ) - на данный момент чаще называется трансплантацией гемопоэтических стволовых клеток (ТГСК), поскольку в качестве источников стволовых клеток в настоящий момент могут также использоваться периферическая и пуповинная кровь.
У детей трансплантация костного мозга используется в качестве метода лечения при многих заболеваниях, включая онкогематологические заболевания, лимфопролиферативные гемобластозы, иммунодефициты, недостаточность костного мозга и врожденные метаболические заболевания.
ТГСК может быть одним из компонентов протокола лечения некоторых заболеваний или единственный куративным методом при других.
Есть два основных типа ТГСК:
Аутологичная ТГСК (ауто-ТГСК) когда пациенту вводят его собственные гемопоэтичексие клетки
Аллогенная ТГСК (алло-ТГСК) когда пациенту вводят гемопоэтические клетки донора. Донор может быть родственным (член семьи) или неродственным.
Первая аллогенная трансплантация стволовых клеток была проведена в 1957 году Э.Д. Томасом. Первые успешные трансплантации стволовых клеток в истории начались в 1968 году с пациентов, у которых был диагностирован тяжелый комбинированный иммунодефицит и синдром Вискотта-Олдрича. Первая успешная трансплантация от неродственного донора была выполнена в 1973 году 5-летнему ребенку с диагнозом тяжелый комбинированный иммунодефицит. Определение антигенов лейкоцитов человека (HLA) обеспечило совместимость тканей между пациентом и донором, и это открытие стало наиболее важным шагом к успешной трансплантации. Шансы найти подходящих неродственных доноров увеличились в результате развития банка данных доноров клеток костного мозга и пуповинной крови.
Режимы подготовки (кондиционирования).
Целью режима кондиционирования при ТГСК является подготовка пациента к трансплантации, и она состоит из трех различных компонентов: «обеспечение места в костном мозге», «иммуносупрессия» и «устранение заболевания».
Обеспечение пространства в костном мозге необходимо для того, чтобы стволовые клетки донора достигли «ниши» и «приживления».
Отторжение трансплантата иммунными клетками реципиента (человека с заболеванием, которому делают пересадку) может быть предотвращено с помощью иммуносупрессии.
Поскольку долгосрочный прогноз связан с контролем заболевания при злокачественных новообразованиях, основной целью режима кондиционирования является борьба с основнм заболеванием.
Комбинация цитостатических препаратов и лучевого воздействия (тотальное облучение тела) применяется с целью создания в организме реципиента состояния иммунологической толерантности для обеспечения приживления ГСК донора при алло-ТГСК. При выборе оптимального режима для конкретного больного учитываются многие факторы, среди которых наиболее важными являются возраст, общее состояние пациента и имеющиеся осложнения, характер и стадия заболевания, особенности донора, профилактика РТПХ
Тот факт, что побочные эффекты режима подготовки (кондиционирования), как правило, переносятся лучше у детей по сравнению со взрослыми, позволяет применять у них более высокие дозы химиопрепаратов. С другой стороны, режимы, в которых выполняется полное облучение организма, у детей могут привести к поздним осложнениям, включая задержку роста, пубертатную недостаточность или задержку полового созревания, которые более важны для детей.
Во многих исследованиях, сравнивающих режимы на основе общего облучения тела с протоколами, содержащими только химиотерапию, не было продемонстрировано никакой разницы с точки зрения прогноза.
Наиболее часто используемые режимы у детей - это режимы, в которых циклофосфамид и бусульфан используются вместе. Различные химиотерапевтические препараты также могут быть добавлены в зависимости от основного заболевания, особенно при врожденных генетических заболеваниях.
Режимы пониженной интенсивности в настоящий момент вышли на передний план, чтобы уменьшить побочные эффекты режимов кондиционирования. Однако опыт работы с детьми в этой области ограничен. В протоколах пониженной интенсивности наиболее часто используемым препаратом является флударабин.
Читайте также: