Показания к операции Якобеуса. Цель операции Якобеуса
Добавил пользователь Alex Обновлено: 28.01.2026
Коллапсотерапия (лат. collapsus ослабевший, упавший + греч. therapeia лечение) — методы лечения туберкулеза путем достижения временного или постоянного спадения (уменьшения объема) пораженного легкого.
Впервые Коллапсотерапия в виде искусственного пневмоторакса была теоретически обоснована К. К. Зейдлицем (1842); искусственный пневмоторакс введен в практику в 1882 г. Форланини (G. Forlanini).
Лечебный эффект Коллапсотерапии заключается в том, что наступает рассасывание воспалительных туберкулезных инфильтратов и заживление каверны. Наиболее распространенными теориями механизма действия К. являются: функциональный покой пораженного легкого, лимфатический стаз, венозный застой в спавшемся легком, перегибы мелких бронхов, нейротрофические изменения в спавшейся легочной ткани. Один из этих факторов или все вместе стимулируют репаративные процессы в пораженном легком, приводящие в большом проценте случаев к излечению от активного туберкулеза легких.
Достигнуть спадения (коллапса) легкого позволяют следующие методы: введение воздуха в плевральную полость путем прокола иглой грудной стенки (см. Пневмоторакс искусственный); резекция задних отделов ребер над пораженным отделом легкого — экстраплевральная торакопластика (см.); отслоение париетальной плевры вместе с пораженным участком легкого и создание полости между грудной стенкой и отслоенной плеврой, в к-рую периодически вводится воздух,— экстраплевральный пневмоторакс; пересечение диафрагмального нерва (см. Френикотомия) или его алкоголизация в области шеи с целью создания паралича и подъема купола диафрагмы; повторные введения e брюшную полость воздуха через прокол иглой брюшной стенки с целью временного подъема купола диафрагмы (см. Пневмоперитонеум). Для каждого метода разработаны показания.
Из всех методов К. наибольшее значение приобрел искусственный пневмоторакс. До появления специфических противотуберкулезных химиопрепаратов он был основным методом лечения различных форм легочного туберкулеза. Его роль особенно возросла после разработки Якобеусом (H. Ch. Jacobaeus, 1913) метода закрытого пережигания плевральных сращений гальванокаутером. Л. К. Богуш (1945) широко применял гидравлическую препаровку плевральных сращений, вдвое увеличивающую эффективность операции Якобеуса.
При облитерации плевральной полости и невозможности наложения искусственного пневмоторакса у больных деструктивным туберкулезом легких широкое применение получили торакопластика и экстраплевральный пневмолиз (см.). Эти операции позволяют избирательно коллабировать пораженную часть легкого (селективная К.). Экстраплевральный пневмолиз применяется при ограниченных деструктивных процессах с небольшими кавернами в верхней доле легкого (верхний пневмолиз) или в VI сегменте (нижний пневмолиз). Л. К. Богуш (1950) усовершенствовал и упростил эту операцию, предложив подмышечный оперативный доступ и отслаивание париетальной плевры марлевым тупфером под контролем освещения лампочкой торакоскопа. Для стабилизации образованной экстраплевральной полости и удержания соответствующей части легкого в коллабированном состоянии в полость периодически вводят воздух (экстраплевральный пневмоторакс); созданную полость можно заполнить стерильным вазелиновым маслом — олеоторакс (см.).
Торакопластика с поднадкостничной резекцией пяти — семи верхних ребер применяется при фиброзно-кавернозном туберкулезе верхних долей легких. При поражении всего легкого производится тотальная торакопластика.
При кровотечении из каверны показания к наложению искусственного пневмоторакса, экстраплевральному пневмолизу или торакопластике могут быть срочными. Возможны двусторонний экстраплевральный пневмолиз, двусторонняя ограниченная торакопластика, а также сочетание пневмолиза на одной стороне с торакопластикой на другой.
С начала 50-х гг. 20 в. показания к К. резко сужены во всех случаях благодаря успехам химиотерапии туберкулеза и широкому применению резекции легких. Сохраняют значение пневмоперитонеум, который накладывают при инфильтративно-пневмоническом туберкулезе в фазе распада и обсеменения и при кровотечениях из каверн в нижней доле, а также торакопластика, к-рая по частоте применения занимает второе место после резекции легких среди методов хирургического лечения легочного туберкулеза.
Коллапсотерапия противопоказана при больших и гигантских кавернах, бронхостенозе, циррозе легкого, а также при выраженной дыхательной недостаточности (см.).
Библиография: Богуш Л. К. О гидравлической препаровке плевральных сращений, Пробл, туб., № 5, с. 29, 1949; Михайлов Ф. А. Искусственный пневмоторакс при туберкулезе легких, Свердловск, 1946; Многотомное руководство по хирургии, под ред. Б. В. Петровского, т. 5, с. 523, М.—Л., 1960; Стойко Н. Г. Хирургическое лечение легочного туберкулеза, М., 1949, библиогр.; Хрущева Т. Н. Экстраплевральный пневмоторакс и олеоторакс, М., 1952, библиогр.; Bier А., Вraun H. u. Kummell H. I. Chirurgische Operationslehre, Bd 3, T. 1, S. 381, Lpz., 1971, Bibliogr.; Malluche H. Die Pneumolyse, Lpz., 1957, Bibliogr.
Показания к операции Якобеуса. Цель операции Якобеуса
Требования к операции Якобеуса. Эффективность искусственного пневмоторакса
Клинические наблюдения приводят нас к заключению, что искусственный пневмоторакс при наличии сращений никогда не может быть надежным. Эти больные склонны к постоянным вспышкам, пневмоплевритам, кровохарканиям и т. д. А самое главное это то, что в таких случаях по прекращений искусственного пневмоторакса чаще всего наступает рецидив туберкулезного процесса.
Веран считает, что при полном коллапсе стойкое излечение наступает в 98%, а при наличии сращений, мешающих спадению пораженной части легкого, почти во всех случаях наблюдается рецидив процесса.
Рентгенологические исследования приводят к тому же заключению. Першина, обследовавшая рентгенологически ряд больных, закончивших лечение искусственным пневмотораксом, обнаружила рецидив туберкулезного процесса именно в тех случаях, когда искусственный пневмоторакс был наложен при наличии плевральных сращений.
Очень интересны наблюдения Кочновой, обследовавшей рентгенологически 102 больных; у 73больных искусственный пневмоторакс дал полный клинический успех. Томографические исследования больных, у которых искусственный пневмоторакс применялся при наличии сращений, обнаружили распад.
На основании своих исследований Кочнова приходит к заключению, что «длительный клинический эффект и удовлетворительный в механическом отношении коллапс легкого при пневмотораксе со спайками довольно часто не соответствуют анатомической полноценности лечебного пневмоторакса».
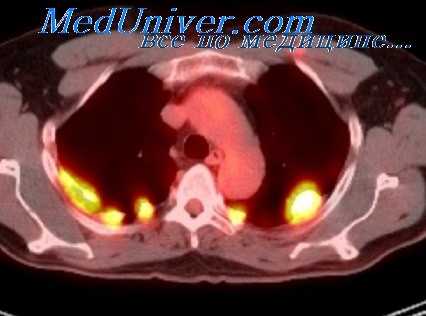
Патологическая анатомия подтверждает те выводы, к которым приводят нас клинико-рентгенологические исследования. Скарпатти описывает 5 случаев, в которых искусственный пневмоторакс привел к полному клиническому выздоровлению, несмотря на наличие сращений; в дальнейшем было обнаружено наличие активных казеозных очагов у основания каждого сращения.
В одном случае двустороннего пневмоторакса на той стороне, где сращения отсутствовали, в легком не было обнаружено туберкулезных изменений, на другой же стороне, где были сращения, у основания их имелись активные казеозные очаги.
Маурером опубликованы данные вскрытия 5 умерших, у которых искусственный пневмоторакс был неполноценным вследствие сращений. Так же как Скарпатти, он обнаружил активные туберкулезные очаги только у основания сращений.
Таким образом, клинико-рентгенологические и патологоанатомические исследования приводят к одному и тому же выводу, и мы считаем себя вправе утверждать, что наличие сращений даже при клинически вполне эффективном искусственном пневмотораксе является абсолютным показанием к торакоскопии.
Следует упомянуть о тех случаях, когда при полном коллапсе легкого каверна продолжает зиять. Мы знаем, что каверна не сжимается тогда, когда вокруг ее стенки имеется инфильтрированная ткань или когда стенка каверны фиброзно изменена.
В первом случае каверна по мере рассасывания инфильтрата может спасться, во втором случае никаких надежд на сжатие каверны не может быть, поэтому нужно своевременно прекратить пневмоторакс и думать о каком-либо другом вмешательстве, ибо такой пневмоторакс ничего, кроме вреда, принести не может. Но в каждом случае окончательное решение вопроса о необходимости прекращения пневмоторакса может быть принято только после тщательной торакоскопии. Нередко в таких случаях удается найти незначительные тяжи, совершенно не обнаруживаемые на рентгенограмме, после устранения которых каверна быстро спадается.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Пример операции Якобеуса. Эффективность операции Якобеуса
Для иллюстрации приведем случай, наблюдавшийся в санатории ВЦСПС им. Ленина в 1933 г.
Больная С., 32 лет, врач, поступила в хирургическое отделение санатория ВЦСПС им. Ленина 26/VI 1933 г. Считает себя больной с 1929 г.; субфибрильная температура, плохое самочувствие, но бациллы Коха отсутствовали. В 1931г. находилась в санатории в Крыму с хорошим результатом. В декабре при диспансеризации были обнаружены бациллы Коха, эластические волокна и каверна. 17/I 1933 г. был наложен искусственный пневмоторакс; через месяц бациллы Коха исчезли. Каверна не сжималась из-за спайки, однако состояние больной было прекрасное и бациллы Коха все время отсутствовали.
При поступлении в санаторий: правосторонний искусственный пневмоторакс с большой несжатой деформированной каверной под ключицей. Бациллы Коха и эластические волокна отсутствуют, состояние хорошее. Несмотря на это, а также сомнения больной относительно необходимости операции, ей настоятельно рекомендовано сделать пережигание спаек.
9/VII торакоскопия. Обнаружено сращение толщиной в палец, идущее к задне-боковой поверхности грудной клетки и прикрепляющееся к III ребру. Рядом вторая спайка толщиной в желобоватый зонд. Обе спайки пережжены. Послеоперационный период прошел без всяких осложнений. Появился небольшой экссудат в синусе, быстро рассосавшийся.
13/VII рентгеноскопия. Легкое хорошо сжато, каверны почти не видно. 14/VII исследование мокроты: обнаружены бациллы Коха в большом количестве. В дальнейшем бациллы Коха быстро исчезли.
1/IX каверна вполне сжата, больная выписана из санатория в хрошем состоянии.
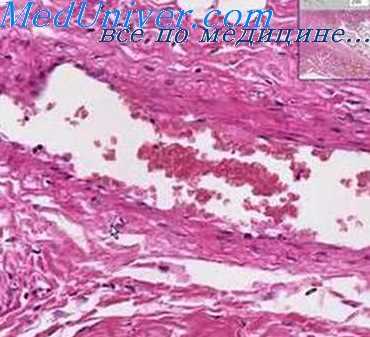
Приведенная история болезни интересна в том отношении, то больная, чувствуя себя после наложения пневмоторакса вполне удовлетворительно и будучи полностью работоспособной, колебалась, подвергаться ли операции, и только после известных уговоров согласилась на операцию. Появление после операции бацилл Коха, отсутствовавших длительное время, объясняется тем, что после коллапса каверны у больной появилась мокрота, которой до операции не было. Последние сведения об этой больной таковы: пневмоторакс прекращен, Каверны нет, бациллы Коха отсутствуют все время, больная вполне работоспособна.
Если рентгеноскопия показывает, что каверна сжата, но больной продолжает выделять бациллы Коха, то безусловно необходимо предпринять торакоскопию, хотя бы рентгенологическое исследование и не установило никаких сращений. В таких случаях почти всегда удается обнаружить тяжи, невидимые во время рентгеноскопии, идущие от наиболее пораженной части легкого; если удается эти тяжи уничтожить, то каверна окончательно спадается и больной вскоре перестает выделять бациллы Коха.
Как поступать в тех случаях, когда каверна сжата, больной не выделяет бацилл Коха, но при рентгенологическом исследовании обнаруживаются сращения?
В решении этого вопроса до сих пор еще нет полного единодушия. Якобеус очень сдержанно относится к операциям пережигания спаек в тех случаях, когда искусственный пневмоторакс клинически вполне эффективен. Унферрихт считает, что наличие сращений, не мешающих эффективности искусственного пневмоторакса, не является показанием к операции.
Ввиду того что наличие клинически и рентгенологически эффективного пневмоторакса и плевральных сращений очень часто вызывает у врачей сомнение в необходимости подвергать больного оперативному вмешательству, следует эту необходимость обосновать с точки зрения клинической, рентгенологической и патологоанатомической.
Главная цель операции Якобеуса заключается в устранении тех препятствий, которые мешают спадению каверны. В большинстве случаев показания к этой операции устанавливаются на основании рентгенологического исследования (снимков и просвечиваний), показывающего наличие сращений между легким и грудной стенкой.
Конечно, если бы мы подходили к операции Якобеуса только с этой точки зрения, то и тогда она себя вполне оправдывала бы, но, несомненно, не были бы использованы все те возможности, которые нам открывает эта операция.
На торакокаустику следует смотреть не только как на способ, дающий возможность путем уничтожения сращений усилить эффективность искусственного пневмоторакса, но как на прекрасный диагностический метод, позволяющий изучить состояние плевральной полости и часто правильно оценить те многочисленные клинические симптомы, которые сопутствуют искусственному пневмотораксу.
В тех случаях, когда по тем или иным причинам мы не можем уничтожить сращения, торакоскопия дает нам возможность более точно и обоснованно установить показания к другим хирургическим вмешательствам.
Если принять принцип, что хирургия туберкулеза легких есть главным образом хирургия каверны и если, кроме того, учитывать, что. искусственный пневмоторакс в подавляющем большинстве случаев накладывается тогда, когда каверна уже образовалась, то необходимо прежде всего ответить на следующие вопросы:
1) предпринимать ли операцию Якобеуса тогда, когда имеется несжатая каверна с тяжами, но бациллы Коха отсутствуют и состояние больного вполне удовлетворительное;
2) оперировать ли в тех случаях, когда рентгенологическое исследование каверны не обнаруживает, но больной продолжает выделять бациллы Коха;
3) производить ли операцию тогда, когда каверны не видно и больной не выделяет палочек Коха, но на рентгенограмме совершенно ясно определяются сращения. На все эти вопросы нужно ответить положительно.
Некоторые авторы придерживаются того мнения, что оперировать следует только тогда, когда больной выделяет бацилл Коха. С этим мнением ни в коем случае согласиться нельзя, так как отсутствие бацилл Коха при несжатой каверне представляет собой явление случайное и отмечается почти исключительно в тех случаях, когда больной или совсем не выделяет мокроты, или выделение ее ничтожно.
В настоящее время уже ни у кого не может быть сомнений в том, что если при наличии искусственного пневмоторакса имеется несжатая каверна, то такой пневмоторакс, несмотря на клиническое благополучие больного и отсутствие бацилл Коха, не может считаться эффективным и должны быть приняты все меры с целью закрытия каверны.
Ставропольский государственный медицинский университет, Центр эндохирургии и литотрипсии, Москва
ФГБОУ ВО «Ставропольский государственный медицинский университет» Минздрава России, Ставрополь, Россия
Техника выполнения лапароскопической продольной резекции желудка при морбидном ожирении
Журнал: Эндоскопическая хирургия. 2018;24(1): 38‑41
Продольная резекция желудка (ПРЖ, sleeve gastrectomy) стремительно набирает популярность в мире и занимает сегодня лидирующие позиции по частоте выполнения в России [1]. По данным национального бариатрического регистра, в структуре бариатрических вмешательств в России в 2015—2016 гг. ПРЖ составила 52—55% [2].
ПРЖ — рестриктивная операция, при которой формируется желудочная трубка объемом 100—150 мл, с сохранением антрального отдела. Механизм снижения веса обусловлен рестриктивным компонентом, а также гормональным механизмом, связанным с резким снижением содержания грелина [3].
Показания к выполнению ПРЖ
1) морбидное ожирение, ИМТ ≥40 кг/м 2 ;
2) алиментарное ожирение, ИМТ ≥30—35 кг/м 2 , в сочетании с сопутствующей патологией (сахарный диабет 2-го типа, артериальная гипертензия, апноэ сна, артралгии и т. д.);
3) возраст старше 55—65 лет в сочетании с морбидным ожирением;
4) морбидное ожирение у детей, в том числе с генетическими синдромами (синдром Прадера—Вилли).
Качество выполнения операции зависит в первую очередь от навыков и знаний хирурга, но не менее важны качество инструментов и понимание последовательности этапов операции.
Техника ПРЖ связана с соблюдением основных факторов:
— положение пациента и хирурга;
— положение троакаров и инструментов;
— знание особенностей лапароскопической анатомии брюшной полости;
— владение навыками выполнения интракорпоральных узлов.
Первое правило лапароскопии: голова хирурга, операционное поле и монитор должны быть расположены раздельно по одной оси. Второе правило: соблюдение дистанции между троакарами. Рабочие троакары должны быть расположены под прямым углом к оптике по направлению к операционному полю.
ПРЖ выполняется традиционным и медиально-латеральным способом. Отличия касаются мобилизационного этапа операции, и прежде всего порядка выполнения этапов. При традиционном способе первым этапом выполняется мобилизация желудка по большой кривизне, а затем — резекция. Другой подход — медиально-латеральный — подразумевает выполнение резекции сразу же после вскрытия сальниковой сумки, а уже затем — мобилизацию по большой кривизне резецированного участка желудка.
Медиально-латеральный подход технически более сложный, с затрудненным выполнением натяжения стенки желудка на калибровочном зонде, особенно в области пищеводно-желудочного перехода. Кроме того, зачастую осложняется визуализация зоны операции, что значительно повышает риск повреждения селезенки и коротких артерий желудка.
Описываемая техника ПРЖ предназначена для лапароскопических операций, однако последовательность этапов и их особенности постоянны как при конверсионной лапаротомии, так и при использовании систем мануально-ассистированного лапароскопического доступа.
Операция проводится под общей анестезией. Пациент располагается в положении лежа на спине с разведенными ногами. Хирург находится между ног пациента, ассистент стоит слева от пациента, второй ассистент — справа.
Если используется лишь один монитор, он располагается за правым плечом пациента так, чтобы обеспечить удобный обзор для всех членов бригады (рис. 1).
Рис. 1. Схема расположения операционной бригады при использовании одного монитора. При использовании нескольких мониторов их размещают за левым плечом и справа от пациента так, чтобы хирург и ассистент могли использовать отдельные мониторы (рис. 2). Рис. 2. Расположение операционной бригады при использовании нескольких мониторов.
Возможные варианты доступа при ПРЖ:
1) лапароскопический 5-портовый;
2) лапароскопический однопортовый;
3) лапароскопический через естественные отверстия (трансвагинальный у женщин);
Как правило, используется 5-портовый доступ. Доступ в брюшную полость получаем путем установки под визуальным контролем операционного лапароскопа с углом оптической оси 0° оптического 12—13 мм троакара по левой среднеключичной линии посередине между пупком и реберной дугой. После наложения карбоксиперитонеума 12—14 мм рт.ст. под визуальным контролем операционного лапароскопа с углом оптической оси 30˚ устанавливаются другие троакары — 12 мм (13 мм при использовании многоразового троакара) троакар по правой среднеключичной линии на одном уровне с левым троакаром и 10 мм троакар, в котором на время всей операции будет установлен лапароскоп и который вводится супраумбиликально; расстояние от пупка при этом зависит от роста и конституции пациента и определяется после визуальной оценки брюшной полости. Субксифоидально устанавливается троакар для печеночного ретрактора; 5 мм троакар для зажима ассистента устанавливается в левом подреберье несколько выше 12 мм троакара (рис. 3).
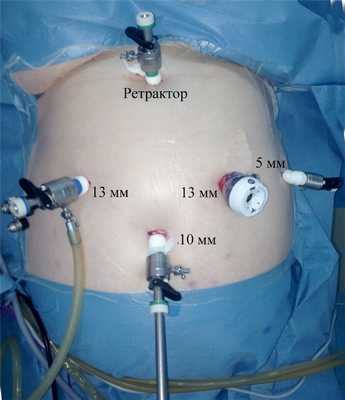
Рис. 3. Расположение троакаров при лапароскопической ПРЖ.
Если предполагаются технические трудности, связанные с недостаточной длиной инструментов при большом объеме и глубине брюшной полости или чрезмерной толщине передней брюшной стенки, линия установки троакаров может быть смещена кверху на 5—10 см.
Важным является выбор расстояния, при котором длина лапароскопа будет достаточной для подведения его к углу Гиса, в то же время троакар не должен находиться выше пилорической части желудка, иначе визуализация при мобилизации и прошивании сшивающими аппаратами в этой зоне будет крайне затруднена (рис. 4).
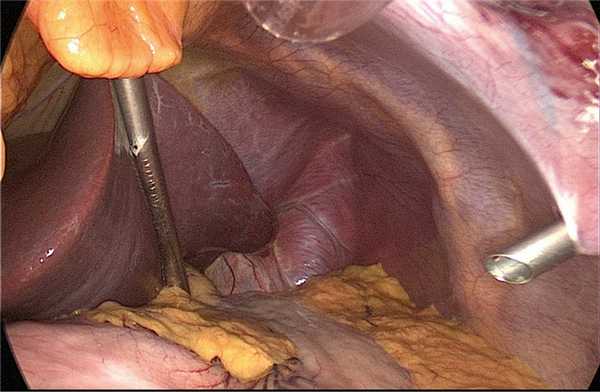
Рис. 4. Обзорный вид брюшной полости после установки троакаров. На представленном фото видно, что весь желудок расположен кпереди и кверху от лапароскопа так, что при любых манипуляциях стенка желудка и большая кривизна находятся в поле зрения, а при манипуляциях в нижней трети желудка и вблизи пилорической зоны угол между лапароскопом и передней брюшной стенкой не достигает 90˚.
После получения доступа в брюшную полость и установки троакаров пациент приводится в обратное положение Тренделенбурга. Если операционный стол обладает такой функциональностью, пациент может быть приведен в полусидячее положение. Выбор положения пациента является одним из ключевых моментов операции, так как при этом обеспечивается нужный объем карбоксиперитонеума, что позволит технически комфортно выполнять операцию (рис. 5).
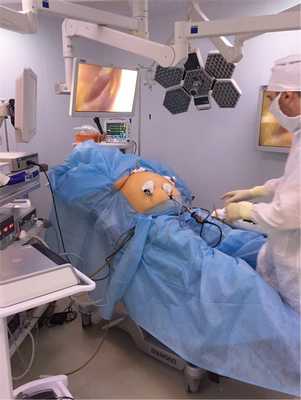
Рис. 5. Пациент находится в положении полусидя.
Через установленные порты вводятся инструменты и лапароскоп. Через субксифоидальный троакар в брюшную полость вводится печеночный ретрактор, отводится печень, и начинается первый этап операции.
Этапы операции:
1) мобилизация желудочно-диафрагмальной связки, мембраны Лаймера—Бертелли;
2) доступ в сальниковую сумку;
3) мобилизация желудка по большой кривизне;
4) укладка калибровочного зонда;
5) резекция желудка;
6) укрепление степлерной линии;
7) удаление калибровочного зонда;
8) проверка на герметичность степлерной линии;
9) удаление резецированного желудка;
10) дренирование брюшной полости (по показаниям).
Во время операции используются следующие инструменты: одноразовый сшивающий аппарат 60 мм и кассеты для него; наконечник ультразвукового диссектора; наконечник инструмента для заваривания и 2 одноразовых 12 мм троакара.
1. Мобилизация начинается с рассечения ультразвуковым скальпелем Harmonic желудочно-диафрагмальной связки слева от пищевода (рис. 6).
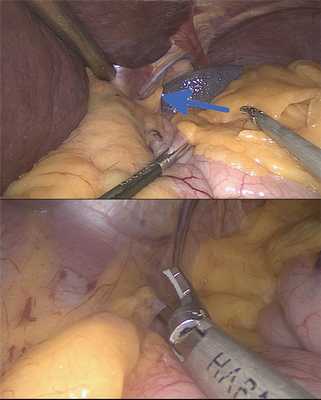
Рис. 6. Пересечение желудочно-диафрагмальной связки (отмечено стрелкой). Выполнение этой манипуляции в самом начале операции очень важно, так как нерассеченная желудочно-диафрагмальная связка затрудняет в дальнейшем мобилизацию в зоне желудочно-селезеночной связки и коротких желудочных артерий, не позволяя обеспечить необходимую тракцию. При выполнении этой манипуляции ассистент отводит ретрактором печень и натягивает дно желудка атравматическим зажимом. В качестве ретрактора можно использовать 10-мм палочку с тупым концом, который атравматично упирается в диафрагму. После использования множества различных ретракторов (Natanson, веерный ретрактор и т. д.) именно этот вариант был выбран из-за минимального риска травмы печени, вероятность которой достаточно высока, если печень изменена по типу жирового гепатоза, что практически всегда встречается при бариатрических операциях. После рассечения желудочно-диафрагмальной связки в зону угла Гиса закладывается небольшая салфетка с рентгеноконтрастной полоской, которая служит маркером в дальнейшем.
2. (2:40) Обеспечение доступа в сальниковую сумку выполняется ультразвуковым скальпелем Harmonic возле стенки нижней трети желудка. При этом хирург и ассистент обеспечивают натяжение сальника за счет тракции за него и за переднюю стенку желудка вниз и вверх соответственно.
3. (3:16) Мобилизация желудка по большой кривизне с использованием инструмента для заваривания сосудов Ligasure. Мобилизация выполняется непосредственно вдоль стенки желудка, при этом важно не оставлять участки сальника на стенке желудка, так как они легко кровоточат при тракции за них.
Мобилизация выполняется по большой кривизне от места вхождения в сальниковую сумку в сторону привратника до уровня угловой вырезки (incisura angularis) так, что до пилорического жома остается несколько сантиметров (3—6 см). При мобилизации в этой зоне необходима осторожность, чтобы не повредить правые желудочно-сальниковые сосуды.
Наибольшую сложность представляет мобилизация дна желудка в области селезенки, которая должна выполняться только под визуальным контролем, для чего иногда приходится применять удлиненную оптику, а также удлиненные инструменты. После пересечения желудочно-селезеночной связки при правильной мобилизации визуализируется предварительно заложенная салфетка, которая является маркером окончания мобилизации в этой зоне. Пересекаются короткие желудочные сосуды, полностью освобождается дно желудка по задней стенке. Затем выделяется угол Гиса, при этом производится активная ревизия на наличие грыжи пищеводного отверстия диафрагмы, которая устраняется в случае обнаружения путем задней крурорафии. Мобилизация считается завершенной при полностью освобожденном дне желудка (рис. 7).
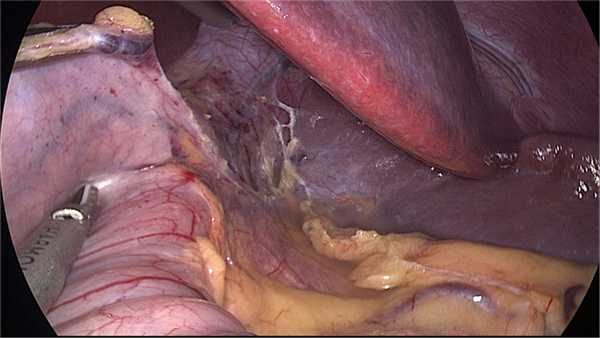
Рис. 7. Мобилизованное дно желудка.
После полной мобилизации по большой кривизне необходимо проконтролировать заднюю стенку желудка — иногда она соединяется спайками с поджелудочной железой. Спайки и сращения недопустимы, так как при прошивании они могут привести к формированию либо слишком широкого «рукава», либо «рукава» неправильной спиралевидной формы, что увеличивает риск возникновения стеноза.
4. (11:35) После мобилизации желудка анестезиолог вводит калибровочный зонд диаметром 36—38 Fr, на котором формируется «рукав». Использование калибровочного зонда обязательно, так как он помогает избежать сужения и стенозирования «рукава». Выбор диаметра калибровочного зонда обусловлен тем, что с увеличением диаметра уменьшается риск несостоятельности, а статистически значимой разницы снижения веса не происходит. Конец зонда вводится в привратник, а сам зонд укладывается по малой кривизне.
5. (12:20) Резекция желудка выполняется линейным сшивающим аппаратом с изменяемой кривизной дистальной части, что позволяет обеспечить наилучшее натяжение желудка на калибровочном зонде и равномерный диаметр остающейся желудочной трубки.
Натяжение желудка проводят хирург и ассистент, при этом необходимо строго следить за тем, чтобы натяжение было равномерным и ни одна из стенок не заходила в сшивающий аппарат бо́льшей порцией, чем другая, так как это может привести к перекруту (kin-king) желудочной трубки и повышает риск несостоятельности степлерной линии.
Перед каждым прошиванием обязательно обеспечивается рекомендованная производителем кассет экспозиция в 15—30 с, а также производится визуальный контроль всей длины кассеты как по передней, так и по задней стенке желудка, для того чтобы исключить попадание в кассету складки желудка или других тканей (рис. 8).
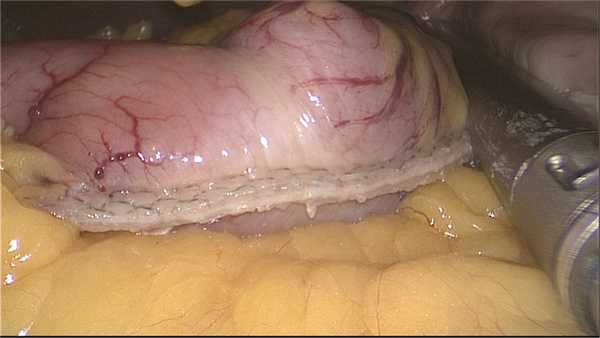
Рис. 8. Равномерно сформированная линия резекции.
Для формирования степлерной линии можно использовать сочетание кассет с различной высотой скрепок, при этом более высокие скрепки применяются в начале прошивания, т. е. в дистальном отделе желудка, а более низкие — в конце, в проксимальных отделах. Операция также может быть выполнена с применением одной высоты скрепок — 3,8 мм («золотая» кассета).
При прошивании в зоне угла Гиса особое внимание уделяется тому, чтобы исключить формирование резидуального кармана, который может образоваться при недостаточном натяжении дна желудка (рис. 9).
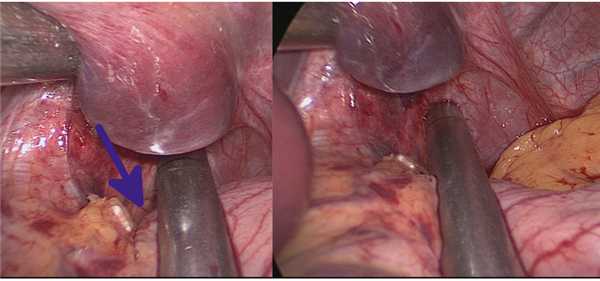
Рис. 9. Пересечение желудка в зоне пищеводно-желудочного перехода (стрелкой указан карман, формирующийся при недостаточном натяжении дна желудка).
6. (17:14) Как правило, степлерную линию можно не укреплять после резекции, но многие хирурги предпочитают усиливать ее дополнительными серозно-мышечными швами, что, возможно, снижает риск возникновения несостоятельности степлерной линии и помогает остановить кровотечение. В большинстве же случаев кровотечение из степлерной линии останавливается либо кратковременным тампонированием салфеткой, либо клипированием. Возможно проведение проверки кровотечения путем кратковременного подъема артериального давления пациента, что снижает частоту возникновения внутрибрюшного кровотечения в послеоперационном периоде. Применение электрической энергии в зоне степлерной линии строго запрещено, так как ток при этом распространяется по всей длине степлерной линии, а температура в зоне контакта скрепки и коагулятора достигает 1000 °C, что может привести к несостоятельности шва.
7. (23:10) Операция завершается удалением калибровочного зонда из просвета культи желудка под визуальным контролем, при этом выполняется активный осмотр «рукава».
8. Можно убедиться в герметичности введением в культю желудка метиленового синего.
9. (23:25) Препарат извлекается через 25-мм ранорасширитель, устанавливаемый на месте 12-мм троакара слева.
10. Операция завершается установкой дренажа вдоль степлерной линии по показаниям.
Правила хирургической техники при выполнении ПРЖ
1. Используется калибровочный зонд, оптимальный размер бужа 36—40 Fr.
2. Резекцию можно начинать только при полной мобилизации дна желудка и пересечении коротких желудочных сосудов.
3. Резекция должна начинаться (первое прошивание) в 2—6 см от пилоруса.
4. Используются кассеты с высотой скобы не менее 1,5 мм.
5. При прошивании последней кассеты нужно избегать наложения сшивающего аппарата на пищеводно-желудочный переход.
6. Растяжение стенок желудка должно быть равномерным относительно оси желудка с целью профилактики перекрута.
7. Ушивание степлерной линии производится только при наличии зонда в просвете желудка с целью профилактики уменьшения объема желудочной трубки.
Техника ПРЖ. Видео доступно по ссылке:
Авторы заявляют об отсутствии конфликта интересов.
Сведения об авторах
Читайте также:
- Возбудитель первичного амебного менингоэнцефалита. Диагностика амебного менингоэнцефалита. Лечение амебного менингоэнцефалита.
- Вторичные гемофагоцитарные лимфогистиоцитозы (ВГС) - клиника, диагностика
- Внутренние органы при сапонификации. Торфяное дубление организма
- Результаты азигопортального разобщения при варикозе вен пищевода. Летальность
- Венерическая лимфогранулема. Болезнь Николя-Фавра. Возбудитель венерической лимфогранулемы. Клиника венерической лимфогранулемы.
