Результаты азигопортального разобщения при варикозе вен пищевода. Летальность
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Больница Центросоюза Российской Федерации, Москва, кафедра эндоскопической хирургии ФДПО ФГБОУ ВО «МГМСУ им. А.И. Евдокимова» Минздрава России, Москва, Россия
Кафедра эндоскопической хирургии факультета последипломного образования Московского государственного медико-стоматологического университета
кафедра эндоскопической хирургии ФПДО МГМСУ
Эндоскопические методы лечения больных с варикозно-расширенными венами пищевода и желудка
Журнал: Эндоскопическая хирургия. 2017;23(3): 49‑53
Портальная гипертензия — это патологический симптомокомплекс, обусловленный повышением кровяного давления в системе воротной вены, вызывающий нарушение оттока крови по портальным сосудам и печеночным венам, в конечном итоге формирующий варикозную трансформацию вен пищевода и желудка. Все это является следствием развития портокавальных анастомозов: гастроэзофагеальных и забрюшинных; анастомозов между нижней полой веной и прямокишечным сплетением; левой ветвью воротной вены и сосудами передней брюшной стенки. Однако наиболее опасен гастроэзофагеальный коллатеральный путь ввиду высокого риска кровотечений из варикозно-расширенных вен пищевода и желудка. Кровотечение является самым грозным осложнением портальной гипертензии. Варикозное расширение вен пищевода и желудка встречается у 90% больных циррозом печени, в 60% случаев оно осложняется кровотечениями. При первом эпизоде кровотечения летальность достигает 30—50% [1].
Принято выделять 3 основных метода лечения портальной гипертензии. Первый метод лечения подразумевает проведение медикаментозной терапии (нитраты, гормоны гипоталамуса, гипофиза, гонадотропины и их антагонисты, альфа- и бета-адреноблокаторы) с целью снижения давления в системе воротной вены. Второй метод профилактики кровотечения из варикозно-расширенных вен пищевода и желудка заключается в хирургических операциях, выполняемых открытым доступом, направленных на создание портокавальных анастомозов (дистальный спленоренальный анастомоз, проксимальный спленоренальный анастомоз, Н-спленоренальный анастомоз). Третий метод профилактики кровотечений из варикозно-расширенных вен пищевода и желудка подразумевает операции по разобщению портокавальных связей (деваскуляризация пищевода и желудка, транссекция пищевода и желудка, прошивание варикозных узлов желудка и нижней трети пищевода, резекция пищевода и желудка). В эту группу также входят малоинвазивные вмешательства, которые на сегодняшний день зарекомендовали себя как более эффективные и малотравматичные. К данным операциям относятся эндоскопическое склерозирование и лигирование варикозно-расширенных вен пищевода и желудка, а также эндоваскулярные операции [2—4].
Целью всех вышеперечисленных оперативных вмешательств являются предупреждение и ликвидация кровотечения из варикозно-расширенных вен пищевода и желудка. Хирургические открытые оперативные вмешательства слишком травматичны, не направлены на радикальное лечение портальной гипертензии и не всегда благополучно переносятся пациентами. Эндоскопические малоинвазивные вмешательства также не носят радикального характера, но они менее травматичны, а также более надежны и эффективны, чем хирургические открытые операции.
Эндоскопическое склерозирование варикозно-расширенных вен пищевода впервые описано C. Crafoord и P. Frenckner в 1939 г. В дальнейшем W. Walters и R. Macbeth продолжили разработку методики, вводя в просвет варикозной вены 5% раствор Sodiummorrahuate [5]. Оперативная техника эндоскопического склерозирования варикозно-расширенных вен заключается во введении определенного склерозантаинтравазально, паравазально либо сочетая оба способа, посредством иглы, проведенной через инструментальный канал эндоскопа. Для интравазального введения чаще всего используется тетрадецилсульфат натрия или 3% раствор этоксисклерола, последний наиболее часто используется при паравазальном склерозировании. Склерозант вызывает воспаление интимы вены, что приводит к образованию внутрисосудистого тромба, а затем к формированию соединительной ткани на месте тромба [6, 7]. В 70—88% случаев удается достичь надежного гемостаза. Однако, по данным литературы, в 6% случаев методика оказывается неэффективной [6, 8].
Эндоскопическое склерозирование варикозно-расширенных вен характеризуется относительно большим количеством постсклеротических реакций и осложнений. Постсклеротические реакции возникают как ответ организма на введенный склерозант. Чаще всего это гипертермия (около 6% случаев), кратковременные и самостоятельно купирующиеся эпизоды загрудинных болей и дисфагии. Постсклеротические осложнения возникают, как правило, через продолжительное время после процедуры склерозирования. Наиболее значимы такие осложнения, как ранний и поздний рецидив кровотечения (16%), изъязвления слизистой оболочки пищевода (14%), стриктуры пищевода с последующим стенозированием (12%), плевральные осложнения (9%), некроз слизистой пищевода и его перфорация (6, 25%), перикардиты (0,4%) [5, 9, 10]. По мнению А.Г. Шерцингера и соавт. [11], эндоскопическая инъекционная склеротерапия является наиболее целесообразным и эффективным эндоскопическим вмешательством при кровотечениях из варикозно-расширенных вен пищевода и желудка. По данным авторов, гемостатический эффект при данной операции в пищеводе составил 93,9%, а в желудке — 100%. Однако, несмотря на такой результат, учитывая большое количество осложнений после подобного вмешательства, многие специалисты предпочитают выполнять эндоскопическое лигирование варикозно-расширенных вен пищевода и желудка.
Эндоскопическое лигирование варикозно-расширенных вен пищевода впервые выполнил G.V. Stiegmannв 1986 г., использовав латексные кольца. Основные показания для эндоскопического лигирования вен пищевода: варикозно-расширенные вены пищевода III степени (более 10 мм в диаметре по классификации N. Soehendra), продолжающееся кровотечение, профилактика первого эпизода кровотечения (первичная профилактика), а также рецидива кровотечения (вторичная профилактика) из варикозно-расширенных вен пищевода. Основное условие для лигирования латексными кольцами — локализация варикозно-расширенных вен в пищеводе [7, 12].
Эндоскопическое лигирование варикозно-расширенных вен пищевода выполняют с использованием многозарядного лигатора, который состоит из нескольких частей: дистального колпачка с кольцами, винта-рукоятки, с помощью которого сбрасываются кольца, и соединяющей их металлической или капроновой струны, которая проводится через инструментальный канал [13]. На сегодняшний день на медицинском рынке не так много фирм, производящих лигаторы, наиболее известны среди них компании «Wilson-Cook» и «Boston Scientific». Выпускаемые ими лигаторы предназначены только для лигирования варикозных вен пищевода.
Стандартная процедура лигирования заключается в том, что эндоскоп с колпачком на дистальном конце проводится к варикозному узлу, лигирование начинают с кардиоэзофагеального перехода, чуть выше зубчатой линии, и продолжают в шахматном порядке по спирали. После появления «красного пятна» при аспирации варикозного узла в колпачок сбрасывают лигирующее кольцо. Манипуляцию повторяют до наложения лигирующих колец на все видимые варикозные узлы. Обычно накладывают 6—10 колец. Через 6—7 сут начинается отторжение тромбированных и некротизированных узлов, на их месте образуются поверхностные язвы, которые заживают в течение 3 нед. В последующем образуются рубцы, не приводящие к стенозированию пищевода. При отсутствии осложнений в обязательном порядке через месяц проводят контрольную эзофагогастродуоденоскопию [13, 14].
Говоря об эндоскопическом лигировании варикозно-расширенных вен желудка, необходимо отметить, что нельзя лигировать вены желудка латексными кольцами, так как они отторгаются через 36—48 ч, а в местах их наложения образуются язвы с последующим развитием профузного кровотечения. Кроме того, при наличии варикозных вен в фундальном отделе желудка (II тип), изолированных варикозных вен желудка без варикозных вен пищевода (III тип) и эктопических узлов тела желудка и антрального отдела (IV тип) эндоскопическое лигирование технически выполнить невозможно. В связи с этим для лигирования варикозно-расширенных вен желудка используют специально изготовленные нейлоновые петли диаметром 11 и 13 мм [12, 15].
Эндоскопическое лигирование варикозно-расширенных вен пищевода и желудка характеризуется меньшим количеством осложнений, чем эндоскопическое склерозирование. Наиболее часто встречаются аллергическая реакция на латекс, дисфагия и боли при глотании в первые дни после операции, незначительные геморрагии из поверхностных язв на фоне отторжения некротизированных узлов. Обычно данные осложнения возникают в раннем послеоперационном периоде и купируются самостоятельно. Однако дисфагия и болевые ощущения при приеме пищи после эндоскопического лигирования варикозно-расширенных вен пищевода у ряда пациентов могут сохраняться длительное время, снижая качество жизни [12].
Эндоскопическое лигирование варикозно-расширенных вен пищевода и желудка позволяет остановить продолжающееся кровотечение в 78—95% случаев, однако рецидив кровотечения отмечается у 28—35% пациентов [16]. E. Mostafa и соавт. [17] провели исследование, при котором изучалась частота ранних рецидивов кровотечения после эндоскопического лигирования, а также причины их возникновения. По данным авторов, частота повторных кровотечений после эндоскопического лигирования составила 20%. Основными причинами рецидива являлись: развитие спонтанного бактериального перитонита (p<0,0007), спленомегалии (p=0,02), наличие портосистемных коллатералей (p=0,006), анемии (p=0,017), крупных варикозных вен с «красными маркерами» — признаками васкулопатии (p<0,0001).
Существует также методика, сочетающая эндоскопическое лигирование и склерозирование. Применение сочетанной методики обусловлено наличием как мелких, так и крупных варикозно-расширенных вен у пациента. При этом эндоскопическое склерозирование используется для небольших варикозных вен, так как введение большего количества склерозанта в более крупные стволы приводит очень часто к постсклеротическим изъязвлениям, а эндоскопическое лигирование используется для крупных варикозных стволов, поскольку аспирация более мелких варикозных вен представляет определенные технические трудности [18].
На сегодняшний день ближайшие и отдаленные результаты эндоскопического лигирования варикозно-расширенных вен пищевода и желудка являются достаточно обнадеживающими. Многими авторами доказана более высокая эффективность методики эндоскопического лигирования, чем методики инъекционной склеротерапии, которая проявляется в снижении количества рецидивов кровотечения в среднем на 20% и летальности в среднем на 10—15% [19]. Следует также отметить, что для достижения полной эрадикации варикозных вен при использовании эндоскопического лигирования требуется проведение меньшего числа сеансов, чем при эндоскопической инъекционной склеротерапии. Процент эрадикации варикозных вен при лигировании (70—80%) выше, чем при инъекционной склеротерапии (40—60%). Такие осложнения, как аспирационная пневмония, перфорация и стриктуры пищевода, практически отсутствуют при эндоскопическом лигировании. Поэтому многоэтапная склеротерапия не является «операцией выбора» при кровотечениях, а представляет собой дополнительное пособие в комбинации с эндоскопическим лигированием [13, 20].
S. Ali и соавт. [21] сравнили результаты лечения 64 пациентов, которым проводилась эндоскопическая склеротерапия, и 60 пациентов после эндоскопического лигирования. Частота развития гипертермической реакции после эндоскопической склеротерапии была значительно выше, чем после эндоскопического лигирования (n=17 (26,6%) против n=6 (10,0%); р=0,02). Частота рецидива кровотечения в отдаленном периоде была чуть выше после выполнения эндоскопической склеротерапии (28,1% против 23,3%; р=0,54), что не составило статистически значимой разницы; частота элиминации варикозных вен после эндоскопической склеротерапии была несколько ниже, чем у больных, перенесших эндоскопическое лигирование (79,7% против 86,7%; р=0,30). Также не было статистически значимых различий в уровне летальности (1,6% против 3,3%; р=0,61) и выживаемости (71,9% против 78,3%; р=0,41) на отдаленных сроках наблюдения.
Стоит отдельно выделить группу пациентов, которые госпитализируются в стационар с продолжающимся кровотечением из варикозно-расширенных вен пищевода и желудка. На сегодняшний день накоплен большой опыт лечения подобных пациентов. В соответствии с Национальными клиническими рекомендациями по лечению кровотечений из варикозно-расширенных вен пищевода сформирован алгоритм лечения кровотечения [7]. Считается, что выполнять эндоскопический гемостаз при продолжающемся кровотечении (эндоскопическое лигирование и склерозирование вен пищевода и желудка) нецелесообразно из-за технических сложностей визуализации источника кровотечения [7, 22]. Однако И.И. Дзидзава и соавт. [23] в своем исследовании показали эффективность эндоскопического лигирования при кровотечениях из варикозно-расширенных вен пищевода у 92,9% (n=26), хотя ранний рецидив кровотечения после лигирования наблюдался в 15—24% наблюдениях. По мнению авторов, столь высокая частота ранних рецидивов кровотечения обусловлена неполноценной эрадикацией варикозных вен из-за плохого эндоскопического обзора при выполнении операции. В связи с этим авторы рекомендуют на 7—10-е сутки после достижения гемостаза выполнять контрольную эзофагогастродуоденоскопию и при необходимости лигировать оставшиеся варикозные вены.
По многочисленным данным, при остром кровотечении рекомендовано выполнять баллонную тампонаду пищевода и желудка зондом-обтуратором Сенгстакена—Блэкмора, а также проводить антибактериальную, вазоактивную и инфузионно-трансфузионную терапию. В последнее время для временной остановки кровотечения из варикозно-расширенных вен пищевода как альтернатива зонду Сенгстакена—Блэкмора все чаще используется металлический покрытый самораскрывающийся стент Даниша (диаметр — 25 мм, длина — 135 мм, диаметр горловины — 30 мм). Для его установки не требуется эндоскопического или рентгенологического контроля. Надежный гемостаз осуществляется за счет компрессии варикозных вен и может быть достигнут в сроки от 2 до 14 дней. Пероральное питание может быть возобновлено сразу после установки стента. Рядом авторов показано преимущество его использования — большая эффективность и меньшее количество осложнений по сравнению с зондом Сенгстакена—Блэкмора [13, 24—26].
Несмотря на то что при использовании клеевых композиций частота рецидивов достигает 35—40%, данный метод считают более надежным и эффективным, чем эндоскопическая склеротерапия, и на сегодняшний день он рассматривается и как метод вторичной профилактики рецидива кровотечения из варикозных вен желудка [30].
Следует отметить, что прогностически неблагоприятным фактором у больных с кровотечением из варикозно-расширенных вен пищевода и желудка является рецидив кровотечения. М.М. Винокуров и соавт. [31] провели сравнение результатов лечения двух групп больных. В первой группе — 50 пациентов — остановка кровотечения проводилась эндоскопическими методами, во второй группе — 145 пациентов — гемостаз проводился традиционными методами (установка зонда-обтуратора, консервативная терапия и хирургическое вмешательство). Анализ результатов данного исследования показал, что частота рецидива кровотечения в первой группе составила 40% и во второй группе — 75%. Применение эндоскопической методики позволило достоверно чаще добиваться остановки кровотечения (12, 4% против 37%). Также авторами было показано, что эндоскопические вмешательства, выполняемые в экстренном порядке, снижают вероятность рецидива кровотечения с 54,5 до 18% и уровень летальности с 33,1 до 8,0%.
Таким образом, эндоскопическая склеротерапия и эндоскопическое лигирование варикозно-расширенных вен пищевода и желудка обеспечивают хорошие результаты лечения, являются достаточно безопасными, эффективными, технически легко выполнимыми и могут применяться при кровотечениях из варикозно-расширенных вен пищевода и желудка с минимальными осложнениями. Данные методики устраняют необходимость проведения повторных сеансов лечения в краткосрочной перспективе. С другой стороны, существует резерв для улучшения показателей качества жизни пациентов в послеоперационном периоде и для дальнейшего сокращения частоты рецидивов кровотечений. Важно также помнить, что решение клинической проблемы лечения и профилактики кровотечений из варикозно-расширенных вен пищевода и желудка требует слаженных действий специалистов различных специальностей: гепатологов, эндоскопистов, хирургов.
Результаты азигопортального разобщения при варикозе вен пищевода. Летальность
Частота осложнений и летальность после азигопортального разобщения во многом зависят от сроков проведения операции и ее объема, обширности зоны деваскуляризации, уровня и способа транссекции. Harada и соавт., обладающие наибольшим опытом эзофагокардиоэктомии при варикозно расширенных венах пищевода, зафиксировали госпитальную летальность 5,2%. В клинике доктора Z. Duan летальность после операции Hassab составляла 8%.
По данным М. Sugiura и S. Futagawa, после выполнения операции по оригинальной методике летальность при профилактических операциях равнялась нулю, при элективных операциях — 1,7%, при срочных — 20%.
Менее обнадеживающими выглядят результаты этой операции у других авторов. Так, по данным G. Battaglia и соавт. (1996 г.), общая летальность после абдоминального этапа операции Sugiura составила 19,8%: при элективных операциях — 10%, при срочных — 27,2%.
По другим данным частота осложнений после операции Sugiura достигает 38—46%, многие из них существенно влияют на структуру послеоперационной летальности, что заставляет ученых разных стран искать пути решения проблемы. Так, М. Selzner из Цюрихского университета докладывает о результатах выполнения модифицированной операции Сугиуры (абдоминальный доступ, без спленэктомии). Все пациенты, кроме умерших в раннем послеоперационном периоде (7%), пережили 4 года.
Модификация операции Sugiura предложена Индийскими учеными: расширенная трансабдоминальная эзофагогастральная деваскуляризация комбинирована с чрезстеночным лигированием пищеводных и желудочных вариксов, была выполнена у больных с кровотечением в анамнезе. Модифицированная операция Sugiura длилась меньше по времени и позволила избегать осложнений, связанных с пищеводной транссекцией и наложением анастомоза.
Летальности в ближайшем послеоперационном периоде не было. Через 12 месяцев у 31% пациентов обнаружены варикозно расширенные вены.
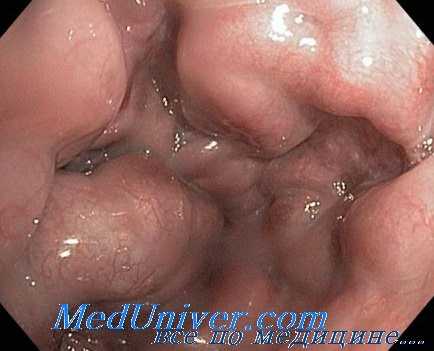
Специалисты Сеульского Университета при кровотечениях из фундальных ВРВ использовали фундэктомию + АПР. Общая смертность составила 26,1% (18,2% в послеоперационном периоде среди больных, перенесших отсроченное вмешательство, 33,3% — среди оперированных в экстренном порядке).
Следует отметить, что самая высокая летальность была после срочных операций азигопортального разобщения. При операциях азигопортального разобщения, выполненных в качестве первичной профилактической меры, в послеоперационном периоде летальность отсутствовала во многих исследованиях.
Успех операции зависит также и от степени печеночноклеточной компенсации. Так, по данным H.S. Han (2004 г.), общая смертность составила 26,1%. Уровень смертности в зависимости от класса А, В, С по Child-Pugh был соответственно 0,9-7, 23,1 и 50,0%.
Хорошие результаты элективного азигопортального разобщения у пациентов с ВРВ пищевода и желудка при компенсированной и субкомпенсированной функции печени получены Е. Kassa с соавт.. 82% его пациентов были с кровотечением из варикозных вен. Класс А по Child-Pugh был у 63,6%, В — у 36,6%, С — у 0. В послеоперационном периоде умерло 12%, рецидив кровотечения был в 3% случаев.
У больных с компенсированной функцией печени при угрозе развития пищеводно-желудочного кровотечения следует предпочесть профилактическое хирургическое лечение.
Отдельные исследователи отмечают улучшение печеночной функции после проведения операций азигопортального разобщения. Так, Y.G. Ма (2004 г.) модифицированным методом Sugiura оперированы 160 пациентов. Операционная летальность отсутствовала. У 96 из 116 пациентов класса В по Child-Pugh (82,8%) функция печени улучшилась по сравнению с предоперационной до класса А в течение 3 месяцев после операции.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Показания для азигопортального разобщения при варикозе вен пищевода. Осложнения
Для операции азигопортальной резекции больных отбирают по следующим критериям: возраст до 65 лет; отсутствие асцита, энцефалопатии и кахексии; уровень альбумина выше 30 г/л; уровень билирубина ниже 20 мг/л, показатель теста с индоциановым зеленым менее 40%. Иными словами, пищеводная транссекция может быть выполнена безопасно у большинства больных с циррозом печени функциональных классов А и В по Child-Pugh.
Одним из основных критериев эффективности операций азигопортальной резекции, как и других вмешательств при ВРВП и ПГ, служит выживаемость в течение 1, 3, 5 и 10 лет.
Главными факторами, влияющими на данный показатель, служат характер заболевания, обусловивший появление варикозно расширенных вен пищевода, функциональный класс по классификации Child-Pugh, рецидивы кровотечений из варикозно расширенных вен пищевода, возникновение гепатоцеллюлярного рака на фоне цирроза печени.
К сожалению, идеального хирургического способа эрадикации варикозно расширенных вен не существует. При операциях азигопортальной резекции сохраняется высокая частота развития грозных осложнений, что закономерно приводит к высокой (40—50%) послеоперационной летальности.
Одним из неблагоприятных результатов транссекции считается кровотечение. Вероятность рецидива кровотечений в раннем после операционном периоде составляет по разным данным от 2—6% до 8— 20%, достигая 30%.
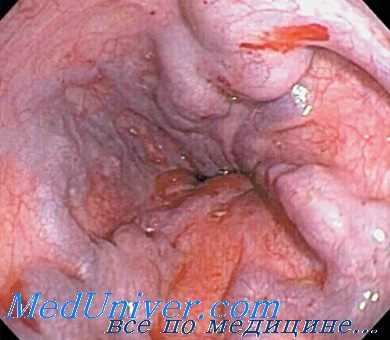
Возникновение рецидива гастроэзофагеального кровотечения на 3—5-е сутки после прошивания ВРВ пищевода и желудка, выполненного как в экстренном, так и плановом порядке, по данным А.К. Ерамишанцева (1997 г.) и А.Г. Шерцингера с соавт (1999 г.)., в большинстве случаев связано с прорезыванием шовных лигатур на варикозных венах. Этому способствует перистальтика пищевода, усиливающаяся при глотательных движениях во время начала кормления больных в раннем послеоперационном периоде.
Причина рецидива в более поздние сроки (6—12-е сутки) — эрозивно-язвенные поражения в результате трофических нарушений слизистой пищевода и желудка. Причем в генезе этих расстройств важная роль принадлежит гнойно-септическим осложнениям, прогрессированию печеночной и сердечной недостаточности.
По данным G. Кауе и соавт., наиболее частой (49%) причиной рецидива кровотечения после транссекции пищевода с применением аппаратов являются единичные или циркулярные эрозии по линии механического шва. Изучение взаимосвязи микроциркуляции в желудке и появления эрозий в пищеводе и желудке после трансабдоминальной транссекции пищевода обнаружило уменьшение кровотока в слизистой на 30% во время операции и на 20% через 4 недели после нее. Эндоскопические признаки нарушения трофики слизистой (петехии, эрозии) обнаружены у всех больных со снижением кровотока в слизистой более чем на 20% (Y. Mitarai).
Частота свищей пищевода после азигопортальной резекции с транссекцией пищевода составляет от 3 до 18%. Существенного влияния на частоту данного осложнения использования ручного или механического шва не установлено. С учетом высокого потенциального риска развития осложнений транссекция пищевода может считаться противопоказанной после предоперационной эндоскопической склеротерапии ВРВП.
К неблагоприятным результатам транссекции пищевода относится дисфагия, частота которой составляет от 2,4 до 35%. Это осложнение может носить функциональный характер (результат обширной деваскуляризации дистального отдела пищевода) или быть органической природы вследствие стеноза анастомоза (в ряде случаев требует проведения дилатации анастомоза).
Печеночная энцефалопатия (ПЭ) — достаточно редкое осложнение после АПР (от 3 до 8%). Возникает значительно реже, чем после формирования ПКА.
Хирургия портальной гипертензии. Эффективность азигопортального разобщения
Модифицированные методы разобщения гастроэзофагеального коллектора могут быть успешно использованы у больных с портальной гипертензией, осложненной ВРВП, как альтернатива портосистемному шунтированию.
Многочисленные модификации операций по разобщению портокавальных коллатералей в гастроэзофагеальной зоне весьма разнообразны по объему и технике выполнения и включают в различных сочетаниях: трансэзофагеальное или трансгастральное прошивание варикозных вен; деваскуляризацию кардии желудка (свода, проксимальной его части или верхней 2/3) и абдоминальной части (нижней трети) пищевода; транссекцию пищевода с помощью сшивающих аппаратов; спленэктомию; ваготомию.
Для достижения лучших результатов лечения перспективно расширение объема разобщающей операции и арсенала способов воздействия на патогенетические механизмы возникновения кровотечения из ВРВ. Этого можно достичь в случаях планового хирургического вмешательства.
Среди многочисленных модификаций операций азигопортального разобщения за рубежом чаще других применяются методика Hassab, операция Sugiura— Futagawa и проксимальная резекция желудка.
Один из наиболее популярных методов азигопортального разобщения в лечении варикозно расширенных вен пищевода — способ оперативного вмешательства, предложенный в 1973 г. М. Sugiura и S. Futagawa. Он получил в Японии название «метод Токийского университета», а в остальных странах известен как операция Sugiura. При этой операции достигается наиболее полное разобщение портальной и кавальной систем.
Вмешательство состоит в обширной параэзофагеальной и парагастральной деваскуляризации, проводимой из торакального и абдоминального доступов.
При торакальном (первом) этапе проводятся деваскуляризация пищевода от кардии до нижней легочной вены и перевязка коммуникантных вен, связывающих варикозные вены и параэзофагеальное сплетение, а также пересечение пищевода на уровне диафрагмы с последующим его сшиванием.
Во время абдоминального (второго) этапа выполняются спленэктомия, деваскуляризация абдоминального отдела пищевода, кардиального отдела желудка и его дна, селективная ваготомия и пилоропластика. При одномоментной операции абдоминальный этап осуществляется трансдиафрагмально.
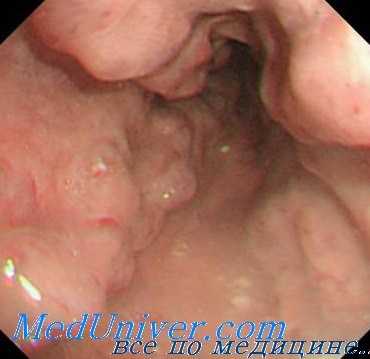
Важный момент вмешательства — проведение деваскуляризации непосредственно у пищевода, что позволяет сохранить коллатеральное кровообращение в параэзофагеальных и коронарных венах.
Вопрос о сохранении или перевязке коронарной вены желудка остается одним из дискутируемых вопросов разобщающих операций. Принцип ее сохранения заложен изначально в оригинальную методику операции Sugiura. Развивая эту концепцию, Y. Idezuki и соавт. считают, что данный этап теоретически важен в профилактике рецидива ВРВП, так как сохраненные параэзофагальные и медиастинальные коллатерали выполняют функцию спонтанных селективных портокавальных шунтов, функционирование которых подтверждено на основании изучения параметров кровотока по непарной вене до и после АПР (N. Kokudo и соавт., 1989 г.).
В ряде хирургических клиник придерживаются противоположного мнения, считая, что только прекращение кровотока по коронарной вене желудка предупреждает рецидивы ВРВП и появление ВРВЖ. По данным Н. Orozco и соавт. (1992 г.), при выполнении АПР необходимо сохранять только портосистемные коллатерали вне эзофагокардиальной области. Необходимость перевязки коронарной вены желудка обосновывается и с позиции изменения портального кровотока после включения данного этапа в операции АПР, поскольку гепатофугальный компонент по коронарной вене достигает 120—250 мл/мин. Перевязка коронарной вены увеличивает объемный портальный кровоток с 742,62 + 141,73 до 986,82 ± 134,58 мл/мин, а скорость кровотока в портальной системе увеличивается с 10,14 ± 2,13 до 13,41 ± 1,9 см/с (D.C. Zhong).
Учитывая основной недостаток — вскрытие двух полостей (брюшной и плевральной) и большой объем операции А.А. Шалимов и В.Н. Полупан разработали менее травматичное вмешательство с применением циркулярного сшивающего аппарата. После вскрытия брюшной полости осуществляли деваскуляризацию абдоминального отдела пищевода и дна желудка, проводили гастротомию, в пищевод вводили циркулярный сшиватель органов, непосредственно над пищеводно-желудочным переходом накладывали лигатуру, которая погружала стенки органа между головкой и телом аппарата. Пищевод пересекали и прошивали механическим швом. Учитывая большую вероятность развития несостоятельности швов, линию анастомоза дополнительно укрывали серозно-мышечными швами.
Придя к заключению, что венозный кровоток в кардиоэзофагеальной зоне при развитии флебэктазий происходит в основном на участке, ограниченном вверху нижними легочными венами, а внизу — границей между проксимальным и дистальным отделами желудка, А.А. Шалимов и соавт. проводили деваскуляризацию проксимальной половины желудка и абдоминального отдела пищевода, стволовую ваготомию, сагиттальную диафрагмотомию над пищеводом и, натягивая желудок, осуществляли деваскуляризацию пищевода до уровня нижней легочной вены слева, пересекая все сосуды, идущие к полому органу. После продольного рассечения привратника выполняли транссекцию пищевода с помощью аппарата. Операцию заканчивали пилоропластикой по Гейнеке—Микуличу, ушиванием диафрагмы узловыми швами и фундопликацией по Ниссену.
Используют и более щадящий вариант вмешательства: транссекцию пищевода после его деваскуляризации на протяжении 8—10 см либо трансабдоминальную транссекцию пищевода с одномоментным наложением аппаратного эзофагоэзофаго- или эзофагогастроанастомоза.
Оригинальный вариант тотального разобщения естественных портокавальных анастомозов гастроэзофагеального коллектора предложен Ф.Г. Назыровым и соавт.. Техника операции заключается в следующем: после щадящей мобилизации с сохранением кровотока желудка вплоть до абдоминального отдела пищевода проводят сшивание передней и задней стенок желудка в области кардии насквозь через все слои аппаратом «Ушиватель органов-60» на всем протяжении от большой до малой кривизны. Затем накладывают передний эзофагогастроанастомоз между абдоминальным отделом пищевода и кардиальным отделом желудка в обход танталовых скобок с камерой анастомоза более 3 см. При этом пищевод рассекают в продольном направлении, а кардию — в поперечном. Операцию завершают фундопликацией.
Помимо осуществления фундопликации А.А. Шалимов с соавт. с целью улучшения арефлюксных свойств пищеводно-желудочного перехода циркулярно прошивали кардию П-образными швами.
Подобным образом поступают Н.Я. Калита и О.Т. Котенко, прошивая варикозные вены в зоне пищеводно-желудочного перехода П-образными узловыми швами, проходящими через все слои пищевода и желудка.
«Арефлюксная» методика разработана в клинике В.И. Оноприева, в которой основную роль в развитии кровотечений из варикозных вен отводят фактору кислотной агрессии.
К выполнению фундопликации приводит стремление предотвратить заброс желудочного содержимого в пищевод, защитить пищеводный анастомоз от его воздействия и предупредить развитие воспалительных изменений слизистой оболочки. Однако некоторые авторы не рекомендуют после азигопортального разобщения проводить пластику пищеводного отверстия диафрагмы и фиксацию эзофагокардиального перехода, указывая на отсутствие достоверных сведений, подтверждающих явные преимущества выполнения различных типов фундопликации после разобщающих вмешательств.
При обширной парагастроэзофагеальной деваскуляризации, как правило, пересекают блуждающие нервы по типу стволовой или селективной ваготомии, заканчивая при этом операцию пилоропластикой, гастроэнтероанастомозом или пилородилатацией. Совершенствование вмешательства привело к выполнению селективной проксимальной ваготомии.
Выбор способа оперативного лечения в пользу операции разобщения, согласно сведениям К.А. Цыбырнэ, И.В. Мишина, может быть решен при наличии пептической язвы двенадцатиперстной кишки, оправдывающей выполнение селективной проксимальной ваготомии и пилоропластики. Аналогичного мнения придерживаются и зарубежные ученые.
Современные представления о хирургических методах лечения больных с варикозно-расширенными венами пищевода и желудка
Журнал: Эндоскопическая хирургия. 2016;22(5): 43‑48
На сегодняшний день кровотечение из варикозно-расширенных вен пищевода и желудка у больных циррозом печени — главная причина летального исхода и самое грозное осложнение портальной гипертензии. В связи с этим необходимость своевременного лечения и проведение профилактики данного заболевания являются основным показанием к хирургическому вмешательству.
Варикозное расширение вен пищевода и желудка встречается у 90% больных циррозом печени, в 35% случаев оно осложняется кровотечениями. В механизме развития варикозной трансформации вен пищевода и желудка важную роль играет затруднение оттока крови по воротной вене, в результате чего формируются 4 основные группы портокавальных анастомозов: 1) гастроэзофагеальные; 2) забрюшинные; 3) между левой ветвью воротной вены и сосудами передней брюшной стенки; 4) между прямокишечным сплетением и нижней полой веной. Но для клиницистов наиболее важен гастроэзофагеальный коллатеральный путь, предопределяющий основное направление хирургического лечения портальной гипертензии [1].
Важно помнить, что хирургические методы лечения портальной гипертензии имеют паллиативный характер, они не направлены на лечение основного заболевания. Их цель — профилактика и ликвидация одного из серьезных симптомов портальной гипертензии — кровотечения из варикозно-расширенных вен пищевода и желудка. Единственный радикальный метод лечения портальной гипертензии у больных циррозом печени на сегодняшний день — трансплантация печени.
Существует 3 подхода к предупреждению кровотечений из варикозно-расширенных вен пищевода и желудка [1].
Вторым подходом в предупреждении кровотечений из варикозно-расширенных вен пищевода и желудка является декомпрессия портальной системы с помощью формирования сосудистых портокавальных анастомозов (дистальный спленоренальный анастомоз, проксимальный спленоренальный анастомоз, Н-спленоренальный анастомоз), а также эндоваскулярный способ формирования шунта — операция TIPS (Transjugular intrahepatic portosystemic shunt, трансъюгулярное внутрипеченочное портосистемное шунтирование) [1].
Существуют 3 вида открытых сосудистых операций по формированию портокавальных шунтов: 1) тотальное шунтирование; 2) парциальное шунтирование; 3) селективное шунтирование [4].
При тотальном шунтировании формируется портокавальный анастомоз большого диаметра (15—25 мм) между нижней полой и воротной, селезеночной или верхней брыжеечными венами. Наиболее распространенная операция при этом — проксимальный спленоренальный анастомоз (анастомоз между селезеночной и левой почечной веной конец в бок) в сочетании со спленэктомией. Одним из условий для формирования шунта является длина селезеночной вены не менее 4—6 см. При выполнении данной операции могут быть получены удовлетворительные результаты, однако летальность составляет 10—35%, энцефалопатия развивается у 3,5—28% больных, возможно развитие послеоперационного панкреатита, а рецидивы кровотечений возникают у 10—27% в связи с тромбозом анастомоза и неполной декомпрессией бассейна воротной вены [2, 5].
При селективном шунтировании происходит избирательная декомпрессия селезеночного и гастроэзофагеального бассейнов. При данном типе шунтирования формируется дистальный спленоренальный анастомоз (операция W. Warren). В литературе имеются работы с описанием данной операции, выполненной лапароскопическим доступом [6]. Селезеночную вену мобилизуют по всему периметру с целью сохранения разобщенности желудочно-селезеночного и брыжеечного бассейнов, однако это чревато повреждением поджелудочной железы и развитием послеоперационного панкреатита, который приводит к тромбозу анастомоза и рецидиву кровотечения из варикозных вен. Сохранение воротного кровотока позволяет снизить частоту развития острой печеночной недостаточности и энцефалопатии в раннем послеоперационном периоде. Поэтому данная операция характеризуется более высокой эффективностью и меньшим процентом осложнений, чем при тотальном шунтировании [5, 7].
При парциальном портокавальном шунтировании формируют анастомоз бок в бок или Н-типа малого диаметра (8—15 мм), выполняемые с использованием любого сосуда портальной системы, кроме воротной вены. При данном типе операции формируется Н-спленоренальный анастомоз, который считается лучшим из всех парциальных портокавальных анастомозов, так как именно в этом случае происходит декомпрессия портальной системы (на 25% интраоперационно снижается давление в портальной вене), а также сохраняется редуцированный кровоток для поддержания функции печени [5, 8].
Операция TIPS впервые разработана J. Rosch в 1969 г. в эксперименте на животных [9]. Впервые в клинической практике операцию TIPS в современном виде выполнил G. Richter в 1998 г. [10]. Данная операция заключается в малоинвазивном способе снижения портального давления путем создания внутрипеченочного соустья между крупными печеночными венами и ветвями воротной вены при помощи чрескожной имплантации металлического стента. Основные показания для данного вмешательства — безуспешность консервативного и эндоскопического методов лечения кровотечений из варикозно-расширенных вен пищевода и желудка, асцит, рефрактерный к диуретической терапии, синдром Budd—Chiari. Одним из серьезных осложнений данной операции являются стенозирование и тромбоз шунта, приводящие к рецидивам кровотечений [11, 12].
Третий подход в профилактике кровотечений из варикозно-расширенных вен пищевода и желудка заключается в разобщении портокавальных связей с помощью хирургических операций, в том числе и малоинвазивных, в целях уменьшения притока крови к варикозно-расширенным венам кардиоэзофагеальной области. К этим операциям относятся деваскуляризация пищевода и желудка, транссекция пищевода и желудка, прошивание варикозных узлов желудка и нижней трети пищевода, резекция пищевода и желудка. К малоинвазивным вмешательствам относятся эндоскопическое склерозирование и лигирование варикозно-расширенных вен пищевода и желудка, эндоваскулярные операции (редукция селезеночного кровотока, редукция печеночного кровотока, эмболизация кардиальных вен желудка, операция BRTO (Balloon-occluded Retrograde Transvenous Obliteration) — ретроградная окклюзия варикозных вен желудка и пищевода) [1].
Впервые оперативное вмешательство по поводу деваскуляризации желудка и нижней трети пищевода в сочетании со спленэктомией выполнил С. Henschen в 1938 г. Классической операцией данного типа является операция M. Hassab (1967), которая заключается в обширной деваскуляризации желудка и нижнего отдела пищевода, включая наддиафрагмальные вены, в сочетании со спленэктомией [2]. Y. Ni и соавт. [13] сравнили широко использующуюся методику деваскуляризации пищевода желудка в сочетании со спленэктомией и без таковой. Для исследования были отобраны 55 пациентов с синдромом портальной гипертензии: 27 из них выполнена деваскуляризация желудка и нижней трети пищевода без спленэктомии (группа А) и 28 пациентам выполнялась данная операция в сочетании со спленэктомией (группа В). Таким образом, портальное давление было снижено на 20% в послеоперационном периоде в обеих группах. Частота возникновения тромбоза в портальной вене в группе, А была значительно ниже, чем в группе В (р=0,032). Частота развития рецидивов кровотечения из вен пищевода и желудка в период послеоперационного наблюдения 1 и 3 года в группе, А составляла 0 и 4,5%, в группе В — 0 и 8,7% соответственно (р=0,631). Таким образом, было доказано, что частота осложнений и возникновение тромбоза в воротной вене у пациентов, оперированных без спленэктомии, ниже, чем у пациентов, оперированных в сочетании со спленэктомией. Однако в настоящее время данная операция чаще всего сочетается с эндоскопическим лигированием варикозно-расширенных вен пищевода, а также без спленэктомии [14].
Операцию транссекции пищевода и желудка впервые предложил N. Tanner (1949), который выполнил транссекцию желудка в поперечном направлении, тем самым разъединив систему воротной вены и верхней полой вены с целью ликвидации кровотечения из варикозно-расширенных вен пищевода и желудка у больных с портальной гипертензией. Суть операции заключается в мобилизации нижнего отдела пищевода и кардии желудка, перевязке левой желудочной артерии и вены через торакоабдоминальный доступ в седьмом и восьмом межреберье слева. Желудок пересекают на 5 см ниже кардии и вновь сшивают. Однако анализ отдаленных результатов операции показал ее неэффективность в связи с рецидивами кровотечений вследствие реваскуляризации в зоне транссекции. В научной литературе описаны работы, в которых данная операция выполнялась лапароскопическим доступом [15, 16]. В 1973 г. М. Sugiura и S. Futagawa разработали комбинированную операцию азигопортального разобщения, которая представляла собой трансторакальную транссекцию пищевода, спленэктомию, деваскуляризацию абдоминального отдела пищевода и верхнего отдела желудка, селективную проксимальную ваготомию и пилоропластику. Спленэктомию, пилоропластику, деваскуляризацию желудка, селективную проксимальную ваготомию выполняют из абдоминального доступа, обширную параэзофагеальную деваскуляризацию до уровня нижних легочных вен и транссекцию пищевода до уровня пищеводного отверстия диафрагмы — из торакального доступа. Данная операция в последнее время претерпела различные модификации (А.А. Шалимов, В.И. Оноприев, О.С. Васнев), в том числе с использованием лапароскопической техники, и аппаратной транссекции пищевода с помощью EEA-stapler, и получила широкое распространение в мире.
Методику прошивания варикозно-расширенных вен пищевода впервые предложил Берем в 1949 г. в случаях экстренного оперативного вмешательства при кровотечениях из вен пищевода. Он прошивал расширенные вены пищевода отдельными узловыми швами и вводил в просвет вен между наложенными лигатурами раствор глюкозы с целью тромбообразования в них. Крайль в 1950 г. прошивал варикозно-расширенные вены пищевода непрерывным кетгутовым швом. Позднее эта операция получила название «операция Берема—Крайля», при этом какие-либо вмешательства на варикозно-расширенных венах желудка не производились. Результаты данной операции показали, что кровотечения могут повторяться как в ближайшем, так и в отдаленном послеоперационном периоде, причем чаще всего (в 40—70% случаев) источником кровотечения являлся разрыв варикозных узлов кардиального отдела желудка. Кроме того, основной причиной смерти при операции Берема—Крайля были несостоятельность швов пищевода с последующим развитием медиастинита и эмпиемы плевры, а также декомпенсация функции печени, приводившие к летальному исходу в 30—70% случаев [1]. В 1967 г. М.Д. Пациора предложила прошивать варикозные узлы желудка и нижней трети пищевода через трансабдоминальную гастротомию в проксимальном отделе желудка в косопоперечном направлении [4, 17]. Суть данной операции заключается в прошивании всех варикозных узлов в кардиальном отделе желудка, а затем прошивании варикозных узлов нижней трети пищевода, в результате чего значительно снижается приток крови к венам пищевода. Данная операция менее травматична, чем операция Берема—Крайля, с низкой частотой летальности, рецидивов кровотечения и осложнений (7,6—15,4%). Однако с развитием малоинвазивных оперативных вмешательств (эндоскопическое лигирование) значимость выполнения полостной операции на варикозно-расширенных венах пищевода снизилась [18—20].
Говоря о пищеводно-желудочных резекциях, следует отметить, что эти операции являются операциями резерва для тех больных, кто ранее многократно был оперирован по поводу рецидива кровотечений из вен пищевода и желудка. Одна из таких операций — частичная эзофагогастрэктомия с инвагинацией пищеводно-желудочного анастомоза по способу К.Н. Цацаниди. Также применяются различные модификации данной операции с интерпозицией сегмента толстой или тонкой кишки. Однако данная операция применяется лишь в исключительных случаях ввиду большого количества осложнений (30—40%), таких как агастральная астения тяжелой формы и рецидивы кровотечения из эрозий культи желудка в послеоперационном периоде [18, 21].
На сегодняшний день малоинвазивные вмешательства — более перспективные методы остановки и профилактики кровотечений из варикозно-расширенных венах пищевода и желудка. Эндоскопическое склерозирование вен пищевода впервые выполнили С. Crafoord и Р. Frenckner в 1939 г. При этой методике интравазально либо паравазально с помощью иглы, проведенной через инструментальный канал эндоскопа, вводят склерозанты (производные жирных кислот — натрия морруат, синтетические вещества — этоксисклерол, тромбовар, а также этиловый спирт, фенол, гистоакрил) в целях образования рубцовой ткани и тромбоза сосудов данной области. Эффективность методики составляет 70—90% [19, 22, 23]. Однако данная операция характеризуется большим количеством осложнений, таких как изъязвления слизистой оболочки пищевода (14%), стриктуры пищевода, плевральные осложнения (9%), субфебрильная температура (6,4%), некроз слизистой пищевода и его перфорация (6,25%), перикардиты (0,4%) [2]. Наиболее частое (65%) и серьезное осложнение — стойкая дисфагия пищевода на фоне выраженных рубцовых стриктур, возникновение которых зависит от количества инъекций и введенного склерозанта [24]. В связи с этим многие клиницисты в последнее время отдают предпочтение эндоскопическому лигированию варикозно-расширенных вен пищевода. Впервые эндоскопическое лигирование варикозно-расширенных вен пищевода выполнил G. Stiegmann в 1986 г., применив латексные кольца. Данную операцию выполняют с помощью многозарядного лигатора фирмы «Wilson-Cook» при лигировании вен пищевода или нейлоновой петли фирмы «Olympus» — при необходимости лигирования вен желудка. Эндоскоп с фиксированным на конце колпачком проводится к выбранному варикозному узлу. Лигирование начинают с кардиоэзофагеального перехода чуть выше зубчатой линии в шахматном порядке по спирали. После аспирации варикозного узла в цилиндр более чем на половину его высоты сбрасывают лигирующее кольцо. Через 6—7 сут начинается отторжение некротизированных узлов, на месте которых образуются поверхностные язвы. Язвы заживают в течение 3 нед, на их месте образуются рубцы без стенозирования просвета пищевода. Наиболее частыми осложнениями данной операции являются аллергическая реакция на латекс, боли при глотании в первые дни, кровотечения из поверхностных язв на фоне отторжения некротизированных узлов. Эта методика позволяет остановить продолжающееся кровотечение в 78—95% случаев, однако рецидив кровотечения отмечается у 28—35% пациентов [25]. Методика эндоскопического лигирования варикозно-расширенных вен пищевода и желудка оказалась более эффективной операцией при кровотечениях из вен пищевода, а также как способ профилактики, чем эндоскопическое склерозирование варикозных вен, так как при лигировании вен отмечалось снижение количества рецидивов кровотечения на 20% и снижение летальности на 15% [26—28].
Осложнения после обширных хирургических вмешательств предписывают отказаться от формирования прямых портокавальных анастомозов в пользу эндоваскулярных методов лечения. Одной из первых эндоваскулярных операций стала чрескожная чреспеченочная эмболизация кардиальных вен желудка, впервые разработанная А. Lunderquist в 1974 г. Данная операция заключается в эмболизации левой желудочной вены и коротких вен желудка посредством металлических спиралей «Гиантурко» и других эмболизирующих средств [29]. В 1986 г. В.А. Черкасов рекомендовал выполнять одномоментно эмболизацию селезеночной артерии и кардиальных вен желудка (левая желудочная вена, короткие вены желудка) [30]. Данная манипуляция эффективна при кровотечениях из варикозно-расширенных вен желудка, а недостаток заключается в быстрой реканализации тромбированных коллатералей, в результате чего возможны рецидивы кровотечения.
Эндоваскулярная эмболизация селезеночной артерии впервые успешно выполнена F. Madson в 1973 г., однако анализ данной методики выявил большое количество осложнений, таких как абсцесс селезенки, бактериальный перитонит, тромбоз воротной вены [31]. В связи с этим Spigos и соавт. в 1979 г. предложили частичную эмболизацию селезеночной артерии, которая применяется по сей день [32]. Одним из основных показаний к данной операции является панцитопения, вызванная тем, что после эмболизации ветвей селезеночной артерии возникают участки инфарктов и некрозов, которые уменьшают депонирование лейкоцитов и тромбоцитов в селезенке, что соответственно приводит к их увеличению в периферической крови.
Операцию BRTO (Balloon-occluded Retrograde Transvenous Obliteration, баллон-ассистированная ретроградная трансвенозная окклюзия) впервые выполнили H. Kanagawa и F. Chikamori независимо друг от друга в 1996 г. [33, 34]. Суть операции заключается в эндоваскулярном перекрытии из антеградного трансфеморального доступа просвета спленоренального шунта окклюзионным баллон-катетером и введении жидкого склерозанта в варикозные узлы желудка [2]. В последние годы выработаны модификации данной операции: катетеризация через бедренную, левую почечную вены и естественный гастроренальный анастомоз — эмболизация варикозных вен желудка [35, 36]; катетеризация через притоки левого брахиоцефального венозного ствола или непарной вены левой перикардио-диафрагмальной вены [36]. Положительные результаты данной операции отмечены в 84—100% случаев. Осложнения встречаются в 5% случаев, среди них — тромбоз воротной вены, легочная эмболия и почечная недостаточность; рецидив кровотечения регистрируется с частотой до 9%; средний уровень выживаемости составляет 90, 75, 68 и 55% через 1, 2, 3 года и 7 лет соответственно [35, 36].
С учетом вышесказанного проблема портальной гипертензии и ее осложнений остается одной из самых сложных областей абдоминальной патологии, несмотря на большое количество существующих видов оперативных вмешательств. Однако все эти операции не радикальны. Все открытые хирургические оперативные вмешательства (деваскуляризирующие операции и операции с формированием портокавальных анастомозов) слишком травматичны, не всегда переносятся больными и не решают проблемы высокого портального давления радикально, в связи с чем остается высоким риск рецидива кровотечения. Эндоваскулярные методы лечения (в частности, операции TIPS, BRTO), а также эндоскопические малоинвазивные вмешательства высокоэффективны, поскольку результаты именно этих операций в последние годы дают надежную гарантию профилактики кровотечения из варикозно-расширенных вен пищевода и желудка.
Читайте также:
- Неходжкинская лимфома околоушной железы - лучевая диагностика
- Стадии течения наркомании. Психика больного наркоманией
- Гипертрофия правого желудочка при ревматизме. Гипертрофия правого желудочка при митральном пороке
- Компрессия локтевого нерва: атлас фотографий
- КТ, МРТ при гемангиоме глазницы у младенцев
