Позиционное клонирование многофакторного заболевания. Гены болезни Крона
Добавил пользователь Валентин П. Обновлено: 30.01.2026
Геномные ассоциации и карта гаплотипов. Tag SNP
До настоящего времени исследования ассоциаций генов болезней человека были лимитированы конкретными комплектами вариантов в ограниченных наборах генов. Например, генетики могли искать ассоциацию с вариантами в генах, кодирующих белки, которые на тот момент считали вовлеченными в патофизиологию болезни. Множество подобных исследований ассоциаций проведено до эры проекта «Геном человека», с использованием локусов HLA, поскольку эти локусы очень полиморфны и легко генотипируются в исследованиях типа случай-контроль.
Более мощный метод должен бы тестировать ассоциации систематически по всему геному среди более чем 10 млн вариантов аллелей и фенотипов болезни, без какого-либо предвзятого мнения, какие гены и аллели могут содействовать болезни. Хотя такое огромное предприятие в настоящее время невыполнимо, последнее достижение в геномике, построение НарМар, делает возможной полномасштабную проверку геномной ассоциации, достаточно мощную, чтобы обнаружить значимые ассоциации по всему геному.
Каким же образом НарМар может облегчить геномные исследования ассоциаций? При обсуждении ограничений исследований ассоциации мы отметили, что неравновесность сцепления в исследованиях случай-контроль может вести к видимой ассоциации между аллелем и болезнью, даже когда аллель функционально не включен в патогенез болезни, поскольку связанный аллель находится в неравновесном сцеплении с другим аллелем в соседнем функционально включенном локусе.
На самом деле, если цель анализа ассоциации в том, чтобы немедленно найти специфический вариант, содействующий болезни, тогда неравновесность сцепления может привести в тупик. Тем не менее предположим, что у нас не столь далеко идущие цели. Положительная ассоциация между болезнью и даже одним аллелем в пределах блока неравновесного сцепления немедленно определяет регион генома, содержащий сцепленный аллель болезни. Следовательно, этот регион будет местом, где нужно искать аллельный вариант, функционально включенный в процесс болезни.
Эта стратегия, построенная на поиске неравновесного сцепления для уменьшения числа полиморфных аллелей, используемых при анализе ассоциаций, стали первичной мотивацией для создания НарМар.
Tag SNP. Если оказывается, что некий аллель в пределах блока неравновесности сцеплен с болезнью, будут ли некоторые аллели в этом блоке лучше других служить в качестве представителя для всех аллелей, с которыми имеется неравновесное сцепление? Изучая все гаплотипы в пределах блока и измеряя степень неравновесности сцепления между аллелями, создающими гаплотипы, можно идентифицировать наиболее полезный минимальный набор аллелей SNP (так называемый tagSNP), способный с минимальной избыточностью определять большинство гаплотипов, содержащихся в каждом блоке неравновесного сцепления.
В теории набор хорошо отобранных tag SNP представляет минимальное число SNP, которое нужно генотипировать для обеспечения практически полной информации о гаплотипах, присутствующих в хромосоме. На практике тщательный анализ образцов блоков неравновесности сцепления показывает, что для анализа ассоциации генотипирование всего нескольких сот тысяч tag SNP только ненамного менее информативно, чем генотипирование более 10 млн вариантов SNP в геноме. Тем не менее любой предлагаемый набор tag SNP должен быть изучен и уточнен с учетом знаний о результатах полученных в проекте НарМар на примере четырех популяций по всему миру.

Ограничения геномного анализа ассоциации с использованием НарМар
Успех в применении неравновесности сцепления между вариантами в генах болезни и tag SNP для обнаружения генов болезни в популяциях во всех странах зависит от некоторых фундаментальных предположений: аллельный вариант, содействующий болезни должен (1) быть частым и (2) не являться результатом независимых повторных мутационных событий.
Частота гена болезни влияет на геномный анализ ассоциаций, основанный на неравновесности сцепления с tag SNP, поскольку гаплотипы, определяемые tag SNP в НарМар — только наиболее частые гаплотипы в различных изученных популяциях.
Если небольшая часть хромосом с конкретным гаплотипом содержит ген болезни, а большая часть хромосом — нет, индивидуумы без гена болезни, но с аналогичным гаплотипом, скрывают любую ассоциацию между гаплотипом и болезнью. Повторные мутации также затрудняют поиск ассоциаций с использованием tag SNP, поскольку, если один и тот же вариант происходил в результате многочисленных мутаций в других фоновых гаплотипах, ни один гаплотип не будет в неравновесном сцеплении с аллелем болезни.
Характеристика, преимущества и недостатки методов ассоциаций и сцепления для картирования генов болезней суммированы ниже.
Анализ сцепления генов:
• Отслеживает передачу признака болезни и генома от одних члена родословных к другим.
• Ищет регионы генома, содержащие аллели болезни; использует полиморфные варианты только как способ маркировки какого-то региона генома, унаследованного от родителей.
• Использует сотни или тысячи полиморфных маркеров в геноме.
• Не разработан для поиска конкретных вариантов, ответственных за предрасположенность к болезни; может только указать, где может находиться вариант (обычно в пределах одной или нескольких мегабаз).
• Основан на событиях рекомбинации, происходящих в семьях в течение только нескольких поколений, что позволяет измерить генетическое расстояние между геном болезни и полиморфными маркерами в хромосомах.
• Необходимо обследование всей семьи, а не только больных.
• Теряет силу, если болезнь имеет комплексное наследование с неполной пенетрантностью.
• Чаще всего используется для картирования патологических мутаций с достаточно выраженными эффектами, вызывающими менделирующие типы наследования.
Анализ ассоциаций генов:
• Проверяет измененные частоты конкретных аллелей или гаплотипов у больных по сравнению с контрольной группой в популяции.
• Изучает вклад в болезнь конкретных аллелей или гаплотипов.
• Использует от нескольких маркеров для известных генов до сотен тысяч маркеров для геномного анализа.
• Может иногда определить вариант аллеля, который действительно функционально отвечает за развитие болезни; чаще определяет гаплотип, связанный с болезнью в интервале от 1 до 10 килобаз (обычно).
• Основан на поиске набора аллелей, включая ген болезни, передающийся вместе через многие поколения из-за малого числа событий рекомбинации между маркерами.
• Может выполняться как в исследованиях типа случай-контроль, так и выборках из популяций.
• Чувствителен к стратификации популяции, хотя это может компенсироваться соответствующим подбором контрольной группы или использованием методов, основанных на семейном анализе.
• Наилучший метод для поиска вариантов с небольшим эффектом, предрасполагающим к сложным признакам.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Позиционное клонирование многофакторного заболевания. Гены болезни Крона
Неспецифический язвенный колит и терминальный илеит — хроническое воспалительное заболевание желудочно-кишечного тракта (ЖКТ), первично поражающее подростков и молодых взрослых. Выделяют две основных категории: болезнь Крона и язвенный колит. Семейные и близнецовые исследования указывают, что болезнь Крона — полигенное заболевание без видимого менделирующего типа наследования.
В семьях с двумя или более больными выполнено множество сканирований генома для использования пар больных сибсов в анализе сцепления разными методами, в том числе непараметрическими. Среди 11 областей генома с положительными NPL-оценками одна с самой высокой оценкой (>5) продемонстрировала сцепление только с болезнью Крона, но не с язвенным колитом; остальные имели сцепление с обеими формами болезни.
Предполагают, что локус, названный IBD1, находится в этом регионе с самой высокой LOD-оценкой, и исследователи пытаются найти вовлеченный ген.
Переход от картирования методом непараметрического анализа сцепления IBD1 к использованию неравновесности сцепления показал, что в исходном геномном сканировании один из маркеров находится в неравновесном сцеплении с болезнью Крона. Ассоциацию изучали с использованием SNP в регионе вокруг данного маркера размером в 160 килобаз, что позволило обнаружить три SNP с достоверно подтвержденной неравновесностью сцепления с болезнью; все три располагаются в кодирующих экзонах гена NOD2 (также известного как CARD15) и вызывают или замену аминокислоты, или преждевременное завершение синтеза белка.
Белок NOD2 связывается с клеточной стенкой грамотрицательных бактерий и участвует в воспалительном ответе на них, активизируя фактор транскрипции NF-кВ в мононуклеарных лейкоцитах. Все три варианта уменьшали способность белка NOD2 активизировать NF-кВ. Предполагают, что варианты в этом гене изменяют способность моноцитов в стенке кишечника реагировать на резидентные бактерии, тем самым предрасполагая к аномальному воспалительному ответу. Таким образом, варианты NOD2 вероятно и будут аллелями, действительно ответственными за повышенную восприимчивость к болезни Крона в локусе IBD1.
Дополнительные исследования в нескольких независимых когортах пациентов с болезнью Крона подтвердили, что данные варианты сильно сцеплены с болезнью. Генетический вклад вариантов NOD2 в болезнь Крона также подтверждается эффектом дозы; гетерозиготы по вариантам NOD2 имеют повышение риска болезни в 1,5-4 раза, а гомозиготы и компаундгетерозиготы — в 15-40 раз.
Открытие вариантов NOD2 помогает объяснить сложный тип наследования при болезни Крона, так как найденные варианты — явно ни необходимы, ни достаточны, чтобы вызвать болезнь Крона. То, что в них нет острой необходимости, показывают следующие факты. Хотя половина всех белых пациентов с болезнью Крона имеет одну или две копии этих вариантов NOD2, вторая половина — нет.
Варианты NOD2 представляют самое большее 20% генетического вклада в хроническое воспаление кишечника у белых пациентов. Кроме того, конкретные варианты, связанные с болезнью в Европе, могут не обнаруживаться в азиатских или африканских популяциях, и болезнь Крона в этих популяциях не покажет никакой ассоциации с NOD2. Этих вариантов также не достаточно, чтобы вызвать болезнь.
Варианты NOD2 часто встречаются в Европе; 20% популяции гетерозиготна по данным аллелям и не проявляют никаких признаков воспаления кишечника. Даже при генотипе самого высокого риска у гомозигот и сложных гетерозигот по вариантам NOD2 пенетрантность составляет менее 10%. Низкая пенетрантность явно указывает на другие генетические или средовые факторы, влияющие на генотипическую восприимчивость в локусе NOD2.
Очевидная связь между болезнью Крона, воспалением кишечника и структурными вариантами в белке NOD2, модуляторе врожденного антибактериального воспалительного ответа — указание на то, какими могут быть факторы окружающей среды. Генетический анализ болезни Крона показывает, что мы теперь знаем о генетическом вкладе в полигенные болезни и как идентифицировать этот вклад и использовать его для дальнейшего понимания всех факторов, как генетических, так и средовых, совместно вызывающих генетические комплексные болезни.
Позиционное клонирование аутосомно-рецессивного заболевания. Гены муковисцидоза
Применение картирования генов в медицинской генетике имело впечатляющий успех. Общая стратегия — картирование расположения гена болезни по сцеплению или другими способами с последующими попытками идентифицировать гены по их положению на генетической карте называется позиционным клонированием. Данная стратегия привела к идентификации генов, связанных с сотнями менделирующих заболеваний, и пока небольшого, но постоянно увеличивающегося числа генов, ассоциированных с генетически комплексными болезнями.
В статьях мы представляем результаты клонирования гена муковисцидоза и генов, ассоциированных с болезнью Крона и ВМД.
Позиционное клонирование аутосомно-рецессивного заболевания с помощью картирования анализом сцепления на основе модели: муковисцидоз
Муковисцидоз из-за сравнительно высокой частоты, особенно в белых популяциях, и почти полного непонимания основ его патофизиологии представлял первичную цель для позиционного клонирования. Анализировали образцы ДНК из почти 50 семей с муковисцидозом для выявления сцепления между геном муковисцидоза и сотнями ДНК-маркеров для всего генома, пока, наконец, не было идентифицировано сцепление муковисцидоза с маркерами в длинном плече хромосомы 7.
Сцепление с дополнительными ДНК маркерами на участке 7q31-q32 позволило уточнить локализацию гена муковисцидоза в регионе хромосомы 7 размером приблизительно в 500 килобаз.
Неравновесность сцепления при муковисцидозе. В этот момент проявилась важная характеристика генетики муковисцидоза: даже если ближайшие сцепленные маркеры все еще находились на некотором расстоянии от гена муковисцидоза, стало ясным, что существует значимая неравновесность сцепления между мутантными аллелями в локусе муковисцидоза и конкретными гаплоти-пами в тесно сцепленных локусах. Были проанализированы области с величайшей степенью неравновесности сцепления, что в 1989 г. привело к выделению гена муковисцидоза.

Ген получил название регулятора трансмембранный проводимости (CFTR, от англ. cystic fibrosis transmembrane conductance regulator), в нем выявлен интересный спектр мутаций. Делеция трех пар нуклеотидов (AF508), удаляющая фенилаланин в 508 позиции белка присутствует приблизительно у 70% всех мутантных генов муковисцидоза в популяциях севера Европы, но никогда в нормальных аллелях в этом локусе. Хотя последующие исследования показали много сотен мутантных аллелей CFTR во всех странах, такая высокая частота мутации AF508 в семьях, использованных для картирования гена муковисцидоза и неравновесность сцепления между этим аллелем и другими полиморфными локусами, оказались очень полезными в окончательной идентификации гена CFTR.
Картирование локуса муковисцидоза и клонирование гена CFTR сделали возможными разнообразные научно-исследовательские и клинические приложения от основ патофизиологии до молекулярного диагноза для генетического консультирования, пренатальной диагностики, моделей на животных и, наконец, постоянных попыток лечить это заболевание.
Влияние картирования генов: пример муковисцидоза:
• 1985 г. — ген муковисцидоза при анализе сцепления в семьях картирован на хромосоме 7q31.2. Сцепленные маркеры немедленно применены для пренатальной диагностики и выявления носительства в семьях.
• 1989 г. — идентификация CFTR как единственного гена, мутации в котором вызывают муковисцидоз. Анализ мутаций немедленно стали применять для диагностики больных, пренатальной диагностики и носительства.
• 1989 г. — создана база данных мутаций в гене CFTR. Она растет в течение следующих 18 лет, включая более 1400 различных аллелей с информацией об их частоте среди разных этнических групп. Обнаружены генетические факторы клинической гетерогенности (функция поджелудочной железы, врожденное отсутствие семявыносящих протоков).
• 1992 г. — успешный предымплантационный диагноз муковисцидоза.
• 1992 г. — первая из большого числа животных моделей (мыши) с мутацией в гене CFTR.
• 1994 г. — первая из большого числа (постоянно продолжающихся) попыток скорректировать муковисцидоз у пациентов введением нормального гена CFTR в эпителиальные клетки легкого.
• 1997 г. — конференция Национального института консенсуса по здоровью (National Institutes of Health Consensus) рекомендует введение скрининга носительства муковисцидоза. Начинается скрининг носителей десятков мутаций.
• 2003 г. — предварительный прогресс в поиске лекарств с потенциальной пользой при муковисцидозе, созданных на основе знания спектра мутаций CFTR, их эффекта в экспрессии и функции белков CFTR и аномалий в транспорте Н2О и ионов, вызванных утратой функции CFTR.
• 2005 г. — идентифицированы гены-модификаторы, влияющие на тяжесть клинических проявлений патологии легких при муковисцидозе, что позволило предположить альтернативные пути патогенеза и новые подходы к лечению.
Иммунный ответ при воспалительных заболеваниях кишечника (болезнь Крона и язвенный колит)
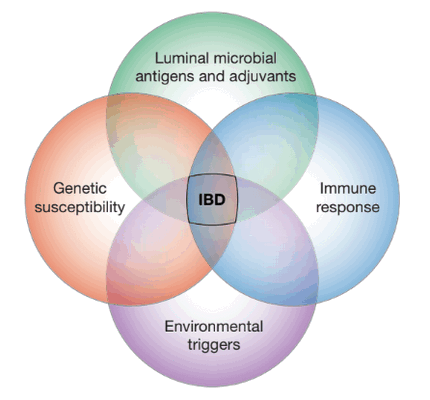
Язвенный колит и болезнь Крона являются хроническими, рецидивирующими, иммунологически опосредованными заболеваниями, которые в совокупности называют воспалительными заболеваниями кишечника (IBD). Распространенность IBD быстро растет в Европе и Северной Америке, и эти заболевания становятся все более распространенными в остальном мире, поскольку разные страны принимают западный образ жизни. Такие эпидемиологические наблюдения показывают, что существуют сильные экологические воздействия на IBD: их влияние подтверждается относительно низким уровнем совпадения признаков у идентичных близнецов (~50 % для болезни Крона и ~10 % для язвенного колита). Эти исследования подтверждают генетическую роль в развитии данных патологий. Даже при этом наборе знаний, этиологии этих болезней остаются загадкой. Есть несколько дополнительных теорий развития болезни Крона и язвенного колита. Наиболее широко распространена гипотеза о патогенезе IBD, которая заключается в том, что чрезмерно агрессивные (опосредованные Т-клетками) иммунные ответы на подмножество условно-патогенных энтеробактерий влияют на развитие генетической восприимчивости организма-хозяина.
Генетика
Достигнуты успехи в понимании генетики IBD (inflammatory bowel disease) из исследований, основанных на однонуклеотидном полиморфизме (SNP —single nucleotide polymorphism), а также на исследованиях экспериментального колита у мышей. Работа в этих двух независимых системах с частично перекрывающимися результатами показала, что несколько генов участвуют как в IBD, так и в экспериментальном колите. Общие особенности состоят в том, что вовлеченные гены регулируют несколько важных биологических функций: иммунная регуляция, целостность слизистой оболочки и микробный клиренс и/или гомеостаз.
CARD15 gene. Первый ген, связанный с болезнью Крона был CARD15 (член № 15 каспазного набора семейства доменов, ранее известный как NOD2). Здесь присутствуют 3 мутации, вызывающие аминокислотные замены Arg702Trp и Gly908Arg и сдвиг рамки 1007fs — найдены в области гена CARD15, который кодирует лейцин-насыщенный повтор, отвечающий за распознавание бактерий. Лейцин-насыщенная область гена CARD15 связывает мурамилдипептид (MDP), который является биологически активным фрагментом пептидогликана. Связывание MDP путем димеризации CARD15 активирует ядерный фактор (NF) κB, являющийся частью центрального сигнального пути, который стимулирует транскрипцию множества генов, кодирующих как провоспалительные, так и защитные молекулы. Мутации Arg702Trp, Gly908Arg и 1007fs вызывают дефекты мурамилдипептида.
SLC22A4 и SLC22A5. Два функциональных варианта переносчиков катионов OCTN1 и OCTN2 связаны с болезнью Крона. Мутации в транскрибируемой области гена SLC22A4, который кодирует OCTN1 и промоторный регион гена SLC22A5, кодируемый OCTN2, влияют на транскрипцию и функции переносчиков карнитина и различных катионов. Эти мутации наиболее активно экспрессируются в кишечном эпителии, макрофагах и Т-клетках, а также они уменьшают транспорт карнитина.
DLG5 gene. Два гаплотипа гена DLG5, который кодирует белок, помогающий в поддержке целостности эпителия, были связаны с болезнью Крона и комбинированным язвенным колитом.
MDR1 gene. Ген MDR1 со множественной лекарственной устойчивостью кодирует P-гликопротеин 170, переносчик, который регулирует отток лекарств. P-гликопротеин 170 может также функционировать как флиппаза (флиппазы —группа АТФ-зависимых переносчиков, осуществляющие транспорт фосфолипидов между двумя сторонами липидного бислоя клеточных мембран), которая движет амфифильный субстрат от внутреннего к внешнему слою клеточной мембраны. Мутации гена MDR1 были связаны с язвенным колитом и болезнью Крона.
Иммунный ответ
В процессе иммунного ответа количество макрофагов и дендритных клеток в собственной пластинке слизистой оболочки кишечника увеличивается и у них ярко выраженный фенотип IBD. Производство провоспалительных цитокинов и хемокинов в IBD и экспрессия молекул адгезии и ко-стимулирующих молекул также увеличено. Клетки, вовлеченные в врожденные иммунные ответы, активируются, и повышается экспрессия большинства провоспалительных цитокинов и хемокинов регулируются как в болезни Крона, так и в язвенном колите.
Т-хелпер типа 1 (TH1) и TH17-связанные цитокины участвуют в врожденном иммунном ответе (например, IL-12, IL-23 и IL-27), однако избирательно активируются в болезни Крона. Молекулы адгезии, такие как молекула межклеточной адгезии (ICAM1), необходимы для циркуляции клеток, чтобы они могли прикрепляться к активированному эндотелию. Кроме того, молекулы адгезии опосредуют миграцию экстравазированных иммунных клеток через строму к источнику максимальной продукции хемокинов. Провоспалительные молекулы предпочтительно продуцируются моноцитами и полиморфно ядерными клетками, которые мигрируют в воспалительный очаг. TLR-молекулы выражены на поверхности различных эффекторных клеток, участвующих в врожденном иммунном ответе. Подобно CARD15, эти рецепторы выборочно связываются с конкретными микробными адъювантами и инициируют активацию через NFκB путь. Несмотря на то, что каждый тип TLR связывает специфический бактериальный адъювант (то есть TLR4 и CD14 связывают липополисахарид, и TLR2 связывает пептидогликан), эти сигналы все сходятся по одному пути через первичный ответ на миелоидную дифференцировку белка MyD88, который активирует NFκB. Активация NFκB стимулирует экспрессию многочисленных молекул, имеющих отношение к патогенезу IBD. К ним относятся молекулы, участвующие в воспалительном ответе: IL-1β, TNF (фактор некроза опухоли), IL-6, IL-8 и другие хемокины, ICAM1 и другие молекулы адгезии и ко-стимулирующие молекулы, включая CD40, CD80, CD86 индуцибельный Т-клеточный ко-стимулятор ICOS. Блокада TNF путем нейтрализации моноклональных антител лечит активную форму болезни Крона и язвенного колита, и антитела к IL-12 p40 купируют болезнь Крона. Селективное ингибирование большинства этих цитокинов ослабляет начало экспериментального колита.
Цитокины, ассоциированные с воспалительными заболеваниями кишечника.
Молекулярные связи свидетельствуют о наследственной природе болезни Крона

Мутации гена NOD2 являются факторами риска болезни Крона. Многие аспекты того, как они влияют на состояние человека при данной болезни, неизвестны. Обнаружение вовлеченных в патогенез заболевания популяций клеток выдвигает новые терапевтические возможности.
Болезнь Крона — хроническое воспалительное заболевание кишечника, поражающее многих людей. Например, более 0,3 % населения Канады и Германии страдают от этого заболевания, а частота выявления случаев возрастает во всем мире [1]. Существует острая потребность в новых методах лечения, однако их эволюции препятствует отсутствие четкого понимания того, как возникает болезнь. Своей статьей в «Naturе» Nayar с соавт. [2] проливают свет на давнюю загадку одного фактора риска болезни Крона; выводы ученых имеют важное клиническое значение.
Болезнь Крона может поражать любой отдел кишечника. Чаще всего это подвздошная кишка, где развивается воспалительный процесс, который часто приводит к фиброзу (отложению волокнистой соединительной ткани как реакция на повреждение). Это приводит к сужению (стриктуре) просвета подвздошной кишки, что требует хирургического вмешательства [3]. Болезнь Крона представляет собой удобную для изучения модель, отображающую заболевания, развитие которых опосредовано комбинацией генетической предрасположенности и влияния окружающей среды. В данном случае, генетическая предрасположенность лежит в основе развития воспалительных реакций на воздействие микроорганизмов кишечника, что в итоге приводит к заболеванию.
Генетические вариации гена NOD2 (полиморфизм) являются самым сильным фактором риска болезни Крона; примерно 20 % от этого всего риска развития болезни связано с тремя однонуклеотидными полиморфизмами данного гена [4]. Кроме того, мутации NOD2 являются сильными прогностическими факторами для развития стриктур подвздошной кишки и, как следствие, необходимости хирургического вмешательства при болезни Крона. Это свидетельствует о сильной взаимосвязи между генетической основой этого состояния и проявлениями болезни [3].
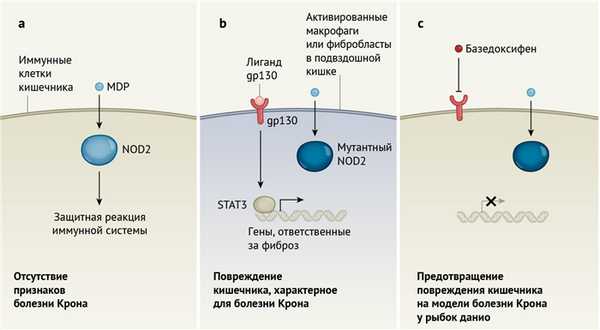
Однако взаимосвязь гена NOD2 и восприимчивость к болезням представляют собой интересный парадокс. NOD2 — это внутриклеточный рецептор (см. рис. 1), который распознает молекулу мурамилдипептида (MDP) — распространенного компонента стенок бактериальных клеток. До того, как NOD2 был описан как ген риска развития болезни Крона, функция его была лучше всего изучена на примере иммунных клеток, обеспечивающих функционирование врожденного звена иммунитета. Активация NOD2 в этих клетках приводит к экспрессии воспалительных молекул, называемых цитокинами, а аномально интенсивный воспалительный ответ может опосредовать повреждение тканей кишечника при болезни Крона [5, 6]. Следовательно, можно предполагать, что мутации NOD2, известные как мутации, приводящие к потере функции (которые не приводят к образованию полноценного кодируемого геном белка), будут защищать от болезни Крона. Тем не менее, такие мутации NOD2, приводящие к потере функции, идентифицируются как факторы риска заболевания. Поэтому последующие исследования были сосредоточены на другом аспекте функции и метаболизма NOD2 в кишечнике — поддержании гомеостаза в кишечнике и роли NOD2 в этом процессе. Ведь именно здесь самая большая биомасса иммунокомпетентных клеток организма постоянно подвергается воздействию MDP кишечных микроорганизмов, а мутации NOD2 нарушают равновесие между микробиомом и иммунной системой, что ведет к болезни [5].
Роль мутаций NOD2 в возникновении фиброза подвздошной кишки до настоящего исследования была неизвестна. Авторы стремились понять, что запускает воспаление и фиброз при болезни Крона. Пытаясь обнаружить взаимосвязь между этими патологическими процессами и NOD2, они применили для исследования человеческие клетки, ткани кишечника человека и рыбок данио.
Во-первых, авторы использовали секвенирование РНК одиночных клеток, взятых из образцов воспаленной ткани подвздошной кишки во время операций у людей с болезнью Крона. В этих клетках обнаружилась сигнатура экспрессии генов, связанных с функциями активированных макрофагов и фибробластов. Авторам также удалось идентифицировать ключевую популяцию клеток, которая экспрессирует маркеры как миелоидных клеток, так и фибробластов. В соответствии с данными сведениями, популяция воспалительных макрофагов в подвздошной кишке дифференцируется для превращения в активированные фибробласты во время болезни.
Поразительно, но авторам удалось обнаружить факт эволюционной консервации этих клеточных популяций на экспериментальной модели воспаления тканей кишечника — на рыбках данио, обработанных декстраном сульфата натрия (DSS). Это вещество уже давно используется для индукции повреждения и воспаления кишечника на стандартных моделях грызунов. При моделировании воспалительных заболеваний кишечника человека in vivo предпочтение отдается именно мышиным моделям. Однако, как демонстрируют Nayar с соавт., рыбки данио представляют собой удобную альтернативу для исследований, от которых ожидается высокая степень результативности и быстрая оценка корреляции с заболеваниями человека. Действительно, кишечник рыбок данио и млекопитающих имеет сходную морфологию. Более того, как и у людей, у рыбок данио имеются звенья врожденного и адаптивного иммунитета, а воспаление тканей кишечника у рыбок данио также зависит от кишечного микробиома [7]. Методики редактирования генов, такие как CRISPR, помогают быстро модифицировать интересующие гены у рыбок данио.
Авторы изучили воспаление кишечника у рыбок данио, генетически модифицированных с дефицитом nod2. У этих рыб, обработанных DSS, было обнаружено повышенное содержание лейкоцитов в кишечнике, что является признаком воспаления, по сравнению с рыбками данио с нормальным количеством nod2. Но модель рыбок данио актуальна только в том случае, если можно найти корреляцию с организмом человека. Соответственно, используя сведения, полученные от детей с впервые диагностированной болезнью Крона, авторы демонстрируют, что увеличение количества копий мутации NOD2 (что связывается с риском развития болезни Крона) действительно коррелировало с сигнатурой экспрессии генов активированных макрофагов и фибробластов в тканях подвздошной кишки.
Чтобы понять функцию NOD2 в клетках человека, дифференцирующихся in vitro, авторы использовали моноциты периферической крови здоровых добровольцев и определили, есть или нет в клетках одна или две копии мутации NOD2, связанные с восприимчивостью к болезни Крона. Затем клетки дифференцировались in vitro в присутствии MDP и без него. Результатом стало большее количество активированных фибробластов в пропорции к клеткам с двумя копиями мутаций NOD2 по сравнению с клетками с нативным NOD2. Кроме того, увеличение количества мутаций NOD2 было связано с соответствующим увеличением количества фибробластов с сигнатурой экспрессии генов, характерной для активированных клеток. Интересно, что рыбки данио с дефицитом nod2, которые испытали воздействие MDP, обладали характеристикой экспрессии генов, характерной для активированных фибробластов, которая сохранялась даже во время восстановления после повреждения, опосредованного DSS. Рыбки данио с нативным типом nod2 таковой характеристикой не обладали. Исходя из этого, можно предположить, что дефицит nod2 препятствует эффективному разрешению фиброза и воспаления.
Для дальнейшего выяснения молекулярных основ связанной с риском мутаций NOD2 сигнатуры экспрессии генов, ответственных за развитие фиброза, авторы решили найти регуляторы транскрипции этого пути, стоящие выше на ступени контроля. Ученым удалось определить, что ген, кодирующий белок STAT3, в большей степени экспрессируется в активированных фибробластах и макрофагах. STAT3 является регулятором транскрипции ключевых компонентов воспалительных реакций и фиброза при воспалительных заболеваниях кишечника и действует через цитокиновый рецептор gp130. Анализ клинических данных, полученных от людей с болезнью Крона (у которых обнаружилось отсутствие реакции на антиФНО-терапию), выявил усиленную экспрессию генов, регулируемых gp130 и кодирующих белки IL-6, онкостатин M и IL-11 (терапия, основанная на антиФНО-антителах [ФНО — фактор некроза опухоли] — наиболее распространенный способ лечения болезни Крона). Это открытие подтверждает роль сигнализации посредством gp130 в этой группе лиц, устойчивых к упомянутой форме терапии.
Авторы предположили, что блокада gp130 может снизить частоту аномалий, возникающих при мутации NOD2. Они проверили эту гипотезу посредством использования базедоксифена (ингибитор gp130) на обработанных MDP клетках человека с мутациями NOD2. Базедоксифен действительно привел к снижению сигнатуры экспрессии генов, связанных с фибротическими процессами и обратил вспять изменения конфигурации клеток, являющихся характерными для активированных фибробластов. Этот препарат также снижал степень повреждения тканей кишечника, что было обнаружено у мутантных по отношению к nod2 рыбок данио, подвергшихся обработке DSS.
Начиная с описания клинических характеристик фиброза при болезни Крона, в данной работе описан молекулярный путь, связанный с мутациями NOD2, характерными для этого заболевания. Работа завершается предложением потенциальных подходов терапии для разрешения настоящих проблем лечения фиброза и лекарственной устойчивости к антиФНО-препаратам. Опираясь на генетику и клинические результаты этого внутриклеточного и молекулярного пути, исследование представляет собой «дорожную карту» для осуществления настоящих и будущих методов лечения.
Не у всех лиц с болезнью Крона существуют мутации NOD2, связанные с риском развития заболевания. Действительно, у людей определенных этнических групп (китайцев, малайцев, индусов) поражение подвздошной кишки является ведущим клиническим проявлением болезни Крона, однако NOD2 не связан с риском развития заболевания в этой популяции [5, 9]. Возможно, молекулярная сигнатура экспрессии генов активированных макрофагов и фибробластов является актуальной ключевой особенностью для людей с поражением подвздошной кишки при болезни Крона. Вероятно, различный генетический ландшафт может привести к сходным клиническим и молекулярным исходам. Следовательно, результаты Nayar с соавт. продвигают эту область на шаг ближе к молекулярной классификации болезни Крона, что может прояснить аспекты этого тяжелого состояния, насчитывающего около 200 генетических областей, связанных с риском развития заболевания [10] и его различными клиническими проявлениями.
Читайте также:
- Саркома Капоши конъюнктивы: признаки, гистология, лечение, прогноз
- Кривая диссоциации оксигемоглобина (КДО). Физиологический смысл КДО
- Спондилодисцит, пиогенный спондилит: атлас фотографий
- Клиника и диагностика сарком кишечника. Метастазы злокачественных опухолей
- Диагностика внематочной беременности. Трансвагинальная эхография при внематочной беременности
