Практическое применение контрастной эхокардиографии миокарда
Добавил пользователь Валентин П. Обновлено: 27.01.2026
Контрастная эхокардиография миокарда
а) Оценка перфузии миокарда. Отныне, благодаря низко- и высокоэнергетическим методикам, можно эхокардиографически визуализировать перфузию миокарда на фоне внутривенного введения содержащего микропузырьки контрастного средства. Основным принципом здесь является сильная отражающая способность микропузырьков в крови, а также богатого капиллярами миокардиального сосудистого русла, так что повышение интенсивности сигнала от миокардиальных структур («окраска миокарда») после внутривенного введения контрастного средства служит доказательством миокардиальной перфузии.
Следовательно, при визуальной оценке локальный дефект окраски миокарда в покое может быть расценен как указание на окклюзию коронарной артерии, а при максимальной вазодилатации — на стенозирование коронарной артерии или на нарушение коронарной микроциркуляции. Эта оценка региональной негомогенности перфузии в принципе обусловливает возможность диагностики макроваскулярных нарушений кровоснабжения миокарда (коронарных стенозов).
Однако миокардиальная контрастная ЭхоКГ позволяет, кроме того, количественно определить объем и поток миокардиальной перфузии, так что эти исследования можно выполнять в группах пациентов с нарушениями микроциркуляции (например, при сахарном диабете или гипертонической болезни) с диагностической целью и для контроля эффективности терапевтических мероприятий.

б) Технические предпосылки. Как уже было указано выше, появление контрастной эхокардиографии миокарда с внутривенным введением контрастных средств является результатом многолетних проб и ошибок как в разработке контрастных средств, так и в применении традиционной, так называемой фундаментальной ЭхоКГ, что стало поводом для многочисленных физических исследований и технических изобретений.
Фактически до 1998 г. клинически пригодные изображения перфузии можно было получить только при помощи внутрикоронарного или, соответственно, внутриартериального введения контрастных средств. Поэтому современный прорыв в развитии физических представлений и технических возможностей обусловливает необходимость описания текущего положения дел или краткого технического введения для специалиста по ультразвуковой диагностике, который хотел бы начать работу с этой крайне интересной областью исследований.
Доступные сегодня контрастные средства соответствуют важнейшим условиям для успешного клинического применения: они обладают транскапиллярной стабильностью и достаточной сохранностью в акустическом поле.
в) Апробированные клинические области применения. Для пациентов с ишемической болезнью сердца исследование коронарной микроциркуляции при помощи контрастной эхокардиографии миокарда расширяет диагностические и прогностические возможности в нижеследующих клинических ситуациях.
1. Острый коронарный синдром:
- «Зона риска» и коллатеральный кровоток. При помощи внутривенного контрастирования можно перед плановой реваскуляризацией надежно определить зону риска, как это уже длительное время практикуется при помощи интракоронарного контрастирования. В дополнение можно исследовать коллатеральное кровоснабжение на территории окклюзированной коронарной артерии. В действительности, сегодня нет другой техники, которая способна была бы предоставить эту информацию настолько же быстро и с таким же хорошим пространственным разрешением. В опубликованном Sabia исследовании на 33 пациентах с подострым инфарктом миокарда размер области миокарда, снабжаемой из коллатеральных сосудов, оказался неожиданно высоким, до 50-100% от зоны инфаркта. Выделение пациентов с достаточным коллатеральным кровотоком в зоне острого инфаркта миокарда позволило бы отодвинуть реваскуляризирующее вмешательство на ближайший, но плановый срок, тогда как обнаружение недостаточной резидуальной перфузии, вероятно, приводило бы к необходимости экстренного вмешательства.
- Феномен невосстановления кровотока. После экстренной реваскуляризации оценивается, как это впервые описал Lang в 1986 г., функциональный успех этого вмешательства. Внутривенное контрастирование особенно хорошо позволяет диагностировать описанный впервые Ito неблагоприятный феномен невосстановления кровотока (no reflow), несмотря на макроскопически успешную реваскуляризацию и поток на уровне TIM 1-3.
Agati в исследовании AMICI показал, что величина дефекта перфузии после экстренной реваскуляризации лучше прогнозирует фракцию выброса левого желудочка и ремоделирование левого желудочка, чем оценка нарушения движения стенки миокарда.
2. Хронический коронарный синдром. Значимый стеноз коронарной артерии при нагрузке ведет к относительной гипоперфузии снабжаемой территории и, следовательно, от метаболических гипоксических реакций к нарушениям диастолического и систолического движения стенки. Тогда как последние изменения были доказаны уже около 10 лет назад при помощи традиционной ЭхоКГ с использованием тканевой допплерографии, внутривенное контрастирование вместе с низкоэнергетическими методиками делает возможной и визуализацию региональной гипоперфузии; при этом чувствительность и специфичность, составляющие для опирающихся только на перфузию методик 86 и 88% соответственно, в комбинации с анализом нарушений движения стенки миокарда повышаются до уровня точности, превосходящего точность нагрузочных тестов с использованием МРТ. Для дифференциального диагноза при острой боли в груди без подъема ST эхокардиографическая оценка движения сердечной стенки и перфузии миокарда у 1017 пациентов в покое дала важную диагностическую и прогностическую информацию.
3. Жизнеспособность и «гибернирующий миокард». Жизнеспособность связана с интактной микроциркуляцией. В связи с этим контрастная ЭхоКГ позволяет проводить прогностически важную дифференцировку между жизнеспособным и некротизированным миокардом, а также оценивать обусловленное коллатералями остаточное кровоснабжение в соотношении с дефектом перфузии в состоянии после инфаркта миокарда и визуализировать зону кровотока в соотношении с зоной «по-reflow» у пациентов после реваскуляризации. Кроме того, контрастная ЭхоКГ при хронической дисфункции миокарда помогает дифференцировать гибернирующий миокард от миокарда с необратимым нарушением функции.
4. Метаболический синдром без КБС и в сочетании с КБС. В последнюю очередь обратимся к далеко не последней по значимости, эндемически обширной и терапевтически полностью недоисследованной области нарушенной миокардиальной микроциркуляции из-за эндотелиальной дисфункции, которая по прежним патофизиологическим представлениям является основой как для коронарной болезни сердца, так и для традиционных сердечно-сосудистых факторов риска у пациентов с метаболическим синдромом. В действительности сегодня уже доказано, что обусловленное микроваскулярными изменениями снижение перфузии миокарда у пациентов с сахарным диабетом 2-го типа в целом выражено в той же степени, что и снижение макро-/микроваскулярной перфузии у пациентов с одно- или двухсосудистым поражением без диабета. Радует, что сегодня уже есть и первые публикации, основанные на контрастной ЭхоКГ, которые на фоне лечения показывают улучшение этой сниженной (о чем известно также по данным ПЭТ и ангиографии) перфузии у диабетиков, будь то в результате интенсивной терапии С-пептидом у пациентов с диабетом 1-го типа, будь то благодаря улучшению характеристик обмена веществ в течение 3 нед., будь то в результате профилактически назначенного сердечно-сосудистого препарата.
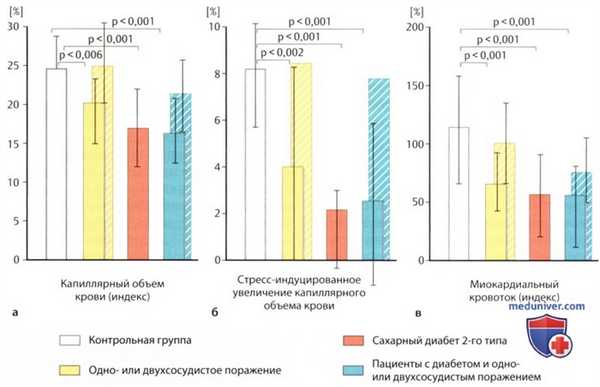
Глобальные (столбики с монотонной раскраской) параметры левожелудочковой перфузии во время максимальной вазодилатации в контрольной группе (белый цвет) в сравнении параметрами у пациентов с одно- или двухсосудистым поражением (желтый цвет), у пациентов с диабетом 2-го типа без ИБС (красный цвет) и у диабетиков с одно- или двухсосудистым поражением (зеленый цвет).
В трех группах пациентов видна одинаковая выраженность значимого снижения (см. соответствующие значения р) глобального капиллярного объема крови при максимальной вазодилатации (слева), его вызванного дипиридамоловым стрессом повышения в сравнении с состоянием покоя (в середине) и глобального миокардиального кровотока (справа). В обеих группах с ИБС была также исследована ангиографически нормальная коронарная территория (параметры изображены позади соответствующего столбика, штриховая раскраска) как аналоговая модель потенциально нормальной микроваскулярной перфузии; в группе без диабета параметры значимо не отличались от контрольной группы, однако даже в группе «диабет + ИБС» были значимо лучше, чему пациентов только с диабетом 2-го типа (р<0,02).
В группе с ИБС были отмечены значимо более высокие дозы приема бета-адреноблокаторов, статинов и аспирина, чем в группах контроля и диабета (из 23).
г) Итоги и перспективы. В целом можно установить, что отныне возможна качественная и количественная оценка миокардиальной перфузии с помощью контрастной ЭхоКГ после внутривенного введения ультразвукового контрастного средства. Многочисленные публикации подтверждают выраженную клиническую релевантность различных диагностических и терапевтических консервативных или интервенционных методик.
Тем не менее стремительный технический прогресс в техниках исследования и анализа требует процесса стандартизации и клинической валидации в мультицентровых исследованиях, прежде чем можно будет ожидать, что эти методики будут приняты в клиническую практику. Кроме того, имеется вынужденная задержка, пока ультразвуковые контрастные средства не поступят, наконец, на рынок с разрешением использования для визуализации перфузии.
Благодаря возможности диагностики у постели больного и произвольному числу повторов контрастной ЭхоКГ миокарда в медицине теперь есть инструмент, который позволяет экономически выгодно и без лучевой нагрузки получить новый взгляд на коронарную микроциркуляцию и тем самым служит для ранней диагностики нарушений перфузии и для контроля при тестировании новых перспективных препаратов и техник лечения. То, что от этих результатов выиграют не только пациенты с ИБС, но и пациенты с метаболическим синдромом, например, с сахарным диабетом 2-го типа, значительно увеличивает клиническое значение этой техники.
Возможности современной эхокардиографии
Кандидат медицинских наук.
Доцент кафедры УЗД РМАПО.
Руководитель эхокардиографического общества г. Москвы.

УЗИ аппарат HM70A
Экспертный класс по доступной цене. Монокристальные датчики, полноэкранный режим отображения, эластография, 3D/4D в корпусе ноутбука. Гибкая трансформация в стационарный сканер при наличии тележки.
Эхокардиография на протяжении последних 15-20 лет является одним из основных методов визуализации сердца. Как любой диагностический метод, эхокардиография имеет свои достоинства и недостатки. Широкое внедрение метода в практику обусловлено высоким уровнем современной аппаратуры, отсутствием вредного влияния на пациента и врача, относительной дешевизной метода по сравнению с остальными. Наличие большого количества вариантов исследования позволяет получить точную анатомическую и гемодинамическую информацию о больном и избежать инвазивных вмешательств. Недостатком эхокардиографии является выраженная зависимость от квалификации исследователя. Специалист, занимающийся ультразвуковой диагностикой сердца должен быть кардиологом, в совершенстве знать топографическую анатомию грудной клетки, гемодинамику сердца, иметь пространственное мышление. При отсутствии одного из данных качеств у исследователя резко возрастает процент ошибок диагностики.
В данном обзоре мы постараемся осветить все варианты современного эхокардиографического исследования.
Варианты эхокардиографического исследования
1. Двухмерная эхокардиография - изображение сердца по длинной или короткой оси в реальном времени. Двухмерная эхокардиография (В-режим) позволяет в реальном времени оценить размеры полостей сердца, толщину стенок желудочков, состояние клапанного аппарата, подклапанных структур, глобальную и локальную сократимость желудочков, наличие тромбоза полостей и т. д.
2. М-режим - графическое изображение движения стенок сердца и створок клапанов во времени. М-режим позволил впервые в реальном времени оценить размеры сердца и систолическую функцию желудочков. В настоящее время применяется как вспомогательный режим при проведении эхокардиографического исследования преимущественно для измерений. В том случае, когда в парастернальной позиции курсор М-режима располагается строго перпендикулярно изображению сердца, измерения могут быть проведены с большой точностью. Если изображение сердца и курсор расположены под углом, все размеры камер сердца будут значительно завышены и могут быть неправильно истолкованы. Эта ошибка встречается у специалистов с небольшим стажем работы. Поэтому следует проводить измерения в B- режиме в конце диастолы в том случае, если М-режим не может быть применен. В настоящее время ряд фирм предложили использовать анатомический М- режим, позволяющий изменить угол курсора.
На графике М-разверстки по вертикали откладывается расстояние, по горизонтали - время. В зависимости от положения курсора на экране, можно получить график колебания серии точек, расположенных вдоль курсора, вытянутый во времени, т.е. проследить за их колебанием в систолу и в диастолу.
3. Допплер-эхокардиография - импульсный, непрерывно-волновой, цветовой, цветовой М-режим, энергетический, тканевой цветовой, тканевой импульсный, тканевой С-режим и т. д. - метод, позволяющий неинвазивно оценить параметры центральной гемодинамики. Активное применение методики в медицине можно отнести к началу 80-х годов.
Проведение допплеровского исследования подразумевает высокий технический навык в проведении двухмерного исследования, знание топографической анатомии и гемодинамики сердца.
В эхокардиографии используют следующие варианты допплера:
- (PW - pulsed wave). (HFPW - high frequency pulsed wave). (CW - continuouse wave). (Color Doppler).
- Цветовой М-модальный допплер (Color M-mode). (Power Doppler).
- Тканевой скоростной допплер (TissueVelosity Imaging).
- Тканевой импульсный допплер (Pulsed Wave TissueVelosity Imaging).
Импульсный допплер (Pulsed Wave, или PW). Графическая разверстка импульсно-волнового допплера отражает характер кровотока в конкретной данной точке, в месте установки контрольного объема. Точка установки контрольного объема называется базовой линией. По вертикали на графике откладывается скорость потока, по горизонтали - время. Все потоки, которые в конкретной данной точке движутся к датчику располагаются на графике выше базовой линии; все потоки, которые движутся от датчика - ниже нулевой линии. Помимо формы и характера кровотока на графике можно зафиксировать щелчки открытия и закрытия створок клапанов, дополнительные сигналы от хорд створок и стенок сердца. Импульсный допплер имеет скоростной предел (не более 2,5 м/с ), поэтому с его помощью нельзя зарегистрировать потоки, имеющие высокую скорость.
Импульсный высокочастотный допплер (HFPW - high frequency pulsed wave). Несколько контрольных объемов распологаются один за другим на различной глубине. Это позволяет регистрировать кровоток, скорость которого превышает 2,5 м/с.
Постоянно-волновой допплер (CW - Continuous Wave Doppler). Позволяет регистрировать высокоскоростные потоки. Недостаток метода состоит в том, что на графике регистрируются все потоки по ходу луча. Методика CW допплеровского исследования позволяет произвести расчеты давления в полостях сердца и магистральных сосудов в ту или иную фазу сердечного цикла, рассчитать степень значимости стеноза и т.д.
Основным уравнением CW является уравнение Бернулли, позволяющее расчитать разницу давления или градиент давления.С помощью уравнения можно измерить разницу давления между камерами в норме и при наличии патологического, высокоскоростного кровотока.
Цветовой допплер (Color Doppler). Цветовой допплер - аналог импульсного допплера, где направление и скорость кровотока картируется различным цветом. Так кровоток к датчику принято картировать красным цветом, от датчика - синим цветом. Турбулентный кровоток картируется сине-зелено-желтым цветом.
Цветовой M-модальный допплер (Color M-mode). Сопоставление M-модального режима и цветового допплера при проведении курсора через ту или иную плоскость, позволяет разобраться в фазами сердечного цикла и патологическим кровотоком.
Энергетический допплер (Power Doppler). Применяется для регистрации низкоскоростного кровотока, поэтому в кардиологии он пока не находит активного применения. При использовании энергетического допплера теряется направление кровотока. В настоящее время энергетический допплер используют в сочетании с контрастными веществами (левовист и др.) для изучения перфузии миокарда.
Тканевый допплер (Tissue Velocity Imaging). Принцип данного метода основан на картировании направления движения тканей определенным цветом. Таким образом красным цветом обозначают движение к датчику, синим - от датчика. Изучая направления движения стенок левого и правого желудочков в систолу и диастолу с помощью TVI можно обнаружить скрытые зоны нарушения локальной сократимости. Совмещение двухмерного исследования в режиме TVI с M-модальным увеличивает точность диагностики.
Тканевой импульсный допплер (Pulsed Wave Tissue Velocity Imaging). Позволяет оценить графически характер движения стенки желудочков в конкретной данной точке. Выделяют систолический компонент, ранний и поздний диастолический компоненты.Данный вариант допплера позволяет проводить картирование миокарда и увеличивает точность диагностики у больных с ишемической болезнью сердца.
Таким образом, допплеровские методики позволяют получить большой объем информации без применения инвазивных методов исследования.
4. Чреспищеводная эхокардиография (моно-, би-, и мультиплановая). Исследование сердца через пищевод с использованием специальных датчиков. Информативность метода очень высокая. Противопоказанием служит наличие стриктуры пищевода.
5. Стресс-эхокардиография (с использованием физической нагрузки, чреспищеводной электростимуляции или медикаментозной нагрузки). Широко применяется у больных с ишемической болезнью сердца.
6. Трехмерное и четырехмерное моделирование сердца - компьютерный анализ изображения и построение объемного изображения камер сердца, створок клапанов, кровотока и т. д.
7. Внутрисосудистый ультразвук - исследование коронарных артерий с использованием специального внутрисосудистого датчика малого диаметра. Инвазивный ультразвуковой метод. Используется параллельно с коронарографией.
8. Контрастная эхокардиография - применяется для контрастирования правых камер сердца при подозрении на дефект, или левых камер сердца для исследования перфузии миокарда. Информативность метода контрастирования левых камер сердца сопоставима со сцинтиграфией миокарда. Положительным фактором является отсутствие лучевой нагрузки на больного. Отрицательными факторами являются инвазивный характер метода и высокая цена препарата ( левовист, альбунекс и т.д.).
Современные эхокардиографические приборы
В настоящий момент на рынке представлены ультразвуковые приборы от самых простых до сверхсложных с возможностью с возможностью трех- и четырехмерного моделирования.
Cкрининговое исследование сердца можно провести на любом ультразвуковом приборе, при наличии соответствующего кардиологического датчика и В- и М- режимов. При этом можно использовать недорогие ультразвуковые сканеры. Уровень диагностики и процент ошибки в этом случае во многом зависят от квалификации специалиста.
Современное эхокардиографическое исследование должно включать, помимо В- и М- режимов, цветовой допплер, импульсноволновой допплер и непрерывноволновой допплер. При наличии патологии, только непрерывноволновой допплер позволит измерить высокоскоростные патологические потоки, провести все необходимые расчеты и измерения, оценить гемодинамику.
Объем получаемой информации зависит от возможности датчика. Внутрисосудистые датчики применяются параллельно с ангиографическим исследованием, используются кардиохирургами. Чреспищеводные датчики могут быть моноплановыми, биплановыми и мультиплановыми.
Современные технологии (тканевый допплер, контрасты) позволяют во много раз повысить информативность исследования, особенно, у больных с патологией миокарда.
За рубежом широко развиваются программы работ с эхоконтрастами, однако, в нашей стране это направление в ультразвуке представлено недостаточно.
Заключение
Современная эхокардиография располагает широким спектором диагностических методик. Эхокардиографические ультразвуковые приборы включают приборы от недорогого до высокого класса. Правильно ориентироваться на рынке ультразвука нам позволяют выставки аппаратуры, конгрессы и конференции, а также, журналы и книги по ультразвуковой диагностике.
Список литературы
Практическое применение контрастной эхокардиографии миокарда
а) Информативные ультразвуковые методики. Для контрастной ЭхоКГ миокарда следует использовать контраст-специфические ультразвуковые методики.
В режиме второй гармоники, обычно используемом сегодня в двумерной ЭхоКГ, отображаемая на мониторе интенсивность сигнала всегда является суммой эхогенностей крови и ткани. Поскольку сосуды составляют примерно 5% от объема миокарда, то эффект контрастирования миокарда после внутривенного введения ультразвукового контрастного средства невелик и непригоден для клинической диагностики. При помощи контрастспецифических ультразвуковых методик (пульс-инвертированная методика, энергетическая пульс-инвертированная методика, энергетическая допплер-ЭхоКГ, режим каденции, режим 1,5-гармоники) можно практически до нуля редуцировать интенсивность сигнала от ткани.
При этом будут отображаться исключительно структуры, содержащие ультразвуковое контрастное средство. Визуализируется очень интенсивный сигнал от полостей сердца и более слабое прокрашивание миокарда. Часто эпикардиальный край контрастируется несколько сильнее по причине эпикардиально расположенных сосудов. Исследование миокардиальной перфузии может проводиться как в режиме реального времени (realtime), так и с помощью облучения короткими импульсами - в определенной триггерной точке сердечного цикла.
Методики, специфические для контрастной ЭхоКГ, например режим каденции (Cadence Imaging): без использования контрастного средства (слева) видны лишь отдельные шумовые сигналы, а во время внутривенной инфузии 1 мл/мин Соновью достигается интенсивное контрастирование левого желудочка и менее выраженное окрашивание миокарда (апикальная позиция по длинной оси). Низкоэнергетическая (realtime) методика для контрастной ЭхоКГ миокарда: непрерывное введение контрастного средства и непрерывное облучение с низкой энергией ультразвука приводят к гомогенному контрастированию миокарда (а), кратковременное облучение с более высокой энергией сначала приводит к выраженному повышению эхогенности (б) и затем к разрушению контрастного средства в данном слое миокарда (в). В полостях сердца также происходит частичное разрушение, которое, однако, не приводит к существенному изменению изображения.
Если затем продолжается облучение с низкой энергией ультразвука, то при нормальной перфузии прокрашивание миокарда контрастным средством восстанавливается за 1-2 с (г).
1. Низкоэнергетические методики. При снижении исходной мощности излучения датчика (механический индекс 0,05-0,3) можно настолько снизить разрушение микропузырьков в облучаемом поле, что становится возможным непрерывное облучение. В то время как сама миокардиальная ткань при низкой мощности излучения почти не отражает ультразвуковые волны, сигналы от контрастного средства в миокарде, как правило, хорошо распознаются. Для того чтобы оценить кинетику потоков контрастного средства в миокарде, производится разрушение контрастного средства в исследуемой плоскости при помощи кратковременного повышения исходной мощности излучения до обычного для двумерной ЭхоКГ уровня (механический индекс >1,0), после чего оценивается время повторного притока контраста.
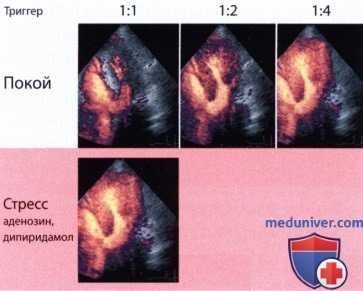
Высокоэнергетическая методика для контрастной ЭхоКГ миокарда. Облучение происходит через определенные промежутки времени для записи отдельных кадров, что приводит к быстрому разрушению микропузырьков, но и к интенсивному сигналу от контрастного средства. Триггерной точкой обычно выбирается конец систолы или конец диастолы. При использовании протокола с аденозином или дипиридамолом выбирается триггер 1/1, т.е. на каждый сердечный цикл производится одно кратковременное облучение. Таким образом время для притока микропузырьков в облучаемую зону миокарда равно одному сердечному циклу. Этого оказывается достаточно для нормального миокарда в состоянии гиперемии.
Если же перфузия миокарда ограничена, то соответствующие зоны остаются темными. В покое миокардиальный кровоток значительно медленнее. Здесь требуется выбрать более долгий интервал, чтобы добиться полноценного контрастирования миокарда (пауза между двумя высокоэнергетическими кадрами составляет 4-6 сердечных циклов).
2. Высокоэнергетические методики. В этом случае используются ультразвуковые колебания с обычной для двумерной ЭхоКГ энергией, что приводит к быстрому разрушению микропузырьков в плоскости исследования. Преимущества «высокоэнергетической» методики заключаются в более высоком соотношении сигнал-шум в сравнении с «низкоэнергетическими». Высокоэнергетические методики используют специфические сигналы, возникающие при разрушении ультразвукового контрастного средства.
Особенно быстро разрушаются микропузырьки, наполненные воздухом, такие как Левовист или Кардиосфера. Эти контрастные средства могут быть разрушены за короткое время, необходимое для построения одного кадра. Постоянное облучение при использовании высокоэнергетических методик невозможно; им требуется периодическая регистрация в специальный «триггерный» момент времени. Для этого в конце диастолы или в конце систолы регистрируется один или несколько кадров. Облучение необходимо постоянно прерывать, чтобы обеспечить приток контрастного средства из соседних слоев. Перерывы в облучении должны быть тем дольше, чем медленнее притекает к миокарду контрастное средство. Поэтому и при высокоэнергетических методиках можно оценивать кинетику притока контрастного средства: чем короче интервал до восполнения контраста в миокарде, тем лучше миокардиальная перфузия.
б) Нормальная перфузия миокарда:
1. Контрастирование миокарда. При использовании контрастспецифических ультразвуковых методик после внутривенного введения контрастного средства, проходящего через легочный круг, возникает гомогенное прокрашивание отделов миокарда. Обнаружение миокардиального контрастирования указывает на интактное микроциркуляторное русло и, тем самым, на жизнеспособный миокард. Но для отнесения данного сегмента в группу «нормально перфузируемого миокарда» дополнительно требуется еще определенный уровень потока контрастного средства в миокарде. Количественная оценка миокардиального кровотока хотя и возможна, но в клинической практике является слишком утомительной и до сих пор недостаточно воспроизводимой.
2. Гиперемия миокарда. Кроме того, миокардиальный поток в покое очень вариабелен и даже при коронарном стенозе высокой степени часто не снижен. Поэтому оценка «нормальности» миокарда лучше всего производится в состоянии максимальной миокардиальной гиперемии. Гиперемию миокарда проще всего вызвать вазодилататором (аденозин, дипиридамол).
Кинетика притока контрастного средства в миокард после целенаправленного разрушения микропузырьков: в покое (прерывистая линия) возобновление контрастирования наблюдается лишь спустя 4 сердечных цикла, т.е. интенсивность сигнала достигает видимого (красного) диапазона. При введении аденозина (сплошная линия) приток контраста происходит значительно быстрее, и уже через один сердечный цикл контрастное средство визуализируется в миокарде. H-PDI - энергетическая гармоническая допплерография. Нормальная перфузия миокарда, внутривенная инфузия 0,8 мл Соновью, режим модуляции энергии: слева - регистрация вскоре после разрушения контрастного средства в миокарде, справа -через 1 с полноценное и гомогенное контрастирование миокарда.
3. Оценка миокардиального кровотока. Миокардиальный кровоток оценивается на основании скорости микропузырьков, которые вместе с кровью пассивно перемещаются через миокард. Лучше всего удается оценить миокардиальный кровоток во время внутривенной инфузии контрастного средства. После целенаправленного разрушения контрастного средства в миокарде можно исследовать приток контрастного средства в миокард. При максимальной гиперемии приток контраста из относительно больших сосудов в микроциркуляторное русло происходит за 1-2 с.
4. «Низкоэнергетические» методики. В случае «низкоэнергетических» методик производится кратковременное облучение ультразвуком с мощностью, обычной для двумерной ЭхоКГ. В результате разрушается контрастное средство, находящееся в плоскости сканирования. Время до повторного прокрашивания миокарда коррелирует со скоростью кровотока в микроциркуляторном русле.
5. «Высокоэнергетические» методики. В случае «высокоэнергетических» методик оценка скорости потока проще: в каждый сердечный цикл происходит однократное облучение для регистрации лишь одного кадра. После кратковременного облучения, которое всегда приводит к разрушению контрастного средства, в течение одного сердечного цикла имеется время для притока контраста. Если за этот период восстанавливается контрастирование миокарда, то при использовании микропузырьков, наполненных азотом, можно говорить о нормальной перфузии.
Перспективы применения контрастной эхокардиографии
а) Физические основы. Доступность современных ультразвуковых контрастных средств привела к целому ряду фармакологических и технических усовершенствований, открывших эхокардиографии совершенно новые перспективы в диагностике и терапии. Контрастспецифические визуализирующие методики позволяют селективно отображать сигналы от контрастного средства и могут надежно подавлять тканевые сигналы, даже от подвижных структур, таких как сердце. Новые алгоритмы используются как для эмиссии ультразвуковых волн, так и для регистрации и обработки сигналов, отраженных от тканей и контрастного средства. Описанные в отдельных статьях визуализирующие методики основаны на различных волновых свойствах микросфер контрастного средства в зависимости от энергии ультразвука.
Рисунок ниже поясняет эти характерные волновые свойства микросфер контрастного средства при различном уровне ультразвуковой энергии. Дополнительно на рисунке показано, что довольно высокий процент микросфер контрастного средства может быть изменен и даже разрушен уже при низких уровнях ультразвуковой энергии. Как раз эти свойства контрастных микросфер принципиально отличаются от отражающих свойств тканей и являются основой для новых стратегий визуализации и терапии, описываемых в статьях на сайте.
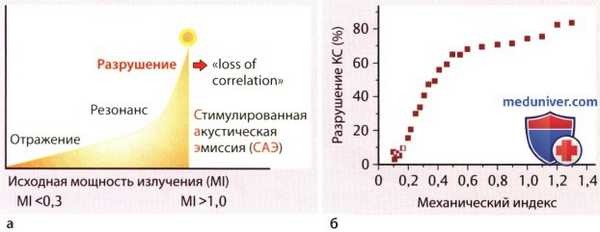
Влияние ультразвуковой энергии на контрастное средство:
а - Влияние энергии ультразвука (механический индекс, MI) на отражательные свойства контрастного средства.
б - Процент разрушения контрастного средства Дефинити в зависимости от MI.
б) Молекулярное построение изображения:
1. Принцип. Благодаря стабилизации оболочки и газового ядра ультразвуковые контрастные средства 2-го поколения можно рассматривать как строго внутрисосудистые усилители сигнала, чье поведение в потоке сходно с поведением эритроцитов. Это позволяет визуализировать сосуды вплоть до микроциркуляторного русла. Многочисленные коллективы занимались вопросом, возможно ли наряду с качественным и количественным анализом макро- и микроциркуляции при помощи модификации микросфер контрастного средства прийти к «таргетному» или даже молекулярному построению изображений. Рисунки ниже демонстрируют примеры таких возможных модификаций, превращающих нормальный микропузырек контрастного средства в так называемый «нацеленный» или «таргетный» («targeted-microbubble»). Основной принцип этих изменений заключен в варьировании оболочки микросферы.
Для этого в оболочку контрастного средства вводятся, например, носители заряда (положительный или отрицательный заряд), биотиновые или стрептовидинбиотиновые комплексы или даже целые комплексы антител.
При помощи соединения с биотином (В) ультразвуковые контрастные средства могут специфически связываться с помеченным антителами эпитопом (цель - target) (см. текст). Перенос медикаментов или генов через модифицированные микропузырьки. Изображенные синим цветом вещества переносятся на оболочке, в оболочке или внутри оболочки, а в нужном месте высвобождаются при разрушении пузырьков. «Пузырек» дополнительно имеет антитела на своей поверхности, позволяющие целенаправленно связываться с антигеном (targeting) перед высвобождением содержимого.
2. Диагностика атеросклероза. В одной из более ранних работ коллектив исследователя Villanueva показал, что возможно присоединение к микропузырькам моноклональных антител к молекуле внутриклеточной адгезии (ICAM-1) (44). ICAM-1 является представителем группы лейкоцитарных молекул адгезии (LAM). Увеличенная экспрессия LAM является специфическим показателем начинающейся эндотелиальной дисфункции. При целенаправленном обнаружении IСАМ-1 на эндотелиальных клетках при помощи микропузырьков, покрытых антителами анти-ICAM-1, впервые был создан ультразвуковой инструмент для ранней диагностики атеросклероза. В модели на животных была изучена и другая важная область применения этой визуализирующей стратегии (также с позитивными результатами): диагностика острой реакции отторжения после трансплантации сердца.
3. Диагностика воспаления. В области диагностики воспалительных реакций Linder и соавт. впервые показали, что микропузырьки задерживаются в месте воспаления. Это происходит из-за связывания микропузырьков с лейкоцитами и из-за их фагоцитоза лейкоцитами. При этом микропузырьки сохраняют свои акустические свойства. При включении фосфатидилсерина в липидную оболочку микропузырьков этот эффект можно усилить. Тем самым создается интересная область применения в сфере сердечно-сосудистых заболеваний, особенно в диагностике постишемических воспалительных реакций миокарда, но, возможно, и в диагностике миокардита. Та же группа при помощи ЭхоКГ с лейкоцит-таргетным контрастным средством впервые продемонстрировала возможность неинвазивной визуализации реперфузионного повреждения миокарда. Schumann и соавт. показали улучшение детекции тромбов при использовании GP-IIb/IIIа-специфических лигандов в оболочке микропузырьков.
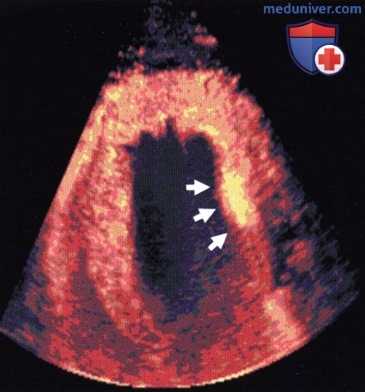
Маркировка статичных лейкоцитов в сердце свиньи через 20 мин после инъекции. Контрастное средство обнаруживается только в миокарде (стрелки: очаг постишемического воспаления).
4. Маркировка целевых областей и отдельных клеток. Рисунок ниже демонстрирует наиболее интересную для исследований возможность маркировки целей при помощи комплексов биотина с антителами. При этом сначала комплекс биотин-антитело связывается с эпитопом целевой области. Последующее добавление биотина (шаг 2) позволяет биотинилированным микросферам контрастного средства связываться с целевой областью. Из-за большого количества доступных антител, особенно для моделей на морских свинках, здесь имеется интересная возможность для применения исследовательских результатов; первые подобные контрастные средства уже находятся в стадии клинического тестирования.
Наряду с маркировкой фиксированных целевых областей можно помечать и отдельные клетки. Здесь принципиально возможным является маркировка клеток ex vivo. Это особенно справедливо для фагоцитирующих клеток, которые можно будет обнаруживать в организме при периферическом внутривенном введении. Точно так же при помощи лигандов создается возможность для специфической маркировки клеток в кровотоке. В научных публикациях эти методики обозначаются как «cell tracking» (отслеживание клеток) и «cell trafficing» (изучение движения клеток) и важны для исследования воспалительных реакций, а также в большой области заместительно-клеточной терапии (исследование стволовых клеток). При этом становится возможным (особенно в модели на животных) неинвазивное отслеживание отдельных клеток в организме с высоким пространственным разрешением. Это удается потому, что высокая чувствительность и специфичность сигналов от контрастного средства позволяет визуализировать даже отдельные микросферы контраста.
в) Использование тканевых эффектов микропузырьков:
1. Кавитация. Дискуссия о потенциальных биологических эффектах ультразвука так же стара, как и сам метод. Кроме нагревания тканей ультразвуковыми волнами, особенную роль в этом играют эффекты кавитации. Термин «кавитация» обозначает образование в жидкости при пониженном давлении пузырьков газа. Такая область пониженного давления может возникнуть при ультразвуковом облучении в отрицательную фазу волны, когда локальное давление ультразвука становится достаточно низким, чтобы растворенный в крови газ переходил в газообразное состояние. Подобно тому, как это бывает в технике (например, при использовании гребных винтов кораблей), при схлопывании этих газовых пузырьков может повреждаться ткань. При диагностическом использовании ультразвука его энергия удерживается на таком низком уровне, что повреждения клеток не возникают.
Но этот биологический эффект может быть более выраженным при введении микросфер ультразвукового контрастного средства в случае достаточно высокого акустического давления и при использовании соответствующим образом построенных ультразвуковых импульсов. Skyba и соавт. показали in vivo (в экспериментах на животных), что при внутривенном введении контрастного средства и облучении ультразвуком можно вызвать повреждение капилляров. Другие группы в опытах на морских свинках при использовании ультразвука с нефизиологически высокой энергией наблюдали повреждения капилляров миокарда при инфузии контрастного средства.
2. Индукция артериогенеза. Однако этот нежелательный биологический эффект, не возникающий при диагностическом использовании ультразвуковых контрастных средств с обычными в клинической практике дозами контраста, может быть использован в терапевтических целях. Song и соавт. показали, что индуцированная ультразвуком деструкция контрастных микросфер в скелетной мышце крысы может вызвать артериогенез. При этом сознательно повреждались сосуды скелетной мышцы при помощи облучения ультразвуком после введения контрастного средства. Одну и две недели спустя после вмешательства у обработанных животных была обнаружена значительно повышенная плотность капилляров. Для объяснений механизма этого артериогенеза Yoshida и соавт. обнаружили повышенное количество воспалительных клеток после таргетной ультразвуковой терапии пузырьками и повышенную продукцию ФРЭС (фактора роста эндотелия сосудов). Индукция этих воспалительных реакций была объяснена как следствие опосредованного ультразвуком повреждения капилляров и повышения оксидативного стресса в окружающих тканях.
В хронической модели ишемии на задней лапе животного был обнаружен неоангиогенез, что привело к значительно более высокой толерантности к нагрузке, так что авторы постулировали возможное применение этой методики в области рефрактерного к лечению терминального артериосклероза.
Imada и соавт., кроме того, показали, что индуцированная ультразвуком деструкция контрастного средства в комбинации с трансплантацией стволовых клеток костного мозга может индуцировать усиление регионального ангиогенеза и артериогенеза. Еще одну возможную область применения прямого действия ультразвука предложили Fitzgerald и соавт. Они показали, что облучение сосудистых стентов приводит к уменьшению неоинтимальной гиперплазии. Эта методика также еще находится на ранней экспериментальной стадии.
г) Сонотромболизис. Уже в 1995 г. Tachibana и соавт. показали, что в экспериментальной модели тромбоза при введении ультразвукового контрастного средства и одновременном облучении ультразвуком разрушение тромба в рамках урокиназного лизиса происходит гораздо быстрее. Mizushige и соавт. на той же модели показали, что для этой терапии особенно подходят новые контрастные средства (2-го поколения). Culp и соавт. в 2003 г. сообщили, что в экспериментах на животных при тромбозированных артериовенозных диализных шунтах после введения ультразвукового контрастного средства и применения нового терапевтического ультразвукового датчика можно было произвести сонотромболизис в шунте и реканализацию во всех случаях острого тромбоза шунта.
1. Инфаркт головного мозга. В первом небольшом клиническом исследовании Eggers и соавт. показали, что у пациентов в острой стадии инсульта, которым был противопоказан тромболизис RTPA (рекомбинантным тканевым активатором плазминогена), одночасовое прерывистое облучение ультразвуком привело к значительно лучшей реперфузии, чем в контрольной группе без лечения. Отсюда авторы сделали заключение, что наряду с улучшением тромболизиса (например, RTPA) от этой методики могут выиграть пациенты с противопоказаниями к традиционному тромболизису. Daffertshofer и соавт. также подтвердили эти результаты в экспериментах на животных и показали лучшую эффективность RTPA-лизиса, что выразилось в меньшем объеме инфаркта. При этом индукция ультразвуком кровотечений не отмечалась.
2. Инфаркт миокарда. Cohen и соавт. при исследовании ретеплазного и тенектеплазного лизиса у пациентов с инфарктом миокарда показали преимущество его сочетания с одновременным чрескожным облучением ультразвуком. В этом исследовании использовался аппарат с низкочастотными ультразвуковыми импульсами, наносившимися через укрепленный на коже грудной клетки датчик. В этом исследовании не было описано никаких побочных явлений. Разработанный прибор в настоящее время находится на стадии клинического тестирования. С точки зрения авторов именно такая методика имеет перспективу на быстрый успех, поскольку без проблем может быть встроена в рутинную схему лечения.
д) Сонопорация:
1. Принцип. Таргетная и локально-региональная доставка веществ и, тем самым, локально-региональная терапия является предметом многочисленных научных усилий с использованием самых различных таргетных носителей. Хотя липосомы, церамиды и другие вещества могут в принципе проникать через эндотелий сосудов, но их нацеленное применение возможно лишь в ограниченной степени. Ультразвуковые контрастные средства впервые дают возможность преодолеть эти ограничения. При так называемой сонопорации фармакологически действенные молекулы или медикаменты при помощи опосредуемых ультразвуком эффектов могут проникать через клеточную мембрану и высвобождаться в заданной целевой области. Точный механизм сонопорации до сих пор не ясен. Однако в записях с высокой частотой кадров было показано, что при взрывах микросфер контрастного средства из газовых пузырьков выходят так называемые «микроструи» («microjets») или «микропар» («micro-streamings»). Фотографии на растровом электронном микроскопе сонопорированных клеток показали наличие в клеточной мембране временных микропор, через которые активно или пассивно медикаменты переходят в цитозоль.
Price с соавт. показал принципиальную применимость этой методики с использованием флуоресцирующих полимерных микросфер с диаметром в 205 и 503 нм.
2. Повышенное локально-региональное усвоение веществ. При одновременном введении микросфер ультразвукового контрастного средства и «фактора роста эндотелия сосудов» («vascular endothelial growth factor», VEGF) было показано более чем 10-кратное повышение усвоения VEGF при одновременном облучении ультразвуком и введении контрастных микросфер. Bekerdjan и соавт. показали органоспецифический локально-региональный перенос флуоресцирующих протеинов в кардиальные структуры. Mehier-Humbert и соавт. постулировали, что сонопорация вызывает появление временных микропор, нанося клетке сублетальное повреждение. Авторы показали, что индуцированные микропоры обнаруживаются лишь в течение очень короткого времени (от миллисекунд до нескольких секунд). В области терапии опухолей в опытах на животных уже были изучены первые применения локальнорегиональной химиотерапии. В одной из новых работ при помощи сонопорации после внутривенного введения доксорубицина была обнаружена значимо повышенная концентрация препарата в сосудистой стенке венозных шунтов в бассейне сонной артерии. Тем самым была уменьшена гиперплазия интимы.
Доказательство экспрессии генов после опосредованной ультразвуком трансфекции (сонопорации) плазмидной ДНК, кодированной на флуоресцирующий белок (eGFP), в клеточной культуре.
Через 36-48 ч после облучения ультразвуком белок (флуоресценция) обнаруживается во флуоресцентном микроскопе как специфическое доказательство трансфекции.
Эта методика имеет значительный потенциал в рамках невиральной генной терапии.
д) Генная терапия:
1. Локальная невиральная генная терапия. Teupe и соавт. и наша собственная рабочая группа показали в первых исследованиях in vitro, что при помощи сонопорации можно переносить не только медикаменты или даже протеины, но и производить трансфекцию плазмидной ДНК при помощи разрушения в клетках микропузырьков, содержащих плазмиды. В эксперименте была произведена трансфекция LacZ-кодирующей плазмидной ДНК, а также плазмиды, кодированной eNOS. Была доказана как успешная экспрессия, так и эффективность генного продукта. Эту новую терапевтическую стратегию можно обобщить термином «локальная невиральная генная терапия», и она представляет собой новую интересную форму применения генных конструктов. Важными преимуществами по сравнению с виральной генной трансфекцией являются отсутствие иммуногенности и локально-региональное применение. Рабочая группа под руководством Grayburn показала высокую эффективность миокардиальной трансфекции. На данный момент, кроме трансфера плазмидной ДНК, уже был продемонстрирован трансфер «малой интерферентной РНК» («small interference RNA», siRNA). Тем самым становится возможным не только стимулировать экспрессию генов, но и целенаправленно подавлять экспрессию определенного белка в заданной целевой области.
2. Применение фокусированного ультразвука. Современные ультразвуковые методики, например такие, как высокоинтенсивный фокусированный ультразвук (High Intensity Focused Ultrasound, HIFU), могли бы играть особенную роль в клинических условиях. В настоящее время проводится интенсивная работа над новыми конструкциями, при помощи которых можно было бы успешно стимулировать поступление препаратов, белков, трансфицировать плазмидные ДНК/siRNA или даже вирусные частицы. Ценность этих новых методик, особенно на фоне возможных повреждений тканей, еще следует определить. Но поскольку при помощи фокусированного ультразвука биологические эффекты, возникающие при сонопорации, можно ограничит ь очень малыми целевыми объемами, в конечном итоге успех этих новых методических разработок зависит от развития эффективных конструкций.
Эхокардиография (УЗИ сердца)
Медицинский редактор: Строкина О.А. - терапевт, врач функциональной диагностики.
Июль, 2019.
Синонимы: УЗИ сердца, эхокардиография, эхокардиоскопия, ЭХОКС, ЭХОКГ.
Эхокардиография - ультразвуковое исследование сердца, позволяющее провести оценку всех структур и функциональное состояние органа.
Обследование проводится врачом функциональной диагностики в амбулаторных или стационарных условиях в течение 15-30 минут, редко длительность доходит до 60 минут, но только в очень сложных случаях и совместно с консилиумом врачей.
Показания
Патологий, при которых необходимо провести эхокардиографию довольно много, и все они связаны так или иначе с дифференциальным диагнозом болезней сердца или аорты. К срочным показаниям для трансторакальной ЭХОКГ относятся:
- острые, колющие, режущие боли в области сердца, которые пациент ощущает впервые;
- давящие, сжимающие боли, возникшие в первый раз или усилившиеся по интенсивности и продолжительности;
- внезапно возникшая одышка.
Кроме того обязательно периодическое исследование сердца при его хронических заболеваниях и при наличии факторов риска:
- , в том числе стенокардия, развившийся ранее инфаркт миокарда; ;
- бактериальный эндокардит (воспаление внутренней оболочки сердца);
- пороки сердца - приобретенные и врожденные;
- протезированные клапаны;
- некоторые малые аномалии развития сердца (двустворчатый аортальный клапан, пролапс митрального клапана); ; ;
- опухоли сердца;
- заболевания аорты; ;
- шумы в сердце;
- нарушения ритма сердца;
- травмы грудной клетки;
- профессиональные занятия спортом.
Виды эхокардиографии
Ультразвуковое исследование сердца проводится разными способами:
Трансторакальная ЭХО-КГ
Фото: классическое положение тела при проведении обычного УЗИ сердца.
Через грудную клетку. Используются обычные ультразвуковые датчики небольшого размера, которые специалист прикладывает к коже. Это наиболее часто используемое в практике исследование из-за простоты самой процедуры и доступности оборудования.
Противопоказаний к трансторакальной ЭХО-КГ нет, однако обследование может быть затруднено в при невозможности проведения исследования на левом боку. Например при тяжелой степени сердечной недостаточности, когда пациент не в состоянии находиться в положении лежа из-за возникающей выраженной одышки. Также сложности возникают при наличии у больного заболеваний легких, которые увеличивают их воздушность (хроническая обструктивная болезнь легких - ХОБЛ) и тем самым препятствуют проникновению ультразвука до сердца. Также существуют и другие патологические состояния, которые могут усложнить обследование.
После трансторакального обследования в покое осложнений не бывает.
Стресс-эхокардиография
Это специфическая методика процедуры позволяющая оценить работу сердца в условиях повышенной активности человека. Для этого в начале проводят обычное трансторакальное исследование, а потом дают физическую нагрузку (приседания, велотренажер) или проводят фармакологическую пробу для имитации повышения физической активности. Первый вариант более предпочтителен, поскольку более физиологичен и вероятность проявления какой-либо нежелательной реакции минимальна. Естественно рядом с пациентом необходимо присутствие врача-реаниматолога и кардиолога, которые смогут адекватно и своевременно отреагировать на острые ситуации (выраженный болевой синдром в области сердца, шок, потеря сознания, остановка сердца, аритмии и т.д.).
При исследовании с физической нагрузкой или фармакологической пробой могут появиться:
- аллергия на лекарственный препарат;
- аритмия;
- боли в области сердца;
- потеря сознания;
- шок и др.
Перечисленные реакции возникают крайне редко и быстро купируются (излечиваются) при наличии рядом реаниматолога или кардиолога.
Черспищеводная ЭХО-КГ (ЧПЭХО)
Процедура похожа на ФГДС - используется специальный эндоскоп с ультразвуковым датчиком на конце, который доктор вводит через рот до уровня сердца (на эндоскопе присутствуют специальные отметки с расстоянием). Датчик прижимается к стенке пищевода и изображение органа появляется на экране монитора аппарата. Этот вид обследования проводится реже, так как это более сложная технология, предусматривающая использование отдельного датчика с эндоскопом и специально обученного специалиста функциональной диагностики и медицинской сестры.
ЧПЭХО проводят, когда нет возможности провести трансторакальное исследование: выраженная подкожно жировая клетчатка, серьезные легочные заболевания, или просто в силу конституции человека легкие большей частью прикрывают сердце. Кроме того доступ через пищевод позволяет с большей точностью выявить дефекты межжелудочковой и межпредсердной перегородок, а также обнаружить тромб в ушке левого предсердия, которое не визуализируется при трансторакальном доступе. Такая процедура обязательна к проведению перед лечением (электроимпульсная терапия - восстановление ритма с помощью небольшого разряда дефибриллятора) определенных видов аритмий.
Из-за большей инвазивности ЧПЭХО для его проведения существует ряд противопоказаний:
- крайне тяжелое состояние пациента;
- заболевания пищевода - злокачественные новообразования, стриктуры (сужения), дивертикулы, варикозное расширение вен пищевода, эзофагит 1 .
Во время ЧПЭХО осложнения также крайне редки и связаны в первую очередь с введением эндоскопа. К таковым относятся перфорация пищевода или повреждение его стенки и голосовых связок. Кроме того возможно появление аритмии.
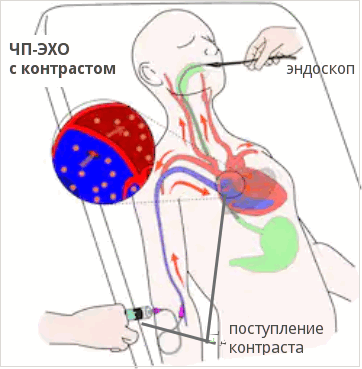
Фото: схема проведения чреспищеводного УЗИ с контрастом
ЭХО-КГ с контрастом (контрастное УЗИ сердца)
Также выделяют эхокардиографию с контрастированием правых камер сердца с использованием обычного физиологического раствора в качестве контрастного вещества и контрастное УЗИ всего сердца с помощью инновационного препарата SonoVue (Соновью). Этот препарат представляет собой микропузырьки с газообразным содержимым. Благодаря свойству ультразвука отражаться от границы сред с разной плотностью (наибольшая разница плотности на границе ткань-газ), контраст “светится”. Такая методика появилась сравнительно недавно и позволяет:
- более четко определить размеры полостей сердца,
- выявить с большей точностью минимальные дефекты перегородок и другие пороки сердца;
- более точно определить функцию левого желудочка за счет проникновения контраста внутрь сердечной мышцы.
ЭХО-КС с контрастированием используется и при доступе через грудную клетку, и через пищевод.
УЗИ с контрастом обычно проводится для диагностики пороков сердца и для подтверждения разрыва миокарда.
Проведение эхокардиографии с контрастированием противопоказано при:
- остром коронарном синдроме;
- нестабильной стенокардии;
- инфаркте миокарда в острой стадии;
- острой сердечной недостаточности III-IV степени;
- тяжелой легочной гипертензии;
- острых стадиях неврологических заболеваний;
- неконтролируемой артериальной гипертензии;
- нахождении пациента на ИВЛ;
- беременности и грудном вскармливании;
- аллергии на компоненты контрастного вещества.
Осложнения при контрастировании ограничиваются локальными реакциями в месте введения препарата в вену или артерию и теоретически непереносимостью препарата. Основную опасность при исследовании с контрастированием представляет то, что его чаще проводят в совокупности с физической нагрузкой или фармакологической пробой, соответственно и осложнения те же.
Как проводится УЗИ сердца
Во время эхокардиоскопии доктор использует различные режимы УЗ аппарата:
- одномерный (М-режим),
- двумерный (В-режим),
- режим допплера (оценка скорости потоков крови в камерах и сосудах),
- цветового допплера - ЦДК (для определения направления потоков крови и выявления патологических),
- энергетический допплер (регистрирует сам факт наличия кровотока в сосудах),
- тканевой допплер (более глубокая оценка сократимости миокарда, основанная на исследовании характера движения стенок от датчика и к нему),
- 3D-эхокардиография (максимальную пользу приносит перед операциями на клапанах - они практически полностью визуализируются до вмешательства, что важно для определения тактики хирургом).
Трансторакальное УЗИ
Эхокардиография через грудную клетку проводится в кабинете ультразвуковой или функциональной диагностики. Иногда в стационаре из-за тяжести пациента и невозможности транспортировки для его обследования используют переносной аппарат УЗИ. Медсестра или врач просят больного раздеться сверху до пояса, в том числе необходимо снять нижнее белье женщинам. Далее пациенту необходимо лечь на кушетку на левый бок и положить левую руку под голову. При этом головной конец кушетки немного приподнят - так достигается максимальное расстояние межреберных промежутков для лучшей визуализации сердца.
Положение больного по отношению к врачу может быть различное, все зависит от предпочтений последнего и обустройства кабинета. Пациент может быть повернут лицом или спиной к доктору, головой к аппарату или от него.
Специалист смазывает датчик УЗ-проводящим гелем для лучшего контакта с кожей, прикладывает его к левой части грудной клетки, визуализирует сердце, выводя стандартные позиции его для произведения измерений.
Чреспищеводное ЭХОКГ
Чреспищеводное ЭХО проводится строго натощак в кабинете УЗИ или функциональной диагностики. Берут согласие пациента на проведение исследования, объяснив перед этим всю его суть и ход событий. Горло орошают лидокаином с помощью спрея, просят удалить зубные протезы и лечь на кушетку на левый бок, согнув ноги в коленях и положив руки под щеку или на живот. В рот вставляется загубник, чтобы пациент не прикусил зонд. Затем врач вводит эндоскоп. В начале просит больного совершить глотательные движения для более легкого продвижения аппарата. Доведя до определенной позиции, врач начинает само обследование. Оно длится 10-20 минут.
ЭХОКГ с контрастом
При использовании контрастного вещества его вводит в одну из вен или артерий на бедре - зависит от вида препарата и цели исследования. При этом УЗ датчик остается на пациенте, чтобы вовремя зарегистрировать все данные и провести измерения.
Расшифровка результатов
Во время исследования врач оценивает линейные размеры и объемы камер сердца, локальную и общую (фракция выброса) сократимость и скорость кровотока через клапаны, в сосудах.
| Показатель | Значение для женщин | Значение для мужчин | ||||||
|---|---|---|---|---|---|---|---|---|
| норма | незначительное нарушение | умеренное нарушение | значительное нарушение | норма | незначительное нарушение | умеренное нарушение | значительное нарушение | |
| Толщина межжелудочковой перегородки | 6-9 мм | 10-12 мм | 13-15 мм | более 16 мм | 6-10 мм | 11-13 мм | 14-16 мм | более 17 мм |
| Толщина задней стенки левого желудочка | 6-9 мм | 10-12 мм | 13-15 мм | более 16 мм | 6-10 мм | 11-13 мм | 14-16 мм | более 17 мм |
| Масса миокарда левдого желудочка (ММЛЖ) | 66-150 г | 151-171 г | 172-192 г | более 193 г | 66-150 г | 151-171 г | 172-192 г | более 193 г |
| Индекс ММЛЖ (более значимый показатель - учитывает рост пациента) | 43-95 г/м2 | 96-108 г/м2 | 109-121 г/м2 | более 122 г/м2 | 49-115 г/м2 | 116-131 г/м2 | 132-148 г/м2 | более 149 г/м2 |
| Фракция выброса | более 55% | 45-54% | 30-44% | менее 30% | более 55% | 45-54% | 30-44% | менее 30% |
| Сократимость | не нарушена | |||||||
В заключении пациент может обнаружить следующие термины:
- акинез - отсутствие сокращения мышцы\стенки;
- гипокинез - минимальное сокращение;
- дискинез - асинхронность сокращений стенок;
- гипертрофия - утолщение;
- диастолическая дисфункция - нарушение расслабления сердечной мышцы;
- систолическая дисфункция - нарушение сократительной способности миокарда;
- дилатация - расширение полости.
Что показывает ЭХОКГ
В процессе проведения процедуры врач проводит структурную визуализацию и гемодинамическую (допплерография) 3 .
Структурная визуализация включает:
- Визуализация перикарда (например, для исключения перикардиального выпота);
- Визуализация левого или правого желудочка и их полостей (для оценки гипертрофии желудочков, аномалии движения стенок, а также для визуализации тромбов);
- Визуализация клапанов (митральный стеноз, стеноз аорты, пролапс митрального клапана);
- Визуализация магистральных сосудов (рассечение аорты);
- Визуализация предсердий и перегородок между камерами сердца (врожденный порок сердца, травматические повреждения).
- Визуализация кровотока через сердечные клапаны (клапанный стеноз и регургитация)
- Визуализация кровотока через камеры сердца (расчет сердечного выброса, оценка диастолической и систолической функции сердца)
ЭХОКГ при сердечной недостаточности
- Дает возможность определить причины развития хронической формы (ХСН)
- Фракция выброса левого желудочка:
- снижена (систолическая ХСН);
- нормальная (диастолическая ХСН).
ЭХОКГ при нарушениях ритма сердца
Важно! Тахикардия затрудняет проведение исследования и точность оценки полученных результатов.
Используется трансторакальная ЭХОКГ и ЧП ЭХОКГ.
- Размеры полостей сердца, особенно предсердий
- Наличие тромбов
- Оценка фракции выброса не всегда достоверна
ЭХОКГ для оценки состояния онкологических больных
Поражение сердца у онкологических больных:
- опухолевая интоксикация;
- кардиотоксичность химиопрепаратов;
- кардиотоксичность лучевой терапии.
Показания к специализированной эхокардиографии для определения кардиотоксичности:
- всем пациентам с онкологическими заболеваниями перед началом лечения;
- получающим химиотерапию или лучевую терапию (после каждого курса);
- получавшим в прошлом химиотерапию или лучевую терапию (регулярность зависит от схемы лечения).
Сравнительная характеристика ЭХОКГ с другими методами
Эхокардиография несмотря на свою огромную пользу остается все-таки субъективным методом. Врачами по-разному проводятся измерения и трактуются некоторые показатели. Порой одной ЭХО-КГ бывает недостаточно или провести ее невозможно в силу каких-либо причин. Тогда на помощь придут другие методики исследования сердца:
- Электрокардиограмма - самый простой способ выявить сердечные проблемы. Аппаратами ЭКГ оснащены все лечебно-профилактические учреждения страны и машины скорой помощи. ЭКГ выявляет нарушения ритма и дает вероятную характеристику локальной сократимости (изменения при инфаркте миокарда), однако при ЭХО-КГ все может выглядеть совершенно по-другому.
- Рентгенография органов грудной клетки позволяет определить границы сердца и выявить кардиомегалию. Для точной диагностики причин необходима визуализация органа. используется для уточнения данных эхокардиографии, изучения морфологии, функций сердечных камер, клапанов. Сейчас она все больше используется для диагностики некоронарогенных болезней миокарда, различных кардиомиопатий.
- Компьютерная томография с контрастированием очень эффективна при исследовании коронарных артерий. Ее стоимость меньше КАГ (коронароангиография) Также можно определить все размеры и объемы сердца, но не даст возможности видеть его работу в реальном времени.
- Коронарная ангиография (КАГ) - “золотой стандарт” в исследовании коронарных артерий с помощью контрастного вещества с выявлением стенозов и последующим возможным их стентированием (способ расширения просвета сосуда). Ее недостатки - очень высокая стоимость и инвазивность процедуры.
- Позитронно-эмиссионная томография - редкое исследование с введением радиофармпрепарата. Прекрасно визуализирует участки с недостаточным кровоснабжением (ишемия) миокарда
Эхокардиография является основным и самым доступным методом визуализации сердца, позволяющим поставить точный диагноз, своевременное лечение, а также оценить его эффективность. Несмотря на субъективность метода, при постоянном обучении, повышении квалификации, обмене опытом с коллегами специалист повышает свою грамотность в обследовании и сводит к минимуму возможность ошибок.
Эхокардиография не стоит на месте. Продолжаются попытки дополнить метод все новыми возможностями визуализации, некоторые из них позволяют максимально объективно проводить исследования и минимизировать различия толкования между разными специалистами.
- Саидова М.А. Чреспищеводная эхокардиография: показания, техника проведения. - Болезни сердца и сосудов, №4 2007. Marwick T.H., пер. с англ.: к.м.н. Крикунова П.В. Рекомендации по применению эхокардиографии при артериальной гипертензии у взрослых: отчет Европейской ассоциации по сердечно-сосудистой визуализации (EACVI) и Американского эхокардиографического общества (ASE). Системные гипертензии. №2 2017. Ishak A Mansi, MD. Echocardiography. - Medscape, Jan 2014.
Важно! Все материалы носят справочный характер и ни в коей мере не являются альтернативой очной консультации специалиста.
Этот сайт использует cookie-файлы для идентификации посетителей сайта: Google analytics, Yandex metrika, Google Adsense. Если для вас это неприемлемо, пожалуйста, откройте эту страницу в анонимном режиме.
Читайте также:
