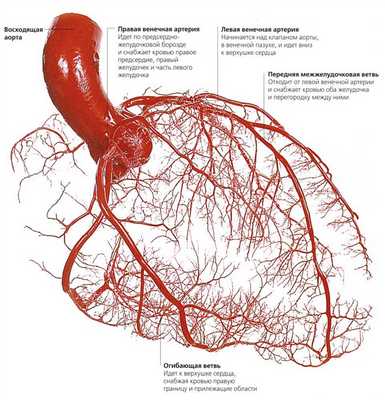
Правая венечная артерия. Правая коронарная артерия. Левая венечная артерия. Левая коронарная артерия.
Добавил пользователь Cypher Обновлено: 28.01.2026

В университетскую программу первых курсов входит изучение строения сердца и его коронарных сосудов. Но чаще всего авторы учебников ограничиваются описанием только крупных сосудов. Клиницисты же используют совершенно иную, но также международную номенклатуру. Коронароангиография и имплантация стентов требуют более подробного описания сосудов сердца, что нашло применение и в международной практике.
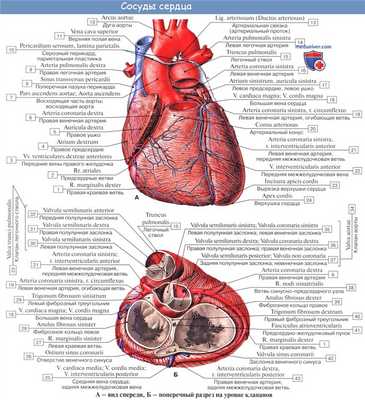
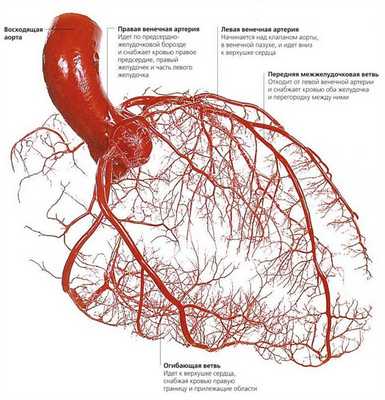
Из курса анатомии каждый узнал, что от аорты отходят две артерии, кровоснабжающие само сердце: левая и правая коронарные артерии. Утолщения на корне аорты, из которых и выходят эти артерии, называются соответственно левым и правым коронарными синусами.
Выделяют следующие части левой коронарной артерии (LCA, left coronary artery): главный ствол, который делится на переднюю межжелудочковую ветвь (ramus interventricularis anterior, RIVA или left anterior descending, LAD), а также огибающую артерию (left circumflex coronary artery, LCх).
Главный ствол этой артерии длиной редко превышает 1 см, а далее делится на две свои конечные ветви. Передняя межжелудочковая ветвь располагается на передней поверхности сердца вплоть до его верхушки. На своем протяжении от этой артерии отходят передние желудочковые ветви (диагональные ветви, RD/R.Diag) и передние перегородочные ветви. В коронароангиографии с целью топического указания места поражения предложено делить коронарное русло на сегменты.
Проксимальный сегмент ПМЖВ начинается своим ответвлением от ствола и продолжается до места отхождения от нее первой перегородочной или первой RD, средняя часть — до ответвления второй перегородочной ветви или второй RD, дистальная — до верхушки сердца/после отхождения второй RD.
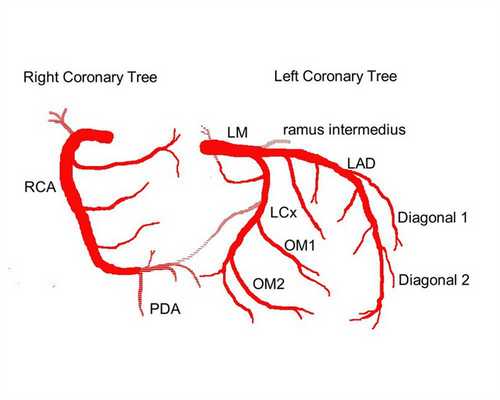
Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Выделяют следующие три части правой коронарной артерии (RCA): проксимальную (от устья до первого ее поворота, обычно располагающегося горизонтально), среднюю (от первого до второго поворота) и дистальную (после второго ее поворота до разделения артерии на ветви у «креста» сердца (crux cordis) — места пересечения задней межжелудочковой и атриовентрикулярной борозд сердца). Иногда непосредственно после самого устья от сосуда отходит маленькая ветвь — ветвь артериального конуса (ramus coni arteriosi, CB), а также много мелких ветвей к правому предсердию.
Самой главной из этих ветвей является артерия синоатриального узла (S-A node artery, SNA). Она часто располагается под правым ушком сердца. В редких случаях ветвь артериального конуса имеет собственное устье. Этот вариант всегда следует учитывать, поскольку при коронароангиографии можно принять эту артерию за главный ствол правой коронарной артерии. Перекрыв вход в эту артерию катетером, можно вызвать локальную ишемию и, как следствие, нарушения ритма вплоть до трепетания камер сердца. В передней части венечной борозды, в области острого края сердца, от правой коронарной артерии отходит ветвь острого края (acute marginal artery, AMB), чаще от одной до трех, которая в большинстве случаев достигает верхушки сердца.
Итак, перечислим еще раз все сокращения:
Левая коронарная артерия — left coronary artery (LCA):
— Передняя межжелудочковая ветвь (ПМЖВ), или передняя нисходящая артерия — left anterior descending artery (LAD); иначе — ramus interventricularis anterior (RIVA/RIA);
— Диагональные артерии (ветви) — ДА; ramus diagonalis (RD/Diag);
— Огибающая ветвь (ОВ) левой коронарной артерии, огибающая артерия — left circumflex coronary artery (LCх));
— Ветвь тупого края, obtuse marginal artery, obtuse marginal branch, (OMB);
— Перегородочные межжелудочковые ветви, ramus septalis (RSA);
— Промежуточная артерия, ramus intermedius (RIM).
Правая коронарная артерия — right coronary artery (RCA):
— Ветвь острого края, acute marginal artery, (AMB);
— Артерия синоатриального узла — ramus nodi sinuatrialis (S-A node artery, SNASA/RNS);
— Задняя межжелудочковая ветвь (ЗМЖВ), или задняя нисходящая артерия — posterior descending artery (PDA); иначе — ramus interventricularis posterior (RIVP/RIP).
И еще раз для повторения (важное задание для диагностики локализации ишемии при инфаркте миокарда): LAD/RIVA, LCx кровоснабжает левую камеру спереди и сбоку, а RCA — сзади. Левое предсердие кровоснабжают LCx, RCA. Перегородку — RSA от LAD. Правую камеру сзади — RCA, спереди — RCA, LAD. Правое предсердие — RCA.
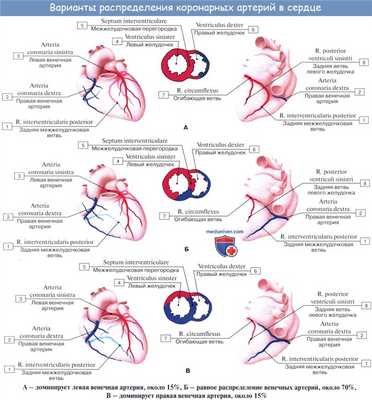
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Для понимания принципа работы ЭКГ необходимо повторить строение проводящей системы сердца. Синоатриальный узел находится в стенке правого предсердия, его импульсы поступают к атриовентрикулярному узлу (также располагается в стенке правого предсердия). Далее импульс распространяется по волокнам пучка Гиса, который делится в межжелудочковой перегородке на две ножки - правую и левую (иногда называются ножками Тавары). К эндокарду сигнал поступает посредством волокон Пуркинье. Иногда встречаются и дополнительные пути передачи возбуждения, как, например, по волокнам Кента. Такие пути часто располагаются между предсердиями и желудочками и идут в обход атриовентрикулярного узла. Из-за этого мускулатура миокарда часто сокращается преждевременно, что становится заметно на ЭКГ, а такие пациенты предрасположены к тахикардии (WPW-синдром).
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.
Например, при инфаркте правых отделов сердца (задней стенки) часто особенно сильно поражается правый желудочек. Чаще всего это происходит из-за тромба в RCA. Правые отделы сердца не способны сокращаться должным образом, что приводит к снижению преднагрузки левой камеры сердца, поскольку таким образом снижается объем крови, транспортируемый к левому предсердию. Сниженный сердечный выброс сердце пытается компенсировать увеличением частоты сокращений. При инфаркте же левых отделов сердца основным осложнением является кардиогенный шок.
Специально для наших подписчиков мы сделали таблицу, в которой показаны изменения ЭКГ в зависимости от локализации возможного повреждения коронарных артерий.

Стоит также повторить и классификацию острых коронарных синдромов:
- Нестабильная стенокардия без повышения тропонина. Эта форма классифицируется по Браунвальду на 3 класса в зависимости от выраженности клинических признаков:
I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день);
II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов);
III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения:
А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность);
B — первичная нестабильная стенокардия;
C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
- Инфаркт миокарда без элевации сегмента ST (NSTEMI) с повышением концентрации кардиального тропонина в крови.
ПБКА и стентирование
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30–40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.
Первую имплантацию стента провел Sigwart в 1987 году. Тогда стенты монтировались непосредственно на баллон самим врачом. Сейчас же вся конструкция идет в комплекте, что позволило снизить риск потери стента в кровеносном русле при его недостаточной фиксации.

Появились и новые типы самих баллонов. Некоторые из них имеют на своей поверхности режущие зубцы, что расположены параллельно оси сосуда, а также баллоны из нитинола и нейлона хеликальные или же параллельные оси сосуда. Эти конструкции позволяют создать идеальную площадку для имплантации будущего стента. Сперва в процессе исследований ученые не заметили разницы между такими баллонами и стандартными, однако недавно выяснилось, что такие надсекающие баллоны, покрытые лекарственными средствами, показывают лучшие результаты.
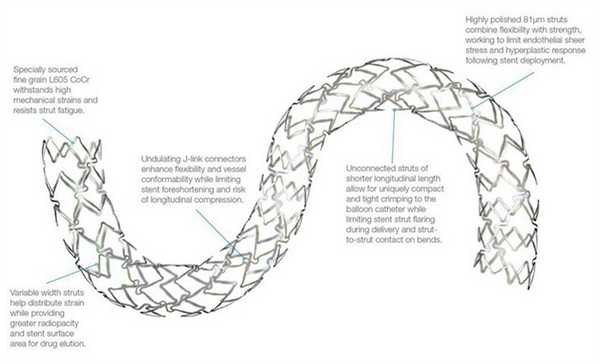
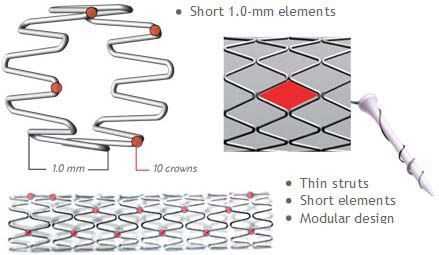
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
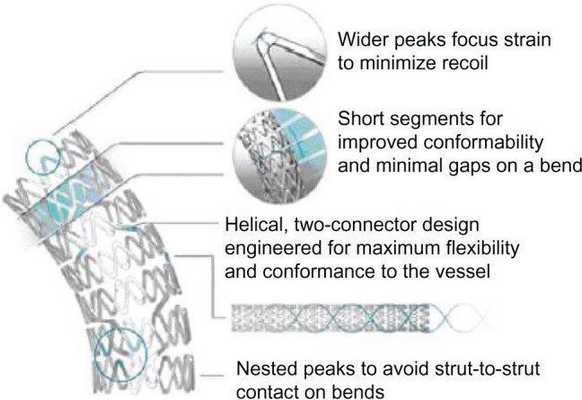
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
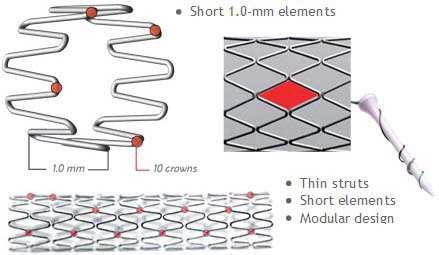
Существуют также стенты с особым покрытием, создающим непроницаемый для крови барьер. К таким вещества относят политетрафторэтилен и полиэтилен. Сперва их использовали для экстренного закрытия небольших перфораций коронарных артерий, однако сейчас их применяют в профилактике коронарных аневризм и артериовенозных фистул.
Drug-eluting-stents (DES) покрыты специальными веществами, подавляющими пролиферацию клеток эндотелия, таким образом препятствуя рестенозированию сосуда, чаще всего развивающемуся в течение 4–8 месяцев после имплантации.
Стенты – ферромагнетики, плотно устанавливающиеся в сосудистом русле не являются противопоказанием для проведения МРТ.
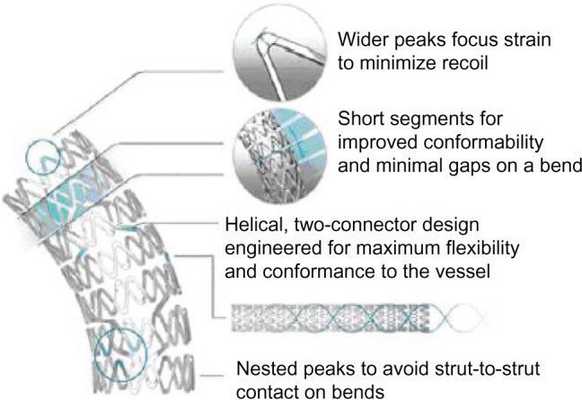
Существуют специальные стенты для позиционирования их в устьях и разветвлениях сосудов. Как и любой инородный объект в кровеносном русле, стенты являются дополнительным фактором тромбообразования. Поэтому после самой процедуры пациенту всегда назначают ДААТ или ТАТ.
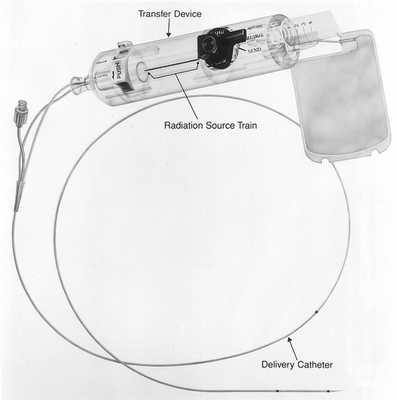
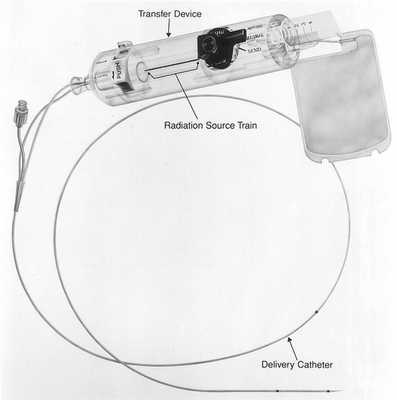
Брахитерапия
Этот метод основан на радиоактивном облучении коронарных артерий при рецидивах после имплантации стентов. Для этого используется бета-излучение, поскольку оно способно проникать лишь на несколько миллиметров внутрь толщи ткани. При этом методе катетер вводят в место стеноза, который прежде был дилатирован баллоном. С помощью этого катетера зону определенное количество времени (3–5 минут) облучают рассчитанной дозой. Васкулярная брахитерапия используется с 1996 года. В феврале 2005 года прекратила свое существование фирма, разрабатывающая аппараты для брахитерапии коронарных сосудов (Beta-Cath-System).
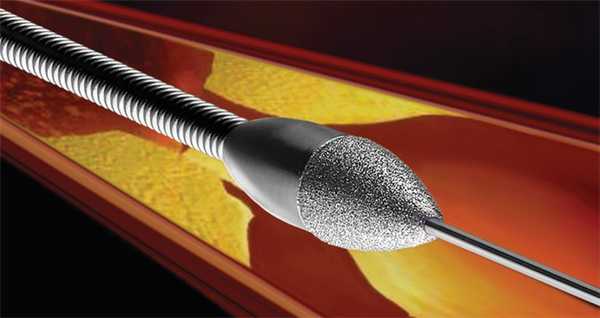
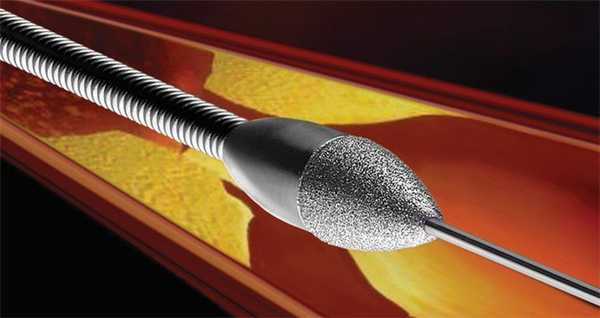
Ротаблационная пластика
Этот метод используется с 1989 года. В сосуд вводится алмазный бор, способный вращаться с частотой 190 000 об. в минуту. С его помощью удаляются ткани в месте рестенозирования. Величина таким образом измельченных частиц составляет 5–10 микрометров (длина эритроцита — 7,5 микрометров). Образуемый канал очень небольшой в диаметре, но достаточный для проведения ПТКА. Как правило, метод используют в случае образования на месте рестеноза кальцификатов. Диаметр головки бора варьируется от 1,25 до 2,5 мм. Поскольку кабель для ротаблационного бора плохо проходит место стеноза, успех операции составляет 80–95 %. К осложнениям относят спазмы сосудов, возникающие чаще (5 %), чем при ПТКА.
Интраваскулярный ультразвук
Еще одним инструментом кардиолога является метод интраваскулярного ультразвука (IVUS). В сосуд вводят ультразвуковой зонд.
Порядок манипуляций напоминает таковой при ПТКА: после позиционирования проводника зонд проводят к месту стеноза. Ультразвук позволяет просмотреть 1 мм тканей на расстоянии от излучателя. Всего на верхушке катетера используется 64 таких кристалла (пьезоэлемента). С помощью этого метода возможно определить состав бляшек и их фибринные, липидные и кальциевые составляющие. Чаще всего к ультразвуку прибегают при неоднозначности ангиографической картины, используя как дополнительный метод обследования.
Всех нас на физиологии мучили графиками давления в сосудах. Мало кто на младших курсах мог подумать, что эти данные действительно используются в диагностике. При каждой коронароангиографии исследуют давление в коронарных артериях и его изменения в зависимости от наличия стенозированных участков. Для этого к исследуемому участку подводят детектор диаметром 0,014 дюймов. Этот катетер продвигают до самого конца коронарной артерии. Потом его тянут обратно. Таким образом фиксируется давление на всем протяжении артерии. На мониторе врачи наблюдают изменение давления; в месте наибольшего его перепада чаще всего и оказывается самый стенозированный участок. Постепенное изменение давления является свидетельством диффузного заболевания сосудов. Важно откалибровать детектор до самого исследования. После аппликации аденозина наблюдается гиперемия, то есть увеличение циркуляции крови, что симулирует состояние нагрузки. После этого давление на протяжении сосуда измеряется еще раз, что позволяет определить, являются ли места стенозирования важными, вызывают ли именно они боли у пациента при физических нагрузках. Аденозиновый тест не является безопасным: возможно развитие нарушений сердечного ритма, однако из-за короткого периода полувыведения аденозина лишь кратковременно.
Спазмы коронарных сосудов и ацетилхолиновый тест
Спазмы коронарных артерий часто являются причиной болей за грудиной в ночное время суток у пациентов без видимых изменений коронарных сосудов. Таким пациентам также назначают коронароангиографию и проводят вышеуказанный провокационный тест, чтобы исключить психогенные или некардиальные причины таких симптомов. Сейчас у каждого человека, уже сдавшего физиологию, должна промелькнуть мысль: «Почему ацетилхолин?». Если вы не находите ответа, возможно, придется снова открыть учебник. Дело в том, что эндотелий сердца при аппликации ацетилхолина вырабатывает NO, что приводит к расширению сосудов. Ацетилхолин оказывает вазоконстрикторное действие на гладкомышечные клетки сосудов в результате прямой их стимуляции, если эндотелий поврежден. Таким образом можно отличить здоровый эндотелий от поврежденного. Здоровые сосуды реагируют на ацетилхолин расширением, поврежденные же сужаются. При сужении сосудов более чем на 75 % по сравнению с аппликацией нитроглицерина внутрикоронарно говорят о коронарном спазме.
Коронарография

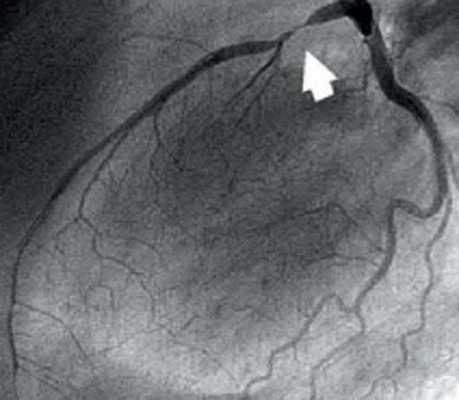
Выделяют следующие части левой коронарной артерии (LCA, left coronary artery): главный ствол, который делится на переднюю межжелудочковую ветвь (ramus interventricularis anterior, RIVA или left anterior descending, LAD), а также огибающую артерию (left circumflex coronary artery, LCх).
Главный ствол этой артерии длиной редко превышает 1 см, а далее делится на две свои конечные ветви. Передняя межжелудочковая ветвь располагается на передней поверхности сердца вплоть до его верхушки. На своем протяжении от этой артерии отходят передние желудочковые ветви (диагональные ветви, RD/R.Diag) и передние перегородочные ветви. В коронароангиографии с целью топического указания места поражения предложено делить коронарное русло на сегменты.
Проксимальный сегмент ПМЖВ начинается своим ответвлением от ствола и продолжается до места отхождения от нее первой перегородочной или первой RD, средняя часть — до ответвления второй перегородочной ветви или второй RD, дистальная — до верхушки сердца/после отхождения второй RD.
- Огибающая артерия всегда располагается на задней поверхности сердца. В ее проксимальной части от нее отходит ветвь тупого края (obtuse marginal artery, obtuse marginal branch, OMB). В зависимости от места этого ответвления различают проксимальную и дистальную части огибающей ветви. Очень редко от главного ствола между передней межжелудочковой ветвью и огибающей ветвью посередине отходит еще одна ветвь, берущая начало непосредственно из общего ствола — промежуточная артерия (RIM, ramus intermedius).
Иногда непосредственно после самого устья от сосуда отходит маленькая ветвь — ветвь артериального конуса (ramus coni arteriosi, CB), а также много мелких ветвей к правому предсердию.
Самой главной из этих ветвей является артерия синоатриального узла (S-A node artery, SNA). Она часто располагается под правым ушком сердца. В редких случаях ветвь артериального конуса имеет собственное устье. Этот вариант всегда следует учитывать, поскольку при коронароангиографии можно принять эту артерию за главный ствол правой коронарной артерии. Перекрыв вход в эту артерию катетером, можно вызвать локальную ишемию и, как следствие, нарушения ритма вплоть до трепетания камер сердца. В передней части венечной борозды, в области острого края сердца, от правой коронарной артерии отходит ветвь острого края (acute marginal artery, AMB), чаще от одной до трех, которая в большинстве случаев достигает верхушки сердца.
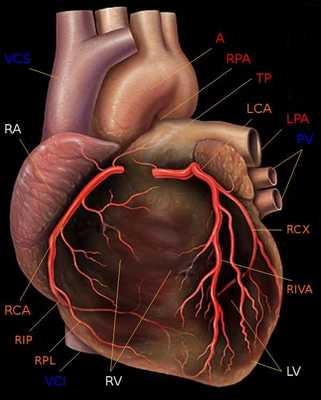
Следует также напомнить о доминантности кровоснабжения миокарда. При так называемом правом типе кровоснабжения сердца, наблюдающемся у 70 % людей, задняя нисходящая артерия (PDA) отходит от правой коронарной артерии. При левом типе кровоснабжения сердца (10 % людей) огибающая артерия (LCx) достигает уровня задней межжелудочковой борозды и образует заднюю нисходящую артерию (PDA). При еще более редком, так называемом смешанном содоминантном типе (20 % людей), имеются две задних желудочковых ветви (RIVP/RIP), отходящих от правой венечной и огибающей артерий.
Электрокардиограмма представляет собой не что иное, как запись распространяемых электрических потенциалов сердца, фиксируемых электродами на конечностях и грудной стенке. ЭКГ включает в себя три стандартных отведения по Эйнтховену (I, II, III), и три усиленных по Гольдбергу (aVR, aVL, aVF). Прикрепление еще шести грудных электродов по Вильсону (V1-V6) позволяет зарегистрировать распространение возбуждение по сердечной стенке в горизонтальной проекции. В зависимости от изменений в этих отведениях еще на догоспитальном этапе при помощи ЭКГ можно предположить локализацию инфаркта и возможную «проблемную» артерию.

Нестабильная стенокардия без повышения тропонина. Эта форма классифицируется по Браунвальду на 3 класса в зависимости от выраженности клинических признаков:
I — недавно возникшая боль за грудиной (менее 2-х месяцев, более 3-х раз в день);
II — боль за грудиной в покое (минимум один раз за прошедший месяц, но не в течении последних 48 часов);
III — боль за грудиной в покое (минимум один раз за последний 48 часов).
Нестабильную стенокардию классифицируют на 3 группы по причинам возникновения:
А — вторичная нестабильная стенокардия (инфаркт миокарда, анемия, повышение температуры, гипотензия, тахиаритмия, тиреотоксикоз, дыхательная недостаточность);
B — первичная нестабильная стенокардия;
C — нестабильная стенокардия после инфаркта (минимум 2 недели после инфаркта).
Инфаркт миокарда без элевации сегмента ST (NSTEMI) с повышением концентрации кардиального тропонина в крови.
Инфаркт миокарда с элевацией сегмента ST (STEMI) с повышением концентрации кардиального тропонина в крови.
ПБКА и стентирование
При ПБКА баллонный катетер с помощью проводника вводится вплоть до места стеноза. Баллон раздувается и тем самым «сплющивает» атеросклеротические бляшки, растягивая сосудистую стенку. Мелкие повреждения интимы во время раздувания баллона часто не имеют последствий, однако иногда именно в этих местах позже начинается пролиферация тканей, что в 30–40 % случаев приводит к рестенозам и рецидивам в течение последующих трех месяцев. Частота экстренных операций по созданию шунтов (bypass) составляет менее 0,5 %. С помощью имплантации стента сосудистая стенка стабилизируется. Существовала также техника primary stenting — имплантация стента без предшествующего дилатирования сосудов баллоном, однако ныне она используется крайне редко и только на начальных этапах сужения просвета сосуда. Исследования последних лет показали, что при значительных сужениях просвета сосуда, у таких пациентов в первые часы после ангиопластики наблюдалась ишемия миокарда, что требовало немедленного повторного хирургического вмешательства или повторной дилатации. Это осложнение возникает вследствие отрыва бляшки от эндотелия. Обнажение поверхности гладкомышечных клеток приводит к тромбообразованию за счет высвобождения молекул коллагена и тканевых факторов, запускающих каскад свертывания крови. Во избежание развития тромбов и рестеноза в настоящее время чаще всего ангиопластику совмещают с имплантацией стентов на месте стеноза.

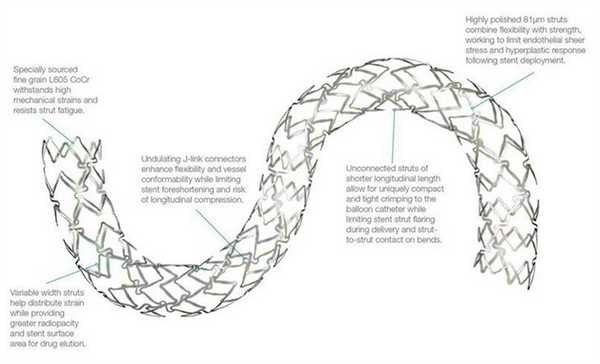
Различают два типа металлических стентов: саморасширяющиеся и прикрепленные к дилатирующему баллону. Исследования показывают, что применение первого типа стентов чаще вызывает развитие неоинтимальной гиперплазии. Поэтому в настоящее время часто используются стенты второго типа. Как правило, они состоят из металлической трубочки, в которой с использованием различных техник создаются отверстия. После расширения сосуда баллонным катетером в его просвете создается сеть, обволакивающая его стенки изнутри. Прототипом такого типа стентов являлся стент Palmaz-Schatz, который сейчас уже не применяется.
Исследование 1994 года не показало разницы между имплантацией такого стента и обычной ангиопластикой. Развитие этого направление позволило разработать новые типы стентов. Чаще всего они состоят из нескольких модулей, соединенных коннекторами. Изначально их производили из стали, однако сейчас в качестве материала для изготовления стентов используется платина, кобальт, нитинол (никель-титан), а также только титан. Из-за этого они стали существенно меньше и легче. РКИ выявили преимущества стентов с толстым каркасом перед таковыми с тонким. Предполагают, что они меньше травмируют сосуды, предотвращая таким образом реэндотелизацию.
Брахитерапия
Ротаблационная пластика
Интраваскулярный ультразвук
Спазмы коронарных сосудов и ацетилхолиновый тест
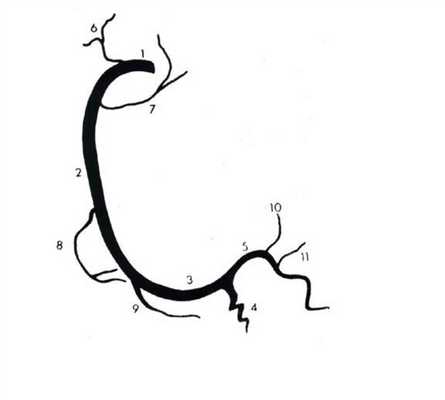
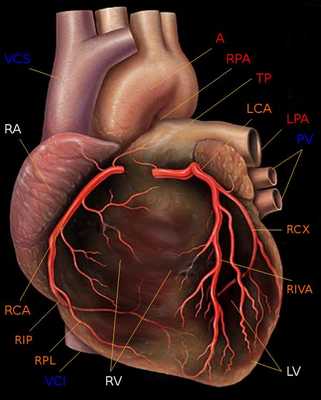
Артерии и вены сердца (ангиография, КТ).
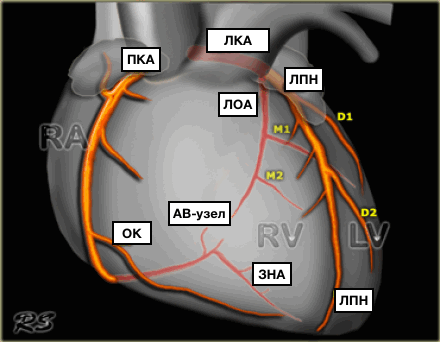
Представлены коронарные артерии в латеральной проекции.
- Левая главная или левая коронарная артерия (ЛКА)
- Левая передняя нисходящая артерия (ЛПН)
- диагональные ветви (D1, D2)
- септальные ветви
- краевые ветви (M1,M2)
- Ветвь острого края (ОК)
- Ветвь АВ-узла
- Задняя нисходящая артерия (ЗНА).
![]()
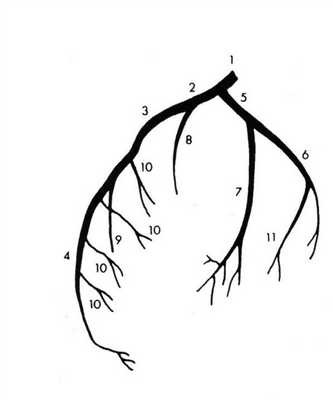
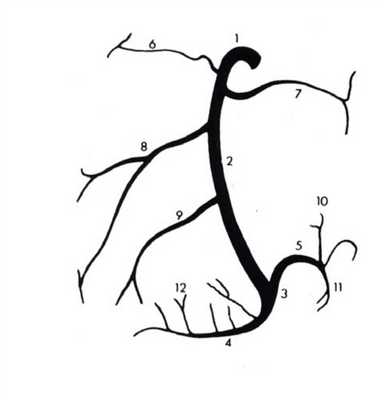
Анатомия коронарных артерий используемая при ангиографии.
![]()
![]()
![]()
В зависимости от преобладания в системе кровоснабжения сердца правых или левых ветвей коронарных артерий выделяют три типа кровообращения:
- Левостороннее (10%) - Для этого типа кровообращения характерен малый диаметр и непротяженный ход правой коронарной артерии, увеличение диаметра ОА и ПНА, отхождение ЛЖВ от ЛКА
- Правостороннее (70%) - Для этого типа кровообращения характерен малый диаметр и непротяженный ход левой коронарной артерии, увеличение диаметра БОКС и ЗНА, отхождение ЛЖВ от ПКА
- Смешанное (20%) - Диаметр коронарных артерий составляет: ЛКА 4.5±0.5 мм [4], ПНА 3.8±0.3 мм вначале, 1.7±0.4 мм - терминальные ветви, ЗНА 2.0-2.5 мм.
Точно диаметр терминальных ветвей венечных артерий в норме измерить невозможно из-за малого размера и ограниченного разрешения при их визуализации. Фокальное увеличение диаметра просвета сосуда более, чем в 1,5 раза относительно близлежащего не измененного участка называется аневризмой, а если расширение имеет диффузный характер, то оно называется эктазией.
![]()
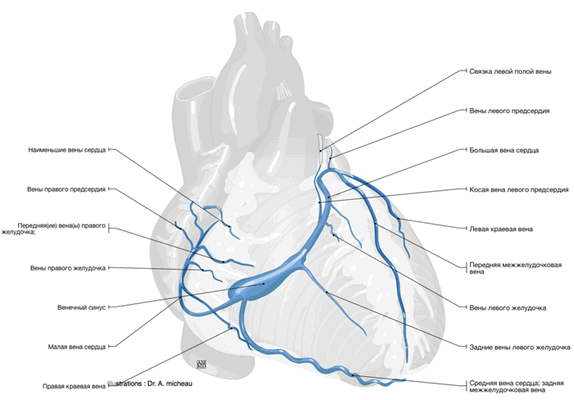
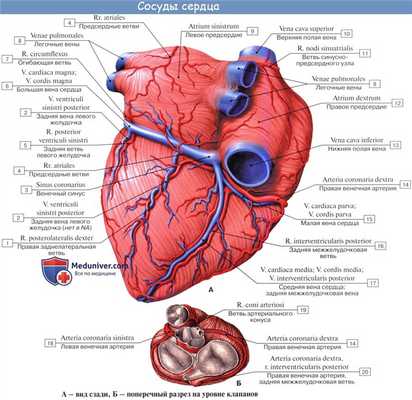
Вены сердца
Вены сердца открываются не в полые вены, а непосредственно в полость сердца. Они начинаются в виде сетей, располагающихся в различных слоях его стенки. Венозное русло значительно преобладает над артериальным.
Венозный отток идет по трем путям: в венечный синус, sinus coronarius; в передние вены сердца; в малые вены Тебезия [Thebesian], впадающие непосредственно в правый отдел сердца.
Венечный синус, sinus coronarius лежит сзади, в венечной борозде, и открывается в правое предсердие несколько ниже ствола нижней полой вены.
В венечный синус приносят кровь большая вена сердца, v. cordis magna, которая собирает кровь от передней поверхности обоих желудочков. Сначала она располагается в передней межжелудоч-ковой борозде, рядом с ramus interventricularis anterior левой венечной артерии, затем уходит под левое ушко и переходит на заднюю поверхность, где впадает (продолжается) в венечный синус.
Средняя вена сердца, v. cordis media, из задней межжелудочковой борозды переходит в венечную борозду и впадает в венечный синус справа. Кроме этих крупных вен, в венечный синус впадают малая вена сердца, v. cordis parva, задняя вена левого желудочка, v. posterior ventriculi sinistri, и косая вена левого предсердия, v. obliqua atrii sinistra [Marshall].
Передние вены сердца, vv. cordis anteriores, несут кровь от верхнего отдела передней стенки правого желудочка и впадают в правое предсердие.
Малые вены, vv. cordis minimae, собирают кровь в глубине стенок сердца и через множество отверстий впадают непосредственно в правое предсердие.
Правая венечная артерия. Правая коронарная артерия. Левая венечная артерия. Левая коронарная артерия.
Кровоснабжение сердца. Питание сердца. Венечные артерии сердца.
Артерии сердца — аа. coronariae dextra et sinistra, венечные артерии, правая и левая, начинаются от bulbus aortae ниже верхних краев полулунных клапанов. Поэтому во время систолы вход в венечные артерии прикрывается клапанами, а сами артерии сжимаются сокращенной мышцей сердца. Вследствие этого во время систолы кровоснабжение сердца уменьшается: кровь в венечные артерии поступает во время диастолы, когда входные отверстия этих артерий, находящиеся в устье аорты, не закрываются полулунными клапанами.
![Анатомия: Кровоснабжение сердца. Питание сердца. Венечные артерии сердца]()
Правая венечная артерия, a. coronaria dextra
Правая венечная артерия, a. coronaria dextra, выходит из аорты соответственно правой полулунной заслонке и ложится между аортой и ушком правого предсердия, кнаружи от которого она огибает правый край сердца по венечной борозде и переходит на его заднюю поверхность. Здесь она продолжается в межжелудочковую ветвь, r. interventricularis posterior. Последняя спускается по задней межжелудочковой борозде до верхушки сердца, где анастомозирует с ветвью левой венечной артерии.
Ветви правой венечной артерии васкуляризируют: правое предсердие, часть передней стенки и всю заднюю стенку правого желудочка, небольшой участок задней стенки левого желудочка, межпредсердную перегородку, заднюю треть межжелудочковой перегородки, сосочковые мышцы правого желудочка и заднюю сосочковую мышцу левого желудочка. ,
![Анатомия: Кровоснабжение сердца. Питание сердца. Венечные артерии сердца]()
Левая венечная артерия, a. coronaria sinistra
Левая венечная артерия, a. coronaria sinistra, выйдя из аорты у левой полулунной заслонки ее, также ложится в венечную борозду кпереди от левого предсердия. Между легочным стволом и левым ушком она дает две ветви: более тонкую переднюю, межжелудочковую, ramus interventricularis anterior, и более крупную левую, огибающую, ramus circumflexus.
Первая спускается по передней межжелудочковой борозде до верхушки сердца, где она анастомозирует с ветвью правой венечной артерии. Вторая, продолжая основной ствол левой венечной артерии, огибает по венечной борозде сердце с левой стороны и также соединяется с правой венечной артерией. В результате по всей венечной борозде образуется артериальное кольцо, расположенное в горизонтальной плоскости, от которого перпендикулярно отходят ветви к сердцу.
Кольцо является функциональным приспособлением для коллатерального кровообращения сердца. Ветви левой венечной артерии васкуляризируют левое, предсердие, всю переднюю стенку и большую часть задней стенки левого желудочка, часть передней стенки правого желудочка, передние 2/3 межжелудочковой перегородки и переднюю сосочко-вую мышцу левого желудочка.
Наблюдаются различные варианты развития венечных артерий, вследствие чего имеются различные соотношения бассейнов кровоснабжения. С этой точки зрения различают три формы кровоснабжения сердца: равномерную с одинаковым развитием обеих венечных артерий, левовенечную и правовенеч-ную. Кроме венечных артерий, к сердцу подходят «дополнительные» артерии от бронхиальных артерий, от нижней поверхности дуги аорты вблизи артериальной связки, что важно учитывать, чтобы не повредить их при операциях на легких и пищеводе и этим не ухудшить кровоснабжение сердца.
![Анатомия: Кровоснабжение сердца. Питание сердца. Венечные артерии сердца]()
Внутриорганные артерии сердца
Внутриорганные артерии сердца: от стволов венечных артерий и их крупных ветвей соответственно 4 камерам сердца отходят ветви предсердий (rr. atriales) и их ушек (rr. auriculares), ветви желудочков (rr. ventriculares), перегородочные ветви (rr. septales anteriores et posteriores). Проникнув в толщу миокарда, они разветвляются соответственно числу, расположению и устройству слоев его: сначала в наружном слое, затем в среднем (в желудочках) и, наконец, во внутреннем, после чего проникают в сосочковые мышцы (аа. papillares) и даже в предсердно-желудоч-ковые клапаны. Внутримышечные артерии в каждом слое следуют 'ходу мышечных пучков и анастомозируют во всех слоях и отделах сердца.
Некоторые из этих артерий имеют в своей стенке сильно развитый слой непроизвольных мышц, при сокращении которых происходит полное замыкание просвета сосуда, отчего эти артерии называют «замыкающими». Временный спазм «замыкающих» артерий может повлечь за собой прекращение тока крови к данному участку сердечной мышцы и вызвать инфаркт миокарда.
Диссекция коронарной артерии ( Расслоение венечной артерии )
Диссекция коронарной артерии — это патология, заключающаяся в надрыве и расслоении сосуда с проникновением крови между его оболочками. Является жизнеугрожающим состоянием. К факторам риска относят атеросклероз, гормональный сбой, операции на миокарде в анамнезе. Симптомы болезни неспецифичны, в основном выражаются кардиалгией, одышкой, слабостью. Основными диагностическими методами считаются электрокардиография, УЗИ сердца, анализы крови, ангиография. На начальных стадиях возможно применение консервативной терапии, но основным методом лечения остается операция (шунтирование, стентирование сосудистого русла).
МКБ-10
Общие сведения
Диссекция или расслоение венечной артерии — редко встречающееся в клинической практике заболевание, способное стать причиной острого коронарного синдрома, внезапной сердечной смерти. Статистические данные свидетельствуют о большей встречаемости патологии как спонтанного явления у женщин (70%), особенно старше 40 лет. Как осложнение чрескожных коронарных вмешательств наблюдается в 0,03% описанных в литературе случаев. Наиболее часто выявляется после операций с применением баллонного катетера. Общая летальность достигает 40%, частота рецидивов в отдаленном периоде — 16%.
Причины
Современная медицина пока не может окончательно ответить на вопрос об этиологии расслоения коронарной артерии. Известно, что чаще диссекция является идиопатической, то есть установить предрасполагающие факторы невозможно. Некоторые наблюдения позволяют выделить экзо-, либо эндогенные причины, способные повредить или ремоделировать сосудистую стенку. К ним относят:
- Нарушение гормонального фона. Самая часто наблюдаемая причина болезни сосудов у женщин. Наиболее опасны периоды перестройки эндокринной системы, особенно изменение функции половых желез во время пубертата, в конце беременности, раннем послеродовом периоде.
- Атеросклероз коронарных сосудов. Наиболее значимый фактор развития патологии в общей популяции. Диссекция формируется при сильной деформации стенки под липидной бляшкой либо как результат разрыва последней. Дестабилизировать ситуацию может высокая концентрация окислительных липопротеинов, воспаление, метаболические нарушения (сахарный диабет, патология почек).
- Механические повреждения. Расслоение артерии может возникнуть при непосредственном ранении сердца, сопровождающемся повреждением сосудистого русла, или в результате ятрогенных причин. Последнюю группу составляют чрескожные коронарные вмешательства, преимущественно с использованием предилатации баллонным катетером.
Патогенез
Механизмы развития данной патологии коронарной артерии разнятся, во многом зависят от причины. Воздействие дестабилизирующих факторов на атеросклеротическую бляшку приводит к истончению защитной капсулы, уменьшению концентрации нитей коллагена. Присоединение воспаления, выделение большого количества цитокинов еще больше ослабляет каркас, матрикс образования, способствует гибели гладкомышечных клеток. Последующая диссекция провоцирует образование внутрисосудистой гематомы, формирование ложного просвета, который значительно уменьшает пропускную способность русла.
Патологические гормональные влияния строятся главным образом на эффектах эстрогенов. Их уровень оказывает влияние на структуру сосудистой стенки, вызывая ее гипертрофию, ослабление матрикса, разрушение коллагена. Помимо этого, оказывается стимулирующее влияние на кардиальную систему — увеличивается сердечный выброс, общий объем кровотока. Повышается давление на поврежденную артерию, что ускоряет формирование диссекции.
Классификация
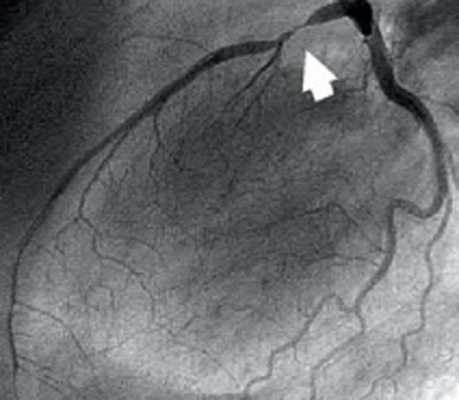
Из-за незначительной распространенности единая номенклатура в настоящее время отсутствует. В литературе можно встретить классификацию Национального института болезней сердца, легких и крови, основанную на ангиографических признаках разных видов диссекции. В зависимости от типа расслоения и характера прохождения контрастного вещества выделяют шесть вариантов состояния:
- Тип А. Контуры коронарной артерии недостаточно четкие, но контрастное вещество протекает по ней без существенных задержек, без пропитывания стенки.
- Тип В. При ангиографии выявляется картина двойного просвета внутри артерии. Задержки контраста не наблюдается.
- Тип С. Признаки двойного просвета вместе с задержкой вещества в стенке сосуда.
- ТипD. Характеризуется наличием всех вышеперечисленных признаков на фоне формирования спирального дефекта заполнения артерии контрастом.
- Тип Е. Отличается обнаружением облаковидных дефектов наполнения.
- ТипF. Наиболее тяжелая стадия, при которой происходит полная окклюзия венечной артерии, фактическое прекращение кровотока.
Симптомы
Выраженность клинических проявлений диссекции коронарного сосуда зависит от ее типа, степени тяжести. Симптомы неспецифичны, могут колебаться от классической картины нестабильной стенокардии до внезапной кардиальной смерти. Пациенты жалуются на боль в области сердца, которая иррадиирует в плечи, шею, нижнюю челюсть, может возникать как при физической нагрузке различной интенсивности, так и в состоянии покоя.
Кардиалгия не изменяется при перемене положения тела, не зависит от фазы дыхательного цикла, ее могут провоцировать эмоциональные нагрузки, холодный воздух, обильный прием пищи. Нитроглицерин оказывает слабый эффект даже в больших дозировках. Помимо боли больные могут предъявлять жалобы на одышку при активном движении, быструю утомляемость, дискомфорт в животе, тошноту. При малых степенях расслоения патология иногда протекает бессимптомно.
Типы Е и F чаще сопровождаются жгучей, сжимающей болью. Пациенты отмечают ее невыносимый характер. Течение может быть волнообразным, продолжительностью от 20 минут до нескольких часов. Подобные случаи требуют инъекции наркотических анальгетиков. Иногда наблюдаются нарушения ритма сердца, угнетение сознания, кинжальные боли в абдоминальной области. Общую клиническую картину нередко дополняют симптомы сопутствующих патологий.
Осложнения
Диссекция коронарной артерии относится к состояниям, требующим пристального внимания медиков на всех этапах оказания помощи. При массивном характере расслоения с существенным перекрытием просвета сосуда значительно повышается риск инфаркта миокарда вплоть до трансмурального. При стремительном характере развития болезни времени для проведения врачебных манипуляций не остается, возможна внезапная сердечная смерть.
Нарушение матрикса и структурной целостности коронарной артерии создает условия для попадания крови между перикардом и эпикардом вплоть до тампонады и невозможности сердечных сокращений. Грубое нарушение обеспечения миокарда кислородом, питательными веществами может стать причиной аритмий — патологической тахикардии, брадикардии, экстрасистолии, блокад. При неблагоприятном течении это приводит к острой левожелудочковой недостаточности и отеку легких.
Диагностика
Диссекция коронарной артерии протекает неспецифично, имеет схожую клиническую картину с ишемической болезнью сердца, нестабильной стенокардией. Физикальное обследование не дает достаточной информации для точной дифференциации. При сборе анамнеза кардиологом уточняются факторы риска, наличие у пациента в ближайшем прошлом дислипидемии, беременности, операций на миокарде. Важно исключить внесердечные причины кардиальных болей (межреберную невралгию, ТЭЛА, плевриты, пневмонии). Клиническую ценность имеют следующие методы диагностики:
- Электрокардиография. Окклюзионный характер диссекции рано или поздно приводит к дефициту кровоснабжения миокарда, что выражается ишемическими изменениями на ЭКГ. Основными являются подъем сегмента ST над изолинией более чем на 1 мм в двух последовательных отведениях, инверсия зубца Т. О случившемся инфаркте миокарда может говорить широкий и глубокий зубец Q.
- Ангиография коронарных сосудов. Данное рентгенологическое исследование, проводимое с использованием контрастного вещества, помогает с точностью установить тип расслоения. Является основным диагностическим методом, дает возможность оценить степень поражения, необходимый объем лечебных мероприятий и примерный запас времени на их реализацию.
- Эхокардиография. Ультразвуковое исследование выполняется для определения размеров сердца и его отдельных камер, оценки структуры миокарда, состояния клапанов и качества внутрикардиальной гемодинамики. Позволяет локализовать очаг некроза. Визуализировать непосредственно коронарные сосуды при этом методе невозможно. Нормальная Эхо-КГ картина не исключает наличия патологии.
- Лабораторные методы. В клиническом анализе крови важно обнаружить маркеры воспалительной реакции, способные указать на формирование некротического очага или дестабилизацию атеросклеротической бляшки. Обращают внимание на высокий уровень лейкоцитов, особенно – гранулоцитов, повышение СОЭ. В биохимическом анализе определяются ферменты клеточного распада (АЛТ, АСТ, тропонины), холестерин, липидные фракции.
Лечение диссекции коронарной артерии
Учитывая достаточную сложность точной диагностики, стремительный характер развития и исхода заболевания, лечебная тактика часто пересекается с терапией других состояний с основным симптомом в виде кардиальной боли. Необходима скорейшая госпитализация больного, назначение постельного режима. Обязательно проводится динамическая запись ЭКГ, по возможности осуществляется ангиография. Основная цель — предотвращение некроза миокарда.
Медикаментозная терапия
Применение лекарственных средств может быть оправдано при легких типах расслоения без выраженного повышения концентрации маркеров клеточной гибели, электрокардиографических признаков крупноочагового инфаркта. Обязательно наблюдение первые 6-8 часов в условиях блока интенсивной терапии либо общей реанимации с динамической записью ЭКГ. Обеспечивается постоянный внутривенный доступ для быстрого введения медикаментов.
- Обезболивающие препараты. Необходимы для уменьшения симптомов стенокардии. Наиболее часто используются вещества, содержащие тринитрат глицерина (нитроглицерин), способствующие увеличению просвета коронарных сосудов, уменьшающие преднагрузку на миокард. Оправдано применение кардиоселективных бета-блокаторов, антагонистов кальция. Эти лекарства уряжают пульс, следовательно – и потребность миокарда в кислороде, питательных веществах. В экстренных случаях внутривенно вводятся наркотические анальгетики.
- Антитромботические средства. Поврежденная сосудистая стенка провоцирует активацию свертывающей системы, агрегацию тромбоцитов, что еще больше ухудшает снабжение кровью сердца. Препаратами выбора являются дезагреганты (ацетилсалициловая кислота, абциксимаб, тиклопидин), прямые антикоагулянты (гепарин, гирудин). Нередко назначается длительный прием.
- Статины. Обязательный компонент терапии, назначаемый с первых дней поступления пациента в стационар, преимущественно при остром коронарном синдроме без подъема ST. Данная группа медикаментов снижает смертность больных с высоким или умеренным изначальным холестерином. Допускается высокодозовое лечение с последующим приемом лекарств в обычных концентрациях в течение нескольких лет.
Хирургическое лечение
Приоритетным методом лечения диссекции является инвазивное вмешательство, особенно при поражении магистральных ветвей венечных артерий — межжелудочковой, огибающей, правой коронарной. Оптимальные условия — стабилизация пациента с последующим проведением манипуляций через 5-7 дней. При успешном лечении симптоматика полностью исчезает в 90% случаях. Степень операционного риска не должна превышать риск при естественном течении заболевания.
- Коронарное стентирование. Данный метод заключается в закрытии поврежденного сосудистого участка каркасом из проволоки или синтетических волокон. Показан при малом сужении просвета венечной артерии (не главной). Необходимое условие — наличие хорошего доступа при ангиопластике, отсутствие выраженной сердечной недостаточности. Диссекция повышает риск прорастания импланта гладкомышечной тканью, сопровождающегося повторным уменьшением диаметра. Это становится одним из препятствий к широкому распространению стентирования.
- Коронарное шунтирование. Операция, с помощью которой удается восстановить нормальный объем кровотока путем обхода места расслоения шунтами, представляющими собой искусственные коллатерали. К преимуществам вмешательства относят отсутствие существенных механических повреждений клеток крови, небольшую временную продолжительность манипуляции, быструю постоперационную реабилитацию. Шунтами могут быть малые ветви других артерий — грудной, лучевой, большой подкожной.
Реабилитация после хирургического вмешательства заключается в борьбе с застойными явлениями в легких, которые могут возникнуть на фоне применения аппарата искусственного кровообращения (преимущественно при АКШ), уходе за постоперационными ранами. Рекомендуется ограничить физические нагрузки в течение 2 месяцев, совершать спокойные пешие прогулки до 60 минут в день. Пациент на постоянной основе должен принимать ацетилсалициловую кислоту, статины, бета-адреноблокаторы.
Прогноз и профилактика
1. Ятрогенная диссекция левой коронарной артерии. Клинический случай/ Артемьев В.Н., Ишметов В.Ш.// Креативная хирургия и онкология — 2017 — №7.
2. Выбор лечебной тактики при диссекции ствола левой коронарной артерии с распространением на восходящий отдел аорты во время чрескожного коронарного вмешательства/ Ганюков В.И., Тарасов Р.С.// Патология кровообращения и кардиохирургия — 2012 — №3.
3. Диссекция коронарной артерии с распространением на защищенный ствол и синус аорты при чрескожном вмешательстве у больного с нестабильной стенокардией/ Ганюков В.И., Шушпанников П.А.// Диагностическая и интервенционная радиология — 2012 — №6.
4. Спонтанная диссекция коронарной артерии как причина развития острого инфаркта миокарда/ Протасов Е.А., Фурман Н.В., Титков И.В.// Кардиоваскулярная терапия и профилактика — 2014 — №5.
Читайте также:
- Методы исследования спонтанного и спровоцированного нистагма
- Псевдомембранозный колит - инфекция Clostridium difficile: диагностика, лечение, профилактика
- КТ при хронической мезентериальной ишемии
- Лучевая диагностика ассиметричной жировой дольки поджелудочной железы
- Принципы операций на сухожилиях кисти
- Левая передняя нисходящая артерия (ЛПН)