Предупреждение отторжения трансплантата
Добавил пользователь Валентин П. Обновлено: 29.01.2026
В.А. Федулкина, А.В. Ватазин, А.В. Кильдюшевский, А.Б. Зулькарнаев, Р.О. Кантария
Отдел трансплантологии, нефрологии и хирургической гемокоррекции ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, Москва
Представлены результаты использования методики экстракорпоральной фотохимиотерапии (ЭФХТ) у 24 реципиентов почечного аллотрансплантата (ПАТ), для которых причиной хронической болезни почек (ХБП) стали урологические заболевания. Группой сравнения послужили 24 парных в основной группе реципиента, получивших трансплантат от одного донора с ними, которым проведена только медикаментозная иммуносупрессия. Установлено, что проведение ЭФХТ снижает не только количество отторжений ПАТ, но и число инфекционных осложнений. Эффективность методики подтверждена клиническими, лабораторными и иммунологическими данными, а также результатами протокольной биопсии. Высказаны предположения о возможных механизмах сохранения противоинфекционной защиты на фоне иммуносупрессии при использовании ЭФХТ.
Введение. Оптимальный подход ведения пациентов с пересаженными органами, позволяющий улучшать выживаемость пациента и трансплантата, предусматривает достижение баланса между профилактикой и лечением отторжения и риском развития инфекций. В течение первых 6 мес. после трансплантации почки (ТП) инфекции развиваются у 52% пациентов [1, 2].
По мнению S. Becker и соавт. в раннем посттрансплантационном периоде чаще других встречается инфекция мочевыводящих путей (ИМП) [3].
H. Green и соавт. сообщают, что в 13,3% случаев ИМП развивается в 1-й мес., в 14,7% – со 2-го по 6-й и в 72% – спустя более 6 мес. после ТП [4].
Инфекции различной локализации способны значительно ухудшать функцию почечного аллотрансплантата (ПАТ) непосредственно при развитии инфекционного процесса, а также инициировать острое отторжение, повышать активность хронического отторжения и ухудшать долгосрочный прогноз выживаемости трансплантатов и реципиентов [5].
В свою очередь нарушенная функция ПАТ становится важным предиктором развития инфекционных осложнений в позднем посттрансплантационном периоде [6].
Кроме известных урологических осложнений ТП (стриктура мочеточника, острый пиелонефрит, гематома ложа трансплантата, гидронефроз, некроз мочеточника с формированием мочевого затека, пузырно-мочеточниковый рефлюкс с присоединением пиелонефрита, лимфоцеле) развитию ИМП также способствуют источник получения органа (трупный или живой донор), сроки восстановления функции ПАТ, вид протокола иммуносупрессии, мочеточниковые стенты и длительное использование уретральных катетеров [7]. Инфекции мочевыводящих путей также способны реактивировать цитомегаловирус (ЦМВ), который может стать причиной острого отторжения ПАТ [8]. Существует предположение, будто глобальная иммуносупрессия может ингибировать регуляторные механизмы, играющие важную роль в поддержании толерантности к чужеродному антигену [9]. В связи с этим разработка и внедрение в клиническую практику новых методик, создающих основы для поддержания иммунологической толерантности, по сей день остаются главной стратегией в трансплантологии.
К одним из таких методов относится экстракорпоральная фотохимиотерапия (ЭФХТ), которая зарекомендовала себя как эффективный метод предупреждения и лечения отторжения при трансплантации сердца, легких, печени и почек. Известны результаты нескольких исследований, где курсы ЭФХТ были с успехом использованы для купирования устойчивых эпизодов отторжения [10, 11]. Имеются также единичные публикации о применении ЭФХТ в качестве профилактики острого отторжения ПАТ [12].
Результаты применения ЭФХТ после ТП больными хроническим гломерулонефритом не выявили увеличения частоты развития ИМП [13]. Однако в отечественной и зарубежной литературе не встречается публикаций, посвященных влиянию ЭФХТ на частоту ИМП у наиболее скомпрометированной группы больных, причиной хронической болезни почек (ХБП) у которых были урологические заболевания. На фоне сформированной у пациентов за долгие годы болезни толерантности ко многим классам антибактериальных препаратов и высокой устойчивости внебольничных штаммов микроорганизмов, вызывающих ИМП, к широко применяемым препаратам применение иммуносупрессии, в том числе ЭФХТ, может сопровождаться тяжелыми гнойно-септическими и инфекционными осложнениями.
В связи с вышесказанным целью данного исследования стало изучение эффективности экстракорпоральной фотохимиотерапии в качестве предупреждения отторжения почечного аллотрансплантата в сочетании со снижением частоты инфекционных осложнений у урологических больных.
Материалы и методы. В исследование вошли 48 пациентов, которые были реципиентами парных трансплантатов от 24 доноров. Основную группу составили 14 мужчин и 10 женщин в возрасте 40,4±11,2 года, которые получали ЭФХТ, группу сравнения – 13 мужчин и 11 женщин в возрасте 39,1±12,1 года. Длительность заместительной почечной терапии перед ТП в основной группе составила 23,2±8,2 мес., в группе сравнения – 24,6±7,4. Индекс совместимости доноров и реципиентов в основной группе составил 8 (4; 13), в группе сравнения – 9 (5; 13).
Причиной ХБП в двух группах больных служили практически идентичные урологические заболевания: хронический пиелонефрит (15 и 17 пациентов основной группы и группы сравнения соответственно), поликистоз почек (4 и 5 пациентов соответ-ственно), гипертоническая нефропатия в сочетании с инфравезикальной обструкцией (2 пациента основной группы), мочекаменная болезнь (2 пациента основной группы и 1 – группы сравнения), аномалия развития мочеполовой системы (по 1 пациенту в каждой группе).

Больным пиелонефритом выполняли нефрэктомию до или одномоментно с ТП при условии отсутствия эффекта от антибиотикотерапии. Показанием к удалению поликистозных почек считали резкое увеличение их размеров, что препятствует пересадке трупной почки в подвздошную область, наличие гематурии, частые атаки пиелонефрита, разрывы кист, наличие конкрементов, постоянные боли в области поликистозной почки. Шести больным перед ТП была выполнена односторонняя нефрэктомия, 3 – поэтапная бинефрэктомия. Из двух больных гипертоническим нефросклерозом и инфравезикальной обструкцией одному во время ТП наложена эпицистостома, ликвидированная после бужирования стриктуры задней уретры, второму выполнена трансуретральная резекция предстательной железы. Обе операции проведены в отделении урологии МОНИКИ.
Процедуры ЭФХТ начинали с 4-х суток и с постепенным увеличением интервалов завершали на 180-е сутки после ТП. Методика заключалась в экстракорпоральной сепарации и накоплении 40–70 мл концентрата мононуклеарных клеток на аппарате Haemonetics, который подвергали воздействию ультрафиолета при длине волны 380–420 нм и после 90 мин инкубационного периода при 37°С реинфузировали пациенту. В качестве фотосенсибилизатора использован аммифурин в дозе 1 мг/кг, который пациент принимал за 2 ч до процедуры.
На основании анализа количества клеток, экспрессирующих коактивационные молекулы CD28, и плотности коэкспрессии их на наивных лимфоцитах (MFI) на 4-е и 30-е сутки после ТП судили о возможности формирования иммунологической толерантности к антигенам донорского органа методом экстракорпоральной фотохимиотерапии.
Статистический и корреляционный анализы проведены с использованием программы Statistica v.8. Определена выживаемость пациентов, продолжительность жизни до ИМП построением кривых по Каплану–Мейеру.
Результаты. Инфекции мочевыводящих путей. Учтены следующие формы инфекций:
- пиелонефрит ПАТ. Диагноз поставлен на основании клинических данных и результатов лабораторных, а также инструментальных методов исследования;
- пиелонефрит собственных почек, в том числе поликистозно измененных. Учтены как первичная атака пиелонефрита, так и обострение хронического пиелонефрита;
- инфекции, связанные с несостоятельностью уретероцистонеоанастомоза или некрозом мочеточника, осложненные экстравазацией мочи, стриктуры мочеточника, гидронефроз ПАТ;
- ЦМВ-инфекция, причем учтены как бессимптомная виремия, так и инфекция, потребовавшая стационарного лечения.
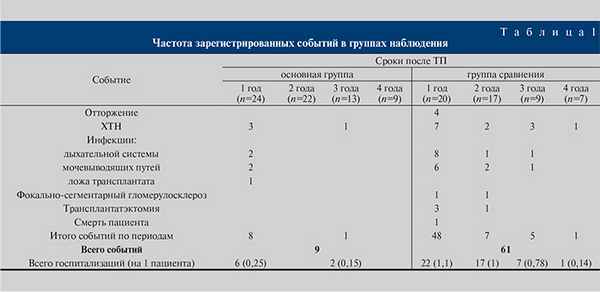
Медиана срока наблюдения составила 28 (10,45; 44,5 мес). На момент проведения исследования у 2 пар реципиентов срок после ТП составил 1 год, у 9 – 2, у 4 – 3 и у 9 пар – 4 года. Три пациента группы сравнения выбыли из исследования по причине трансплантатэктомии в раннем послеоперационном периоде (рецидивирующий пиелонефрит ПАТ, острое отторжение, тромбоз вены ПАТ), 1 реципиент группы сравнения – через 1 год после ТП ввиду трансплантатэктомии (фокально-сегментарный гломерулосклероз по данным биопсии) и 1 пациент группы сравнения умер в результате развившейся на фоне усиленной иммуносупрессии пневмоцистной пневмонии (табл. 1).
Сравнительный анализ показал, что абсолютное большинство случаев ИМП (17) имело место в контрольной группе, тогда как в основной группе клинически незначимый пиелонефрит ПАТ констатирован в 2 наблюдениях (табл. 2).
Важно, что у 1 пациента основной группы бессимптомная бактериурия стала проявлением основного заболевания – аномалии развития мочеполовой системы. При МСКТ выявлен двусторонний пассивный пузырно-мочеточниковый рефлюкс. Через 1 мес. после ТП больной выполнена билатеральная нефрэктомия. В дальнейшем эпизодов пиелонефрита не было, удовлетворительная функция ПАТ сохраняется в течение 4 лет. Второй случай пиелонефрита ПАТ в основной группе был обусловлен осложнениями цистоскопического извлечения стента мочеточника.
В бактериальных посевах мочи на 5-е сутки выявлены Еnterococcus spp. 103, на 12-е сутки – Enterobact. spp. 103, E. facium 104, через 3 мес. – отсутствие роста бактерий. Функция ПАТ до сих пор расценивается как удовлетворительная, эпизодов пиелонефрита ПАТ не было, в госпитализации пациент за 4 года не нуждался.
В свою очередь в группе сравнения наблюдали 9 случаев пиелонефрита. У 1 больного на 3-и сутки после ТП развился мочевой затек, обусловленный некрозом мочеточника. В бактериальных посевах мочи выявлен рост Сandida albicans 105, Pseudomonas aeruginosa 105, Klebsiela pneumoniae 105. На 5-е сутки пациенту выполнено реконструктивное оперативное вмешательство на мочеточнике. Через 1 мес. диагностирован рецидивирующий пиелонефрит ПАТ с ухудшением функции почки и развитием гидронефроза ПАТ, в бактериальном посеве – дрожжевые грибы 105, Кlebsiela pneumoniae 105, больной перенес очередную ревизию ложа ПАТ, в ходе которой обнаружены гематома, некроз мочеточника; выполнена очередная реконструктивная операция. Пациент выписан с улучшением функции ПАТ, однако менее чем через год госпитализирован с жалобами на слабость, боли в области ПАТ, повышение температуры тела до 38°С, рост уровня креатинина до 220 нг/мл. По данным УЗИ установлен гидронефроз ПАТ, выполнена трансплантатэктомия.
У 4 реципиентов основной группы и 8 – группы сравнения в крови выявлена ДНК ЦМВ. При этом у всех реципиентов основной группы инфекция протекала в виде бессимптомной виремии. У 3 реципиентов группы сравнения отмечены клинические проявления ЦМВ-инфекции, потребовалась госпитализация. В 2 случаях констатирована дисфункция ПАТ, а при морфологическом исследовании биоптата выявлены пограничные изменения. Проведено лечение (ганцикловир, пульс-терапия метилпреднизолоном, иммуноглобулин) с положительной динамикой. У 1 реципиента на фоне ЦМВ развилась тяжелая панцитопения, в связи с чем потребовались отмена микофеноловой кислоты и введение гранулоцитарно-макрофагального колониестимулирующего фактора роста.
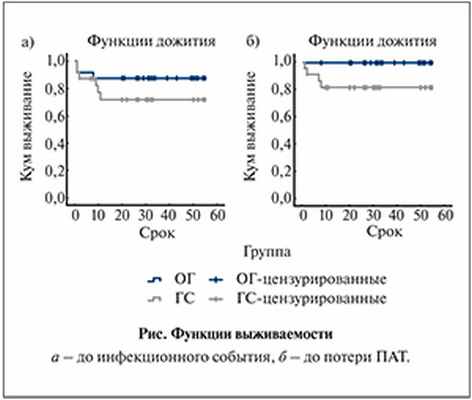
Как видно из табл. 2, доля пациентов группы сравнения, у которых ИМП были причиной госпитализации, в различные сроки анализируемого периода варьировалась от 5 до 40%. Причем основная масса госпитализаций приходится на первый год после ТП (8 эпизодов). Число пациентов, у которых ожидаемое событие, т.е. развитие ИМП, не произошло к определенному моменту времени, достоверно не различалось – 87,5 и 75% в основной группе и группе сравнения соответственно (Log Rank (Mantel-Cox)=0,231; рисунок, а).
Интересными представляются результаты сравнительного анализа выживаемости трансплантата (рисунок, б), показатели которой составили 100 и 83,3% в основной группе и группе сравнения соответственно (Log Rank (Mantel-Cox)=0,036). Три пациента группы сравнения перенесли трансплантатэктомию в течение первого года после ТП по причинам рецидивирующего пиелонефрита ПАТ, острого отторжения ПАТ и тромбоза вены ПАТ, 1 трансплантатэктомия выполнена через год после ТП (фокально-сегментарный гломерулосклероз). В функцию дожития не включен пациент контрольной группы, который умер в результате развившейся на фоне усиленной иммуносупрессии пневмонии.
При анализе лабораторных данных через 6 мес. после ТП отмечено достоверное преимущество основной группы по показателям скорости клубочковой фильтрации (56,7±6,2 против 41,5±5,1 мл/мин, р<0,001) и протеинурии (0,55±0,08 против 1,48±0,54 г/л, р<0,001).
Таким образом, подтверждается общеизвестный факт, согласно которому развитие ИМП в течение первых 5 лет после ТП служит фактором риска гибели ПАТ. Частично большее количество случаев полной утраты функции ПАТ можно объяснить статистически значимо большим числом кризов отторжения в группе контроля (4 случая), подтвержденных биопсией, и полным отсутствием такововых у пациентов, получавших ЭФХТ. В связи с этим перспективным остается внедрение ЭФХТ при ТП, способной предупредить развитие отторжения без увеличения риска ИМП у больных урологического профиля, что, безусловно, улучшит результаты ТП для данной категории больных.
Результаты иммунологических исследований.
В результате иммуносупрессии на 4-е сутки количество клеток, экспрессирующих коактивационные молекулы CD28, было почти в 2 раза меньше, чем в норме. При этом плотность коэкспрессии их на наивных лимфоцитах (MFI) уменьшалась пропорционально их количеству (r=0,58, p=0,01). Через 30 дней после ТП в группе сравнения не происходило существенного изменения количества клеток, экспрессирующих молекулы коактивации (57,7±18,2% и 52,7±23,2%; р>0,05) и MFI (22,7±6,0 и 19,6±7,0 Е; р>0,05). В то же время в основной группе отмечено статистически значимое уменьшение количества таких клеток (с 57,7±18,2 до 34,5±11,4%; р<0,05) и MFI (c 22,7±6,0 до 16,8±5,1 ЕД; р<0,05). Это свидетельствует об универсальности и более точной направленности ЭФХТ на ингибирование коактивационных молекул, через которые реализуется второй сигнальный путь активации Т-клеточного рецептора.
Заключение. В ходе настоящего исследования продемонстрировано, что ЭФХТ – это эффективный способ предупреждения отторжения ПАТ в сочетании с уменьшением частоты ИМП, что наиболее актуально для больных с урологической этиологией ХБП. Применение ЭФХТ после ТП сопровождается стабильной и с течением времени улучшающейся функцией ПАТ, что подтверждено лабораторными данными и результатами протокольной биопсии. Экстракорпоральная фотохимиотерапия позволяет селективно блокировать второй путь коактивации Т-хелперов и супрессоров, может служить ценным дополнением к стандартному протоколу иммуносупрессивной терапии, обеспечивая индукцию антигенспецифического ингибирования эффекторных Т-клеточных функций и формирование иммунологической толерантности к антигенам донорского органа.
Литература
1. Ватазин А.В., Круглов Е.Е., Астахов П.В., Зулькарнаев А.Б., Федулкина В.А. Бактериальные инфекции и долгосрочные результаты трансплантации почки. Нефрология. 2013;17(2):75–78.
2. Zukowski M., Kotfis K., Biernawska J., Zegan-Barańska M., Kaczmarczyk M., Ciechanowicz A., Brykczyński M., Różański J., Ziętek Z., Nikodemski T., Bohatyrewicz R. Graft infection in kidney recipients and its relation to transplanted kidney function. Transplant Proc. 2011;43(8):2997–2999.
3. Becker S., Witzke O., Rübben H., Kribben A. Urinary tract infections after kidney transplantation: Essen algorithm for calculated antibiotic treatment. Urologe A. 2011;50(1):53–56.
4. Green H., Rahamimov R., Gafter U., Leibovitci L., Paul M. Antibiotic prophylaxis for urinary tract infections in renal transplant recipients: a systematic review and meta-analysis. Transpl. Infect. Dis. 2011;13(5):441–447.
5. Ватазин А.В., Дутов В.В., Зулькарнаев А.Б., Федулкина В.А., Крстич М. Инфекционные осложнения после трансплантации почки. Урология. 2013;3:107–111.
6. Senger S.S., Arslan H., Azap O.K., Timurkaynak F., Cağir U., Haberal M. Urinary tract infections in renal transplant recipients. Transplant Proc. 2007;39(4):1016–1017.
7. Vaccarisi S., Cannistrà M., Pellegrino V., Cavallari G., Nardo B. Urologic complications in kidney transplantation: a single-center experience. Transplant Proc. 2011;43(4):1074–1075.
8. Silva M.Jr., Marra A.R., Pereira C.A., Medina-Pestana J.O., Camargo L.F. Bloodstream infection after kidney transplantation: epidemiology, microbiology, associated risk factors, and outcome. Transplantation. 2010;90(5):581–587.
9. Al-Hasan M.N., Razonable R.R., Kremers W.K., Baddour L.M. Impact of Gram-negative bloodstream infection on long-term allograft survival after kidney transplantation. Transplantation. 2011;91(11):1206–1210.
10. Rummler S., Barz D. Extracorporeal photopheresis – a benifical treatment for cardiac and lung transplant rejection. Transplant international. 2011;24:5e.
11. Jardine M.J., Bhandari S., Wyburn K.R., Misra A.K., McKenzie P.R., Eris J.M. Photopheresis for Problematic Renal Allograft Regection. J. of Clin. Apheresis 2009;24:161–169.
12. Lamioni A., Carsetti R., Legato A., Landolfo A., Isacchi G., Emma F., Bottazzo G.F., Dello Strologo L. Induction of regulatory T cells after prophylactic treatment with photopheresis in renal transplant recipient. Transplantation. 2007;83:1393–1396.
13. Федулкина В.А., Ватазин А.В., Кильдюшевский А.В., Столяревич Е.С., Кантария Р.О., Зулькарнаев А.Б. Трансляционная клеточная иммунотерапия при аллотрансплантации трупной почки. Альманах клинической медицины. 2013;28:25–31.
Об авторах / Для корреспонденции
Предупреждение отторжения трансплантата
Предупреждение отторжения трансплантата
Если бы иммунная система была полностью подавлена, отторжения трансплантата не происходило бы. Фактически у некоторых людей с тяжелой депрессией иммунной системы трансплантация могла бы быть успешной без использования значительной терапии для предупреждения отторжения. При отсутствии этой терапии у людей, даже при условии максимально возможной тканевой совместимости, аллотранспланта-ты отторгаются в течение нескольких дней или недель.
Поскольку важной частью иммунной системы, участвующей в уничтожении трансплантированных клеток, являются в основном Т-клетки, их подавление гораздо важнее, чем подавление антител плазмы. Далее перечислены некоторые лечебные агенты, используемые для этой цели.
1. Глюкокортикоидные гормоны, выделенные из коры надпочечников (или лекарственные средства с активностью, подобной глюкокортикоидам), подавляют рост всей лимфоидной ткани и, следовательно, снижают формирование антител и Т-клеток.
2. Различные лекарства, оказывающие токсическое влияние на лимфоидную систему и, следовательно, блокирующие формирование антител и Т-клеток (например, азатиоприн).
3. Циклоспорин специфически тормозит образование Т-хелперов и, следовательно, особенно эффективен для блокады Т-клеточной реакции отторжения. Доказано, что этот препарат — один из наиболее полезных лекарственных средств, поскольку он не подавляет другие части иммунной системы.
Использование этих агентов часто оставляет человека беззащитным перед инфекционными болезнями, иногда бактериальные и вирусные инфекции у них становятся неуправляемыми. Кроме того, риск заболевания раком в несколько раз выше у человека с подавленной иммунной системой, возможно в связи с тем, что эта система важна для разрушения многих ранних раковых клеток до начала их пролиферации.
Итак, трансплантация живых тканей человека имеет ограниченный, но важный успех. Если когда-нибудь удастся заблокировать иммунный ответ реципиента без одновременного разрушения его специфического иммунитета против болезней, ситуация резко изменится.
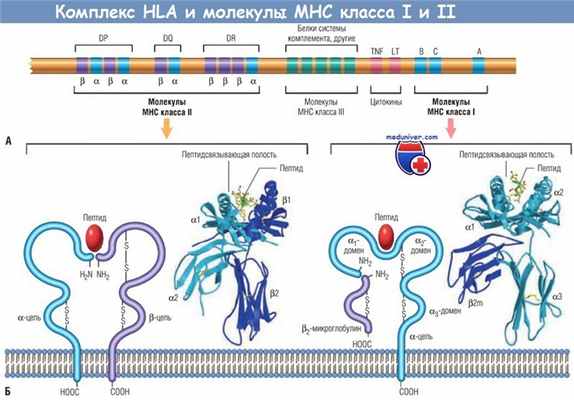
Комплекс HLA и структура молекул HLA.
(А) Расположение генов комплекса HLA (положение, величина и расстояния между генами даны в произвольном масштабе).
Гены, кодирующие различные белки, которые участвуют в процессинге антигена (транспортеры, связанные с процессингом антигена компоненты протеасом и HLA-DM), располагаются в области класса II (не показаны).
(Б) Схематическое изображение и кристаллическая структура молекул HLA классов I и II.
LT — липопротеин; МНС — главный комплекс гистосовместимости; TNF — фактор некроза опухоли.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Реакция отторжения трансплантата
Реакция отторжения трансплантата (РОТ) – иммунологический процесс, направленный против чужеродных для организма тканей, пересаженных в ходе операции трансплантации. Сопровождается комплексом местных (отек, воспаление) и общих (явления интоксикации, повышение температуры, слабость) проявлений, выраженность и скорость развития которых зависят от варианта реакции. Диагностика производится посредством изучения клинической картины, гистологического исследования пересаженных тканей, ряда лабораторных и инструментальных методов в зависимости от типа трансплантата. Лечение сводится к проведению иммуносупрессивной терапии, использованию цитотоксических средств, некоторые препараты назначают пожизненно.
Общие сведения
Иммунологические реакции отторжения трансплантата возникают при использовании аллогенных (пересаженных от человека человеку) или ксеногенных (от животных человеку) тканей и органов. Аутотрансплантаты, например кожа, пересаженная с бедра на лицо, имеют такую же антигенную структуру, как и другие ткани организма, поэтому реакции не вызывают. Отторжение крайне редко возникает при пересадке бессосудистых структур – роговицы, некоторых хрящей – поскольку в этом случае отсутствует контакт чужеродных тканей с иммунокомпетентными клетками. Состояние было самым распространенным осложнением на заре трансплантологии, но в последние годы встречается все реже, несмотря на увеличение количества хирургических операций такого типа. Это связано с успехами в определении гистосовместимости тканей донора и реципиента, разработкой более действенных методов иммуносупрессивной терапии.
Причины реакции отторжения трансплантата
Антигенная совместимость тканей обусловлена сочетанием ряда антигенов – в первую очередь, главного комплекса гистосовместимости (шесть главных антигенов и ряд второстепенных или минорных). Кроме того, влияние могут оказывать и другие белковые антигенные комплексы (АВ0, белки соединительных тканей). Во многом реакции отторжения аналогичны обычному иммунному ответу при попадании в организм чужеродных антигенов или (в некоторых случаях) реакциям гиперчувствительности 2-го и 3-го типов. В их развитии принимают участие гуморальные и клеточные механизмы иммунитета. Скорость возникновения патологических изменений трансплантата зависит от вида реакции, активности иммунитета реципиента, величины антигенного различия тканей.
Причиной молниеносных разновидностей отторжения трансплантата служит сенсибилизация организма реципиента, в результате которой при пересадке возникают процессы, аналогичные реакциям непереносимости с образованием иммунных комплексов и активацией системы комплемента. Более распространенные острые виды иммунологической реакции на пересаженные ткани обычно развиваются из-за несовместимости по антигенам ГКГС, в патогенезе участвует преимущественно клеточный иммунный ответ. Хронические формы РОТ обусловлены как клеточными, так и гуморальными реакциями, их причиной часто становится некорректная иммуносупрессивная терапия, назначенная после операции.
Патогенез
Процессы патогенеза реакции отторжения трансплантата отличаются при разных формах этого состояния. Сверхострые или молниеносные реакции обусловлены сенсибилизацией организма к антигенам пересаженного органа, поэтому протекают по типу непереносимости или аллергии. При контакте тканей аллотрансплантата с кровью реципиента стимулируется образование иммунокомплексов, оседающих на внутренней поверхности сосудов. Они провоцируют активацию системы комплемента, сильно повреждая эндометрий сосудистой сети трансплантата, из-за чего происходит образование множественных микротромбов и эмболизация сосудов. Это ведет к ишемии пересаженных тканей, их отеку, а при отсутствии терапевтических мер – к некрозу. Скорость развития патологических процессов составляет всего несколько часов или суток.
В основе острых и хронических видов РОТ лежат процессы клеточного иммунного ответа, поэтому такие реакции развиваются несколько медленнее – на протяжении нескольких недель. При антигенной несовместимости тканей трансплантата и реципиента на фоне адекватной или повышенной активности иммунитета происходит распознавание чужеродных клеток макрофагами и Т-лимфоцитами (хелперами или индукторами). Последние активируют Т-киллеры, которые выделяют протеолитические ферменты, разрушающие клеточные мембраны структур аллотрансплантата. Итогом является развитие воспалительной реакции в пересаженном органе, выраженность которой зависит от уровня активности иммунной системы. При длительно протекающем процессе возможно подключение гуморальных факторов иммунитета с синтезом специфических антител, направленных против антигенов трансплантата.
Классификация
Выделяют несколько форм реакции отторжения, различающихся между собой по скорости развития и ряду клинических проявлений. Причиной такой разницы являются разные виды РОТ, обладающие неодинаковой скоростью возникновения, а также преимущественным поражением тех или иных структур трансплантата. Зная примерные сроки формирования того или иного типа иммунного ответа, специалист может определить его характер и назначить оптимальное лечение. Всего существует три основных клинических формы реакций непереносимости тканей трансплантата:
- Молниеносная или сверхострая. Возникает в первые минуты или часы после «подключения» пересаженного органа к системному кровотоку реципиента, обусловлена сенсибилизацией организма последнего к антигенам трансплантата. Характеризуется массивными микроциркуляторными нарушениями с ишемическими явлениями в аллотрансплантате и развитием некроза, воспаление при этом имеет вторичный характер.
- Острая. Регистрируется в течение первых трех недель после пересадки, патогенез основан на клеточном иммунном ответе при несовместимости донора и реципиента. Основным проявлением становится развитие воспалительных процессов в пересаженных тканях, их выраженность зависит от активности иммунитета.
- Хроническая. Возникает через несколько месяцев после трансплантации, может иметь рецидивирующий характер, сильно зависит от режима иммуносупрессивной терапии. Развивается посредством как клеточных, так и гуморальных механизмов иммунного ответа.
Симптомы реакции отторжения трансплантата
Все проявления отторжения аллотрансплантата разделяют на системные, зависящие только от патогенеза процесса и реактивности иммунитета, и локальные, связанные непосредственно с трансплантированным органом или тканью. Среди общих симптомов всегда наблюдается повышение температуры, озноб, лихорадка большей или меньшей степени выраженности. Регистрируются проявления общей интоксикации – головная боль, тошнота, рвота, снижение артериального давления. Симптомы интоксикации организма резко усиливаются при развитии процессов некроза в трансплантате, в тяжелых случаях на этом фоне возможно возникновение токсигенного шока.
Локальные проявления РОТ связаны с пересаженным органом, поэтому могут различаться у разных больных. При трансплантации целого органа на первый план выступают симптомы, обусловленные нарушением его функции – например, кардиалгии, нарушения ритма, сердечная недостаточность при пересадке сердца. Острая почечная недостаточность может быть связана с реакцией отторжения трансплантированной почки, печеночная – печени. При аллотрансплантации кожного лоскута возникает его отек, покраснение вплоть до багрового оттенка, возможно присоединение вторичной бактериальной инфекции. Сроки появления местных и общих симптомов отторжения зависят от его формы – молниеносный тип характеризуется тяжелой реакцией уже через 2-3 часа после трансплантации, тогда как острые и хронические виды могут проявляться через несколько недель или даже месяцев.
Осложнения
Наиболее ранним и тяжелым осложнением реакции отторжения пересаженных тканей является развитие шока, связанного с иммунологическими процессами или обусловленного интоксикацией организма. Некроз и поражение тканей трансплантированного органа, работа которого является жизненно важной для организма (например, сердца), часто приводит к летальному исходу. К осложнениям РОТ некоторые специалисты относят и инфекционные болезни, вызванные усиленной иммуносупрессивной терапией. В отдаленной перспективе на фоне искусственного понижения активности клеточного иммунитета возможно развитие онкологических заболеваний.
Диагностика
Особенностью диагностики реакции отторжения трансплантата является необходимость ее максимально быстрого проведения, позволяющего не только улучшить состояние больного, но и сохранить пересаженный орган. Некоторые исследователи относят к диагностике РОТ ряд иммунологических исследований, выполняемых перед операцией на этапе подбора донора – типирование спектра трансплантационных антигенов, определение биологической совместимости тканей. Качественное выполнение данных анализов позволяет избежать развития сверхострой реакции и значительно снизить вероятность возникновения других форм отторжения. Среди диагностических процедур, выполняемых после трансплантации, наиболее информативными являются следующие:
- Лабораторные исследования. При процессе отторжения в общем анализе крови будут выявляться признаки неспецифического воспаления – лимфоцитоз, увеличение СОЭ. Исследование иммунного статуса позволяет обнаружить иммунные комплексы, увеличение уровня компонентов комплемента (при молниеносных формах), иммуноглобулинов. Под действием иммуносупрессивной терапии результаты анализов могут искажаться, что необходимо учитывать при их интерпретации.
- Инструментальные исследования. Инструментальные методы диагностики (рентгенография, УЗИ, УЗДГ, КТ, МРТ) используют для оценки функциональной активности и структуры трансплантата – почки, печени, сердца, легкого. В общем плане РОТ проявляется отеком органа, нарушением его работы, наличием циркуляторных нарушений (ишемии, инфарктов, некроза). При хронических и рецидивирующих типах реакции в структуре трансплантата могут определяться участки склероза.
- Гистологические исследования. Биопсия тканей аллотрансплантата, их последующее гистологическое и гистохимическое изучение является золотым стандартом в определении РОТ. При молниеносном типе реакции в биоптате выявляются поврежденны е капилляры, периваскулярный отек, признаки ишемии и некроза тканей, биохимические исследования определяют иммунные комплексы на поверхности эндометрия. При хронических или острых типах отторжения обнаруживается лимфоцитарная инфильтрация тканей трансплантата, наличие участков ишемии и склероза.
Подходы к диагностике реакций отторжения могут меняться с учетом конкретного пересаженного органа. Например, при трансплантации почки показаны общий и биохимический анализ мочи, УЗДГ и другие ультразвуковые исследования органа, с осторожностью – экскреторная урография. В случае пересадки сердца необходимо проведение электрокардиографии, ЭхоКГ, коронарной ангиографии.
Лечение реакции отторжения трансплантата
Лечение РОТ заключается в уменьшении активности иммунного ответа, до сих пор продолжается разработка наиболее эффективных методов. Составлением схемы терапии занимается врач-иммунолог в кооперации с трансплантологом. Перспективной техникой считается выработка иммунологической толерантности к антигенам аллотрансплантата, однако ее механизмы довольно сложны и пока недостаточно изучены. Поэтому практически единственным методом лечения и профилактики отторжения является неспецифическая иммуносупрессивная терапия, проводимая несколькими группами лекарственных средств:
- Стероидные препараты. К этой группе относят преднизолон и его производные, дексаметазон и другие средства. Они снижают скорость пролиферации лимфоцитов, являются антагонистами многих факторов воспаления, эффективно уменьшают выраженность иммунного ответа. В ряде случаев курсовое применение этих препаратов после проведения трансплантации назначают пожизненно.
- Аналоги азотистых оснований. Данные препараты способны встраиваться в процесс синтеза нуклеиновых кислот и тормозить его на определенном этапе, снижая скорость образования иммунокомпетентных клеток и выраженность процессов отторжения. В целях профилактики их используют вскоре после пересадки органа.
- Алкилирующие средства. Группа препаратов, способных присоединяться к ДНК клеток и блокировать их деление. Медикаменты применяют при острых формах данного состояния по причине быстрого и надежного цитотоксического эффекта.
- Антагонисты фолиевой кислоты. Витамин В9 участвует в синтезе некоторых азотистых оснований и пролиферации лимфоцитов, его антагонисты замедляют процесс развития иммунного ответа при РОТ. Средства используют при хронических формах реакции в составе комплексной терапии.
- Антибиотики. Отдельные препараты данной группы (циклоспорин, хлорамфеникол) блокируют синтез РНК, тормозя как клеточные, так и гуморальные иммунные реакции. Иногда применяются пожизненно после трансплантации для профилактики отторжения.
По показаниям могут быть назначены и другие медикаменты для улучшения состояния больного – детоксикационные препараты, диуретики, стимуляторы сердечной деятельности, противовоспалительные и жаропонижающие средства. При тяжелых осложнениях (шок, острая сердечная или почечная недостаточность) необходимы реанимационные мероприятия, гемодиализ. При присоединении инфекции на фоне иммуносупрессии требуется своевременное назначение антибиотиков, противогрибковых или противовирусных (с учетом характера возбудителя) средств.
Прогноз и профилактика
Прогноз при молниеносных видах реакции отторжения трансплантата практически в 100% случаев неблагоприятный – требуется операция по удалению пересаженного органа, подбор нового донора и повторная трансплантация. В то же время, риск развития РОТ при вторичной пересадке повышается в несколько раз. Своевременно начатая иммуносупрессия при острых или хронических вариантах состояния нередко позволяет сохранить аллотрансплантат, но повышает риск инфекционных осложнений и вероятность возникновения рака в будущем. Эффективной профилактикой отторжения является тщательный подбор донора для пересадки, проверка совместимости по всем возможным антигенным системам – особенно по ГКГС, совместимы должны быть не менее 4-х из 6-ти главных аллелей. Резко снижает вероятность развития патологии наличие прямой кровной родственной связи между донором и реципиентом.
Пересадка стволовых клеток и отторжение трансплантата
Было бы желательно пересмотреть антибиотикопрофилактику при трансплантации гемопоэтических стволовых клеток (ТГСК), поскольку такое лечение приводит к дисбиозу кишечника, усиливая негативное влияние реакции «трансплантат против хозяина».
Следите за сообществом микробиоты
Раздел для широкой публики
en_sources_title
Делиться - значит заботиться
Возможно, эта тема заинтересует ваших коллег. Почему бы не поделиться ею?
Разделы
Об этой статье
Антибиотикопрофилактика перед трансплантацией аллогенных гемопоэтических стволовых клеток (ГСК) является обычной практикой в онкогематологии. Ее целью является предупреждение бактериальных инфекций, связанных с лучевой и химиотерапией, которые серьезно вредят эпителию кишечника. Тем не менее эта практика, как полагают, повышает уровень осложнений и смертности в связи с реакцией «трансплантат против хозяина» (РТПХ), при которой Т-клетки донора оборачиваются против эпителиальных клеток реципиента – главным образом клеток кожи, печени и желудочно-кишечного тракта. Убивая комменсальные бактерии, антибиотики снижают устойчивость кишечника реципиента к колонизации. Кроме того, считается, что они способствуют появлению антибиотикорезистентных бактерий 12,13 .
НЕГАТИВНОЕ ВЛИЯНИЕ СОКРАЩЕНИЯ РАЗНООБРАЗИЯ БАКТЕРИЙ
Применение антибиотиков также приводит к дисбиозу кишечника с сокращением бактериального разнообразия, характеризующегося в некоторых случаях пролиферацией одного таксона, например Enterococcus в ущерб другим бактериям, включая Faecalibacterium spp. и Ruminococcus spp. (оба вида принадлежат к отряду Clostridiales) 13 . Это оказывает негативное влияние, поскольку данные виды производят бутират, соединение, способное вызывать размножение и дифференцировку регуляторных T-клеток, которые могут уменьшать воспаление, обусловленное Т-клетками донора. Как следствие, сокращение численности этих видов может провоцировать воспаление. Точно так же присутствие Blautia (Clostridiales), как представляется, ассоциируется с более низкой смертностью от РТПХ. В сочетании с иммунодепрессантами и цитотоксическими лекарственными препаратами антибиотики могут повышать риск бактериальной транслокации и, следовательно, распространения патогенов в различные органы, подверженные РТПХ1 13 .
ДВИЖЕНИЕ К ПЕРСОНАЛИЗИРОВАННОЙ МИКРОБИОТИЧЕСКОЙ МЕДИЦИНЕ?
Составление микробного профиля в реальном времени позволит снизить потенциальное пагубное влияние антибиотикопрофилактики. Возможность определения снижения количества бактерий Clostridiales или сокращения разнообразия микробиоты кишечника реципиента поможет выявлять пациентов с высоким риском и адаптировать лечение (применять антибиотики более узкого спектра, про- или пребиотики или даже непосредственно добавки КЦЖК, трансплантацию фекальной микробиоты и т. п.). Составление бактериального профиля также может оказаться полезным на этапе последующего наблюдения с точки зрения профилактики риска обострения, особенно это относится к анализу на наличие Enterobacteriaceae в стуле (Escherichia coli, Klebsiella spp., Enterobacter spp.) для предупреждения бактериемии, вызванной Enterobacter. Необходимо также учитывать состояние микробиоты кишечника донора, поскольку при низком содержании Bacteroides и Parabacteroides, как правило, бывает низкая концентрация КЦЖК. Все это – перспективные направления, которые могут помочь улучшить прогноз для пациентов при аллогенной ТГСК 12 .
Сандиммун неорал 50 мг 50 шт. капсулы
Трансплантация — трансплантация солидных органов: предупреждение отторжения аллотрансплантатов почки, печени, сердца, легкого, поджелудочной железы, а также комбинированного сердечно-легочного трансплантата; лечение отторжения трансплантата у больных, ранее получавших другие иммунодепрессанты; — трансплантация костного мозга: предупреждение отторжения трансплантата после пересадки костного мозга; предупреждение и лечение болезни "трансплантат против хозяина". Показания, не связанные с трансплантацией — эндогенный увеит: активный угрожающий зрению средний или задний увеит неинфекционной этиологии в случаях, когда традиционное лечение не оказало эффекта или в случаях развития тяжелых побочных эффектов; увеит Бехчета с повторными приступами воспаления с вовлечением сетчатки; — нефротический синдром: стероидозависимый и стероидорезистентный нефротический синдром у взрослых и детей, обусловленный патологией клубочков, такой как нефропатия минимальных изменений
Аналоги

Информация о товаре
Характеристики
Лекарственная форма
Состав
Вспомогательные вещества: D,L-альфа-токоферол, этанол, пропиленгликоль, моно-, ди- и триглицериды кукурузного масла, полиоксил 40 гидрогенизированного касторового масла.
Фармакотерапевтическая группа
Фармакодинамика
Иммунодепрессивный препарат, является циклическим полипептидом, состоящим из 11 аминокислот. Циклоспорин представляет собой селективный иммунодепрессант, ингибирующий активацию кальцийневрина лимфоцитов в фазе G0 или G1 клеточного цикла. Таким образом, предотвращается активация Т-лимфоцитов и, на клеточном уровне, антиген-зависимое высвобождение лимфокинов, включая интерлейкин-2 (фактор роста Т-лимфоцитов). Циклоспорин действует на лимфоциты специфично и обратимо. В отличие от цитостатиков он не подавляет гемопоэз и не влияет на функцию фагоцитов.
Циклоспорин увеличивает время жизни аллогенных трансплантатов кожи, сердца, почек, поджелудочной железы, костного мозга, тонкой кишки, легких. Циклоспорин также подавляет развитие клеточных реакций в отношении аллотрансплантата, кожных реакций гиперчувствительности замедленного типа, экспериментального аллергического энцефаломиелита, артрита, обусловленного адъювантом Фройнда, болезни “трансплантат против хозяина” (БТПХ) и зависимое от Т-лимфоцитов образование антител. Была показана эффективность применения Сандиммуна Неорала при пересадке костного мозга и солидных органов у человека для предупреждения и лечения отторжения и БТПХ, а также при лечении различных состояний, которые по своей природе являются аутоиммунными или могут рассматриваться как таковые.
Лекарственные формы препарата Сандиммун® Неорал® (раствор для приема внутрь и мягкие капсулы, в которые также заключен раствор) имеют следующую особенность. Раствор представляет собой микроэмульсионный преконцентрат, который образует микроэмульсию в присутствии жидкости (жидкости, с которой смешивают раствор для приема внутрь перед приемом или в присутствии жидкостей в желудке при приеме препарата в форме капсул). За счет этого уменьшается вариабельность фармакокинетических параметров и обеспечивается линейная зависимость между дозой и эффектом циклоспорина с более равномерным профилем абсорбции и меньшей зависимостью от одновременного приема пищи. При изучении микроэмульсионного преконцентрата было показано, что корреляция между базальной концентрацией циклоспорина и его действием более выражена при применении Сандиммуна Неорала, чем Сандиммуна.
Фармакокинетика
При приеме Сандиммуна Неорала обеспечивается более четкая линейная зависимость между дозой и эффектом циклоспорина (AUCB), более постоянный профиль абсорбции и меньшая зависимость от одновременного приема пищи и суточного ритма, которая характерна для Сандиммуна. Этими свойствами в совокупности обусловлены низкая вариабельность фармакокинетики циклоспорина у одного и того же пациента и более выраженная корреляция между базальной концентрацией и биодоступностью (AUCB). Вследствие указанных дополнительных преимуществ в режиме дозирования Сандиммуна Неорала больше нет необходимости учитывать время приема пищи. Кроме того, при применении Сандиммуна Неорала обеспечивается более равномерное воздействие циклоспорина как в течение суток, так и в течение курса поддерживающей терапии.
Tmax составляет 1.5-2 ч, абсорбция Сандиммуна Неорала происходит быстро, среднее значение Cmax в плазме больше на 59% и биодоступность выше на 29% в сравнении с Сандиммуном.
Циклоспорин распределяется большей частью вне кровяного русла. В крови 33-47% циклоспорина находится в плазме, 4-9% - в лимфоцитах, 5-12% - в гранулоцитах и 41-58% - в эритроцитах. Связывание с белками плазмы (преимущественно липопротеинами) составляет примерно 90%.
Циклоспорин в значительной степени подвергается биотрансформации изоферментом CYP3A4, и, в меньшей степени, в ЖКТ и почках, с образованием примерно 15 метаболитов. Не существует какого-либо одного главного пути метаболизма.
Циклоспорин выводится преимущественно с желчью и только 6% принятой внутрь дозы выводится с мочой (причем в неизмененном виде выводится только 0.1%).
Величины конечного T1/2 циклоспорина весьма вариабельны, что зависит от применяемого метода определения и обследуемого контингента больных. Конечный T1/2 при неизмененной функции печени составляет приблизительно 6.3 ч; у больных с тяжелыми заболеваниями печени - приблизительно 20.4 ч.
Показания
— трансплантация солидных органов: предупреждение отторжения аллотрансплантатов почки, печени, сердца, легкого, поджелудочной железы, а также комбинированного сердечно-легочного трансплантата; лечение отторжения трансплантата у больных, ранее получавших другие иммунодепрессанты;
— трансплантация костного мозга: предупреждение отторжения трансплантата после пересадки костного мозга; предупреждение и лечение болезни "трансплантат против хозяина".
— эндогенный увеит: активный угрожающий зрению средний или задний увеит неинфекционной этиологии в случаях, когда традиционное лечение не оказало эффекта или в случаях развития тяжелых побочных эффектов; увеит Бехчета с повторными приступами воспаления с вовлечением сетчатки;
— нефротический синдром: стероидозависимый и стероидорезистентный нефротический синдром у взрослых и детей, обусловленный патологией клубочков, такой как нефропатия минимальных изменений
Противопоказания
Не следует назначать циклоспорин больным с нарушениями функции почек (за исключением больных нефротическим синдромом с допустимой степенью этих нарушений), неконтролируемой артериальной гипертензией, злокачественными новообразованиями, инфекционными заболеваниями, не поддающимися адекватной терапии.
Способ применения и дозы
При трансплантации солидных органов лечение Сандиммуном Неоралом должно быть начато за 12 ч до операции в дозе от 10 до 15 мг/кг массы тела, разделенной на 2 приема. В течение 1-2 недель после операции препарат назначают ежедневно в той же дозе, после чего дозу постепенно снижают (под контролем концентрации циклоспорина в крови) до достижения поддерживающей дозы 2-6 мг/кг/ (в 2 приема).
Сандиммун® Неорал® назначают в комбинации с другими иммунодепрессантами, в т.ч. с ГКС, а также в составе комбинированной трехкомпонентной (Сандиммун® Неорал® + ГКС + азатиоприн) или четырехкомпонентной (Сандиммун® Неорал® + ГКС + азатиоприн + препараты моно- или поликлональных антител) терапии. Четырехкомпонентная схема применяется у больных с высоким риском развития отторжения. В случае применения Сандиммуна Неорала в составе схем комбинированной терапии его доза может быть уменьшена уже на начальном этапе терапии (3-6 мг/кг/ в 2 приема) или скорректирована в процессе лечения с учетом концентрации циклоспорина в плазме крови и динамики показателей безопасности (концентрация мочевины, креатинина в сыворотке, АД).
При трансплантации костного мозга начальную дозу следует вводить в день, предшествующий пересадке. В большинстве случаев предпочтительным является в/в введение; рекомендуемая доза составляет 3-5 мг/кг/ Инфузионное введение в этой же дозе продолжают в течение 2 недель после пересадки, затем переходят на пероральную поддерживающую терапию Сандиммуном Неоралом в суточной дозе около 12.5 мг/кг, разделенной на 2 приема. Поддерживающую терапию проводят не менее 3 мес (предпочтительно 6 мес), после чего дозу постепенно снижают до нуля в течение 1 года после трансплантации. Если Сандиммун® Неорал® назначается и для начального этапа терапии, то рекомендованная суточная доза составляет 12.5-15 мг/кг (в 2 приема) начиная со дня, предшествующего пересадке.
При наличии заболеваний ЖКТ, приводящих к снижению всасывания, могут потребоваться более высокие дозы Сандиммуна Неорала или в некоторых случаях применение в/в инфузий Сандиммуна.
После прекращения введения Сандиммуна у некоторых больных может развиться болезнь БТПХ, которая обычно регрессирует после возобновления терапии. Для лечения этого состояния при его хроническом течении в слабовыраженной форме следует использовать Сандиммун® Неорал® в низких дозах.
При эндогенном увеите для индукции ремиссии препарат назначают в начальной суточной дозе 5 мг/кг внутрь в 2 приема до исчезновения признаков активного воспаления и улучшения остроты зрения. В случаях, трудно поддающихся лечению, доза может быть увеличена до 7 мг/кг/ на непродолжительный период.
Если не удается контролировать ситуацию с помощью одного Сандиммуна Неорала, то для достижения начальной ремиссии или для купирования приступа воспаления можно присоединить системные ГКС (преднизолон в суточной дозе 0.2-0.6 мг/кг или другой глюкокортикостероид в эквивалентной дозе).
Побочные действия
Многие побочные эффекты, связанные с применением циклоспорина, дозозависимы и обратимы при уменьшении дозы. Спектр побочных эффектов в целом одинаков при различных показаниях, хотя частота и тяжесть побочных эффектов может варьировать. У больных, перенесших трансплантацию, из-за более высокой дозы и большей продолжительности лечения побочные эффекты встречаются чаще и обычно более выражены, чем у больных с другими показаниями.
При в/в введении циклоспорина отмечались случаи развития анафилактоидных реакций. У пациентов, получающих иммуносупрессивное лечение циклоспорином или комбинированную терапию, включающую циклоспорин, повышается риск развития локальных и генерализованных инфекций (вирусной, бактериальной, грибковой этиологии) и паразитарных инвазий. Также возможно обострение имевшихся ранее инфекционных заболеваний. Сообщалось о случаях развития инфекционных поражений с летальным исходом.
У больных, получающих иммуносупрессивное лечение циклоспорином или комбинированную терапию, включающую циклоспорин, повышается риск развития лимфом, лимфопролиферативных заболеваний и злокачественных новообразований, особенно кожи. Частота развития злокачественных новообразований возрастает при увеличении интенсивности и длительности иммуносупрессивной терапии.
Лекарственное взаимодействие
Ниже перечислены препараты, для которых взаимодействие с циклоспорином является подтвержденным и клинически значимым.
Различные препараты могут повышать или снижать концентрации циклоспорина в плазме или крови за счет подавления или индукции ферментов, принимающих участие в метаболизме циклоспорина, в частности изоферментов цитохрома CYP3A4. Поскольку циклоспорин является ингибитором цитохрома CYP3A4 и мембранного переносчика молекул Р-гликопротеина, при одновременном применении с Сандиммуном Неоралом возможно повышение концентрации препаратов, являющихся субстратами цитохрома CYP3A4 и/или мембранного переносчика Р-гликопротеина.
Препараты, снижающие концентрацию циклоспорина: барбитураты, карбамазепин, фенитоин; нафциллин, сульфадимидин при его в/в введении; рифампицин; октреотид; пробукол; орлистат; препараты, содержащие зверобой продырявленный (Hypericum perforatum); тиклопидин, сульфинпиразон, тербинафин, бозентан.
Особые указания
Сандиммун® Неорал® должен использоваться только врачами, имеющими опыт проведения иммуносупрессивной терапии и обладающими возможностью обеспечить адекватное наблюдение за больным, включая регулярное полное физикальное обследование, измерение АД и контроль концентрации креатинина в сыворотке. Наблюдение за больными, перенесшими трансплантацию и получающими препарат, следует проводить только в тех учреждениях, которые обеспечены обученным медицинским персоналом, адекватными лабораторными и прочими ресурсами.
Следует иметь в виду, что при применении циклоспорина, равно как и других иммунодепрессантов, повышается риск развития лимфом и других злокачественных новообразований, чаще кожных покровов. Повышенный риск развития этого осложнения связан больше со степенью и длительностью иммуносупрессии, чем с использованием конкретного препарата. Таким образом, следует соблюдать осторожность при применении комбинированных режимов иммуносупрессивной терапии, помня о вероятности развития лимфопролиферативных заболеваний и солидных органных опухолей, иногда приводящих к летальным исходам.
Учитывая потенциальный риск развития злокачественных новообразований кожи, пациентам, получающим лечение циклоспорином, следует избегать чрезмерного пребывания под прямыми солнечными лучами, воздействия ультрафиолетового UV-B излучения, ПУВА-терапии (фотохимиотерапии).
Применение циклоспорина, как и других иммунодепрессантов, предрасполагает к развитию различных бактериальных, грибковых, паразитарных и вирусных инфекций, причем часто с участием условно-патогенных возбудителей. Учитывая потенциальную опасность этих инфекций для жизни больного, следует применять эффективную систему профилактических и лечебных мероприятий, особенно в случаях длительного применения комбинированного иммуносупрессивного лечения.
В течение первых нескольких недель терапии Сандиммуном Неоралом может появиться частое и потенциально опасное осложнение - повышение уровня креатинина и мочевины в сыворотке. Эти функциональные изменения обратимы и дозозависимы, нормализуются при снижении дозы. При длительном лечении у некоторых больных возможно развитие в почках структурных изменений (например, интерстициального фиброза), которые у пациентов с почечными трансплантатами следует дифференцировать с изменениями при хроническом отторжении. Сандиммун® Неорал® может также вызывать дозозависимое обратимое повышение билирубина сыворотки и, редко, ферментов печени. В этих случаях требуется тщательное наблюдение за показателями функции почек и печени. В случае отклонений этих показателей от нормы может потребоваться снижение дозы.
Для контроля концентраций циклоспорина в крови предпочтительно использование специфических моноклональных антител (измерение количества неизмененного препарата). Можно использовать метод ВЭЖХ, при помощи которого также измеряется концентрация неизмененного вещества.
Читайте также:
