Причудливая параоссальная остеохондроматозная пролиферация (опухоль Нора) кисти: атлас фотографий
Добавил пользователь Владимир З. Обновлено: 30.01.2026
Пролиферативная активность клеток отражает интенсивность роста опухолей. В статье приведены данные изучения уровня пролиферации клеток базалиомы — наиболее частой злокачественной опухоли кожи. Исследование проводили иммуногистохимическим методом с маркером пролиферации Ki67. По характеру пролиферации базалиома представляла гетерогенную группу. Солидный, аденоидный, поверхностный мультицентрический тип базалиомы отличались низкой пролиферативной активностью с преимущественным распределением клеток, экспрессирующих Ki67, по периферии комплексов. Высокую пролиферативную активность выявляли в инфильтративном, склерозирующем и микронодулярном типе при равномерном распределении пролиферирующих клеток.
В структуре злокачественных эпителиальных опухолей кожи первое место занимает базалиома, на долю которой приходится от 75 до 94% [1, 2]. В подавляющем большинстве случаев регистрируются солитарные опухоли, локализующиеся на открытых участках кожи, подверженных инсоляции. Опухоль отличается медленным течением и относительно благоприятным прогнозом. Однако в ряде случав она может значительно увеличиваться в размере, характеризуясь выраженным экзофитным ростом, либо приобретать инвазивные черты, проникая в окружающие и подлежащие ткани, приводя к их разрушению. Подобный рост опухоли обычно ассоциируется с определенными морфологическими типами, которые рассматривают как агрессивные [3].
Показателем интенсивности роста ткани является пролиферативная активность клеток. Она относительно спокойна в доброкачественных процессах и резко возрастает в злокачественных опухолях. Аналогичные тенденции присущи и эпителиальным опухолям кожи. Так, пролиферативная активность клеток базальноклеточного рака кожи выше, чем в очагах лейкоплакии [4], а при раке in situ индекс пролиферации превосходит таковой при предраковом актиническом кератозе [4,5]. Плоскоклеточный рак кожи отличается высоким уровнем пролиферации, который следует за снижением степени его дифференцировки [6, 7, 8].
Предыдущие исследования показали, что по характеру пролиферативной активности клеток базалиома представляет гетерогенную группу. Наиболее интенсивный рост имела язвенная форма, тогда как нодулярная и поверхностная характеризовались умеренными и низкими показателями [9]. Высокий уровень пролиферации отмечали в микронодулярном, метатипическом типе базалиомы и типе морфеа [10, 12]. Также отмечали повышение индекса Ki67 в инфильтративном и метатипическом типе по сравнению с нодулярным и поверхностным [11, 13]. В то же время единого мнения о связи уровня пролиферации с гистологическим типом базалиомы до сих пор нет, так как другие исследования свидетельствовали, что индекс Ki67 в нодулярном и поверхностном мультицентрическом типе базальноклеточного рака значительно превосходил аналогичный показатель в склерозированном и типе морфеа [14, 15]. Учитывая противоречивые данные, представляется интересным и актуальным продолжить изучение пролиферативной активности клеток в различных морфологических типах базалиомы, что позволит более детально понимать маркеры и предикторы агрессивного течения опухоли.
Материалы и методы
В работе исследования использовали 36 биоптатов кожи больных базальноклеточным раком кожи. Биопсию кожи размером 0,5 х 0,5 см проводили под местной анестезией 2% раствором новокаина, биоптаты фиксировали в 10% растворе формалина, забуфференом по Лилли при рН-7,4. Материал заливали в парафин по обычной методике. Серийные срезы толщиной 3–5 мкм депарафинировали по стандартной схеме, затем окрашивали гематоксилином и эозином. Иммуногистохимическое исследование проводили в соответствии со стандартным протоколом. Парафиновые срезы наносили на стекла с адгезивным покрытием, депарафинировали по стандартному протоколу. Срезы, погруженные в цитратный буфер, инкубировали в микроволновой печи при мощности 690 Вт два раза по пять минут. Двадцать минут при комнатной температуре, срезы охлаждали, подсушивали и наносили первичные антитела. Для определения уровня пролиферации использовали моноклональные антитела к протеину Ki67 (DAKO), разведение 1:200. Использовались соответствующие позитивные и негативные контроли – иммунные и неиммунные сыворотки. Срезы промывали в буфере, подсушивали, затем на них наносили EnVision (anti-mouse и anti-rabbit, фирмы DAKO, Дания) на 30–40 минут. Для визуализации реакции наносили DAB+ (3, 3 ґ– диаминобензидин), что позволяло получать специфическую коричневую окраску. Затем срезы докрашивали гематоксилином Майера. Определение уровня пролиферации оценивалась с помощью индекса, который вычислялся как среднее от числа меченных ядер на 100 учтенных ядер (при учете 500–1000 опухолевых клеток). Подсчет меченных ядер проводился в репрезентативных полях зрения с относительно равномерным распределением опухолевых клеток, сверху вниз и слева направо. Клетки на периферии срезов, где чаще всего наблюдается фоновое окрашивание, не учитывались.
Для статистической обработки данных использовались методы t-Стьюдента с поправкой для множественных сравнений; хи-квадрат. Расчеты проводились при помощи программы BIOSTAT. Полученные различия считались достоверными при значениях p ? 0,05.
Среди 36 базалиом пять имели поверхностный мультицентрический тип строения, четыре – поверхностный мультицентрический в сочетании с солидным, семь – солидный, два – аденоидный, два – солидно-аденоидный, пять – инфильтративный, три – микронодулярный. В восьми случаях отмечали различные варианты сочетания солидного, инфильтративного, микронодулярного, склерозирующего строения.
Индекс пролиферации Ki67 в поверхностном мультицентрическом типе и при сочетании его с солидным компонентом варьировал от 14,9 до 31,1%. Средний индекс составлял 22,2%. Пролиферирующие клетки в шести случаях располагались преимущественно по периферии клеточных комплексов, в трех – равномерно по клеточным комплексам. При солидных опухолях средний индекс составил 26,5%, он варьировал от 14,5 до 38,2% (рис.1). Периферическое распределение наблюдали в четырех случаях, равномерное – в трех. При аденоидном строении пролиферирующие клетки распределялись равномерно, индекс пролиферации составлял 22,6 и 31,3%. В случаях, когда имелось сочетание солидного и аденоидного компонентов, индекс пролиферации составлял 36,8 и 19,2%, В первом случае клетки распределялись равномерно, во втором – равномерно в аденоидном компоненте и по периферии – в солидном. В опухолях инфильтративного, микронодулярного строения и при их сочетании клетки, экспрессирующие маркер Ki67, диффузно регистрировались по всем клеточным комплексам. В инфильтративном типе минимальное и максимальное значение индекса было 27,6 и 47,8% (среднее значение – 35,4%) (рис.2). Микронодулярные базалиомы имели средний индекс Ki67 26,9%. В случаях инфильтративно-склерозирующего строения индекс имел значение 40,2 и 31,6%, пролиферирующие клетки равномерно распределялись в комплексах (рис.3). При сочетании инфильтративного, солидного и микронодулярного строения преимущественно отмечали равномерное распределение пролиферирующих клеток, и средний индекс составлял 36,5% (значения варьировали от 22,1 до 50,4%). Солидное строение в сочетании с инфильтративным склерозирующим имели опухли с индексом Ki67 26,7 и 35,3%, в солидном компоненте пролиферирующие клетки располагались преимущественно по периферии комплексов, инфильтративном склерозирующем – равномерно.
При анализе пролиферативной активности клеток мы сгруппировали опухоли в зависимости от характера течения и роста. В группу неинвазивного роста мы включили опухоли, имеющие поверхностный мультицентрический, солидный, аденоидный, сочетание поверхностного мультицентрического и солидного компонентов. В группу с инвазивным ростом нами были включены опухоли инфильтративные, микронодулярные, инфильтративно склерозирующие, а также опухоли сложного строения (инфильтративный + микронодулярный + солидный и солидый + инфильтративный склерозирующий).
Средний индекс пролиферации неагрессивных типов составил 24,77 ± 7, 47 с доверительным интервалом 95% 21,27–28,26 (табл. 1). Средний индекс Ki67 агрессивных типов составлял 33,53 ± 8,94 с доверительным интервалом 95% 28,77–38,29 (табл. 1). Различия в уровне пролиферации между агрессивными и неагрессивными типами носили статистически значимый характер (р = 0,003). Анализ характера распределения пролиферирующих клеток в опухолевых комплексах показал, что в неагрессивных типах периферическое распределение клеток наблюдалось в 50% случаев, равномерное – в 45%, в 5% случаев ряд комплексов в опухоли имели один тип распределения, другие комплексы – иной тип распределения (табл.2). В агрессивных типах 81,25% случаев имели равномерное распределение пролиферирующих клеток, сочетание двух типов распределения – 18,75% (табл. 2). Периферическое распределение пролиферирующих клеток в агрессивных типах не встречалось. При сравнении распределения клеток между агрессивными и неагрессивными типами опухоли было показано, что различия носят статистически достоверный характер (р = 0,003).
Таблица 1. Индекс пролиферации Ki67 в агрессивных и неагрессивных морфологических типах базалиомы
Саркомы мягких тканей
Понятие «саркомы мягких тканей» объединяет большое количество новообразований, различных по клиническим и морфологическим признакам. В связи с небольшим числом случаев заболеваний, разнообразием гистологических вариантов и локализацией сарком мягких тканей, определяющих биологическое поведение, клиническое течение и особенности лечения, все пациенты с данным заболеванием должны концентрироваться в отделении, занимающимся лечением сарком.
Что такое саркомы?
Саркомы мягких тканей – это злокачественные новообразования, которые возникают из мягких тканей. Они объединяются в одну группу ввиду сходства их гистопатологических характеристик и клинических проявлений, а также течения опухолевого процесса. Часто рецидивируют с ранним появлением гематогенных метастазов.
Статистика
0,2–2,6% — занимают в структуре онкозаболеваний злокачественные опухоли мягких тканей.
Локализация, % от всех случаев
Конечности — до 60%, в том числе руки — 46%, 13% – ноги.
Голова и шея — 5-10%
Забрюшинное пространство – 13-25%.
Классификация
Выделяют опухоли и опухолеподобные образования следующих тканей и структур:
- фиброзной
- жировой
- мышечной
- лимфоидной
- синовиальной
- мезотелия
- кровеносных сосудов
- плюрипотентной мезенхимы
- эмбриональных структур.
Кроме этого рассматривают опухоли экстрагонадного зародышевого происхождения, опухоли неясного гистогенеза и неопухолевые или сомнительные опухолевые поражения.
Этиология и патогенез
Причины появления сарком мягких тканей не выявлены. Факторы, повышающие риск развития этой патологии:
- Болезнь Педжета (деформирующий остоз);
- Болезнь Рекленгхаузена (нейрофиброматоз);
- Синдром Гарднера (диффузный полипоз толстой кишки);
- Синдром Вернера (множественный эндокринный аденомтаоз);
- Прием анаболических стероидов.
Клиническое течение злокачественных опухолей мягких тканей характеризуется вариабельностью.
К общим признакам сарком мягких тканей относят частые местные рецидивы. Почему саркомы часто рецидивируют? Это объясняют следующими причинами:
- Отсутствие истинной капсулы;
- Склонность к инфильтративному росту;
- Мультицентричный рост.
Клинические симптомы сарком мягких тканей
Симптомы зависят от локализации опухоли. Чаще всего больные обращаются к врачу, обнаружив у себя безболезненную опухоль.
Выраженный болевой синдром наблюдается при поражении надкостницы и кортикального слоя кости, а также при сдавлении опухолью нервных стволов. Присоединение неврологической симптоматики и сосудистых расстройств возможно при сдавлении или прорастании опухолью магистральных сосудов и нервов.
Диагностика сарком мягких тканей
Диагностические исследования включают в себя:
— Осмотр опытного специалиста, врача-онколога; На фото можно увидеть, как выглядит саркома мягких тканей:
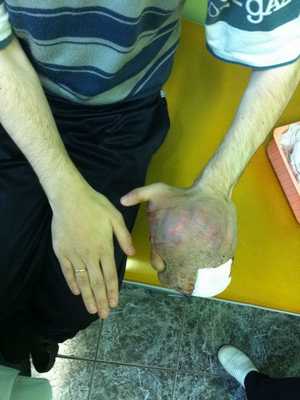
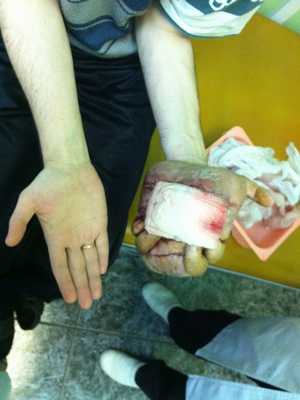
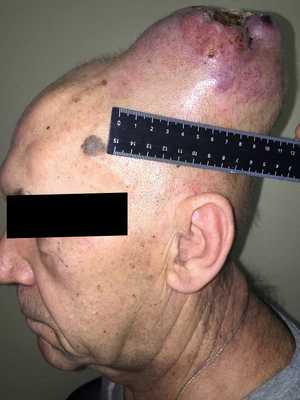
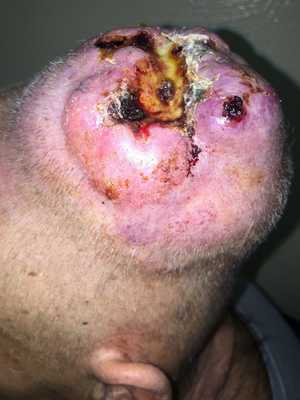
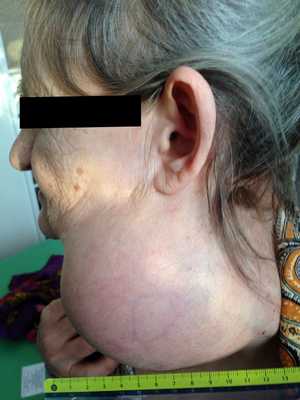
— Рентгенологическое исследование. Позволяет визуализировать тень опухоли, деформацию прилежащих к опухоли фасциальных перемычек, выявить изменения в костях;
— УЗИ опухолей мягких тканей. Это метод диагностики как первичного очага, так и поражения региональных зон. Позволяет определить границы опухоли, связь с окружающими органами, структуру опухоли;
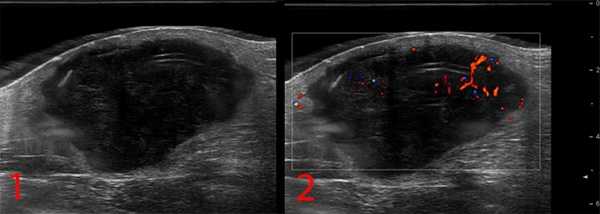
Рисунок №1. Саркома мягких тканей бедра. УЗ-картина в серошкальном и сосудистом режимах визуализации
— КТ первичной опухоли, органов грудной клетки и брюшной полости;
— МРТ первичной опухоли
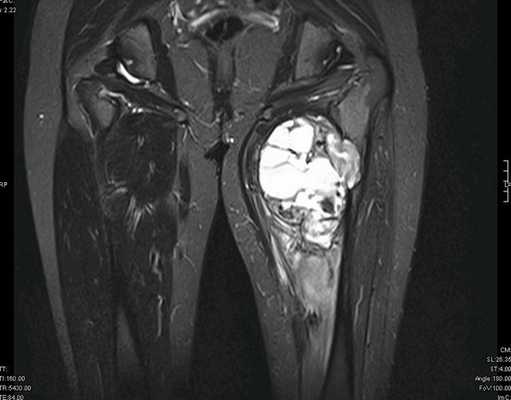
Рисунок №2. Саркома мягких тканей верхней трети левого бедра
— Морфологическая верификация (пункционная биопсия, трепан-биопсия) является самым важным методом диагностики.
После получения результатов осмотра, лабораторной и инструментальной диагностики врач-онколог определяет тактику ведения пациента, согласно современным рекомендациям.
Общие принципы лечения сарком мягких тканей
Лечение сарком мягких тканей должно быть многокомпонентным. Для определения тактики лечения пациента собирается консилиум врачей.
Основной метод:
Дополнительные методы:
Предоперационная лучевая терапия в комбинации с хирургическим лечением позволяет снизить количество рецидивов за счет снижения злокачественного потенциала опухоли и уменьшение ее объема.
Применяется интраоперационная лучевая терапия, т.е. облучение опухоли во время операции с целью подавления субклинических очагов и наращивания лучевой дозы.
В комбинации с хирургическим лечением также применяется химиотерапия. Была отмечена тенденция к улучшению показателей выживаемости, однако данный метод не считается стандартом в лечении сарком мягких тканей.
Лечение после операции
Послеоперационная лучевая терапия выполняется с целью предупреждения развития рецидивов и диссеминирования заболевания.
Химиотерапия является основным методом лечения диссеминированного процесса при мягкотканых саркомах.
Саркома мягких тканей — прогноз выживаемости
Прогностические факторы тесно связаны со стадией болезни, радикализмом операции и морфологическим типом опухоли.
Процент выживаемости при саркомах мягких тканей зависит от размера опухоли, глубины поражения, степени злокачественности. Также очень важен такой фактор, как ответ опухоли на специальное лечение.

Авторская публикация:
ГАФТОН ИВАН ГЕОРГИЕВИЧ
врач-онколог
НИИ онкологии им Н.Н. Петрова
Что вам необходимо сделать
Если вы хотите узнать побольше о бесплатных возможностях ФБГУ НМИЦ онкологии им. Н.Н. Петрова Минздрава России, получить очную или заочную консультацию по диагностике и лечению, записаться на приём, ознакомьтесь с информацией на официальном сайте.
Если вы хотите общаться с нами через социальные сети, обратите внимание на аккаунты в ВКонтакте и Одноклассники.
Если вам понравилась статья:
- оставьте комментарий ниже;
- поделитесь в социальных сетях через удобные кнопки:
Публикации по теме:
Методами терапии детей и подростков с мягкотканными саркомами и редкими опухолями мягких тканей являются операция ?, лучевая терапия ?, химиотерапия ?, либо комбинация этих видов лечения.
Набор методов лечения в том или ином случае зависит от анамнеза пациента и его особенностей, тактика лечения определяется лечащим врачом или консилиумом и является индивидуальной.
Псевдолимфомы кожи
Псевдолимфомы кожи – группа доброкачественных реактивных дерматозов, характеризующихся гиперплазией лимфоидной ткани. Особенностью патологического процесса является локализация первичных элементов (эритем, узелков, бляшек) на лице, при некоторых видах псевдолимфомы может наблюдаться диссеминация высыпаний. Постановка диагноза осуществляется клинически с учётом анамнеза патологии (провоцирующих факторов), результатов гистологии, ПЦР-диагностики и иммуногистохимического тестирования. Лечение включает детоксикационную терапию, антигистаминные средства, кортикостероиды, энтеросорбенты и физиотерапию.
Общие сведения
Псевдолимфомы кожи – совокупность пролиферативных процессов лимфоидной ткани доброкачественного характера, способных к разрешению после курса базовой терапии или удаления провоцирующего агента. Патологический процесс встречается на всех географических широтах, не имеет расовых и сезонных различий. Впервые термин псевдолимфома был введён в дерматологическую практику в 1891 году М. Капоши. В 70-х годах прошлого столетия на основании иммуногистохимических методов исследования псевдолимфомы удалось разделить на две группы: Т-клеточные и В-клеточные – в зависимости от типа доминирующих в лимфоидном инфильтрате клеток. В-клеточные псевдолимфомы кожи чаще диагностируются у детей и подростков, Т-клеточные – у взрослых мужчин.
Современные дерматологи признают термин псевдолимфомы условно. Многие практикующие врачи считают более верным предложенный Г. Вудом термин клональный дерматит, в основу которого положено выявление клона лимфоцитов, преобладающих в развитии патологического процесса. Актуальность проблемы обусловлена возможностью озлокачествления псевдолимфом, необходимостью их точной и своевременной диагностики из-за преимущественной локализации на лице, а также снижения качества жизни пациента из-за возникающего эстетического дефекта.
Причины псевдолимфом кожи
Причин развития псевдолимфом несколько, одни из них известны, как, например, укус иксодового клеща при В-клеточных псевдолимфомах, другие установлены предположительно, как например, инфекция, свет, аутоиммунные процессы и аллергия при Т-клеточных псевдолимфомах. Общим является реактивный ответ кожи в виде усиления лимфопролиферативных процессов.
Механизм развития патологии зависит от разновидности псевдолимфомы. В случае В-клеточных псевдолимфом активная пролиферация связана с изменением клеточного метаболизма. Важнейшим моментом является насыщение клетки кислородом. Для нормальной работы иммунной системы лимфоидным клеткам необходимо достаточное количество энергии, чтобы вырабатывать В-лимфоциты, стимулировать защитные механизмы и восстанавливать нарушенную целостность дермы. В случае псевдолимфомы повышенная потребность лимфоидной ткани во внутриклеточном кислороде не удовлетворяется, поскольку значительную часть кислорода получают В-лимфоциты, нейтрализующие антиген-триггер.
Кроме того, нормальное кислородоснабжение необходимо клеткам дермы, участвующим в восстановлении кожных покровов. В результате перераспределения кислорода у Т- и В-лимфоцитов, призванных вместе с клетками ретикулоэндотелиальной системы восстановить дефект кожи, наступает гипоксия, провоцирующая усиленное компенсаторное деление клеток. В процесс включаются фибробласты, клетки гистиоцитарного ряда и плазмоциты, которые при исследовании выявляются в лимфоцитарном инфильтрате.
В случае Т-клеточных псевдолимфом механизм развития лимфопролиферативных процессов несколько отличается, ведущая роль в нём отводится нарушению дифференцировки Т-лимфоцитов на фоне системных аутоиммунных заболеваний. Измененные Т-лимфоциты провоцируют усиленную пролиферацию клеток дермы, которые в результате антигенного повреждения начинают выработку биологически активных веществ, стимулирующих воспаление и активизирующих пролиферацию Т-клеток. В обоих случаях (как при Т-, так и при В-клеточных псевдолимфомах) образуется доброкачественный лимфопролиферативный инфильтрат.
Классификация псевдолимфом кожи
Единой классификации патологического процесса не существует. Рабочей классификацией в современной дерматологии принято считать разделение псевдолимфом по клеточному составу. Выделяют В-клеточные и Т-клеточные псевдолимфомы, состоящие преимущественно из В-лимфоцитов и Т-лимфоцитов.
Наиболее распространенной В-клеточной псевдолимфомой является доброкачественная лимфоплазия кожи (ДЛК, лимфоцитома, лимфаденоз доброкачественный Бефверстедта, псевдолимфома Шпиглера-Фендта), возникающая под влиянием экзогенных факторов. Первичным элементом является спонтанно регрессирующий и вновь появляющийся бурый тестообразный узелок с чёткими границами, локализующийся на лице, ушных раковинах и в подмышечных впадинах. Различают:
- Постборрелиозную разновидность В-клеточной ДЛК – формируется во второй стадии боррелиоза, проявляется папулами и бляшками.
- Постскабиозную разновидность В-клеточной ДЛК (персистирующая узловая реакция на укусы насекомых, постскабиозная лимфоплазия кожи) – персистирующую псевдолимфому, зудящий дерматоз, первичным элементом которого являются папулы, локализующиеся в области половых органов, в подмышечных впадинах, на ягодицах и локтях.
Выделяют следующие разновидности Т-клеточных псевдолимфом:
- Лимфоцитарная инфильтрация Джесснера-Канофа – хронический доброкачественный патологический процесс, первичным элементом которого является плоская розово-синюшная бляшка, локализующаяся на лице.
- Истинная псевдолимфома (ретикулярная гиперплазия, реактивный ретикулёз, синдром псевдолимфомы, эритродермия псевдолимфоматозная) – доброкачественный патологический процесс, возникающий в ответ на действие лекарственных средств, бензина, ароматических масел и некоторых пищевых продуктов. Псевдолимфома склонна к спонтанному разрешению, ее отличительная черта – способность быть маркером латентного опухолевого процесса в организме. Клинически всегда сопровождается продромальными явлениями, первичным элементом является сливная эритема.
- Лимфоматоидный папулёз – доброкачественная медленно растущая узелковая опухоль кожи, первичным элементом является бурое пятно без излюбленной локализации.
- Актинический ретикулоид – редкий хронический фотодерматоз, гистологически напоминающий грибовидный микоз. Первичным элементом является эритема, возникающая под действием световых лучей и трансформирующаяся в эритродермию.
Симптомы псевдолимфом кожи
Клинические проявления Т-клеточных и В-клеточных псевдолимфом разнятся. В-клеточные псевдолимфомы чаще поражают детей и подростков, сопровождаются реактивным высыпанием мелкоузелковых или бляшечных розовато-фиолетовых элементов с четкими границами (одиночных или множественных), способных формировать более крупные инфильтраты. Локализация – лицо, шея, ушные раковины, подмышечные впадины, вокруг сосков молочной железы, на мошонке. Субъективное состояние пациентов не нарушено, в процесс часто вовлекаются регионарные лимфоузлы.
Т-клеточные псевдолимфомы встречаются у взрослых мужчин в виде спонтанного высыпания на лице, туловище и конечностях. Представляют собой синюшные папулы, растущие по периферии, образующие очаги инфильтративного поражения с регрессом в центральной части и самостоятельным разрешением. С течением времени процесс возобновляется на тех же участках кожного покрова или на неповреждённой коже.
Диагностика и лечение псевдолимфом кожи
Диагностика псевдолимфомы с неустановленной причиной возникновения представляет собой достаточно сложную задачу. Необходимо исключить злокачественный процесс, поэтому наряду с клиническими и анамнестическими данными используют результаты гистологического исследования. Обязательно проводят ПЦР-диагностику, иммуногистохимическое тестирование (выражена экспрессия иммуноглобулиновых лёгких цепей лямбда и каппа) и Саузерн-блот-анализ, позволяющий выявлять дефектные гены.
В-клеточные псевдолимфомы дифференцируют с иммуноцитомой, лимфосаркомой, В-лимфомой, лимфомой MALT-типа, саркоидозом, туберкулёзной волчанкой и эозинофильной гранулёмой лица. Дифференциальную диагностику Т-клеточных псевдолимфом проводят с токсикодермией, красной волчанкой, другими вариантами псевдолимфом, лимфомами кожи, каплевидным псориазом, папулонекротическим ангиитом, папулонекротическим туберкулёзом, грибовидным микозом, синдромом Сезари, фотодерматозами и узловатой почесухой.
Терапию осуществляет дерматолог, при необходимости к лечению подключают онколога и косметолога. Приоритет отдают детоксикационной терапии (гемодез, плазмаферез, гемосорбция). Используют кортикостероиды внутрь и наружно, назначают энтеросорбенты, антигистаминные препараты, аминохинолины, цитостатики и нестероидные противовоспалительные средства. В локальные очаги вводят глюкокортикоиды путем инъекций. Применяют ПУВА-терапию. Прогноз относительно благоприятный, необходимо регулярное наблюдение у дерматолога.
Базалиома – базальноклеточный рак
Базальноклеточная карцинома — это наиболее распространенная форма рака кожи среди жителей России. По различным статистическим сведениям на ее долю приходится до 75% всех эпителиальных немеланомных новообразований кожи.
Чаще всего базалиома кожи имеет наружную локализацию, в частности — область лица и волосистой части головы, что обусловлено рядом факторов, способствующих ее развитию.
На первом месте среди них выступает повреждающее действие инсоляции на открытые участки тела. В зоне риска оказываются любители позагорать в солярии.
При наличии генетической предрасположенности — светлой коже с многочисленными родинками — солнечное облучение является травмирующим фактором, который провоцирует клетки на самообновление. Частое повреждение клеток вызывает потерю контроля организма над процессами восстановления, что в свою очередь является начальным этапом онкопроцесса.
Кожные инфекции, хронические дерматозы, иммунодефицит различного происхождения также способствуют развитию базалиом.
Особенностью данного заболевания является редкая частота метастазирования, но при этом инвазивный рост с разрушением окружающих тканей определяет агрессивность течения.
Базалиома — начальная стадия
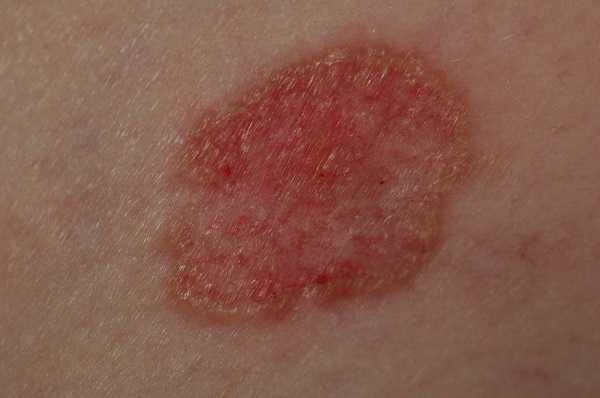
Для начальной стадии базалиомы характерна разнообразная клиническая картина. Различают следующие формы базально-клеточного рака кожи (виды):
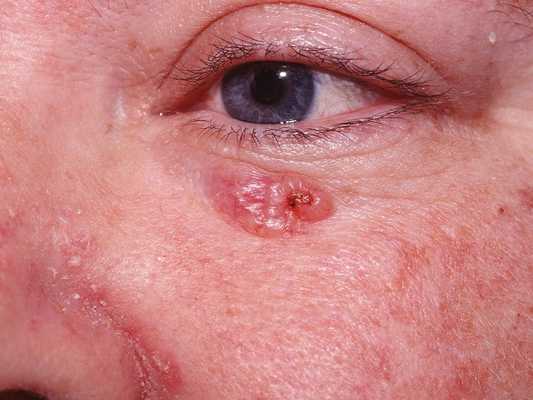
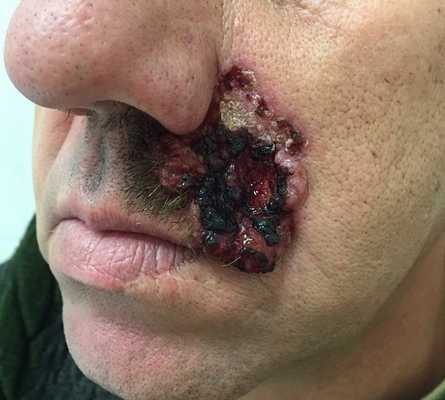
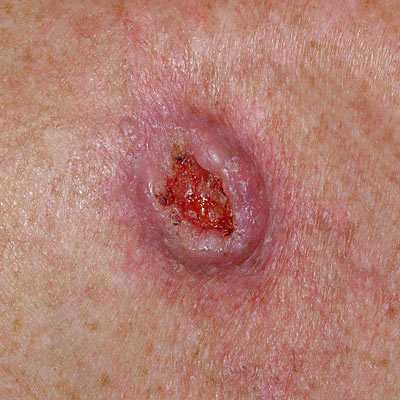
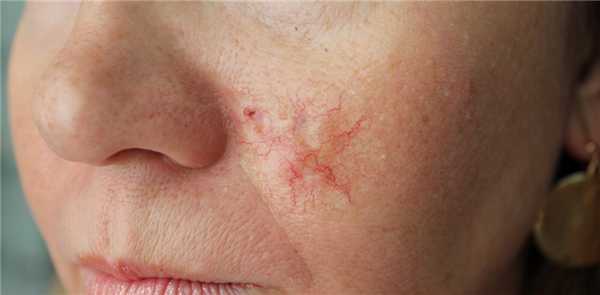
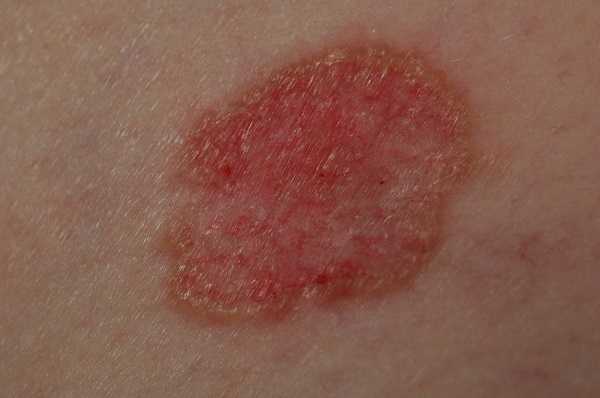
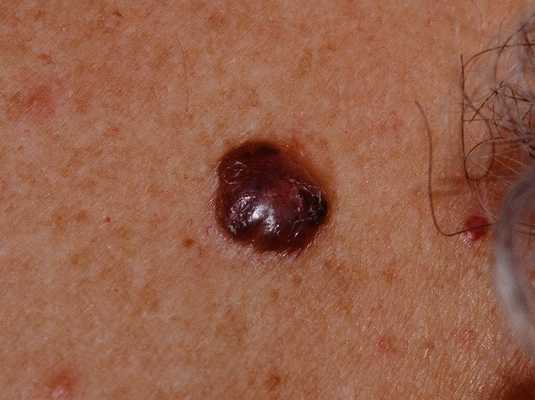
Несмотря на наличие кожного дефекта, пациенты с начальной стадией опухоли базалиомы из-за боязни услышать страшный диагноз «онкология» надолго откладывают свой визит к врачу. Именно от того, насколько своевременно начнется лечение заболевания рак кожи, зависит прогноз выживаемости и продолжительность жизни пациента с базалиомой.
Часто злокачественные опухоли кожи, в том числе базалиома, появляются на месте существующей на коже родинки, которая много лет никак не беспокоила человека. Если родинка была травмирована и изменилась, следует обраться к дерматологу. Бывает, что родинки начинают меняться без каких-то видимых причин: расти, терять волосяной покров, изменять цвет, зудеть и т.п.
К настораживающим симптомам также следует отнести язвы в области кожи и слизистой рта. Они могут привести к злокачественной опухоли в области рта или на слизистой оболочке губ.
Как выглядит базалиома до и после лечения можно увидеть на фото:
До
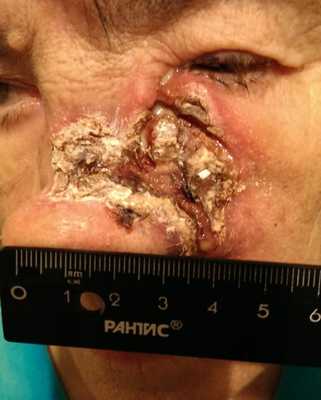
После
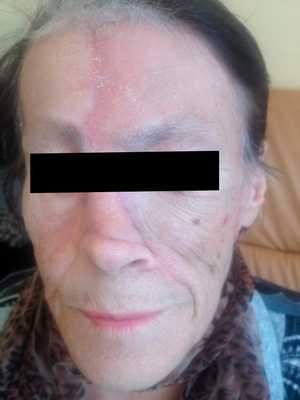
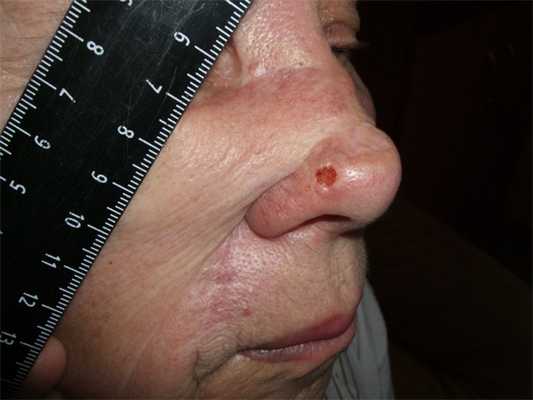
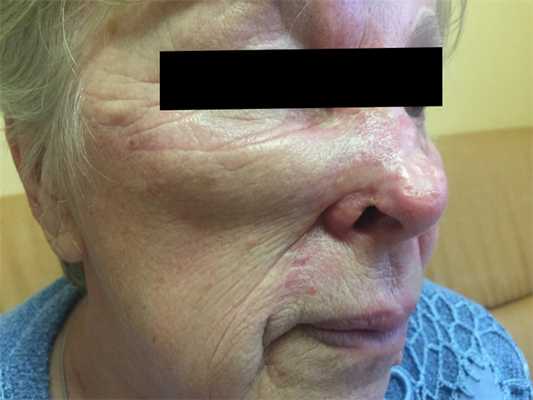
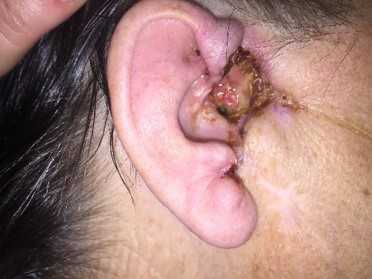
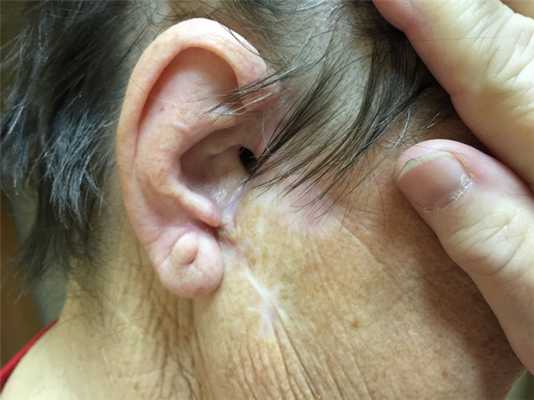
Базалиома – диагностика
После осмотра, проведенного врачом-дерматологом с помощью специального прибора — дерматоскопа, может быть заподозрена злокачественная природа опухоли.
Постановка диагноза — базальноклеточная карцинома — возможна только после морфологической верификации. На первом этапе это цитологическое исследование соскоба с поверхности новообразования на наличие атипичных клеток. Безусловным диагностическим мероприятием является биопсия, позволяющая сделать гистологическое заключение с учетом структуры ткани.
Методы лечения базалиомы кожи
Современная медицина владеет достаточно широким спектром лечебных пособий по борьбе с наиболее распространенной формой рака кожи. Тактика ведения пациента подразумевает грамотный выбор способа лечения. На сегодняшний день существуют следующие методики:
- хирургическое иссечение
- близкофокусная рентгенотерапия
- фотодинамическая терапия
- лазерная терапия
- криотерапия
- медикаментозная терапия.
В отделении опухолей головы и шеи НИИ онкологии им. Н.Н. Петрова пациентам с базалиомой кожи лица успешно делают реконструктивно-пластические операции. Выполняется и криодеструкцию базалиом под УЗ-контролем.
Криодеструкция актуальна для:
- поверхностных поражений;
- опухолей с локализацией в сложных анатомических зонах области лица;
- ослабленных пациентов с тяжелой сопутствующей патологией;
- соблюдения косметических требований.
Разные виды криодеструкции – струйная, аппликационная, пункционная – позволяют максимально индивидуализировать лечение. Накопленный опыт отделения позволяет судить об очень низком проценте рецидивов заболевания. Процедура криодеструкции заключается в местной анестезии, взятии биопсийного материала и троекратном холодовом воздействии сверхнизкой температуры с последующим оттаиванием.
Продолжительность каждого воздействия определяется распространенностью опухолевого процесса и глубиной инвазии. На месте зоны раневого дефекта формируется крионекроз, заживление происходит под струпом. Данная методика относится к хирургическим вмешательствам, поэтому подготовка к ней и послеоперационный период требуют контроля со стороны врача и ответственного выполнения всех предписаний пациентом. По окончанию периода заживления на месте криовоздействия остается эластичная рубцовая ткань удовлетворительных косметических свойств.
Продолжаются разработки новых методов лечения. Одним из достижений молекулярной онкологии является расшифровка мутаций генов Hedgehog-сигналинга, наблюдаемых в большинстве случаев базальноклеточной карциномы. Данное открытие дало толчок по внедрению в клиническую практику новых таргетных препаратов для системного лечения, что особенно актуально для пациентов с метастазами.
Таким образом, онконастороженность, профилактические меры, своевременное обращение пациентов за медицинской помощью, качественная диагностика и грамотный подход к лечению в совокупности могут обеспечить радикальный контроль над базальноклеточным раком кожи.


Авторская публикация:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Гигантоклеточная опухоль кости ( Остеобластокластома , Остеокластома )
Гигантоклеточная опухоль кости – это доброкачественное, реже злокачественное новообразование, состоящее из мононуклеарных и гигантских многоядерных клеток, напоминающих остеокласты. Чаще локализуется в метафизах длинных трубчатых костей. Протекает бессимптомно или проявляется болями, припухлостью, локальной гипертермией, ограничением движений. Диагностика базируется на данных опроса, объективного осмотра, рентгенографии, компьютерной томографии, других аппаратных методик, цитологического и гистологического исследования. Лечение – хирургическое вмешательство, лучевая терапия.
МКБ-10
Гигантоклеточная опухоль кости (ГКО, остеобластокластома, остеокластома) – неоплазия с двумя клиническими вариантами течения. Данные о распространенности существенно разнятся – от 4 до 25% от общего количества опухолевых поражений скелета. Доля злокачественного варианта составляет 5-10%. 80% пациентов находятся в возрастной категории 20-50 лет, пик заболеваемости приходится на третье десятилетие жизни. Женщины страдают несколько чаще мужчин. В 50-65% случаев поражается область коленного сустава (дистальная часть бедра или проксимальная часть голени).
Причины
Этиология гигантоклеточных опухолей окончательно не выяснена. Специалисты придерживаются общей для всех новообразований концепции Петерсона, согласно которой неоплазии являются полиэтиологическим заболеванием, возникают при сочетании внешних и внутренних неблагоприятных влияний. К экзогенным факторам риска относят вредные биологические (вирусные), химические, лучевые воздействия. Эндогенными факторами считаются обменные расстройства, нарушения гормонального баланса, снижение реактивности организма.
Патанатомия
В 89% ГКО формируется в длинных трубчатых костях. Нижние конечности поражаются двое чаще верхних. Первое место по распространенности занимает дистальный метафиз бедра, второе – проксимальная часть большеберцовой либо малоберцовой кости, третье – периферические отделы луча, четвертое – дистальная часть большеберцовой кости. Позвонки, мелкие и плоские кости страдают редко.
Характерны одиночные очаги, в литературе также описываются отдельные двойные локализации, чаще расположенные близко друг к другу в сочленяющихся костях. Гигантоклеточная опухоль находится в метафизе, иногда растет в сторону диафиза. Первично диафизарное расположение выявляется крайне редко. Одноядерные клетки новообразования имеют сходство с остеобластами, гигантские многоядерные – с остеокластами. В ткани неоплазии выявляются костные балочки, включения остеоида.
Доброкачественные опухоли имеют типичное строение. При озлокачествлении возможны три варианта. Первый – остеокластома метастазирует, сохраняя стандартную структуру (которая, выявляется, в том числе, в отдаленных очагах). Второй – первично злокачественная ГКО, которая отличается от доброкачественной наличием атипии и митозов преимущественно в одноядерных клетках. Третий – трансформация первично доброкачественной остеобластокластомы в различные виды сарком: остеогенную, веретеноклеточную, фибросаркому.
Симптомы
У большинства пациентов на начальной стадии единственным проявлением доброкачественной (типичной) гигантоклеточной опухоли является боль в зоне поражения. Иногда прослеживается связь между болевым синдромом и предшествующим травматическим повреждением. Симптом выражен умеренно, эпизодически беспокоит при движениях, имеет ноющий либо тянущий характер. Реже болезненности сопутствует появление опухолевидного образования, еще реже припухлость возникает без болевых ощущений.
У взрослых ГКО крайне редко манифестирует патологическим переломом. В то же время, у детей доля этого признака составляет более 50%. Все проявления, кроме патологического перелома, не доставляют особого беспокойства, поэтому больные впервые обращаются к врачу через 8 и более месяцев после дебюта заболевания, на стадии формирования развернутой клинической картины. На этом этапе боли выявляются у всех пациентов, нарастают при физической нагрузке, сохраняются в покое, зачастую беспокоят постоянно, усиливаются по ночам.
Пальпируемая неоплазия обнаруживается в 70-75% случаев. У остальных больных отмечается локальный отек мягких тканей. Частым симптомом в этом периоде становится ограничение подвижности в близлежащем суставе. Проявление, как правило, связано с усилением боли во время движений. Иногда отмечаются постепенно формирующиеся контрактуры, напрямую не связанные с болевым синдромом. У некоторых пациентов определяется выпот.
Злокачественная гигантоклеточная опухоль проявляется аналогичными признаками. Основными отличиями считаются незначительная продолжительность периода первичной симптоматики, быстрое прогрессирование, более высокая интенсивность болезненных ощущений. Новообразование, в среднем, начинает прощупываться через 4 месяца, развернутая клиническая картина выявляется спустя полгода с момента появления первых симптомов остеобластокластомы. Метастазы в легкие, другие кости, мягкие ткани обнаруживаются редко.
Диагностика
Первичные диагностические мероприятия осуществляются травматологами-ортопедами, в дальнейшем пациентов направляют к специалистам в области остеоонкологии. Характер патологии определяют на основании жалоб, данных физикального обследования, дополнительных исследований. В ходе внешнего осмотра выявляют опухолевидное образование костной плотности, отек и гиперемию, оценивают объем движений. Для уточнения вида новообразования применяют следующие методы:
- Рентгенография кости. На снимках визуализируется кистообразные изменения или неоплазия в виде «мыльных пузырей» в метафизарной зоне. Признаки общего остеопороза отсутствуют, вокруг измененного участка может просматриваться остеосклероз. Границы доброкачественной ГКО более четкие, но из-за местно-агрессивного роста при значительном размере возможно появление «костного козырька». Выраженная периостальная реакция нехарактерна. Злокачественная остеокластома имеет нечеткую структуру. На снимках рано обнаруживается разрушение кортикального слоя.
- КТ и МРТ кости. Компьютерная томография дает более четкое представление о форме, размерах, границах гигантоклеточной опухоли, в сомнительных случаях позволяет подтвердить или опровергнуть разрыв коркового слоя. В ходе магнитно-резонансной томографии исследуют интрамедуллярный и кистозный компоненты, оценивают состояние окружающих мягких тканей, расположение сосудов и нервов. Методики помогают выбрать оптимальный вариант хирургического вмешательства, спланировать операцию.
- Другие аппаратные исследования. При злокачественном процессе назначают сцинтиграфию костей скелета или ПЭТ-КТ. Благодаря накоплению остеотропных фармпрепаратов, методы хорошо визуализируют новообразование, выявляют вторичные костные очаги. Ангиография при злокачественном течении свидетельствует о формировании беспорядочной сосудистой сети с артериями неравномерного диаметра. Рентгенография легких показана при подозрении на метастазирование.
- Морфологические исследования. Верификацию гигантоклеточной опухоли осуществляют путем цитологического или гистологического анализа. Материал получают методом аспирационной биопсии или трепанобиопсии. Вероятность точного определения вида и степени дифференцировки неоплазии составляет 80-90%, сложности чаще возникают при рецидивах. При недостаточной информативности выполняют повторный забор ткани методом открытой биопсии.
- Другие лабораторные анализы. Результаты тестов неспецифичны, но способствуют дифференцировке доброкачественных и злокачественных ГКО. В первом случае изменения отсутствуют, во втором в крови выявляются ускорение СОЭ, лейкоцитоз, снижение железа и белка, увеличение уровня щелочной фосфатазы, фосфора, кальция. В моче обнаруживаются гексокиназа, оксипролин.
Различение проводят с аневризмальной костной кистой (чаще – солидным вариантом), центральной гигантоклеточной гранулемой, хондробластомой. Также требуется дифференциальная диагностика с неоссифицирующей фибромой и остеосаркомой.
Лечение гигантоклеточной опухоли кости
Основной метод лечения ГКО – хирургическое вмешательство. Объем операции выбирают с учетом размеров и распространенности неоплазии. В случаях «неудобного» расположения (в позвонках, плоских костях) или незначительного поражения трубчатых костей осуществляют экскохлеацию. Новообразования среднего размера удаляют методом краевой резекции. При вовлечении половины и более диаметра либо центральном расположении прибегают к сегментарной резекции. По показаниям применяют костно-пластические методики для замещения образовавшегося дефекта. Ампутации требуются редко.
При ограниченных легочных метастазах производят парциальную резекцию легких. Лучевая терапия показана при труднодоступных неоплазиях, прежде всего – расположенных в верхних отделах крестца. Метод также используется при отказе от операции, наличии тяжелой соматической патологии. В рамках комбинированного лечения рекомендован в пред- и послеоперационном периоде. Чаще всего проводится дистанционная гамма-терапия.
Прогноз
Прогноз доброкачественной гигантоклеточной опухоли кости достаточно благоприятный – после радикального иссечения с соблюдением принципов абластичности в большинстве случаев наступает выздоровление. Частота рецидивирования напрямую зависит от выбранного оперативного метода, составляет 46% после экскохлеации, 30% после краевой резекции и 6,6% после радикальной резекции. При злокачественном характере патологического процесса пятилетняя выживаемость составляет 35%, через 10 лет в живых остается 18% больных.
1. Первичные опухоли костей и костные метастазы. Диагностика и принципы лечения. Учебное пособие/ Маланин Д.А., Черезов Л.Л. – 2007.
2. Дифференциальная диагностика гигантоклеточных опухолей у детей. Автореферат диссертации/ Рогожин Д.В. – 2018.
Читайте также:
- Рентгенограмма, КТ, МРТ при вторичной остеосаркоме
- Кортикостероиды при сердечной недостаточности. Гормональные причины гипертрофии миокарда
- Лучевая диагностика проводника зуба
- Борозды и шероховатости ногтей при системных болезнях
- Рефлекторные ушные шумы. Ушные шумы при сенсебилизации слухового нерва
