Приращение плаценты
Добавил пользователь Владимир З. Обновлено: 29.01.2026
Цель. Изучить современные возможности диагностики и прогнозирования, а также наиболее эффективные методы органосохраняющего лечения при врастании плаценты по данным отечественной и зарубежной литературы.
Материалы и методы. По ключевым словам «плацента», «врастание плаценты», «PAS», «органосохраняющее лечение», «accreta», «increta», «percreta» проведен поиск литературных источников в отечественных и зарубежных базах данных: elibrary, Medline/PubMed, Embase, CINAHL. Отобрано 40 источников.
Результаты. Ученые-первооткрыватели Irving и Hertig определили термин «врастание плаценты» как «аномальное частичное или полное прикрепление последа к стенке матки». В настоящее время выделяют несколько степеней врастания плаценты (placenta accretа spectrum [PAS]): 1 степень (placenta adherenta or creta) – плотное прикрепление или приращение плаценты к мышечному слою; 2 степень (placenta increta) – когда ворсины прорастают мышечный слой; 3 степень (placenta percreta) – когда плацента прорастает все слои матки. Клинически аномальное прикрепление плаценты проявляется в ее неспособности отделиться от стенки матки (как это происходит в норме). К наиболее значимым факторам риска развития указанной патологии относят: предшествующие оперативные вмешательства на матке, предлежание плаценты и PAS в анамнезе. Для диагностики с равной эффективностью используют ультразвуковой метод (УЗИ) и метод магнитно-резонансной томографии (МРТ). С целью хирургического лечения предпочтение отдается органосохраняющим методам, позволяющим сохранить не только жизнь матери, но и ее репродуктивную функцию.
Заключение. Врастание плаценты – опасное осложнение беременности, приводящее к массивной кровопотере, высокой материнской заболеваемости и смертности. К настоящему моменту проведено значительное количество исследований с целью изучения данной проблемы и выработки эффективной тактики ведения подобных пациенток. Определены особенности терминологии, эпидемиологии, возможные факторы риска, молекулярные маркеры и атрибуты патогенеза указанной нозологии. Подробно описаны наиболее эффективные методы органосохраняющего лечения при врастании плаценты.
Терминология
Термин «врастание плаценты» известен миру с 1937 г., когда впервые ученые Irving и Hertig определили его как «аномальное частичное или полное прикрепление последа к стенке матки» [1]. С указанного момента проведено значительное количество исследований с целью изучения данной патологии и выработки эффективной тактики ведения подобных пациенток.
Патоморфологически врастание плаценты определяет полное или частичное отсутствие основной децидуальной оболочки (decidua basalis), приводящее к приращению или прорастанию ворсинами плаценты мышечного слоя матки [2, 3]. Согласно последней классификации FIGO (включающей клинические и патоморфологические критерии), выделяют несколько степеней врастания плаценты (placenta accretа spectrum [PAS]): 1 степень (placenta adherenta or creta) – плотное прикрепление или приращение плаценты к мышечному слою; 2 степень (placenta increta) – когда ворсины прорастают мышечный слой; 3 степень (placenta percreta) – когда плацента прорастает все слои матки. Placenta percreta подразделяют на категории: 3a – инвазия ограничена серозной оболочкой матки; 3b – присутствует инвазия в мочевой пузырь; 3c – присутствует инвазия в друге органы/ткани малого таза [4]. Аномальное прикрепление плаценты проявляется в ее неспособности отделиться от стенки матки (как это происходит в норме). Врастание плаценты – опасное осложнение беременности, приводящее к массивной кровопотере, высокой материнской заболеваемости и смертности. Пренатальная диагностика и стадирование в соответствии с указанной классификацией имеет решающее значение при выборе тактики ведения пациенток с указанной патологией.
Эпидемиология
Определиться с эпидемиологией врастания плаценты достаточно сложно, учитывая, что рекомендации и классификация FIGO (с клиническими и патоморфологическими критериями) опубликованы только в 2018–2019 гг., а до этого использовали термин PAS (placenta accreta spectrum), включающий все указанные формы врастания. Отсутствие единой стандартизации учета указанной нозологии привело к значительной дисперсии данных, представленных отечественными и зарубежными авторами. И, в частности, по одним данным частота врастания плаценты составила 1/3000 родов, а по другим – достигала 1/250 [5–10]. Однако, согласно результатам исследований, с определенной долей уверенности можно заключить, что частота встречаемости врастания плаценты стремительно выросла в последние десятилетия. Так, по данным авторов из Италии, частота встречаемости искомой патологии значительно выросла к 2008 г. (1/322) в сравнении с данными 1970-х гг. (1/833) [8], что также согласуется с данными ирландских ученых: рост встречаемости от 1/1266 (в 2005 г.) до 1/943 (в 2010 г.) [9].
Факторы риска
Большинство изученных факторов риска развития врастания плаценты связано с оперативными вмешательствами на матке, которые, вероятно, инициируют травму и воспаление, с последующей неадекватной репарацией поврежденных тканей. К факторам риска относят: предлежание плаценты, предшествующие операции кесарева сечения, множественные оперативные вмешательства на матке в анамнезе (оперативная гистероскопия, кюретаж, миомэктомия), эмболизация маточных артерий в анамнезе, placenta accretа в анамнезе, использование вспомогательных репродуктивных технологий (ВРТ) [5].
Ученые Irving и Hertig в своей работе 1937 г. опубликовали данные 20 клинических случаев врастания плаценты и выполнили обзор литературы по 86 случаям, опубликованным ранее. Учитывая результаты патоморфологического исследования, авторы определили «врастание плаценты» как отсутствие децидуального слоя (Нитабуха) между плацентой и миометрием [1]. Следует отметить, что только у одной пациентки из 20 описанных клинических случаев были предыдущие оперативные роды путем операции кесарева сечения; кроме того, из 86 случаев, описанных в обзоре, также только в одном – кесарево сечение в анамнезе.
С тех пор ситуация изменилась кардинальным образом. В настоящее время некоторые авторы относят врастание плаценты к ятрогенным заболеваниям, связанным с резким скачком частоты кесарева сечения (с открытием антибиотиков кесарево сечение стало более безопасным). Авторы указывают также на изменение соотношения между менее и более агрессивными формами врастания плаценты, отмечая рост более агрессивных в настоящее время [4].
К другим значимым факторам риска развития врастания плаценты относят ее предлежание (placenta previa) [3]. Так, по данным разных исследователей, частота развития PAS у пациенток с предлежанием плаценты составляет от 1/16 до 1/9 случаев родов [5, 6, 11]. Кроме того, риск развития врастания плаценты у женщин с предлежанием и кесаревым сечением в анамнезе растет с числом оперативных родов путем операции кесарева сечения. Так, риск развития врастания плаценты у женщин с ее предлежанием и предшествующими кесаревыми сечениями составляет 3, 11, 40, 61 и 67% для 1, 2, 3, 4 и 5 .
Врастание плаценты
Врастание плаценты – это все более встречающаяся патология, связанная с избыточным прорастанием тканей плаценты в стенку матки. Основным фактором, способствующим развитие данной патологии является рубец на матке, чаще всего от предыдущего кесарева сечения, особенно в тех случаях, когда плацента расположена низко.
Ответами на вопрос почему у одной женщины после кесарева сечения было все типично, а у меня произошло врастание пока не может дать никто. Существуют некоторые попытки раскрыть механизм данного процесса, но в связи с небольшими клиническими наблюдениями во всем мире еще нет достаточной доказательной базы, чтобы сказать точно, на каком этапе «что-то пошло не так».

Само врастание плаценты практически не имеет какой-либо специфической клинической картины во время беременности. Лишь только в тех случаях, когда оно по каким-то причинам «пропущено» и женщине рекомендованы самопроизвольные роды его можно установить, так как послед в этом случае не отделяется.
Принимая во внимание тот факт, что врастание плаценты происходит в большей части случаев у женщин после кесарева сечения, мы рекомендуем своевременно проходить рутинное ультразвуковое исследование, позволяющее оценить прикрепление и положение плаценты.
Если во время УЗИ и цветного допплеровского картирования будут выявлены ЭХО-графические признаки врастания, то для уточнения диагноза проводится дополнительное исследование, безопасное для матери и плода, - магнитно-резонансная томография.
Отдельно стоит отметить про оптимальные сроки для родоразрешения при врастании плаценты. Следует понимать, что пролонгирование беременности до 38 недель является опасным сточки зрения риска развития кровотечения, отслойки плаценты, острой гипоксии плода, что может окончиться фатально как для матери, так и для ожидаемого ее ребенка. В связи с чем докторами решается вопрос об индивидуальном оптимальном сроке, позволяющем не войти в зону риска и получить более зрелого малыша, средний срок при этом 34-36 недель беременности.
Родоразрешение в Центре с врастанием плаценты
Возможности нашего Центра позволяют с минимально допустимыми кровопотерей и осложнениями давать возможность сохранить нормальную анатомию и физиологию женской репродуктивной системы. Это достигается за счет слаженной мультидисциплинарной высококвалифицированной бригады врачей, включающей акушера-гинеколога и хирурга, которые проводят бережное кесарево сечение с последующим этапом пластики участка матки, вовлеченного в патологический процесс, в условиях хирургического снижения кровопотери методами, не включающих воздействие рентгеновских лучей и внутрисосудистого введения различных катетеров. Наличие современной детской реанимации позволяет выходить детей, которые рождаются еще не достаточно зрелыми при данной патологии. Усилиями анестезиологов-реаниматологов и трансфузиологов обеспечивается не только адекватное обезболивание, имеющее определенные особенности при таком объеме оперативного вмешательства, но и все необходимые технологии гемотрансфузии, включающее аутореинфузию собственных эритроцитов, что означает переливание пациенту собственной крови, которая логично теряется во время проведения родоразрешения.
Наш трехгодичный опыт позволил более 50 женщинам со всей России сохранить репродуктивную функцию, что позволяет нам смело брать на себя ответственность в ведении и родоразрешении пациенток с врастанием плаценты.
Плотное прикрепление или приращение плаценты
В течение 30 минут после рождения ребенка должен родится послед. Если этого не происходит, врачи могут заподозрить плотное прикрепление или приращение плаценты.
Более опасным считается приращение плаценты, которое встречается крайне редко: 1 случай на 24000 родов, и наблюдается почти исключительно у повторнородящих.
Причины
- структурные изменения в матке вследствие перенесенных операций, абортов и воспалительных заболеваний;
- патология расположения плаценты (предлежание или низкое расположение плаценты);
- нарушение ферментативного равновесия в системе гиалуроновая кислота-гиалуронидаза между ворсинками хориона и децидуальной (слизистой) оболочкой матки.
Что происходит?
В процессе образования плаценты ворсины хориона «внедряются» в слизистую оболочку матки (эндометрий). Это та самая оболочка, которая отторгается во время менструального кровотечения. Однако бывают случаи, когда ворсины прорастают в мышечный слой, а порой и во всю толщу стенки матки. Возникает плотное прикрепление или приращение плаценты, различающиеся глубиной прорастания ворсин хориона в стенку матки.
Распознать приращение и плотное прикрепление плаценты (и отличить их друг от друга), к сожалению, можно только в родах, при операции ручного отделения плаценты. При плотном прикреплении и приращении плаценты в последовом периоде (III период родов) плацента самопроизвольно не отделяется.
Плотное прикрепление или приращение плаценты может быть полным, если плацента на всей площади прикреплена к своему ложу, и частичным, если плацента прикреплена только на каком-либо участке. В первом случае спонтанного кровотечения не бывает. Во втором — при начавшейся отслойке плаценты возникает кровотечение, которое может быть весьма обильным.
Диагностика
Плотное прикрепление плаценты проявляется либо кровотечением в III периоде родов (частичное плотное прикрепление или приращение), либо отсутствием признаков самостоятельного отделения плаценты в течение 30 минут после рождения ребенка (полное плотное прикрепление или приращение).
Ручное отделение плаценты
Показания к операции:
- отсутствие признаков отделения плаценты без кровотечения через 30 минут после рождения ребенка;
- отсутствие признаков отделения плаценты при начавшемся кровотечении, как только кровопотеря достигнет 250 мл
Операция проводится под внутривенным наркозом. Одновременно с началом операции приступают к капельному введению глюкозы, кристаллоидных растворов, сокращающих матку средств. При плотном прикреплении плацента легко отделяется от стенки матки.
После ручного обследования стенок полости матки и уверенности полного ее опорожнения, внутривенно вводят окситоцин, кладут пузырь со льдом на низ живота и периодически пальпацией через переднюю брюшную стенку контролируют состояние матки. С целью предупреждения послеродовой инфекции во всех случаях оперативного вмешательства в последовом периоде назначают антибиотики. При патологической кровопотере (500 мл и более) возмещают кровопотерю.
В случае приращения — плаценту (или часть ее) не удается отделить от матки. В этой ситуации врачи обязаны прекратить все попытки отделения плаценты и произвести срочное удаление матки.
Кровотечение в III периоде родов, связанное с аномалиями прикрепления плаценты, следует дифференцировать от кровотечения, обусловленного задержкой или ущемлением отделившейся плаценты.
Приращение плаценты
Приращение плаценты — это аномалия врастания хориальных ворсин с инвазией трофобласта в базальную отпадающую оболочку, миометрий, периметрий, окружающие органы. Проявляется отсутствием признаков отделения плаценты, профузным маточным кровотечением в последовом периоде, симптомами вовлечения смежных органов (тазовыми болями, примесью крови в кале и моче, запорами и др.). Для диагностики применяют УЗИ тазовых органов, ЦДК, МРТ-пельвиометрию, определение уровня АФП. Лечение предполагает проведение ручного отделения плаценты, надвлагалищной ампутации матки, гистерэктомии, метропластики, донного варианта кесарева сечения.
МКБ-10
Общие сведения
Приращение плаценты было впервые описано в 1836 году английским гинекологом Джеймсом Симпсоном, морфологическую основу расстройства в 1889 году определил немецкий патолог Фредерик Харт. За последние 50 лет отмечается более чем десятикратное увеличение частоты патологии – с 1: 30 000 беременных в 1950-60-х годах до 1:2 500 в 2007 году, что напрямую связано со стремительным ростом числа кесаревых сечений. Зачастую патологическая глубокая инвазия хориона сочетается с предлежанием плаценты. По данным исследований, после первого оперативного родоразрешения риск приращения плацентарной ткани при ее предлежании повышается на 10%, а после 4-5-го — на 60% и более.
Причины
Патологическому врастанию ворсин хориона в маточные оболочки способствуют как локальные дистрофические изменения эндометрия, так и нарушения бластогенеза. Риск развития расстройства повышается по мере увеличения возраста женщины и количества выношенных ею беременностей. По мнению большинства специалистов в сфере акушерства, основными причинами приращения тканей плаценты являются:
- Рубцовые изменения маточной стенки. Предпосылками к возникновению локальной дистрофии эндометрия становятся рубцы после перенесенных оперативных вмешательств, инвазивных манипуляций — кесарева сечения, миомэктомии, аборта, диагностического выскабливания. Дистрофические изменения провоцируются нарушениями процессов кровообращения и рубцовым перерождением эпителия.
- Заболевания матки. Нормальная архитектоника эпителиальной оболочки может нарушаться при неспецифическом и специфическом эндометрите, вызванном возбудителями хламидиоза, гонореи, туберкулеза, других инфекционных заболеваний половых органов. Приращение часто наблюдается при синдроме Ашермана, деформации маточной полости одной крупной или множественными подслизистыми миомами.
- Высокая протеолитическая активность хориона. В части случаев аномалии бластогенеза проявляются не нарушениями гаметогенеза и формированием пороков развития плода, а повышенной инвазивной способностью хориона. Более глубокая имплантация наблюдается при нарушении ферментативного равновесия в системе гиалуронидаза – гиалуроновая кислота между бластоцистой и децидуальной оболочкой.
Дополнительными факторами риска, способствующими аномальному врастанию хориальных ворсин, являются низкое расположение или предлежание плаценты, многоплодие, переношенная беременность, аномалии развития (двурогая матка, наличие внутриматочной перегородки). Патологию чаще выявляют у пациенток, страдающих хроническим гломерулонефритом, тяжелыми формами гестозов, при которых отмечаются микроциркуляторные нарушения в различных органах, в том числе в эндометрии и миометрии.
Патогенез
Механизм приращения плаценты основан на несоответствии проникающей способности трофобласта толщине и строению децидуальной оболочки. Недостаточная толщина эндометрия может быть обусловлена физиологической гипотрофией (функциональный слой слизистой обычно более тонкий в нижнем маточном сегменте) и патологическими процессами. Ситуация усугубляется при повышении протеолитической активности ферментов, способствующих внедрению бластоцисты в стенку матки. При наличии посттравматических, воспалительных, дистрофических изменений наблюдается рубцовое перерождение губчатого слоя отпадающей оболочки плаценты, по которому происходит ее отторжение в третьем периоде родов. При врастании в уплотненную ткань плацентарных ворсин становится невозможным их самопроизвольное отделение от стенки матки.
Значительное истончение эпителия сопровождается частичным или полным отсутствием губчатого слоя. В результате хориальные ворсины отделены от миометрия скоплениями фибриноида, а в более тяжелых случаях непосредственно контактируют с мышечными волокнами и даже прорастают в них на различную глубину. Плацентарные септы частично формируются из миоцитов, происходит обильная васкуляризация миометрия, подлежащего под плацентарной площадкой. После родов кавернозно измененная мышечная ткань не может сокращаться под влиянием окситоцина, что приводит к развитию массивного маточного кровотечения.
Классификация
Критериями для систематизации основных вариантов приращения плаценты служат площадь аномального прикрепления плацентарной ткани, глубина ее врастания в матку. Такой подход обеспечивает более точное прогнозирование осложнений и выбор оптимальной врачебной тактики. Приращение бывает полным с вовлечением в процесс всей плаценты и частичным с наличием участков нормальной и патологической плацентации. В зависимости от глубины проникновения в оболочки матки выделяют следующие виды расстройства:
- Ложное приращение (placenta adhaerens). Имеет более благоприятный прогноз в плане сохранения матки. Встречается значительно чаще, чем истинное. Возникает при рубцовом перерождении губчатого слоя. Хориальные ворсины плотно врастают в децидуальную оболочку и достигают базальной мембраны, однако не проникают до миометрия. Плацента самостоятельно не отделяется, использование специальных приемов ручного разделения плацентарной ткани и матки позволяет обойтись без полостной операции.
- Истинное приращение. Развивается на фоне атрофии губчатого слоя, проявляется проникновением ворсин хориона до мышечных волокон (приращенная плацента), в миометрий (вросшая плацента) и за пределы матки (проросшая плацента). Ручное отделение плаценты невозможно. Зачастую единственным методом, позволяющим сохранить жизнь родильницы, становится хирургическое удаление матки. Частота приращенной плаценты составляет около 78% всех случаев истинного приращения, вросшей — 15%, проросшей — 7%.
Симптомы приращения плаценты
Клинические признаки расстройства во время беременности отсутствуют. Патология проявляется в родах отсутствием внешних признаков отделения детского места в течение получаса после изгнания ребенка: маточное дно не поднимается выше пупка, не наблюдается выпячивание плаценты над симфизом, оставшийся конец пуповины не удлиняется, втягивается после натуживания женщины и укорачивается при надавливании на живот. При полном ложном и истинном приращении послеродовое кровотечение не возникает, при частичном приращении и попытке отделить приросший послед вручную начинается профузное маточное кровотечение. О прорастании плаценты в брюшину и другие органы свидетельствуют тазовые боли различной интенсивности, затруднения дефекации, примесь крови в моче или кале.
Осложнения
При нарушении бластогенеза приращение плаценты может сочетаться с пороками развития плода, хотя и не служит их непосредственной причиной. В дородовом периоде у женщин с нарушением плацентации чаще возникает фетоплацентарная недостаточность, гипоксия плода с задержкой его развития, преждевременное старение плаценты. В родах приращение плацентарной ткани осложняется маточным кровотечением, которое без оказания экстренной помощи способно привести к значительной кровопотере, возникновению геморрагического шока, смерти женщины. В редких случаях у родильниц развивается воздушная эмболия, респираторный дистресс-синдром, ДВС-синдром.
Диагностика
Для своевременного выявления патологии скрининговое обследование проводится всем беременным из группы риска — многократно рожавшим, женщинам с аномалиями матки, низко расположенной или предлежащей плацентой, пациенткам, ранее перенесшим кесарево сечение, миомэктомию, повторные аборты. Наиболее информативными являются методы ультразвуковой диагностики приращения плаценты:
- Эхография. Признаками возможного аномального крепления плацентарной ткани по данным УЗИ матки и плода считаются уменьшение расстояния между ретроплацентарными сосудами и периметрием до 10 мм и менее, наличие в толще плаценты кист, гиперэхогенных включений. Вероятность приращения повышается при обнаружении гипо- и анэхогенных участков с кровотоком лакунарного типа в мышечной стенке матки.
- Цветовое допплеровское картирование (ЦДК). Метод считается золотым стандартом в пренатальной диагностике приращения. В ходе исследования точно определяется локализация аномальных сосудистых зон. Патогномоничным признаком расстройства является расширение субплацентарного венозного комплекса. ЦДК также обеспечивает точную оценку глубины проникновения хориальных ворсин в миометрий.
В последние годы с диагностической целью акушеры-гинекологи все чаще назначают МРТ-пельвиометрию, позволяющую в сомнительных случаях достоверно визуализировать неровности маточной стенки, патологическую неоднородность структуры миометрия и плацентарной ткани. Косвенным лабораторным признаком расстройства служит повышение уровня альфа-фетопротеина.
При выявлении патологии в родах важно быстро выполнить дифференциальную диагностику между ложным и истинным приращением при помощи ручного отделения последа. При плотном прикреплении плацентарную ткань удается отделить полностью и, таким образом, купировать профузное кровотечение. Об истинном приращении свидетельствует невозможность отделения плаценты единым массивом, разрывы тканей, отсутствие отдельных долек, оставшихся в матке. Заболевание дифференцируют с другими расстройствами, сопровождающимися массивными маточными кровотечениями: маточной гипотонией, ДВС-синдромом, коагулопатиями, беременностью с нормально прикрепленной плацентой в трубном углу удвоенной или двурогой матки и др. По показаниям пациентку консультирует уролог, проктолог, хирург, анестезиолог-реаниматолог.
Лечение приращения плаценты
Выявление патологии служит показанием для проведения хирургического вмешательства. При антенатальной диагностике приращения естественные роды противопоказаны, операция выполняется в плановом порядке на 37-39 неделях гестационного срока одновременно с кесаревым сечением, при обнаружении в родах — экстренно по жизненным показаниям. Рекомендованный объем вмешательства определяется типом приращения плаценты:
- Ручное отделение с выделением последа. Акушерское пособие для извлечения неотделившейся плаценты с плодными оболочками проводят под внутривенной анестезией при ложном приращении. В ходе вмешательства акушер отделяет и удаляет плотно прикрепленную плацентарную ткань вручную.
- Удаление матки. При проникновении ворсин хориона к миометрию или их врастании в гладкомышечные волокна традиционно осуществляется надвлагалищная ампутация или гистерэктомия. Несмотря на травматичность, до недавнего времени такие операции были единственным способом остановить кровотечение.
- Органосохраняющие вмешательства. Антенатальная диагностика с последующим проведением донного кесарева сечения или метропластики позволяет сохранить матку даже при истинном приращении. Подобные операции в России пока производят редко, однако накоплен положительный опыт их выполнения за рубежом.
При прорастании маточной стенки рекомендованы комбинированные урогинекологические и проктогинекологические вмешательства, направленные на полное удаление плацентарной ткани. Часто щадящие хирургические методы дополняют эндоваскулярными для профилактики или остановки маточного кровотечения (эмболизацией маточных артерий, временной баллонной окклюзией). При экстренной операции родильнице показано восстановление объема циркулирующей крови с проведением инфузионной терапии (переливания цельной крови, ее компонентов, коллоидных и кристаллоидных растворов). Симптоматическое лечение включает назначение утеротоников (при сохранении матки), гемостатиков, препаратов для поддержания давления и сердечной деятельности.
Прогноз и профилактика
Благоприятный исход приращения плаценты возможен только при своевременной диагностике и выборе оптимального способа лечения. Для улучшения прогноза используют антенатальный скрининг и плановое хирургическое родоразрешение с выполнением операции рекомендованного объема. Первичная профилактика предполагает отказ от необоснованных диагностических и лечебных внутриматочных вмешательств, планирование беременности, лечение воспалительных заболеваний матки, проведение кесарева сечения строго при наличии акушерских или экстрагенитальных показаний.
1. Врастание плаценты. Стратегия лечения. Реалии. Ближайшие перспективы/ Памфамиров Ю.К., Самойленко А.В./ Современные инновации. – 2017.
2. Диагностика, профилактика и органосохраняющие методы родоразрешения беременных с врастанием плаценты/ Хасанов А.А.// Казанский медицинский журнал. – 2016.
3. Лучевая диагностика и органосохраняющие операции при приращении плаценты/ Гаязов Д.Р., Терегулова Л.Е., Терегулов А.Ю., Юсупова А.Ф.// Практическая медицина. – 2017.
4. Органосохраняющее хирургическое лечение родильниц с патологией прикрепления плаценты: Автореферат диссертации/ Агрба И.Б. – 2014.
Приращение плаценты
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии
Кафедра акушерства и гинекологии № 2 ГБОУ ВПО "Омская государственная медицинская академия"
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии Минздрава России
ГБУЗ Омской области «Областная клиническая больница» Омск, Россия
Приращение плаценты в области рубца на матке после миомэктомии: комбинированный подход при оперативном родоразрешении
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии
Представлено применение комбинированного подхода при оперативном родоразрешении двух пациенток с приращением плаценты в области рубца после миомэктомии, включающего интраоперационное применение двух автономных баллонных катетеров Жуковского (вагинального и маточного), билатеральную перевязку маточных сосудов, наложение надплацентарного серозно-мышечного гемостатического шва, метропластику, позволившего выполнить органосохраняющие операции при истинном врастании плаценты.
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии
Кафедра акушерства и гинекологии № 2 ГБОУ ВПО "Омская государственная медицинская академия"
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии
Кафедра акушерства и гинекологии №2 Омской государственной медицинской академии Минздрава России
ГБУЗ Омской области «Областная клиническая больница» Омск, Россия
Такие состояния, как предлежание, приращение плаценты могут приводить к катастрофическим последствиям как для матери, так и плода, особенно при доношенном сроке беременности. Акушерские кровотечения, обусловленные предлежанием плаценты, занимают одно из ведущих мест среди причин материнской смертности [1—3].
Проблема диагностики истинного врастания плаценты и разработка методов лечения пациенток с данной патологией представляются чрезвычайно актуальными, так как, с одной стороны, подобная патология сопряжена с высоким риском для жизни женщины из-за профузного кровотечения во время отделения плаценты, нередко приводящего к гистерэктомии, с другой — распространенность ее значительно увеличилась с ростом числа кесаревых сечений [4—7].
Одними из основных факторов, предрасполагающих к приращению плаценты, являются ее локализация в нижних отделах матки и наличие рубца после кесарева сечения. Риск инфильтрации ворсинами всей толщи миометрия повышается при наличии в анамнезе нескольких абдоминальных родоразрешений [8—10], причем ситуация может осложниться вовлечением в патологический процесс задней стенки мочевого пузыря.
Цель настоящей работы — представление комбинированного подхода при оперативном родоразрешении 2 пациенток с приращением плаценты в области рубца на матке после миомэктомии, включающего интраоперационное применение двух автономных баллонных катетеров Жуковского (вагинального и маточного) [11], билатеральную перевязку маточных сосудов, наложение надплацентарного серозно-мышечного гемостатического шва.
Клиническое наблюдение № 1
Повторнобеременная, первородящая Н., 43 лет, поступила в родильный дом бюджетного учреждения здравоохранения Омской области «Областная клиническая больница» 08.11.16 с диагнозом: беременность 39 нед. Головное предлежание. Рубцы на матке после малого кесарева сечения и трех миомэктомий. Подозрение на приращение плаценты. Истмико-цервикальная недостаточность (ИЦН), корригированная акушерским пессарием. Гестационный сахарный диабет. Артериальная гипертензия умеренная. Отягощенный акушерско-гинекологический анамнез.
Антропометрические данные женщины: рост 164 см, масса тела 71 кг.
В анамнезе имелись 3 миомэктомии по поводу субсерозной миомы матки больших размеров: в 2005 г. — лапаротомия, энуклеация узла 10 см в левом маточном углу, гистологическое исследование: клеточная лейомиома; в 2010 г. — лапаротомия, энуклеация узла 6 см в левом маточном углу, гистологическое исследование: лейомиома; в 2012 г. — лапаротомия, энуклеация узла 6 см в левом маточном углу, гистологическое исследование: лейомиома.
Настоящая беременность — пятая, предстояли первые роды. Предыдущие беременности: 1) 2004 г. — неразвивающаяся беременность в 6—7 нед беременности, вакуум-аспирация плодного яйца; 2) 2006 г. — прерывание беременности по медицинским показаниям (врожденные пороки развития плода), малое кесарево сечение в 20 нед; 3) 2009 г. — неразвивающаяся беременность в 6—7 нед, вакуум-аспирация плодного яйца; 4) 2012 г. — самопроизвольный аборт в 5—6 нед беременности.
Течение и осложнения настоящей беременности. На учете в женской консультации состояла с 11-й недели; угроза прерывания — в 9 нед, стационарное лечение. С целью коррекции ИЦН в 15—16 нед был установлен акушерский пессарий Доктор Арабин, получала прогестерон (утрожестан 200 мг) до 36 нед беременности. В 17 нед наблюдалась угроза прерывания беременности, получала стационарное лечение. Отмечено повышение артериального давления (АД) до 130/90 мм рт.ст.; общая прибавка массы тела за беременность составила 10 кг.
На момент поступления жалоб не предъявляла. Общее состояние удовлетворительное. Зрение ясное. Головной боли нет. Кожные покровы обычной окраски. Живот увеличен за счет беременной матки, при пальпации мягкий, безболезненный. Область послеоперационных рубцов на матке при пальпации безболезненная. Матка в нормотонусе. Положение плода продольное, предлежит головка над входом в малый таз. Сердцебиение плода приглушено, ритмичное, до 140 ударов в минуту. Воды целы. Отеков нет. Физиологические отправления в норме. Влагалищное исследование: влагалище нерожавшей, шейка матки — в акушерском пессарии, расположена по центру, длиной до 2,0 см, умеренно размягчена, цервикальный канал пропускает кончик исследующего пальца; плодный пузырь цел; предлежит головка над входом в малый таз; таз емкий, мыс не достижим.
Ультразвуковое исследование проводилось на аппарате SonoScape-8000Pro. В полости матки живой плод, предлежание головное, положение продольное, I позиция, передний вид. Фетометрические показатели плода соответствовали 38,5 нед беременности. Врожденные пороки развития не обнаружены, масса плода 3362 г. Плацента располагалась по задней стенке, выше внутреннего зева на 10 см. Толщина плаценты 43 мм, III степень зрелости, структура с кальцинатами. Индекс амниотической жидкости — 11,2 см. Гипертонуса нет. Стенка матки в зоне плацентации утолщена за счет расширенной сосудистой сети.
На данном этапе, учитывая рубцы на матке после малого кесарева сечения и трех миомэктомий, у первородящей 43 лет с сугубо отягощенным акушерско-гинекологическим анамнезом, решено родоразрешить беременную путем кесарева сечения в плановом порядке.
В этот же день пациентка осмотрена анестезиологом-реаниматологом, при проведении кесарева сечения рекомендована регионарная спинальная анестезия. Учитывая высокий риск кровотечения, рекомендована интраоперационная реинфузия аутологичных эритроцитов с помощью аппарата Cell Saver.
09.11.16 (10:50—12:10) в условиях регионарной спинальной анестезии, в присутствии перфузиолога проведено кесарево сечение. Передняя брюшная стенка послойно вскрыта от лона до пупка. По вскрытии брюшины обнаружено: величина матки соответствует доношенной беременности, в дне матки и по левому углу матки — рубцовые изменения стенки после миомэктомии, миоматозных узлов не выявлено. Полость матки вскрыта поперечным разрезом в области нижнего сегмента по Гусакову. Излились светлые околоплодные воды в количестве 500 мл. На 5-й минуте извлечен живой доношенный мальчик массой 3076 г, ростом 51 см, без видимых пороков развития, с оценкой состояния по шкале Апгар — 7 и 8 баллов.
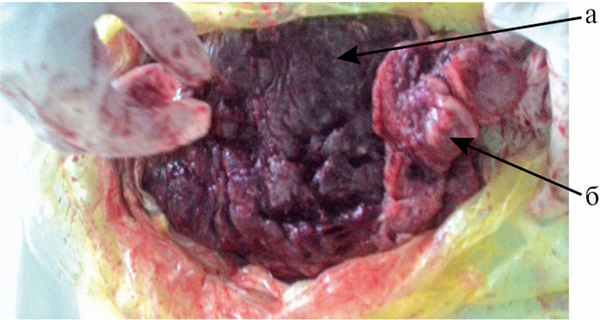
С целью уменьшения кровопотери произведена билатеральная перевязка маточных сосудов. Признаки отделения плаценты отсутствовали. Наружные приемы отделения плаценты были без эффекта. Решено произвести ручное отделение плаценты. При осмотре полости матки плацента располагалась по задней стенке матки с переходом на дно. При попытке отделения плаценты пилящими движениями правой руки в левом маточном углу, в зоне послеоперационного рубца, выявлено врастание плаценты на всем протяжении (10×10 см). Произведена резекция левого маточного угла с вросшей плацентой (рис. 1). Рис. 1. Плацента вместе с резецированным участком стенки матки. а — плацента; б — резецированный участок матки с вросшей плацентой. Резецированный участок матки зашит отдельными восьмиобразными швами. Произведена ревизия полости матки, удалены сгустки крови. Для остановки кровоточивости зоны операционной раны на матке применялся местный гемостатик Гемоблок. Методика применения: наружно стерильно смачивали раствором марлевые салфетки и прикладывали к кровоточащей, предварительно осушенной поверхности раны на 3 мин.
На заднюю стенку матки наложен надплацентарный серозно-мышечный гемостатический шов. Полость матки осушена салфетками. На углы раны на матке наложены отдельные викриловые швы. Через гистеротомический разрез устанавливали модифицированный баллонный маточный катетер с использованием проводника, проводя его через цервикальный канал. Рана на матке зашита отдельными восьмиобразными швами. Модифицированный баллонный маточный катетер наполняли изотоническим раствором натрия хлорида после зашивания раны на матке, затем интравагинально через проводник к маточному баллону подводили вагинальный модуль, заполняя его 150 мл изотонического раствора натрия хлорида. Продолжительность нахождения вагинального и маточного катетеров составляла 14 ч. Интраоперационная кровопотеря составила 1500 мл, диурез 100 мл. Реинфузия крови аппаратом Cell Saver 600 мл.
Послеоперационный период протекал без особенностей, проводилась антибактериальная, утеротоническая терапия. Женщина выписана в удовлетворительном состоянии с ребенком на 6-е сутки.
Гистологическое исследование иссеченного участка стенки матки с плацентой — глубокое врастание ворсин хориона в миометрий.
Клиническое наблюдение № 2
Первобеременная, первородящая М., 32 лет, поступила в родильный дом бюджетного учреждения здравоохранения Омской области «Областная клиническая больница» 15.11.16 с диагнозом: беременность 37 нед. Головное предлежание. Рубцы на матке после миомэктомий. Множественная миома матки больших размеров. Истмико-цервикальная недостаточность, корригированная акушерским пессарием. Хронический пиелонефрит вне обострения. Нефроптоз справа.
Антропометрические данные женщины: рост 162 см, масса тела 80 кг.
В анамнезе две миомэктомии по поводу субсерозной миомы матки больших размеров: 2013 г. — лапаротомия, энуклеация узла 8 см в правом маточном углу, при гистологическом исследовании — клеточная лейомиома; 2016 г. (июль) — лапаротомия, энуклеация узла 10 см в левом маточном углу, при гистологическом исследовании — лейомиома.
Течение и осложнения настоящей беременности: на учете в женской консультации состоит с 10 нед; с целью коррекции ИЦН в 17 нед установлен акушерский пессарий Доктор Арабин, получала прогестерон (утрожестан 400 мг) до 36 нед; общая прибавка массы тела за беременность составила 8 кг.
На момент поступления жалоб не предъявляла. Общее состояние удовлетворительное. Зрение ясное. Головной боли нет. Кожные покровы обычной окраски. Живот увеличен за счет беременной матки, при пальпации — мягкий, безболезненный. Область послеоперационного рубца на матке при пальпации безболезненная. Матка в нормотонусе. Положение плода продольное, предлежит головка над входом в малый таз. Сердцебиение плода приглушено, ритмичное, до 150 ударов в минуту. Воды целы. Отеков нет. Физиологические отправления в норме. Влагалищное исследование: влагалище нерожавшей, шейка матки — в акушерском пессарии, по центру, длиной до 1,5 см, умеренно размягчена, цервикальный канал пропускает кончик исследующего пальца; плодный пузырь цел; предлежит головка над входом в малый таз; таз емкий, мыс не достижим.
Ультразвуковое исследование проводилось на аппарате SonoScape-8000Pro. В полости матки живой плод, предлежание головное, положение продольное, I позиция, передний вид. Фетометрические показатели плода соответствуют 37 нед. Врожденные пороки развития не обнаружены, масса плода 2914 г. Плацента располагалась по задней стенке с переходом на дно, выше внутреннего зева на 9 см. Толщина плаценты 37 мм, III степень зрелости. Индекс амниотической жидкости 21,7 см. Гипертонуса нет. В нижнем сегменте по задней стенке определяется миоматозный узел размером 69×64×63 мм. В дне матки определяются два миоматозных узла в зоне плацентации размером 38×15×31 и 45×42×43 мм, при цветовом допплеровском картировании (ЦДК) — аваскулярные.
На данном этапе, учитывая рубцы на матке после двух миомэктомий, в том числе 05.07.16, множественную миому матки больших размеров, решено родоразрешить беременную досрочно путем кесарева сечения в плановом порядке.
Осмотрена анестезиологом-реаниматологом, при проведении кесарева сечения рекомендована регионарная спинальная анестезия. Учитывая высокий риск кровотечения, рекомендована интраоперационная реинфузия аутологичных эритроцитов с помощью аппарата Cell Saver.
18.11.16 (9:15—10:50) в условиях регионарной спинальной анестезии в присутствии перфузиолога проведено кесарево сечение. Передняя брюшная стенка послойно вскрыта от лона до пупка. После вскрытия брюшины вскрыта полость матки поперечным разрезом в области нижнего сегмента по Гусакову. Излились светлые околоплодные воды в количестве 400 мл. На 5-й минуте извлечен живой доношенный мальчик массой 2743 г, ростом 49 см, без видимых пороков развития, с оценкой состояния по шкале Апгар 7 и 7 баллов.
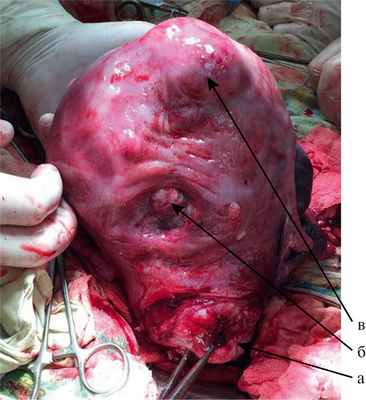
Матка выведена в рану, обнаружено следующее (рис. 2): Рис. 2. Субсерозная миома матки, грыжевое выпячивание в рубце на матке после миомэктомии. а — позадишеечный интерстициально-субсерозный миоматозный узел; б — грыжевое выпячивание; в — интерстициально-субсерозный миоматозный узел в области дна. по задней стенке в нижнем сегменте — интерстициально-субсерозный миоматозный узел диаметром 9 см, в области дна — интерстициально-субсерозный миоматозный узел диаметром 6 см. По задней стенке в зоне плацентарной площадки в области старого рубца после миомэктомии — грыжевое выпячивание диаметром 4 см (плацентарная грыжа), выраженное варикозное расширение вен придатков матки. С целью уменьшения кровопотери произведена билатеральная перевязка маточных сосудов при неотделившейся плаценте.
Послед удален потягиванием за пуповину, плацента расположена по задней стенке. Осмотрено ложе грыжевого выпячивания: обнаружен участок врастания плацентарной ткани; кровотечения нет. Произведен поперечный разрез на матке, выполнена миомэктомия позадишеечного узла. Ложе зашито восьмиобразными швами, рана зашита двухрядным викриловым швом. Для остановки кровоточивости в зоне операционной раны на матке применялся местный гемостатик Гемоблок (рис. 3). Рис. 3. Применение гемоблока после миомэктомии с грыжевым выпячиванием. а — грыжевое выпячивание; б — местный гемостатик Гемоблок. Острым путем проведено грыжесечение. Иссечена и удалена рубцовая ткань с участками врастания плаценты (рис. 4). Рис. 4. Иссечение участка врастания плаценты. Ложе зашито восьмиобразными швами, рана зашита двухрядным викриловым швом. Аналогично произведена миомэктомия интерстициально-субсерозных миоматозных узлов в дне матки.
Произведена ревизия полости матки, удалены сгустки крови. Для остановки кровоточивости зоны операционной раны на матке применялся местный гемостатик Гемоблок. На заднюю стенку наложен надплацентарный серозно-мышечный гемостатический шов. Полость матки осушена салфетками. На углы раны на матке наложены отдельные викриловые швы. С целью управляемой тампонады матки через гистеротомический разрез устанавливали модифицированный баллонный маточный катетер с введением проводника через цервикальный канал. Рана на матке зашита отдельными восьмиобразными швами. Модифицированный баллонный маточный катетер наполняли изотоническим раствором натрия хлорида после зашивания раны на матке, затем интравагинально через проводник к маточному баллону подводили вагинальный модуль, заполняя его 120 мл изотонического раствора натрия хлорида. Продолжительность нахождения вагинального и маточного катетеров составляла 14 ч. Интраоперационная кровопотеря составила 1100 мл, диурез 150 мл. Реинфузия крови аппаратом Cell Saver — 500 мл.
Послеоперационный период протекал без особенностей, проводилась антибактериальная, утеротоническая терапия. Родильница выписана в удовлетворительном состоянии с ребенком на 6-е сутки.
Гистологическое заключение: иссеченный участок стенки матки с плацентой — глубокое врастание ворсин хориона в миометрий.
Таким образом, приведенные примеры показывают, что применение комбинированного подхода при оперативном родоразрешении пациенток с приращением плаценты в области рубца на матке после миомэктомии, включающего интраоперационное применение двух автономных баллонных катетеров Жуковского (вагинального и маточного), билатеральную перевязку маточных сосудов, наложение надплацентарного серозно-мышечного гемостатического шва, позволяет выполнить органосохраняющие операции и сохранить репродуктивную функцию пациенткам.
Читайте также:
