Разрыв аорты, псевдоаневризмы, аортит. Опухоль сердца - миксома
Добавил пользователь Алексей Ф. Обновлено: 28.01.2026
Разрыв аорты, псевдоаневризмы, аортит. Опухоль сердца - миксома
Разрыв аорты — жизнеугрожающее осложнение, при котором выживаемость зависит от быстроты диагностики и хирургического лечения. Поскольку при ЧПЭхоКГ можно визуализировать весь грудной отдел Ао, она является методом выбора при подозрении на разрыв грудного отдела аорты. Помочь в диагностике также могут КТ и МРТ.
Псевдоаневризмы формируются при образовании отверстия в стенке аорты и истечении крови из аорты в ограниченную полость аневризмы. Образование ограниченной полости может быть связано с предшествующими травмами, оперативными вмешательствами или инфекциями. Псевдоаневризмы отличаются от истинных наличием четко ограниченного места разрыва, через которое аорта сообщается с полостью псевдоаневризмы. Учитывая риск разрыва, обычно рекомендуется оперативное вмешательство с целью пластики псевдоаневризм.
Аортит развивается при воспалении стенки аорты инфекционного генеза (сифилитический или микотический), гигантоклеточном артериите, болезни Takayasu, анкилозирующем спондилите, ревматоидном артрите, рецидивирующем полихопдрите. Поражение аорты отражает системный характер указанной патологии. Стенка Ао утолщается, затрудняя дифференциальную диагностику с интрамуральной гематомой по результатам ЧПЭхоКГ.
При болезни Takayasu может развиться сужение грудного или брюшного отдела Ао с обструкцией. Сифилитический аортит встречается редко и, как правило, поражает восходящий очдел Ао. Спондили, сопровождающийся анкилозом, характеризуется утолщением и расширением корня аорты. Уплотнение створок аортального клапана и дилатация корня аорты приводят к прогрессирующей аортальной недостаточности, что может потребовать протезирования аортального клапана. Аортит с дилатацией аорты можно наблюдать у больных с синдромами Reiter, Behcet и псориатическим артритом.

Опухоль сердца - миксома
В сердце можно визуализировать опухоли, тромбы, вегетации, ятрогениый материал, внесердечные структуры и структуры, являющиеся вариантом нормы. Для дифференциальной диагностики имеют значение размер, форма, расположение, подвижность и место фиксации образований. Очень важно точно диагностировать эти структуры, поскольку неправильная диагностика приводит к неверному лечению, в т.ч. хирургическому.
Миксомы образуются из мультииотентных мезенхи-мальных клеток эндокарда. Миксомы сердца — самые частые первичные опухоли сердца у взрослых, составляющие до 83% первичных опухолей сердца. Миксомы обычно появляются между третьей и шестой декадами жизни, причем в 2 раза чаще у женщин, чем у мужчин. большинство миксом расположено в ЛП, прикрепляется к МПП (83-88%), но могут находиться во всех камерах сердца и прикрепляться к клапанам.
Миксомы обычно имеют типичную ЭхоКГ-картину: слизеподобную рыхлую консистенцию, иногда с некрозом в центре. До 7% миксом имеют наследственный характер. Самым известным из них является синдром Carney — аутосомно-доминантное состояние с кожными проявлениями, включая лентиго, веснушки и голубые невусы, миксомами сердца с атипичной локализацией, развивающимися у людей в возрасте < 40 лет, и эндокринными нарушениями. Этот синдром связан с генной мутацией в длинном плече хромосомы 17.
Единичные предсердные миксомы обычно хорошо лечатся хирургически, но при наследственном характере поражения они нередко рецидивируют, появляясь на некотором расстоянии от исходной.
Миксомы могут осложняться эмболиями, характерными для миксом малых размеров, обструкцией входного или выходного отдела, системной патологией и редко — метастазированием.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Аневризма синуса Valsalva. Атеросклероз аорты
Локальное отсутствие медии в стенке аорты приводит к развитию аневризм синуса Valsalva. Эти аневризмы могут быть случайными находками при ЭхоКГ. Аневризмы могут прорываться в смежные камеры сердца, чаще всего в ПП, ПЖ или МЖП, и сдавливать рядом расположенные структуры. Парастернальная и апикальная позиции по длинной оси помогают дифференцировать эти аневризмы от аневризм мембранозной части МЖП. Аневризма синуса Valsalva локализуется в аортальной части ЛК, тогда как аневризма мембранозной части МЖП расположена со стороны желудочков. Эти аневризмы можно четко отличить, используя ЧПЭхоКГ и ТТЭхоКГ.
Естественное течение аневризм синуса Valsalva изучено не до конца, однако установлено, что они с высокой вероятностью связаны с эндокардитом, фатальным разрывом, эмболиями и появлением соустий между камерами сердца. Хирургическое лечение строго показано при разрывах аневризм, приводящих к появлению шунта слева направо. Вопрос о пластике неосложненных аневризм решается индивидуально.
Атеросклероз аорты
При рутинной ТТЭхоКГ у пожилых людей часто визуализируются атеросклеротические бляшки и их фрагменты. Бляшки в Ао обычно имеют неправильную форму и подвижны. В рамках исследования SPARC (Stroke Prevention Assessment of Risk in a Community) бессимптомным больным выполняли ЧПЭхоКГ. В этом исследовании возраст, курение в анамнезе и САА были независимо связаны с атеросклерозом Ао, и фрагменты атеросклеротических бляшек в Ао часто определяли у больных с эмболиями. Изъязвленные бляшки в дуге Ао были обнаружены у 26% из 239 больных с цереброваскулярными событиями и только у 5% из 261 пациента без цереброваскулярной патологии.
Предварительные результаты свидетельствуют, что длительная варфариновая гипокоагуляция эффективна при атеросклерозе для уменьшения вероятности эмболических осложнений; при рецидивирующих эмболиях на фоне гипокоагуляции показано хирургическое удаление бляшек.

Несмотря на то что у большинства больных с расслоением аорты она расширена при визуализации в В-режнме ЭхоКГ, при ТТЭхоКГ обнаружить расслоение аорты трудно; кроме того, при ТТЭхоКГ невозможно визуализировать нисходящий отдел Ао. При отсутствии данных о расслоении аорты или недостаточно оптимальной визуализации требуется дополнительное обследование.
При ЧПЭхоКГ проксимальное расслоение Ао отображается хорошо. При этом можно полностью визуализировать грудной отдел аорты вследствие его близкого расположения к пищеводу. При горизонтальной чреспищеводной позиции может быть не видна дистальная часть восходящей Ао и проксимальная часть дуги Ао из-за интерпозиции трахеи. Однако эту слепую зону можно визуализировать в продольной позиции, благодаря четкому и полному изображению всей аорты ЧПЭхоКГ изменила роль ЭхоКГ в диагностике и лечении расслоения аорты. В IRAD (International Registry of acute Aortic Dissection) опубликованы методы, использованные для диагностики расслоения аорты. У 628 больных с острым расслоением аорты из 13 международных медицинских центров наиболее распространенными методами диагностики расслоения аорты были КТ и ЧПЭхоКГ.
Многоцентровое исследование European Cooperative Study Group of Echocardiography впервые продемонстрировало, что ЧПЭхоКГ даже превосходит КТ и аортографию в диагностике расслоения Ао (чувствительность 99%). Последующие исследования подтвердили высокую диагностическую ценность ЧПЭхоКГ при расслоении Ао. После широкого распространения ЧПЭхоКГ в клинической практике чувствительность ЧПЭхоКГ, по данным IRAI), снизилась до 88% по сравнению с чувствительностью КГ (93%). В настоящее время ЧПЭхоКГ или КТ с контрастированием являются методами выбора при подозрении на расслоение Ао. Диагностическую точность МР'Г оценивали в недостаточном количестве исследований, но ее клиническое значение ограничено длительностью исследования, трудностями наблюдения за больными во время исследования и большим расстоянием места обследования от отделений реанимации и интенсивной терапии.
Интрамуральная гематома предшествует расслоению аорты и часто ассоциирована с артериальной гипертензией и пожилым возрастом. Интрамуральная гематома появляется у 15-20% больных с расслоением аорты и заканчивается расслоением или разрывом Ао у 45% больных . У 34% гематома полностью исчезает, у 12% заканчивается расслоением Ао, у 20% — развитием аневризмы аорты, у 24% — развитием псевдоаневризмы. Интрамуральная гематома хорошо визуализируется при ЧПЭхоКГ, Представляя собой повышение эхоплотности вдоль стенки Ао, соответствующее формированию тромба между интимой и адвентицией. Это изображение необходимо дифференцировать от атсросклсротичсских бляшек в Ао и аортита. Интрамуральная гематома также легко диагностируется при КТ и МРТ. Аортография — наименее ценный метод диагностики интрамуральной гематомы.
Изъязвление атеросклеротической бляшки в аорту может проникать через внутреннюю эластическую мембрану в медию. Это называют пенетрирующей атеросклеротичсской язвой Ао. Такая язва может привести к появлению интрамуральной гематомы, расслоению или разрыву Ао; ее можно заподозрить у больных артериальной гипертензией при болях в груди или спине, напоминающих боли при расслоении аорты. Язвы обычно локализуются в нисходящем отделе аорты. При ЧПЭхоКГ пенетрирующая язва аорты представляет собой кратерообразное или локальное выпячивание атеросклеротически измененной стенки аорты .
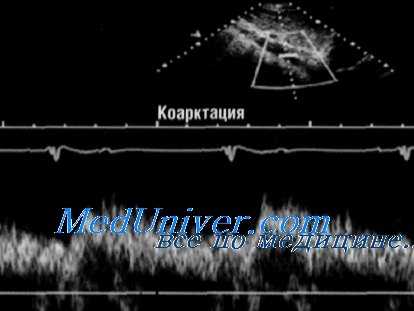
Открытый артериальный (боталлов) проток. Эхокардиография при коарктации аорты
Коарктация аорты обычно представляет собой дискретное образование складок медии Ао в области задней стенки, что приводит к сужению верхнего отдела нисходящей аорты. Это сужение может располагаться ниже отхождения левой подключичной артерии (область, противоположная расположению артериального протока или его рудимента), его называют постдуктальной коарктацией. Коарктация аорты составляет 6-8% ВПС. Физиология коарктации аорты зависит от возраста пациента, степени и локализации стеноза и ассоциированных повреждений. Клинические проявления могут варьировать от тяжелой СН и шока у новорожденных до бессимптомной АГ со снижением пульсации на бедренных артериях или шумом у детей старшего возраста и взрослых.
При ТТЭхоКГ область сужения можно увидеть из супрастернального доступа или высокой левой парастернальной позиции; однако ИВ ДЭхоКГ — лучший метод количественной оценки степени обструкции. ДЭхоКГ при гемодииамически значимой коарктации характеризуется увеличением скорости кровотока в нисходящей аорте, которая расширяется во время диастолы. Показатель систолического Р при тяжелой коарктации не позволяет правильно оценить тяжесть обструкции, если имеются хорошо развитые коллатерали, поэтому требуются ополнительные данные. При тяжелой коарктании исследование пульсовой волны в брюшной аорты определяет искажение скоростей кровотока со снижением амплитуды во время систолы и сохранением кровотока во время диастолы. Нарушения абдоминального кровотока помогают в диагностике рекоарктации аорты у взрослых. У пожилых людей и у пациентов после пластики коарктации МРТ и КТ заняли место ангиографии в диагностике и гемодинамической оценке коарктации и рекоарктации.
The American College of Cardiology и American Heart Association (ACC/ AHA) в 1997 г. опубликовали свои первые совместные Рекомендации по использованию ЭхоКГ. В 2003 г. АСС/АНА выпустили обновленную редакцию этих Рекомендаций, а также совместно с рядом других профессиональных обществ — клинические стандарты соответствия профессиональным требованиям. В Рекомендации по использованию ЭхоКГ вошла также информация по специфическим клиническим синдромам, таким как пороки клапанов сердца и подозрение на эндокардит.
В Рекомендациях АСС/АНА рассматриваются вопросы применения ЭхоКГ в различных клинических условиях, при которых результаты, полученные этим методом, позволяют улучшить лечение больных либо, наоборот, не дают никаких преимуществ. В Рекомендации входит новый раздел по интраоперационной ЧПЭхоКГ, который содержит обновленные рекомендации, опубликованные American Society of Anesthesiologists и Society of Cardiovascular Anesthesiologists. В рекомендациях указана частота, с которой следует проводить повторные ДЭхоКГ в различных клинических ситуациях. В Рекомендациях советуют ограничивать назначение повторных ЭхоКГ у тех пациентов, у которых при первичном обследовании были обнаружены минимальные или умеренные нарушения и отсутствуют изменения в клиническом состоянии. Не рекомендуется использовать ЭхоКГ для скрининга из-за высокой стоимости исследования и достаточно большой вероятности получения ложноположительных результатов, которые могут стать причиной дальнейших дополнительных обследований и неправильного лечения.
В данных Рекомендациях термин «эхокардиография» относится к допплеровскому исследованию, М-режиму ЭхоКГ, двухмерной ТТЭхоКГ и, когда указано, к ЧПЭхоКГ.
Как и в других Рекомендациях АСС/АНА, здесь используют стандартную классификацию для показаний:
Класс I: состояния, для которых существуют доказательства и/или общее соглашение, что такое исследование полезно и эффективно.
Класс II: состояния, для которых существуют противоречивые доказательства и/или расхождения мнений о полезности/эффективности проводимого исследования.
Класс IIа: преобладают доказательства или мнения о полезности/эффективности исследования.
Класс IIb: полезность или эффективность метода подтверждена недостаточно.
Класс III: состояния, для которых существуют доказательства и/или общее соглашение, что метод бесполезен или неэффективен, а в некоторых случаях может быть вреден.
В зависимости от типа доказательств рекомендации подразделяют на три уровня.
Уровень А основан на результатах многих рандомизированных клинических исследований, уровень
В — на данных одного рандомизированного исследования,
уровень С — на соглашении экспертов.
Миксома
Миксома – первичная, гистологически доброкачественная, внутриполостная опухоль сердца. Миксома сердца может вызывать повышение температуры тела, одышку, ортопноэ, кашель, кровохарканье, сердцебиение, слабость, анемию, похудение, головокружение, преходящую потерю сознания, отек легких, тромбоэмболии. Миксома диагностируется с помощью ЭКГ, трансторакальной и чреспищеводной ЭхоКГ, фонокардиографии, рентгеноконтрастного исследования сердца. Лечение заключается в хирургическом удалении миксомы.
Общие сведения
Миксома сердца – первичное новообразование с внутрипредсердным или внутрижелудочковым ростом. Серди доброкачественных опухолей сердца у взрослых миксомы встречаются в 50% случаев, у детей – в 15% случаев. В 75% наблюдений миксома локализуется в левом предсердии, в 20% - в правом; у незначительной части пациентов опухоль поражает желудочки сердца или клапанный аппарат. Преимущественный возраст заболевших составляет от 40 до 60 лет; статистически чаще опухоль выявляется у женщин.
Миксома – соединительнотканная опухоль, содержащая большое количество слизи. Кроме сердца, миксомы могут выявляться в межмышечной клетчатке, на конечностях, в области апоневрозов и фасций; реже поражают мочевой пузырь и нервные стволы.
Причины миксомы
Вопрос об этиологии до конца неясен. Примерно в 7-10% наблюдений носят семейный характер с аутосомно-доминантным типом наследования. В этом случае чаще всего миксома входит в состав наследственного синдрома Карни, также характеризующегося диффузными пигментными изменениями кожи (множественными невусами, веснушками, гиперпигментацией губ), гемангиомами, подкожными нейрофибромами, гиперплазией коры надпочечников, миксоидной фиброаденомой молочной железы, опухолями гипофиза с акромегалией или гигантизмом, опухолями яичка.
Спорадические миксомы обычно солитарные, после удаления практически никогда не рецидивируют; наследственные формы – мультилокулярные, часто возникают вновь после хирургического иссечения. Предполагают, что миксома развивается из мукоидной эмбриональной ткани. Преимущественная локализация миксомы в области межпредсердной перегородки объясняется склонностью этой зоны к тканевой пролиферации, которая сохраняется после рождения.
В кардиологии не исключается вероятность возникновения миксомы вследствие травм сердца, предшествующей пластики септальных дефектов, чрескожной баллонной дилатации митрального клапана, транссептальной пункции и т. д.
Макроскопически миксома имеет вид полипоидной опухоли на ножке с рыхлой желеобразной консистенцией, сосочковой или гроздьевидной структурой. Миксомы могут достигать размеров от 1 до 15 см в диаметре и массы 250 г. Гистологически миксома представлена матриксом, состоящим из мукополисахаридов, в котором рассеяны полигональные клетки опухоли. Миксома содержит много капилляров и более крупных сосудов, встречаются очаги некрозов, кровоизлияний, обызвествлений.
Патогенез
Локализация и размер миксомы определяет ее стенозирующий эффект: так, миксома левого предсердия вызывает обструкцию левого атриовентрикулярного отверстия и затрудняет отток крови из легочных вен; правопредсердная опухоль – обтурирует правое атриовентрикулярное отверстие и нарушает венозный отток, приводя к развитию синдрома верхней полой вены. Миксома левого желудочка стенозирует выносящий тракт левого желудочка; опухоль правого желудочка суживает устье легочного ствола.
Миксома сердца характеризуется быстрым ростом, симптомы обструкции левого предсердия появляются, когда опухоль достигает диаметра примерно 7 см, правого – при диаметре более 10—12 см. Миксомы предсердий имитируют клинику митрального или трикуспидального стеноза; миксомы желудочков напоминают клинику подклапанного стеноза аорты или стеноза легочной артерии.
Симптомы миксомы сердца
В клинической картине миксомы превалируют три основных синдрома: синдром системных проявлений, тромбоэмболический синдром, синдром внутрисердечной обструкции. Общая симптоматика развивается более чем у 90% пациентов с миксомой сердца и характеризуется повышением температуры тела, общей слабостью, похудением. В крови выявляется анемия, ускорение СОЭ, тромбоцитопения, повышение уровня иммуноглобулинов, диспротеинемия, повышенное содержание СРБ. На фоне миксомы могут развиваться полиартралгии, сетчатое ливедо, синдром Рейно.
Тромбоэмболический синдром, обусловленный закупоркой сосудистого русла фрагментами опухоли или тромботическими массами, при миксоме сердца встречается в 40-50 % случаев. При миксоме левых отделов сердца поражаются артерии большого круга кровообращения, чаще всего церебральные (ишемический инсульт) и коронарные (инфаркт миокарда). При тромбоэмболии артерий сетчатки возникает преходящая или стойкая потеря зрения. Эмболия сосудов брыжейки приводит к окклюзии мезентериальных сосудов. Миксома, исходящая из правых отделов сердца, служит источником ТЭЛА и формирования хронической легочной гипертензии. Тромбоэмболия при миксоме сердца может привести к внезапной смерти.
Синдром обструкции внутрисердечного кровотока сопровождается легочной венозной или артериальной гипертензией, одышкой, кровохарканьем, ортопноэ, тахикардией, головокружением, кратковременными эпизодами потери сознания, развитием периферических отеков. При миксоме сердца возникновение и выраженность данных симптомов может изменяться при смене положения тела и перемещении опухоли.
Диагностика
Аускультативная картина и данные фонокардиографии при миксоме могут быть вариабельны, однако шумы сердца обычно изменяются при перемене положения тела и смещении опухоли относительно клапана. ЭКГ-изменения неспецифичны и позволяют судить лишь о функциональном состоянии сердца. При рентгенографии грудной клетки чаще обнаруживается митральная форма сердца, признаки венозного застоя в легких, иногда - очаги кальциноза миксомы.
Решающее значение отводится трансторакальной или чреспищеводной эхокардиографии. С помощью УЗИ сердца обнаруживается объемное образование, определяются его локализация и размеры, место прикрепления ножки и подвижность. Полученные данные уточняются путем проведения атриографии, вентрикулографии, КТ и МРТ сердца. Коронарография проводится всем претендентам на оперативное лечение в возрасте старше 40 лет.
Дифференциальная диагностика проводится с комбинированным митральным и трикуспидальным пороками сердца, инфекционным эндокардитом, аномалией Эбштейна, констриктивным перикардитом, коллагенозами, злокачественными новообразованиями сердца и других локализаций. При необходимости гистологической верификации миксомы на дооперационном этапе выполняется катетеризация сердца и эндомиокардиальная биопсия.
Лечение миксомы сердца
Радикальное лечение миксомы подразумевает хирургическое удаление внутриполостной опухоли сердца. Ввиду высокого риска тромбоэмболических осложнений и внезапной смерти показана незамедлительная операция сразу после установления диагноза.
Удаление миксомы производится из срединного продольного стернотомического доступа в условиях умеренной гипотермии и ИК. В процессе операции иссекается не только сама опухоль, но и место ее прикрепления, в связи с чем нередко требуется проведение пластики дефекта межпредсердной перегородки перикардиальной заплатой. В процессе операции крайне важно предотвратить интраоперационную эмболию фрагментами опухоли. С этой целью исключается проведение пальцевой ревизии полостей сердца; удаление опухоли осуществляется единым блоком при пережатой аорте и кардиоплегии; выполняется тщательное промывание полости сердца после удаления миксомы.
При повреждении миксомой митрального или трикуспидального клапанов выполняется их пластика или протезирование.
Прогноз
Риск внезапной смерти у больных с миксомой составляет 30%. При естественном течении заболевания продолжительность жизни не превышает 2-х лет с момента появления симптомов. Гибель пациентов, как правило, связана с опухолевой эмболией или окклюзией клапанных отверстий сердца.
После операции у большинства пациентов наступает полное выздоровление или улучшение состояния. Послеоперационные рецидивы опухоли возникают в 1-2% случаев при изолированной миксоме сердца и в 12-22% - при наследственных синдромах. При солитарных миксомах повторное возникновение опухолей, как правило, связано с неполным иссечением площадки их прикрепления.
Опухоли сердца
Опухоли сердца – разнородные по гистологическому строению новообразования, первично возникающие из тканей сердца или прорастающие в них из других органов. Опухоли сердца, в зависимости от их типа, локализации и размера, могут вызывать одышку, кашель, тахикардию, аритмии, боли за грудиной, сердечную недостаточность, тампонаду сердца, тромбоэмболии. Диагностика опухолей сердца проводится с учетом данных ЭхоКГ, рентгенографии, вентрикулографии, МРТ и МСКТ сердца, ЭКГ, биопсии. При выявлении первичных доброкачественных опухолей сердца производится их радикальное иссечение; лечение первичных злокачественных и метастатических новообразований обычно паллиативное (лучевая терапия, химиотерапия).
Опухоли сердца – гетерогенная группа новообразований, произрастающая из тканей и оболочек сердца. Опухоли могут развиваться из любых тканей сердца и возникать в любом возрасте. Новообразования могут прорастать сердечную мышцу, перикард, поражать клапаны и перегородки сердца. У плода они могут быть обнаружены с помощью фетальной эхокардиографии, начиная с 16-20 нед. внутриутробного развития. Первичные опухоли сердца встречаются в кардиологии с частотой 0,001-0,2%; вторичные (метастатические) - в 25-30 раз чаще. Все опухоли сердца несут потенциальную опасность возникновения смертельно опасных осложнений - сердечной недостаточности, аритмий, перикардита, тампонады сердца, системных эмболий.
Классификация
Опухоли сердца, представляющие самостоятельные заболевания, являются первичными; опухоли, метастазирующие по кровеносным и лимфатическим сосудам либо прорастающие из соседних органов, - вторичными. Причины развития первичных опухолей сердца неизвестны. Вторичные опухоли сердца чаще представлены метастазами рака молочной железы, желудка, легких, реже - рака щитовидной железы и почек.
По морфологическому принципу опухоли сердца подразделяются на доброкачественные (составляют 75%) и злокачественные (составляют 25%). По происхождению злокачественные новообразования могут быть как первичными, так и метастатическими, вторичными. Среди доброкачественных опухолей встречаются миксомы сердца (50-80%), тератомы, рабдомиомы, фибромы, гемангиомы, липомы, сосочковые фиброэластомы, кисты перикарда, параганглиомы и др. В число злокачественных новообразований входят саркомы, мезотелиомы перикарда и лимфомы.
К псевдоопухолям относятся инородные тела сердца, организованные тромбы, образования воспалительного характера (абсцессы, гуммы, гранулемы), эхинококковые и другие паразитарные кисты, конгломераты кальциноза. Отдельную группу составляют экстракардиальные опухоли средостения и перикарда, сдавливающие сердце.
Первичные доброкачественные опухоли сердца
Миксомы
Половина случаев среди всех первичных опухолей сердца приходится на миксому. Спорадические миксомы сердца в 2-4 раза чаще обнаруживаются у женщин. Встречается наследственный комплекс Карни с аутосомно-доминантным типом наследования, характеризующийся мультицентрическими опухолями различной локализации, – миксомами сердца, пигментными опухолями кожи, фиброаденомами молочных желез, кистами яичников, узловой дисплазией надпочечников, миксоидными опухолями яичек, аденомами гипофиза, шванномами периферических нервов.
Преимущественной локализацией миксом является левое предсердие (около 75%). Миксомы, имеющие ножку, пролабируют через митральный клапан, затрудняя опорожнение левого предсердия и заполнение желудочка во время диастолы. Макроскопически миксомы могут иметь слизевидную, твердую, дольчатую или рыхлую структуру. Неоформленные рыхлые миксомы представляют наибольшую опасность в плане развития системной эмболии.
Сосочковые фиброэластомы
Среди первичных опухолей сердца вторыми по частоте являются доброкачественные сосочковые фиброэластомы, преимущественно поражающие аортальный и митральный клапаны. Морфологически они представляют бессосудистые папилломы с ветвями, напоминающими актинии, отходящими от центрального ядра. Чаще всего они имеют ножку, однако в отличие от миксом, не вызывают дисфункции клапанов, но увеличивают вероятность эмболии.
Рабдомиомы
Рабдомиомы среди всех доброкачественных опухолей сердца составляют 20% и являются самым частым новообразованием у детей. Обычно рабдомиомы множественны, имеют интрамуральную локализацию в перегородке или стенке левого желудочка, поражают проводящую систему сердца. Течение рабдомиомы могут сопровождаться тахикардией, аритмиями, сердечной недостаточностью. Данные опухоли сердца часто ассоциированы с туберозным склерозом, аденомами сальных желез, доброкачественными новообразованиями почек.
Фибромы
Соединительнотканные опухоли сердца также, главным образом, встречаются у детей. Могут поражать клапаны и проводящую систему сердца, вызывать механическую обструкцию, имитируя клапанный стеноз, клиническую картину сердечной недостаточности, гипертрофической кардиомиопатии, констриктивного перикардита. Фибромы сердца могут являться частью синдрома базально-клеточного невуса (синдрома Горлина).
Прочие доброкачественные опухоли сердца
Гемангиомы встречаются в 5-10 % случаев всех первичных опухолей сердца. Чаще они не вызывают клинической симптоматики и выявляются при плановом обследовании. Реже внутримиокардиальные гемангиомы сопровождаются нарушениями атриовентрикулярной проводимости, а при прорастании предсердно-желудочкового узла могут приводить к внезапной смерти.
Липомы сердца могут развиваться в любом возрасте. Обычно это опухоли на широком основании, локализующиеся в эпикарде или эндокарде. Течение липом чаще бессимптомное; при достижении больших размеров они могут вызывать аритмии, нарушения проводимости, изменение формы сердца, выявляемое рентгенологически.
Феохромоцитомы могут иметь интраперикардиальную или миокардиальную локализацию, сопровождаться секрецией катехоламинов. Кисты перикарда на рентгенограммах грудной клетки часто имитируют опухоли сердца или экссудативный перикардит. Чаще они протекают бессимптомно, иногда могут вызывать симптомы компрессии органов грудной клетки.
Злокачественные опухоли сердца
Мезотелиомы перикарда относительно редки и встречаются преимущественно у мужчин. Они обычно метастазируют в плевру, позвоночник, мозг, окружающие мягкие ткани.
Первичные лимфомы чаще поражают лиц, страдающих иммунодефицитом (в т. ч. ВИЧ-инфекцией). Эти опухоли сердца склонны к чрезвычайно быстрому росту и сопровождаются сердечной недостаточностью, аритмиями, тампонадой и синдромом верхней полой вены.
Метастатические опухоли сердца чаще всего поражают перикард, реже – сердечную мышцу, эндокард и сердечные клапаны. Как и первичные опухоли сердца, они могут вызывать одышку, острый перикардит, тампонаду сердца, нарушения ритма, атриовентрикулярную блокаду, застойную сердечную недостаточность. В сердце могут метастазировать рак легких, груди, почечный рак, саркома мягких тканей, лейкоз, меланома, лимфома, саркома Капоши.
Симптомы опухолей сердца
Проявления опухолей сердца обусловлены типом новообразования, его локализацией, величиной, способностью к распаду. Внесердечные опухоли проявляются лихорадкой, ознобом, снижением массы тела, артралгией, кожными высыпаниями. При сдавлении опухолью камер сердца или венечных артерий, возникают одышка, боли в груди. Рост опухоли или кровотечение может приводить к развитию тампонады сердца.
Опухоли сердца с интрамиокардиальным ростом (рабдомиомы, фибромы), сдавливающие или внедряющиеся в проводящую систему, сопровождаются атриовентрикулярной или интравентрикулярной блокадой, пароксизмальными тахикардиями (наджелудочковыми или желудочковыми).
Внутриполостные опухоли сердца, главным образом, нарушают функцию клапанов и препятствуют току крови из камер сердца. Они могут вызывать явления митрального и трикуспидального стеноза или недостаточности, сердечной недостаточности. Симптоматика внутриполостных опухолей сердца обычно возникает при смене положения тела в связи с изменением гемодинамики и физических сил, действующих на опухоль.
Часто первыми проявлениями опухолей сердца служат тромбоэмболии в сосуды системного или легочного круга кровообращения. Опухоли из правых отделов сердца могут вызывать эмболию легочной артерии, легочную гипертензию и легочное сердце; опухоли левых отделов сердца - преходящую мозговую ишемию и инсульт, инфаркт миокарда, ишемию конечностей и др. Возникновение инфарктов внутренних органов у лиц молодого возраста при отсутствии врожденных и приобретенных пороков сердца, мерцательной аритмии и инфекционного эндокардита заставляет думать о наличии опухоли сердца.
Ввиду вариабельности клинической картины и множественности морфологических форм опухолей сердца, их диагностика является непростой задачей.
Данные ЭКГ при опухолях сердца полиморфны и малоспецифичны: они могут отражать признаки гипертрофии камер сердца, нарушения проводимости и ритма, ишемию миокарда и т. д. Рентгенография органов грудной клетки чаще всего выявляет увеличение размеров сердца и признаки легочной гипертензии. Более чувствительным методом диагностики опухолей является УЗИ сердца: с помощью чреспищеводной ЭхоКГ лучше визуализируются опухоли предсердий, путем трансторакальной ЭхоКГ – опухоли желудочков.
При сомнительных результатах диагностики выполняется МРТ и МСКТ сердца, радиоизотопное сканирование, зондирование полостей сердца и вентрикулография. Для верификации гистологической структуры опухоли сердца проводится ее биопсия в процессе катетеризации или диагностической торакотомии. При экссудативном перикардите ценную диагностическую информацию может дать цитологическое исследование жидкости, полученной при пункции перикарда. Дифференциальная диагностика опухолей сердца проводится с ВПС, миокардитом, кардиомиопатиями, перикардитом, амилоидозом сердца.
Лечение опухолей сердца
Опухоли сердца лечатся хирургическим путем. Операции при опухолях сердца могут включать удаление внутриполостной опухоли, удаление опухоли миокарда или перикарда, перикардэктомию, удаление кисты перикарда. В ходе радикальной операции производится иссечение опухоли сердца с прилежащими окружающими тканями, ушивание или пластика дефекта. Доброкачественные опухоли сердца в большинстве случаев могут быть удалены радикально. В некоторых случаях пациенты могут нуждаться в пластике или протезировании клапанов.
Удаление первичных злокачественных опухолей сердца малоэффективно. В этом случае чаще всего прибегают к частичному (паллиативному) удалению опухоли с последующим проведением лучевой или химиотерапии. При вторичных опухолях сердца лечение также паллиативное.
Удаление единичных доброкачественных опухолей сердца обычно сопровождается хорошими отделенными результатами – 3-хлетняя выживаемость составляет 95%. В дальнейшем пациентам показано наблюдение кардиолога и кардиохирурга с ежегодным проведением эхокардиографии для своевременного выявления рецидива опухоли сердца. Множественные опухоли сердца снижают выживаемость в течение ближайших 5 лет до 15 %. При первичных и метастатических опухолях сердца прогноз весьма неблагоприятный; хирургическое лечение малоэффективно, химиотерапия и лучевая терапия на прогноз практически не влияют.
Читайте также:
