Регуляция пролиферации стволовых клеток. Свойства стволовой клетки
Добавил пользователь Валентин П. Обновлено: 24.01.2026
Гематология: Стволовая кроветворная клетка (СКК) - свойства, функции, типы
Родоначальницей всех клеток крови является стволовая кроветворная клетка (СКК), которая может развиваться в различные виды зрелых клеток. Она способна к самоподдержанию, т. е. производству себе подобных клеток, не обязательно сразу после деления вступающих в дифференцировку.
Представление о наличии стволовой кроветворной клетки (СКК) и унитарной теории кроветворения, в соответствии с которой все клетки крови происходят из единой клетки-предшественницы, было сформулировано в 1909 г. профессором Военно-медицинской академии А. А. Максимовым в работе «Лимфоцит как общая постоянная клетка различных элементов крови в эмбриональном развитии и в последующей жизни млекопитающих».
Существование стволовой кроветворной клетки (СКК) в 1961 г. доказали J. E. Till и Е. A. A. McCullough с помощью культуральных исследований: было установлено, что при пересадке донорского костного мозга облученной мыши в ее селезенке развиваются очаги кроветворения, которые представляют собой потомство одной клетки (так называемой колониеобразующей единицы селезенки, или КОЕс), способной дифференцироваться по всем росткам кроветворения.
Основными свойствами популяции стволовой кроветворной клетки (СКК) являются: 1) полипотентность (возможность дифференцироваться по всем росткам кроветворения); 2) способность к самоподдержанию, которая является ключевой в концепции стволовой клетки.
В настоящее время имеются две теории, объясняющие этот феномен: 1) деление стволовой кроветворной клетки (СКК) асимметрично: из двух произведенных СКК одна является недифференцированной, другая — дифференцированной (продуцирующей зрелые клетки крови); 2) при делении стволовой кроветворной клетки (СКК) образуется либо две новых СКК, либо две более зрелых клетки (т. е. пул стволовой кроветворной клетки (СКК) поддерживается не асимметричным делением стволовых клеток, а равновесием между числом делений, увеличивающих количество СКК, и делений, связанных с появлением более зрелых клеток).
Различают два типа стволовых кроветворных клеток (СКК): первичные, или истинные, долгоживущие СКК, способные к самоподдержанию, и короткоживущие клетки, которые могут пролиферировать in vivo и воспроизводить все клетки крови, но не способны к самоподдержанию.
Изучение стволовой кроветворной клетки (СКК) затруднено в связи с их незначительным количеством — приблизительно 1 клетка на 104-106 миелокариоцитов и на 105-107 клеток периферической крови. Иммунофенотип стволовой кроветворной клетки (СКК) характеризуется экспрессией антигенов CD34, CD59, Thyl и рецептора для фактора стволовых клеток (kit), отсутствием антигенов CD33, CD38 и HLA-DR. В результате последовательных делений и дифференцировок из одной СКК образуется около 103 клеток-предшественниц и 106 зрелых клеток.
Кроме того, выделяют CD133+ гемопоэтические стволовые клетки, выявляемые среди CD34 негативных клеток. Этот маркер имеется также на ранних предшественниках эндотелиальных, мышечных и нервных клеток.
Культуральными исследованиями доказана высокая колониеобразующая способность стволовой кроветворной клетки (СКК) и их способность к длительному самоподдержанию. Направление дифференцировки стволовой кроветворной клетки (СКК) определяется кроветворным микроокружением.
Важное влияние на процессы самоподдержания и дифференцировки стволовой кроветворной клетки (СКК) оказывают гемопоэтические ростовые факторы. Некоторые из них (ИЛ-1, ИЛ-6) могут выступать как пусковой механизм, запускающий «дремлющие» СКК в пролиферацию; другие (гранулоцитарный КСФ, фактор стволовых клеток, ИЛ-3), напротив, способствуют длительному сохранению стволовой кроветворной клетки (СКК) в фазе G0.
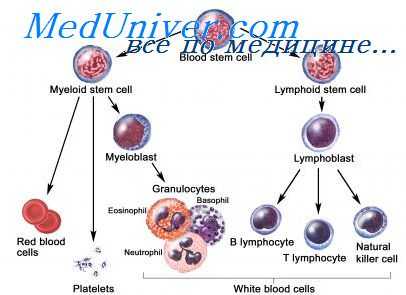
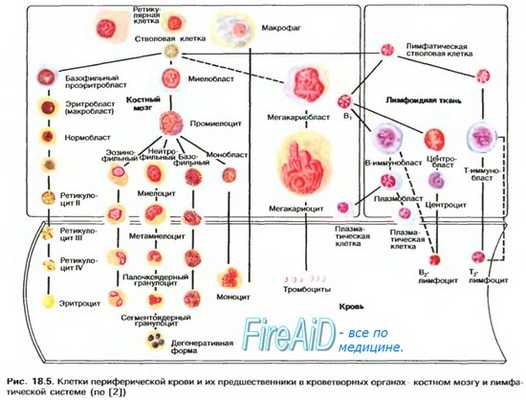
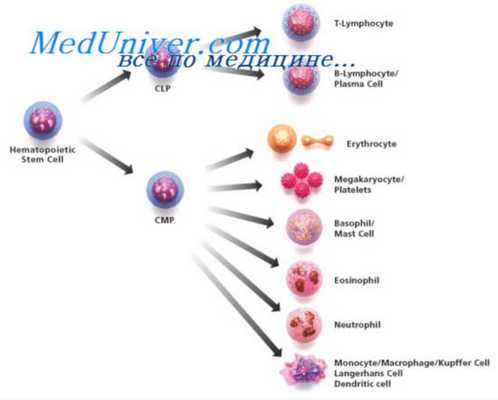
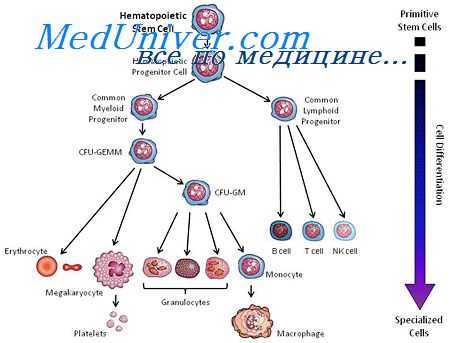
К ближайшим потомкам стволовой кроветворной клетки (СКК) относятся миелоидная и лимфоидная стволовая кроветворная клетка (СКК), которые могут дифференцироваться соответственно в клетки миелоидного и лимфоидного ряда. Следующим классом клеток-предшественниц в лимфоцитарном ряду являются пре-В- и npe-T-клетки, в миелоидном — смешанная клетка-предшественница, способная созревать в эритроидные, гранулоцитарные, моноцитарные и мегакариоцитарные клетки (КОЕ-ГЭММ).
Следующим этапом развития клеток-предшественниц являются клетки-предшественницы гранулоцитов и моноцитов (КОЕ-ГМ), гранулоцитов, эозинофилов (КОЕ-Эоз), базофилов (КОЕ-Баз), мегакариоцитов (КОЕ-Мег), эритроцитов (БОЕ-Э — бурстобразующие единицы, получившие название от английского слова «burst» — взрыв, в связи со способностью быстрого образования большого количества содержащих гемоглобин клеток), которые имеют все более низкий дифференцировочный потенциал. Морфологически все эти клетки также не отличаются от лимфоцита, и их наличие доказывается культуральными методами и иммунофенотипированием.
Самые ранние стволовые кроветворные клетки (СКК) обладают очень высоким пролиферативным потенциалом, выраженным самоподдержанием и способностью давать потомство многим направлениям дифференцировки. С возрастом общее число стволовых кроветворных клеток (СКК) не меняется. Стволовые клетки, вступившие на путь дифференцировки, называют коммитированными. Процесс коммитирования заключается в снижении способности клеток к самоподдержанию, полипотентности и определении направления дифференцировки, что приводит к образованию дифферонов.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Регуляция пролиферации стволовых клеток. Свойства стволовой клетки
Можно считать доказанным, что исходным элементом всей системы клеток крови является стволовая клетка, полипотентная, способная к многочисленным разнообразным дифференцировкам и в то же время обладающая способностью к самоподдержанию, т. е. к пролиферации без видимой дифференцировки.
Отсюда следует, что принципы управления системой кроветворения должны обеспечивать такую ее регуляцию, в результате которой при стабильном кроветворении выполняются следующие два основных условия: число продуцируемых клеток каждого типа постоянно и строго соответствует числу погибших зрелых клеток; число стволовых клеток постоянно, и образование новых стволовых клеток точно соответствует числу их, ушедших в дифференцировку.
Еще более сложные задачи решаются при стабилизации системы после возмущающего воздействия. В этом случае число образующихся стволовых клеток должно превышать число ушедших в дифференцировку до тех пор, пока величина отдела не достигает исходного уровня, после чего вновь должны быть установлены сбалансированные отношения между числом новообразующихся и дифференцирующихся стволовых клеток.
С другой стороны, дифференцировка стволовых клеток должна регулироваться так, чтобы восстановить число зрелых клеток только того ряда, который оказался уменьшенным (например, эритроидные клетки после кровопотери) при стабильной продукции других клеток. И здесь после усиленного новообразования данной категории клеток ее продукция должна быть снижена до сбалансированного уровня.
Количественная регуляция кроветворения, т. е. обеспечение образования необходимого числа клеток нужного типа в определенное время, осуществляется в последующих отделах, прежде всего в отделе коммитированных предшественников.
Стволовая клетка обладает двумя основными свойствами: способностью к самоподдержанию, достаточно длительному, сравнимому со временем существования всего многоклеточного организма, и способностью к дифференцировке. Так как последняя, видимо, необратима, «принявшая решение» о дифферсицировке стволовая клетка необратимо покидает отдел.
Итак, важнейшая проблема регуляции в этом отделе состоит в том, чтобы при повышении запроса дифференцировке нe подвергались бы все стволовые клетки, после чего регенерация кроветворения оказалась бы невозможной в связи с истощением способных к самоподдержанию элементов, так как клетки всех последующих отделов к длительному самоподдержанию не способны. Такая регуляция в организме действительно существует. После облучения в высоких дозах практически вся кроветворная система погибает. Между тем, например, у мыши, регенерация возможна после того, как облучением уничтожено 99,9% всех стволовых клеток (Bond е. а., 1965). Несмотря на огромный запрос на дифференцировку, сохранившиеся 0,1% стволовых клеток восстанавливают свое число и обеспечивают резкое повышение дифференцировки клеток последующих отделов.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Контроль дифференцировки стволовых клеток. Ускорение пролиферации стволовой клетки
Резкое повышение дифференцировки достигается прежде всего за счет ускорения пролиферации стволовых клеток. При стабильном кроветворении стволовые клетки пролиферируют медленно или вообще большая часть их находится в стадии покоя, вне клеточного цикла. При регенерации темп пролиферации стволовых клеток, или доля их, находящаяся в клеточном цикле, резко возрастает. Однако этого недостаточно для увеличения общего числа стволовых клеток.
Действительно, при стабильном кроветворении число стволовых клеток поддерживается постоянным. Это значит, что для стволовых клеток вероятность остаться стволовой клеткой (Р) из расчета на один генерационный цикл равна 0,5; в результате каждого деления в среднем на одну новообразованную стволовую клетку приходится одна ушедшая в дифференцировку стволовая клетка. Ясно, что если величина Р оставалась бы неизменной, то общее число стволовых клеток не могло бы увеличиваться.
Ускорение пролиферации привело бы только к повышению продукции зрелых клеток. Отсюда следует, что при снижении общего числа стволовых клеток регулируются два параметра— темп пролиферации стволовых клеток и вероятность для них остаться стволовой клеткой после митоза из расчета на один генерационный цикл.
Одна из наиболее интересных моделей регуляции пролиферации стволовых клеток (модель индуцирующего кроветворение микроокружения) основана на гипотезе, согласно которой пролиферация стволовых клеток происходит под влиянием специального индуктора, выделяемого микроокружением кроветворных клеток (Matioli е. а., 1973). Такие клетки равномерно распределены по кроветворным органам.
Выделяемый ими фактор нестоек и в среде не сохраняется или из среды не проникает в стволовые клетки. Поэтому передача фактора, его внутриклеточная микродиффузия, возможны только при прямом контакте «источника» со стволовой клеткой.
В результате возникает слабое взаимодействие таких двух клеток за счет стереохимической комплементарности между макромолекулярным комплексом на поверхности источника и стволовой клеткой.
Вторым следствием соединения стволовой клетки с источником является существенное повышение проницаемости мембран клеток в месте контакта, что облегчает микродиффузию фактора. Когда концентрация его внутри стволовой клетки превышает пороговый уровень, стволовая клетка делится с образованием двух новых стволовых клеток. Одна из них прямо контактирует с источником, другая — через первую стволовую клетку. Далее события повторяются, и от каждого источника стволовые клетки растут в виде ветви.
Чем дальше от источника находится стволовая клетка, тем меньше у нее шансов накопить индуктор в концентрации выше пороговой. Без фактора стволовые клетки через некоторое время подвергаются дифференцировке и, следовательно, выходят из отдела стволовых клеток. Вероятность самообновления определяется не только расстоянием стволовой клетки от источника, но и наличием других клеток. Так, скопление дифференцирующихся клеток может разорвать нить стволовых клеток, прекращая тем самым микродиффузию и дифференцируя стволовые клетки, расположенные за местом перерыва. Таким образом, в этой модели регуляция пролиферации и дифференцировки стволовых клеток осуществляется микроокружением, т. е. совокупностью локальных условий в микроучастке кроветворения, включая в эту совокупность и клеточные факторы, в частности число предшественников и более зрелых клеток, наличие популяции управляющих клеток стромального происхождения и т. д.
Стволовые клетки могут дифференцироваться в конечное состояние разными путями
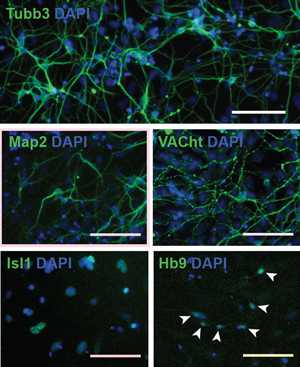
Рис. 1. Моторные (двигательные) нейроны, полученные из стволовых клеток. Голубой — DAPI, ядра клеток. Зеленый — белки, подтверждающие, что эти нейроны функциональны: Tubb3 — тубулин, белок микротрубочек в аксонах; Map2 — белок, связанный с микротрубочками; VACht — белок, транспортирующий вакуоли с нейромедиатором ацетилхолином. Изображение из обсуждаемой статьи в eLife
Дифференцировка стволовых клеток, то есть их превращение в тот или иной клеточный тип, — это сложный многоступенчатый процесс. По пути в конечное состояние клетка проходит ряд промежуточных стадий. Существует два подхода к дифференцировке клеток in vitro. Можно последовательно воспроизводить процессы, происходящие в зародыше при развитии, и постепенно вести клетку в требуемом направлении. А можно сразу экспрессировать в клетке белки, характерные для конечного состояния. Будут ли в этом случае клетки проходить все промежуточные состояния или какие-то пропустят? Или же они вообще пойдут другим путем?
Развитие зародыша от зиготы до полноценного организма можно представить в виде дороги со множеством развилок. По мере того как клетки делятся, каждая из них выбирает путь, по которому она будет двигаться дальше, то есть приобретает некоторые характерные свойства (форму, внутреннее строение и экспрессию конкретных генов). В результате множества таких последовательных «решений» клетка достигает конечного состояния — одного из клеточных типов взрослого организма со всем набором его характерных признаков. Весь этот путь клетки в целом называют дифференцировкой, а итог — дифференцированным состоянием.
В 1954 году английский биолог Конрад Уоддингтон предложил модель эпигенетического ландшафта, которая, в частности, применима и к дифференцировке стволовых клеток. Этот ландшафт выглядит как горка с параллельными разветвляющимися колеями (креодами), а клетка представляется шариком, скатывающимся по этой горке (рис. 2.). Согласно этой модели, судьба клетки определяется раз и навсегда, и изменить ее уже не получится. Чтобы клетка оказалась вместо одного органа в другом, ей нужно перескочить в соседнюю колею, что в данной модели энергетически невыгодно.
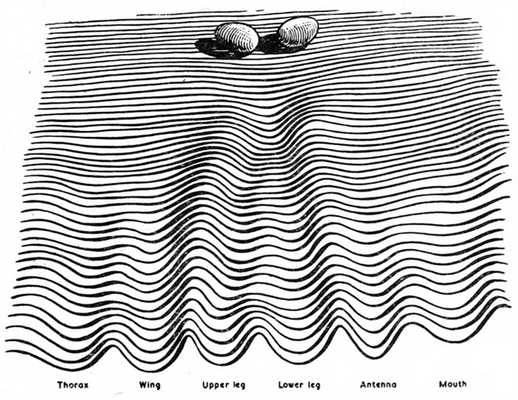
Рис. 2. Эпигенетический ландшафт Уоддингтона. Под каждой колеей указано итоговое предназначение клетки: грудь, крыло, верхняя нога, нижняя нога, антенна, рот (речь идет о развитии дрозофилы). Изображение из книги: C. H. Waddington. «Principles of embryology». NY, 1956.
Идеи Уоддингтона остаются актуальными до сих пор, однако эксперименты со стволовыми клетками подсказывают нам новые правила обращения с этим ландшафтом. Так, в 2006 году японским ученым Такахаси и Яманаке удалось «забросить камень обратно на гору» — вернуть клетки мыши из терминально-дифференцированного состояния на уровень эмбриональных стволовых клеток зародыша, из которых можно получить любой клеточный тип (см. K. Takahashi, S. Yamanaka, 2006. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors). Для этого в зрелые фибробласты мыши вводили 4 ключевых транскрипционных фактора, обеспечивающих стволовое состояние. Этот процесс назвали репрограммированием клеток. Однако сам Яманака отметил невысокую эффективность этого процесса: в первых экспериментах удавалось репрограммировать лишь 0,05% клеток.
Потом эти цифры выросли, в некоторых случаях даже до 10%, но большинство клеток всё равно не поддавалось методике (см. S. Yamanaka, 2009. Elite and stochastic models for induced pluripotent stem cell generation). Яманака предпринял попытку объяснить это через ландшафт Уоддингтона (рис. 3). Предположим, что мы пытаемся забросить шарик обратно на гору. На его пути может возникнуть несколько препятствий: он может не долететь до верха и скатиться вниз окончательно (в данном случае это означает апоптоз, то есть намеренную гибель клетки, стрелка 4), может докатиться до верха и не удержаться там (тогда клетка будет дифференцироваться снова в случайном направлении, стрелка 2) или может полететь в неправильном направлении и перескочить в соседнюю колею (дифференцироваться в другой тип, стрелка 3). И только в тех редких случаях, когда шарик долетает до верха и удерживается там, клетка репрограммируется и становится стволовой (стрелка 1).
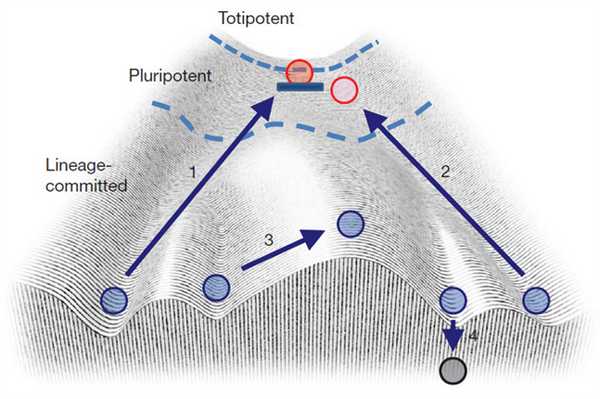
Рис. 3. Применение ландшафта Уоддингтона к репрограммированию клеток. 1 — полный возврат к эмбриональному состоянию. 2 — неудавшееся репрограммирование. 3 — переход в другой тип клеток. 4 — клеточная гибель. Изображение из статьи: S. Yamanaka, 2009. Elite and stochastic models for induced pluripotent stem cell generation
Но на этом приключения шарика на горке не заканчиваются. До недавнего времени были известны всего две основные методики работы со стволовыми клетками: дифференцировка и репрограммирование. Протоколы дифференцировки состояли из последовательного действия на клетки веществами, «направляющими» их в ту или иную сторону. Набор этих веществ определяли экспериментально, основываясь на реальных процессах развития. Если для дифференцировки клеток нервной системы на некоторой стадии в зародыше мыши нужна ретиноевая кислота, то и в лаборатории можно добавить ее в среду культивирования для получения нейронов. Теперь представим себе, что мы хотим получить, например, культуру нейронов человека. Можно взять его клетки кожи, репрограммировать до эмбриональных стволовых клеток, а затем дифференцировать в нейроны. Это оказывается долго и неэффективно, поэтому давно идет поиск более короткого пути.
Коротких путей обнаружилось два — прямая дифференцировка и трансдифференцировка. В ходе прямой дифференцировки предлагается получить нейроны из эмбриональных стволовых клеток без промежуточных стадий. Трансдифференцировка же предполагает получение нейронов напрямую из клеток кожи. Отметим сразу, что клеточные типы здесь даны как примеры, реально они могут быть практически любыми. Эти короткие пути осуществляются одним способом: в культуре исходных клеток (стволовых или дифференцированных) запускается экспрессия транскрипционных факторов, характерных для нужного клеточного типа (в данном случае, нейронов). Эффективность этих методов пока остается невысокой, однако оба они работают. Поэтому возникает множество вопросов: насколько функциональны полученные таким образом клетки? Какие механизмы лежат в основе ускоренной дифференцировки? Что при этом происходит с промежуточными стадиями, исчезают ли они полностью или частично сохраняются? Этими вопросами и задались авторы обсуждаемой статьи (рис. 4).
Рис. 4. Исследовательские вопросы авторов обсуждаемой статьи. а) Как в случае прямой дифференцировки обходятся промежуточные стадии? Возможные варианты: все стадии присутствуют, некоторые стадии пропущены, появляются альтернативные стадии. b) Какие из промежуточных стадий исчезают? Возможные варианты: самые ранние, самые поздние, весь путь отличается от классического. с) Получаются ли в результате прямой дифференцировки полноценные функциональные клетки? Возможные варианты: полное или частичное достижение эффекта. Изображение из обсуждаемой статьи в eLife
Авторы работали с эмбриональными стволовыми клетками мыши. Они запустили параллельно стандартный протокол последовательной дифференцировки и прямую дифференцировку в моторные нейроны спинного мозга. Чтобы отследить, на каких стадиях находятся клетки, они анализировали РНК в отдельных клетках на ранних (4–5 день) и поздних (11–12 день) стадиях дифференцировки. Затем исключали клетки, от которых получено слишком мало РНК, и те, у которых обнаруживали повышенную экспрессию митохондриальных генов, связанных со стрессом: эти клетки, возможно, развивались аномально. В оставшихся клетках вычисляли гены, экспрессия которых статистически значимо менялась в ходе дифференцировки.
Это позволило определить основные стадии, через которые проходили клетки. При стандартном протоколе дифференцировки путь получился следующим: эмбриональные стволовые клетки — общие нейральные предшественники — клетки заднего отдела нервной системы — клетки брюшной стороны заднего отдела — предшественники моторных нейронов — ранние моторные нейроны — поздние (зрелые) моторные нейроны. При этом в культуре можно было обнаружить несколько стадий одновременно, так как клетки дифференцируются асинхронно. Ученые обнаружили, что при использовании стандартного протокола до поздних стадий доходило меньше клеток, чем при прямой дифференцировке, а также больше клеток отклонялось от намеченного пути и превращалось в другие типы. В то же время при прямой дифференцировке не удалось обнаружить двух стадий: клетки не приобретали постепенно свойств заднего и брюшного отделов нервной системы (рис. 5). При этом начальные и конечные стадии в обоих протоколах оказались очень похожими. Итогом стали полноценные и функциональные моторные нейроны.
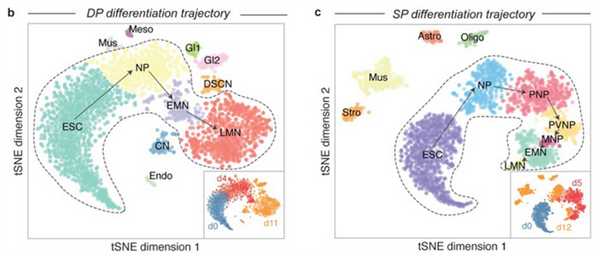
Рис. 5. Последовательные стадии, которые проходят клетки при прямой (b) и постепенной (с) дифференцировке. По осям отложены статистические показатели, отражающие экспрессию характерных для разных стадий групп генов. Клетки с близкими значениями этих показателей считали находящимися на одной стадии. Обозначения стадий: ESC — эмбриональные стволовые клетки, NP — общие нейральные предшественники, PNP — клетки заднего отдела нервной системы, VNP — клетки брюшной стороны заднего отдела, MNP — предшественники моторных нейронов, EMN — ранние моторные нейроны, LMN — поздние (зрелые) моторные нейроны. Изображение из обсуждаемой статьи в eLife
Это отличие прямой дифференцировки от стандартной наглядно показывает нам разницу между развитием клетки в эмбрионе и в культуре. В целостной системе, такой как зародыш, на ранних этапах возникает разметка плана строения, и только после этого начинается окончательная дифференцировка. Вероятно, это необходимо для адекватного взаимодействия между тканями и разными типами клеток в эмбрионе. В то же время эти стадии оказываются не критичными для последующего формирования функционального нейрона, если идет речь о культуре, где клетки не взаимодействуют с окружением. При прямой дифференцировке клетки проходили стадию, нехарактерную для стандартного протокола: в них включались гены переднего мозга. Впрочем, к поздним стадиям их экспрессия исчезала, и конечные стадии дифференцировки в обоих протоколах оказались очень похожими.
Технология прямой дифференцировки вызывает много вопросов и споров. Несмотря на ее эффективность, прежде чем использовать ее на практике, необходимо убедиться в том, что «нестандартные» пути развития клеток не привносят в них никаких побочных свойств. Авторы обсуждаемой статьи полагают, что стадия терминально-дифференцированной клетки относится к числу так называемых «бассейнов притяжения» (см. Basin of attraction), то есть устойчивых состояний, к которым стремятся все незначительно отличающиеся состояния и которые устойчивы к умеренным колебаниям окружающей среды. Это означает, что если в результате дифференцировки каким-либо образом будет достигнута экспрессия ключевых транскрипционных факторов, то клетка так или иначе придет к конечному состоянию. И вероятность того, что она в последний момент пойдет по другому пути, крайне мала. Если это действительно так, то можно ожидать, что короткие пути дифференцировки вскоре вытеснят длинные и традиционные, увеличив эффективность процесса и приблизив нас к использованию этих технологий в медицине.
Источник: James Alexander Briggs, Victor C. Li, Seungkyu Lee, Clifford J. Woolf, Allon Klein, Marc W. Kirschner. Mouse embryonic stem cells can differentiate via multiple paths to the same state // eLife. 2017. V. 6. P. e26945. Doi: 10.7554/eLife.26945.
Новая парадигма стволовых клеток
Классические представления о гемопоэтических стволовых клетках (ГСК) основываются на том, что поддержание количества клеток крови осуществляется уникальной клеточной популяцией со строго определенным набором характеристик: малочисленность популяции, экспрессия специфических маркеров, состояние «покоя», самообновление за счет асимметричного деления (одна из дочерних клеток полностью идентична материнской, вторая — вступает на путь дифференцировки до зрелой клетки и утрачивает стволовые свойства), однонаправленная дифференциация (невозможность вернуться в мультипотентное состояние и неизбежная гибель) [1, 2]. Эта иерархическая модель послужила стереотипным шаблоном в биологии стволовых клеток и долгое время считалась эталонной. Однако поиски популяции «профессиональных» стволовых клеток в большинстве других тканей не увенчались успехом. В связи с этим возник новый, более широкий подход к пониманию «стволовости» клетки: основополагающим моментом становится способность заменять погибшие клетки. Природа такой клетки может быть различной в условиях устойчивого состояния и в период регенерации тканей [3].
Регенеративный потенциал имеют весьма обильно представленные в конкретной ткани клоны клеток. Например, базальные клетки эпидермиса способны продуцировать клоны, которые со временем меняют форму и размеры, а также способны сохраняться в течение очень длительных периодов [4]. Обнаружение этого факта стало одним из первых поводов усомниться в том, что редкость (малочисленность), асимметричное деление или состояние покоя являются универсальными характеристиками стволовых клеток ткани взрослого организма.
Впоследствии в тканях других активно обновляющихся органов, структура которых включает большие популяции активно пролиферирующих клеток, также были обнаружены регенеративные способности. К таким органам относятся пищевод, кишечные крипты, железы слизистой оболочки желудка и яичко [5]. Как и в эпидермисе, пролиферативные клетки в каждом из этих компартментов имеют потенциал к генерации долгоживущей клеточной линии. Эти постоянно пролиферирующие клетки вынуждены конкурировать за ограниченное пространство стволовой ниши. Активное деление одной клетки может привести к вытеснению соседа, причем этот процесс носит стохастический (случайный) характер. Такая конкуренция в итоге формирует ткань, которая постоянно теряет клоны стволовых клеток, в то время как оставшиеся в нише клоны-«победители» становятся все многочисленнее [6].
Активно делящиеся потенциальные стволовые клетки в этих тканях не соответствуют классическим характеристикам ГСК. Они представлены в органе в изобилии и постоянно делятся по принципу симметричной модели (обе дочерние клетки идентичны материнской). Становится ли каждая из этих двух дочерних клеток фактически стволовой зависит от их местонахождения относительно нишевого пространства. Их продолжительность жизни не предопределена и может быть крайне вариабельна [7].
Поддержание относительного постоянства данной популяции стволовых клеток обеспечивается микроокружением, главным образом, размерами стволовой ниши.
Необратимость процесса клеточной дифференцировки также не абсолютна. Существует пул так называемых резервных стволовых клеток. Он формируется из частично или даже полностью дифференцированных клеток при повреждении тканей (рис. 1) [5, 8, 9]. Такая экстренная мобилизация клеток характерна для печени. Помимо гепатоцит-индуцированной регенерации, потенциально стволовой клеткой является и холангиоцит. Когда различные токсины, вирусы или наследственные дефекты метаболизма приводят к повреждению практически всех гепатоцитов, в ткани печени возле желчных протоков обнаруживаются клетки, экспрессирующие маркеры дедифференцировки (эпителиальную молекулу клеточной адгезии EpCAM или транскрипционный фактор Sox9). Эти овальные клетки (или атипичные протоковые клетки) обеспечивали регенерацию обоих типов клеток (как холангиоцитов, так и гепатоцитов) in vivo на мышиных моделях, у которых пролиферация гепатоцитов генетически заблокирована. «Профессиональных» стволовых клеток в печени не обнаружено, и ее уникальная способность к регенерации обеспечивается за счет пластичности двух эпителиальных клеточных линий — гепатоцитов и холангиоцитов [8, 9].
.
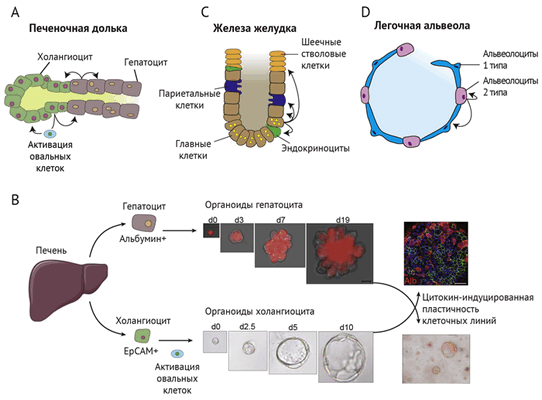
(A) Печень: производные энтодермы (холангиоциты и гепатоциты) имеют способность пролиферировать и восстанавливать оба типа клеток.
EpCAM+ — молекула клеточной адгезии эпителия
Альбумин+ — экспрессия специфичного для гепатоцитов белка
(B) Клональные органоиды, полученные из гепатоцитов [7] или холангиоцитов [8], могут длительно пролиферировать (на рисунке d – срок культивирования в днях) и трансдифференцироваться между собой.
(C) Дифференцированные главные клетки могут вносить вклад в обновление всех других типов клеток в железах желудка.
(D) В альвеолах альвеолоциты типа 2 (большие или гранулярные) могут действовать как резервные стволовые клетки и генерировать как тип 2, так и тип 1 (плоские или респираторные) [5].
Плюрипотентные стволовые клетки (эмбриональные стволовые клетки, а также
индуцированные плюрипотентные стволовые клетки) могут быть культивированы в течение длительных периодов времени, находясь в состоянии постоянной пролиферации. Отсутствие у данного типа клеток состояния покоя не исключает их способности служить источником всех типов тканей здоровой мыши при инъекции в бластоцисту [5].
Из приведенных примеров становится ясно, что клеточные парадигмы одной системы организма не должны быть экстраполированы на другие. Ткани значительно различаются по размерам клеток и гистоархитектонике, они имеют уникальные физиологические функции и подвергаются различным физическим, химическим и биологическим изменениям. Нет веских оснований предполагать, что эволюция «оснастила» каждый из наших органов универсальным механизмом поддержания целостности тканей. Более вероятно наличие индивидуальных «смарт»-стратегий функционирования стволовых клеток в каждом компартменте.
Читайте также:
- Переезд пешеходов грузовиками. Механизмы травм при переезде пешехода
- Признаки повреждения медиальных связок голеностопного сустава на артрограмме
- Признаки травмы коллатеральной связки пальцев кисти
- Рентгенограмма, КТ, МРТ при артрозе дугоотростчатых суставов шейных позвонков
- Диагностика подострой субдуральной гематомы по КТ, МРТ
