Регуляция расслабления миокарда. Разделение актин-миозиновых комплексов миокарда
Добавил пользователь Владимир З. Обновлено: 20.01.2026
Волгоградское областное бюро судебно-медицинской экспертизы
Сравнительный анализ сократительной способности сердца при некоторых причинах смерти
Журнал: Судебно-медицинская экспертиза. 2013;56(4): 46‑50
Резник А.Г. Сравнительный анализ сократительной способности сердца при некоторых причинах смерти. Судебно-медицинская экспертиза. 2013;56(4):46‑50.
Reznik AG. The comparative analysis of cardiac contractility associated with certain causes of death. Sudebno-Meditsinskaya Ekspertisa. 2013;56(4):46‑50. (In Russ.).
Представлен сравнительный анализ структурных изменений саркомеров кардиомиоцитов при некоторых причинах смерти методом поляризационной микроскопии. Рассмотрены основные причины снижения сократительной способности и остановки сердца в случаях изолированной черепно-мозговой травмы, при острых формах ишемической болезни сердца (острой коронарной недостаточности и острого инфаркта миокарда в донекротической стадии), пневмонии и странгуляционной механической асфиксии (вследствие полного повешения с наложением петли на передней поверхности верхней трети шеи и заднебоковым расположением узла).

Одной из функций сердца является сократимость — способность сокращаться под влиянием импульсов и выполнять функцию насоса. Элементарной сократительной единицей сердечного мышечного волокна (кардиомиоцит) является саркомер — участок миофибриллы, ограниченный с двух сторон темными линиями, так называемыми Z-линиями. Расстояние между Z-линиями зависит от степени сокращения или растяжения мышц и составляет от 1,6 до 2,2 мкм. Саркомер состоит из равномерно чередующихся светлых — анизотропных (А) и темных — изотропных (I) полос (дисков), придающих волокнам миокарда характерный исчерченный вид (рис. 1). Рисунок 1. Равномерное чередование анизотропных дисков, участки очаговых субсегментарных контрактурных повреждений кардиомиоцитов при ЧМТ с быстрым темпом наступления смерти. Поляризационная микроскопия. Ув. 640. А-диски расположены в центре, образованы толстыми миозиновыми нитями. I-диски состоят из тонких нитей, содержащих актин, тропониновый комплекс (I, T, С), тропомиозин, титин и составляют половину ширины А-дисков [1—6].
Сокращение кардиомиоцитов является энергозависимым процессом, регулируется кальцием, аденозинтрифосфатом и сбалансированным содержанием калия, натрия, магния в миокарде [3, 7—12]. Сила сокращения сердечной мышцы зависит от ее исходной длины. Наиболее мощное сокращение саркомера наблюдают при длине 2,2 мкм. Именно при такой его длине расположение анизотропных и изотропных дисков по отношению друг к другу наиболее благоприятно для их взаимодействия, что обусловливает максимальную инотропную функцию миокарда (закон Франка—Старлинга) [4, 13—15].
Получены экспериментальные данные, что в сердечной мышце длина саркомера прямо пропорциональна длине мышцы. Если длина саркомера увеличивается до 3,65 мкм, то тонкие нити полностью выходят за пределы А-полосы и создаваемое напряжение падает до нуля. По мере уменьшения длины саркомера до 2,0—1,5 мкм I-диски сначала сужаются, а затем исчезают, в то время как ширина А-дисков остается постоянной. В этот момент Z-линии упираются в края А-полос и создаваемое напряжение приближается к нулю. В таких случаях возможны скручивание тонких нитей и их двойной перегиб. Одновременно снижается чувствительность тропонин-актинового комплекса к ионам кальция, а следовательно, и сила мышечного сокращения [16—18].
Оценку степени сокращения саркомера и его патоморфологических изменений целесообразно проводить с помощью поляризационной микроскопии. При смерти от различных причин отмечают следующие стереотипные самостоятельные типы острой патологии сердечных мышечных волокон: 1) контрактурный тип повреждения (сегментарные и субсегментарные контрактуры); 2) внутриклеточный миоцитолиз; 3) глыбчатый распад миофибрилл; 4) цитолиз; 5) релаксация; 6) трещины; 7) диссоциация [5, 19—21].
Для контрактурного типа повреждения кардиомиоцитов характерны избыточное сокращение миофибрилл и различная степень укорочения или исчезновение I-дисков. Сегментарные контрактуры захватывают всю мышечную клетку, а субсегментарные отличаются сокращением отдельных групп саркомеров. При сегментарных контрактурах I степени происходит незначительное сближение А-дисков, длина саркомеров сохраняется или несколько уменьшается, высота I-дисков не претерпевает изменений. Развитие контрактур II степени сопровождается укорочением саркомеров за счет уменьшения высоты I-дисков. Поперечная исчерченность кардиомиоцитов сохраняется. При контрактурах III степени I-диски полностью исчезают, А-диски сливаются в сплошной светящийся конгломерат, поперечная исчерченность сердечных мышечных волокон не различается [5, 19, 21—23].
Глыбчатый распад миофибрилл характеризуется распадом миофибрилл на глыбки в результате очагового мозаичного лизиса и контрактуры отдельных групп саркомеров. Внутриклеточный миоцитолиз проявляется дезагрегацией и лизисом миофибрилл на отдельном участке кардиомиоцита; перифокально участки мышечного волокна сохраняют поперечную исчерченность. Такая поляризационная микроскопическая картина получила название «вид ткани, изъеденной молью». Цитолиз выражается в том, что во внешне неизмененных мышечных клетках за счет разрушения I-дисков миофибрилл происходит постепенное исчезновение поперечной исчерченности [5, 19, 21, 22].
Релаксация кардиомиоцитов характеризуется увеличением высоты I-диска, при этом высота А-диска не меняется. Трещины сердечных мышечных волокон верифицируют по наличию тонких поперечных прямых или ступенчатых трещин по ходу сердечного мышечного волокна. Диссоциация кардиомиоцитов связана с расширением Z-полос. Контрактуры III степени, глыбчатый распад и внутриклеточный миоцитолиз считают необратимыми. Маркерами фибрилляции желудочков сердца являются участки трещин и диссоциации кардиомиоцитов. Морфологические проявления асистолии до настоящего времени не выявлены [19, 24—28].
В премортальном периоде нарушение сократительной способности миокарда сопровождается прогрессирующим снижением артериального давления. Несмотря на все разнообразие причин смерти, все они группируются в 4 типа терминальных состояний: мозговой, сердечный, легочный и смешанный. Дисбаланс электролитов в миокарде обусловливает его электрическую нестабильность. Прекращение сердечной деятельности наступает от фибрилляции желудочков сердца (98% всех случаев) или в виде асистолии [24, 26—31]. Рассмотрим некоторые причины смерти.
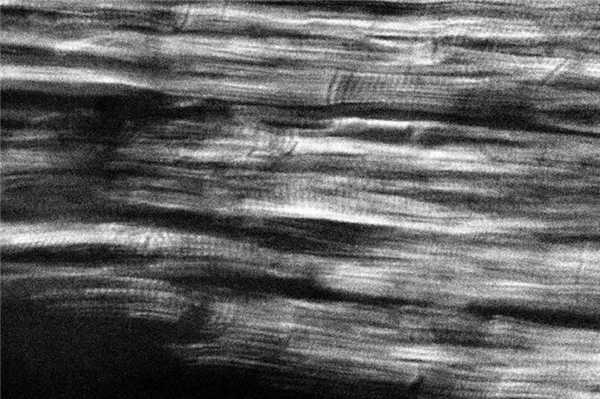
У погибших от изолированной черепно-мозговой травмы (ЧМТ), сопровождавшейся быстрым наступлением смерти вследствие повреждения ствола головного мозга, в поляризационной картине преобладает равномерное чередование анизотропных дисков в обоих желудочках сердца (см. рис.1), что соответствует физиологическому строению саркомера. При ЧМТ с непродолжительным премортальным периодом в миокарде левого и правого желудочка превалируют очаговые субсегментарные и сегментарные контрактуры кардиомиоцитов I степени (рис. 2). Рисунок 2. Контрактурные повреждения кардиомиоцитов I степени, очаговые субсегментарные контрактуры, трещины и диссоциация кардиомиоцитов при ЧМТ с переживанием. Поляризационная микроскопия. Ув. 500. Указанные изменения отражают минимальную степень гиперсокращения саркомеров. Независимо от темпа наступления смерти во всех случаях обнаруживали маркеры фибрилляции желудочков сердца, а показатели перикардиальной жидкости (концентрация глюкозы, натрия, калия, кальция и магния) указывали на отсутствие изменения углеводного и минерального обмена в миокарде [32—34]. Следовательно, у погибших по мозговому типу терминального состояния в случаях изолированной ЧМТ независимо от продолжительности премортального периода остановка сердца не связана с потерей сократительной способности миокарда. Она обусловлена нарушением его иннервации со стороны центральной нервной системы (ЦНС) с последующим возникновением фибрилляции желудочков сердца (фибрилляция желудочков центрального генеза).
У скончавшихся от острой ишемической болезни сердца (ИБС) при поляризационной микроскопии в левом желудочке сердца выявляли маркеры ишемического повреждения миокарда. В случаях острой коронарной недостаточности (ОКН) они представляли контрактурные повреждения кардиомиоцитов III степени (рис. 3), Рисунок 3. Контрактурные повреждения кардиомиоцитов II—III степени, участки релаксации, трещины и диссоциация кардиомиоцитов при ОКН. Поляризационная микроскопия. Ув. 500. при остром инфаркте миокарда в донекротической стадии (ОИМДС) — сочетание контрактур III степени с зонами внутриклеточного миоцитолиза (рис. 4) Рисунок 4. Внутриклеточный миоцитолиз кардиомиоцитов при ОИМДС. Участки растворения миофибрилл имеют вид «ткани, изъеденной молью». Поляризационная микроскопия. Ув. 640. и глыбчатого распада миофибрилл [34—37]. Указанные изменения необратимы и связаны с полным исчезновением темных I-дисков в структуре саркомера вследствие распада тропонинового комплекса. Исследованию сердечных тропонинов при ИБС посвящено много научных работ [38—42], однако взаимосвязь между наличием сердечного тропонина I в перикардиальной жидкости и микроскопическими изменениями миокарда при острых формах ИБС была установлена [36].
Дополнительно, как при ОКН, так и при ОИМДС, в левом желудочке сердца обнаруживали зоны контрактурных изменений II степени и релаксации кардиомиоцитов, маркеры фибрилляции сердечных мышечных волокон.
В правом желудочке при обеих формах маркеры ишемического повреждения отсутствовали. Преобладали участки трещин и диссоциации кардиомиоцитов, а также контрактуры сердечных мышечных волокон I—II степени, очаговые субсегментарные контрактуры и релаксация саркомеров [34, 37, 43]. Феномен релаксации кардиомиоцитов как признак, сопутствующий ишемии миокарда, описан только для левого желудочка сердца [21, 25, 28, 45].
При ОКН распространение маркеров ишемического повреждения миокарда левого желудочка имеет «мозаичный» характер. Ишемический процесс поражает одновременно не менее трех его областей на различной глубине: в субэпикардиальных, субэндокардиальных и интрамуральных отделах. У умерших от ОИМДС появление маркеров ишемии носит очаговый характер и обычно ограничивается одной—двумя смежными областями левого желудочка. Преобладало трансмуральное поражение стенки миокарда, реже встречались субэндокардиальные или субэпикардиальные очаги. В правом желудочке зоны гиперсокращения и релаксации кардиомиоцитов локализовались в трех топографических областях, причем наиболее часто встречались в субэндокардиальных отделах миокарда. Менее часто они захватывали интрамуральные зоны, реже их наблюдали субэпикардиально [34, 37, 43].
Исследование перикардиальной жидкости при ОКН и ОИМДС установило дисбаланс электролитов с повышением содержания калия, кальция и магния, снижением концентрации натрия. У скончавшихся от ОКН нарушение углеводного обмена характеризовалось повышением содержания глюкозы, а при ОИМДС ее снижением. Отличие между острыми формами ИБС обусловлено длительностью ишемического периода [33, 34, 44].
Итак, при ОКН и ОИМДС нарушение углеводного обмена и электролитный дисбаланс обусловливают электрическую нестабильность миокарда. В левом желудочке сердца участки гиперсокращения (контрактуры II степени), распада саркомеров (контрактуры III степени, зоны внутриклеточного миоцитолиза и глыбчатого распада миофибрилл) чередуются с очагами релаксации (увеличение длины саркомеров) сердечных мышечных волокон, что обусловливает необратимую потерю его сократительной способности. В правом желудочке сердца зоны гиперсокращения (контрактуры сердечных мышечных волокон I—II степени, очаговые субсегментарные контрактуры) также сочетаются с релаксацией саркомеров кардиомиоцитов. Следствием указанных процессов является асинхронное сокращение миокарда левого и правого желудочков сердца.
Асинхронное сокращение миокарда на фоне его электрической нестабильности, по мнению ряда авторов [46—49], является причиной возникновения фибрилляции желудочков по механизму повторного входа возбуждения (re-entry). Принимая во внимание, что маркеры фибрилляции выявлены в обоих желудочках сердца одновременно, есть все основания считать, что участки потери сократительной способности миокарда как в зонах ишемического повреждения, так и в очагах релаксации кардиомиоцитов являются триггерными зонами возникновения фибрилляции желудочков [43].
Таким образом, при острых формах ИБС, которая характеризуется сердечным типом терминального состояния, остановка сердца связана с распадом структур саркомеров кардиомиоцитов и необратимой потерей его сократительной способности, что в конечном счете обусловливает возникновение фибрилляции желудочков сердца (фибрилляция желудочков кардиального генеза).
При пневмонии с помощью поляризационной микроскопии выявили маркеры фибрилляции — участки трещин и диссоциации кардиомиоцитов, а также сочетание контрактур I и II степени с релаксацией сердечных мышечных волокон в левом и правом желудочках сердца. Поляризационные изменения одновременно локализовались в передней, боковой и задней стенках левого желудочка, а также передней, боковой и задней стенках правого желудочка. Чаще других они захватывали субэндокардиальные отделы, реже интрамуральные и с наименьшей частотой встречались в субэпикардиальных зонах [34].
Исследование перикардиальной жидкости выявило нарушение углеводного (снижение концентрации глюкозы) и белкового (повышение содержания мочевины) обмена, дисбаланс электролитов (увеличение содержания магния и калия, снижение концентрации натрия) [33, 34]. Эти процессы вызваны нарушением вентиляционных, перфузионных и фильтрационных процессов в легких, нарушением проходимости дыхательных путей и гемодинамики малого круга кровообращения. Изменение газового состава крови со снижением концентрации в ней кислорода обусловливает гипоксию тканей и органов, нарушение деятельности дыхательного и сосудодвигательного центров продолговатого мозга. Повышение концентрации мочевины связано с катаболизмом белков в организме и ее усиленным синтезом в печени, а перикардиальная жидкость представляет собой ультрафильтрат крови и межклеточной жидкости [29, 31, 40—42, 50].
Таким образом, при пневмонии, которая характеризуется легочным типом терминального состояния, чередование зон гиперсокращения и релаксации саркомеров кардиомиоцитов (в разных топографических областях и на различной глубине стенки) обусловливает асинхронное сокращение миокарда левого и правого желудочков и последующее снижение сократительной способности сердца. Дисбаланс электролитов приводит к электрической нестабильности миокарда, а дисфункция дыхательного и сосудодвигательного центров продолговатого мозга вызывает нарушение его иннервации со стороны ЦНС. Следовательно, остановка сердца обусловлена фибрилляцией желудочков смешанного генеза.
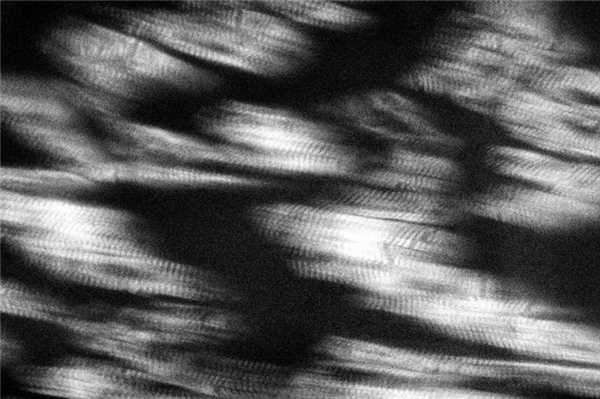
У погибших от странгуляционной механической асфиксии (СМА) вследствие полного повешения с наложением петли на передней поверхности верхней трети шеи и заднебоковым расположением узла исследование микропрепаратов в поляризованном свете установило наличие распространенных субсегментарных контрактур в левом и правом желудочках сердца (рис. 5). Рисунок 5. Распространенные субсегментарные контрактурные повреждения и зоны релаксации кардиомиоцитов при смерти от странгуляционной механической асфиксии. Поляризационная микроскопия. Ув. 640. В левом желудочке они чаще всего встречались в интрамуральных отделах, а в правом наиболее часто отмечались в субэндокардиальных зонах, реже в интрамуральных и еще реже в субэпикардиальных отделах. В обоих желудочках распространенные субсегментарные контрактуры чередовались с зонами релаксации сердечных мышечных волокон и маркерами фибрилляции желудочков. Исследование перикардиальной жидкости выявило повышение содержания глюкозы, калия, магния и кальция, снижение содержания натрия [32—34].
В настоящее время установлено, что при СМА вследствие полного повешения происходит резкое изменение газового состава крови со снижением в ней концентрации кислорода и накоплением углекислоты, токсичных недоокисленных продуктов метаболизма. Активация симпатико-адреналовой и гипофизарно-надпочечниковой систем, резкая гипоксия организма повышают автоматизм сердца, возбудимость и сократимость миокарда обоих желудочков, значительно увеличивая их потребность в кислороде. Раздражение рецепторов блуждающего нерва шеи угнетает образование импульсов в синоатриальном узле, снижает сократимость кардиомиоцитов. Итогом всех этих процессов является прогрессирующая гипоксия миокарда. Токсическое действие углекислоты и снижение парциального давления кислорода в крови действуют на сосудодвигательный центр продолговатого мозга. Смерть наступает по смешанному типу терминального состояния — мозговому и сердечному [30, 51—53].
Следовательно, в рассмотренных случаях смерти от СМА участки гиперсокращения и расслабления саркомеров кардиомиоцитов в разных топографических областях и на различной глубине стенки вызывают асинхронное сокращение миокарда левого и правого желудочков с последующим снижением сократительной способности сердца. Изменение углеводного обмена и дисбаланс электролитов приводят к электрической нестабильности миокарда. Резкая гипоксия способствует расстройству деятельности дыхательного и сосудодвигательного центров продолговатого мозга и дезорганизации его иннервации со стороны ЦНС. В связи с этим есть все основания считать, что остановка сердца обусловлена фибрилляцией желудочков смешанного генеза.
Таким образом, при изолированной ЧМТ прекращение сердечной деятельности происходит без потери его сократительной способности за счет нарушения иннервации со стороны ЦНС. При острых формах ИБС (ОКН и ОИМДС) потеря сократительной способности сердца обусловлена необратимым распадом сократительных структур саркомеров кардиомиоцитов левого желудочка, чередованием зон гиперсокращения и релаксации кардиомиоцитов правого желудочка с последующим асинхронным сокращением миокарда обоих желудочков. В случаях пневмонии и СМА (вследствие полного повешения с наложением петли на передней поверхности верхней трети шеи и заднебоковым расположением узла) снижение сократительной способности сердца обусловлено чередованием зон гиперсокращения и релаксации сердечных мышечных волокон с последующим возникновением асинхронного сокращения левого и правого желудочков сердца.
Приведенные данные получены с помощью дополнительного метода исследования — поляризационной микроскопии, которую необходимо широко внедрять в практическую деятельность бюро судебно-медицинской экспертизы. Результаты исследований необходимо использовать при решении вопросов судебно-медицинской экспертной практики.
Регуляция расслабления миокарда. Разделение актин-миозиновых комплексов миокарда
Психогенные причины соматических заболеваний. Невроз органа
Вопрос о том, какие соматические заболевания могут быть обусловлены психогенными факторами, не является окончательно разрешенным. Мнения клиницистов по этому поводу расходятся. К. М. Быков и И. Т. Курцин считают, что прямым доказательством кортико-висцерального генеза того или иного заболевании является возможность возникновения этого заболевания в процессе развития экспериментального невроза.
Нами указывалось выше, что подобные доказательства уже были получены в отношении гипертонической болезни, язвы желудка, спазма коронарных сосудов. Несомненно, что роль психогенных факторов в патогенезе заболеваний может быть различной, они могут быть основной причиной заболевания или осложнять заболевания, обусловленные другими причинами.
Одним из путей выяснения роли высших отделов нервной системы в течении соматического заболевания является изучение особенностей высшей нервной деятельности в процессе болезни. В экспериментальных исследованиях, посвященных этому вопросу, наметилась взаимосвязь и взаимозависимость между нарушениями высшей нервной деятельности и тяжестью течения болезни.
Для описываемого нового направления медицины большой интерес представляют функциональные заболевания внутренних органов, так называемые неврозы органов. Изучением этого вопроса занимаются патофизиологи, невропатологи и терапевты. Мнение представителей этих специальностей сходится на том, что неврозы органов нельзя рассматривать как изолированное заболевание органа или системы. Оно является лишь одним, иногда ведущим симптомом общего нервного расстройства.
А. Г. Иванов-Смоленский (19526) считает, что развитие невроза органа связано с особенностью конфликта, вызвавшого невроз, а. также с относительной неполноценностью данного органа. В ходе развития нервного заболевания и вегетативной нервной системе устойчиво фиксируются явления патологической застойности, которые обусловливают стойкую неполноценность деятельности органа и системы. В подобных случаях нарушения функции органа могут выявляться и на фоне относительно компенсированного общего невроза. Однако в особо трудных жизненных условиях вновь отчетливо выступают явления общего невротического расстройства. Эти взгляды хорошо согласуются со всеми данными, полученными в ходе изучения экспериментальных неврозов у животных.
В настоящее время в зарубежных странах получило широкое распространение так называемое психосоматическое направление медицины, которое также придает большое значение психогении в патогенезе соматических заболеваний. Представителями этого направления накоплен богатый клинический материал, подтверждающий правильность этого положения. Однако при объяснении развития заболеваний теоретики психосоматической медицины базируются на идеалистических концепциях школы Фрейда и его последователей, что лишает нх возможности вскрыть физиологические механизмы изучаемых явлений.
В заключение укажем, что в настоящее время ужо имеются материалы, свидетельствующие о том, что при органических и функциональных заболеваниях изменяется реакция пораженных органов и систем на условнорефлекторные раздражители. Так, в определенной стадии гипертонической болезни безусловные сосудистые рефлексы оказываются еще не измененными, тогда как образование сосудистых условных рефлексов нарушено (Быков и Курцин, 1960). По данным Л. Я. Балонова (1959), у больных, страдающих пороком сердца, своеобразно изменен весь ход выработки условных сердечных рефлексов. Нам представляется, что анализ изменений безусловной и условнорефлекторной деятельности в ходе болезни должен способствовать выяснению роли кортикальных влияний в возникновении и развитии заболевания. В этом направлении проведено и наше исследование.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Релаксация левого желудочка находится под тройным контролем систолической нагрузки: инактивации миофибрилл; равномерности распределения нагрузки; инактивации в пространстве и времени. Таким образом, систолическая нагрузка за счет увеличения ЛД является критическим фактором, влияющим на релаксацию. Исследования выявили, что протеипкиназа А — опосредованное фосфорилировапие тропонина I (Tpl) — регулирует взаимодействие постнагрузочной релаксации.
Уменьшение ПкА-опосредованного фосфорилирования Tpl повышает чувствительность релаксации к увеличению нагрузки при СН. Однако значение этого механизма при СНнФВ остается неясным. Равномерность распределения нагрузки и инактивации в пространстве и времени приводит к тому, что увеличение систолической нагрузки может иметь различные последствия в зависимости от того, в какой момент систолы действует нагрузка.
Увеличение давления в конце систолы ЛЖ ускоряет наступление релаксации ЛЖ, но релаксация происходит более медленными темпами (увеличение х). Увеличение давления в позднюю систолу ЛЖ встречается у пожилых людей из-за возрастной жесткости сосудов, которая так изменяет сроки отражения волны давления в сосудистом русле, что отраженная волна приходит в конце систолы, а не диастолы.
На уровне миофибрилл или камер синхронность релаксации во всех сегментах повышает релаксацию ЛЖ, в то время как асинхронность (например, вызванная ишемией миокарда, асимметричной гипертрофией или нарушением проводимости) будет снижать общую релаксацию ЛЖ. Инактивация миофибрилл определяется множеством клеточных процессов, которые в итоге влияют на скорость и степень разрушения актин-миозиновых мостиков, что позволяет миофибриллам удлиняться во время диастолы.
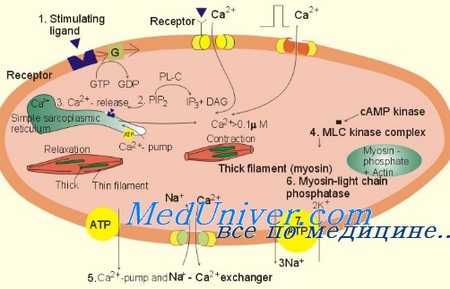
Для разделения актин-миозиновых мостиков по время диастолы необходимо оперативное уменьшение концентрации кальция в цитозоле. Увеличение периода переноса кальция связано со сниженным обратным захватом кальция Са2+-АТФазой саркоплазматического ретикулума и регулирующим ее белком фосфоламбаном.
Нарушенное выведение кальция из КМЦ Ca2+/Na+-насосом пли «утечка» кальция из СР во время диастолы при потенциальных нарушениях в рианодинчувствительных кальцийвыводящих каналах СР и модулирующего их белка FKBP-12.6 может привести к задержке или неполному разрыву актин-миозиновых мостиков, замедлению или неполной релаксации. Уменьшение количества или активности Ca2+-АТФазы СР или нарушение функции фосфоламбана влияет на релаксацию; улучшение релаксации происходило на моделях животных при переносе генов для повышения уровня миокардиальной Са2+-АТФазы СР.
Бета-адрснергическая стимуляция приводит к фосфорилированию фосфоламбана и повышает релаксацию за счет увеличения активности Са2+-АТФазы СР и скорости обратного захвата кальция. Таким образом, катехоламины также являются люзинотропными (повышающими релаксацию) средствами, как и инотропные препараты. Поскольку другие ферменты или регуляторные белки, влияя на процесс транспорта кальция, также регулируются фосфорилированием, уменьшение количества либо активности ПкА или увеличение протеинкиназы С, активирующей протеинфосфатазы, могут способствовать нарушению релаксации.
Важность быстрого снижения уровня кальция в регуляции скорости релаксации подчеркнута в исследовании, демонстрирующем, что перенос миокардиальных генов с парвальбумином (небольшим внутриклеточным белком, связывающим растворимый кальций, обнаруженным в быстро сокращающихся скелетных мышцах) повышает релаксацию КМЦ и ЛЖ.
- Вернуться в оглавление раздела "Кардиология"
Факторы влияющие на релаксацию миокарда. Признаки нарушения релаксации миокарда
Сокращение и расслабление регулируются сложным взаимодействием актина, тропомиозина, миозина и регуляторными белками ТрТ, TpI и ТрС с кальцием и фосфорилирующей протеинкиназой, а также АТФ и АДФ. В то время как связывающий кальций ТрС освобождает его от ингибиро-вания TpI, тем самым способствуя актин-миозиновым взаимодействиям, фосфорилирование TpI восстанавливает его ингибирующую роль и ускоряет релаксацию.
Как отмечалось ранее, TpI и его фосфорилирование, по всей видимости, регулирует индуцированные нагрузкой изменения релаксации. В связи с тем что при СН существуют некоторые признаки уменьшения фосфорилирования TpI, возможны более важные терапевтические последствия; именно поэтому методы повышения фосфорилирования TpI могут стать терапевтической стратегией, т.к. индуцированные нагрузкой нарушения релаксации могут способствовать повышению давления наполнения и появлению симптомов при СНнФВ.
Энергетическая поддержка (потребление АТФ) может влиять на релаксацию путем регулирования обратного захвата кальция Са2+-АТФазой СР, влияя на актин-миозиновые мостики в области головки миозина, где челночный механизм обмена фосфокреатина обеспечивает доставку АТФ из митохондрий и удаление АДФ и неорганического фосфата из области актин-миозиновых мостиков. Недостаточное количество АТФ и повышение уровня АДФ нарушает и разрушает актин-миозиновые мостики и замедляет релаксацию.
Острая ишемия вызывает нарушение и неполную релаксацию через снижение уровня АТФ и уменьшение внутриклеточного рН. Нарушенная релаксация является первым функциональным изменением при острой ишемии; также описан одновременный сдвиг диастолического отношения давление/объем вверх (сниженная растяжимость) наряду с ухудшением релаксации и тахикардией, которая усиливает действие релаксации на давление наполнения и вносит спой вклад в повышение давления наполнения при ишемии. Гипертрофированное сердце более чувствительно к ишемии, поскольку в результате ишемии происходим большее увеличение давления наполнения.
Следует признать, что диастолическая релаксация связана с систолической функцией эффектом восстановления. Когда сократимость ЛЖ ниже критического объема, потенциальная энергия сохраняется, что ускоряет релаксацию во время последующей диастолы. Этот процесс называют эластической отдачей, и факторы, которые влияют на силу систолы, могут влиять на скорость и степень релаксации.
Признаки нарушения релаксации миокарда
Результаты исследований с участием пациентов с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ), на старых собаках с АГ и с помощью математических моделированных систем поддерживают концепцию, что нарушение релаксации может способствовать повышению среднего диастолического давления в ЛЖ при СНнФВ и увеличении ЧСС. Более того, любой другой фактор, который укорачивает период диастолического наполнения (замедленное сокращение или длинный интервал PR), будет усиливать воздействие нарушенной релаксации ЛЖ на диастолическое давление во время наполнения и таким образом влиять на среднее давление в ЛП, необходимое для наполнения ЛЖ.
В исследованиях у пациентов с сердечной недостаточностью с нормальной фракцией выброса (СНнФВ) отмечено среднее значение т=60 мсек (при ЧСС ~ 70 уд/мин) с увеличением значений до 86 мсек при ФН. Можно ли использовать терапию для улучшения релаксации непосредственно, а также может ли такая терапия облегчать симптомы — эти вопросы требуют активного изучения.
Пациенты с нарушенной релаксацией и повышенной зависимостью от сокращения предсердий имеют риск развития СН при возникновении пароксизма ФП. Острое уменьшение наполнения, связанное с потерей систолической активности предсердий, ассоциировано с увеличением ЧСС и приводит к острому повышению давления в ЛП для поддержания его наполнения. В противоположность этому у здоровых людей с нормальными релаксацией и ранним диастол и ческим наполнением зависимость от потока медленного наполнения желудочков и предсердного наполнения минимальна, поэтому менее вероятно, что острое возникновение ФП может вызвать острый отек легких.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, – 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин – доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
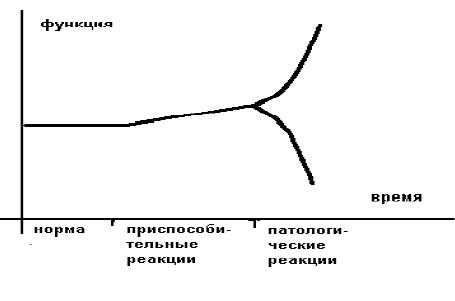
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение – определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани – мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности – церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) – больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) – жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов – централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции – застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров – плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы – развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
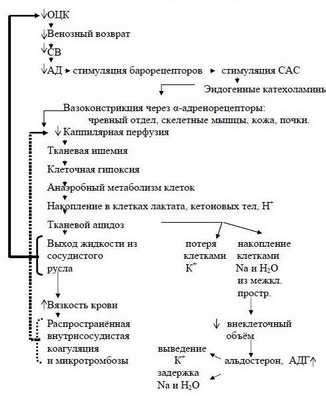
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" – развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов – раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Читайте также:
