Регуляция сердечного выброса по кислороду. Влияние венозного притока на сократимость миокарда
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Сердце и кровеносные сосуды – основная транспортная система человеческого организма. Строение и функции сердечно-сосудистой системы, регуляция ее работы. Сердечный цикл. Методы исследования сердечно-сосудистой системы. Тренировка сердца.
Сердечно-сосудистая система обеспечивает все процессы метаболизма в организме человека и является компонентом различных функциональных систем, определяющих гомеостаз. Основой кровообращения является сердечная деятельность.
Наше сердце всегда первым откликается на потребности организма: будь то физические нагрузки, подъем в горы, воздействие эмоций или других факторов. Так, при средней продолжительности жизни человека в 70 лет оно сокращается свыше 2,5 миллиардов раз. За это время перекачивается огромное количество крови, для перевозки которой потребовался бы состав из 4 000 000 вагонов. И эта работа выполняется органом, масса которого 250 г (у женщин) и немногим больше 300 г (у мужчин).
У людей, занимающихся спортом, сердце в состоянии напряжения может работать с частотой свыше 200 сокращений в минуту и при этом обладать удивительной выносливостью. В это время увеличивается сила и скорость сокращений сердца, а через его сосуды проходит крови в 4-5 раз больше, чем в состоянии покоя . Мышца сердца при этом не испытывает дефицита питательных веществ и кислорода. Однако нетренированным людям стоит только немного пробежаться, как у них появляется сердцебиение и одышка. Почему это происходит? Давайте попробуем разобраться и решить для себя: действительно ли так важны для нашего организма занятия спортом.
Рассмотрим кратко строение сердечно-сосудистой системы и ее функции.
Сосуды, отводящие кровь от сердца, называют артериями, а доставляющие ее к сердцу – венами. Сердечно-сосудистая система обеспечивает движение крови по артериям и венам и осуществляет кровоснабжение всех органов и тканей, доставляя к ним кислород и питательные вещества и выводя продукты обмена. Она относится к системам замкнутого типа, то есть артерии и вены в ней соединены между собой капиллярами. Кровь никогда не покидает сосуды и сердце, только плазма частично просачивается сквозь стенки капилляров и омывает ткани, а затем возвращается в кровяное русло.
Строение и работа сердца человека. Сердце – полый симметричный мышечный орган размером примерно с кулак человека, которому оно принадлежит. Сердце разделено на правую и левую части, каждая из которых имеет две камеры: верхнюю (предсердие) для сбора крови и нижнюю (желудочек) с впускным и выпускным клапанами для предотвращения обратного тока крови. Стенки и перегородки сердца представляют собой мышечную ткань сложного слоистого строения, называемую миокардом.
Сердце обладает уникальным свойством самовозбуждения, то есть импульсы к сокращению зарождаются в нем самом.
Если извлечь у животного сердце и подключить к нему аппарат искусственного кровообращения, оно будет продолжать сокращаться, будучи лишенным каких бы то ни было нервных связей. Это свойство автоматизма обеспечивает проводящая система сердца, расположенная в толще миокарда. Она способна генерировать собственные и проводить поступающие из нервной системы электрические импульсы, вызывающие возбуждение и сокращение миокарда. Участок сердца в стенке правого предсердия, где возникают импульсы, вызывающие ритмические сокращения сердца, называют водителем ритма. Тем не менее, сердце связано с центральной нервной системой нервными волокнами, оно иннервируется более чем двадцатью нервами. Казалось бы, зачем они, если сердце может сокращаться самостоятельно?
Регуляция работы сердца. Нервы выполняют функцию регуляции сердечной деятельности, которая служит еще одним примером поддержания постоянства внутренней среды (гомеостаза).
Сердечная деятельность регулируется нервной системой – одни нервы увеличивают частоту и силу сердечных сокращений, а другие – уменьшают.
Импульсы по этим нервам поступают на водитель ритма, заставляя его работать сильнее или слабее. Если перерезать оба нерва, сердце все равно будет сокращаться, но с постоянной скоростью, так как перестанет приспосабливаться к потребностям организма. Эти нервы, усиливающие или ослабляющие сердечную деятельность, составляют часть вегетативной (или автономной) нервной системы, которая регулирует непроизвольные функции организма. Примером такой регуляции является реакция на внезапный испуг – вы чувствуете, что сердце “замирает”. Это приспособительная реакция ухода от опасности.
Коротко рассмотрим, как происходит регуляция сердечной деятельности в организме (рисунок 1.5.6).
Рисунок 1.5.6. Гомеостатическая регуляция сердечной деятельности
Нервные центры, регулирующие деятельность сердца, находятся в продолговатом мозге. В эти центры поступают импульсы, сигнализирующие о потребностях тех или иных органов в притоке крови. В ответ на эти импульсы продолговатый мозг посылает сердцу сигналы: усилить или ослабить сердечную деятельность. Потребность органов в притоке крови регистрируется двумя типами рецепторов – рецепторами растяжения (барорецепторами) и хеморецепторами. Барорецепторы реагируют на изменение кровяного давления – повышение давления стимулирует эти рецепторы и заставляет посылать в нервный центр импульсы, активирующие тормозящий центр. При понижении давления, наоборот, активируется усиливающий центр, сила и частота сердечных сокращений увеличиваются и кровяное давление повышается. Хеморецепторы “чувствуют” изменения концентрации кислорода и углекислого газа в крови. Например, при резком увеличении концентрации углекислого газа или понижении концентрации кислорода эти рецепторы тотчас же сигнализируют об этом, заставляя нервный центр стимулировать сердечную деятельность. Сердце начинает работать более интенсивно, количество крови, протекающей через легкие, увеличивается и газообмен улучшается. Таким образом, перед нами пример саморегулирующейся системы.
Но не только нервная система влияет на работу сердца. На функции сердца влияют и гормоны, выделяемые в кровь надпочечниками. Например, адреналин усиливает сердцебиение, другой гормон, ацетилхолин, наоборот, угнетает сердечную деятельность.
Теперь, наверное, вам не составит труда понять, почему, если резко встать из лежачего положения, может даже наступить кратковременная потеря сознания. В вертикальном положении кровь, питающая мозг, движется против силы тяжести, поэтому сердце вынуждено приспосабливаться к этой нагрузке. В лежачем положении голова ненамного выше сердца, и такой нагрузки не требуется, поэтому барорецепторы дают сигналы ослабить частоту и силу сердечных сокращений. Если же неожиданно встать, то барорецепторы не успевают сразу отреагировать, и на какой-то момент произойдет отток крови от мозга и, как следствие, головокружение, а то и помутнение сознания. Как только по команде барорецепторов темп сердечных сокращений ускорится, кровоснабжение мозга окажется нормальным, и неприятные ощущения исчезнут.
Сердечный цикл. Работа сердца совершается циклически. Перед началом цикла предсердия и желудочки находятся в расслабленном состоянии (так называемая фаза общего расслабления сердца) и наполнены кровью. Началом цикла считают момент возбуждения в водителе ритма, в результате которого начинают сокращаться предсердия, и в желудочки попадает дополнительное количество крови. Затем предсердия расслабляются, а желудочки начинают сокращаться, выталкивая кровь в отводящие сосуды (легочную артерию, несущую кровь в легкие, и аорту, доставляющую кровь в остальные органы). Фаза сокращения желудочков с изгнанием из них крови называется систолой сердца. После периода изгнания желудочки расслабляются, и наступает фаза общего расслабления – диастола сердца.
С каждым сокращением сердца у взрослого человека (в состоянии покоя) в аорту и легочный ствол выбрасывается 50-70 мл крови, в минуту – 4-5 л. При большом физическом напряжении минутный объем может достигать 30-40 л.
Во время диастолы полости желудочков и предсердий вновь заполняются кровью, одновременно происходит восстановление энергетических ресурсов в клетках миокарда за счет сложных биохимических процессов, в том числе за счет синтеза аденозинтрифосфата. Затем цикл повторяется. Этот процесс фиксируется при измерении артериального давления – верхний предел, регистрируемый в систоле, называют систолическим, а нижний (в диастоле) – диастолическим давлением. Измерение артериального давления (АД) является одним из методов, позволяющим контролировать работу и функционирование сердечно-сосудистой системы.
Одним из первых, кто детально проанализировал показатели АД, был немецкий физиолог К. Людвиг. Он вводил канюлю в сонную артерию собаки и регистрировал АД с помощью ртутного манометра, с которым была соединена канюля. В манометр погружался поплавок, который соединялся с прибором, регистрирующим колебания различной амплитуды.
В настоящее время АД измеряют бескровным методом с помощью специального прибора – тонометра, что позволяет определить следующие показатели:
1. Минимальное, или диастолическое АД – это та наименьшая величина, которой достигает давление в плечевой артерии к концу диастолы. Минимальное давление зависит от степени проходимости или величины оттока крови через систему капилляров, частоты сердечных сокращений. У молодого здорового человека минимальное давление составляет – 80 мм рт.ст.
2. Максимальное, или систолическое АД – это давление, выражающее весь запас потенциальной и кинетической энергии, которым обладает движущаяся масса крови на данном участке сосудистого русла. В норме у здоровых людей максимальное давление составляет 120 мм рт.ст.
В медицинской практике для определения работы и состояния сердечно-сосудистой системы используют различные методы исследования сердечно-сосудистой системы, информативность, клиническая значимость и клиническая доступность которых весьма различны. В настоящее время ведущее место в клинической практике занимают такие методы как электрокардиография, эхокардиография, рентгенокардиография (более подробно о которых рассказано в разделе 2.1.2) и многие другие. Подобные исследования проводятся специалистами с помощью различных приборов в лечебных учреждениях.
Сердце – это мышечный насос, основная функция которого – сократительная – заключается в непрерывном круговом перемещении крови по всему организму. Кислород доставляется от легких к тканям, а углекислый газ, являющийся одним из “шлаков”, – к легким, где кровь снова обогащается кислородом. Кроме того, с кровью во все клетки организма доставляются питательные вещества, а из них уносятся другие “шлаки”, которые с помощью органов выделения (например почки) удаляются из организма, как зола из печки хорошим хозяином.
От сердца кровь движется по артериям, артериолам и капиллярам. Самая крупная артерия – аорта, она идет непосредственно от сердца (от левого желудочка), самые мелкие сосуды – капилляры, через стенки которых и происходит обмен веществ между кровью и тканями. Кровь, насыщенная углекислым газом и отходами обмена веществ, собирается в венулах и далее по венам, освобождаясь от шлаков в органах выделения, движется обратно к сердцу, которое выталкивает ее в легкие для освобождения от углекислого газа и обогащения кислородом. Обогащенная кислородом кровь из легких по легочным венам поступает в левое предсердие, перекачивается левым желудочком в аорту, и начинается новый цикл кругового перемещения крови.
Коронарные артерии и вены снабжают саму сердечную мышцу (миокард) кислородом и питательными веществами. Это питание для сердца, которое выполняет такую важную и большую работу.
Малый круг начинается в правом желудочке и заканчивается в левом предсердии. Он служит для питания сердца, обогащения крови кислородом. Большой круг (от левого желудочка до правого предсердия) отвечает за кровоснабжение всего тела, кроме легких.
Стенки кровеносных сосудов очень эластичны и способны растягиваться и сужаться в зависимости от давления крови в них. Мышечные элементы стенки кровеносных сосудов всегда находятся в определенном напряжении, которое называют тонусом. Тонус сосудов, а также сила и частота сердечных сокращений обеспечивают в кровяном русле давление, необходимое для доставки крови во все участки тела. Этот тонус, так же как интенсивность сердечной деятельности, поддерживается с помощью вегетативной нервной системы. В зависимости от потребностей организма парасимпатический отдел, где основным посредником (медиатором) является ацетилхолин, расширяет кровеносные сосуды и замедляет сокращения сердца, а симпатический (посредник – норадреналин) – наоборот, суживает сосуды и ускоряет работу сердца.
Тренировка сердца. Теперь попробуем разобраться, почему у нетренированного человека при незначительной физической нагрузке появляются признаки “кислородного голодания”: сердцебиение, одышка и другие. К примеру, во время бега, тяжелой физической работы потребность организма в кислороде возрастает примерно в 8 раз. А это означает, что сердце должно перекачивать в 8 раз больше крови, чем обычно.
Знаете ли вы, что.
Ученые подсчитали, что за сутки сердце расходует количество энергии, достаточное для поднятия груза в 900 кг на высоту 14 м (!)
У человека, ведущего малоподвижный образ жизни, учащение сердечных сокращений не приводит к увеличению кровоснабжения сердца, как это требуется организму. В этом случае мышца сердца и скелетные мышцы получают недостаточное количество кислорода, работают в условиях кислородного голодания, в результате накапливаются вредные продукты обмена веществ, что приводит к более быстрому износу сердечной мышцы. Нетренированное сердце со слабой сердечной мышцей не может долго работать с повышенной нагрузкой. Оно быстро устает, причем кровоснабжение сначала ненадолго усиливается, а затем ухудшается. Поэтому человек должен с детства заботиться о своем сердце и тренировать его.
Подробная информация о препаратах, применяемых при болезнях сердечно-сосудистой системы представлена в главе 3.5.
Регуляция сердечного выброса по кислороду. Влияние венозного притока на сократимость миокарда
Известно, например, что при сохраненном уровне кровотока транспорт кислорода к клеткам может возрасти в 3 раза за счет увеличенной утилизации кислорода при продвижении крови к клеткам. Следовательно, без увеличения кровотока (сердечного выброса) потребление кислорода может быть увеличено максимум в 3 раза, и снижение минутного объема сердца только на 1/3 приведет к тяжелым нарушениям жизнедеятельности клеток.
Видимо поэтому было введено понятие «коэффициент безопасности», указывающее на величину резерва, который может быть реализован тканями при чрезвычайных обстоятельствах. По данным автора, этот коэффициент для кислорода равен 3, для глюкозы — 3, для углекислоты — 25, для жирных кислот — 28, для аминокислот — 36, для продуктов белкового обмена — 480.
Единственным механизмом, обеспечивающим поддержание обмена веществ в этих условиях, является сердечный выброс. Отсюда следует, что если кровоток (сердечный выброс) будет поддерживаться на достаточном уровне, обеспечивающим транспорт кислорода, то транспорт других веществ, необходимых для реализации обмена веществ, будет поддерживаться автоматически.
Логично предположить, что процессы транспорта кислорода, его потребления, интенсивности обмена веществ и уровня жизнедеятельности организма должны быть тесно связаны, а потребление кислорода является фактором регуляции сердечного выброса. Справедливость этого предположения была доказана еще в начале прошлого века.
На диаграмме рисунка представлены результаты взаимоотношений сердечного выброса и потребления кислорода при различном уровне обмена веществ (интенсивности мышечной работы), полученные рядом исследователей на добровольцах. На графике отчетливо видно, что имеется прямая зависимость увеличения обмена веществ (интенсивности мышечной работы), величин потребления кислорода и сердечного выброса.
Известно, что при интенсивной нагрузке СВ может возрасти в 6 раз, а коэффициент утилизации кислорода в 3 раза. Следовательно, при интенсивном возрастании обмена веществ доставка кислорода к тканям может увеличиться приблизительно в 18 раз.
Приведенные данные позволяют убедиться в правомочности утверждения, что потребление кислорода является основным фактором, регулирующим насосную функцию сердца.
Влияние венозного притока на сократимость миокарда
Механизмы регуляции насосной функции сердца можно подразделить на две большие группы: механизмы, реализующиеся за счет функции самого сердца и механизмы, связанные с изменением периферического кровообращения.
С тех пор, когда впервые был сформулирован закон Стерлинга и до настоящего времени в специальной литературе ведется полемика относительно роли самого сердца в регуляции сердечного выброса.
Сторонники взглядов о превалирующей роли сердца в регуляции сердечного выброса приводят следующие доводы: а) стимуляция вегетативных нервов может ослаблять или усиливать работу сердца; б) снижение сократительной функции миокарда при различных заболеваниях сопровождается снижением сердечного выброса, а ее восстановление после соответствующей терапии — его увеличением.
Сторонники преобладающей роли периферического кровообращения в регуляции сердечного выброса в пользу справедливости своих взглядов приводят результаты эксперимента на изолированном сердечно-легочном препарате. В этом эксперименте величина сердечного выброса почти полностью зависела от периферических факторов (притока крови к сердцу).
Кроме того, они приводят еще один довод: при денервации сердца в условиях тотальной спинальной анестезии, сердечный выброс хотя и снижается, но это снижение не превышает 20-30%.
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Слабость сократительной функции миокарда. Регуляция сердечного выброса на фоне ИВЛ
Слабость сократительной функции миокарда обусловлена сопутствующей патологией (хроническая гипоксемия, нарушения коронарного кровотока, гиперкоагуляция). Сопротивление венозному притоку всегда связано с торакотомией (повышение внутригрудного давления), особенностями оперативного вмешательства: повышение сосудистого тонуса, в том числе, и в системе легочной артерии (рефлекторная атака из заложенных в средостении нервных сплетений), препятствие венозному притоку при манипуляциях хирурга в области верхней полой вены (снижение притока) и правого предсердия (повышенное давление).
Перечисленные факторы существенно осложняют поддержание адекватного сердечного выброса. К этому необходимо добавить нередко возникающие сложности в обеспечении необходимого уровня среднего системного давления из-за реальной опасности передозировки жидкости при внутривенной инфузии (легочная артериальная гипертензия), следствием чего может возникнуть отек легких по описанному выше механизму.
Наиболее приемлемым методом поддержания системного давления в этих случаях является строго контролируемая внутривенная инфузия при постоянном мониторинге сердечного выброса. Желательно также добиваться от хирурга бережного отношения к органам грудной клетки. В необходимых случаях приходится с большой осторожностью применять средства, повышающие сократительную способность миокарда.
Регуляция сердечного выброса на фоне ИВЛ
Весьма актуальной в настоящее время является проблема регуляции сердечного выброса при искусственной вентиляции легких. Антифизиологичность механики дыхания, частое применение ИВЛ с положительным конечным экспираторным давлением (ПДКВ-РЕЕР), использование режимов спонтанного дыхания при постоянном положительном давлении (СРАР, BiPAP), все это не может не сказаться на состоянии регуляции сердечного выброса.
Обсуждая вопрос о влиянии различных факторов на величину венозного притока, мы указывали на важную роль присасывающей функции грудной клетки в регуляции сердечного выброса. Уменьшение внутриплеврального давления неизменно сопровождается снижением давления в правом предсердии, увеличением градиента давления со средним системным давлением, вследствие чего возрастает венозный приток и сердечный выброс.
В связи с тем, что при спонтанном дыхании во время дыхательного цикла градиент давлений все время меняется, венозный приток и сердечный выброс также должны подвергаться изменениям.
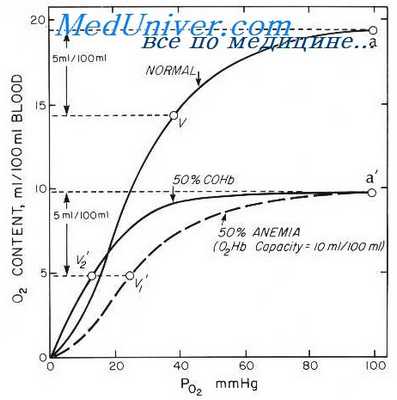
На диаграмме представлены 3 кривые сердечного выброса при среднем системном давлении 7 мм Нg. При величине давления в правом предсердии 0 мм Нg точка равновесия А соответствует нормальной величине венозного притока и сердечного выброса (5 л/мин.).
Во время вдоха, в силу снижения внутригрудного давления (давление в правом предсердии уменьшается до -2,7 мм Нg), кривая сердечного выброса (зеленая окраска) смещается влево, и точка равновесия В соответствует величине венозного притока и сердечного выброса 6,3 л/мин. Во время выдоха, в результате сокращения выдыхательных мышц, внутригрудное давление повышается (давление в правом предсердии возрастает до +2,6 мм Нg), кривая сердечного выброса (зеленая окраска) смещается вправо, точка равновесия С сдвигается вниз, что соответствует величине венозного притока и сердечного выброса 3 л/мин. Таким образом, колебания сердечного выброса во время дыхательного цикла составляют более 3 литров.
В действительности эти колебания касаются больше венозного притока, чем сердечного выброса. При увеличении венозного притока во время вдоха и нарушения равновесия приток—выброс сразу же включаются некоторые механизмы, ограничивающие приток крови в левое предсердие, прежде всего депонирование крови в малом круге кровообращения, вследствие чего равновесие приток выброс восстанавливается, что и препятствует увеличению сердечного выброса. Во время выдоха депонированный объем крови возвращается в левое предсердие и сердечный выброс возрастает.
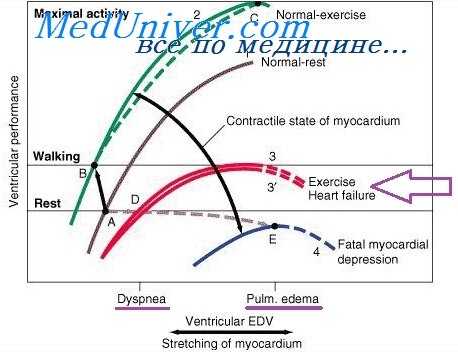
Современный взгляд на сердечный выброс. Взаимоотношение факторов влияющих на сократимость миокарда
Исследования последнего времени позволили примерить сторонников различных взглядов на механизмы регуляции сердечного выброса. А. Гайтон в своей монографии, суммируя результаты экспериментальных и клинических исследований, приходит к выводу, что в различных ситуациях на величину сердечного выброса могут оказывать преобладающее влияние или сердечные, или периферические гемодина-мические факторы.
При физиологическом покое и при умеренной физической нагрузке в регуляции минутного объема сердца преобладающую роль играют периферические механизмы- уровень притока крови к сердцу, зависящий от периферического сопротивления, объема циркулирующей крови и некоторых других факторов.
При таких заболеваниях, при которых сердце не в состоянии перекачать кровь из венозной системы в артериальную, уровень сердечного выброса будет напрямую зависеть от функции сократительного миокарда.
В ситуации, когда значительно снижается периферическое сопротивление (гипоксемия, применение симпатолитиков, большой артерио-венозный шунт и др.), увеличение сердечного выброса связано в основном с объемом венозного возврата. Однако при значительных объемах притекающей к сердцу крови, превышающих контрактильные возможности миокарда, в регуляции сердечного выброса начинает преобладать сердечный фактор.
В клинической практике редко встречается такое четкое разделение факторов, влияющих на сердечный выброс. Чаще всего наблюдаются различные сочетания механизмов, определяющих уровень сердечного выброса.
На рисунке приведена схема взаимоотношений различных факторов, принимающих участие в регуляции сердечного выброса. Приводим комментарии относительно главных из этих факторов.
1. Скорость кровотока через правое сердце (Ргк) влияет на величину давления в легочной артерии (Ра ).
2. Давление в легочной артерии (Ра ), в свою очередь, влияет на скорость кровотока через правое сердце.
3. Давление в легочной артерии влияет на объем крови в сосудах малого круга кровообращения (У ).
4. Давление в легочной артерии влияет на величину кровотока в сосудах малого круга кровообращения (Рр).
5. Изменение объема крови в легочных сосудах влияет на величину сопротивления сосудов малого круга (Вр)
6. Сопротивление в сосудах малого круга влияет на величину давления в легочной артерии.
7. Сопротивление в сосудах малого круга влияет на величину кровотока в этих сосудах.
8. Объем кровотока в сосудах малого круга влияет на венозное давление в легочных венах (Ри ).
9. Венозное давление в легочных венах влияет на величину кровотока в малом круге кровообращения.
10. Величина венозного давления изменяет объем крови в сосудах легких.
11. Величина венозного давления влияет на объем крови, притекающей в левое сердце.
12. Объем крови, протекающей через левое сердце, влияет на величину давления в венах малого круга.
13. Объем крови, протекающей через левое сердце, влияет на величину артериального давления в большом круге кровообращения.
14. Артериальное давление в большом круге кровообращения влияет на количество крови, протекающей через левое сердце.
15. Артериальное давление в сосудах большого круга кровообращения влияет на объем крови, находящейся в сосудах большого круга кровообращения (Уз).
16. Артериальное давление влияет на величину кровотока в сосудах большого круга кровообращения (Рз).
17. Давление в сосудах большого круга кровообращения влияет на величину периферического сопротивления (их).
18. Периферическое сопротивление влияет на величину артериального давления.
19. Периферическое сопротивление влияет на величину кровотока в сосудах большого круга кровообращения.
20. Величина кровотока в сосудах большого круга кровообращения влияет на величину венозного давления (PVT).
21. Венозное давление в сосудах большого круга кровообращения влияет на величину объема крови в большом круге кровообращения.
22. Венозное давление в сосудах большого круга кровообращения влияет на величину кровотока в большом круге кровообращения.
23. Давление в венах большого круга кровообращения влияет на количество крови, притекающей к правому сердцу.
24. Количество крови, притекающей к правому сердцу, влияет на величину давления в венах большого круга кровообращения.
Из приведенного выше перечисления взаимовлияния различных факторов, реализующих сердечный выброс, очевидно, что изменение в каком-нибудь одном фрагменте этой схемы неизбежно приведет к изменению всего комплекса взаимодействия факторов, определяющих насосную функцию сердца.
Чурсин В.В. Клиническая физиология кровообращения (методические материалы к лекциям и практическим занятиям)
Чурсин В.В. Клиническая физиология кровобращения. Методические материалы к практическим и семинарским занятиям, – 2011. - 44 с.
Содержит информацию о физиологии кровообращения, нарушениях кровообращения и их вариантах. Также представлена информация о методах клинической и инструментальной диагностики нарушений кровообращения.
Данные материалы являются переработанным вариантом предыдущих изданий (1999г., 2003г.), первым автором которых являлся В.Ф.Туркин – доцент кафедры анестезиологии и реаниматологии АГИУВ.
Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Введение
Академик В.В.Парин (1965г.) дает такое пояснение: «Клиническая физиология исходит из положения, что в организме при болезни многие возникающие реакции являются приспособительными. Под влиянием чрезвычайных раздражителей приспособительные реакции резко изменяются и, приобретая опасное для организма значение, становятся реакциями патологическими. Переход приспособительных реакций в патологические является узловым звеном в патогенезе заболеваний. А его детальное изучение является одной из главных задач клинической физиологии кровообращения».
Исходя из этого пояснения, можно отметить, что значение клинической физиологии любой системы предполагает:
Более образно это можно представить в следующем виде (рисунок 1).
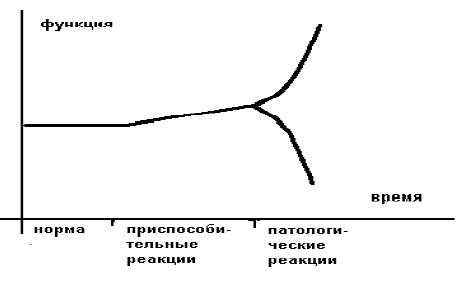
Приспособительные реакции обеспечивают компенсацию, а патологические реакции обуславливают декомпенсацию страдающего органа или страдающей системы. В общем виде отличием (границей) между нормой и приспособлением является изменение свойств приспосабливающего органа или приспосабливающейся системы.
Границей между приспособлением и патологией является резкое изменение ("излом") приспособительной реакции по направлению и величине.
Различают срочные приспособительные реакции и долговременные. Врачам интенсивной терапии чаще приходится иметь дело с острыми расстройствами, поэтому необходимы знания срочных приспособительных реакций и их переход в патологические.
Кровообращение – определение, классификация
Кровообращение - это непрерывное движение (обращение) крови по замкнутой системе, именуемой сердечно-сосудистой.
- 2 - аорта и крупные артерии, имеют много эластических волокон, представляются как буферные сосуды, благодаря им резко пульсирующий кровопоток превращается в более плавный;
- 3 - прекапиллярные сосуды, это мелкие артерии, артериолы, метартериолы, прекапиллярные жомы (сфинктеры), имеют много мышечных волокон, которые могут существенно изменить свой диаметр (просвет), они определяют не только величину сосудистого сопротивления в малом и большом кругах кровообращения (поэтому и называются резистивными сосудами), но и распределение кровопотока;
- 4 - капилляры, это обменные сосуды, при обычном состоянии открыто 20-35% капилляров, они образуют обменную поверхность в 250-350 кв.м., при физической нагрузке максимальное количество открытых капилляров может достигать 50-60%;
- 5 - сосуды - шунты или артериоло-венулярные анастомозы, обеспечивают сброс крови из артериального резервуара в венозный, минуя капилляры, имеют значение в сохранении тепла в организме;
- 7 - вены, крупные вены, они обладают большой растяжимостью и малой эластичностью, в них содержится большая часть крови (поэтому и называются емкостными сосудами), они определяют "венозный возврат" крови к желудочкам сердца, их заполнение и (в определенной мере) ударный объём (УО).
Объем циркулирующей крови (ОЦК)
Вопрос объема имеет важное значение. Прежде всего потому, что определяет наполнение камер сердца и таким образом влияет на величину УО.
По классическому представлению ОЦК составляет у мужчин 77 и у женщин 65 мл/кг массы тела 10%. В среднем берётся 70 мл/кг.
Необходимо чётко представлять, что ОЦК является «жидким слепком сосудистой системы» - сосуды не бывают полупустыми. Ёмкость сосудистой системы может изменяться в достаточно больших пределах, в зависимости от тонуса артериол, количества функционирующих капилляров, степени сдавления вен окружающими тканями («наполненность» интерстиция и тонус мышц) и степенью растянутости свободно расположенных вен брюшной полости и грудной клетки. Разница в ОЦК, определяемая изменением состояния вен, предположительно составляет примерно 500-700 мл у взрослого человека (А.Д.Ташенов, В.В.Чурсин, 2009г.). Мнение, что венозная система может вместить, кроме ОЦК, еще 7-10 литров жидкости, можно считать ошибочным, так как излишняя жидкость достаточно быстро перемещается в интерстиций. Депо ОЦК в организме является интерстициальное пространство, резервная-мобильная емкость которого составляет примерно ещё 1 литр. При патологии интерстиций способен принять около 5-7 литров жидкости без формирования внешне видимых отеков (А.Д.Ташенов, В.В.Чурсин, 2009г.).
Особенностью интерстициальных отеков при некорректной инфузионной терапии является то, что жидкость при быстром поступлении в организм прежде всего уходит в наиболее «мягкие» ткани – мозг, легкие и кишечник.
Последствием этого является наиболее наблюдаемые недостаточности – церебральная, дыхательная и кишечная.
Физиологи на сегодняшний день считают, что практически у среднего человека номинальной величиной ОЦК принимается 5 литров или 5000 см 3 . В ОЦК различают две составных части: объем заполнения (U) и объем растяжения (V) сосудистой системы. U составляет 3300 см., V составляет 1700 см 3 . Последний, объем растяжения имеет непосредственное отношение к давлению крови и скорости объемного потока крови в сосудах.
Избыточная, особенно быстрая, инфузия растворов ведет к увеличению объема, прежде всего в сосудах легких, чем в других органах. При быстрой инфузии, особенно крупномолекулярных растворов (декстраны, ГЭК, СЗП, альбумин) жидкость не успевает переместиться в интерстиций, и при этом жидкость депонируется в первую очередь в легочных венах. Имеются сведения о том, что легочные вены могут дополнительно вместить еще примерно 53% общего легочного объема крови. При дальнейшей избыточной инфузии в действие вступает рефлекс Китаева. При этом рефлексе импульсы с рецепторов перерастянутых легочных вен, возбуждающе действуя на мускулатуру легочных артериол, суживают их, предотвращая таким образом переполнение легочных венозных сосудов.
Из-за спазма легочных артериол при дальнейшей избыточной инфузии наступает объемная перегрузка правых отделов сердца, в первую очередь правого желудочка. При его чрезмерной перегрузке в действие вступает рефлекс Ярошевича. Импульсы с рецепторов легочных артерий, возбуждающе действуя на мускулатуру в устьях полых вен, суживают их, предотвращая таким образом переполнение правых отделов сердца.
Здесь граница, за которой далее приспособление может перейти в патологию. В случае продолжения избыточной инфузии - вследствие избыточного давления в правом предсердии и его перерастяжения возникают следующие условия.
Во-первых ухудшается отток в правое предсердие значительной части крови из коронарных вен. Затруднение оттока по коронарным венам приводит к затруднению притока крови по коронарным артериям и доставки кислорода к миокарду (боль в области сердца).
Во-вторых, может возникнуть рефлекс Бейнбриджа (подробнее - раздел регуляции кровообращения), он вызывает тахикардию, которая всегда увеличивает потребность миокарда в кислороде.
У лиц со скрытой коронарной недостаточностью (что почти никогда не выявляется у больных перед операцией из-за недостаточного обследования) и у лиц с явной ишемической болезнью сердца (ИБС) все это может обусловить возникновение острой коронарной недостаточности вплоть до возникновения острого инфаркта миокарда (ОИМ) с дальнейшим развитием острой сердечной лево-желудочковой недостаточности (ОСЛН).
Если компенсаторные возможности коронарного кровообращения не скомпрометированы и не реализуется рефлекс Бейнбриджа, то дальнейшая объемная перегрузка приводит к растяжению полых вен. При этом с рецепторов, расположенных в устьях полых вен, импульсация поступает к центрам осморегуляции в гипоталамусе (супраоптическое ядро). Уменьшается секреция вазопрессина, приводящая к полиурии (выделению мочи более 2000 мл/сут), что отмечается утром дежурным врачом (и, как правило, безотчётливо) – больной спасает себя. Хорошо, если у больного регуляция водного баланса не нарушена и почки функционируют, в противном случае больной будет «утоплен» с благими намерениями.
Не затрагивая вопросов о «хроническом» уменьшении ОЦК, когда это обусловлено хроническим уменьшением потребления жидкости, коснемся вопроса уменьшения ОЦК, обусловленного именно острой кровопотерей, с чем чаще всего имеют дело врачи анестезиологи-реаниматологи.
По современным представлениям отмечаются следующие приспособительные изменения функции сердечно-сосудистой системы.
Когда ОЦК снижается на 10-20%, то такая кровопотеря представляется компенсируемой. При этом первой приспособительной реакцией является уменьшение емкости венозных сосудов за счёт сдавления их окружающими тканями. Вены из округлых становятся сплющенными или почти полностью спадаются, и таким образом емкость сосудов приспосабливается к изменившемуся объему циркулирующей крови. Венозный приток крови к сердцу и его УО поддерживаются на прежнем уровне. Компенсаторную реакцию организма можно сравнить с ситуацией, когда содержимое неполной 3-х литровой банки переливают в 2-х литровую и она оказывается полной.
Компенсаторным механизмом является и перемещение жидкости из интерстиция за счёт уменьшения венозного давления и увеличения скорости кровотока (укорочения времени изгнания даже без развития тахикардии) – жидкость как бы засасывается из интерстиция. Этот компенсаторный механизм можно наблюдать у доноров при донации, когда экстракция 500 мл крови не приводит к каким-либо изменениям кровообращения.
С уменьшением ОЦК до 25-30% (а это уже потеря растягивающей части ОЦК - V) кровопотеря представляется не компенсируемой за счёт критического уменьшения ёмкости венозной системы. Начинает уменьшаться венозный приток к сердцу и страдает УО. При этом развивается приспособительная (компенсаторная) тахикардия. Благодаря ей поддерживается достаточный уровень сердечного выброса (СВ за минуту = МСВ) за счёт уменьшенного УО и более частых сердечных сокращений. Одновременно с тахикардией развивается сужение периферических артериальных сосудов – централизация кровообращения. При этом ёмкость сосудистой системы значительно уменьшается, подстраиваясь под уменьшенный ОЦК. При сниженном УО и суженных периферических артериальных сосудах поддерживается достаточный уровень среднего артериального давления (АДср) в сосудах, направляющих кровь к жизненно важным органам (мозг, сердце и лёгкие). Именно от величины АДср зависит степень перфузии того или иного органа. Таким образом, развивается приспособительная централизация кровообращения за счет уменьшения кровоснабжения периферических тканей (кожа, скелетные мышцы и т.д.). Эти ткани могут переживать ишемию (I фазу нарушения микроциркуляции) и кислородную недостаточность в течение более продолжительного времени.
Эта реакция аналогична процессу воспаления, при котором организм, образуя грануляционный вал и отторгая омертвевшее, жертвует частью во имя сохранения целого.
Когда ОЦК снижается более чем на 30-40% и восполнение кровопотери задерживается, то такая кровопотеря переходит в разряд некомпенсированной и может стать необратимой. При этом несмотря на тахикардию, СВ уменьшается и снижается АДср. Из-за недостаточного транспорта кислорода в организме усиливается метаболический ацидоз. Недоокисленные продукты метаболизма парализуют прекапиллярные сфинктеры, но периферический кровоток не восстанавливается из-за сохраняющегося спазма посткапиллярных сфинктеров.
Развивается II фаза нарушений микроциркуляции – застойной гипоксии. При этом за счёт ацидоза повышается проницаемость капилляров – плазматическая жидкость уходит в интерстиций, а форменные элементы начинают сладжироваться, образуя микротромбы – развивается ДВС-синдром. К моменту, когда на фоне нарастающего ацидоза парализуются и посткапиллярные сфинктеры (III фаза нарушений микроциркуляции) капиллярное русло уже необратимо блокировано микротромбами.
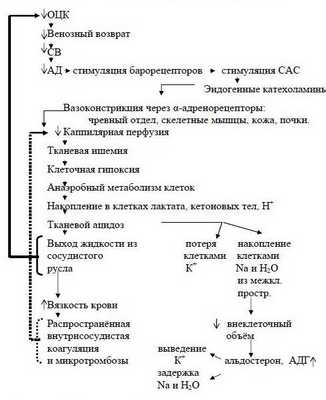
Наступает несостоятельность тканевой перфузии. Во всех случаях затянувшегося синдрома малого СВ присоединяется преренальная анурия. Всё это клиническая форма шока с классической триадой: синдром сниженного СВ, метаболический ацидоз, преренальная анурия. При этом во многих органах, как отмечает профессор Г.А.Рябов, "наступают необратимые изменения и даже последующее восполнение кровопотери и восстановление ОЦК не всегда предотвращает смертельный исход из-за осложнений, связанных с необратимыми изменениями в некоторых органах" – развивается полиорганная недостаточность (ПОН) или мультиорганная дисфункция (МОД).
Последовательность в нарушениях гомеостаза при кровопотере схематически представлена на рисунке 2 (Р.Н.Лебедева и сотр., 1979 г.).
Таким образом, при абсолютном снижении ОЦК практически любого происхождения границей перехода приспособления в декомпенсацию является увеличение частоты сердечных сокращений (ЧСС) с одновременным снижением СВ и АДср.
Данное положение не применимо к случаям, когда имеется относительное уменьшение ОЦК за счет патологической вазодилятации.
Следует учитывать и то, что очень часто острая кровопотеря сопровождается болью и это вносит разлад в последовательность компенсаторных механизмов – раньше чем нужно и в большем количестве выбрасываются эндогенные катехоламины. Централизация развивается быстрее и времени на спасение больного остается меньше.
Читайте также:
- Плоскоклеточный рак ротовой полости
- Лучевая диагностика фораминальной экструзии межпозвонкового диска
- Микропапулезный туберкулид. Милиарная диссеминированная волчанка лица
- Клиника дивертикулита. Флегмонозный дивертикулит. Консервативное лечение острого дивертикулита.
- Клиника гемотрансфузионного шока. Диагностика посттрансфузионных реакций
