Ресинхронизация сердца при сердечной недостаточности. Имплантируемый кардиовертер-дефибриллятор при СН
Добавил пользователь Владимир З. Обновлено: 21.01.2026
Главная » Все конференции » Архив конференций / Conferences' Archive » Вторая открытая конференция молодых ученых Саратовского НИИ кардиологии, посвященная Дню науки » Влияние имплантируемых кардиовертеров-дефибрилляторов и устройства для ресинхронизирующей терапии на сократительную способность миокарда у пациентов с хронической сердечной недостаточностью
Влияние имплантируемых кардиовертеров-дефибрилляторов и устройства для ресинхронизирующей терапии на сократительную способность миокарда у пациентов с хронической сердечной недостаточностью
Резюме
Ключевые слова
хроническая сердечная недостаточность, кардиовертер-дефибриллятор, ресинхронизирующая терапия сердца, внезапная сердечная смерть
Статья
Введение
Хроническая сердечная недостаточность (ХСН) – это прогрессирующее заболевание, характеризующееся значительной смертностью. Одним из вариантов прогрессирования ХСН является внезапная сердечная смерть (ВСС). ВСС является большой проблемой общественного здравоохранения. От ВСС в США ежегодно погибает от 180-250 тыс. человек. Больше, чем половина смертей при патологии сердца является внезапной, причем примерно половина из этих случаев является первым клиническим проявлением кардиальной патологии 3.
Количество больных страдающих синдромом ХСН в США составляет 5,7 млн. человек, при ежегодной заболеваемости - 550 тыс. случаев и ежегодной смертности более 56 тыс. случаев [4]. В РФ распространенность в популяции ХСН I–IV ФК составила 7% случаев (7,9 млн. человек), клинически выраженная ХСН (II–IV ФК) имеет место у 4,5% населения (5,1 млн. человек), распространенность терминальной ХСН (III–IV ФК) достигает 2,1% случаев (2,4 млн. человек) [5]. Изменения в структуре и геометрии камер сердца часто предшествуют клиническим проявлениям ХСН. Явления ремоделирования усугубляют систолическую и диастолическую дисфункцию желудочков и отрицательно влиять на качество жизни и прогноз у больных [6].
Физиологические последствия ремоделирования включают дилатацию фиброзного кольца митрального клапана и дисфункцию папиллярных мышц с сопутствующей митральной недостаточностью, увеличение нагрузки на стенки левого желудочка, повышенную потребность в кислороде и ишемию миокарда даже при отсутствии поражения коронарных артерий [7]. Снижение насосной функции у таких пациентов обусловлено не только нарушением сократительной способности миокарда, но и асинхронным сокращением правого и левого желудочков, а также различных участков миокарда каждого из желудочков. При нарушениях проводимости происходит задержка диастолы левого желудочка. Раннее наполнение правого желудочка приводит к смещению межжелудочковой перегородки влево, что затрудняет наполнение левого. С другой стороны, дилатация камер сердца и повышенное внутрипредсердное давление вызывают нарушение растяжимости перикарда при наполнении желудочков. Тенденция к более раннему наполнению правого желудочка приводит к повышению давления в полости перикарда в начале наполнения левого желудочка. В фазу быстрого наполнения ток крови осуществляется по градиенту давления между левым предсердием и левым желудочком, а эта разница ограничена суммой гидростатического давления крови в левом желудочке и давления снаружи на его стенки и полости перикарда. Таким образом, этот механизм также вызывает нарушение диастолической функции левого желудочка. Вследствие нарушения внутрижелудочковой проводимости и удлинения интервала между деполяризацией межжелудочковой перегородки и активацией свободной стенки левого желудочка, последняя начинает сокращаться тогда, когда миокард перегородки уже начал расслабляться. Такая асинергия приводит к снижению глобальной и региональной сократимости левого желудочка [8,9]. Подводя итог вышесказанному, можно предположить, что клиника ХСН это результат нарушений проводимости и геометрии камер сердца. Соответственно, оказывая воздействие на эти процессы можно добиться обратного ремоделирования сердца, снизив ее выраженность.
Параллельно изучению и развитию консервативной терапии ХСН, не малых результатов добились кардиологи с помощью электрофизиологических методов лечения, ассортимент которых, на сегодняшний день, сводится к трем процедурам.
Первое – это постановка (имплантация) обычных электрокардиостимуляторов (ЭКС), что актуально для пациентов с синдромом слабости синусового узла (СССУ) и предсердно-желудочковыми блокадами. Кроме коррекции ритма сердца, это позволяет более эффективно и безопасно проводить медикаментозную терапию ХСН. При этом оптимальным является использование ЭКС не с фиксированной, а с адаптируемой частотой стимуляции, и прежде всего – двухкамерных. Однако длительная стимуляция правого желудочка сама по себе является причиной асинхронии сокращения желудочков и чревата усугублением течения ХСН. Поэтому предпочтительнее имплантировать желудочковый электрод с активной фиксацией в средние отделы межжелудочковой перегородки (МЖП) 12.
Первые ЭКС работавшие в асинхронном режиме (VVO) или их стимуляции по требованию (VVI), хотя и спасали жизнь, но приводили к предсердно-желудочковой диссинхронии или к инвертированной последовательности сокращения желудочков и предсердий, что нередко приводило к развитию пейсмекерного синдрома. Возникающий при этом ретроградный заброс крови в легочные вены сопровождался сохранением и/или прогрессированием ХСН. Использование ЭКС с электродами в правом предсердии (ПП) и ПЖ позволяет восстановить последовательность и оптимизировать во времени сокращения предсердий и желудочков, тем самым нормализовать диастолическое наполнение ЛЖ и улучшить гемодинамику. Тем не менее, двухкамерная стимуляция не является в полной мере сердечной ресинхронизирующей терапией (СРТ), так как, синхронизируя сокращение предсердий и желудочков сердца, она сопровождается возникновением асинхронности сокращения между желудочками и внутри желудочков. Это связано с тем, что ПЖ начинает активироваться и сокращаться раньше левого, демонстрируя на ЭКГ картину блокады левой ножки пучка Гиса (БЛНПГ). Развитие этого направления привело к внедрению метода так называемой сердечной ресинхронизирующей терапии (СРТ). Для этого используется схема трехкамерной стимуляции сердца – один электрод в правом предсердии, второй в ПЖ и третий (через коронарный синус) в ЛЖ. Такая система позволяет установить оптимальную для каждого больного атрио-вентрикулярную задержку (паузу между навязанным сокращением предсердий и желудочков) и устранить асинхронию в работе желудочков (путем их одновременной стимуляции). Наконец, последним методом является постановка имплантируемого кардиовертера-дефибриллятора (КВДФ) больным ХСН и опасными для жизни желудочковыми нарушениями ритма сердца – желудочковой тахикардией или фибрилляцией желудочков сердца 15.
Следует отметить, что применение всех электрофизиологических методов лечения ХСН должно начинаться только на фоне максимальной активной терапии при ее недостаточной эффективности. Это не альтернатива, а дополнение к максимально активной терапии больных. Имплантация устройств СРТ-Д рекомендуется больным, которые не только находятся на оптимальной медикаментозной терапии по поводу СН, но и могут иметь достаточно высокий уровень качества жизни и ее продолжительность не менее одного года после имплантации устройств.
Целью данного исследования явилось изучение результатов влияния КВДФ и устройства для ресинхронизирующей терапии сердца с функцией дефибрилляции на сократительную способность миокарда в отдаленном периоде.
Материалы и методы
Клиническая характеристика пациентов
Данное исследование имеет ретроспективный характер. Основным показателем эффективности имплантированного устройства явилась сократительная способность миокарда, в частности фракция выброса ЛЖ. Отбор пациентов происходил в зависимости от типа имплантированного устройства. В первой группе были пациенты с КВДФ, во второй – устройствами для ресинхронизирующей терапии с функцией дефибрилляции. В настоящее исследование вошло 24 пациента. 17 пациентов (70,1%) мужского пола и 7 (29,9%) женского пола, которым были выполнены операции по имплантации КВДФ. Более подробная характеристика приведена в таблице №1. Средний возраст составил 53,4 ±15,3 года. Функциональный класс по NYHA в первой группе в среднем составлял 2,09 ± 0,3, во второй – 2,7±0,5. У семнадцати пациентов (70,8%) имела место пароксизмальная форма желудочковой тахикардии (ЖТ), документированные на ЭКГ либо индуцированные во время электрофизиологического исследования сердца (ЭФИ), у девяти пациентов (37,5%) отмечалась ишемическая болезнь сердца (ИБС). Дилатационная кардиомиопатия (ДКМП) в стадии декомпенсации, с расширением камер сердца и снижением ФВ ЛЖ, на фоне оптимальной медикаментозной терапии вявлена у 6 пациентов (25%). У 1 пациента (4,2%) диагноз аномалия Эбштейна, после репротезирования трикуспидального клапана (ТК) биологическим протезом. У него в послеоперационном периоде отмечалась полная атриовентрикулярная блокада с пароксизмами ЖТ, что потребовало имплантации КВДФ. У 7 пациентов (29,2%) - в анамнезе острый инфаркт миокарда (ОИМ), 6-ти (25%) - выполнена операция аортокоронарного шунтирования (АКШ), в двух случаях, из них в сочетании с геометрической реконструкцией левого желудочка по поводу аневризмы ЛЖ. Трем пациентам (12,6%) выполнено стентирование коронарных артерий, 2 (8,4%) из которых ранее выполнена АКШ. Одному пациенту (4,2%) была выполнена радиочастотная аблация (РЧА) правого перешейка сердца по поводу трепетания предсердий. Артериальная гипертензия сопутствовала в тринадцати случаях, преимущественно в группе с СРТ-Д. Тринадцати пациентам (41,7%) после имплантации КВДФ, была произведена его замена в связи с истощением батареи.
Предоперационная подготовка
В предоперационном периоде все пациенты проходили стандартное клинико-диагностическое обследование, включающее лабораторную диагностику анализов крови, электрокардиографическое исследование (ЭКГ), эхокардиографическое исследование сердца (ЭхоКГ), рентгенологическое исследование органов грудной клетки, суточное мониторирование ЭКГ. Пациентам, у которых в диагнозе фигурировала желудочковая тахикардия, выполнялось ЭФИ по утвержденному протоколу, для выявления и устранения эктопического очага, вызывающего пароксизм, а также других потенциально возможных нарушений ритма. Решение об имплантации КВДФ принималось при невозможности определения эктопического очага, либо его устранения. Пациентам, которым планировалась имплантация устройства СРТ, выполнялась ЭхоКГ с тканевой допплерографией для определения диссинхрони, также по утвержденному протоколу. Пациенты, получающие антиагрегантную терапию, переводились на гепарин за 10 дней, с отменой аспирина и контролем показателей агрегации тромбоцитов. За сутки до операции гепарин отменялся. За 30 минут до доставки пациента в рентгеноперационную, выполнялась премедикационная инъекция (раствор 1мл 2% промедола и 2мл 0,5% реланиума), а также антибиотикопрофилактика.
Ведение и наблюдение в послеоперационном периоде
После перевода в палату, пациенту прописывался постельный режим на сутки с грузом в области имплантации устройства, с целью гемостаза. Пациенты были подключены к непрерывному мониторингу ЭКГ и АД. На вторые сутки проводилась плановая активизация, выполнялся контроль общего анализа крови, а также рентгенологическое исследование, с целью исключения пневмоторакса и дислокации электродов. В послеоперационном периоде все пациенты получали плановую антибиотикотерапию в течение трех суток, с последующей отменой и переводом на нестероидные противовоспалительные препараты (НПВП). Пациенты с ИБС получали стандартную терапию, включающую ß-блокаторы, ингибиторы АПФ, антагонисты Са, мочегонные препараты. Назначение дезагрегантной терапии осуществлялось в зависимости от процесса заживления послеоперационной раны. Пациенты с пароксизмальной ЖТ, получали соответствующую антиаритмическую терапию, направленную на стабилизацию миокарда, снижение частоты желудочковых аритмий и срабатывания КВДФ, что, напрямую, отражается на качестве жизни пациента, а также снижает расход заряда батареи, отсрочивая ее истощение. Пациенты с ДКМП получали терапию, соответствующую таковой при ХСН. Выписка производилась на 5-7 сутки после операции при отсутствии каких-либо осложнений, после контрольной проверки параметров имплантированного устройства (КВДФ или СРТД) и электродов, что выполнялось под контролем ЭхоКГ для подбора оптимальных параметров функционирования последних. Перед выпиской все пациенты также проходили полный клинико-диагностический контроль, включающий лабораторные анализы крови, ЭКГ, рентгенологическое исследование органов грудной клетки, ХМ ЭКГ и трансторакальное ЭхоКГ.
Результаты
Для статистических расчетов применялись следующие программные пакеты: «Excel MS Office- Professional» и «Statistica 8.0». Сравнение зависимых переменных выполнялось при помощи критерия парных сравнений Вилкоксона. Сравнение групп проводилось с использованием t-критерия Стьдента или U-критерия Манна-Уитни. Надежность используемых статистических оценок принималась не менее 95%.
Госпитальная летальность отсутствовала. Общее время наблюдения в среднем составило 2,9±1,2 лет, у одиннадцати пациентов (45,6%) продолжительность наблюдения была равна 3,7±0,9 лет. Результаты обследования по данным ЭхоКГ до операции и после наблюдения представлены в таблице 2. Средние значения ФВ ЛЖ в общей группе до операции составили 46,5 ±16,4%, в группе с КВДФ 58,7±14,8%, а с СРТД 35,3±7,2%. После наблюдения (период 34,8 мес.) ФВ ЛЖ в группе с КВДФ практически не изменилась. В группе с СРТД увеличилась до 42,1±9,6% (p=0,0341). Аналогичная тенденция прослеживается в остальных показателях. КДО ЛЖ до операции в общей группе составлял 220,9 ±97,0 мл, после 156,8 ±78 мл, в группе с КВДФ 146,8 ±57,8 мл до операции и 133,7±45,4 мл после операции, в группе же с устройствами СРТД КДО ЛЖ до операции составлял 276,4±83мл и 187,6±102,5 мл после операции. КДР ЛЖ до операции в общей группе составлял 5,9±1,2см, после 5,9±1,2см, в группе с КВДФ 5,3 ±0,8см до операции и 5,3 ±0,8см после операции, в группе же с устройствами СРТ КДР ЛЖ до операции составлял 7,1±1,0см и 6,7±1,0см после операции. КСР ЛЖ до операции в общей группе составлял 4,7±1,5см, после 4,3±1,2см, в группе с КВДФ 3,6±1,1см до операции и 3,7±0,9см после операции, в группе же с устройствами СРТ КСР ЛЖ до операции составлял 5,8 ±0,9см и 5,2±1,0см после операции. Что указывает на процесс обратного ремоделирования сердца. За время пребывания в стационаре в послеоперационном периоде осложнения развились у трех больных, среди которых одно нагноение ложа КВДФ, с последующей эксплантацией устройства и имплантацией нового КВДФ с контралатеральной стороны, с благоприятным исходом. Также выявлено два случая дислокации электрода. Этим пациентам была выполнена репозиция электрода в условиях рентгеноперационной, также с благоприятным исходом.
В настоящем исследовании представлены результаты имплантации КВДФ и ресинхронизирующих устройств с функцией дефибрилляции пациентам с ХСН, с низкой ФВ ЛЖ, а также с жизнеугрожающими нарушениями ритма сердца. Анализируя эти данные можно утверждать, что синхронное сокращение желудочков сердца, как результат ресинхронизирующей терапии, приводит к обратному ремоделированию сердца, уменьшая объемы и размеры камер сердца, что благотворно влияет на выживаемость и качество жизни пациентов в ближайшем и отдаленном периоде.
Ресинхронизирующая терапия является современным эффективным и безопасным методом лечения пациентов с сердечной недостаточностью, причем как в случае с исходно низкой фракцией выброса левого желудочка, которым проводится операция на сердце в условиях искусственного кровообращения, с применением временной бивентрикулярной стимуляции, так и при лечении ХСН с имплантацией устройств для постоянной ресинхронизирующей терапии.
Высокая эффективность КВДФ в первичной и вторичной профилактике внезапной сердечной смерти у пациентов высокой группы риска была убедительно продемонстрирована в исследованиях AVID, MADIT I, MADIT II. Кардиомиопатия, постинфарктный кардиосклероз, ФВ менее 35%, а также аритмии сердца, угрожающие жизни, являются показанием к имплантации ресинхронизирующего устройства с функцией дефибрилляции.
В 2011 году опубликованы результаты мета-анализа «Сердечная ресинхронизирующая терапия у пациентов с умеренно-выраженной сердечной недостаточностью». Цель мета-анализа заключалась в оценке преимуществ и недостатков ресинхронизирующей терапии у пациентов с тяжелой и слабо выраженной СН. Мета-анализ включал такие исследования как: B-LEFT HF, BELIEVE, CARE-HF, COMBAT, COMPANION, DECREASE-HF, HOBIPACE, MADIT-CRT, MIRACLE, MIRACLE ICD и др, общей сложностью 25 исследований и более 9 тысяч пациентов, по результатам которого выявлено, что имплантация устройств для ресинхронизирующей терапии имеет положительные результаты у пациентов с сниженной ФВ ЛЖ, симптомами сердечной недостаточности, удлиненным интервалом QRS, не зависимо от функционального класса по NYHA [16].
Выводы
Имплантация устройств СРТ с функцией дефибрилляции улучшает фракцию выброса левого желудочка приводит к обратному ремоделированию сердца, с уменьшением объемов и размеров его камер, а также снижает риск развития внезапной сердечной смерти.
ИКВДФ не влияют на фракцию выброса левого желудочка, однако снижают риск ВСС, тем самым улучшая выживаемость среди пациентов с жизнеугрожающими аритмиями.
Ресинхронизация сердца при сердечной недостаточности. Имплантируемый кардиовертер-дефибриллятор при СН
Показания для имплантируемого кардиовертера - дефибриллятора (ИКД) и ЭКГ при нем
• Имплантируемый кардиовертер/дефибриллятор (ИКД) может сразу «распознать» желудочковую тахикардию или мерцание желудочков и через определенный, заранее установленный промежуток времени вызвать дефибрилляцию.
• Техника операции по установке электродов через центральную вену и имплантации самого устройства (размеры которого в настоящее время удалось уменьшить) стала значительно проще.
• Основными показаниями к установке ИКД являются желудочковая тахикардия, рефрактерная к медикаментозной терапии, и состояние после реанимации с применением дефибриллятора.
Устойчивая желудочковая тахикардия является опасным для жизни нарушением ритма сердца, которое наблюдается практически только при серьезном поражении сердца, например у больных ИБС или перенесших ИМ. Если не предпринять своевременно мер по ее устранению, то она неизбежно приведет к смерти. Для лечения устойчивой желудочковой тахикардии применяют медикаментозную и электрошоковую терапию. Однако медикаментозное лечение у 30—50% больных с рецидивирующими желудочковыми тахиаритмиями оказывается безуспешным.
Кардиоверсия или дефибрилляция - это действенные методы неотложной терапии, которые, однако, можно применять не везде и не в любое время. При повышенном риске смерти следует обсудить возможность имплантации кардиовертера/дефибриллятора.
Под кардиоверсией понимают нанесение разряда, синхронизированного с зубцом R. Такая синхронизация позволяет избежать «попадания» разряда в уязвимую фазу (зубец Т). При дефибрилляции разряд наносят без синхронизации.
Имплантируемый кардиовертер-дефибриллятор (ИКД) может «распознать» желудочковую тахикардию или мерцание желудочков и через определенный, заранее установленный промежуток времени автоматически выполнить кардиоверсию или дефибрилляцию. Если позволяют условия, прежде чем нанести разряд, следует попытаться устранить тахикардию при помощи опережающей желудочковой стимуляции. Кроме того, можно попробовать это сделать при помощи ЭКС для двухкамерной стимуляции (DDD).
Принцип действия и примеры применения импланируемого кардиовертер-дефибриллятора (ИКД):
а Схематическое изображение принципа действия ИКД.
b Синусовый ритм.
с Желудочковая тахикардия.
d Желудочковая тахикардия, затем упреждающая желудочковая стимуляция (7 стимулов), не приведшая к урежению ритма.
е Автоматическая интракардиальная кардиоверсия, приведшая к возвращению синусового ритма.
После первого описания Муrowski в 1980 г. ИКД это устройство было значительно усовершенствовано:
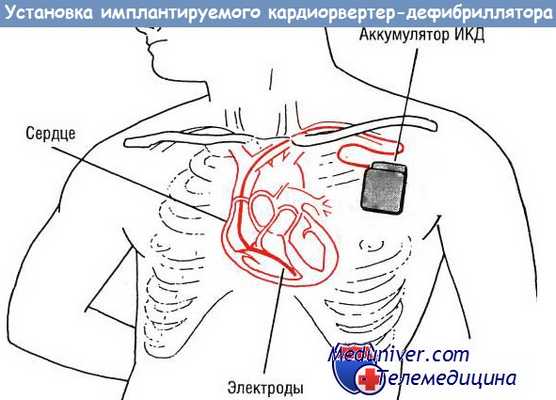
• Трансвенозные электроды: в настоящее время уже нет необходимости выполнять торакотомию, которая таит риск осложнений. Электроды, при помощи которых осуществляют электрическую дефибрилляцию для прерывания тахиаритмии, уже не подшивают к эпикарду, а вводят в ПЖ, как при имплантации ЭКС. Это значительно упростило операцию и сделало ее более безопасной.
• Уменьшение размеров ИКД: устройство для кардиоверсии/дефибрилляции раньше весило 280 г, в настоящее время оно весит около 60 г, что позволяет вживлять ИКД под грудную мышцу. Летальность при этой операции составляет примерно 0,5% (раньше, когда выполняли торакотомию и использовали эпикардиальные электроды, операционная летальность была равна 5,5%).
Основными показаниями к установке импланируемого кардиовертер-дефибриллятора (ИКД) являются:
• устойчивая желудочковая тахикардия, рефрактерная к медикаментозной терапии;
• состояние после реанимации с применением дефибриллятора;
• неустойчивая желудочковая тахикардия, например после ИМ, на фоне сниженной фракции выброса ЛЖ (<30%);
• синдром удлиненного интервала QT и синдром Бругада (блокада ПНПГ с подъемом сегмента ST в отведениях V1-V3 и с обмороками) и опасными для жизни желудочковыми тахиаритмиями;
• тяжелая сердечная недостаточность (фракция выброса <35%);
• обмороки при фракции выброса
При помощи импланируемого кардиовертер-дефибриллятора (ИКД) нового типа можно регистрировать приступы апноэ, что важно при лечении больных с синдромом апноэ во сне. Применение импланируемого кардиовертер-дефибриллятора (ИКД) значительно улучшило прогноз у больных с желудочковыми тахиаритмиями.
Особенности импланируемого кардиовертер-дефибриллятора (ИКД):
• Нанесение электрического разряда (кардиоверсия или дефибрилляция) после распознавания аритмии
• Основные показания: рефрактерная к терапии желудочковая тахикардия и состояние после реанимации с применением дифибриллятора
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Показания для имплантации кардиовертера-дефибриллятора (ИКД)
Показания рассматриваются с точки зрения необходимости первичной и вторичной профилактики внезапной смерти. Первичная профилактика - это лечебное вмешательство, проводимое у пациентов с высоким риском смерти от ЖТ или ФЖ, у которых, однако, эти тахиаритмии еще никогда не возникали. Вторичная профилактика - это лечение пациентов, у которых уже наблюдались эпизоды ЖТ и ФЖ.
Показания для имплантации кардиовертера-дефибриллятора в Великобритании
(Национальный институт здоровья и клинического мастерства)
а) С целью вторичной профилактики. Вопрос об имплантации дефибриллятора следует рассмотреть в отношении следующих пациентов при условии, что аритмия не связана с острым ИМ или устранимой причиной: 1.Лица, пережившие внезапную сердечную смерть, вызванную ФЖ или ЖТ
2. Пациенты, перенесшие устойчивую ЖТ, сопровождавшуюся синкопальным состоянием или выраженными нарушениями гемодинамики
3. Пациенты, перенесшие устойчивую ЖТ, не сопровождавшуюся синкопальным состоянием или остановкой кровообращения, у которых ФВ ЛЖ
б) С целью первичной профилактики. Вопрос об имплантации дефибриллятора следует рассмотреть в отношении следующих пациентов:
1. Пациенты, перенесшие острый ИМ (более 4 нед. назад) и имеющие симптомы хронической сердечной недостаточности не тяжелее III класса по классификации NYHA и все из нижеперечисленного:
а) неустойчивую ЖТ при амбулаторном мониторировании ЭКГ
б) ЖТ, индуцированную при электрофизиологическом исследовании
в) ФВЛЖ120 мс
2. Пациенты, страдающие следующими заболеваниями сердца при наличии факторов высокого риска внезапной смерти:
а) синдром удлиненного интервала QT
б) ГКМП
в) синдром Бругада
г) аритмогенная кардиомиопатия ПЖ
д) состояние после хирургической коррекции врожденного порока сердца
В ряде крупных клинических исследований было показано, что у данных пациентов установка имплантируемого кардиовертер-дефибриллятора (ИКД) обеспечивает снижение смертности по сравнению с антиаритмической терапией. В целом, по данным этих исследований, смертность от сердечных причин снижается на 50%, а общая смертность - примерно на 24%.
Проведенный анализ показал, что за 3-летний период на каждые 4-5 ИКД приходится одна сохраненная жизнь. Эти рекомендации основаны на результатах исследований, в которых было показано, что у данных пациентов установка ИКД приводит к уменьшению смертности по сравнению с антиаритмической терапией (в основном с использованием амиодарона).
Относительно пункта д было показано, что у больных с тетрадой Фалло, перенесших хирургическое вмешательство с целью коррекции порока, предикторами внезапной смерти являются увеличение продолжительности комплекса QRS и дисфункция желудочков.

Трансвенозная кардиоверсия по поводу желудочковой тахикардии (ЖТ)
Дополнительные показания для первичной профилактики, не противоречащие рекомендациям Великобритании
Анализ результатов этих исследований показал, что тактика лечения, предусматривающая имплантацию ИКД у больных с резко выраженной желудочковой дисфункцией, будет способствовать продлению жизни в среднем на 2-6 лет и является экономически целесообразной.
В упомянутых исследованиях также было продемонстрировано, что антиаритмическая лекарственная терапия (в основном с использованием амиодарона) хотя и может уменьшить частоту возникновения желудочковых аритмий, не улучшает прогноз.
Имплантируемый кардиовертер-дефибриллятор при недавно перенесенном инфаркте миокарда
Пациенты с недавно перенесенным ИМ в представленные выше исследования не включались. В другом исследовании принимали участие больные, недавно перенесшие ИМ, с ФВ ЛЖ
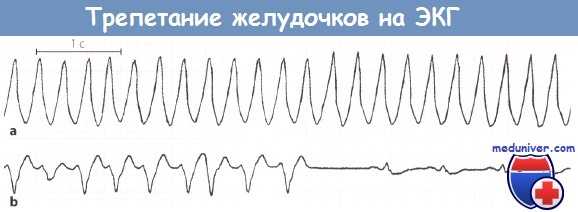
Трепетание желудочков:
а Трепетание желудочков. Частота сокращений желудочков 230 в минуту. Комплексы QRS уширены и деформированы.
b Желудочковая тахикардия, появившаяся после электрошоковой терапии. Позднее появился устойчивый синусовый ритм.
Показания для имплантации кардиовертера-дефибриллятора по руководству Американской коллегии кардиологов и Американской ассоциации сердца
Ниже перечислены основные рекомендации (т.е. рекомендации I класса).
Имплантация имплантируемого кардиовертер-дефибриллятора (ИКД) показана пациентам:
1) выжившим после остановки сердца вследствие ФЖ или устойчивой ЖТс нарушением гемодинамики (только после обследования с целью установления этиологии данных аритмий и исключения всех полностью обратимых причин)
2) с органическим заболеванием сердца и спонтанной устойчивой ЖТ независимо от того, протекала ли она с нарушением гемодинамики или без такового
3) с синкопальным состоянием неустановленной природы и клинически значимой, гемодинамически нестабильной устойчивой ЖТ или ФЖ, индуцированной в ходе электрофизиологического исследования
4) с ФВ ЛЖ 5) с дилатационной кардиомиопатией неишемического генеза и ФВ ЛЖ 6) с дисфункцией ЛЖ и ФВ ЛЖ 7) с неустойчивой ЖТ вследствие перенесенного ранее ИМ и ФВ ЛЖ 540%, у которых в ходе электрофизиологического исследования удалось индуцировать ФЖ или устойчивую ЖТ

Устранение фибрилляции желудочков (ФЖ) при помощи имплантируемого кардиовертер-дефибриллятора (ИКД)
Уточнения, касающиеся имплантации кардиовертера-дефибриллятора с целью первичной профилактики
Перед применением результатов клинических исследований на практике необходимо обсудить с пациентом как негативные аспекты установки имплантируемого кардиовертер-дефибриллятора (ИКД), так и существенную пользу данного вмешательства.
Недостатками являются возможность развития осложнений, связанных с установкой имплантируемого кардиовертер-дефибриллятора (ИКД), как в ближайшем, так и в отдаленном периоде, вероятность неадекватного срабатывания устройства, возможность отрицательного влияния на психику пациента, а также ограничения, связанные с управлением автотранспортом (см. ниже).
С возрастом у пациента увеличивается вероятность развития других «некардиальных» заболеваний, которые могут сократить жизнь (к ним относятся, например, инсульт или рак). Таким образом, с точки зрения ожидаемой продолжительности жизни, у пожилого пациента с нарушенной функцией желудочков вероятность того, что установка ИКД окажется полезной, меньше, чем у лиц молодого или среднего возраста.
Недавно в одном исследовании было продемонстрировано, что установка имплантируемого кардиовертер-дефибриллятора (ИКД) больному, удовлетворяющему трем и более критериям (возраст старше 70 лет, класс NYHA выше II, мочевина сыворотки >26 мг/дл, продолжительность QRS >120 мс, наличие ФП), вероятнее всего, окажется бесполезной с позиции первичной профилактики.

Мономорфная ЖТ, купированная с помощью короткой серии частых желудочковых стимулов: артефакты стимулов лучше всего видны в отведениях V3 и V4.
Около 30% пациентов со сниженной ФВ симптомной СН (III/IV ФК NYI1A) имеют продолжительность комплекса QRS > 120 мсек. Это проявление патологической меж- и внутрижелудочковой проводимости на ЭКГ используют для выявления пациентов с асинхронным сокращением желудочков. Механические последствия желудочковой диссинхронии включают недостаточное наполнение желудочков, снижение сократимости ЛЖ, увеличение длительности (и следовательно, тяжести) митральной регургитации и парадоксальное движение межжелудочковой перегородки.
Бивентрикулярная стимуляция и СРТ возбуждают оба желудочка почти одновременно, тем самым улучшая координацию их сокращения и снижая тяжесть MP При сочетании СРТ и оптимального медикаментозного лечения у пациентов с синусовым ритмом наблюдается значительное снижение показателей смертности и госпитализаций, обратное ремоделирование ЛЖ, а также улучшение качества жизни и переносимости ФН. В ходе исследования CARE-HF (Cardiac Resynchronization in Heart Failure) пациенты с СН III/IV ФК NYHA при ФВ ЛЖ < 35% и с признаками сердечной диссинхронии были рандомизированы на две группы лекарственной терапии с применением СРТ или без такового.
Соответственно, на основе обобщенного опыта клинических исследований СРТ рекомендуется пациентам с синусовым ритмом при ФВ < 35% и продолжительностью комплекса QRS >120 мсек, у которых сохраняются симптомы (III/IV ФК NYH А), несмотря на оптимальное медикаментозное лечение. Эффективность СРТ у пациентов с ФП не установлена.
Профилактическая имплантация ИКД у пациентов с легкой или умеренной СН (И/Ш ФК NYH А) снижает количество ВСС у пациентов с ишемической или неишемической КМП. Цель исследования SCD-HeFT (Sudden Cardiac Death in Heart Failure Trial) заключалась в выяснении, будет ли терапия амиодароном или применение однокамерного ИКД, используемого только при шоке, снижать риск смерти по любой причине у пациентов с легкой или умеренной СН ишемического или неишемического происхождения.
Результаты исследования показали, что по сравнению с плацебо амиодарон ассоциируется с таким же риском смерти (ОР 1,06; 97,5% ДИ 0,86-1,30; р = 0,53), в то время как применение ИКД сопровождалось снижением риска смерти на 23% (ОР 0,77; 97,5% ДИ 0,62-0,96; р = 0,007). Соответственно, имплантацию ИКД следует рассматривать при лечении пациентов с СН II/III ФК NYHA и сниженной ФВ < 30-35%, уже получающих оптимальную базовую терапию, включающую ИАПФ, ВРА, бета-АБ и антагонист альдостерона.
ИКД (отдельно или в комбинации с амиодароном) также высокоэффективен при лечении рецидивов устойчивой ЖТ и/или фибрилляции желудочков (ФЖ) у пациентов с СН с рецидивами аритмии и/или потерей сознания вследствие внезапного паления СВ. ИКД можно при необходимости комбинировать с бивентрикулярным кардиостимулятором.
- Вернуться в оглавление раздела "Кардиология."
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Услуги, которые оказывает стационар Клиники
Медикаментозное восстановление синусового ритма – восстановление нормального ритма сердечных сокращений с помощью приема препарата внутрь или внутривенного введения.
Электроимпульсная терапия (ЭИТ) – медицинская процедура восстановления нормального ритма сердечных сокращений с помощью электрического разряда.
Если есть показания для электроимпульсной терапии при таких нарушениях ритма, как фибрилляция или мерцание, трепетание предсердий.
Как проходит процедура?
- В экстренной ситуации, когда речь идет о спасении жизни, специальная предварительная подготовка нецелесообразна. Если позволяет время и процедура заранее запланирована, проводится лёгкая внутривенная седация (внутривенное введение лекарственных препаратов, позволяющих провести процедуру без каких-либо ощущений).
- В 95% случаев восстановление нормального сердцебиения с использованием электрического тока проводится в плановом порядке. Процедура требует госпитализации и определенной подготовки.
- Плановое лечение проводится только в условиях отделения реанимации. Здесь можно использовать анестезиологическое пособие, контролировать жизненные показатели организма (сердцебиение, давление), а также при необходимости проводить комплекс реанимационных мероприятий.
- Для контроля работы сердца пациенту устанавливаются на поверхности тела датчики ЭКГ, и анестезиолог проводит внутривенный наркоз (короткого действия, управляемый).
- Пластины-электроды кардиовертера (прибора для восстановления ритма) накладывают на переднюю и боковую поверхность грудной клетки в области сердца.
- Разряд наносится на выдохе, первоначальная его мощность составляет 200 Дж. Если такая величина разряда оказалась неэффективной, наносят второй разряд мощностью 270 Дж. Если не произошло восстановления ритма, электроды располагают на груди и на спине пациента, и процедуру повторяют вновь.
- В течение всего периода проведения процедуры врач-анестезиолог контролирует работу сердца и артериальное давление на кардиомониторе.
Хирургическое лечение нарушений ритма сердца и проводимости, а также состояний, связанных с редкой частотой пульса
В рентгеноперационной «КардиоКлиники» уже много лет проводятся операции по имплантации современных кардиостимуляторов. В последнее время врачи-аритмологи Клиники все чаще рекомендуют имплантацию МРТ-совместимых устройств, в том числе с функцией ресинхронизации, дефибрилляторов – кардиовертеров.
С 2021 года после полной реинновации и обновления оборудования рентгеноперационной на самое современное и высокотехнологичное Клиника стала заниматься инвазивной аритмологией – это проведение «прижиганий» участка аритмии с помощью радиочастотного датчика (РЧА – радиочастотная аблация) или локальным воздействием экстремально низкими температурами - холодом (криоаблация).
Купирование гипертонического криза
Купирование гипертонического криза осуществляется под круглосуточным наблюдением врача кардиолога, реаниматолога с применением суточного мониторирования артериального давления.
При необходимости проводится осмотр высококвалифицированными специалистами смежных специальностей: неврологом, эндокринологом, флебологом, пульмонологом. Есть возможность выполнения МРТ, КТ головного мозга и других органов и систем. И, конечно, после купирования гипертонического криза и подбора базовой терапии для лечения гипертонической болезни, пациент получает подробные индивидуальные рекомендации по профилактике и навыкам самостоятельного купирования криза.
Подбор оптимальной медикаментозной терапии
Подбор оптимальной медикаментозной терапии проводится для лечения артериальной гипертензии, сердечной недостаточности, ишемической болезни сердца (ИБС), нарушений сердечного ритма. В условиях стационара осуществлять подбор терапии очень эффективно и безопасно. Находясь под круглосуточным наблюдением врачей с регистрацией всех параметров сердечно-сосудистой системы (артериального давления, пульса, ЭКГ) путём передачи данных на центральный пост, есть возможность в кратчайшие сроки подобрать индивидуальную схему лечения.
Лечение сахарного диабета и его осложнений
Лечение сахарного диабета в отделении Клиники проводится под наблюдением высококвалифицированного специалиста – эндокринолога.
Врач осуществляет индивидуальный подбор сахароснижающей терапии с возможностью круглосуточной регистрации глюкозы крови, проводит детальное обследование и лечение осложнений
сахарного диабета.
Эмболизации артерий
Лечение легкой и средней тяжести ТЭЛА
- Выполняется МСКТ ангиопульмонография, ЭхоКГ, контроль лабораторных показателей, в т.ч. коагулограммы.
- УЗДГ вен н/конечностей, при необходимости МСКТ и УЗИ органов брюшной полости; консультация смежных специалистов
- Подбор эффективной и безопасной дозы антикоагулянтной терапии;
- Лечение осложнений ТЭЛА.
Лечение ухудшения течения сердечной недостаточности
Лечение тяжелых форм сердечной недостаточности, как правило, проводится в отделении реанимации и интенсивной терапии под круглосуточным контролем показателей гемодинамики (АД, пульса, ЧСС)пациента.
Проводится дегидратирующая терапия, направленная на уменьшение нагрузки на сердце, устранение застойных явлений во всех органах, уменьшение периферических отеков путём внутривенного введения мочегонных препаратов. При этом проводится ежедневный контроль эффективности данной терапии, т. е. адекватный диурез: контролируется вес, количество выпитой, а также введенной внутривенно жидкости и выделенной мочи, лабораторные показатели.
Лечение осуществляется под круглосуточным наблюдением врача реаниматолога-анестезиолога.
Переливание крови
Трансфузиологическая помощь оказывается в «КардиоКлинике» с 2021 года.
Проводится гемотрансфузия (переливание крови) следующим категориям пациентов:
Читайте также:
