Результаты слуховой стволовой имплантации и ее прогноз
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Результаты слуховой стволовой имплантации и ее прогноз
Сравнительные результаты эффективности начальной группы реципиентов многоканальных ABI сообщались ранее. За некоторыми заслуживающими внимания исключениями, восприятие речи с использованием ABI обычно не достигает очень высоких уровней, обеспечиваемых современными кохлеарными имплантатами. Тем не менее, слуховые ощущения в комбинации с чтением по губам могут быть очень эффективными в помощи речевой связи. При регулярном и продолжительном использовании ABI, у реципиентов обычно наблюдается значительное повышение эффективности со временем, продолжающееся в течение многих лет. Регулярное использование устройства сильно увеличивает эффективность, и необходимость этого должна быть разъяснена пациентам до операции.
На рисунке ниже показаны средние уровни восприятия речи в различных тестах у двух групп реципиентов ABI: менее двух лет использования и более двух лет использования. Эти результаты получены из клинических испытаний FDA пациентов, использовавших старые восьмиэлектродные решетки. В группе с большей длительностью использования показатели были значительно лучше.
Это показывает, что эффект продолжает улучшаться через два года после имплантации ABI. У нескольких пациентов улучшение продолжалось даже через семь лет. Пациенты с завышенными ожиданиями, или те, у которых сохраняется слух на противоположной стороне, часто не используют ABI регулярно, и обычно у них не происходит повышения эффективности со временем. При потере остаточного слуха, например, после удаления опухоли на второй стороне, начинается регулярное использование устройства, и обычно отмечается повышение эффективности. Имплантация при первом удалении опухоли имеет преимущество в том, что она позволяет приспособиться к звуку ABI постепенно, до того, как пациент станет полностью зависеть от ABI.
Восприятие речи при использовании ABI, также как и кохлеарных имплантатов, может быть связано с наличием зависящих от электрода ощущений высоты звука. Такие ощущения возникают у большей части реципиентов ABI, однако диапазон, магнитуда и относительное соответствие значительно различаются. Это может быть обусловлено различиями в анатомии, сохранности нейронов и близости поверхностных электродов к слуховым нейронам. Количество доступных для использования электродов также зависит от пациента. На него отчасти влияет наличие легких неслуховых ощущений, вызванных распространением воздействия на другие близлежащие области ствола мозга. Неслуховые ощущения обычно включают покалывание, головокружение и ощущение некоторого дрожания поля зрения.
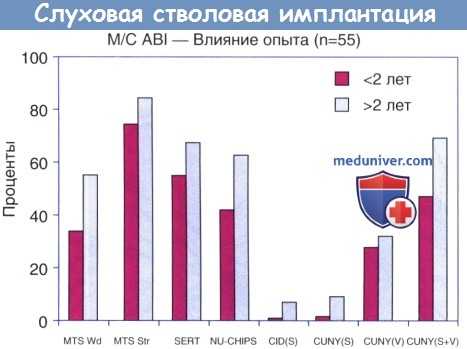
Средние уровни восприятия речи пациентов с менее чем двухлетним опытом по сравнению с теми, кто имеет больший опыт.
MTS Wd, распознавание речи односложными словами, хореем, спондеем; MTS Stress, стресс-распознавание речи односложными словами, хореем, спондеем;
SERT, тест распознавания звуковых эффектов; NU-CHIPS, тест Северо-западного университета восприятия речи детьми;
СЮ, тест предложений Центрального института глухоты; CUNY, тест предложений Городского университета Нью-Йорка;
S, только звук; S+V, звук и визуальная информация.
Устранить эти эффекты обычно удается уменьшением длительности стимулирующих импульсов или выбором другого заземляющего электрода. В большинстве случаев магнитуда неслуховых ощущениий со временем также уменьшается. Около 9% наших пациентов не получили приемлемого слуха после имплантации в первую очередь по анатомическим причинам (большой латеральный карман, деформация или повреждение крупными опухолями, неадекватное прилегание решетки к поверхности ствола мозга). В нескольких подобных случаях мы имплантировали другой многоканальный ABI при удалении опухоли второй стороны, после чего был получен эффект.
Программирование речевых процессоров ABI требует опыта. На результат могут повлиять воспринимаемые частоты, количество доступных к использованию электродов и другие факторы. Целью является оптимизация восприятия важных спектральных стимулов. В качестве части процесса, измеряли и ранжировали частотные ощущения, используя классические психофизиологические методы. Производилась попытка выстроить электроды в правильном порядке по частотам, относительно каналов частотного анализа звукового процессора. Такие «картированные» процессоры считались правильно «выстроенными по частотам».
Воспринимаемые частоты и неслуховые ощущения изменялись до определенного уровня со временем, поэтому требовалось перепрограммирование для поддержания и улучшения эффективности. Пациенты, по некоторым причинам пропустившие такую запланированную процедуру, очень часто жаловались на снижение эффективности.
Мы рассмотрели связь между числом используемых электродов, местоположением электродов и эффективностью. При наличии поверхностной электродной решетки сильной зависимости найдено не было, что заставляет предполагать, что другие стимулы, такие как временная информация могут быть также важны. При относительно больших (0,7-1 мм в диаметре) поверхностных электродах было довольно сложно активировать соответствующие нейроны в улитковых ядрах. Тем не менее, пациенты обычно отмечали лучший результат, если у них было как минимум три или четыре доступных электродных «канала», и они были правильно привязаны к широтам волн речевого процессора. Все пациенты с лучшей эффективностью также имели более широкий диапазон частотных ощущений (>30 единиц частотной шкалы, шкала из 100 единиц) между электродами.
Информация по этому вопросу представлена на рисунке ниже. Мы исследовали распознавание гласных и согласных при только звуковом предъявлении с четырьмя разными конфигурациями процессоров у одной нз наших лучших и наиболее опытных (семь лет) пациенток. Ее частотный диапазон составлял около 35 единиц. При одной конфигурации процессора использовались все девять ее электродов, но они были неправильно (в случайном порядке) выстроены по частотам.
Кроме нее, были запрограммированы двух-, четырех- и девятиэлектродные конфигурации, в которых электроды были правильно выстроены по частотам. Распознавание гласных и согласных было хуже всего при случайном выстраивании в девятиэлектродной конфигурации. Даже в конфигурации, использующей два правильно выстроенных электрода результат был лучше, чем в девятиэлектродной конфигурации со случайным выстраиванием. Результаты были почти одинаковыми (52 и 55%) у четырех- и девятиэлектродных процессоров. Затем мы протестировали двух других пациентов с хорошей эффективностью, и получили схожие результаты.
Программирование звуковых процессоров ABI, может требовать больше времени, чем программирование кохлеарных имплантатов, но упрощение процесса за счет менее тщательного выстраивания электродов может быть вредным. Лучшей конфигурацией, которая могла относительно быстро быть достигнута у вышеуказанной пациентки, являлась четырехэлектродная версия. Качество пациентка определила как более простое звучание, т.е. как отдельные ноты, а не аккорды в музыке Впоследствии она отметила, что обучение использованию ABI — длительный процесс, а четырехэлектродная конфигурация легче для начинающих пользователей.
Кохлеарные имплантаты могут обеспечивать более высокие уровни эффективности, чем ABI, отчасти по причине тонотопической организации аксональных отростков в модиолусе. Было показано, что микростимуляция слуховых нейронов ствола мозга у животных, в том числе прототипом игольчатых электродов, эффективна в создании тонотопического градиента. Это привело к разработке проникающего микроэлектрода ABI, о котором будет сказано в отдельной статье на сайте «Последние разработки слуховой стволовой имплантации».
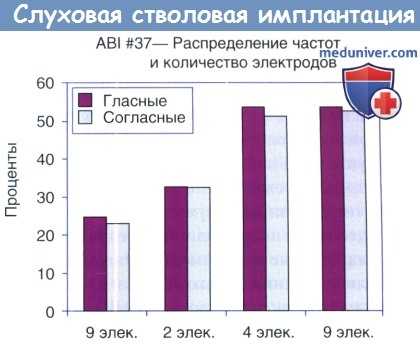
Эффект выстраивания по частотам и число электродов (элек)
на распознавание гласных и согласных (только звук) у реципиентки слухового стволомозгового имплантата с наилучшим результатом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Этапы и техника слуховой стволовой имплантации
а) Анатомические особенности слуховой стволовой имплантации. Мишенями для установки электродной решетки ABI являются дорсальные и вентральные улитковые ядра. Хотя ядра прикрыты ножками мозжечка, поверхностные ориентиры являются полезными для идентификации этой области. Часто, однако, эти структуры могут быть нарушены опухолью.
На рисунке ниже показаны основные структуры понтомедуллярного соединения и вид операционного поля при транслабиринтном доступе. Важные ориентиры включают рукавообразное окончание латерального кармана, формирующего отверстие Лушки, снизу корешок языкоглоточного (IX) черепно-мозгового нерва, и кверху от отверстия — корешки преддверно-улиткового и лицевого нервов.
Обычно интактное сосудистое сплетение указывает на вход в латеральный карман (отверстие Лушки), а сосудистая полоска косо пересекает корень бокового кармана, указывая на поверхность вентрального улиткового ядра. Эти структуры могут четко не идентифицироваться, если большая опухоль нарушает латеральную поверхность моста и мозга. В таких случаях можно проследить остаток восьмого черепно-мозгового нерва до входа в боковой карман. Девятый черепно-мозговой нерв также может использоваться как ориентир бокового кармана.
Впадину, которая иногда видна между восьмым и девятым черепно-мозговым нервом, не следует путать с входом в латеральный карман.
В самом кармане и на верхнем крае обнаруживаются дорсальные и вентральные кохлеарные ядра. Электродную решетку устанавливают в карман для обеспечения позиционной стабильности. Электрическая стимуляция вентральных ядер, основных переключателей импульсов восьмой пары черепно-мозговых нервов и большей части восходящих слуховых путей, возможно, является основным источником слуховых ощущений, даже учитывая, что некоторая часть решетки также располагается рядом с дорсальными улитковыми ядрами.
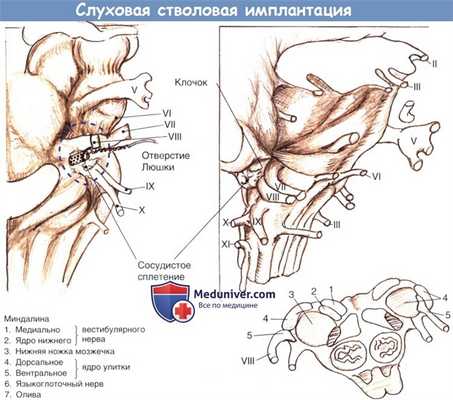
Схема области кохлеарных ядер, показывающая взаиморасположение разных ориентиров.
Отмеченная пунктиром область приблизительно соответствует операционному обзору.
Электродная решетка полностью установлена в правильное положение.
б) Хирургические особенности слуховой стволовой имплантации. Транслабиринтная краниотомия обеспечивает лучший доступ для удаления опухолей и обзора латерального кармана четвертого желудочка. Выполняется удаление акустической опухоли транслабиринтным доступом по обычной методике, за исключением дополнительной установки записывающих электродов для вызванных электричеством слуховых потенциалов ствола мозга (EABR) и любой активности VII и IX черепно-мозговых нервов. Также, как правило, используется обычный заушный разрез, а устройство размещают в кармане в височной области.
Профилактически во время индукции наркоза внутривенно вводят антибиотик, например, 3 г цефуроксима (Zinacef®, GalaxoSmithKline). Мониторинг EABR позволяет подтвердить, что электродная решетка установлена в правильное положение. Может потребоваться небольшая настройка решетки, чтобы минимизировать ответы, вызванные активацией неслуховых нервных структур. Для мониторинга EABR подкожные игольчатые электроды вводятся в область макушки, над седьмым шейным позвонком, а также на уровне роста волос на затылке.
Для электромиографической записи неслуховой активации проводится мониторинг лицевого нерва по обычной методике, а в мышцы глотки (мягкого неба) той же стороны устанавливают биполярные электроды для мониторинга активности IX черепно-мозгового нерва.
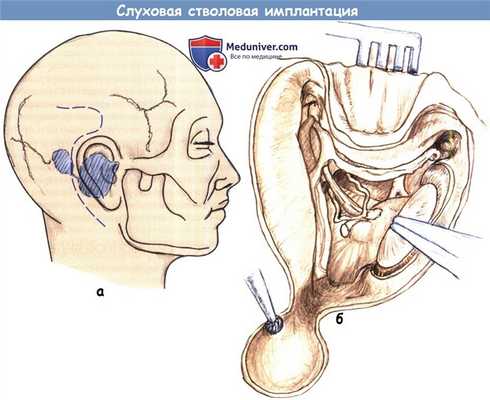
а - Расположение разреза по отношению к планируемому месту ресивера/стимулятора.
Продолжение кверху может не выполняться, а имплантат располагаться в подкожном кармане.
б - Схема операционного поля после выполненной транслабиринтной краниотомии,
высверлены ложе для ресивера/стимулятора и борозды для его проводов.
в) Техника слуховой стволовой имплантации. Удаление опухоли проводится обычным способом посредством транслабиринтной краниотомии. После полного удаления опухоли и адекватного гемостаза определяют место для размещения внутреннего ресивера кзади и кверху от мастоидальной полости, височную мышцу в этой области отделяют от теменной части и иссекают. Используя копию ресивера/стимулятора в качестве шаблона, округлую часть кортикальной кости в этой области уплощают режущими борами, и формируется проход для размещения проводов между ложем имплантата и мастоидальной полостью. На другой стороне ресивера/стимулятора наносят туннелирующие отверстия для швов, который после этого фиксируется нейлоновыми швами.
Эти действия проводятся перед размещением электродной решетки, поэтому манипуляции с проводами не влияют на положение электродов. Как только внутренний ресивер имплантирован, для гемостаза может применяться только биполярная коагуляция, поскольку прохождение тока через имплантат к стволу мозга при монополярной коагуляции представляет потенциальную опасность.
Положение латерального кармана может быть подтверждено истечением спинномозговой жидкости (СМЖ), когда анестезиолог проводит продувание среднего уха по методу Вальсальвы. Эту технику следует оставлять для последней проверки после локализации входа в латеральный карман по обычным ориентирам, поскольку СМЖ быстро дренируется и преимущества этой техники при многократном выполнении пробы Вальсальвы теряются.
После идентификации отверстия Лушки электродная решетка, надетая на иглу Rosen вводится в латеральный карман электродами кверху. С опытом мы обнаружили, что имплантат функционирует лучше, а неслуховые побочные эффекты менее выражены, если электроды полностью установлены в латеральный карман. После установки выбранные электроды в решетке активируют, чтобы определить их позицию относительно улитковых ядер.
Электродная решетка фиксируется при помощи небольшого куска тефлонового материала, которым тампонируют вход в латеральный карман. Впоследствии врастающая соединительная ткань окончательно стабилизирует решетку в ее положении. Провода электродов располагают в мастоидальной полости и костном ложе. Затем слуховую трубу и среднее ухо тампонируют оксицелюллозой (Surgicel®) и мышцей. Для облитерации дефекта в мастоидальной полости используют внутрибрюшной жир.
В это время магнит в ресивере/стимуляторе удаляют, для обеспечения возможности проведения МРТ. Поскольку магнит в ресивере/стимуляторе во время имплантации обычно отсутствует, определение положения ресивера/стимулятора во время начальной стимуляции может быть проблематичным. Неправильное расположение катушки наружного трансмиттера в подобных случаях может приводить к ложному впечатлению об отказе устройства или невозможности стимуляции. Теперь мы всегда отмечаем татуировкой центр позиции круглой антенны ресивера/стимулятора во время операции для облегчения последующего поиска. Разрез закрывают послойно без установки дренажей.
в - Схема установленного ресивера/стимулятора.
г - Схема электродной решетки слухового стволомозгового имплантата, введенной в латеральный карман. Схематическое изображение имплантата, проводов электродов и жира,
расположенных на своих местах, перед закрытием кожи.
г) Послеоперационное ведение. Послеоперационное ведение после слуховой стволомозговой имплантации сходно с ведением после обычных краниотомий при удалении акустических неврином. Большая мастоидальная повязка оставляется на три дня. Тщательное внимание к любому промоканию повязки обеспечивает быструю идентификацию истечения СМЖ из заушной раны. Устройство обычно активируют первый раз через 4-8 недель после имплантации. Это обеспечивает отсутствие отека кожного лоскута, покрывающего ресивер/стимулятор, который мог бы помешать адекватному достижению сигналом имплантата. При непосредственном использовании пациенты после имплантации должны брить эту область и накладывать тонкую полоску и металлический диск («удерживающий» диск), на котором держится магнитная катушка трансмиттера.
Пациент или помощник должен уметь контролировать правильное и устойчивое положение катушки трансмиттера над ресивером/стимулятором имплантата. Во многих случаях жалобы на плохой сигнал или снижение качества звука оказываются связанными с неправильным положением удерживающего диска.
д) Послеоперационные осложнения слуховой стволовой имплантации. Наиболее значимым осложнением в раннем послеоперационном периоде является истечение СМЖ. В противоположность обычным транслабиринтным операциям, при которых жидкость обычно истекает носовым путем через слуховую трубу, электрод ABI и провода создают путь, по которому СМЖ может проходить под кожным лоскутом. Мы отметили, что частота истечения СМЖ значительно снизилась после перехода на полностью имплантируемые ресиверы от чрезкожных коннекторов, использовавшихся в одноканальных ABI. Предотвращение истечения начинается с тщательного сближения краев твердой мозговой оболочки.
Хотя отверстие в твердой мозговой оболочке не может быть закрыто герметично, его края должны быть сближены насколько это возможно, а для закрытия остаточного дефекта в твердой мозговой оболочке используются полоски абдоминального жира.
Для заполнения слуховой трубы и среднего уха обычно применяются Surgicel® и мышца, а для тампонады мастоидальной полости — аутогенный жир. Поверх жира, для удержания его на месте, располагают титановую сетку. Наконец, многослойное закрытие раны уменьшает риск истечения СМЖ через разрез.
Это более безопасный путь лечения истечения СМЖ, чем хирургическая ревизия и повторная тампонада раны. Менингит может возникать как спонтанно, так и вследствие послеоперационного истечения СМЖ. Это редкое осложнение при быстром выявлении отвечает на антибиотикотерапию и прекращение истечения СМЖ.
Новые технологии в оториноларингологии: стволомозговая имплантация
Авторы: Янов Ю.К. 1 , Кузовков В.Е. 2 , Королева И.В. 3 , Левин С.В. 4 , Behr R. 5 , Левина Е.А. 4 , Сугарова С.Б. 6 , Лиленко А.С. 6
1 ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» Минздрава России
2 Военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия
3 ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» Минздрава России; ФГБОУ ВПО «Российский государственный педагогический университет им. А.И. Герцена», Санкт- Петербург
4 ФГБУ «Санкт-Петербургский НИИ уха, горла, носа и речи» Минздрава России;ФГБОУ ВО «СЗГМУ им. И.И. Мечникова» Минздрава России, Санкт-Петербург
5 Клиника Fulda, Германия
6 ФГБУ «СПб НИИ ЛОР» Минздрава России, Санкт-Петербург, Россия
Пациенты с глухотой, которым не показана операция кохлеарной имплантации, раньше оставались глухими на всю жизнь. Это пациенты с ретрокохлеарной патологией и аномалиями развития улитки. Для помощи этой группе пациентов была создана система стволомозговой имплантации (СМИ). Она представляет собой модифицированный кохлеарный имплантат, который устанавливается при помощи хирургической операции в ствол головного мозга на поверхность улиткового ядра.
Цель исследования: оценить эффективность применения метода слуховой стволомозговой имплантации у пациентов с глухотой.
Материал и методы: отобрано 3 пациента: 2 взрослых пациента с нейрофиброматозом 2-го типа и один ребенок в возрасте 2-х лет с двусторонней аплазией улиток.
Результаты: у пациентов со СМИ после подключения речевого процессора порог слуха составлял 50–60 дБ в частотном диапазоне 500–4000 Гц. В конце первой реабилитации порог слуха составил 45–50 дБ. Взрослые воспринимали разные звуки, различали слова с опорой на длительность и слоговую структуру. Через 6 мес. после подключения речевого процессора у пациентов наблюдалась положительная динамика развития этих навыков. Ребенок хорошо реагировал на звуки разной частоты. Появились предречевые и речевые вокализации. Через 2 года после операции взрослые пациенты различали слова из закрытого выбора. У ребенка пассивный словарь составлял около 200 слов.
Выводы: метод слуховой СМИ является методом выбора реабилитации пациентов с глухотой, у которых невозможно или нецелесообразно проведение кохлеарной имплантации. После выполнения СМИ взрослые пациенты отмечают улучшение качества жизни. Разборчивость речи у этой группы пациентов составляет 30–70%.
Ключевые слова: слуховая стволомозговая имплантация, мостомозжечковый угол, имплантат, желудочек, стволомозговая имплантация, слухоречевая реабилитация глухих, глухота, кохлеарная имплантация.
Для цитирования: Янов Ю.К., Кузовков В.Е., Королева И.В. и др. Новые технологии в оториноларингологии: стволомозговая имплантация. РМЖ. 2017;23:1695-1698.
New technologies in otorhinolaryngology: brainstem implantation
Janov Yu.K. 1 , Kuzovkov V.E. 1 , Koroleva I.V. 1,2, Levin S.V. 1,4 , Behr R. 3 , Levina E.A. 1 , Sugarova S.B. 1 , Lilenko A.S. 1
1 St.Petersburg Research Institute of Ear, Nose, Throat and Speech
2 Russian State Pedagogical University named after A.I. Herzen, St.Petersburg
3 Fulda Clinic, Germany
4 North-Western State Medical University named after I.I. Mechnikov, St.Petersburg
Patients with deafness who have no surgical indications to the operation of cochlear implantation used to remain deaf for life.These are patients with retrochlear pathology and impaired cochlea development. To help this group of patients, a system of brainstem implantation was created. It is a modified cochlear implant that is installed by surgical operation in the brain stem on the surface of the cochlear nucleus.
Aim: to evaluate the effectiveness of the auditory brainstem implantation method in deaf patients.
Patients and Methods. 3 patients were selected. Two adult patients with type 2 neurofibromatosis and one child aged 2 years with bilateral cochlear aplasia.
Results: In patients with the brainstem implantation, after connection of the speech processor, the hearing thresholds ranged from 50 to 60 dB in the frequency range from 500 Hz to 4,000 Hz. At the end of the first rehabilitation, the hearing thresholds were 45-50 dB. Adults perceived different sounds, distinguished words based on duration and syllabic structure. Six months after the connection, the patients showed a positive development of these skills. The child responded well to sounds of different frequencies. Pre-speech and speech vocalizations appeared. In 2 years after the operation, adult patients distinguished the words from the closed selection. The child had a passive vocabulary of about 200 words.
Conclusions: auditory brainstem implantation is a method of choice for the rehabilitation of deaf patients in which it is impossible or impractical to conduct a cochlear implantation. Adult patients note an improvement in the quality of their life. Speech intelligibility in this group of patients varies from 30% to 70%.
Key words: auditory brainstem implantation, cerebellopontine angle, implant, ventricle, brainstem implantation, auditory rehabilitation of deaf patients, deafness, cochlear implantation.
For citation: Janov Yu.K., Kuzovkov V.E., Koroleva I.V. et al. New technologies in otorhinolaryngology: brainstem implantation // RMJ. 2017. № 23. P. 1695–1698.
Статья посвящена стволомозговой имплантации, которая является методом выбора реабилитации пациентов с глухотой и невозможностью проведения кохлеарной имплантации. Оценена эффективность применения метода слуховой стволомозговой имплантации у 3-х пациентов с глухотой.
В настоящее время в мире существует множество методов восстановления слуха у человека. Не все методы эффективны при тугоухости высокой степени или глухоте. У пациентов с большой степенью снижения слуха наиболее эффективным методом лечения является операция кохлеарной имплантации [1, 2]. Проведение этой операции возможно при сохранении анатомии внутреннего уха и проводимости слухового нерва. Но есть группа пациентов, которым эта операция не показана [3]. У них пострадали не внутренние волосковые клетки Кортиева органа, как при сенсоневральной тугоухости, а анатомия улитки и слухового нерва. При ретрокохлеарной патологии или невозможности установки электрода в улитку операция кохлеарной имплантации будет неэффективна. Помочь может метод стволомозговой имплантации (СМИ) – установка электродной решетки имплантата выше места повреждения, в центральные отделы слуховой системы [4, 5]. В Российской Федерации первый опыт проведения СМИ состоялся в декабре 2014 г., при тесном сотрудничестве НИИ уха, горла, носа и речи, Российского научно-исследовательского нейрохирургического института им. проф. А.Л. Поленова и клиники Fulda (Германия). В ходе данной операции электродная решетка СМИ устанавливается в IV желудочек головного мозга, на проекцию улиткового ядра. В этом случае звуковая информация попадает в обход периферического отдела слуховой системы и слухового нерва сразу в центральный отдел слуховой системы. Эта более сложная по сравнению с кохлеарной имплантацией операция требует от нейрохирурга большого опыта операций на стволе головного мозга. Через месяц после установки стволомозгового имплантата пациенту выполняется подключение наружной части системы СМИ – речевого процессора и проводится длительная слухоречевая реабилитация.
Система слуховой СМИ (ABI, auditory brainstem implant) состоит из 2-х частей и представляет собой модифицированный кохлеарный имплантат, предназначенный для электрической стимуляции кохлеарных ядер ствола мозга в обход улитки, и речевой процессор (рис. 1, 2) [6].
Показаниями для операции слуховой СМИ является сенсоневральная тугоухость IV степени, вызванная ретрокохлеарной патологией, либо прогнозируемая глухота после нейрохирургической операции [7]. Основными причинами, наиболее часто вызывающими двустороннее поражение корешков VIII нерва, является нейрофиброматоз 2-го типа, травматическое повреждение волокон слухового нерва, вызванное переломом основания черепа, хирургическими операциями и т. д., или врожденное отсутствие слуховых нервов – аплазия с двух сторон [8]. Нейрофиброматоз 2-го типа – это наследственное заболевание, представляющее собой множественные, обычно доброкачественные опухоли оболочки нервной ткани [9, 10]. В процессе развития заболевания у пациентов могут возникать двусторонние невриномы слухового нерва. Это доброкачественные опухоли, растущие из швановских оболочек слухового нерва [11, 12]. Другим показанием к слуховой СМИ является полная облитерация или аплазия улиток височных костей с двух сторон. В этом случае невозможно выполнить кохлеарную имплантацию, т. к. нет возможности установить электрод в каналы улитки.
Цель нашего исследования: оценить эффективность применения метода слуховой стволомозговой имплантации у пациентов с глухотой.
Материал и методы
Результаты и обсуждение
Подключение процессора слухового СМИ проводилось через 1,5–2,5 мес. после операции. У взрослых пациентов настройка параметров электрической стимуляции проводилась по субъективным ощущениям, а также с учетом реакций пациента на звуки и наблюдений сурдопедагога [17]. В связи с особенностью локализации электрода слухового СМИ у всех пациентов были не только слуховые, но и неслуховые ощущения. При определении порогов комфортных уровней на каждом электроде одномоментно оценивалась слуховая и неслуховая стимуляция по аналоговым шкалам интенсивности. У ребенка во время стимуляции электродов № 7 и 10 возникало ощущение покалывания в той же половине тела (side effect). При подаче импульсов с электродов № 7, 9–12 проявлялась стимуляция вестибулярных ядер – резкое головокружение во время подачи стимула (рис. 4). В процессе настройки электроды, вызывающие преимущественно неслуховую стимуляцию, были отключены (табл. 1).
У всех пациентов, во время первого подключения непрерывно оценивались ощущения при стимуляции разных электродов имплантата. В процессе ежедневных настроечных сессий были определены электроды, вызывающие слуховые ощущения, и электроды, дающие побочные эффекты. Важным этапом для взрослых пациентов было определение восприятия частоты на каждом электроде. Так как кохлеарный имплантат позволяет перераспределять электроды на разные частотные каналы СМИ, нами был определен порядок электродов, вызывающих повышение воспринимаемой частоты тонов (рис. 5).
В результате такой настройки пациенты отмечали лучшее различение звуков по частоте, т. к. низкочастотные звуки попадали в области ствола мозга, отвечающие преимущественно за низкие частоты, звуки средней частоты – в области, отвечающие за средние частоты, и звуки высокой частоты – в области, отвечающие за высокие частоты (см. табл. 1).
Как показано в таблице, ежедневно менялись комфортные уровни стимуляции на разных электродах, менялось ощущение воспринимаемой частоты стимуляции электродов. По ощущениям пациента проводились коррекции настройки речевого процессора. Электроды со стойкими неслуховыми ощущениями были в процессе настройки отключены. В результате у пациента В. были активны 9 электродов, у пациента К. – 6 электродов, и у пациента Г. – 7 электродов. У ребенка не проверялось восприятие частоты по причине возраста. За счет пластичности головного мозга у него произойдет самостоятельная адаптация ядра к данной стимуляции. У взрослых пациентов этот тест был обязательным, т.к. в ядрах ствола тонотопика очень отличается от тонотопики улитки.
Оценка результатов работы процессора слухового стволового имплантата показала, что у всех пациентов улучшилось качество жизни. Уже на первой реабилитации пациенты узнавали некоторые звуки на слух, слышали голоса людей и узнавали собственное имя, стали чувствовать себя увереннее. Порог слуха достигал 45–55 Дб.
Результаты тестирования ребенка с двусторонней аплазией улиток и слуховых нервов после слуховой СМИ представлены на рис. 6.
Видно, что за 5 мес. работы речевого процессора достигнута заметная динамика слухоречевого развития.
Выводы
1. После подключения и первых настроек речевого процессора возможно возникновение неслуховых ощущений при использовании стволомозгового имплантата. Если операция проведена успешно, эти побочные эффекты можно устранить при настройке речевого процессора.
2. Для данной группы пациентов требуется более продолжительная реабилитация. Пациенты после первого подключения только на второй неделе настроек отмечали стабильные слуховые ощущения.
3. При настройке речевого процессора стволомозгового имплантата уровни максимальной комфортной громкости могут достигать больших значений, чем при настройке системы кохлеарной имплантации.
4. В ходе настройки речевого процессора стволомозгового имплантата при обнаружении неслуховой стимуляции может быть отключено большее количество электродов в 1-ю сессию настройки, чем при кохлеарной имплантации.
Заключение
Безусловно, метод слуховой стволовой имплантации является прорывом в реабилитации пациентов с глухотой. Стало возможным проведение реабилитационных мероприятий даже в случаях двусторонней аплазии и гипоплазии слухового нерва и улитки, полной облитерации улитки после перенесенного менингита, травмы ствола слухового нерва, опухолевых процессов внутреннего слухового прохода и мостомозжечкового угла. По данным зарубежной литературы, 80–90% пациентов получают возможность не только воспринимать тональные сигналы, но и разбирать речь. После проведения реабилитационных мероприятий разборчивость речи достигает 30–70%. Однако в период отбора пациентов необходимо учитывать сложность нейрохирургического вмешательства, сопровождающегося трепанацией черепа, и доступа к стволу головного мозга. В 10% случаев возможно отсутствие слуховых ощущений после операции, например в связи со смещением электрода в послеоперационном периоде.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Последние разработки слуховой стволовой имплантации
а) Слуховые стволомозговые имплантаты с пенетрирующими электродами. Многие пациенты с обычными поверхностными ABI демонстрируют хорошее распознавание речи, при этом наблюдается некоторая связь с электрод-специфичными ощущениями высоты звука. Поэтому с целью улучшения этого типа воспринимаемой информации и возможного улучшения эффективности восприятия речи была разработана система PABI с игольчатыми микроэлектродами.
Одним из полученных в ходе этой работы результатов оказалось понимание того, что у нескольких пациентов эффективность была лучше при использовании комбинации поверхностных и пене-трирутощих электродов.
Каждый тип электрода имеет свои преимущества, а в комбинации они, по-видимому, работают синергично. Большая площадь прохождения тока поверхностных электродов увеличивает возможность возникновения слухового ощущения, а более фокусированный ток из кончика игольчатого микроэлектрода обеспечивает звуковые ощущения при заряде на 1-2 нКл меньше, чем у пластинчатых электродов.
Пенетрирующие электроды также обеспечивают более широкий частотный диапазон, однако более фокусированная стимуляция также означает, что слуховые нейроны могут не попасть в контакт со стимулирующей поверхностью. Поэтому при использовании пенетрирующих электродов чаще встречается невозможность вызывать слуховые ощущения, либо невозможность обеспечивать комфортный уровень громкости при максимальном уровне тока. Тем не менее, один из пациентов не получал никаких слуховых ощущений с поверхностных электродов, но получил слуховые ощущения от 6 из 10 пенетрирующих электродов.
Несмотря на то, что телеметрия нервного ответа (NRT) была полезна в обнаружении активности близлежащих структур к кохлеарным имплантатам, полезного эффекта от ее применения при установке ABI (и предположительно PABI) выявлено не было.
б) Слуховые имплантаты среднего мозга и имплантаты задних холмов четверохолмия. Реципиенты слуховых стволомозговых имплантатов обычно не показывали отличных уровней эффективности, достижимых современными кохлеарными имплантатами, возможно, из-за отсутствия у них слуховых нервов, либо из-за невыявленного повреждения ствола мозга вестибулярной шванномой или в ходе ее удаления. Эффект обхода нижнего ствола мозга при стимуляции нижнего холма четверохолмия (IC), поверхностной электродной решеткой (слуховой имплантат среднего мозга [AMI]) или пенетрирующей решеткой (имплантат нижнего холма четверохолмия [ICI ]) изучался, по крайней мере, в двух исследованиях. После имплантации двух типов устройств (Spring, 2007) были получены слуховые ощущения (R. Shannon, при личном общении). Могли быть достигнуты различные электод-специфичные ответы, а звуковые ощущения были полезными для общения в комбинации с чтением по губам.
Однако не было получено распознавания слов при только звуковом предъявлении, впрочем, еще слишком рано оценивать долгосрочные возможности этих имплантатов среднего мозга.
Многоканальные ABI получили одобрение FDA для коммерческого использования как эффективные методы обеспечения звуковыми ощущениями людей, оглохших от двусторонней вестибулярной шванномы (НФ2). Звуковая информация, предоставляемая устройством, включает восприятие, распознавание и словесную коммуникацию при использовании совместно с чтением по губам. Также в отдельных случаях у реципиентов ABI был достигнут значительный уровень понимания речи даже без чтения по губам.
Методы программирования ABI и обработки звуков речи могут влиять на эффективность и результат, поэтому необходимы дополнительные исследования в этой области. В будущем ABI могут быть полезны в лечении глухоты, вызванной другими причинами, вовлекающими периферические слуховые нервные пути. Изучение новых техник микростимуляции решетками ABI, разработанными для проникновения к матриксу слухового ствола мозга у человека, позволили достичь определенных результатов, как и возможность стимуляции слуховой области среднего мозга для сохранения слуха.
Авторы признательны Michael Waring за редакторскую помощь в вопросах электрофизиологии, а также пациентам и персоналу Клиники уха House за потраченное время и усилия при исследовании ABI.
«Проект: Аудиология» - сборник научно-практических материалов для профессионалов в области аудиологии и слухопротезирования, включающий материалы конференций, статьи по кохлеарной имплантации, отоневрологии и законодательные акты по сурдологии.

Слуховой стволомозговой имплантант (ABI, auditory brainstem implant) представляет собой модифицированный кохлеарный имплант, и предназначен для электрической стимуляции кохлеарных ядер ствола мозга пациента.
ABI был разработан специально для пациентов с заболеванием, известным как нейрофиброматоз II типа (НФ-2). НФ-2 характеризуется наличием двусторонних вестибулярных шванном. Сама опухоль или хирургическое удаление опухоли часто приводит к значительному поражению слухового нерва, поэтому кохлеарная имплантация не является методом выбора для этих пациентов. После удаления опухоли электродный массив ABI вводится в латеральный карман четвёртого желудочка и размещается на поверхности вентрального и дорсального кохлеарных ядер. Стимулируя слуховые нервные структуры в пределах кохлеарного ядра, ABI передаёт важную информацию о частоте, амплитуде и временных характеристиках звуков.
Дизайн и функционирование ABI подобны многоканальному кохлеарному импланту, за исключением различий в дизайне стимулирующего электродного массива 6. Программирование устройства ABI отличается от программирования кохлеарного импланта по некоторым важным аспектам.
В статье внимание сфокусировано на многоканальной высокочастотной системе ABI производства MED-EL.
Техническое описание системы C40+ ABI
Система состоит из многоканальной имплантируемой части и речевого процессора.
Имплантируемые части системы C40+ ABI включают в себя ABI-стимулятор (приёмник/передатчик), активный электродный массив и референтный электрод.

Стимулятор
Приблизительные размеры стимулятора С40+ 3,5 х 2,4 см, толщина менее 0,4 мм. Все электронные компоненты помещены в твёрдый и компактный керамический корпус (Рисунок 1), в котором герметично запаяны электронная схема и мощный микрочип. Корпус импланта и электроника ABI аналогична тем, которые используются в кохлеарном импланте С40+.
Рисунок 1. Слуховой стволомозговой имплант.
Активный электродный массив ABI.
От стимулятора отходит активный электродный массив, который состоит из 12 активных платиновых контактов, запаянных в овальную силиконовую капсулу-пластинку в форме весла с размерами (5,5 х 3,0 х 0,6) мм (Рисунок 2, середина). На обратной стороне силиконовой капсулы имеется сеточка из дакрона (синтетическая нерассасывающаяся нить), которая облегчает фиксацию электродного массива.
Рисунок 2. Электроды слухового стволомозгового импланта (MED-EL, Combi 40+R). (Верх): Четырёхканальный тест-электрод для локализации кохлеарного ядра. (Середина): Двенадцатиканальный активный электрод, который будет имплантирован.

Электродный массив преформирован идущими поперёк платиновыми проводками. Это позволяет так сформировать этот элемент, чтобы он подходил к контуру (поверхности) кохлеарного ядра (Рисунок 3).
Рисунок 3. Активный электродный массив слухового стволомозгового импланта.
Референтный электрод
Референтный электрод в форме листа клевера идентичен тому, который используется в кохлеарном импланте C40+ (Рисунок 2, низ).
Внешними компонентами ABI производства MED-EL являются заушный речевой процессор TEMPO+ (Рисунок 4) или карманный речевой процессор CIS PRO+.
Рисунок 4. Полностью заушный речевой процессор TEMPO+.
Речевой процессор разработан для того, чтобы кодировать акустические сигналы окружающей среды, которые собираются микрофоном. Акустический сигнал преобразовывается в электрический сигнал и превращается в паттерн электрических импульсов в соответствии с используемой стратегией кодирования речи. От речевого процессора закодированные электрические импульсы передаются через передающую катушку, через интактную (неповреждённую) кожу к импланту. Электроника декодирует сигналы, полученные внутренней вторичной катушкой. Эти сигналы передаются затем активному электродному массиву, и кохлеарное ядро стимулируется.
В ABI MED-EL используется стратегия обработки речи CIS (continuous interleaved sampling, стратегия высокочастотной непрерывной выборки), разработанная в 90-х годах XX столетия Вильсоном (Wilson) с партнёрами. С этим устройством возможна высокочастотная симуляция с максимумом в 18180 имп./с. Максимальная частота стимуляции на канал составляет 515/с при 12 активных электродах. Режим стимуляции является монополярным, против референтного электрода, который помещается под височную фасцию.
Показания, отбор кандидатов для ABIs
Когда стволомозговая имплантация только начиналась, ABIs использовались почти исключительно только у пациентов с нейрофиброматозом II типа, которые потеряли слух до или во время удаления двусторонней вестибулярной шванномы. Позже показания в Европе для ABI стали включать аплазию кохлеарного нерва (в том числе и вследствие атрезии внутреннего слухового прохода) и выраженную мальформацию улитки у детей, а также полную оссификацию улитки или разрыв кохлеарного нерва из-за травмы у взрослых 7.
При отборе должна учитываться индивидуальная мотивация пациента для повторных послеоперационных процедур настройки и его/её готовность к ежедневным занятиям с устройством. Пациенты должны быть полностью информированы о возможных результатах чтобы избежать любого разочарования, которое может отразиться на их общей мотивации или готовности к сотрудничеству. Кандидаты должны иметь нормальный уровень интеллектуального развития. Проявления основной болезни не должны помешать процессу настройки или реабилитации. По мнению некоторых авторов, НФ-2 типа Wischard, при котором есть выраженные признаки и симптомы и уменьшенная продолжительность жизни, не должен считаться противопоказанием. За и против имплантации при этом подтипе НФ-2 должны взвешиваться у каждого конкретного пациента. Если пациент в физическом и психическом плане способен и согласен пройти все необходимые послеоперационные процедуры настройки и реабилитации и имеет хорошую поддержку со стороны семьи, нет никакой причины отказывать ему/ей в шансе улучшить слух. [10].
Периост и фасция височной мышцы рядом с ним отводятся кпереди чтобы сформировать второй слой, который прикроет имплант. Кость вскрывается в ретромастоидальной области и обнажается твёрдая мозговая оболочка за сигмовидным и ниже поперечного синусов. Полушария мозжечка отводятся после дренирования цереброспинальной жидкости (ЦСЖ) при вскрытии базальных цистерн. Арахноидальная оболочка, покрывающая опухоль, вскрывается, на опухоль накладывается зажим и она постепенно удаляется. В зависимости от размера опухоли и интраоперационных находок, внутренний слуховой проход рассверливается до, во время или после удаления экстрамеатальной порции опухоли. После полного удаления опухоли каудальные черепно-мозговые нервы выделяются из арахноидальной оболочки. Открываются флоккулюс мозжечка и хориоидное сплетение бокового кармана четвертого желудочка. Доступ к отверстию Люшка (Luschka) облегчается поворотом головы в сторону опухоли. В отверстие Люшка вводится четырёхполярный стимулирующий тест-электрод (Рисунок 2, верх) и размещается в латеральном кармане четвёртого желудочка, на поверхности кохлеарного ядра. Главная цель – вентральное кохлеарное ядро.
Расположение тест-электрода ABI выполняется в соответствии с анатомическими ориентирами, которые доступны обзору хирурга. Анатомические ориентиры, использующиеся для размещения импланта, включают корешок VIII нерва, языкоглоточный нерв, лицевой нерв и хориоидальное сплетение, а также вход в латеральный карман (латеральная апертура, отверстие Люшка (Luschka)), где все эти структуры сходятся (Рисунки 6-8). При операции, когда практически всегда ствол мозга искажён опухолью, отверстие Люшка расположено выше IX нерва. IX нерв обычно находится в фиксированном анатомическом положении, приводящем практически всегда в отверстие Люшка. Кроме того, важна луковица яремной вены, потому что её расположение может очень сильно варьироваться.
Рисунок 6. Анатомия кохлеарных ядер: анатомический препарат (левая сторона) показывает внутренний слуховой канал (IAC), VIII и IX черепно-мозговые нервы, сходящиеся ко входу в латеральный карман (отверстие Люшка), где имеется сплетение (Т). Показана локализация вентрального (VCN) и дорсального (DCN) кохлеарных ядер. С = каудально; D = дорсально; R = рострально; V = вентрально.

Рисунок 7. На гистологическом препарате показаны область латерального кармана четвёртого желудочка (Ve), VII (VIIn), VIII (VIIIn), IX (IXn) черепно-мозговые нервы и взаимоотношения между вентральным кохлеарным ядром (VCN), дорсальным кохлеарным ядром (DCN), нижней ножкой мозжечка ICP) и вестибулярными ядрами (VN). Также показаны мозжечок (CE) и нижние оливы (IO). A = кпереди; Р = кзади.
Рисунок 8. Показана область имплантации на препарате. Электрод (Е) виден в латеральном кармане в области кохлеарного ядра; отверстие Люшка (Luschka) окружено (обрисовано) VIII (VIIIn) и IX (IXn) черепно-мозговыми нервами; ножки мозжечка (Се) ограничивают его сверху; хориоидальное сплетение (Ch) обычно выходит из бокового кармана. С = каудально; D = дорсально; R = рострально; V = вентрально.

В затылочно-теменной области выше поперечного синуса формируется костное ложе для приёмника-передатчика (стимулятора) – таким образом, чтобы приёмник/передатчик был погружён в кость по крайней мере на половину своей толщины, на ~ 2 мм. Внимательно следят за тем, чтобы не повредить внутренний кортикальный слой кости. Приёмник/передатчик фиксируется звёздчатым швом, позже он покрывается фасцией и периостом, после чего кожный лоскут укладывается на место и ушивается двумя слоями швов.
Затем тест-электрод в латеральном кармане ещё раз проверяется. Измерения EABR в каждом из вариантов режима биполярной стимуляции в пределах расположения четырёх электродов повторяют, пока результаты всех возможных биполярных комбинаций из четырёх контактов не покажут адекватные волны EABR. После этого тест-электрод удаляют и из стерильной упаковки извлекают 12-ти-канальный электродный массив ABI (Рисунок 2, середина, Рисунок 3) (активный электрод). Затем активный электродный массив размещают в соответствии с положением, намеченным регистрацией EABR при помощи тест-электрода. Перед тем как зафиксировать активный электрод, с него проводится окончательная запись EABR (Рисунок 10).
Рисунок 10. ABR: акустические ABR (а), электрические EABR у пользователя кохлеарным имплантом (b), электрические EABR у пациента с ABI (c)
Хотя КТ-сканирования достаточно для контроля за пациентами с ABI, большинство пациентов требуют проведения МРТ в связи с их основным заболеванием (НФ-2). Тайссл (Teissl) с сотрудниками, затем Хохмайр (Hochmair) (Университет Инсбрука, 2001) показали, что МРТ при 0,2 и 1,5 Т не оказывает никакого отрицательного влияния на импланты MED-EL [10, 16].
Доктора Уильям Хауз (William House) и Уильям Хитцельбергер (William Hitselberger) первыми использовали одноканальный имплант, получивший в дальнейшем название ABI, для электрической стимуляции кохлеарного ядра у пациента с НФ-2 в 1979 году 2. Перед имплантацией было доказано, что электрическая стимуляция кохлеарного ядра у людей могла приводить к слуховым ощущениям. Первое устройство ABI состояло из пары шаровидных электродов, которые помещались в толщу кохлеарного ядра. Управлял электродами модифицированный слуховой аппарат Bosch. Однако, эта пара электродов смещалась и вызывала неслуховые побочные эффекты. При операции-ревизии в 1981 году этому пациенту в латеральный карман четвёртого желудочка, на поверхность кохлеарного ядра, был имплантирован электродный массив в форме весла с двумя электродами. Вплоть до 1991 года использовался этот тип электродов и все созданные в последнее время электродные массивы использовали его как прототип и имплантируются также в латеральный карман. С тех пор устройство претерпело несколько модификаций – каналов стало больше (теперь доступны системы с от 8 до 21 каналов) 27, разработаны новые стратегии кодирования звукового сигнала, появляются новые варианты электродов, такие как пенетрирующий ABI. Главной движущей силой для усовершенствования был успех операций кохлеарной имплантации. Другими предпосылками стали развитие микрохирургической техники, интраоперационного мониторинга и нейроанестезии. Также произошли изменения и в отношении хирургов: они больше не удовлетворены просто удалением акустической невриномы, сейчас они хотят сохранить функцию. Первоначально это желание относилось к лицевому нерву, сейчас оно распространяется и на кохлеарный нерв [17].
ABI MED-El был разработан и произведён в ходе сотрудничества инженеров MED-EL Инсбрукского университета, Австрия, и Вюрцбургского университета, Германия на основе кохлеарного импланта Combi 40/40+ (компания MEDEL, Инсбрук, Австрия), который был оценён в европейском мультицентровом клиническом исследовании [18]. Не так давно MED-EL разработан ABI нового поколения – Pulsar i100 ABI.
Стволомозговой имплант фирмы Cochlea был разработан совместно компанией Cochlear, House Ear Institute (Лос-Анджелес, Калифорния, США) и Медицинским Исследовательским Институтом (Хантингтон, США). Авторами считаются Роберт Шеннон и Дералд Брекмен. 20 октября 2000 г. изделие было одобрено FDA (Управлением по контролю за продуктами и лекарствами США).
Исследования не стоят на месте. Ранние исследования электрической стимуляции нижних бугров четверохолмия у человека не обеспечивали ощущения звука [19]. Однако Коллетти (Colletti) и др. [20, 23] недавно имплантировал электроды в нижние бугры четверохолмия пациенту с двусторонним дефектом слухового нерва вследствие удаления вестибулярной шванномы, продемонстрировав, что электрическая стимуляция нижних бугров четверохолмия действительно может обеспечить восприятие звука и некоторую разборчивость речи.
В House Ear Institute (Лос-Анджелес, Калифорния, США) и Huntington Medical Research Institute (Пасадена, Калифорния, США) в сотрудничестве с производителем, Cochlear Corporation, с целью улучшения точности стимуляции слуховых нейронов ствола мозга разрабатывается и проходит испытания PABI (пенетрирующий ABI), состоящий из двух электродных массивов: 12-ти-электродного поверхностного массива и 10-ти-электродного массива с игольчатыми микроэлектродами, который размещается в толще вентральной порции кохлеарного ядра. Считается, что микростимуляция с игольчатыми электродами обеспечит активацию малых скоплений тонотопических групп нейронов в глубоких слоях с восприятием целого диапазона частот (высот звука) [21].
К настоящему времени в мире устройство ABI получили более 500 пациентов. Операции активно проводятся в институтах Европы, США, Ближнего Востока, Азии.
Возможные осложнения, побочные эффекты
Кроме осложнений, непосредственно связанных с имплантацией, а именно: хирургических повреждений нижележащих черепно-мозговых нервов, сосудистых повреждений или геморрагий в области ствола мозга, в литературе описано развитие на 7-20 день после операции псевдомембраноцеле. Поскольку важно расстояние между передающей катушкой и имплантированным передатчиком, это осложнение нужно лечить, даже если оно (лечение) не требовалось бы неимплантированным пациентам [10].
Описан случай развития у пациента гидроцефалии, которая потребовала вентрикулоперитонеального шунтирования через 2 месяца после первой операции [10]. У этого пациента была глиома в области brachium pontis мозжечка на контралатеральной от операции стороне и бессимптомная солидная и кистозная глиома нижних отделов ствола мозга, которые, возможно, нарушали циркуляцию цереброспинальной жидкости.
Несмотря на хорошие интраоперационные EABR, иногда только несколько слуховых электродов может функционировать после операции. Это может быть связано с движением (перемещением, смещением) электродного массива после операции или, в некоторых случаях, корешок VIII нерва, возможно, временно давал хорошие ответы EABRs в операционной, но после его атрофии ответы не регистрировались [15].
При подключении речевого процессора и первых его настройках крайне важно следить за жизненными показателями пациента; подключение и настройку следует делать в отделении интенсивной терапии или в присутствии анастезиолога-реаниматолога, т.к. в литературе описаны случаи стимулирования блуждающего нерва, что может привести к остановке сердца [15].
Как было показано в ходе психофизиологического тестирования во время первичной настройки ABI, более 90% пользователей слухового стволомозгового импланта испытывают какие-либо неслуховые побочные эффекты [22]. Они появляются после подключения речевого процессора и активации импланта. К ним относятся покалывание в горле, покалывание или подёргивание в туловище или в верхних и/или нижних конечностях, раздражение лицевого нерва, подёргивание глаз или рта, размытость (нечёткость) полей зрения, затруднения при глотании или боль. Неслуховые эффекты могут быть уменьшены или устранены путём регулирования программных параметров или выключением канала [14].
Восстановление слуха с использованием стволомозговых имплантов у пациентов с НФ-2 и другими состояниями, при которых нарушена целостность слухового нерва – это надёжная и многообещающая процедура для тех, кто иначе был бы полностью глухим.
Читайте также:
