Генетика ретинобластомы. Механизмы развития
Добавил пользователь Дмитрий К. Обновлено: 28.01.2026
Причины и механизмы развития ретинобластомы, ретиномы у ребенка
Ретинобластома — редкая злокачественная опухоль глаз у детей с частотой 1 на 18000 живорожденных. Поздняя диагностика приводит к смертности в 70% случаев; при доступности оптимальной терапии более 95% детей вылечиваются. Эффективным подходом в лечении ретинобластомы является мультидисциплинарный подход с участием как клиницистов (офтальмологи, детские онкологи и лучевые терапевты, медицинские сестры, генетики), так и специалистов в области получения изображений, детских (игровых) специалистов и родителей. Национальные руководства могут способствовать разработке стандартов и созданию условий для проверок, исследований и клинических испытаний для постоянного развития системы оказания помощи и улучшения результатов лечения.
Опухоли происходят из эмбриональных клеток сетчатки, поэтому в большинстве случаев развиваются в возрасте до четырех лет. Первичное лечение включает выполнение энуклеации и проведение химиотерапии в комбинации с лазерокоагуляцией и криотерапией. Пациенты с системной мутацией гена-супрессора опухолевого роста RB1 находятся в повышенной зоне пожизненного риска развития других злокачественных опухолей, риск повышается при радиационном облучении. Более того, лучевая терапия в настоящее время не является лечением первого выбора с целью сохранения глаза, поэтому скрининговое обследование на экстраокулярную и трехстороннюю (трилатеральную) ретинобластому предпочтительно проводить при помощи МРТ и ультразвукового исследования, а не КТ.
Исследование ретинобластомы являлось основополагающим в понимании рака в целом. Исследования ретинобластомы обнаружили, что наследственные и ненаследственные опухоли развиваются при потере обеих аллелей гена-супрессора опухолевого роста RB1. На основании данных клинических исследований ретинобластомы было предположено существование специфического гена, подавляющего развитие злокачественной опухоли.
Ген RB1 был первым клонируемым геном-супрессором опухолевого роста, и было обнаружено, что он играет ведущую роль в развитии многих видов злокачественных опухолей.
Патогенез ретинобластомы
а) Наследственная и ненаследственная ретинобластома. У всех детей с двусторонней (билатеральной) ретинобластомой в одной из хромосом (13) имеется мутация гена RB1, предрасполагающая к развитию опухолей сетчатки в младенческом возрасте и других опухолей в течение жизни. Несмотря на то, что в 90% случаев отсутствует предшествующий семейный анамнез ретинобластомы и у впервые заболевших в этих семьях имеется новая мутация зародышевой линии, у 50% их потомства мутантный ген RB1 передастся и разовьется опухоль. У большинства детей без семейного анамнеза ретинобластомы только в одном глазу имеются нормальные врожденные аллели RB1, но на глазу с развившейся опухолью происходит потеря обеих функциональных аллелей, напоминая картину наследственной опухоли.
У 15% лиц с развившейся односторонней ретинобластомой были врожденные мутации аллели RB1, которые могут передаться их потомству.
Молекулярная и клиническая генетика являются неотъемлемой частью лечения во всех семьях, пораженных ретинобластомой.
б) Потеря обеих аллелей гена RB1 вызывает развитие ретинобластомы. Наблюдение, согласно которому у детей с двусторонней ретинобластомой заболевание диагностируется в более раннем возрасте, чем с ненаследственной, привело к теории Нудсона, утверждающей, что для начала развития ретинобластомы необходимы две мутации. На основе этого анализа предположено, что вторая одиночная мутация в развивающейся клетке сетчатки, с уже имеющейся предрасполагающей врожденной мутацией, вызывает развитие опухоли (наследственная ретинобластома), но при ненаследственной односторонней форме ретинобластомы в одной развивающейся клетке сетчатки имеются обе мутантные аллели.
Эти два события могут быть мутациями обеих аллелей гена, который бы «подавлял» развитие опухоли в сетчатке. В развивающейся клетке сетчатки с одной нормальной аллелью RB1 достаточно высока вероятность потери второй аллели RB1, так как для наследственной ретинобластомы характерны множественные опухоли. Однако у детей без врожденной мутации аллели RB1 практически невозможна потеря обеих аллелей в нескольких клетках сетчатки, поэтому развивается только одна односторонняя опухоль, и, как правило, она диагностируется у детей в более старшем возрасте, чем при наследственной ретинобластоме.
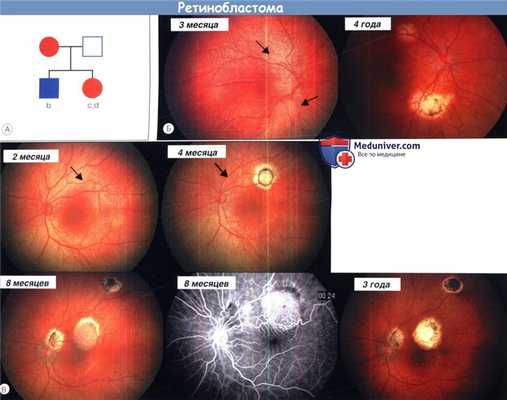
(А) Семейное дерево: матери проводили лечение двусторонней ретинобластомы энуклеацией глаза и дистанционной лучевой терапией другого глаза.
Через 42 года в зоне облучения у нее развились метастазы гемангиосаркомы (красная).
Роды обоих детей были проведены на 36 неделе гестации для облегчения раннего лечения двусторонних опухолей.
Мать и оба ребенка являются носителями зародышевой мутации RB1, что приводит к отсутствию pRB при потере нормальной аллели RB1 (М2) в развивающейся клетке сетчатки, вызывая развития опухоли.
(Б) Изображения камеры RetCam®: в три месяца на правом глазу мальчика до лечения видны две опухоли (группа А по IIRC, опухоль более чем в 1,5 мм от диска зрительного нерва);
стабильное состояние правого глаза в четыре года после лазерокоагуляции и двух курсов КЭВ (карбопластин, этопозид и винкристин) химиотерапии с циклоспорином А и еще большим числом курсов лазерокоагуляции.
(В) Изображения камеры RetCam®: до лечения, левый глаз девочки в два месяца (группа В по IIRC, опухоль менее чем в 3 мм от фовеа);
рубцы после лазерокоагуляции и новая опухоль над зрительным нервом в четыре месяца;
рецидив в области исходного рубца с распространением в сторону фовеа с васкуляризацией опухоли по данным флюоресцентной ангиогарфии;
плоские рубцы в 2,5 года после проведения лазерокоагуляции, двух курсов КЭВ химиотерапии с циклоспорином А для контролирования,
угрожающих зрению, повторного проведения химиотерапии и в большем объеме лазерокоагуляции (иллюстрации Leslie MacKeen, Cynthia VandenHoven и Carmelina Trimboli.)
в) Функции белка ретинобластомы. Продуктом гена RB1 (pRB) является фосфопротеин массой 110 кДа, который при взаимодействии со многими белками участвует в регуляции клеточного цикла, дифференцировке и в контроле стабильности генома. Опухолевые ДНК-вирусы, вызывающие развитие злокачественных опухолей (например, вирус папилломы человека), реализуют это за счет частичного связывания с областью структурного «кармана» белка pRB.
Мутация зародышевой линии RB1 приводит к 40000-кратному относительному риску (ОР) развития ретинобластомы, 500-кратному ОР развития саркомы, который возрастает до 2000-кратного при применении лучевой терапии, но не повышается при лейкозе. Хотя pRB является ключевым во всех делящихся клетках, его роль в развитии клеток крайне тканеспецифична. Часть развивающихся клеток сетчатки может зависеть исключительно от pRB для окончательной дифференцировки во взрослую, функционирующую сетчатку. Потеря pRB способствует геномным изменениям и нестабильности, приводящей к последующим мутациям в онкогенах и других генах-супрессорах опухолей, что приводит к развитию опухоли сетчатки.
г) Спектр мутаций гена RB1. Большинство мутаций в гене RB1 уникальны для каждой семьи, и распределяются в гене RB1 на всем протяжении без настоящих «горячих точек». Выявление чувствительных мутаций требует подсчета числа копий в каждом экзоне и промоторе гена для выявления больших делений и дупликаций, секвенирования для точечных мутаций, исследования мРНК для подтверждения или выявления интронных мутаций, нарушающих сплайсинг экзонов, и анализа статуса метилирования промотора в образце опухоли. Применение этих методов в комбинации с генетической экспертизой, сфокусированной на ретинобластоме для интерпретации данных, позволяет выявить более 95% мутаций гена RB1 9,14.
д) Другие манифестации мутантных аллелей гена RB1. Мутация RB1 также предрасполагает к доброкачественным опухолям сетчатки, ретиноме, эктопической интракраниальной ретинобластоме (трилатеральная (трехсторонняя) ретинобластома), и второй экстраокулярной злокачественной опухоли.
е) Ретинома. Ретинома — доброкачественный вариант мутации гена RB1, Эту непрогрессирующую патологию характеризуют три признака: проминирующая серая масса сетчатки, кальцинаты и окружающие их пролиферирующий пигментный эпителий сетчатки (ПЭС) и пигментация. Эти три признака также видны и после проведения лучевой терапии по поводу ретинобластомы. Ретинома, если она выявлена в детстве, что бывает очень редко, бессимптомная опухоль без озлокачествления. Описаны единичные случаи, когда ретинома прогрессировала в активную ретинобластому. Однако как правило, ретинома располагается под активной ретинобластомой и может быть обнаружена при патогистологическом исследовании энуклеированного (удаленного) глаза. Отличительной особенностью является образование цветочноподобных клеток и отсутствие маркеров пролиферации.
При ретиноме обе аллели RB1 мутантные и определяется геномная нестабильность, которая прогрессирует в степени и числе генов, вовлеченных в смежной, быстро пролиферирующей ретинобластоме. Обнаружение ретиномы при осмотре сетчатки у родственника пациента с ретинобластомой указывает, что они несут мутантную аллель RB1.
ж) Эктопическая внутричерепная (трилатеральная, трехсторонняя) ретинобластома. Трехсторонняя (трилатеральная) ретинобластома это среднемозговая опухоль или первичная опухоль пинеальной области, связанная с наследственной ретинобластомой, но не вследствие метастазирования. Опухоль относится к нейробластомам и напоминает низкодифференцированную ретинобластому. Пинеальные опухоли развиваются у 5% детей с мутациями гена RB1, но не следует их путать с кистами шишковидной железы, встречающимися у 2% всех детей и не требующими лечения. У больных детей может быть повышенное внутричерепное давление при отсутствии признаков новообразования в пинеальной или параселлярной областях по данным МРТ. Опухоль шишковидной железы можно выявить при помощи МРТ при рутинном скрининге на интракраниальные опухоли на стадии, когда еще можно провести лечение.
з) Множественные разные злокачественные опухоли. У людей с мутантным геном RB1 повышенный риск развития второй экстраокулярной злокачественной опухоли, которая может развиваться внутри или вне зоны облучения. Облучение, особенно у младенцев до года жизни, повышает риск развития сарком и других злокачественных опухолей внутри зоны облучения. Наиболее характерной второй первичной опухолью у лиц с мутациями гена RB1 является остеосаркома, но имеются публикации и о множестве других новообразований. Эти индуцированные облучением опухоли крайне сложны в лечении, раньше дети с мутациями в гене RB1 чаще умирали от второй опухоли, чем от неконтролируемой ретинобластомы. В настоящее время у детей с ретинобластомой облучение ограничивают, чтобы сохранить оставшийся глаз.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Генетика ретинобластомы. Механизмы развития
Ретинобластома, образец болезни, вызываемой мутацией в гене-супрессоре опухолевого роста, — редкая злокачественная опухоль сетчатки у младенцев, со встречаемостью около 1 на 20 000 новорожденных.
Диагноз ретинобластомы обычно предполагает удаление пораженного глаза, хотя небольшие, рано диагностированные опухоли можно лечить местной терапией с целью сохранения зрения.
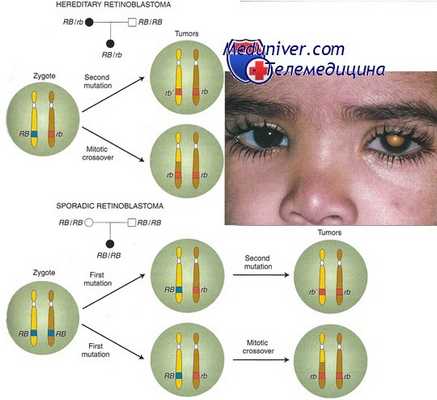
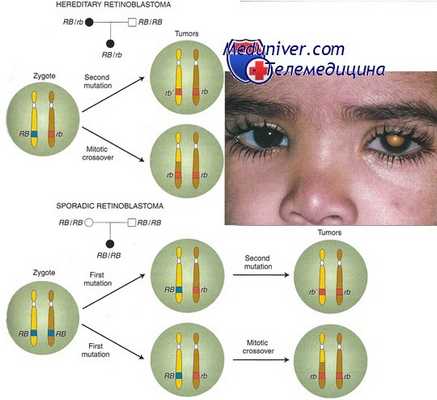
Около 40% случаев ретинобластомы — наследственная форма, при которой ребенок наследует один мутантный аллель в локусе ретинобластомы (RB1). К развитию опухоли приводят соматические мутации или другие изменения в одной единственной клетке сетчатки, приводящие к утрате функции оставшегося нормального аллеля.
Заболевание наследуется как доминантный признак, поскольку появление соматической мутации весьма вероятно из-за большого числа первичных ретинобластов (более 106) и их быстрой пролиферации. Поскольку шанс «второго удара» при наследственной форме столь велик, патологические изменения часто происходят более чем в одной клетке, и, таким образом, гетерозиготы по заболеванию часто поражаются множественными опухолями, нередко обоих глаз.
С другой стороны, «второй удар» не происходит в 100% случаев, являясь случайным событием; следовательно, пенетрантность ретинобластомы, хотя и высокая, но не полная.
Оставшиеся 60% случаев ретинобластомы ненаследственные (спорадические); в этих случаях оба аллеля RB1 в одной клетке сетчатки инактивировались независимо друг от друга. Поскольку два таких события в одной клетке — редкий случай, обычно наблюдают только моноклональную опухоль и только в одном глазу.
Хотя спорадическая ретинобластома обычно происходит только в одном участке одного глаза, у 15% больных с односторонней ретинобластомой имеется наследственный тип со случайным развитием опухоли только в одном глазу. Другое различие между наследственными и спорадическими опухолями состоит в том, что средний возраст начала спорадической формы — ранний дошкольный возраст, позже, чем у детей с наследуемой формой.
Генетика ретинобластомы
Потеря гетерозиготности при ретинобластоме
Генетики, изучавшие полиморфизмы ДНК в области, близкой к локусу RB1, сделали необычное, но очень значимое генетическое открытие, когда проанализировали аллели, встречающиеся в опухолевых тканях у пациентов с ретинобластомой. Больные с ретинобластомой, гетерозиготные по полиморфным локусам вблизи гена RB1 в нормальных тканях, например в лейкоцитах, имели опухоль, содержащую аллели только из одного гомолога хромосомы 13 с потерей гетерозиготности (loss of heterozygositi — LOH) в регионе гена.
В семейных случаях маркеры на хромосоме 13 оказались унаследованными от больного родителя, т.е. с одним аномальным аллелем RB1. Таким образом, потеря гетерозиготности представляет собой «второй удар» по оставшемуся аллелю. Потеря гетерозиготности может происходить вследствие интерстициальной делеции, но есть и другие механизмы, например митотическая рекомбинация или нерасхождение хромосом. Потеря гетерозиготности — наиболее общий мутационный механизм нарушения функции нормального аллеля RB1 у гетерозигот.
Когда потеря гетерозигоности не выявляется, «второй удар» обычно — соматическая мутация второго гена или случайная транскрипционная инактивация нормального аллеля метилированием. Потеря гетерозиготности характерна для множества других опухолей, как наследуемых, так и спорадических, и часто считается подтверждением существования гена-супрессора опухолевого роста, даже если этот ген неизвестен.
Ген RB1 картирован на хромосоме 13, в положении 13ql4. У небольшого процента больных с ретинобластомой первая мутация — цитогенетически обнаруживаемая делеция или транслокация этой части хромосомы 13. Подобные хромосомные изменения, если они также нарушают смежные с RB1 гены, могут вызывать, кроме ретинобластомы, дополнительные дисморфические симптомы.
Выжившие дети с наследственной формой ретинобластомы имеют существенно повышенный (в 400 раз) риск развития других опухолей в последующем. Риск значительно выше, если ребенок получал лучевую терапию, поскольку пациенты с наследственной формой уже несут мутацию в одном аллеле RB1 во всех клетках их тела и, следовательно, подвержены другим опухолям, если теряют вторую копию.
Мезенхимальные опухоли, обычно развивающиеся в зрелости, включают остеогенные саркомы, фибросаркомы и меланомы. Хотя ген RB1 экспрессируется во многих тканях, потеря RB1 вызывает опухоли в детстве только в сетчатке и, позже в жизни, в тканях мезенхимального происхождения. Причина тканевой специфичности неизвестна.
Продукт гена RB1, названный p110 Rbl (белок размером 110 килодальтон), — фосфопротеин, сначала гипофосфорилируемый, а затем гиперфосфорилируемый на разных этапах клеточного цикла. В гипофосфорилированном состоянии он блокирует клеточный цикл между G1 и S, тормозя вход в S-фазу, за счет связывания и инактивации фактора транскрипции, обеспечивающих синтез ДНК.
Когда белок p110 Rbl становится более фосфорилированным, он высвобождает факторы транскрипции, допуская вход клетки в S-фазу; затем последовательно дефосфорилируется в течение клеточного цикла, что позволяет ему снова функционировать, блокируя переход в S-фазу следующего цикла. Утрата гена RB1 лишает клетки важной митотической контрольной точки и приводит к неконтролируемой пролиферации. Следовательно, ген RB1 — образец гена-супрессора опухолевого роста типа ХКЦ. Известно, что ген RB1 видоизменяется во многих клеточных линиях, происходящих из определенных различных опухолей в ходе их формирования.
Ретинобластома: причины, диагностика, лечение
Этиология и встречаемость ретинобластомы. Ретинобластома (MIM №180200) — редкая эмбриональная опухоль сетчатки (рис. С-34, см. цв. вклейку), вызванная унаследованными или соматическими мутациями, или их сочетанием, в обоих аллелях гена RB1. Она встречается во всех странах с частотой 1 на 18 000-30 000.
Патогенез ретинобластомы
Белок ретинобластомы — супрессор опухолевого роста, играющий важную роль в регуляции прохождения делящихся клеток через клеточный цикл и выход из него дифференцированных клеток. Белок ретинобластомы выполняет эти две функции, ограничивая активность других факторов транскрипции и усиливая деацетилирование гистонов, модификацию хроматина, связанную с подавлением активности генов.
Мутации в гене RB1, вызывающие ретинобластому, встречаются как в кодирующей области, так и в промоторе гена. Мутации в кодирующей области гена могут дестабилизировать белок ретинобластомы или затруднять ассоциацию с ферментами, необходимыми для деацетилирования гистонов. Мутации в промоторе снижают экспрессию нормального белка ретинобластомы. Оба типа мутаций приводят к недостатку функционального белка ретинобластомы.
Унаследованную мутацию RB1 обнаруживают у 40% пациентов с ретинобластомой, но только 10% из них имеют других пораженных членов семьи. Мутации RB1 включают цитогенетические аномалии, захватывающие участок хромосомы 13ql4, однонуклеотидные замены и небольшие инсерции или делеции. Существует подтверждение того, что большинство новых унаследованных мутаций возникает в отцовских аллелях, а соматические мутации возникают с равной частотой как в материнских, так и в отцовских аллелях.
Почти половина мутаций происходит в динуклеотидах CpG. При наличии унаследованного аллеля или появления соматической мутации в одном аллеле клетки, для неконтролируемого размножения и развития в ретинобластому также должен утратить функцию и другой аллель RB1 (второй «удар» двухударной гипотезы). Утрата второго функционального аллеля может произойти вследствие новой мутации, потери гетерозиготности или при гиперметилировании участка промотора CpG; чаще всего встречается делеция или изодисомия, реже всего — гиперметилирование промотора.
Ретинобластома обычно передается как аутосомно-доминантный признак с полной пенетрантностью; тем не менее, описано несколько семей с неполной пенетрантностью. Мутации гена RB1, идентифицированные в этих семьях, представляют собой миссенс-мутации, мутации сдвига рамки и мутации промотора. В отличие от более частых аллелей RB1 с полной потерей функции, считают, что эти мутации представляют аллели с некоторой остаточной функцией.

Фенотип и развитие ретинобластомы
Пациенты с двусторонней ретинобластомой обычно проявляются на первом году жизни, тогда как односторонняя форма проявляется несколько позже, с максимумом между 24 и 30 мес. Приблизительно 70% пациентов имеют одностороннюю ретинобластому, а 30% — двустороннюю. Все больные с двусторонней ретинобластомой имеют унаследованные мутации RB1, но не у всех людей с этими мутациями развивается двусторонняя патология. Болезнь диагностируют до 5 лет жизни у 80-95% пациентов.
Ретинобластома однозначно детальна при отсутствии лечения; тем не менее при правильной терапии у 80-90% пациентов удается сдержать болезнь в течение 5 лет после установления диагноза.
Как и следует ожидать при мутациях ключевого регулятора клеточного цикла, пациенты с унаследованными мутациями гена RB1 имеют заметно повышенный риск вторичных неоплазий; этот риск увеличивается влияниями факторов окружающей среды, например от лучевой терапии первичной ретинобластомы. Наиболее частые вторичные опухоли — остеосаркомы, саркомы мягких тканей и меланомы. У пациентов с ненаследственной ретинобластомой увеличения риска злокачественных опухолей нет.
Особенности фенотипических проявлений ретинобластомы:
• Возраст начала: детство
• Лейкокория
• Косоглазие
• Ухудшение зрения
• Конъюнктивиты
Лечение ретинобластомы
Для оптимального исхода важны раннее обнаружение и лечение болезни. Цель терапии — вылечить болезнь и по возможности максимально сохранить зрение. Лечение зависит от размера опухоли и вовлеченности смежных тканей. Варианты лечения при ретинобластоме — энуклеация, различные виды лучевой терапии, криотерапия, лазерная коагуляция и химиотерапия.
Если на момент осмотра болезнь односторонняя, необходимы частые обследования для выявления возможных новых ретинобластом в здоровом глазу, поскольку 30% видимо спорадических случаев вызваны новой унаследованной мутацией. Такие частые обследования обычно продолжают, по крайней мере, до 7 лет жизни.
Для того чтобы более эффективно организовать наблюдение, желательно проведение молекулярных тестов для идентификации мутации в гене RB1. Обычно сначала исследуют образец опухоли, а затем другую ткань, например, кровь, чтобы отличить одну из имеющихся мутаций от унаследованной. Если ни одна из мутаций не унаследованная, такого частого контроля пациенту не нужно.
Риски наследования ретинобластомы
Если у одного из родителей двусторонняя ретинобластома и он, вероятно, несет унаследованную мутацию, эмпирический риск для ребенка равен 45%; это отражает высокую вероятность второй соматической мутации (или «удара») во втором аллеле гена RB1 у ребенка. С другой стороны, если у родителя одностороннее поражение, эмпирический риск заболевания у ребенка составляет от 7% до 15%; это отражает соотношение наследуемых и соматических мутаций у таких пациентов. Почти 90% детей с ретинобластомой — первый случай в семье.
Интересно, что при обследовании сетчатки у 1% здоровых родителей больных детей обнаруживается подтверждение спонтанно разрешившейся ретинобластомы; следовательно, для этих семей риск родить больного ребенка равен 45%. За исключением редкой ситуации, когда один из родителей — непенетрантный носитель мутации гена RB1 семей, в которых ни один из родителей не имел ретинобластомы, риск повторения равен общепопуляционному.
Пример ретинобластомы. Ж.В., 2-летняя девочка, направлена педиатром для обследования по поводу правостороннего косоглазия и лейкокории (отсутствие красного рефлекса зрачка, приводящее к появлению белого зрачка). Ее мать рассказала, что у девочки развилось прогрессирующее правостороннее сходящееся косоглазие на первом месяце жизни, до осмотра педиатра. Она не отметила болезненности, припухания или покраснения правого глаза.
В остальном девочка была здорова. Родители и 4-месячная сестра здоровы; у других членов семьи заболеваний глаз не было. За исключением лейкокории и косоглазия, данные медицинского осмотра оказались нормальными. При офтальмологическом обследовании выявлена одиночная опухоль сетчатки размером 8 диаметров зрительного диска, расположенная около макулы. МРТ головы не обнаружила распространения опухоли за пределы глазного яблока. Ж.В. получила химиотерапию с прицельной лучевой терапией. ДНК-анализ показал, что у девочки присутствует унаследованная мутация (замена С на Т) в одном аллеле гена ретинобластомы (RB1).
Современная молекулярная генетика и наследственные дистрофии сетчатки
Для цитирования: Шамшинова А.М., Зуева М.В., Залетаев Д.В. и др. Современная молекулярная генетика и наследственные дистрофии сетчатки. Клиническая офтальмология. 2001;2(4):142.
Modern molecular genetics and hereditary retinal distrophy
Modern molecular genetics and hereditary retinal distrophy
Shamshinova A.M., Zueva M.V., Zaletaev D.V., Tsipenco I.V., Zolnikova I.V., Yakovlev A.A.
There is an analysis of genetic studies, devoted to determination of specific chromosomal areas of various macular and peripheral retinal dystrophies, represented in the article. Results of genetic analysis showed that, in spite of differences in clinical picture of some retinal dystrophies, they may be connected with the expression of the same genes.
Литература
Adato A., Weston M.D., Berry A. et al. Three novel mutations and twelve polymorphisms identified in the USH2A gene in Israeli USH2 families // Hum. Mutat– 2000.– V.15, N4.– P. 388.
Aguilar–Bryan L., Ntehols C.G., Wechster S.W. et al. Cloning of the beta cell high–affinity suffon–ylurea receptor: a regulator of insulin secretion // Science.–1995.– V. 268.– P. 423–426.
Allikmets R., Singh N., Shroyer N.F. et al. A photoreceptor cell–specific ATP–binding transporter gene (ABCR) is mutated in recessive Stargardt macular dystrophy // Nat. Genet.–1997.– V. 15.– P. 236–246.
Allikmets R., Shroyer N.F., Singh N. et al. Mutation of the Stargardt disease gene (ABCR) in age–related macular degeneration // Science.–1997.– V.277.– P.1805–1807.
AI–Maghtheh M., Ingleheam C.F., Keen T.J..et al. Identification of a sixth locus for autosomal dominant retinitis pigmentosa on chromosome 19 // Hum. Mol. Genet.–1994.– V. 3.– P. 351–354.
Azarian S.M.. Travis G.H. The photoreceptor rim protein is an ABC transporter encoded by the gene for recessive Stargardts–disease (ABCR) // FEBS Lett.–1997.– V. 409.– P. 247–252.
Azarian S.M., Papennaster D.S., Travis G.H. Molecular characterization of the rim protein in bovine photoreceptors // Invest. Ophthalmol. Vis. Sci.–1996.– V. 37.– P. 5805.
Azarian S.M., Megarity Ch.F., Weng J. et al. The human photoreceptor rim protein gene (ABCR):
genomic structure and primer set information for mutation analysis // Hum. Genet.– 1998.– V. 102.– P. 699–705.
Baneriee P., Klein P. W., Knowles J.A.et al. TULP1 mutation in two extended Dominican kindreds with autosomal recessive retinitis pigmentosa // Nat. Genet.–1998.– V. 18.– P. 177–179.
Bard/en S., Ebenezer N., Greenberg J.,et al. An eighth locus for autosomal dominant retinitis pigmentosa is linked to chromosome 17q // Hum. Mol. Genet.–1995.– V. 4.– P. 1459–1462.
Bech–Hansen N. Т.; Nayfor M. J.; Maybaum T. A. et a/. Loss–of–function mutations in a calcium–channel alpha–1–subunit gene in Xp11.23 cause incomplete X–linked congenital stationary night blindness // Nature Genet.–1998.– V. 19.– P. 264–267.
Вегдеп, А. А. В., ten Brink J. В., Riemslag F. et al. Localization of a novel X–linked congenital stationary night blindness locus: dose linkage to the RP3 type retinitis pigmentosa gene region // Hum. Molec. Genet,– 1995.– V. 4.– P. 931–935.
Bird AC. Clinical investigations of retinitis pigmentosa // Brit. J. Ophthatmol.–1988.– V. 59.– P. 177–199.
Bhattacharya S.S., Wnght A.F., Clayton J.F.,et al. Close genetic linkage between X–linked retinitis pigmentosa and a restriction fragment lenght polymorphism identified by recombinant DNA probe LI.28 // Nature.– 1984.– V. 309.– P. 253–255.
Blanton S.H., Heckenlively J.R.. Cottingham A.W., etal. Linkage mapping of autosomal dominant retinitis pigmentosa (RP1) tothe pericentric region of human chromosome 8 // Genomics.–1991.– V. 11.–P. 857–869.
Sough/nan J.A., Confally P.M. and Nance W.E. Population genetic studies of retinitis pigmentosa // Amer. J. Hum. Genet.–1980.– V. 32.– P. 223–235.
Boycott К. M., Реагсе W. G., Musarella M. A. et al. Evidence for genetic heterogeneity in X–linked congenital stationary night blindness // Amer. J. Hum. Genet.–1998.– V. 62.– P. 865–875.
Bunker C.H., Berson E.L, Bromley W.C.,et al. Prevalence of retinitis pigmentosa in Maine // Amer. J. Ophthalmol.–1984.– V. 97.– P. 357–365.
Connell G.J., Molday R.S. Molecular cloning, primary structure, and orientation of the vertebrate photoreceptor cell protein peripherin in the rod outer segment disc membrance // Biochemistry.–1990.–V. 29.– P. 4691–4698.
Cremers F.P.M., Pol D.J.R. van de, Hollander A.I. den et al. Autosomal recessive retinitis pigmentosa and cone–rod dystrophy caused by splice site mutation in the Stargardfs disease gene ABCR // Hum. Mol. Genet– 1998.–V. 7– P. 355–362.
Crouch R.K.. Goletz P., Yu S. et al. A possible role for RPE65 in retinoid processing // Invest. Ophthalmol. Vis. Sci.–1997.–V. 38.– P. 1422.
Dean M.. Allikmets R. Evolution of ATP–binding cassette transporter genes // Curr. Opin. Genet. Dev.–1995.– V. 5.– P. 779–785.
Devree J.M.L, Jacquemin E; Sturm E. et al. Mutations in the Mdr3 gene cause progressive familial intrahepatic cholestasis // Proc. Natl. Acad. Sd. USA.–1998.– V. 95.– P. 282–287.
Dryja T.P., Finn J.T., Peng Y–W., et a/.Mutations in the gene encoding the a subunit of the rod cGMP–gated channel in autosomal recessive retinitis pigmentosa // Proc. Natt. Acad. Sd. USA.–1995.–V.92.–P. 10177–101181.
Dryja T.P., McGee T.L, Reichel E., et al. A point mutation of rhodopsin gene in one form of retinitis pigmentosa // Nature.–1990.– V. 343.– P. 364–366.
Fagerheim T, Raeymaekers P, Merren J, et al. Homozygosity mapping to the USH2A locus in two isolated populations // J. Med. Genet.–1999.– V. 36, N2.– P.44–47.
Farrar G.J., Kenna P., Jordan S.AД et al. A three base–pair deletion in the peripherin–RDS gene in one form of retinitis pigmentosa // Nature.– 1991.– V. 354.– P. 478–480.
Finckh U., Xu S., Kumaramanickavel G., Schumann M., et a/. Homozygosity mapping of autosomal recessive retinitis pigmentosa locus (RP22) on chromosome 16p12.1–p12.3 // Genomics.–1998.–V.48.–P. 341–345.
Fisher S. E., Ciccodicola A., Tanaka K. et al. Sequence–based exon prediction around the synaptophysin locus reveals a gene–rich area containing novel genes in human proximal Xp // Genom–ics.– 1997.– V. 45.– P. 340–347.
Franke R.R., Sakmar T.P., Graham P.M. et a/.Structure and function in rhodopsin: Studies of the interaction between the rhodopsin in cytoplasmic domain and transdudn // J. Biol. Chem.– 1992.– V. 267.–P. 14767–14774.
Gat A., Apfelstedt–Sytta E., Janecke A.R. et al. Rhodopsin mutation in inherited retinal dystrophies and dysfunctions // Prog. Ret. Eye Res.– 1997.– V. 16.– P. 51–79.
Gal A.. Orth U.. Baehr W., et al. Heterozygous missense mutation in the rod cGMP phosphodiesterase b subunit gene in autosomal dominant stationary night blindness // Nat.Genet–1994.– V. 7.– Р. 64–68.
Greenberg J., Goliath R., Beighton P. et at. A new locus for autosomal dominant retinitis pigmentosa on the short arm of chromosome 17 // Hum. Mol. Genet.–1994.– V. 3.– P. 915–918.
Gu S., Thompson D.A., Srikuman S.,et al. Mutations in RPE65 cause autosomal recessive childhood onset severe retinal dystrophy // Nat. Genet–1997.– V. 17.– P. 194–197.
Hamel C.P., Tsilou E., Pfeffer B.A., et al. Molecular cloning and expression of RPE65, a novel retinal pigment epithelium–specific microsomal protein that is post–transcriptionally regulated in vitro // J. Biol. Chem.– 1993.–V. 268.– P. 15751–15757.
Hardcastle A. J., David–Gray Z. К., Jay, M. et al. Localization of CSNBX (CSNB4) between the retinitis pigmentosa loci RP2 and RP3 on proximal Xp // Invest. Ophthal. Vis. Sci.– 1997.– V. 38.– P. 2750–2755.
Heckenlively J.R. and Foxmann S.G. Congenital and early–onset forms of retinitis pigmentosa // Retinitis Pigmentosa / Heckenlively J.R. ed. Lippincott: Philadelphia PA.–1988.– P. 107–149
Hmani M., Ghorbel A.. Boulila–Elgaied A. et al. A novel locus for Usher syndrome type II, USH2B, maps to chromosome 3 at p23–24.2 // Eur. J. Hum. Genet.–1999.– V. 7, N 3.– Р. 363–367/
Ноупд С.В., Poppelaars F., Pol T.J. van de et al. Genetic fine mapping of the gene for recessive Stargardt disease // Hum. Genet.–1996.– V. 98.– P. 500–504.
Huang S.H., Huang X., Pittter S.JДet al. A mutation in the gene encoding the a–subunit of rod cGMP phosphodiesterase (PDEA) in retinitis pigmentosa // Invest. Ophthalmol. Vis. Sci.– 1995.– 36 (suppi).– 8825 (abstract no.3815).
Illing M., Molday LL, Molday R.S. The 220–kDa rim protein of retinal rod outer segments is a member of the ABC transporter superfamily // J. Biol. Chem.–1997.– V. 272,– P. 10303–10310.
Ingleheam C.F., Carter S.A., Keen T.J., et al. A new locus for autosomal dominant retinitis pigmentosa on chromosome 7p // Nat. Genet.–1993.– V. 4.– P. 51–53.
Janecke A.R., Meins M., Sadeghi M.. et al. Twelve novel myosin VIIA mutations in 34 patients with Usher syndrome type I: confirmation of genetic heterogeneity // Hum. Mutat.–1999.– V. 13, N 2.– Р. 133–140.
Jay M. Figure and fantasies: the frequencies of the different genetic forms of retinitis pigmentosa // Birth Defects.–1982.–V. 18.– P. 167–173.
Joensuu Т., Hamalainen P., Lehesioki A.E. et al. A sequence–ready map of the Usher syndrome type III critical region on chromosome 3q.6 // Infect. Immun.– 2000.– V. 68, N 4.– Р. 2009–2015.
Jordan S.A.. Farrar G.J., Kenna P.et al. Localisation of an autosomal dominant retinitis pigmentosa gene to 7q // Nat. Genet.–1993.– V. 4.– P. 54–58.
Jordan S.A., Farrar G.J., Kumar–Singhe R–.et al. Autosomal dominant retinitis pigmentosa (adRP; RP6): Cosegration of RP6 and the peropherin–RDS locus in a late–onset family of Irish origin // Amer. J. Hum. Genet–1992.–V. 50.– P. 634–639.
Kajhwara К., Berson E.L, Dryja T.P. Digenic retinitis pigmentosa due to mutations at the unlinked peripherin/RDS and ROM1 loci // Science.–1994.– V. 264.– P. 1604–1608.
Kajiwara К., Hahn L.B., Mukai S. et al. Mutations in the human retinal degeneration slow gene in autosomal dominant retinitis pigmentosa // Nature.–1991.– V. 354.– P. 480–482.
Knowtes J.A., Shugarts Y.Y., Baneijee P.et al. Identification of a locus, distinct from RDS–peripherin, for autosomal recessive retinitis pigmentosa on chromosome 6p // Hum. Mol. Genet.–1994.–V.3.–P. 1401–1403.
Kumaramanickavel G., Maw M., Denton M.J. et al. Missense rhodopsin mutation in a family with recessive RP // Nat. Genet.–1994.– V. 8.– P. 10–11.
Liu X.Z., Hope С., Liang С. Y. et at. A mutation (2314delG) in the Usher syndrome type IIA gene:
high prevalence and phenotypic variation // Amer. J. Hum. Genet.–1999.– V. 64, N 4.– Р. 1221–1225.
Mansergh F.C., Millington–Ward S., Kennan A. et al. Retinitis pigmentosa and progressive sensorineural hearing loss caused by a C12258A mutation in the mitochondrial MTTS2 gene // Amer. J. Hum. Genet,– 1999.– V. 64, N 4.– Р. 971–985.
Marlhens F., Bareil C., Griffon C. et al. Mutations in RPE65 cause Leber’s congenital amaurosis // Nat. Genet.–1997.–V. 17.– P. 139–140.
Martinezmir A., Bayes M., Vilageliu L., et at. A new locus for autosomal recessive retinitis pigmentosa (RP19) maps to 1p13–1p21 // Genomics.– 1997.– V. 40.– P. 142–146.
Martinezmir A., Bayes MД Vilageliu L. et al. A new locus for autosomal recessive retinitis pigmentosa (RP19) maps to 1p13–1p21 // Genomics.– 1997.– V. 40.– P.142–146.
Martinezmir A., Paloma E., Allikmets R. et al. Retinitis pigmentosa caused by a homozygous mutation in the Stargardt–disease gene // Nat. Genet.–1998.– V. 18.– P. 11–12.
Maw M.A., Kennedy В., Knight A. et al. Mutation of the gene encoding cellular retinaldehyde–binding protein in autosomal recessive retinitis pigmentosa // Nat. Genet.–1997.– V. 17.– P. 198–200.
McLaughlin M.E., Sandberg M.A., Berson E.Let at. Recessive mutations in the gene encoding the b–subunit of rod phosphodiesterase in patients with retinitis pigmentosa // Nat. Genet– 1993.– V. 4.–P. 130–134.
McWilliam P., Farrar G.J., Kenna P. et al. Autosomal dominant retinitis pigmentosa (ADRP):
Localisation of an adRP gene to the long arm of chromosome 3 // Genomics.–1989.– V. 5.– Р. 619–622.
Meindl A., Dry К., Herrmann К. et at. A gene (RPGR) with homology to the RCC1 guanine nucleotide exchange factor is mutated in X–linked retinitis pigmentosa (RP3) // Nature Genet.– 1996.– V. 13.–P. 35–42.
Mosser J.. Douar AM, Sarde C.O. et al. Putative X–linked adrenoleukodystrophy gene shares unexpected homology with ABC transporters // Nature.–1993.– V. 361.– Р. 726–730.
Pieke–Dahl S., Moller C.G., Kelley P.M. et al. Genetic heterogeneity of Usher syndrome type II:
localisation to chromosome 5q // Med. Genet.– 2000.– V. 37, N 4.–P. 256–262.
Rosenfield P.J., Cowley G.S., McGee T.Let al. A null mutation in the rhodopsin mutation in the rhodopsin gene causes rod photoreceptor dysfunction and autosomal recessive retinitis pigmentosa // Nat. Genet.– 1992.– V. 1.– P. 209–213.
Rozzo C., Fossaretio М., Galleri G. et al. Complete congenital stationary night blindness maps on Xp11.4 in a Sardinian family // Europ. J. Hum. Genet.–1999.– V. 7.– P. 574–578.
Shugarts Y. Y., Banerjee P., Knowles J.A. et al. Fine genetic mapping of a gene for autosomal recessive retinitis pigmentosa on chromosomal 6p21 //Amer. J. Hum. Genet.–1995.– V. 57.– P. 499–502.
Strom Т. М., Nyakatura G., Apfelstedt–Sylta E. et al. An L–type calcium–channel gene mutated in incomplete X–linked congenital stationary night blindness // Nature Genet–1998.– V. 19.– P. 260–263.
Thomas P.M., Cote G.J., Wohllk N. et al. Mutations in the sulfonylurea receptor gene in familial persistent hyperinsulinemic hypoglicemia of infancy // Science.–1995.– V. 268.– P. 426–429.
Thomson J.L, Brzeski H., Dunbar B. et al. Photoreceptor rim protein: partial sequences of cDNA show a high degree of similarity to ABC transporters // Curr. Eye Res.–1997.– V. 16.– P. 741–745.
Travis G.H., Вгеппап М.В., Danielson P.E. et al. Identification of a photoreceptor–specific mRNA encoded by the gene responsible for retinal degeneration slow (rds) // Nature.– 1989.– V. 338.– P. 70–73.
Travis G.H., Sutcliiffe J.G., Bok D. The retinal degeneration slow (rds) gene product is a photoreceptor disc membrane associated glycoprotein // Neuron.–1991.– V. 6.– P. 61–70.
Van Soest S. et al Assignment of a gene for autosomal recessive retinitis pigmentosa (RP12) to chromosome 1q31–q32.1 in an inbred and genetically heterogeneous disease population // Genomics.» 1994.–V.22.–P. 499–504.
Weston M.D., Eudy J.D., Fujita S. et al. Genomic structure and identification of novel mutations in usherin, the gene responsible for Usher syndrome type fia A // Amer. J. Hum. Genet.– 2000.– V. 66, N 4.–P. 1199–1210.
Whght A.F., Bhattacharya S.S., Clayton J.F. et al. Linkage relationships between X–linked retinitis pigmentosa and nine short arm markers; exclusion of the disease locus from Xp21 and localisation to between DXS7 and DXS14 // Amer. J. Hum. Genet.–1987.– V. 41.– P. 635–644.
Xu S.Y., Schwartz M., Rosenburg T. et al. A ninth locus (RP18) for autosomal dominant retinitis pigmentosa maps in the pericentromeric region of chromosome 1 // Hum. Mol. Genet.–1996.– V. 5.– P. 1193–1997.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Ретинобластома
Ретинобластома – злокачественное внутриглазное новообразование, развивающееся из нейроэктодермы сетчатки и встречающееся преимущественно у детей раннего возраста. Для клиники ретинобластомы характерна потеря центрального и бинокулярного зрения, боль, лейкокория, развитие косоглазия, экзофтальма, вторичного воспаления и глаукомы. Обследование при подозрении на ретинобластому включает исследование зрения, измерение внутриглазного давления, осмотр глазного дна, проведение УЗИ глаза, рентгенографии орбиты и придаточных пазух носа, КТ головного мозга, люмбальной пункции. Пациентам с ретинобластомой выполняется фотокоагуляция, криотерапия опухоли; при невозможности сохранения органа зрения - энуклеация пораженного глаза с последующим глазопротезированием.
Общие сведения
Ретинобластома – злокачественное новообразование детского возраста, поражающее сетчатку, сосудистую оболочку глаза, орбиту и часто дающее отдаленные метастазы. На долю ретинобластомы приходится 2,5-4,5% случаев всех злокачественных новообразований у детей до 15 лет. В большинстве случаев ретинобластома развивается в возрасте до 5 лет, пик заболеваемости приходится на 2-3 года. В офтальмологии опухоль с одинаковой частотой встречается у девочек и мальчиков.
Причины ретинобластомы
В 50-60% случаев ретинобластомы имеют генетическое (врожденное) происхождение. Более половины детей с ретинобластомой рождается от родителей, имевших в детстве аналогичное заболевание. Врожденная ретинобластома обычно выявляется у детей в возрасте до 30 месяцев. В этом случае ретинобластома, как правило, сочетается с другими врожденными аномалиями – пороками сердца, расщелинами неба («волчьей пастью»), кортикальным детским гиперостозом и др. У больных с генетической формой ретинобластомы имеется повышенный риск развития злокачественных новообразований другой локализации.
Спорадические случаи ретинобластомы встречаются реже и возникают по неизвестным причинам. К числу факторов риска негенетической формы ретинобластомы принято относить высокий возраст родителей, их занятость на металлургических производствах, неблагоприятные экологические и алиментарные факторы, вызывающие аберрации в хромосомах ретинальных и половых клеток. Данная форма опухоли проявляется у детей более старшего возраста и крайне редко - у взрослых.
Современные воззрения на гистогенез ретинобластомы позволяют ее отнести к опухолям нейроэктодермального происхождения. Ретинобластома может исходить из клеток любого ядерного (зернистого) слоя сетчатки. При микроскопическом исследовании определяются отсутствие стромы, очаги некроза и кальцификаты, разная степень дифференцировки опухолевых клеток.
Для ретинобластомы характерен быстрый рост, метастазирование по зрительному нерву в головной мозг, а также гематогенное распространение в костный мозг и трубчатые кости.
Классификация ретинобластомы
По происхождению ретинобластомы делятся на наследственные и спорадические. Наследственные ретинобластомы обычно поражают одновременно оба глаза. Спорадические ретинобластомы, как правило, поражают один глаз и развиваются локально, с образованием единичного (унилатерального) опухолевого узла.
По степени дифференцировки опухолевых клеток различают дифференцированную форму опухоли – ретиноцитому и недифференцированную форму – ретинобластому, которая встречается чаще и является более злокачественной.
Ретинобластома может иметь эндофитный тип роста в направлении центра глазного яблока: при этом происходит разрушение слоев сетчатки и стекловидного тела. При другом варианте роста – экзофитном, ретинобластома инфильтрирует сетчатку, распространяясь в субретинальное пространство. Экзофитные опухоли могут вызывать отслойку сетчатки и скопление транссудата в субретинальном пространстве. В редких случаях (1-2%) встречается инфильтративная форма ретинобластомы, которая ведет к диффузному истончению сетчатки, накоплению экссудата в передних отделах глаза, развитию передних спаек и псевдогипопиона.
Согласно клинической классификации ретинобластомы по системе TNM, выделяют степени развития первичной опухоли:
- Т1 – ретинобластома занимает до 25% глазного дна
- Т2 – ретинобластома распространяется на площадь более 25%, но менее 50% поверхности сетчатки
- ТЗ – ретинобластома распространяется более чем на половину сетчатки или выходит за ее пределы, но сохраняет интраокулярное расположение
- Т4 – ретинобластома выходит за пределы орбиты.
- N1 – имеются метастазы в регионарных (околоушных, подчелюстных, шейных) лимфоузлах.
- Ml - определяются отдаленные метастазы ретинобластомы в головном мозге, костном мозге, костях, печени и др. органах.
Симптомы ретинобластомы
В клиническом течении ретинобластомы различают четыре последовательные стадии.
I – стадия покоя. В этом периоде субъективные симптомы отсутствуют. При осмотре пораженного глаза выявляется лейкокория (симптом «кошачьего глаза») – белый зрачковый рефлекс, обусловленный просвечиванием опухолевой массы через зрачок. К ранним признакам ретинобластомы относят потерю центрального и бинокулярного зрения, вследствие чего может развиваться косоглазие.
II – стадия глаукомы. Сопровождается воспалительными явлениями в глазу – гиперемией, светобоязнью, слезотечением, развитием иридоциклита и увеита. На фоне опухолевой инвазии отмечается локальный болевой синдром. Разрушение ретинобластомой трабекулярного аппарата приводит к затруднению оттока ВГЖ, увеличению внутриглазного давления и возникновению вторичной глаукомы.
III - стадия прорастания. Характеризуется развитием экзофтальма различной степени выраженности, инвазией мягких тканей орбиты и разрушением ее стенок, прорастанием ретинобластомы в придаточные пазухи и субарахноидальное пространство.
IV – стадия метастазирования. Протекает с выявлением отдаленных диссеминированных очагов в костном мозге, печени, трубчатых костях, головном мозге, костях черепа. Распространение ретинобластомы происходит по мягкой мозговой оболочке, зрительному нерву, лимфогенным и гематогенным путем. На этой стадии страдает общее состояние пациента: развивается интоксикация, слабость, мозговые симптомы (тошнота, рвота, головная боль).
Диагностика ретинобластомы
Дети с семейным анамнезом ретинобластомы должны находиться под постоянным наблюдением офтальмолога. На развитие ретинобластомы обычно указывает триада симптомов: лейкокория, косоглазие, расширение зрачка с ослаблением его реакции на свет. При появлении данных признаков проводится тщательное офтальмологическое обследование ребенка, включающее биомикроскопию, прямую и обратную офтальмоскопию, визометрию, тонометрию, гониоскопию, исследование бинокулярного зрения, экзофтальмометрию, измерение угла косоглазия. При помутнении оптических сред важная роль в выявлении ретинобластомы принадлежит УЗИ глаза.
Интраокулярная биопсия может привести к диссеминации злокачественных клеток внутри глаза, поэтому к ее проведению прибегают только при наличии абсолютных показаний. Для оценки распространенности ретинобластомы используются рентгенография орбиты, рентгенография околоносовых пазух, КТ и МРТ головного мозга, сцинтиграфия печени, остеосцинтиграфия. Для оценки возможного отдаленного метастазирования прибегают к выполнению люмбальной пункции с исследованием цереброспинальной жидкости; пункции костного мозга и исследованию миелограммы.
В процессе диагностики ретинобластому следует дифференцировать от рубцовой ретинопатии, дисплазии сетчатки, гамартом, мягкотканных сарком, метастазов нейробластомы, поражений орбиты при лимфоме и лейкемии.
Дети с ретинобластомой должны быть проконсультированы неврологом и отоларингологом.
Лечение ретинобластомы
Лечение ретинобластомы проводится с учетом стадии опухолевого поражения. При этом может использоваться хирургическое вмешательство, лучевая и лекарственная химиотерапия, лазеркоагуляция, криотерапия, термотерапия. Правильное сочетание этих методов во многих случаях позволяет сохранить глаз и зрение. В случает двусторонней ретинобластомы, в отношении каждого глаза определяется дифференцированная тактика в зависимости от степени его поражения опухолью.
В настоящее время офтальмохирурги и офтальмоонкологи стремятся придерживаться максимально консервативного ведения ретинобластомы. При поражениях переднего участка сетчатки и диаметре опухоли до 7 мм прибегают к криодеструкции ретинобластомы; при поражении задних отделов и размерах опухоли до 4 мм показана фотокоагуляция. Возможно проведение термотерапии – комплексного воздействия на опухоль с помощью микроволновой терапии, ультразвукового и инфракрасного излучения.
При массивном внутриглазном поражении, развитии глаукомы, утрате и невозможности восстановления зрения прибегают к энуклеации глаза с последующим глазопротезированием. При экстраокулярном распространении ретинобластомы показана экзентерация глазницы.
Ретинобластома чрезвычайно чувствительна к лучевому лечению. Лучевая терапия при ретинобластоме позволяет добиться хороших результатов в сочетании с органосохраняющими и хирургическими методами лечения. При этом возможно как наружное дистанционное, так и контактное облучение с помощью аппликаций радиоактивных веществ. Осложнением лучевой терапии может являться развитие постлучевой катаракты, лучевого кератита, ксероза.
Химиотерапия в лечении ретинобластомы используется при массивном внутриглазном поражении, опухолевой инвазии зрительного нерва, региональных метастазах. Наиболее эффективным признано сочетание нескольких цитостатиков (винкристина, этопозида, карбоплатина).
Прогноз и профилактика ретинобластомы
При своевременной диагностике и выявлении ретинобластомы на ранней стадии возможно стойкое излечение пациента с помощью органосохраняющих методов – фотокоагуляции, криотерапии, лучевой терапии. При энуклеации глаза также наблюдается высокая выживаемость, однако данная операция сопровождается потерей глаза как органа зрения и образованием косметического дефекта. Факторами неблагоприятного прогноза ретинобластомы служат прорастание опухоли в зрительный нерв, инвазия хориоидальной оболочки, экстрасклеральное распространение опухоли, двустороннее поражение.
Для профилактики ретинобластомы необходимо медико-генетическое консультирование семей с наследственными случаями рака сетчатки, обследование детей раннего возраста из групп риска.
Читайте также:
- Глаза при аутоиммунном тиреоидите. Экзофтальм при микседеме
- Внутривенные и ингаляционные препараты для вводного наркоза
- Нарушение ритма сердца и проводимости при пороках сердца. Внутрижелудочковая блокада при пороке сердца
- Лечение венозной гипертонии. Последствия венозной гипертонии
- Обратимые ингибиторы ЦОГ: НПВС. Антагонисты АДФ-рецепторов: тиклопидин, клопидогрел
