Саркома Юинга - клиника, диагностика
Добавил пользователь Владимир З. Обновлено: 28.01.2026
Саркома Юинга - клиника, диагностика
Саркома Юинга представляет собой злокачественную круглоклеточную опухоль кости с неизвестной этиологией. Транслокация хромосом, характерная для клеток саркомы Юинга, обсуждается в отдельной статье на сайте (рекомендуем пользоваться формой поиска на главной странице сайта).
Пик заболевания приходится на возраст 10-20 лет, и подобно остеосаркоме, опухоль чаще встречается у мужчин (1,5:1). У жителей африканских стран и у темнокожего населения Америки опухоль развивается крайне редко.
Обычные симптомы развития опухоли — боли и припухлость, причем они могут развиться за несколько месяцев до постановки диагноза. Больной обращается к врачу, в первую очередь, с легочной симптоматикой, которая связана с метастазами.
Опухоль развивается, главным образом, на плоских костях таза, реже поражаются бедренная большеберцовая и плечевая кости. Также опухоль может возникать в позвонках, ребрах и в костях черепа. Довольно часто, особенно при больших метастазирующих опухолях, больные жалуются на лихорадочное состояние и потерю веса.
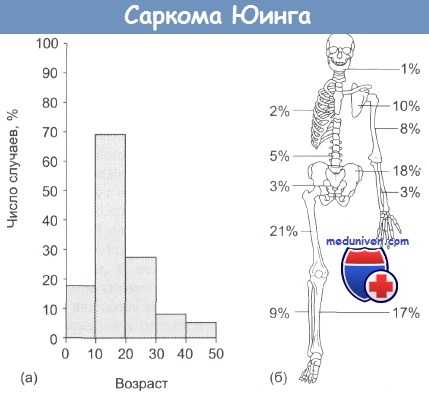
Саркома Юинга:
(а) зависимость заболеваемости от возраста;
(б) локализация первичной опухоли.
Патогенез саркомы Юинга
Обычно опухоль развивается на диафизе и реже на метафизе. Опухоли эпифиза крайне редки. Гистологически опухоль состоит из мелких клеток округлой формы и напоминает лимфому неходжкинского типа, метастазирующую нейробластому и некоторые типы рабдомиосаркомы. Это следует учитывать при дифференциальной диагностике саркомы Юинга.
Используя традиционные методы гистологического анализа, практически невозможно отличить эту саркому от простых опухолей нейроэктодермального происхождения (PNET), таких как опухоль Аскина Действительно, классическая саркома Юинга и PNET, по-видимому, являются представителями семейства разновидностей круглоклеточной опухоли с различной степенью нейродифференцировки.
С помощью иммуногистохимических методов в клетках PNET можно обнаружить характерные для нейронов маркеры, например специфическую энолазу и молекулы, обеспечивающие их адгезию. При развитии PNET в кости прогноз не сильно отличается от случаев саркомы Юинга. Дифференциальная диагностика с лимфобластомой проводится с помощью антител к общему антигену лейкоцитов (при этом клетки лимфомы прокрашиваются).
Также в клетках саркомы Юинга отсутствует поверхностный иммуноглобулин. Клетки саркомы Юинга обычно прокрашиваются антителами к MIC2 — антигену, характерному для клеток опухоли.
Обычно опухоль прорастает медуллярный и кортикальный слои кости, и поэтому при планировании операции или схемы лучевой терапии необходимо учитывать, что границы иссечения опухоли или поля облучения должны быть максимально-широкими. Часто в цитоплазме клеток саркомы Юинга обнаруживается гликоген (с реактивом Шиффа), что облегчает ее дифференциальную диагностику с использованием клинических, рентгенографических и биохимических методов. Часто наблюдаются метастазы в легкие и в кости.
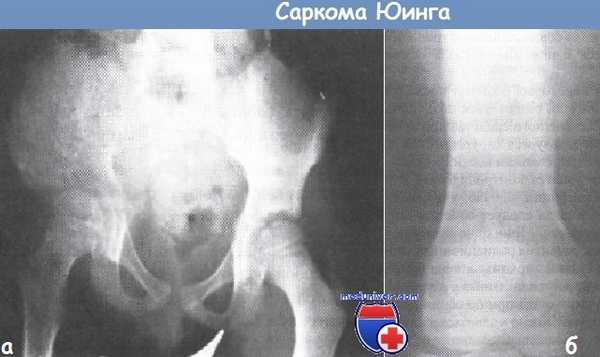
а - саркома Юинга правой подвздошной кости.
Размер кости увеличен, что вызвано массивным разрастанием опухоли.
б - рентгенограмма бедренной кости с саркомой Юинга.
Видно расположение опухоли на диафизе, подъем надкостницы и образование новой кости.
Обследование больных при подозрении на саркому Юинга
Диагноз ставится на основании гистологического исследования образца ткани опухоли, полученного при биопсии. На рентгенограмме плоских костей обычно видны диффузные области эрозии. Такие же области видны на диафизе длинных костей. Часто наблюдаются характерные изменения надкостницы, иногда имеющие вид «луковой кожуры», обычно с вовлечением мягких тканей, нередко обширного характера.
При дальнейшем обследовании больным делают полный анализ крови, который может показать анемию или лейкоцитоз, характерные для быстрого роста опухоли или для поздних стадий заболевания. Проводят также ренгтгенографическое обследование грудной клетки и КТ места локализации первичной опухоли и грудной клетки. При этих процедурах можно обнаружить метастазы. Обычно для обнаружения метастазов выполняют изотопное сканирование костей.
Проводят анализ лактатдегидрогеназы в сыворотке крови и пробу на функциональную активность печени. При подозрении на нейробластому назначают анализ мочи с определением ванилилминдальной кислоты. Ценная информация о степени инвазии опухоли в костную и мягкую ткань может быть получена при магнитно-резонансном исследовании. При первичном диагнозе примерно у 20% больных обнаруживаются метастазы.
Присутствие клеток саркомы Юинга в костном мозге можно обнаружить с помощью чувствительного молекулярного метода определения транслокаций t(11:22). Примерно в 50% случаев это связано с существованием крупных опухолей с неблагоприятным прогнозом.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Саркома мягких тканей
Саркома мягких тканей – это группа редких злокачественных новообразований мезодермального происхождения, которые развиваются из жировой клетчатки, мышечной и фиброзной ткани, оболочек периферических нервов. Клинические проявления опухоли включают локальное уплотнение, болевой синдром и нарушение функции органа на поздних стадиях заболевания. Для диагностики применяются методы визуализации (УЗИ, КТ, МРТ), гистологическая верификация, лабораторные исследования. Комплексное лечение саркомы требует проведения радикальных хирургических вмешательств, лучевой терапии, полихимиотерапии и таргетной терапии.
МКБ-10



Общие сведения
Хотя мягкие ткани занимают 50% веса тела, распространенность сарком невелика. В мире они составляют 1-2,5% от всех видов злокачественных опухолей у взрослых, до 15% – у детей. В России ежегодно диагностируется более 10 тыс. новых эпизодов болезни, что составляет 1% от всей онкопатологии или 30 случаев на 1 млн. населения. Несмотря на постоянное развитие онкологии, терапия сарком мягких тканей (СМТ) остается недостаточно эффективной. Большую актуальность имеет разработка таргетных препаратов и иммунотерапии для повышения результативности и радикализма лечения.

Причины
Точные этиологические факторы развития саркомы пока не установлены. В научной онкологии ведутся диспуты по поводу роли химических канцерогенов (инсектициды, гербициды, хлористый винил) и неблагоприятного радиационного фона. Среди предрасполагающих факторов называют генетические болезни: нейрофиброматоз, синдромы Гарднера и Ли-Фраумени. Некоторые авторы к причинам СМТ причисляют хроническую лимфедему.
Патогенез
Развитие саркомы подчиняется классическим законам патофизиологии опухолевого роста. Клетки новообразования отличаются утратой верхнего лимита Хайфлика и отсутствием контактного торможения, что обуславливает их неконтролируемые циклы деления. Опухолевая ткань имеет метаболический и энергетический атипизм, высокую способность к анаэробному гликолизу и развитию в условиях гипоксии.
Для сарком характерна интенсивная васкуляризация. Процессы ангиогенеза играют решающую роль в развитии и метастазировании опухолей, определяют их агрессивный инвазивный рост. Образование сосудов контролируется VEGF – фактором роста эндотелия, который признан важнейшим промоутером ангиогенеза. Он активизируется на фоне клеточной гипоксии, связывается со специфическими рецепторами и вызывает пролиферацию эндотелиальных клеток.
Классификация
Самые распространенные гистологические подтипы сарком мягких тканей включают злокачественные фиброзные гистиоцитомы (28%), липосаркомы (15%), лейомиосаркомы (12%) и неклассифицируемые саркомы (11%). Реже встречаются рабдомиосаркомы (5-6%), фибросаркомы (3%). В практической онкологии широко используется клиническая классификация TNM, согласно которой существует 4 стадии заболевания:
- Iстадия. Характеризуется размером первичной опухоли до 5 см, низким уровнем злокачественности клеток, отсутствием регионарных и отдаленных метастазов.
- IIстадия. Устанавливается при любом размере поверхностной опухоли или глубоком новообразовании диаметром менее 5 см. Любые признаки метастазирования отсутствуют.
- IIIстадия. Определяется при появлении метастазов в регионарных лимфатических узлах либо при диаметре глубокой опухоли свыше 5 см без признаков метастазирования.
- IVстадия. Регистрируется при образовании метастазов саркомы в регионарных лимфоузлах или любых других органах тела.

Симптомы саркомы мягких тканей
К типичным локализациям новообразования относят нижние конечности и висцеральные органы (по 26%), в 23% случаев опухоли располагаются ретроперитонеально или интраабдоминально. Около 12% СМТ расположены на верхних конечностях, 8% – на грудной клетке, не более 5% – в области головы и шеи. Клиническая картина сарком мягких тканей разнообразна, определяется их размерами, локализацией, стадией болезни и степенью злокачественности клеток.
При локализации опухоли в поверхностных мягких тканях пациенты самостоятельно обнаруживают новообразование, которое постепенно разрастается, приобретает плотную структуру. Некоторые больные ошибочно принимают симптомы за признак травмы и не обращаются к врачу. Позже в пораженном отделе тела возникают боли, онемение, покалывание. При крупных образованиях человек испытывает неудобства при ходьбе, ношении одежды.
При длительном существовании новообразования его поверхность изъязвляется, кровоточит, нагнаивается. Опухоль малоподвижна, при ее ощупывании удается определить участки размягчения (распада). В тяжелых случаях пораженная конечность теряет свою функциональность. При саркомах брюшной и грудной полости основным признаком выступают боли, которые имитируют заболевания соответствующих органов.
Осложнения
Саркомы склонны к бурному росту и быстрому метастазированию. При поздней диагностике образования в 100% случаев присутствует поражение близлежащих лимфатических узлов. В отдаленное метастазирование в основном вовлекаются легкие. Независимо от локализации СМТ у больных развивается клинический синдром раковой интоксикации, осложняющийся иммунной недостаточностью, нарушениями функций внутренних органов.
Ведущую проблему при СМТ составляет отложенное начало лечения опухоли, которое сопряжено с худшим прогнозом выживаемости. Несвоевременная диагностика обусловлена как поздней обращаемостью пациентов, так и отсутствием онкологической настороженности у терапевтов и специалистов вторичного звена (гастроэнтерологов, пульмонологов, ортопедов-травматологов).
Диагностика
Обследование при подозрении на саркому мягких тканей требует проведения расширенного комплекса инструментальных и специализированных лабораторных методов. Диагностика выполняется под руководством врача-онколога в специализированном отделении. План исследований различается с учетом локализации новообразования, однако базовая программа при всех видах СМТ включает следующие методы:
- УЗИ мягких тканей. Методика эффективна для обнаружения поверхностно расположенных новообразований в любой части тела. Благодаря неинвазивности и безопасности сонография назначается на первом этапе постановки диагноза пациентам с подозрительными образованиями.
- Рентгеновская визуализация.КТ брюшной полости, легких, головного мозга и других органов определяет висцеральное расположение первичной опухоли или ее метастазов. Широко применяется КТ мягких тканей нижних и верхних конечностей.
- Магнитно-резонансная томография.МРТ более информативна при визуализации мягких тканей и внутренних органов, поэтому рекомендуется в рамках уточняющей диагностики.
- Сцинтиграфия костей. Исследование назначается всем пациентам с подозрением на метастатическое поражение скелета. Результаты сцинтиграфии необходимы для быстрого обнаружения вторичных костных опухолей любой локализации.
- Гистологический анализ. При морфологическом исследовании материала аспирационной биопсии или образца резецированной опухоли определяют ее морфологические характеристики: степень злокачественности, тип мутировавших клеток, наличие иммунологических маркеров.
- Лабораторная диагностика. Для оценки общего состояния здоровья онкологического пациента применяются клинический и биохимический анализы крови, коагулограмма. Обязательно проводят измерение уровня онкомаркеров.
Дифференциальная диагностика
Основные трудности при постановке диагноза возникают при дифференцировке доброкачественных и злокачественных образований мягких тканей. Клинико-инструментальные данные имеют ограниченную ценность, поэтому подтвердить СМТ удается только гистологическим исследованием. Опухоль также необходимо отличать от:

Лечение саркомы мягких тканей
Консервативная терапия
Предоперационная лучевая терапия и химиотерапия используются для уменьшения размеров новообразования, расширения возможностей оперативного вмешательства и уменьшения риска интраоперационного метастазирования. При определении дозы облучения руководствуются международными протоколами с учетом клинической ситуации у конкретного пациента. Единые стратегии лечения пока не разработаны.
Адъювантная химиотерапия используется как ведущий метод лечения распространенных форм саркомы мягких тканей, когда нет возможности провести радикальную операцию. Для повышения эффективности применяются комбинированные режимы AI, GemTax, MAID и другие. В группе пациентов старше 65 лет методом выбора признана монотерапия препаратами антрациклинового ряда.
Хирургическое лечение
Оперативное вмешательство – основной этап радикального лечения поверхностно расположенных сарком. Чаще всего к помощи хирургов прибегают при локализации опухоли на конечностях, где удается ее полностью резецировать с адекватным косметическим результатом. Преимущество отдается органосохраняющим операциям, которые проводятся в 10% случаев. Ампутации и экзартикуляции выполняются при отсутствии менее травматичных альтернатив.
При СМТ по возможности соблюдается принцип радикальности вмешательства, который предполагает одномоментное удаление образования в мышечно-фасциальном футляре. Такой вариант имеет наилучший отдаленный прогноз выживаемости. Пациентам с терминальными стадиями саркомы рекомендованы нерадикальные и паллиативные операции, направленные на улучшение качества жизни.
Экспериментальное лечение
При саркомах мягких тканей применяется таргетная терапия ингибиторами ангиогенеза. Лечение проводится моноклональными антителами, которые угнетают биологическую активность VEGF, уменьшают васкуляризацию опухоли и препятствуют ее инвазивному росту. Анти-VEGF терапия снижает сосудистую проницаемость и внутриопухолевое давление, что делает новообразование более чувствительным к классической химиотерапии.
Прогноз и профилактика
Для контроля состояния здоровья и предупреждения рецидивов пациентам показано динамическое наблюдение после окончания комбинированного лечения. В течение 2-х лет посещения врача планируются каждые 3 месяца, затем переходят на осмотры раз в полгода на протяжении еще 3-х лет. Обследование включает опрос, сдачу комплекса анализов, УЗИ послеоперационного рубца и КТ органов грудной клетки.
Уровень 5-летней выживаемости пациентов с саркомой, выявленной на I стадии, составляет 60%. При запоздалой диагностике показатели успешности терапии снижаются до 10%. Прогностически неблагоприятными признаны размеры СМТ 5 см и более, возраст пациента старше 60 лет, высокая степень злокачественности. Первичная профилактика включает неспецифические меры: отказ от вредных привычек, употребление антиканцерогенных веществ, регулярные чек-апы здоровья.
2. Практические рекомендации по лекарственному лечению сарком мягких тканей/ А.А. Феденко, А.Ю. Бохян, В.А. Горбунова, А.Н. Махсон, В.В. Тепляков// RUSSCO. Версия 2017.
3. Таргетная терапия в лечении сарком мягких тканей/ А.А. Феденко//Практическая онкология. – 2013. – №2.
4. Современные подходы к лечению сарком мягких тканей/ М.Д. Алиев// Практическая онкология. – 2004. – №4.
Саркома Юинга
Саркома Юинга – это злокачественное новообразование, развивающееся из костной ткани. Чаще возникает в подростковом или юношеском возрасте. Поражает плоские и длинные трубчатые кости. Является одной из наиболее агрессивных опухолей, склонна к раннему метастазированию. Проявляется болью, затем – отеком, местной гиперемией и гипертермией, а также локальным расширением венозной сети. На поздних стадиях определяется опухоль, нередко возникает патологический перелом пораженной кости. Лечение комбинированное, включает в себя операцию (при возможности – радикальное удаление новообразования) в сочетании с лучевой терапией, а также пред- и послеоперационной химиотерапией.

Саркома Юинга – злокачественная опухоль костей, характеризующаяся быстрым ростом и ранним появлением метастазов. Обычно развивается у детей, подростков и лиц молодого возраста. Сопровождается болями и местными изменениями мягких тканей (отек, гиперемия, гипертермия). На поздних стадиях опухоль становится заметна при осмотре и пальпации. Лечение осуществляется врачом-онкологом, включает в себя оперативное удаление новообразования, химио- и лучевую терапию.
Саркома Юинга – вторая по частоте злокачественная опухоль костной ткани, возникающая в детском возрасте, составляет от 10 до 15% от общего числа злокачественных новообразований костей. У взрослых старше 30 и детей младше 5 лет встречается редко. Наибольшее количество случаев заболевания приходится на возраст от 10 до 15 лет. Мальчики болеют чаще девочек, европеоиды – чаще представителей негроидной и монголоидной расы.
В отдельных случаях первичное новообразование при этом заболевании возникает в мягких тканях, а не в костях. Такая форма заболевания называется экстраоссальной (внекостной) саркомой Юинга. Кроме того, существуют сходные по характеру и структуре агрессивные злокачественные опухоли, относящиеся к группе так называемых опухолей семейства саркомы Юинга. В эту группу, кроме внекостной и костной саркомы относят ПНЭО (периферические примитивные нейроэктодермальные опухоли). Внекостные формы и ПНЭО в сумме составляют около 15% от всего числа случаев саркомы Юинга.

Причины развития саркомы Юинга в настоящее время точно не установлены. Однако ряд исследователей в сфере современной онкологии считает, что определенную роль в возникновении этого заболевания играет наследственная предрасположенность. Примерно в 40% случаев выявляется связь с предшествующей травмой. Существуют данные, свидетельствующие о повышении вероятности развития болезни у пациентов с некоторыми разновидностями скелетных аномалий (аневризмальной костной кистой, энхондромой и др.), а также нарушениями внутриутробного развития мочеполовой системы (редупликацией почечной системы, гипоспадиями). Какой-либо связи с воздействием ионизирующей радиации не установлено.
Патанатомия
Чаще всего саркома Юинга выявляется в бедренной кости, костях таза, большеберцовой и малоберцовой кости, лопатке, ребрах, плечевой кости и позвонках. При возникновении в длинных трубчатых костях опухоль обычно локализуется в области диафиза, а затем по мере роста распространяется в сторону эпифизов. Более чем в 90% случаев отмечается интрамедуллярное расположение новообразования и тенденция к распространению опухолевых клеток по костномозговому каналу.
Саркома Юинга наиболее часто метастазирует в легкие. На втором месте по распространенности – метастазы в костный мозг и костную ткань. На поздних стадиях практически у всех больных определяются метастазы в центральную нервную систему. В редких случаях выявляются отдаленные метастазы в плевру, лимфатические узлы средостения, внутренние органы и забрюшинное пространство. Из-за раннего метастазирования к моменту постановки диагноза от 15 до 50% пациентов уже имеют метастазы, которые можно выявить при помощи рутинных исследований. У подавляющего количества больных есть микрометастазы.
Симптомы саркомы Юинга
Первым, самым ранним признаком заболевания становится боль в области поражения. Вначале она слабая или умеренная, самопроизвольно ослабевает или исчезает, а затем появляется снова. В отличие от болей при воспалительных процессах такая боль не ослабевает в покое, по ночам или при фиксации конечности. Напротив, для саркомы Юинга характерно усиление болей в ночное время.
По мере прогрессирования боли становятся более интенсивными, лишают сна и ограничивают повседневную активность. В близлежащем суставе развивается болевая контрактура. Пальпация области поражения болезненна. Температура кожи над ней повышена. Отмечается пастозность мягких тканей, местная гиперемия и расширение подкожных вен. Опухоль быстро увеличивается и (обычно спустя несколько месяцев после возникновения первых симптомов) становится настолько крупной, что ее можно прощупать. На поздних стадиях в области новообразования нередко возникает патологический перелом.
Местные клинические признаки сочетаются с нарастающими симптомами общей опухолевой интоксикации. Больные предъявляют жалобы на слабость и потерю аппетита. Отмечается снижение веса вплоть до истощения. Температура тела повышена до субфебрильных или даже фебрильных цифр. Определяется регионарный лимфаденит. По анализам крови выявляется анемия.
Некоторые симптомы зависят от локализации новообразования. Так, при возникновении саркомы Юинга на костях нижних конечностей появляется хромота. При поражении позвонков возможно развитие компрессионно-ишемической миелопатии с нарушением функции тазовых органов и явлениями параплегии. При новообразованиях в области костей грудной клетки может возникнуть дыхательная недостаточность, плевральный выпот и кровохарканье.
Как правило, на начальном этапе пациенты обращаются к врачам-травматологам. И первым исследованием, позволяющим заподозрить саркому Юинга, становится рентгенография пораженной кости. Для данного патологического процесса характерно сочетание реактивного и деструктивного процессов костеобразования. Контуры кортикального слоя нечеткие, определяется расслоение и разволокнение кортикальной пластинки.
При вовлечении в процесс надкостницы на рентгенограмме выявляются мелкие пластинчатые или игольчатые образования. Кроме того, на снимках видна область изменения мягких тканей, по своему размеру превышающая первичную костную опухоль. При этом мягкотканный опухолевый компонент отличается однородностью, хрящевые включение, очаги обызвествления или патологического костеобразования отсутствуют.
При выявлении типичных рентгенологических признаков саркомы Юинга больного направляют в отделение онкологии, где проводится расширенное обследование для оценки состояния первичного очага и выявления метастазов. В ходе такого обследования выполняется компьютерная томография или магнитно-резонансная томография костей и мягких тканей, пораженных злокачественным процессом. Данные исследования позволяют точно определить размер новообразования, степень его распространения по костно-мозговому каналу, связь с сосудисто-нервным пучком и окружающими тканями.
Для выявления метастазов в легочную ткань применяется компьютерная томография и рентгенография легких. Для обнаружения метастазов в костях, костном мозге и внутренних органах – позитронно-эмиссионная томография, УЗИ и остеосцинтиграфия. Кроме того, выполняется ряд исследований для точной оценки характера новообразования.
Производится биопсия, при этом материал берут из участка костной ткани рядом с костномозговым каналом, либо, если это невозможно – из мягкотканого компонента опухоли. Поскольку для саркомы Юинга характерно местное и отдаленное поражение костного мозга, выполняется билатеральная трепанобиопсия, в ходе которой производится забор костного мозга из крыльев подвздошной кости. Для оценки характера процесса также может проводиться иммуногистохимическое исследование и молекулярно-генетические исследования (флуоресцентная гибридизация – для подтверждения диагноза, полимеразная цепная реакция – для выявления микрометастазов).

КТ ОГК. Патоморфологически подтвержденная саркома Юинга 10-го ребра слева. Кортикальная пластинка ребра с внутренней стороны неравномерно утолщена (красная стрелка). Определяется массивное мягкотканное образование грудной стенки (зеленая стрелка).
Лечение саркомы Юинга
Поскольку данная опухоль относится к категории высокоагрессивных неоплазий, рано дающих метастазы, ее лечение должно включать в себя воздействие на весь организм, а не только на первичный очаг, даже в тех случаях, когда метастазы не были обнаружены. Дело в том, что существует очень высокая вероятность раннего появления микрометастазов, которые на момент постановки диагноза невозможно выявить при помощи существующих методов. Лечение саркомы Юинга комбинированное, включает в себя как консервативную терапию, так и хирургические вмешательства и состоит из следующих компонентов:
- Пред- и послеоперационная химиотерапия, как правило – с использованием нескольких препаратов (доксорубицин, винкристин, циклофосфан, ифосфамид, этопозид и актиномицин в различных комбинациях). После курса лечения оценивается ответ опухоли на терапию. Хорошим результатом считается наличие не более 5% живых клеток опухоли.
- Лучевая терапия с использованием высоких доз. Проводится на первичный очаг, а, при наличии метастазов в легочную ткань – и на легкие.
- Хирургическая операция. Если это возможно, опухоль удаляют радикально, вместе с мягкотканым компонентом. При этом удаленный участок кости заменяют эндопротезом. Но даже если в силу места расположения и размера новообразования удалить его полностью не представляется возможным, оперативное лечение (частичная резекция) позволяет улучшить контроль над опухолью и повысить шансы на благополучный исход.
В прошлом при саркоме Юинга обычно проводились калечащие операции – ампутации и экзартикуляции. Современные техники позволяют выполнять органосохраняющие оперативные вмешательства не только на мелких (малоберцовой, лучевой, локтевой, лопатке, ключице и ребрах), но и на крупных костях (плечевой, бедренной и даже костях таза). При метастазировании в костный мозг и кости назначается интенсивная терапия, включающая в себя тотальное облучение всего тела, химиотерапию с использованием мегадоз препаратов и трансплантацию периферических стволовых клеток или костного мозга.
Своевременное комбинированное лечение обеспечивает 70% общую выживаемость пациентов с локализованной саркомой Юинга. При наличии метастазов в кости и костный мозг прогноз существенно ухудшается, однако сочетание высокодозной химиотерапии, тотальной лучевой терапии и трансплантации костного мозга дает возможность повысить выживаемость больных с метастатической формой заболевания с 10% до 30% и более.
Все пациенты после излечения должны проходить регулярное обследование для раннего выявления рецидивов и контроля над побочными эффектами. Следует учитывать, что ряд побочных эффектов может возникать не только при прохождении курса лечения, но и спустя длительное время после его окончания. К числу таких эффектов относится мужское и женское бесплодие, кардиомиопатия, нарушение роста костей и увеличение вероятности развития вторичных злокачественных новообразований. Однако многие пациенты, прошедшие лечение по поводу саркомы Юинга могут жить полноценной жизнью. Профилактика не разработана.
3. Саркома Юинга / Шалыга И.Ф., Ачинович С.Л., Козловская Т.В., Мартемьянова Л.А., Турченко С.Ю., Авижец Ю.Н. // Проблемы здоровья и экологии - 2018 - №1
Саркома Капоши
Саркома Капоши (множественная геморрагическая идеопатическая саркома Капоши, ангиосаркома Капоши, ангиоэндотелиома кожи) — множественные злокачественные поражения дермы, развивающиеся из эндотелия проходящих в ней лимфатических и кровеносных сосудов. Зачастую заболевание сопровождается поражением слизистой рта и лимфатических узлов. Проявляется саркома Капоши множественными синюшно-красноватыми пятнами на коже, трансформирующимися в опухолевые узлы до 5 см в диаметре. Диагностика саркомы Капоши включает гистологию биопсийного образца из очага поражения, исследование иммунитета и анализ крови на ВИЧ. Лечение проводится путем системного и местного применения химиопрепаратов и интерферонов, лучевым воздействием на опухолевые узлы, криотерапией.

Саркома Капоши получила свое название по имени венгерского дерматолога, впервые описавшего заболевание в 1872 году. Распространенность саркомы Капоши не так велика, но среди больных ВИЧ она достигает 40-60%. У этих пациентов саркома Капоши является самой часто встречающейся злокачественной опухолью. По данным проводимых в дерматологии клинических исследований у мужчин саркома Капоши диагностируется примерно в 8 раз чаще, чем у женщин.
К группам риска, в которых развитие саркомы Капоши наиболее вероятно, относятся: инфицированные ВИЧ мужчины, мужчины средиземноморского происхождения в пожилом возрасте, народности Центральной Африки, реципиенты пересаженных органов или пациенты, длительно получающие иммуносупрессивную терапию.
Причины саркомы Капоши
Медицине пока неизвестны точные причины развития саркомы Капоши и ее патогенез. Заболевание нередко возникает на фоне других злокачественных процессов: грибовидного микоза, болезни Ходжкина, лимфосаркомы, миеломной болезни. Исследования последних лет подтверждают связь заболевания с присутствием в организме специфических антител, образующихся при инфицированности вирусом герпеса 8 типа. Заражение вирусом может произойти половым путем, через кровь или слюну.
На сегодняшний день ученым удалось выделить цитокины, оказывающие стимулирующее действие на клеточные структуры саркомы Капоши. К ним относят: 3FGF — фактор роста фибробластов, IL-6 — интерлейкин 6, TGFp — трансформирующий фактор роста. В возникновении опухоли у больных СПИДом большое значение отводят онкостатину.
Саркома Капоши является не совсем обычной злокачественной опухолью. Слабая митотическая активность, зависимость процесса от иммунного статуса пациента, мультицентрическое развитие, возможность обратного развития очагов опухоли, отсутствие клеточной атипии и гистологическое выявление признаков воспаления подтверждают предположение о том, что в начале своего возникновения саркома Капоши скорее представляет собой реактивный процесс, нежели истинную саркому.
Симптомы саркомы Капоши
Наиболее часто заболевание начинается с появления на коже фиолетово-синих пятен, которые инфильтрируются с образованием округлых дисков или узлов. В отдельных случаях саркома Капоши начинается с возникновения на коже папул, что имеет сходство с высыпаниями красного плоского лишая. Узлы постепенно растут, достигая величины лесного или грецкого ореха. Они имеют плотно-эластичную консистенцию и шелушащуюся поверхность, часто пронизанную сосудистыми звездочками. Узлы причиняют пациенту боль, усиливающуюся при давлении на них. Со временем при саркоме Капоши возможно самопроизвольное рассасывание узлов с образованием рубцов в виде вдавленных гиперпигментаций.
Выделяют 4 клинических варианта саркомы Капоши: классический, эпидемический, эндемический и иммунно-супрессивный.
Классическая саркома Капоши распространена в России, Украине, Белоруссии и странах Центральной Европы. Ее типичная локализация — кожа боковой поверхности голеней, стоп и кистей. Характерна четкая очерченность и симметричность опухолевых очагов, отсутствие субъективной симптоматики (лишь в некоторых случаях пациенты отмечают жжение или зуд). Данная форма саркомы крайне редко протекает с поражением слизистых. В течении классической саркомы Капоши выделяют 3 клинический стадии: пятнистую, папулезную и опухолевую.
Пятнистая стадия — самое начало заболевания. Представлена красно-синюшними или красно-бурыми пятнами неровной формы, размер которых не превышает 0,5 см. Пятна имеют гладкую поверхность.
Папулезная стадия саркомы Капоши имеет вид множественных элементов, выступающих над уровнем кожи в виде сфер или полусфер. Они плотные, эластичные, диаметр колеблется от 0,2 до 1 см. Сливаясь между собой, элементы могут образовывать полушаровидные или уплощенные бляшки с шероховатой или гладкой поверхностью. Но чаще отдельные элементы саркомы Капоши этой стадии остаются изолированными.
Опухолевая стадия характеризуется образованием опухолевых узлов диаметром от 1 до 5 см. Узлы, как и элементы пятнистой стадии, имеют синюшно-красный или красновато-бурый оттенок. Они сливаются друг с другом и изъязвляются.
Эпидемическая саркома Капоши ассоциирована со СПИДом и является одним из характерных симптомов этого заболевания. Типичен молодой возраст заболевших (до 37 лет), яркость высыпных элементов и необычное расположение опухолей: слизистые, кончик носа, верхние конечности и твердое небо. При этой форме саркомы Капоши происходит быстрое вовлечение в процесс лимфатических узлов и внутренних органов.
Эндемическая саркома Капоши встречается, как правило, в Центральной Африке. Заболевание развивается в детском возрасте, чаще на первом году жизни. Характеризуется поражением внутренних органов и лимфатических узлов, изменения кожи минимальны и редки.
Иммунно-супрессивная саркома Капоши протекает хронически и наиболее доброкачественно, как правило, без вовлечения внутренних органов. Возникает на фоне проводимого иммунносупрессивного лечения у пациентов, перенесших пересадку органов. При отмене подавляющих иммунитет препаратов часто происходит регресс симптомов заболевания.
К осложнениям саркомы Капоши относятся деформация и ограничение движений в пораженных конечностях, кровотечения из распадающихся опухолей, лимфостаз с развитием лимфедемы при сдавлении опухолью лимфатических сосудов и др. Изъязвление опухолевых узлов опасно возможностью инфицирования, что на фоне иммунодефицита приводит к быстрому развитию сепсиса и может явиться причиной летального исхода.
Диагностика саркомы Капоши
Диагностика саркомы Капоши основана на ее типичных клинических проявлениях и данных биопсии образований. Гистологическое исследование выявляет в дерме множественные новообразованные сосуды и пролиферацию веретенообразных клеток — молодых фибробластов. Наличие гемосидерина и экстравазатов (геморрагических экссудатов) позволяет отличить саркому Капоши от фибросаркомы.
Пациентам проводят иммуннологические исследования крови и анализ на ВИЧ. Для выявления поражений внутренних органов при саркоме Капоши применяют УЗИ брюшной полости и сердца, гастроскопию, рентгенографию легких, сцинтиграфию скелета, КТ почек, МРТ надпочечников и т. п.
Необходима дифференциальная диагностика саркомы Капоши с красным плоским лишаем, саркоидозом, гемосидерозом, грибовидным микозом, высокодифференцированной ангиосаркомой, микровенулярной гемангиомой и др.
Лечение саркомы Капоши
Важным моментом в лечении саркомы Капоши является терапия основного заболевания для повышения иммунного статуса организма. Системное лечение саркомы Капоши обычно назначается пациентам с благоприятным иммунологическим фоном при бессимптомном течении болезни. Оно состоит в интенсивной полихимиотерапии. Риск применения подобной терапии у пациентов с иммуннодефицитом связан с токсическим воздействием препаратов на костный мозг, особенно в сочетании с медикаментами для лечения ВИЧ-инфекции. На 1 и 2 стадии саркомы Капоши наиболее оптимальной считается однокомпонентная химиотерапия проспидием хлоридом, который отличается отсутствием угнетающего действия на иммунную систему и кроветворение. В лечении классической и эпидемической формы саркомы Капоши успешно применяются интерфероны: α-2a, α-2b и β. Они препятствуют пролиферации фибробластов и способны инициировать апоптоз опухолевых клеток.
Местное лечение саркомы Капоши включает криотерапию, инъекции химиотерапевтических препаратов и интерферона в опухоль, аппликации динитрохлорбензола и мази проспидия хлорида, др. методы. При наличие болезненных и крупных очагов поражения, а также для лучшего косметического эффекта проводится локальное облучение.
Прогноз саркомы Капоши
Прогноз заболевания при саркоме Капоши зависит от характера его течения и тесно связан с состоянием иммунной системы пациента. При более высоких показателях иммунитета проявления заболевания могут носить обратимый характер, системное лечение дает хороший эффект и позволяет добиться ремиссии у 50-70% больных. Так у больных саркомой Капоши с показателем лимфоцитов CD4 больше 400 мкл-1 частота ремиссий на фоне проводимой иммунной терапии превышает 45%, а при CD4 меньше 200 мкл-1 добиться ремиссии удается лишь 7% пациентов.
Группа опухолей типа Юинга включает ряд опухолей очень близких подтипов, таких как саркома Юинга, атипичная саркома Юинга и злокачественные периферические нейроэктодермальные опухоли (PNET или MPNET). Опухоли Юинга являются вторыми по частоте злокачественными опухолями костей у детей и подростков. Повышенная заболеваемость отмечается между 10 и 15 годами. Самая частая локализация - таз, затем диафизы длинных трубчатых костей – бедренной, большеберцовой и малоберцовой. Около 20% пациентов в момент постановки диагноза уже имеют отдалённые метастазы.
Категория пациентов: дети до 15 лет с верифицированным диагнозом и/или с клиническими проявлениями заболевания.

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 800 RUB / 4500 KZT / 27 BYN - 1 рабочее место в месяц

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место - 800 RUB / 4500 KZT / 27 BYN в месяц
Мне интересно! Свяжитесь со мной
13-15 октября, Алматы, "Атакент"
600 брендов, более 150 компаний-участников из 20 стран.
Новинки рынка стоматологии. Цены от производителей
Факторы и группы риска
Диагностические критерии: наличие клинических симптомов заболевания, данных инструментальных методов исследования и морфологическое подтверждение заболевания.
Около 30% случаев у больных с саркомами Юинга в момент диагностики имеются метастазы в легких, костях, костном мозге, плевре.
Рентгенологические признаки саркомы Юинга:
- деструкция костной ткани;
- распространение опухоли в мягкие ткани;
- реактивное образование костной ткани;
- периостальная реакция - типа «луковичного периостита»;
- участки просветления в виде «солнечных» лучей;
- утолщение периоста;
- склероз;
- переломы.
Жалобы, сбор анамнеза, общий осмотр: локальная боль, локальный отек и припухлость, лихорадка, параплегии. В анамнезе предшествует травма.
Физикальные обследования: сбор анамнеза, общий осмотр, определение местного распространения и окружности опухоли.
Рентгенографическое исследование органов грудной клетки в 2-х проекциях для исключения МТС поражения легких.
Необходимый объём исследований перед плановой госпитализацией: ОАК, Б/х крови, рентгенография или КТ пораженной кости и грудной клетки.
3. Преимущественно проведение открытой инцизионной биопсии для гистологического подтверждении опухоли.
4. КТ лучше использовать для оценки кортикальных костных поражений, а МРТ для оценки поражения костного мозга и мягких тканей, а также, вовлечения сосудов и нервов.
Биопсия для окончательной постановке диагноза является обязательной и планируется как открытая инцизионная биопсия для получения достаточного и репрезентативного тканевого материала с последующими гарантированными гистологическими исследованиями. При планировании биопсии должно учитываться, что канал биопсии, как и рубец, считаются контаминированными и позже, при проведении локальной терапии должны быть резецированы или облучены.
КТ или МРТ первичной опухоли и пораженных костей скелета. КТ лучше использовать для оценки кортикальных костных поражений, а МРТ для оценки
Пункционная или трепанбиопсия для цитологической и гистологической верификации опухоли. Преимущественно проведение открытой инцизионной биопсии для гистологического подтверждении опухоли (±ИГХ).
Лабораторная диагностика
Лабораторные исследования:
- общий анализ крови;
- общий анализ мочи;
- биохимический анализ крови (общий белок, билирубин, мочевина, глюкоза, тимоловая проба, креатинин, мочевина, щелочная фосфатаза, ЛДГ, печеночные ферменты).
Дифференциальный диагноз
Дифференциальный диагноз:
- острый гематогенный остеомиелит;
- остеосаркома;
- метастатические (вторичные) поражения костей;
- другие костные опухоли;
- туберкулёз костей.
Лечение
Цели лечения: целью любой стандартизованной терапии должна быть гарантия достаточного локального и системного контроля.
Неоадъювантная химиотерапия 2-4 цикла с 3-х нед. перерывами, если опухоль изначально нерезектабельная ± Неоадъювантная лучевая терапия Оперативное лечение - полное удаление опухоли, если операция не вызовет значительного нарушения функции или удаление основной массы опухоли, когда полное удаление опухоли приведет к значительному функциональному нарушению адъювантная химиотерапия - 6-8 циклов с 3-х нед. перерывами ± лучевая терапия.
Лечение саркомы Юинга включает мультимодальный подход с применением операции и облучения для контроля над первичной опухолью и химиотерапии для борьбы с субклиническими микрометастазами. При планировании терапии учитываются необходимость сохранения функции конечности и возможные отдаленные последствия лечения.
Оперативное лечение: используется в случаях, когда удаление пораженной кости не приведет к значительному функциональному дефекту и когда технически возможна расширенная резекция опухоли.
Начальным этапом лечения возможна операция при резектабельных опухолях:
Саркома Юинга – чувствительная к облучению опухоль. Местный контроль над опухолью у большинства больных может быть достигнут с помощью применения достаточных доз облучения и включения в поля облучения адекватного объёма окружающей нормальной ткани. Рекомендуемая доза для облучения первичных опухолей составляют 55-60 гр.
Саркома Юинга составляет 10-15% первичных злокачественных опухолей скелета. Опухоль характеризуется быстрым ростом и ранним метастазированием. Заболевание у детей протекает более злокачественно, чем у взрослых.
В настоящее время общепринятым считается комплексное или комбинированное лечение детей с саркомой Юинга с обязательным включением в программу оперативного вмешательства наряду с химиолучевыми методами лечения. Длительность лечения саркомы Юинга составляет от 18 до 24 месяцев.
I этап: неоадъювантная (индукционная) химиотерапия- 4 курса полихимиотерапии с 3-х недельным интервалом между курсами по схеме VАСР:
II этап: проведение лучевой терапии в СОД-50-60 гр., с желательным проведением 4-х курсов полихимиотерапии на фоне ЛТ, по схеме:
III этап: для операбельных опухолей (при локализации опухоли в области малоберцовой кости, ребра, ключицы и т.д.) - оперативное удаление опухоли (с оценкой степени терапевтического патоморфоза).
IV этап: полихимиотерапия по схеме VАСР - 4-5 курсов с 4-х недельными интервалами между курсами. При достижении предельно допустимой дозы адриамицина (500 мг/м 2 ) применяют еще 3-4 курса ПХТ с интервалом между курсами 4-5 недель по схеме СА VM:
При локализации саркомы Юинга в области длинных трубчатых костей на первом этапе комплексного лечения проводится 4 курса полихимиотерапии по следующей схеме:
При неэффективности вышеуказанных программ полихимиотерапии возможно использование следующих альтернативных курсов полихимиотерапии с 3-х нед. перерывами до 6 циклов по схемам:
При появлении на фоне лечения метастазов проводится 3-5 альтернирующих курсов полихимиотерапии с интервалом между курсами 3 недели по схеме:
Для усиления эффективности лечения и с целью достижения операбельности метастазов после окончания полихимиотерапии возможно присоединение лучевой терапии в СОД-30 гр.
При стабилизации процесса в легких планируется проведение оперативного лечения в различных объемах. При патоморфозе I-II степени (в метастазе) назначают препараты интерферон-альфа в течение 1 года в возрастных дозировках. При патоморфозе III-IV степени - продолжение химиотерапии по схемам идентичным предоперационным. В зависимости от переносимости полихимиотерапии возможно назначение 3-4-х курсов препараты интерферон-альфа в возрастных дозировках для консолидации полученного эффекта При отсутствии эффекта от лечения назначается лучевая терапия с паллиативной целью.
В случае дальнейшей диссеминации процесса используют альтернирующие схемы с интервалами между ними 3 недели:
Этап консолидации: в зависимости от стадии, объёма опухоли, наличия радикальной операции и степени лечебного патоморфоза проводится различные схемы ХТ.
При локализованных операбельных СЮ, объёмом не более 200 см 3 и хорошим лечебным патоморфозом (не более 5% живых опухолевых клетко) проводится 8 курсов ХТ по схеме:
При локализованных неоперабельных, с плохим лечебным патоморфозом (более 5% живых опухолевых клетко) и при метастатическом поражении только легких проводится 8 курсов VAI или 1 курс и далее высокодозной ПХТ по схеме: бусульфан+мелфалан.
При метастатических СЮ - внелегочные или комбинированные метастазы - проводится высокодозная ПХТ: бусульфан+мелфалан.
Лечение СЮ по протоколу REN-3, в рамках кооперированной итальянской группой по изучению сарком ISG с 1997г.
- циклофосфамид - 1200 мг/м 2 – в 1 день на 1, 4, 7, 10,13, 16, 19, 22, 25, 28, 31, 34, 37, 40-й неделях;
- дактиномицин - 0,5 мг/м 2 – 4-х часовая инфузия - 1-3 дни на 4, 10, 16, 22, 28, 34, и 40-й неделях.
Профилактические мероприятия
Онкопедиатрическая настороженность врачей общей лечебной сети, педиатров, детских хирургов. Профилактика послеоперационных, цитотоксических, постлучевых осложнении – сопроводительная терапия (антибактериальная, антиэметогенная, колоностимулирующая, дезинтоксикационная и т.д.).
Индикаторы эффективности лечения и безопасности методов диагностики и лечения, описанных в протоколе:
Критериями эффективности лечения является регрессия основного очага, наличие или отсутствие метастазов в других органах.
Госпитализация
Показания для госпитализации: плановая.
Наличие клинических проявлений заболевания, верификация диагноза, направительная выписка с предварительными данными исследования.
Информация
Источники и литература
- Периодические протоколы диагностики и лечения злокачественных новообразований у детей МЗ РК (Приказ №883 от 25.12.2012)
- 1. Руководство по детской онкологии. Москва, 2003. Л.А. Дурнов. 2. Справочник по химиотерапии злокачественных новообразований у детей. Душанбе, 2001, Л.А. Дурнов, Д.З. Зикиряходжаев. 3. Противоопухолевая химиотерапия. Справочник под редакцией Н.И. Переводчиковой. 4. Детская онкология. Москва, 2002. Л.А. Дурнов, Г.В. Голдобенко. 5. Pediatric oncology. New York, 1981. Konrad P.N., Ertl J.E. 6. Лучевая терапия в детской онкологии. 1999. Эдвард К.Гальперин 7. Детская онкология. Санкт-Петербург, 2002. М.Б.Белогурова. 8. Руководство по химиотерапии опухолевых заболеваний, под редакцией Н.И.Переводчиковой, 2011. 9. Стандарты оказания специализированной помощи детям и подросткам с гематологическими и онкологическими заболеваниями у детей и подростков. Медпрактика-М, Москва, 2009.
Информация
Процент вновь выявленных пациентов со злокачественным новообразованием костной ткани, получающих начальное лечение в течение двух месяцев после начала заболевания = (Количество пациентов, с установленным диагнозом саркомы Юинга, получающих начальное лечение в течение двух месяцев после начала заболевания/Все пациенты с впервые установленным диагнозом саркомы Юинга) х 100%.
Процент онкологических больных, получающих химиотерапию в течение двух месяцев после проведения оперативного лечения = (Количество онкологических больных, получающих химиотерапию в течение двух месяцев после проведения оперативного лечения/Количество всех больных саркомой Юинга после проведения оперативного лечения, которым требуется проведение химиотерапии) х 100%.
Процент рецидивов саркомы Юинга у пациентов в течение двух лет = (Все пациенты с рецидивами саркомы Юинга в течение двух лет/Все прооперированные пациенты с диагнозом саркомы Юинга) х 100%.
Рецензенты:
Кожахметов Б.Ш. – зав.каф.онкологии Алматинского государственного института усовершенствования врачей, д.м.н., проф.
Абисатов Г.Х. – зав.каф.онкологии, маммологии Казахстанско-Российского медицинского университета, д.м.н., проф.
Указания условий пересмотра протокола: через 3 года или по мере внедрения новых методов с уровнем доказательности.Читайте также:
