Строение и функции интегринов
Добавил пользователь Morpheus Обновлено: 28.01.2026
Видео: Интегрины: характеристики, структура и функции
Содержание:
В интегрины они представляют собой большую группу или семейство белков клеточной поверхности, очевидно, уникальных для животного мира. Они являются основным ресурсом клеток для поддержания взаимодействия (в форме адгезии) с другими клетками и с клеточным матриксом.
Его структура состоит из двух субъединиц, называемых альфа и бета. Известно, что у млекопитающих существует от 16 до 18 альфа-единиц и от 3 до 8 бета, которые действуют в зависимости от их комбинации, а также от физиологического состояния конкретной клетки или ткани.
Есть несколько белков, которые выполняют адгезивные функции. Однако группа интегринов является наиболее распределенной и взаимодействует со всеми ключевыми белками клеточного матрикса. Интегрины участвуют в фагоцитозе, миграции клеток и заживлении ран и даже хорошо изучены на предмет их участия в метастазировании.
характеристики
Это белки, которые характеризуются механическим соединением клеточного цитоскелета одной клетки с другой и / или с внеклеточным матриксом (во взаимодействии клетка-клетка и / или клетка-матрица). Биохимически они определяют, произошла ли адгезия, и передают клеточные сигналы, связывающие внеклеточную среду с внутриклеточной в обоих направлениях.
Они работают или функционируют с другими рецепторами, такими как иммуноглобиллины, кадгерин, селектины и синдеканды. Что касается лигандов интегринов, они, среди прочих, состоят из фибронектина, фибриногена, коллагена и витронектина.
Их объединение с лигандами происходит за счет внеклеточных двухвалентных катионов, таких как кальций или магний. Использование того или другого будет зависеть от конкретного интегрина.
Интегрины имеют удлиненную форму, оканчивающуюся головкой в форме шара, которая, согласно наблюдениям электронной микроскопии, выступает из липидного бислоя более чем на 20 нанометров.
Состав
Интегрины - гетеродимеры, то есть молекулы, всегда состоящие из двух белков. Оба белка считаются субъединицами или протомерами и дифференцируются как альфа-субъединицы и бета-субъединицы. Обе субъединицы связаны нековалентно. Они имеют молекулярную массу от 90 до 160 кДа.
Количество альфа- и бета-субъединиц варьируется между различными группами организмов в животном мире. У таких насекомых, как плодовая муха (Дрозофила), например, имеется 5 альфа и 2 бета субъединиц, тогда как у нематодных червей рода Caenorhabditis есть 2 альфы и одна бета.
Исследователи предполагают, что у млекопитающих существует фиксированное количество субъединиц и их комбинаций; однако в литературе нет единого мнения относительно этого числа. Например, некоторые упоминают, что существует 18 альфа-субъединиц, 8 бета и 24 комбинации, в то время как другие говорят о 16 альфа и 8 бета для 22 комбинаций.
Каждая субъединица имеет следующую структуру.
Альфа-субъединица
Альфа-субъединица представляет собой структуру с доменом β-спирали из семи листов или листов, которые образуют голову, доменом бедра, двумя доменами теленка, одним трансмембранным доменом, а также коротким цитоплазматическим хвостом, который не представляет собой ферментативный или связывание с актином.
В нем представлены цепи примерно с 1000 до 1200 остатков. Он может связывать двухвалентные катионы.
У млекопитающих, интегрины которых были изучены больше всего, альфа-субъединицы можно сгруппировать в зависимости от того, содержат ли они встроенный домен (альфа I).
Со вставленным доменом Alpha I
Домен с вставкой альфа I состоит из области из 200 аминокислот. Присутствие этого домена в интегринах указывает на то, что они являются рецепторами коллагена и лейкоцитов.
Домен не вставлен
Альфа-интегрины, не имеющие интегрированного домена, подразделяются на 4 подсемейства, которые мы увидим ниже.
PS1
Рецепторы гликопротеинов, также называемые ламининами, жизненно важны для интеграции тканей мышц, почек и кожи.
PS2
Это подсемейство является рецептором аргинилглициласпарагиновой кислоты, также известной как RGD или Arg-Gly-Asp.
PS3
Это подсемейство наблюдалось у беспозвоночных, особенно у насекомых. Хотя о нем мало что известно, существуют исследования, оценивающие его важную роль в функциональной активности гена интегрина лейкоцитов CD11d у людей.
PS4
Это подсемейство известно как группа альфа 4 / альфа 9 и включает субъединицы с такими же названиями.
Эти субъединицы способны спариваться с субъединицами бета 1 и бета 7. Кроме того, они имеют общие лиганды, очень похожие на альфа-субъединицы, которые представляют вставленный домен альфа I, такие как молекулы адгезии сосудистых клеток, растворимые в крови лиганды, фибриноген и другие. включая даже патогены.
Бета-субъединица
Структурно бета-субъединица состоит из головки, секции, называемой ножкой / ножкой, трансмембранного домена и цитоплазматического хвоста. Головка состоит из домена бета I, который вставляется в гибридный домен, который связывается с доменом плексин-семафор-интегрин, также известным как PSI.
Секция стебля / ножки содержит четыре модуля, одинаковых или очень похожих на богатый цистеином интегрин эпидермального фактора роста и, как уже упоминалось, цитоплазматический хвост. Этот цитоплазматический хвост, как и альфа-субъединица, не обладает ферментативной или актин-связывающей активностью.
Они представляют собой цепи с числом остатков, колеблющимся между 760 и 790, и они могут связывать, как альфа-субъединицы, двухвалентные катионы.
Интегрины имеют несколько функций, однако в основном они известны тем, что мы увидим ниже.
Прикрепление или сцепление клетки с внеклеточным матриксом
Связь, которая существует между клеткой и внеклеточным матриксом благодаря интегринам, способствует устойчивости клетки к механическому давлению, предотвращая их отрыв от матрицы.
Некоторые исследования предполагают, что соединение с клеточным матриксом является основным требованием для развития многоклеточных эукариотических организмов.
Миграция клеток - это процесс, в который интегрины вмешиваются путем связывания или связывания с различными субстратами. Благодаря этому они вмешиваются в иммунный ответ и заживление ран.
Передача сигнала от внеклеточного матрикса к клетке
Интегрины участвуют в процессе передачи сигнала. Это означает, что они вмешиваются в получение информации из внеклеточной жидкости, они ее кодируют, а затем в качестве реакции начинается изменение внутриклеточных молекул.
Эта сигнальная трансдукция участвует в большом количестве физиологических процессов, таких как запрограммированное разрушение клеток, дифференциация клеток, мейоз и митоз (деление клеток), а также рост клеток, среди прочего.
Интегрины и рак
Несколько исследований показывают, что интегрины играют важную роль в развитии опухолей, особенно в метастазировании и ангиогенезе. Примером этого являются, среди прочего, интегрины αVβ3 и α1β1.
Эти интегрины связаны с раком, повышенной терапевтической резистентностью и гематопоэтическими новообразованиями.
Эволюционная перспектива
Эффективная адгезия между клетками для образования тканей была, без сомнения, важнейшей характеристикой, которая должна была присутствовать в эволюционном развитии многоклеточных организмов.
Возникновение семейства интегринов восходит к появлению многоклеточных животных около 600 миллионов лет назад.
Группа животных с гистологическими характеристиками предков - это пористые, обычно называемые морскими губками. У этих животных клеточная адгезия происходит за счет внеклеточного протеогликанового матрикса. Рецепторы, которые связываются с этой матрицей, имеют типичный интегрин-связывающий мотив.
Фактически, в этой группе животных были идентифицированы гены, относящиеся к определенным субъединицам некоторых интегринов.
В ходе эволюции предок многоклеточных животных приобрел интегрин и интегрин-связывающий домен, который со временем сохранялся у этой огромной группы животных.
В структурном отношении максимальная сложность интегринов наблюдается в группе позвоночных. Существуют различные интегрины, которых нет у беспозвоночных, с новыми доменами. Действительно, у людей было идентифицировано более 24 различных функциональных интегринов, а у плодовых мушек Drosophila melanogaster их всего 5.
Строение и функции интегринов
Значение интегринов и других компонентов внеклеточного матрикса
• Методом гомологичной рекомбинации на мышах проведены эксперименты по изучению последствий нокаута генов, кодирующих более 40 различных белков внеклеточного матрикса и 21 гена интегринов. Нокаут одних генов привел к летальным последствиям, в то время как инактивация других лишь в слабой степени отразилась на фенотипе
• Адресная инактивация гена β1-интегрина показала, что он играет критическую роль в структуре кожи и в развитии эритроцитов
Многие сведения о белках клеточной адгезии и их внеклеточных лигандах получены в экспериментах in vitro, с использованием клеточных культур, изолированных белков, и в условиях, сильно отличающихся от нормального физиологического состояния организма. При таком упрощенном подходе белок часто обладает такими функциями, которые не проявляются в более сложных системах. Поэтому конечная цель состоит в том, чтобы выяснить, как функционируют эти белки в нормальном, здоровом организме.
Для того чтобы понять, каковы функции внеклеточного матрикса и межклеточных контактов в здоровом организме, применялись два общих подхода. Один из них состоит в использовании таких модельных организмов (например, плодовых мушек и червей), цикл развития которых хорошо известен и которые удобны для генетических экспериментов. При обработке этих организмов мутагенами в их клетках образуются различные мутации. Используя организмы с мутантным фенотипом (т. е. организмы с нарушениями развития), был идентифицирован мутировавший ген (или гены).
Еще один, более прямой подход заключается в получении селективной мутации в интересующем нас гене, или же полном выключении его функции (нокаут гена). По мере развития мутантного организма, он исследуется. Наиболее распространенный метод, позволяющий избавиться от какого-либо гена, — гомологичная рекомбинация, проведенная на эмбриональных стволовых клетках. Этот метод был использован применительно к 21 из 27 известных генов интегрина у мышей.
На рисунке ниже показана связь между различными мутациями в интегринах и изменениями фенотипа. Аналогичным образом, проводились эксперименты на мышах с нокаутом генов более 40 различных белков внеклеточного матрикса, включая гликопротеины и сердцевинные белки протеогликанов.
На основании этих исследований мы выяснили, что белки адгезии и внеклеточного матрикса выполняют много важных функций в процессе развития. Выключение функций одних генов (например, β1-интегрина, γ1-цепи ламинина, протеогликана перлекана) приводит к летальным последствиям, в то время как инактивация других (например, α1-интегрина, коллагена типа X, протеогликана декорина) слабо отражается на фенотипе. В последнем случае может проявляться эффект функциональной избыточности, при котором функция отстутствующего интегрина компенсируется другими.
Поскольку традиционный нокаут отражается на гене всех клеток, развивающихся из эмбриона, то летальные мутации делают невозможным оценку функции данного белка во взрослом организме. Например, мышиные эмбрионы с выключенной функцией ламинин γ1 гена остаются жизнеспособными в продолжении не более пяти дней после оплодотворения. Эту проблему можно решить, если разработать процедуру нокаута, при котором во всех тканях, за исключением исследуемых, будет экспрессироваться нормальная копия гена. Такой адресный нокаут проводят, используя индуцируемую генетическую рекомбинацию с участием системы Cre/lох, вместо спонтанной рекомбинации, которая обычно используется для получения линий нокаутных мышей.
Адресный нокаут был использован для исследования функций рецепторов β1-интегрина в коже. Мыши, у которых в кератиноцитах отсутствовал ген β1-интегрина, развивались до взрослых особей, однако у них отмечались многочисленные аномалии: сильное выпадение волос, разрушение волосяных фолликулов, неправильная сборка базальной ламины, замедление сборки полудесмосом и пузырчатость эпидермиса. Такой фенотип отражает функции интегринов и белков внеклеточного матрикса. Клетки кожи, в которых отсутствует β1-интегрин, не образуют многие типы интегриновых рецепторов, что, в свою очередь, не обеспечивает прикрепление таких клеток к базальной ламине и к другим компонентам внеклеточного матрикса. Клетки, неспособные прикрепляться к внеклеточному матриксу, часто оказываются нежизнеспособными, что объясняет развитие у мышей многочисленных аномалий. Например, гибель эпителиальных клеток, образующих волосы, вызывает потерю волос. Исследования, проведенные на таких мышах, показали, что одна из критических функций гена β1-интегрина состоит в организации всех тканей и белков внеклеточного матрикса, включая также и те, которые не связываются с β1-интегрином. Пока вывод такого уровня не удалось бы получить ни на одной из существующих систем in vitro.
В результате дальнейшего развития метода индуцированного нокаута стало возможным инактивировать гены во взрослом здоровом организме. Эта система была использована для удаления гена β1-интегрина из предшественников эритроцитов у эмбрионов мышей и взрослых животных, и было показано блокирование адгезивных свойств и миграции этих клеток в костный мозг. Эксперименты продемонстрировали, что для хоминга предшественников эритроцитов необходим β1-интегрин. Таким образом, получение различных нулевых мутантов этого интегрина позволило выяснить его роль в отдельных тканях и в различные периоды развития организма.
Фенотипические проявления мутаций интегриновых генов у мышей. Изменения фенотипа у мышей при нокауте генов белков внеклеточного матрикса.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
• Почти все клетки животных экспрессируют интегрины, представляющие собой наиболее распространенную группу рецепторов белков внеклеточного матрикса
• Некоторые интегрины ассоциированы с другими трансмембранными белками
• Интегрины состоят из двух отдельных субъединиц, известных под названием а- и b-цепи. Внеклеточные участки обеих цепей связаны с белками внеклеточного матрикса, а цитоплазматические участки — с белками цитоскелета и с сигнальными белками
• У позвоночных существует много а- и b-субъединиц интегрина, которые связываются друг с другом, образуя по меньшей мере 24 различных ap-рецептора гетеродимерной структуры
• Большинство клеток экспрессируют более одного типа интегриновых рецепторов, и тип экспрессируемого рецептора может измениться со временем или в ответ на изменение внешних условий
• Интегриновые рецепторы связываются со специфическими последовательностями аминокислот, присутствующими в различных белках матрикса. Все известные последовательности содержат по крайней мере один остаток кислой аминокислоты
Клетки связываются с белками внеклеточного матрикса посредством специфических рецепторов. Наиболее известная группа таких рецепторов включает белки семейства интегринов. Интегрины связываются с белками внеклеточного матрикса и иногда с мембранными белками, которые экспрессируются на поверхности других клеток. Рецепторы интегринов экспрессируются почти во всех клетках животных. Интегрины представляют собой основные белки клеточной поверхности, которые ответственны за скрепление тканей. Интегрины скрепляют внеклеточный матрикс с внутриклеточными сигнальными белками и с цитоскелетом.
Для того чтобы понять, как функционируют интегрины, мы должны знать их структуру. Интегриновые рецепторы состоят из двух различных полипептидов, которые называются а- и b-субъединицы. Они один раз проходят сквозь мембрану и нековалентно связаны друг с другом, образуя гетеродимерный рецептор. На основании экспериментальных результатов, включая данные рентгеноструктурного анализа кристаллических форм рецептора, построена полная модель структуры интегрина.
Каждая субъединица содержит несколько доменов, участвующих в функционировании интактного рецептора. Для a-цепи эти домены включают структуру, которая называется b-пропеллер и находится на N-концевом участке субъединицы, расположенном с внеклеточной стороны. Пропеллер содержит семь повторов, каждый состоящий из 60 аминокислот, которые образуют его «лопасти», а также три или четыре последовательности, называемые руки EF, которые связывают такие двухвалентные катионы, как Са2+. Некоторые а-субъединицы содержат дополнительный домен, который называется домен I, или A-домен. Этот домен взаимодействует с сайтом адгезии, зависимым от ионов Mg2+/Mn2+ (MIDAS), который находится на субъединице b.
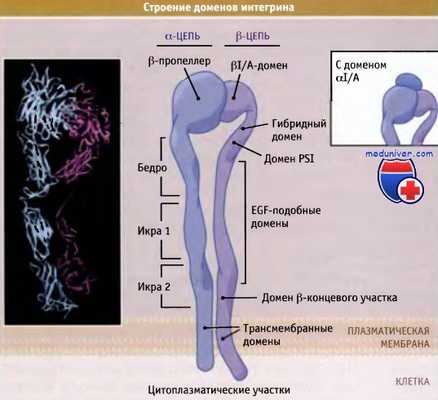
Интегриновые рецепторы представляют собой гетеродимеры.
Некоторые a-цепи содержат домен aI/A, который связан с областью пропеллера на внеклеточном участке рецептора (врезка).
Большая часть интегриновых рецепторов лишена домена αI.
Представлена расправленная кристаллическая структура внеклеточных доменов интегрина ανβ3.
Ближе к плазматической мембране субъединица а содержит три домена, которые вместе образуют структуру «ноги» и которые называются бедро, икра 1 и икра 2. Все b-цепи на N-конце содержат консервативный PSI домен, за которым расположен гибридный домен, связанный с глобулярным доменом I/A, контактирующим с доменом b-пропеллера в a-цепи. Ближе к мембране b-цепь содержит три повтора домена, который напоминает структуру эпидермального фактора роста (домен EGF), за которым расположена хвостовая часть b-домена. Наконец, обе цепи, а и b, содержат один трансмембранный домен и короткий цитоплазматический домен на С-концевом участке.
В настоящее время у позвоночных известно 18 а-и 8 b-субъединиц интегринов. (Большинство их имеет цифровую нумерацию, хотя некоторые обозначаются буквами, в соответствии с тем, как они были идентифицированы.) Эти 26 субъединиц при взаимодействии образуют, по меньшей мере, 24 различных сочетания ab-рецепторов. Вместе с тем, варианты некоторых субъединиц образуются за счет альтернативного сплайсинга, что обеспечивает дополнительные вариации их состава. Большинство клеток экспрессирует более одного типа интегриновых рецепторов, в ответ на специфические стимулы и в процессе развития тип экспрессируемых рецпторов может меняться.
Зачем клетке так много интегринов? Генетический нокаут одних субъединиц интегрина приводит развивающиеся организмы к гибели. В то же время нокаут генов других интегринов проявляется слабо. Это позволяет предполагать, что некоторые из этих рецепторов могут компенсировать функции друг друга. Такая способность интегринов к взаимной компенсации функций носит название функциональная избыточность.
В зависимости от характера b-субъединиц, интегрины подразделяются на три подсемейства.
Интегрины b1, главным образом, связываются с белками внеклеточного матрикса и представляют собой наиболее распространенную группу. Интегрины b2 экспрессируются только в лейкоцитах, и некоторые из них связываются с поверхностными белками других клеток. Некоторые из интегринов b3 экспрессируются в тромбоцитах и в мегакариоцитах (родоначальниках тромбоцитов), и играют критическую роль в процессах адгезии тромбоцитов и свертывания крови. Остальные b3-интегрины также экспрессируются в эндотелиальных клетках, фибробластах и в клетках некоторых опухолей. Рецепторы, включающие субъединицы Р4-Р8, немногочисленны и обладают крайне разнообразной структурой. Поэтому они не относятся ни к одному из перечисленных подсемейств.
Как интегрины поддерживают адгезию клеток? Интегриновый рецептор непосредственно связывается с белком внеклеточного матрикса с помощью внеклеточных доменов своих а- и b-цепей. Считается, что для большинства интегриновых рецепторов внеклеточный домен a-цепи определяет специфичность лиганда. За исключением фибронектинового рецептора а5b1, все интегрины могут связываться более чем с одним лигандом. Каждый белок внеклеточного матрикса также может связываться более чем с одним интегрином. Хотя на основании аминокислотной последовательности лиганда невозможно предсказать структуру сайта связывания интегрина, для всех известных сайтов связывания белков внеклеточного матрикса характерно присутствие кислой аминокислоты (например, аспарагиновой).
Такие лиганды, как коллаген, витронектин и фибронектин, содержат последовательность аргинин-глицин-аспарагиновая ктислота (RGD). Как мы увидим из следующего раздела, в адгезивной функции интегринов также участвуют их цитоплазматические участки, которые связывают цитоскелетные и сигнальные белки.
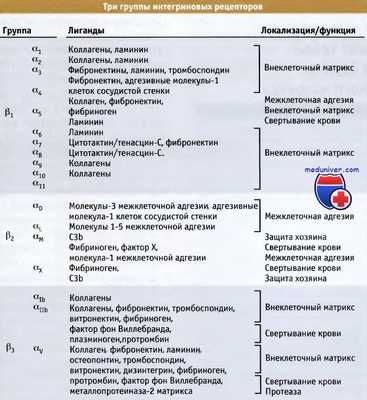
В зависимости от типа b-субъединиц, интегрины подразделяются на подгруппы.
Интегрины структура, функции и эволюционная перспектива
Яntegrinas они являются трансмембранными белками, ответственными за опосредование адгезии между клетками. Эти белки имеют часть, которая распространяется в окружающую среду за пределами клетки и может связываться с другими белками во внеклеточном матриксе. Другие могут связываться с другими соседними клетками, бактериальными полисахаридами или определенными вирусными белками..
Все эти взаимодействия, в которых участвуют интегрины, генерируют стабильность с точки зрения различных клеточных соединений, образования внеклеточного матрикса, образования агрегатов тромбоцитов, установления клеточных соединений в иммунной системе, среди других событий, имеющих биологическое значение..
Интегрины были обнаружены в различных организмах, таких как млекопитающие, птицы, рыбы и некоторые простые эукариоты, такие как губки, нематоды и плодовая муха..
- 1 структура
- 1.1 Структурные общности интегринов
- 1.2 Характеристика подразделений
- 1.3 Ковалентный союз между субъединицами
структура
Структурные общности интегринов
Интегрины являются гликопротеинами. Белки представляют собой макромолекулы, образованные длинными цепями аминокислот, которые выполняют самые разные функции в организмах. Термин «глико» относится к наличию углеводов (также называемых углеводами) в цепи аминокислот.
Этот гликопротеин является трансмембранным, то есть он проникает через плазматическую мембрану клетки. В интегрине можно выделить три домена: внеклеточный домен, который позволяет объединяться с другими структурами, домен, который пересекает клеточную мембрану, и последний, который расположен внутри клетки и соединяется с цитоскелетом.
Внеклеточная часть
Одна из наиболее важных характеристик интегринов заключается в том, что часть, которая выходит за пределы клетки, имеет шаровидную форму. У них есть ряд сайтов, которые позволяют распознавать молекулы, расположенные в матрице. Эти последовательности состоят из аминокислот аргинина, глицина и аспартата.
Эта часть, которая участвует в объединении, имеет длину около 60 аминокислотных остатков.
Трансмембранная часть
Последовательность белка, который проходит через клеточную мембрану, характеризуется наличием структуры типа альфа-спирали. Далее две цепи погружаются в цитоплазму клетки.
Цитоплазматическая часть
Уже в цитоплазме клетки вы можете присоединиться к другим структурам, будь то различные белки или цитоскелет, такие как талин, актин и другие..
«Хвост», который находится в цитоплазме, имеет среднюю длину 75 аминокислотных остатков (хотя есть исключения с более чем 1000 в этом регионе).
Этот механизм позволяет интегринам функционировать в качестве моста для довольно динамичного обмена информацией: белки связывают молекулы внеклеточного матрикса с молекулами, которые находятся внутри, генерируя серию сигналов и передавая информацию.
Характеристика подразделений
Каждый интегрин образован нековалентной ассоциацией двух трансмембранных гликопротеинов: α и β субъединицы. Поскольку эти субъединицы не равны, интегрин называется гетеродимером (прямой разными и димер объединением двух субъединиц). Α-цепь имеет длину почти 800 аминокислот, а β - 100 аминокислот..
Α-субъединица имеет две цепи, связанные дисульфидными связями, и имеет глобулярную головку с сайтами связывания двухвалентных катионов. С другой стороны, β-субъединица богата остатками аминокислоты цистеина, и внутриклеточная часть может опосредовать взаимодействие с рядом соединяющихся белков..
Ковалентный союз между подразделениями
Есть 18 α цепей и 8 β цепей. Различные комбинации между обеими субъединицами определяют существующие интегрины с минимум 24 различными димерами.
Комбинации могут быть заданы следующим образом: α с β или α с несколькими β-цепями. Β-нити отвечают за определение того, насколько специфичным будет связывание, и являются ли частью интегрина, ответственными за опосредование взаимодействия с молекулой-мишенью.
Таким образом, конкретные комбинации субъединиц определяют, с какой молекулой будет связан. Например, интегрин, образованный из субъединицы α 3 и β 1, специфичен для взаимодействия с фибронектином.
Этот интегрин известен как α3β1 (Чтобы назвать их, просто упомяните номер субъединицы как индекс). Аналогично, интегрин α2β1 связывается с коллагеном.
функции
Интегрины являются важными белками в обеспечении взаимодействия между клеткой и окружающей средой, поскольку они обладают рецепторами объединения с различным компонентом внеклеточного матрикса. В частности, связывание происходит между матрицей и цитоскелетом.
Благодаря этим свойствам интегрины отвечают за регуляцию формы, ориентации и движения клетки..
Кроме того, интегрины способны активировать различные внутриклеточные пути. Цитоплазматическая часть интегрина может запускать сигнальную цепь.
Это взаимодействие приводит к глобальному клеточному ответу, как это происходит с обычными сигнальными рецепторами. Этот путь приводит к изменениям в экспрессии генов.
Эффективная адгезия между клетками для формирования тканей была, без сомнения, важнейшей характеристикой, которая должна была присутствовать в эволюционной эволюции многоклеточных организмов..
Появление семейства интегринов было прослежено до появления метазоев около 600 миллионов лет назад..
Группа животных с наследственными гистологическими характеристиками - это порифера, обычно называемая морскими губками. У этих животных клеточная адгезия происходит с помощью внеклеточного матрикса протеогликана. Рецепторы, которые связываются с этой матрицей, имеют типичный мотив связывания интегрина.
На самом деле, в этой группе животных мы определили гены, связанные со специфическими субъединицами некоторых интегринов.
В ходе эволюции предок метазоя приобрел интегрин и связывающий домен, который со временем сохранялся в этой огромной группе животных..
Конструктивно максимальная сложность интегринов наблюдается в группе позвоночных. Существуют разные интегрины, которых нет у беспозвоночных, с новыми доменами. Действительно, у человека было идентифицировано более 24 различных функциональных интегринов - в то время как у плодовой мухи Drosophila melanogaster всего 5.
Механизм передачи сигнала от интегринового рецептора
• Интегрины являются сигнальными рецепторами которые контролируют как связывание клеток с белками внеклеточного матрикса, так и внутриклеточные процессы сопровождающие адгезию клеток
• Сами интегрины не проявляют ферментативной активности. Вместо этого они взаимодействуют с адаптерными белками, которые связывают их с сигнальными белками
• Прочность связывания интегринов с белками внеклеточного матрикса регулируется двумя процессами, модуляцией сродства (т. е. изменение прочности связи индивидуальных рецепторов) и модуляцией связывания (т. е. изменение степени кластеризации рецепторов)
• Центральными для обоих регуляторных процессов являются изменения конформации интегринового рецептора, которые происходят или за счет изменений цитоплазматического участка его субъединиц, или за счет изменений внеклеточной концентрации катионов
• При передаче сигнала по схеме inside-out (изнутри наружу) изменения конформации рецептора происходят за счет внутриклеточных сигналов, которые возникают в любом месте клетки (например, на другом рецепторе)
• При передаче сигнала по схеме outside-in (снаружи внутрь) сигналы возникают на рецепторе (например, при связывании лиганда) и распространяются на другие части клетки
• В зависимости от типа интегринов и белков внеклеточного матрикса, природа цитоплазматических белков, связанных с интегриновыми кластерами, сильно варьирует. В соответствии с этим варьирует и ответ клетки на сигнал от интегрина, передающийся по схеме outside-in (снаружи внутрь)
• Многие процессы передачи сигнала от интегрина перекрываются с процессами передачи сигнала от рецептора фактора роста
В ответ на внешние сигналы связывание интегриновых рецепторов с белками внеклеточного матрикса может измениться. Почему это может оказаться необходимым? Рассмотрим, например, циркулирующий в крови тромбоцит. Основная его функция заключается в образовании кровяного сгустка, который способствует устранению повреждений стенки кровеносных сосудов.
Для этого тромбоциты связываются с белками внеклеточного матрикса и с белками свертывания крови. Тромбоциты не должны инициировать образование сгустка в неповрежденной области стенки сосуда. Адгезия тромбоцитов (и других клеток) к внеклеточным белкам контролируется интегриновыми рецепторами. Еще один пример: неподвижные клетки прочно скрепляются с белками внеклеточного матрикса, а когда клетки становятся подвижными, их связь с этими белками ослабляется.
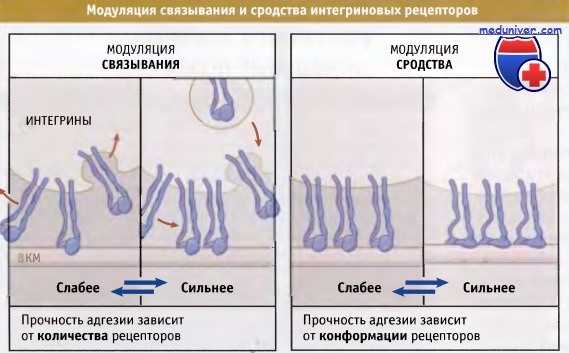
![Интегриновые рецепторы]()
Модуляция связывания описывает изменения плотности рецепторов на поверхности клеток,
а модуляция сродства относится к изменениям прочности связывания белками индивидуального рецептора.Прочность связывания интегрина с белками находится под контролем двух комплементарных механизмов:
• Модуляция сродства, при которой изменение конформации рецептора влечет за собой изменение его сродства к лиганду.
• Модуляция связывания, при которой изменяется число контактов, образующихся между интегринами и белками внеклеточного матрикса.Оба механизма могут контролироваться внутриклеточными процессами передачи сигнала, и изменения конформации интегрина являются основным фактором в обоих типах модуляций.
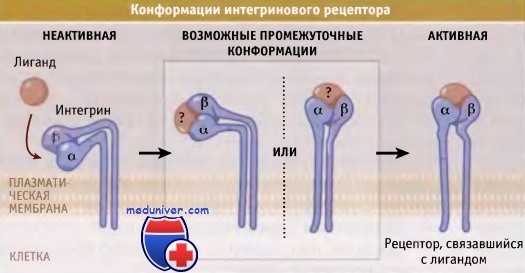
На основании данных рентгеноструктурного анализа кристаллов интегриновых рецепторов предложена модель активации интегрина. В неактивном состоянии внеклеточная часть обеих цепей согнута по направлению к плазматической мембране, и рецептор не связывает лиганда. Бедренные и гибридные домены действуют как шарниры для а- и b-субъединиц соответственно.
Для активации интегринового рецептора необходимо, чтобы эта внеклеточная часть рецептора выпрямилась; считается, что чем более выпрямлен рецептор, тем больше его сродство к лиганду. В процессе выпрямления рецептора происходит его связывание с лигандом. Это связывание характеризуется сначала низким сродством, и, возможно, оно даже может способствовать еще большему выпрямлению рецептора. Последующие изменения конформации рецептора находятся под контролем или локальной концентрации двухвалентных катионов, которые связываются с (3-пропеллером и областью MIDAS рецептора, или процессов передачи сигнала.
Одно из наиболее важных преимуществ этой модели заключается в том, что она демонстрирует, каким образом обеспечиваются разные формы интегринов и, соответственно, возникают разные состояния связывания. Эта модель помогает объяснить, как клетки тонко регулируют связывание с белками внеклеточного матрикса.
Концентрация двухвалентных катионов во внеклеточной жидкости может меняться в процессе поддержания в организме солевого баланса. Поскольку интегрины связываются с ионами Са2+ и Mg2+, это приводит к изменению их конформации и поэтому влияет на связывание с внеклеточными белками. Как правило, в условиях in vitro, удаление катионов приводит к сгибанию рецепторов и к утрате ими адгезивных свойств, а добавление катионов их выпрямляет и восстанавливает адгезивные свойства.
Изменения функции интегринов также наступают в ответ на сигнал, переданный от других рецепторов, например от рецепторов факторов роста. Такая передача обозначается как передача сигнала по схеме «изнутри наружу» и показана на рисунке ниже. Сигнал распространяется по цитоплазме и заканчивается на внеклеточных участках интегриновых субъединиц. Биохимические изменения, лежащие в основе этого способа передачи сигнала на интегрины, не исследованы.
В результате описанной активации выпрямление внеклеточных участков интегриновых рецепторов приводит к соответствующим изменениям формы их цитоплазматических участков. Эти изменения являются важной частью процесса передачи сигнала, поскольку они влияют на взаимодействие интегринов с белками цитозоля. Предложены две модели, объясняющие, как цитоплазматические участки интегриновых рецепторов изменяют свою конформацию в ответ на изменения внешних условий или при передаче сигнала по схеме inside-out. Одна модель, построенная по данным кристаллической структуры очищенных препаратов интегринов, предполагает, что активация приводит к расхождению их цитоплазматических участков, которые, таким образом, ведут себя наподобие ножниц.
Это обеспечивает связывание внутриклеточных сигнальных молекул. В неактивном состоянии интегрин находится в закрытой конформации, и связывание сигнальных молекул не происходит.
Другая модель построена по данным ядерно-магнитного резонанса и представлена на рисунке ниже. Она предполагает, что, когда рецептор неактивен, цитоплазматическая часть интегриновой субъединицы а образует петлю, аналогично внеклеточному участку рецептора, а после активации эта петля раскручивается. В результате происходит связывание сигнальных белков.
Как показано на рисунке ниже, при изменении связывания, после активации, на поверхности клетки увеличивается степень кластеризации интегриновых рецепторов. Отдельные интегрины, в большом количестве находящиеся на поверхности клеток, образуют сравнительно слабые связи со своими лигандами. Однако если такое же количество интегринов образует в плоскости мембраны кластеры, то плотность возникающих связей будет обеспечивать большую устойчивость ткани к растяжению. Таким образом, при диффузном распределении рецепторов обеспечивается меньшая степень адгезии, чем при образовании их кластеров, даже когда количество и сродство рецепторов не меняются.
Когда интегриновые рецепторы образуют кластеры на поверхности клеток, цитоплазматические участки их а- и b-субъединиц служат сайтами причаливания для сборки различных белков, которые могут выполнять две функции. Во-первых, посредством интегринов они формируют связь между внешним окружением клетки и компонентами ее цитоскелета. Таким же образом силы растяжения передаются по клетке и на окружающий внеклеточный матрикс. В полудесмосоме интегрин α6β4 связывается с сетью промежуточных филаментов. В противоположность этому, белки, которые собираются вокруг интегринов β1, β2 и β3, связывают их с актиновым цитоскелетом, что позволяет клеткам изменять форму и выполнять такие функции, как миграция и деление.
![Конформации интегринового рецептора]()
Данная модель активации интегрина предполагает, что в неактивном состоянии внеклеточная часть рецептора согнута по направлению к плазматической мембране.
По мере выпрямления интегринового рецептора он связывает лиганд, и становится активным.
Рецептор, находящийся в полностью выпрямленном состоянии, обладает максимальным сродством к лиганду.В каждом сайте активации и кластеризации интегринов в культуре клеток с ними связывается группа внутриклеточных белков. При этом образуются фокальные адгезии, которые представляют собой бляшки, хорошо заметные на клеточной поверхности. Через них осуществляется контакт или связывание с субстратом. Кластеры интегриновых рецепторов, которые формируются вскоре после того, как клетки образуют контакт с внеклеточным матриксом, называются фокальными комплексами. По мере того как эти комплексы мобилизуют в кластер дополнительные цитоплазматические белки, они созревают с образованием фокальных контактов или фокальных адгезий.
Во-вторых, при сборке сигнальных белков, эти белки выполняют опорную функцию. Сами по себе интегриновые рецепторы не принадлежат к сигнальным белкам. Скорее они создают структурную основу для трехмерной сборки белков, которые переводят изменения связывания интегрина на язык химических сигналов, быстро распространяющихся по клетке. Процесс внутриклеточной передачи сигналов, который запускается связыванием и кластеризацией интегрина называется передачей сигнала по схеме снаружи внутрь. Модели, учитывающие конформационные изменения интегрина, представленные на рисунке ниже, также можно применить для схемы внешнего сигнала.
Поскольку сигнальные белки не образуют друг с другом стабильных ассоциатов, их идентификация представляет собой трудную задачу. Одним из методов, который использовался для идентификации белков, взаимодействующих с цитоплазматическими участками интегринов, является дрожжевая двухгибридная система. Затем, используя другие методы, подтверждали присутствие и оценивали функции этих белков в сигнальных комплексах.
Идентифицировано по меньшей мере 24 различных цитоплазматических белков, образующих комплекс с интегриновыми кластерами. Точный состав каждого кластера варьирует в зависимости от типа интегринов в кластере, типа внеклеточного матрикса, связанного с интегринами, силы растяжения, приложенной к кластеру, положения его в клетке, а также от типа клеток, в которых он образуется. Поэтому невозможно описать, как должен выглядеть «типичный» интегриновый сигнальный комплекс.
В качестве примера можно назвать фокальные адгезии, представляющие собой относительно устойчивые структуры, поддерживающие адгезию клеток к внеклеточному матриксу, и сигнальные комплексы, которые активируются после контакта с внеклеточным матриксом. В этих случаях сигнальные комплексы содержат структурные белки, образующие связи с актином цитоскелета, и сигнальные белки, включающие различные белки и киназы липидов, наряду с регуляторными белками, контролирующими их функции. Некоторые из структурных белков включают талин, а-актинин и винкулин, которые связываются с актиновыми филаментами. Не все белки комплекса непосредственно связываются с интегрином.
Наличие взаимодействий между белками подтверждали методом аффинной хроматографии, используя очищенные препараты интегринов и белков цитозоля и исследуя связывание между их фрагментами.
Многие сигнальные белки, связанные с кластерами интегрина и показанные на рисунке ниже, также обнаружены в сигнальных комплексах, которые образуются вокруг рецепторов факторов роста. Действительно, многие пути передачи сигналов с участием интегринов перекрываются с сигнальными путями рецепторов факторов роста, и некоторые из этих рецепторов мобилизуются в кластеры интегрина, так что часто трудно оценить вклад каждого из двух типов рецепторов.
Например, киназа белкового комплекса фокальной адгезии (FAK), которая находится в интегриновых кластерах, организует несколько путей передачи сигнала и играет основную роль в контроле роста и миграции клеток. В результате перекрывания сигнальных путей связывание интегрина с молекулами внеклеточного матрикса способствует контролю роста клеток и блокирует их программированную гибель.
Сигналы, распространяющиеся в цитоплазме (например, от факторов роста),
передаются на цитоплазматическую часть интегриновых рецепторов.
Эти сигналы модулируют связывание или сродство интегринов на поверхности клеток.
Таким образом, говорят о передаче сигнала по схеме изнутри-кнаружи,
т. е. из цитоплазмы к внеклеточному пространству. Две модели, описывающие, как интегрины активируются, связывая внеклеточный лиганд,
и открывают сайты связывания для белков цитозоля.
Сам сигнал активации может иметь внутри- или внеклеточное происхождение. Полудесмосомы и фокальные адгезии представляют собой структурно
и функционально различные комплексы белков, связанных с интегрином. Фокальные адгезии образуются вокруг кластеров интегринов на поверхности клетки
и выполняют функцию структурных связей между внеклеточным матриксом и актиновым цитоскелетом.
В фокальных адгезиях также находятся многочисленные сигнальные белки. Цитоплазматические участки интегриновых рецепторов связываются со многими сигнальными и адаптерными белками.
Представлены две модели строения сигнальных комплексов. Согласно одной модели, основным сигнальным белком является FAK,
который связывается с интегрином непосредственно или через белки талин и паксилин.
Во второй модели в качестве основного сигнального функционирует белок Shc, который связан с интегрином через адаптерный белок, кавеолин.
Оба сигнальных комплекса контролируют процессы с участием МАР киназы.Читайте также: