Сборка антител. Комплементация иммуноглобулинов
Добавил пользователь Алексей Ф. Обновлено: 27.01.2026
Особенности репродукции ДНК- и РНК- содержащих вирусов.
Геном вирусов содержит или РНК, или ДНК (РНК- и ДНК- вирусы соответственно). Выделяют позитивную (+) РНК, обладающую матричной активностью и соответственно- инфекционными свойствами, и негативную ( - ) РНК, не проявляющую инфекционные свойства, которая для воспроизводства толжна транскрибироваться (превращаться) в +РНК. Механизмы репродукции различных вирусов очень сложные и существенно отличаются. Основные их схематические варианты представлены ниже.
1. вирионная (матричная) +РНК à комплементарная -РНК (в рибосомах) à вирионная +РНК.
2. - РНК à вирусная (информационная) +РНК à - РНК (формируется на геноме зараженной клетки).
3. однонитевая ДНК: +ДНК à +ДНК -ДНК à +ДНК -ДНК +ДНК à +ДНК.
4. ретровирусная однонитевая РНК: РНК à ДНК (провирус) à РНК.
5. двунитевая ДНК: разделение нитей ДНК и формирование на каждой комплементарной нити ДНК.
Генофонд вирусов создается и пополняется из четырех основных источников:
двух внутренних (мутации, рекомбинации) и двух внешних (включение в геном генетического материала клетки хозяина, поток генов из других вирусных популяций).
Комплементация- функциональное взаимодействие двух дефектных вирусов, способствующее их репликации и горизонтальной передаче.
Фенотипическое смешивание- при заражении клетки близкородственными вирусами с образованием вирионов с гибридными капсидами, кодируемыми геномами двух вирусов.
Популяционная изменчивость вирусов связана с двумя разнонаправленными процессами - мутациями и селекцией, связанными с внешней средой как индуктором мутаций и фактором стабилизирующего отбора. Гетерогенность вирусных популяций- адаптационный генетический механизм, способствующий пластичности (устойчивости, приспособляемости) популяций, фактор эволюции и сохранения видов во внешней среде.
Генофонд вирусных популяций сохраняется за счет нескольких механизмов:
- восстановления изменчивости за счет мутаций;
- резервирующих механизмов (возможность перехода любых, даже негативных мутаций в следующую генерацию)- комплементация, рекомбинация;
- буферных механизмов (образование дефектных вирусных частиц, иммунных комплексов и др.), способствующие сохранению вируса в изменяющихся внешних условиях.
Типы взаимодействия вируса с клеткой. Стадии репродукции вирусов.
Типы взаимодействия вируса с клеткой. Различают три типа взаимодействия вируса с клеткой: продуктивный, абортивный и интегративный.
Продуктивный тип - завершается образованием нового поколения вирионов и гибелью (лизисом) зараженных клеток (цитолитическая форма). Некоторые вирусы выходят из клеток, не разрушая их (нецитолитическая форма).
Абортивный тип - не завершается образованием новых вирионов, поскольку инфекционный процесс в клетке прерывается на одном из этапов.
Интегративный тип, или вирогения - характеризуется встраиванием (интеграцией) вирусной ДНК в виде провируса в хромосому клетки и их совместным сосуществованием (совместная репликация).
Репродукция вирусов осуществляется в несколько стадий, последовательно сменяющих друг друга: адсорбция вируса на клетке; проникновение вируса в клетку; «раздевание» вируса; биосинтез вирусных компонентов в клетке; формирование вирусов; выход вирусов из клетки.
Адсорбция. Взаимодействие вируса с клеткой начинается с процесса адсорбции, т. е. прикрепления вирусов к поверхности клетки. Это высокоспецифический процесс. Вирус адсорбируется на определенных участках клеточной мембраны - так называемых рецепторах. Клеточные рецепторы могут иметь разную химическую природу, представляя собой белки, углеводные компоненты белков и липидов, липиды. Число специфических рецепторов на поверхности одной клетки колеблется от 104 до 105. Следовательно, на клетке могут адсорбироваться десятки и даже сотни вирусных частиц.
Проникновение в клетку. Существует два способа проникновения вирусов животных в клетку: виропексис и слияние вирусной оболочки с клеточной мембраной. При виропексисе после адсорбции вирусов происходят инвагинация (впячивание) участка клеточной мембраны и образование внутриклеточной вакуоли, которая содержит вирусную частицу. Вакуоль с вирусом может транспортироваться в любом направлении в разные участки цитоплазмы или ядро клетки. Процесс слияния осуществляется одним из поверхностных вирусных белков капсидной или суперкапсидной оболочки. По-видимому, оба механизма проникновения вируса в клетку не исключают, а дополняют друг друга.
«Раздевание». Процесс «раздевания» заключается в удалении защитных вирусных оболочек и освобождении внутреннего компонента вируса, способного вызвать инфекционный процесс. «Раздевание» вирусов происходит постепенно, в несколько этапов, в определенных участках цитоплазмы или ядра клетки, для чего клетка использует набор специальных ферментов. В случае проникновения вируса путем слияния вирусной оболочки с клеточной мембраной процесс проникновения вируса в клетку сочетается с первым этапом его «раздевания». Конечными продуктами «раздевания» являются сердцевина, нуклеокапсид или нуклеиновая кислота вируса.
Биосинтез компонентов вируса. Проникшая в клетку вирусная нуклеиновая кислота несет генетическую информацию, которая успешно конкурирует с генетической информацией клетки. Она дезорганизует работу клеточных систем, подавляет собственный метаболизм клетки и заставляет ее синтезировать новые вирусные белки и нуклеиновые кислоты, идущие на построение вирусного потомства.
Реализация генетической информации вируса осуществляется в соответствии с процессами транскрипции, трансляции и репликации.
Формирование (сборка) вирусов. Синтезированные вирусные нуклеиновые кислоты и белки обладают способностью специфически «узнавать» друг друга и при достаточной их концентрации самопроизвольно соединяются в результате гидрофобных, солевых и водородных связей.
Существуют следующие общие принципы сборки вирусов, имеющих разную структуру:
1. Формирование вирусов является многоступенчатым процессом с образованием промежуточных форм;
2. Сборка просто устроенных вирусов заключается во взаимодействии молекул вирусных нуклеиновых кислот с капсидными белками и образовании нуклеокапсидов (например, вирусы полиомиелита). У сложно устроенных вирусов сначала формируются нуклеокапсиды, с которыми взаимодействуют белки суперкапсидных оболочек (например, вирусы гриппа);
3. Формирование вирусов происходит не во внутриклеточной жидкости, а на ядерных или цитоплазматических мембранах клетки;
4. Сложно организованные вирусы в процессе формирования включают в свой состав компоненты клетки-хозяина (липиды, углеводы).
Выход вирусов из клетки. Различают два основных типа выхода вирусного потомства из клетки. Первый тип - взрывной - характеризуется одновременным выходом большого количества вирусов. При этом клетка быстро погибает. Такой способ выхода характерен для вирусов, не имеющих суперкапсидной оболочки. Второй тип - почкование. Он присущ вирусам, имеющим суперкапсидную оболочку. На заключительном этапе сборки нуклеокапсиды сложно устроенных вирусов фиксируются на клеточной плазматической мембране, модифицированной вирусными белками, и постепенно выпячивают ее. В результате выпячивания образуется «почка», содержащая нуклеокапсид. Затем «почка» отделяется от клетки. Таким образом, внешняя оболочка этих вирусов формируется в процессе их выхода из клетки. При таком механизме клетка может продолжительное время продуцировать вирус, сохраняя в той или иной мере свои основные функции.
Время, необходимое для осуществления полного цикла репродукции вирусов, варьирует от 5-6 ч (вирусы гриппа, натуральной оспы и др.) до нескольких суток (вирусы кори, аденовирусы и др.). Образовавшиеся вирусы способны инфицировать новые клетки и проходить в них указанный выше цикл репродукции.
2. Антитела. Классификация иммуноглобулинов. Динамика антителообразования.
Следовательно, антитела - это иммуноглобулины, вырабатываемые в ответ на введение антигена и способные специфически взаимодействовать с этим же антигеном.
Функции. Первичная функция состоит во взаимодсйствии их активных центров с комплементарными им детерминантами антигенов. Вторичная функция состоит в их способности:Нейтрализация токсинов,лизис бактерий.при.участии.комплимента,опсонизация и усиление фагацитоза,участвовать в распознавании «чужого» антигена и его связывание;нейтрализация внеклеточ вируса,цитотоксическое действие на вирус,
обеспечивать кооперацию.иммунокомпетентных клеток (макрофагов, Т- и В-лимфоцитов);участвовать в различных формах иммунного ответа .
Иммуноглобулины по структуре, антигенным и иммунобиологическим свойствам разделяются на пять классов:
IgM-5-10% в крови,молек масса 900 000,5 мономеров, валентность 10,содерж.в сыворотке крови- 1г/л, синтезируется В-лимфоцитами,не проходит через плаценту,функции:первич.имун.ответ,может образовывать секреторную форму и выделяться в молоко,обеспечивает нейтрализацию,опсонизацию и маркирование антигена,осуществляет запуск комплимент-опосредованного цитолиза и антителозависимой клеточно-опосредованной цитотоксичности.
IgG-75-85%ур.крови,150 000 масса,1 мономер,валентность2, в сыворотке 12г/л,проходит через плаценту и обеспеч гуморал имунитет новорожденного в первые 3 месяца,участвует во 2-ом имун.ответе, синтезируется В-лимфацитами и плазматическими клетками,участвует в развитии аллерг.реакции 1-го типа, выделяется в секрет слизистыхи в молоко путем диффузии.
IgA-7-5% в крови молек.масса 170 000(сывороточный) или 350 000(секреторный), Сывороточный- 1 мономер,валентность 2,синтез. В-лимфоцитами и плазматич.клетками.Облад.высок. афинностью,не связ комплемент,не проходит через плацентарный барьер.Секреторный-2 мономера,валентность 4,синтез.В-лимфоцитами,Секретор Ig-основной фактор спецефического гуморалного местного иммунитета слизистых оболочек ЖКТ,мочеполовой системы и респираторного тракта,он препятствует адгезии микробов на эпителиальных клетках и генерализации инфекции в пределах слизистых.
IgE-0,002%в крови,масса 190 000,1 мономер, валентность 2,содерж в сыворотке 0,00025 г/л,синтезируется В-лимфацитами, плазматическими клетками в лимфоидной ткани,бронхолегочной ткани ,ЖКТ, не связ.комплемент, не проходит через плаценту,является реагином-защита от паразитов.
IgD-1%в крови,масса 180 000,мономеры 1, валентость 2,в сыворотке 0,03г/л,является мембранным рецептором..
Молекулы иммуноглобулинов всех пяти классов состоят из полипептидных цепей: двух одинаковых тяжелых цепей Н и двух одинаковых легких цепей - L, соединенных между собой дисульфидными мостиками. Как в Н-, так и в L-цепях имеется вариабельная - V область, в которой последовательность аминокислот непостоянна, и константная - С область с постоянным набором аминокислот. В легких и тяжелых цепях различают NH2- и СООН-концевые группы.
При воздействии протеолитическим ферментом папаином иммуноглобулин расщепляется на три фрагмента: два не кристаллизующихся, содержащих детерминантные группы к антигену и названных Fab-фрагментами I и II и один кристаллизующий Fc-фрагмент. FabI- и FabII-фрагменты сходны по свойствам и аминокислотному составу и отличаются от Fc-фрагмента; Fab-и Fc-фрагменты являются компактными образованиями, соединенными между собой гибкими участками Н-цепи, благодаря чему молекулы иммуноглобулина имеют гибкую структуру.
Как Н-цепи, так и L-цепи имеют отдельные, линейно связанные компактные участки, названные доменами; в Н-цепи их по 4, а в L-цепи - по 2.
Активные центры, или детерминанты, которые формируются в V-областях, занимают примерно 2 % поверхности молекулы иммуноглобулина. В каждой молекуле имеются две детерминанты, относящиеся к гипервариабельным участкам Н-и L-цепей, т. е. каждая молекула иммуноглобулина может связать две молекулы антигена. Поэтому антитела являются двухвалентными.
Сборка антител. Комплементация иммуноглобулинов
Ткани и органы. Иммунная система
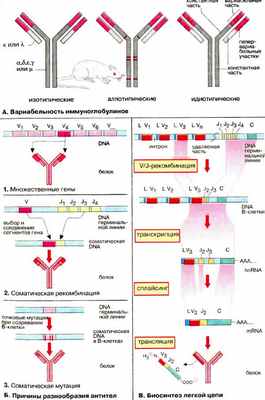
А. Вариабельность иммуноглобулинов
Несмотря на сходство своей основной структуры иммуноглобулины (Ig) чрезвычайно разнообразны. Считается, что в организме человека имеется примерно 10 8 различных вариантов антител. Вариабельность Ig относится как к легким, так и тяжелым цепям.
Имеется пять разновидностей тяжелых H-цепей (α, β, ε, γ и μ, см. с. 288), которые и определяют классы антител, и две разновидности легких L-цепей (κ и λ). Эти типы вариаций называют изотопическими . При биосинтезе Ig может происходить переключение плазматических клеток с продукции одного изотипа на другой («переключение генов»). Аллотипические вариации относятся к вариабельности аллелей в пределах вида, т. е. к генетически определяемым различиям одного индивидуума от другого. Идиотипические вариации определяют различия в антигенсвязывающем участке антител, Они касаются вариабельных доменов (на схеме розового цвета) легкой и тяжелой цепей. Некоторые их участки являются гипервариабельными (красного цвета на рисунке), т.е. их отличия особенно велики. Эти последовательности непосредственно участвуют в связывании антигена.
Б. Причины разнообразия антител
Исключительная вариабельность антител обусловлена тремя причинами.
1. Множественность генов. Имеется множество генов, кодирующих белки вариабельных доменов, однако выбирается и экспрессируется только один ген.
2. Соматические рекомбинации. Гены разделены на несколько сегментов, для которых имеются различные версии. Во время созревания В-клеток благодаря случайной комбинации сегментов возникают новые гены (мозаичные гены).
3. Соматические мутации. Во время дифференциации В-клеток и превращения в плазматические клетки происходят мутации в кодирующих генах. Таким образом, изначальные гены терминальной линии могут стать различными соматическими генами в индивидуальных клонах В-клеток.
В. Биосинтез легкой цепи
Рассмотрим основные особенности организации гена иммуноглобулина и его экспрессии на примере биосинтеза мышиной κ-цепи. Сегменты гена, кодирующие эту легкую цепь, обозначаются как L, V, J и С. Они локализованы на хромосоме 6 в ДНК (DNA) терминальной линии клеток мыши (у человека на хромосоме 2) и разделены друг от друга интронами различной длины.
Примерно 150 идентичных сегментов L гена кодируют сигнальный пептид (17-20 аминокислот) для секреции продукта (см. рис. 233). Наибольшая часть вариабельного домена (95 из 108 аминокислотных остатков) кодируется около 150 различными V-сегмен тами , расположенными рядом с L-сегментом. L- и V-сегменты всегда расположены парами, так называемым тандемом. Напротив, для J-сегмента (от англ. joining) существует максимально только пять вариантов. Они кодируют пептид из 13 аминокислотных остатков, который связывает вариабельную и константную части κ-цепи. Константная часть легкой цепи (84 аминокислоты) кодируется единственным С-сегментом .
Во время дифференциации В-лимфоцитов уникальная V/J-комбинация возникает в каждой В-клетке. Один из 150 сегментов L-V-тандема выбирается и связывается с одним из пяти J-сегментов. Это приводит к возникновению соматического гена, который значительно меньше по сравнению с геном терминальной линии. Транскрипция этого гена ведет к образованию гяРНК (hnRNA) для κ-цепи. Из этой РНК удаляются путем сплайсинга интроны и лишние J-сегменты (см. рис. 243). Зрелая мРНК (mRNA) содержит сегменты L-V-J-C и после транспорта в цитоплазму готова для трансляции. Последующие шаги биосинтеза Ig те же, что и для других мембранных или секреторных белков (см. рис. 233).
Сборка антител. Комплементация иммуноглобулинов
Сборка антител. Комплементация иммуноглобулинов
Синтез Н- и L-цепей осуществляется отдельными классами полирибосом, не связанными между собой. Как образуется молекула иммуноглобулина, состоящая из 4—5 (в случае IgG и IgA) или из 21 (в случае IgM) полипептидных цепей и содержащая, кроме того, значительное количество углеводов, и где это происходит?
По этим вопросам существует огромная литература, подробное рассмотрение которой в рамках настоящего обзора невозможно. Мы ограничимся лишь кратким перечислением основных установленных фактов.
Показано, что сборка молекул IgG, IgA и IgM может начинаться в тот момент, когда тяжелые цепи еще не достроены до конца и связаны с полирибосомами. В этом случае L-цепи, высвободившиеся из легких полирибосом, подходят к тяжелым полирибосомам и комплементируются с растущими на них Н-цепями.
Подтверждением этому служат многочисленные данные об обнаружении L-цепей на тяжелых полирибосомах, полученные в различных лабораториях при изучении механизмов синтеза и сборки молекул иммуноглобулинов как на целых клетках (Shapiro е. а., 1966; Askonas, Williamson, 1967b), так и в бесклеточных системах (Vassalli е. а., 1971).
Было даже высказано предположение, что L-цепи участвуют в снятии Н-цспей с полирибосом, и постулировано, что промежуточными продуктами при сборке молекул иммуноглобулинов должны являться HL-половинки молекул (Shapiro e. a., 1966b). В ряде случаев такие димеры действительно были найдены. Иногда это ковалентно связанные полипептидные цепи (Schubert, 1968), а иногда просто ассоциированные за счет нековалентных взаимодействий молекулы (Laskov е. а., 1971).
В то же время в опытах Вассалли и сотрудников (Vassalli е. а., 1971) наблюдалось высвобождение из полирибосом Н-цепей без какой-либо ассоциации их с L-цепями, а в опытах Циммермана и Керна (Zimmerman, Kern, 1972) — секреция неполностью синтезированных Н-цепей из клеток лимфоузла кролика. Это указывает на то, что снятие тяжелых цепей с нолирибосом может осуществляться и без участия легких цепей. Однако, по-видимому, L-цепи облегчают этот процесс, способствуя солюбилизации Н-цепей.
Основная сборка молекул осуществляется в цистернах эндоплазматического ретикулума, куда поступают вновь синтезированные Н- и L-цепи. Там они сначала образуют нековалентные комплексы HL, НН, HHL и LHHL, которые почти тотчас же превращаются в ковалентные за счет замыкания S—S-связей. Сборка молекул иммуноглобулинов может идти самыми разными путями (Baumal е. а., 1971).
В настоящее Исследования промежуточных продуктов при синтезе и секреции иммуноглобулинов клетками различных миелом показали, что возможны и действительно осуществляются все мыслимые комбинации.
В ряде случаев в одной и той же клетке наряду с полностью собранными молекулами обнаруживаются и продукты частичной сборки.
В опухолях обычно имеется один основной и несколько минорных путей сборки молекул иммуноглобулинов. Миеломные белки IgGl и IgG2a собираются главным образом по пути I, a IgG2b— по путям II и III. Характерно, что в среднем распределение различных предшественников в миеломных клетках сходно с таковым в гетерогенной популяции иммунных лимфоидных клеток мыши (Baumal е. а., 1971).
Информация на сайте подлежит консультации лечащим врачом и не заменяет очной консультации с ним.
См. подробнее в пользовательском соглашении.
Какие тесты на антитела против COVID-19 нужны и для чего. Инструкция
Российские лаборатории предлагают несколько вариантов тестов на антитела к возбудителю COVID-19. Какой стоит выбрать, в каких случаях что понадобится и почему не надо сравнивать тесты из разных лабораторий — разбирался РБК

Какие есть виды тестов
«Нейминг, подверженный вандализму»: эксперты — о ребрендинге Wildberries
Перевод денег западному партнеру: как сделать, чтобы их не заблокировали
Сильнейшие. Бизнес по правилам Netflix
Биотехи стремительно дешевеют. Как этим воспользоваться — The Economist
Россияне стали быстрее делать карьеру. Почему это опасно для компаний
Эффект плацебо: можно ли силой мысли вылечиться от всех болезней
«Я смогу тебя уволить»: к чему приводит дружба начальника с подчиненными
Акции «Полиметалла» подорожали на 82% с минимума. Разбираемся почему
Принцип действия тест-систем прост: в них работают белки коронавируса, с которыми должны связываться антитела из сыворотки крови человека. Если белки связываются, значит, антитела есть и способны нейтрализовать вирус.
Антитела могут образовываться к разным белкам вируса. В SARS-CoV-2, который вызывает COVID-19, есть четыре структурных белка, кодирующих РНК вируса. Это спайковый (S), оболочечный (E), нуклеокапсидный (N) и мембранный (M) белки. Например, «шипы» на оболочке коронавируса, с помощью которых он прикрепляется к клеткам, сформированы S-белком.
Качественные и количественные
- Качественные определяют, есть ли в принципе в сыворотке крови антитела.
- Количественные измеряют количество антител на единицу объема сыворотки и позволяют косвенно судить о силе иммунитета.
Количественный анализ показывает концентрацию антител, выраженную в определенных единицах в объеме биологического материала (например ед./мл), его результаты могут использоваться для оценки динамики уровня антител в крови. Качественный анализ лишь дает возможность понять, есть ли антитела в крови или нет.
Тесты на IgG к S-белку
- Тест на наличие антител к спайковому S-белку, с помощью которого вирус прикрепляется к клетке организма («шипы» коронавируса). Эти антитела нейтрализующие и обеспечивают защиту от заражения, не позволяя вирусу проникнуть в клетки. Тест может использоваться для проверки, была ли эффективна прививка вакциной, содержавшей антиген S-белка. Поскольку антитела вырабатываются не сразу, исследование рекомендовано проводить спустя одну-две недели после начала заболевания или вакцинации.
Тесты на IgG к RBD-домену S1/S2 белка
Тесты на IgG к нуклеокапсидному N-белку
- Используются для определения, сталкивался ли человек с коронавирусом. Чаще этот анализ выполняется для оценки наличия естественного иммунитета, появившегося после болезни.
- Делать этот тест для проверки, выработался ли иммунитет после вакцинации, в большинстве случаев нет смысла.
Тесты на IgM
- IgM — неспецифичные антитела. Их наличие показывает острый инфекционный процесс, длящийся одну или несколько недель.
- Оценку IgM в крови используют как дополнительный тест для определения наличия инфекции в случае появления клинических признаков, но отрицательных ПЦР-тестов.
Тесты на авидность антител
- Авидность — показатель прочности связывания антитела с антигенами. Высокая авидность антител ускоряет и усиливает связывание антигенов. В большинстве случаев чем дольше иммунная система борется с патогеном, тем выше этот показатель.
- Тесты на авидность могут использоваться для оценки эффективности выработанного иммунитета как в случае вакцинации, так и появления естественной защиты после перенесенного заболевания.
Антитела, или иммуноглобулины (сокращенно их обозначают Ig), — это молекулы, которые вырабатывает иммунная система, с их помощью организм борется с любыми патогенами, например с вирусами или аллергенами. «Каждое антитело, или солдат, в нашей системе обучено распознавать один конкретный антиген. В нашем организме тысячи различных антител. Когда организм человека впервые подвергается воздействию какого-либо антигена, требуется время, чтобы иммунная система отреагировала и выработала антитела, специфические для этого антигена», — описывает ВОЗ механизм работы антител.
Тест на антитела, или серологическое исследование, — это проведение анализа на наличие антител в сыворотке крови. Антитела, которые работают против SARS-CoV-2, обычно обнаруживаются в первые несколько недель после заражения. Наличие антител показывает, что человек был инфицирован SARS-CoV-2, независимо от того, протекало ли заболевание в тяжелой, легкой или бессимптомной форме.
Но антитела могут появиться не только после болезни. Начать их выработку организм может и после вакцинации.
Антиген — это элемент вируса, к которому вырабатываются антитела. После того как антитела, специфические для конкретного антигена, выработаны, они начинают работать вместе с остальной иммунной системой, чтобы уничтожить патоген и остановить болезнь. Вакцины содержат ослабленные или инактивированные частицы конкретного микроорганизма (антиген), которые вызывают иммунную реакцию организма.
Антитела бывают разных классов, которые обычно обозначают латинскими буквами А, М, G, Е и D. Таким образом, антитела класса A будут обозначаться IgА. Чаще всего в крови исследуется наличие антител IgM и IgG.
Первыми после активации иммунной системы и распознавания чужеродного вещества, выявления его особенностей начинают вырабатываться антитела IgM.
После этого начинают образовываться антитела класса IgG. То есть антитела IgM — маркер острой инфекции, антитела IgG — маркер перенесенного заболевания или наличия иммунитета.
Структурные белки — белки, с помощью которых кодируется геном микроорганизмов. У коронавирусов они кодируют РНК.
Считается, что чем выше уровень антител в крови, тем ниже риск повторного заражения вирусом SARS-CoV-2, а также вероятность тяжелого течения и развития осложнений COVID-19.
Какие бывают тесты на антитела и в чем их проблемы
Сравнивать результаты количественного анализа можно только в случае тестов, полученных в разное время, но выполненных по одной и той же методике. Тогда можно сделать вывод, как изменился уровень антител. Если же тест-системы и методики разные, сравнить их не получится.
Сейчас в России используется 150 разнообразных тест-систем на COVID-19, которые различаются чувствительностью, возможностью количественной и качественной оценки уровня антител, используемыми антигенами и т.д., пояснила РБК Эльвира Соколовская, исполнительный директор сети клиник «Семейный доктор».
У каждой тест-системы свои показатели измерения и референсные значения, объясняет Дмитрий Денисов, медицинский директор лабораторной службы «Хеликс». Эти значения лаборатории указывают, как правило, на бланках результата. «В связи с этим для определения уровня антител и возможности последующего сравнения результатов следует сдавать тест в одной лаборатории, который будет выполняться одинаковым методом на реагентах одного и того же производителя», — рекомендует эксперт.
Различия есть и в тестах на то, к какой части вируса вырабатываются антитела. Например, один из самых популярных — на антитела к спайковому белку (S). «Считается, что определенный подтип таких антител в первую очередь обеспечивает защиту от инфекции. Это так называемые нейтрализующие антитела. Часто такой анализ выполняется для контроля эффективности проведения вакцинации препаратами, содержащими именно антиген S-белка», — пояснил РБК специалист.
«Если привить вакцинами «Спутник V», Phizer, AstraZeneca, образуются только антитела к S-белкам. После перенесенной инфекции — антитела и к S-белкам, и к N-белкам, и к другим структурным вирусным белкам», — рассказывает вирусолог, профессор МГУ Алексей Аграновский.
Какой должен быть результат теста
Сейчас в мире нет единого подхода к тому, какой результат теста на антитела доказывает, что у человека есть защита от коронавируса. «В настоящее время нет ни одного руководящего документа или обзорных работ с достаточным уровнем доказательности, которые бы регламентировали оценку результатов исследований на уровень IgG», — поясняет Дмитрий Денисов.
«Тест-системы существуют разные, в том числе определяющие антитела к двум-трем белкам. Они сделаны по разным принципам. И у них есть коэффициент — разница между контролем, который не должен связывать, и образцом — сывороткой, которая связывает. Этот коэффициент разный, цифры во всех тест-системах разные. Где-то хорошо — это, например, показатель 400, а в каких-то тестах — 2. Когда выдают анализ, выдают и расшифровку с обозначением, что, допустим, от 1 до 20 означает отсутствие антител, от 20 до 40 — сомнительный анализ, а выше 40 — определенно положительный анализ, есть антитела. Цифры условные. Единых чисел для всех сейчас нет», — объяснил РБК академик РАН Виталий Зверев, завкафедрой микробиологии, вирусологии, иммунологии Сеченовского университета.
Анастасия Луканина, замглавврача сети лабораторий «Инвитро», отмечает, что с началом распространения в Москве индийского штамма («дельта» и «дельта плюс») установить корректный уровень антител IgG в крови, при котором обеспечивается иммунитет, нельзя.
Нужны ли тесты на антитела для вакцинации
Всемирная организация здравоохранения (ВОЗ) не рекомендует использовать тесты на антитела для принятия решения о вакцинации, заявила РБК официальный представитель ВОЗ в России Мелита Вуйнович.
«Оценка иммунитета является сложной задачей и требует различных научных уровней и наличия сложных лабораторий. Присутствие определенных антител в обычных тестах (выполняемых в коммерческих лабораториях. — РБК), как правило, не говорит о том, являются ли они нейтрализующими антителами, то есть могут ли они остановить вирус, поэтому ВОЗ не рекомендует данный вид тестов», — объяснила Вуйнович.

Представитель ВОЗ также подчеркнула, что само по себе наличие антител не служит препятствием для вакцинации: сделать прививку можно при любом их уровне в крови. «Если у вас есть антитела, это не значит, что вакцина нанесет вам какой-то вред. Это абсолютно неправда. Несмотря на уровень титров антител, возможно безопасно вакцинироваться», — говорила она ТАСС.
КОВИД-глобулин (COVID-globulin) инструкция по применению
Форма выпуска, упаковка и состав препарата КОВИД-глобулин
Раствор для инфузий прозрачный или слегка опалесцирующий, бесцветный или светло-желтый.
| 1 мл | |
| белки плазмы человека | 100 мг, |
| из которых иммуноглобулин G* | не менее 95% |
| специфическая активность антител к SARS-CoV-2 в ИФА | не менее 160 АКЕ* |
Примечание:
* Антиковидная единица (АКЕ) - единица активности специфического иммуноглобулина против SARS-CoV-2. За 1 единицу АКЕ иммуноглобулина принимается величина, обратная его разведению, обладающему способностью ингибировать появление на монослое культуры клеток Vero цитопатогенного действия (ЦПД) SARS-CoV-2 в 2 из 3 лунок в реакции нейтрализации против 2.0 (±0.3) lg ТЦД 50 (БОЕ) SARS-CoV-2.
Вспомогательные вещества: глицин (кислота аминоуксусная) - 25 мг, вода д/и - до 1 мл.
Препарат не содержит консервантов и антибиотиков.
20 мл - флаконы бесцветного стекла (1) - пачки картонные.
50 мл - флаконы бесцветного стекла (1) - пачки картонные.
100 мл - флаконы бесцветного стекла (1) - пачки картонные.
Фармакологическое действие
Действующим началом препарата являются иммуноглобулины класса G, обладающие активностью антител к SARS-CoV-2. Распределение подклассов иммуноглобулина G (IgG) в препарате близко к таковому в естественной плазме и имеет все свойства, характерные для здорового человека. Молекулы IgG при изготовлении препарата не подвергаются изменению вследствие химического или ферментативного воздействия. Активность антител полностью сохранена. Препарат повышает неспецифическую резистентность организма.
Фармакокинетика
При в/в инфузии препарат сразу же попадает в системный кровоток, биодоступность составляет 100%. Фармакокинетические параметры являются линейно зависимыми от активности препарата. После в/в инфузии значения времени содержания антител IgG к вирусу SARS-CoV-2 в максимальной концентрации варьируют от 25 мин до 6 ч. Средние значения C max антител против вируса SARS-CoV-2 составляют 21-26 АКЕ/мл. AUC 0-t и AUC 0-∞ составляют 4100-4900 АКЕ×ч/мл и 6000-6800 АКЕ×ч/мл соответственно. V d лекарственного средства - 4-6 л.
Специфические антитела IgG к вирусу SARS-CoV-2 элиминируются из плазмы крови со средним значением Т 1/2 11 суток. Происходит перераспределение препарата между плазмой и внесосудистым пространством, после чего иммуноглобулин G и комплексы IgG утилизируются клетками ретикулоэндотелиальной системы.
Показания препарата КОВИД-глобулин
- лечение инфекции, вызванной вирусом SARS-CoV-2, в составе комплексной терапии.
Режим дозирования
Препарат вводят в/в капельно без разведения однократно в дозе 4 мл/кг массы тела. Введение препарата должно осуществляться только в условиях стационара при соблюдении всех правил асептики. Перед началом введения температура раствора должна быть доведена до комнатной или температуры тела пациента. Раствор должен быть прозрачным или слегка опалесцирующим. Запрещается использовать мутные и/или содержащие осадок растворы.
Любое количество оставшегося после инфузии препарата должно быть уничтожено. Начальная скорость введения - от 0.01 до 0.02 мл/кг массы тела/мин в течение 30 мин. Если препарат хорошо переносится, скорость введения можно постепенно увеличивать максимально до 0.12 мл/кг массы тела/мин.
Побочное действие
Нежелательные реакции, представленные ниже, перечислены на основании опыта клинического применения препаратов иммуноглобулина человека для в/в введения, в соответствии с поражением органов и систем органов (классификацией MedDRA) и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (>1/10), часто (>1/100 и 1/1000 и
В рамках частоты встречаемости в каждой группе нежелательные реакции перечислены в порядке убывания степени серьезности.
| Классификация нежелательных реакций в соответствии с поражением органов и систем органов (MedDRA) | Клинические проявления | Категория частоты встречаемости |
| Инфекционные и паразитарные заболевания | Асептический менингит | Нечасто |
| Со стороны крови и лимфатической системы | Анемия, лейкопения, гемолиз (включая гемолитическую анемию) | Часто |
| Анизоцитоз (включая микроцитоз), тромбоцитоз | Нечасто | |
| Снижение количества нейтрофилов | Неизвестно | |
| Со стороны иммунной системы | Гиперчувствительность | Часто |
| Анафилактический шок | Нечасто | |
| Со стороны нервной системы | Головная боль (включая синусную головную боль, мигрень, дискомфорт в области головы, головную боль напряжения) | Очень часто |
| Головокружение (включая вертиго) | Часто | |
| Сонливость, тремор | Нечасто | |
| Со стороны сердца | Ощущение сердцебиения, тахикардия | Нечасто |
| Со стороны сосудов | Артериальная гипертензия покраснение (включая приливы, гиперемию), гипотензия | Часто |
| Тромбоэмболические осложнения, васкулиты (включая периферические сосудистые нарушения) | Нечасто | |
| Синдром острого посттрансфузионного повреждения (СОППЛ) | Неизвестно | |
| Со стороны дыхательной системы | Затруднение дыхания (включая боль в груди, дискомфорт в области грудной клетки, боль при дыхании) | Часто |
| Со стороны ЖКТ | Тошнота, рвота, диарея, боль в эпигастрии | Часто |
| Со стороны печени и желчевыводящих путей | Гипербилирубинемия | Часто |
| Со стороны кожи и подкожных тканей | Крапивница, высыпания | Часто |
| Поражения кожи (включая высыпания, зуд, крапивницу, макуло-папулезную сыпь, покраснение, шелушение кожи) | Нечасто | |
| Со стороны скелетно-мышечной и соединительной ткани | Боль в мышцах (включая спазмы в мышцах, костно-мышечную скованность, боль в мышцах и костях) | Часто |
| Со стороны почек и мочевыводящих путей | Протеинурия, повышение уровня креатинина в крови | Нечасто |
| Острая почечная недостаточность | Неизвестно | |
| Общие расстройства и нарушения в месте введения | Боль (включая боль в спине, боль в конечности, артралгия, боль в шее, лицевая боль), лихорадка (включая озноб), гриппоподобное заболевание (включая назофарингит, боль и пузырьковые высыпания на слизистой ротоглотки, чувство стеснения в горле) | Очень часто |
| Утомляемость, астения (включая мышечную слабость | Часто | |
| Боль в месте инъекции (включая дискомфорт в месте инъекции) | Неизвестно | |
| Со стороны лабораторных и инструментальных исследований | Снижение гемоглобина (включая снижение количества эритроцитов, снижение гематокрита), положительная прямая проба Кумбса, увеличение активности АЛТ, увеличение активности АСТ, увеличение активности ЛДГ в крови | Часто |
Противопоказания к применению
- повышенная чувствительность к иммуноглобулину человека, особенно в редко встречающихся случаях дефицита в крови иммуноглобулина класса A (IgA) и наличия антител против IgA;
- повышенная чувствительность к компонентам препарата;
- наличие в анамнезе аллергических реакций на препараты крови человека;
- аутоиммунные заболевания;
- возраст до 18 лет и старше 60 лет (в связи с отсутствием данных об эффективности и безопасности);
- беременность;
- период грудного вскармливания.
С осторожностью: аллергические заболевания (бронхиальная астма, атопический дерматит, рецидивирующая крапивница) в анамнезе; заболевания, в генезе которых ведущими являются иммунопатологические механизмы; ожирение; артериальная гипертензия; сахарный диабет; заболевания сосудистой системы; тяжелая сердечная недостаточность; склонность к развитию тромбозов; длительное нахождение в неподвижном состоянии; гиповолемия; заболевания, сопровождающиеся повышенной вязкостью крови (гипергаммаглобулинемия, гиперфибриногенемия, серповидно-клеточная анемия); почечная недостаточность в анамнезе; сопутствующая терапия нефротоксичными лекарственными препаратами.
Применение при беременности и кормлении грудью
Безопасность применения иммуноглобулина человека против COVID-19 при беременности и в период грудного вскармливания не изучалась в контролируемых клинических исследованиях, поэтому их назначение беременным женщинам и женщинам в период грудного вскармливания противопоказано.
Применение при нарушениях функции почек
Применение у детей
Противопоказано применение в возрасте до 18 лет (в связи с отсутствием данных об эффективности и безопасности).
Применение у пожилых пациентов
Противопоказано применение в возрасте старше 60 лет (в связи с отсутствием данных об эффективности и безопасности).
Особые указания
Препарат КОВИД-глобулин следует вводить без разведения в/в капельно в условиях стационара при соблюдении всех правил асептики.
Не пригоден к применению препарат во флаконах с нарушенной целостностью и/или маркировкой, в случае помутнения раствора, изменения цвета, присутствия в растворе осадка, при истекшем сроке годности, при несоблюдении условий хранения.
Препарат не содержит консервантов, предназначен для однократного применения. Таким образом, после вскрытия содержимое флакона должно быть использовано незамедлительно.
Помещения, где вводят препарат, должны быть обеспечены средствами противошоковой терапии.
Необходимо проводить тщательный мониторинг пациентов и наблюдение на предмет возникновения любых симптомов на протяжении всего периода инфузии и в течение 60 мин после окончания введения препарата.
Некоторые нежелательные реакции могут наблюдаться более часто:
- в случае высокой скорости введения;
- у пациентов с гипогаммаглобулинемией или агаммаглобулинемией с недостаточностью IgA или без недостаточности IgA;
- у пациентов, которые получают терапию иммуноглобулином человека для в/в введения в первый раз.
Возможных осложнений можно избежать, если убедиться, что:
- у пациента не проявляется гиперчувствительность к иммуноглобулину человека при медленном введении препарата;
- во время и после периода инфузии все симптомы, возникающие у пациентов, тщательно отслеживаются.
В случае развития нежелательного явления следует уменьшить скорость введения или прекратить введение препарата.
В случае развития шока необходимо использовать стандартное лечение шоковых состояний.
Истинные реакции гиперчувствительности встречаются редко. Они могут возникать в очень редких случаях при дефиците IgA с антителами к IgA.
Редко иммуноглобулин человека для в/в введения может быть причиной снижения АД с развитием анафилактоидной реакции, даже у пациентов, которые ранее хорошо переносили терапию иммуноглобулином человека.
Развитие гемолиза связано со следующими факторами риска: высокие дозы, независимо от введения в виде однократной дозы или отдельных доз в течение нескольких дней; а также группы крови А (II), В (III) и АВ (IV) в совокупности с сопутствующим наличием воспалительного процесса.
Необходимо проводить мониторинг клинических признаков и симптомов гемолиза у пациентов, получающих терапию препаратами иммуноглобулина человека для в/в введения.
Синдром асептического менингита (САМ)
Имеются клинические данные о связи между применением иммуноглобулина человека для в/в введения и случаями возникновения тромбоэмболических осложнений, такими как инфаркт миокарда, острое нарушение мозгового кровообращения (включая инсульт), легочная тромбоэмболия и тромбоз глубоких вен, которые предположительно связаны с относительным увеличением вязкости крови при введении большого количества иммуноглобулинов. Необходимо соблюдать осторожность при назначении и проведении инфузий иммуноглобулинов человека для в/в введения пациентам с ожирением и пациентам с ранее установленными факторами риска развития тромботических осложнений, такими как пожилой возраст, артериальная гипертензия, сахарный диабет, тромбоэмболии или сердечно-сосудистое заболевание в анамнезе, случаи наследственной или приобретенной тромбофилии, продолжительный период нарушения подвижности, пациентам с гиповолемией и пациентам с заболеваниями, при которых наблюдается увеличение вязкости крови.
Острая почечная недостаточность
Были выявлены случаи развития острой почечной недостаточности у пациентов, получавших терапию иммуноглобулином человека для в/в введения. В большинстве случаев были определены факторы риска, такие как предшествующее наличие почечной недостаточности, сахарного диабета, гиповолемии, излишнего веса, сопутствующее лечение нефротоксичными препаратами или возраст старше 65 лет. Основываясь на оценке клинических данных, пациентам с риском развития острой почечной недостаточности или тромбоэмболических осложнений препараты иммуноглобулинов человека для в/в введения необходимо вводить с минимальной скоростью инфузии и в минимальной возможной дозе.
Синдром острого посттрансфузионного повреждения легких (СОППЛ)
В редких случаях может возникнуть некардиогенный отек легких вследствие лечения препаратами иммуноглобулина человека для в/в введения. СОППЛ характеризуется тяжелой острой дыхательной недостаточностью, отеком легких, гипоксемией, нормальной функцией левого желудочка и лихорадкой. Симптомы, как правило, появляются в интервале от 1 до 6 ч после введения препарата. Необходимо мониторировать состояние пациентов при развитии нарушений со стороны легких.
Влияние на диагностические тесты
После введения иммуноглобулинов в крови пациента временно увеличивается число различных пассивно переданных антител, что может привести к ложноположительному результату в серологических тестах.
Пассивный перенос антител к антигенам эритроцитов, например, А, В и D, может привести к неверному результату в некоторых серологических тестах для определения антител к эритроцитам (например, проба Кумбса), при определении количества ретикулоцитов и в гаптоглобиновом тесте.
Информация по безопасности в отношении инфекционных агентов
Препарат производят из плазмы человека. Стандартные меры по предотвращению передачи инфекций, возникающих в результате применения лекарственных препаратов, изготовленных из крови или плазмы человека, включают отбор доноров, проверку индивидуальных донаций и пулов плазмы на наличие специфических маркеров инфекции и включение эффективных этапов производства, направленных на инактивацию и/или удаление вирусов. Несмотря на это, при применении препаратов, изготовленных из крови или плазмы человека, нельзя полностью исключить возможность передачи инфекционных агентов. Это положение также применимо в отношении неизвестных или новых вирусов и других инфекционных агентов. Меры, предпринимаемые для обеспечения противовирусной безопасности, считаются эффективными для вирусов, имеющих оболочку, таких как ВИЧ, вирусов гепатита В и С, а также для безоболочечных вирусов, таких как вирус гепатита А и парвовирус В19. Получен обнадеживающий клинический опыт, указывающий на отсутствие передачи вируса гепатита А и парвовируса В19 с препаратами иммуноглобулина человека, и также предполагается, что наличие антител вносит значительный вклад в вирусную безопасность. Рекомендуется при каждом применении препарата в установленных учетных формах регистрировать наименование препарата, номер серии, дату выпуска, срок годности, наименование предприятия-производителя, дату введения, дозу и побочные реакции на препарат.
Влияние на способность к управлению транспортными средствами и механизмами
Некоторые нежелательные реакции, связанные с действием препарата, могут оказывать воздействие на способность управлять транспортным средством или движущимися механизмами. Для пациентов, у которых наблюдались нежелательные реакции при введении препарата, управление транспортным средством или движущимися механизмами возможно только после исчезновения симптомов нежелательных реакций.
Передозировка
Передозировка может привести к гиперволемии и увеличению вязкости крови, особенно у пациентов, которые относятся к группе риска, включая пациентов пожилого возраста и пациентов с сердечной недостаточностью или нарушенной функцией почек.
Лекарственное взаимодействие
Препарат может применяться в комплексной терапии заболевания в сочетании с другими лекарственными средствами, в частности, с антибиотиками. При этом не допускается смешивание препарата с другими лекарственными средствами в одном флаконе.
Введение иммуноглобулина может снижать эффективность активной иммунизации, поэтому живые вакцины (против кори, эпидемического паротита, краснухи, ветряной оспы) следует вводить не ранее чем через 3 месяца после введения иммуноглобулина. После вакцинации против этих инфекций иммуноглобулин следует вводить не ранее чем через 2 недели; в случае необходимости применения иммуноглобулина ранее этого срока вакцинацию против кори, эпидемического паротита, краснухи, ветряной оспы следует повторить. Прививки против других инфекций могут быть проведены в любые сроки до или после введения иммуноглобулина.
В случае вакцинации против кори снижение эффективности вакцины возможно в течение 1 года после введения иммуноглобулина. В связи с этим у пациентов, привитых вакциной против кори, рекомендуется контролировать уровень антител.
Условия хранения препарата КОВИД-глобулин
Препарат следует хранить в соответствии с СП 3.3.2.3332-16 при температуре от 2° до 8°С, в защищенном от света и недоступном для детей месте. Не замораживать.
Читайте также:
